(2: 中国科学院大学, 北京 100049)
(3: 大理市生态文明建设总工程师办公室, 大理 671000)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(3: General Engineer's Office of Dali Committee for the Construction of Ecological Civilization, Dali 671000, P. R. China)
水体富营养化已成为全世界面临的重大环境问题之一, 伴随着浮游植物大量繁殖, 在夏季蓝藻水华大量暴发, 容易导致水质恶化, 危及渔业资源, 甚至影响人类的健康[1-2].湖泊富营养化问题是湖泊水体在自然环境因子和人类活动的双重影响下, 大量营养盐输入湖泊使水体逐步由生产力水平较低的贫营养状态向生产力水平较高的富营养状态变化的一种现象[3].近些年来, 国内外科研工作者一直致力于水体富营养化的预防和治理研究, 目前对于蓝藻水华的防治方法包括物理、化学和生物方法, 其中以生物操控法应用前景最为广阔, 其中, 在富营养化水体中放养鲢(Hypophthalmichthys molitrix)、鳙(Aristichthys nobilis)的非经典生物操纵方法广泛用于浅水湖泊的蓝藻水华控制, 被认为是导致东湖1980s蓝藻水华消失的主要原因之一[4], 是蓝藻水华治理最有效的手段之一.
洱海(25°25′~26°16′N, 99°32′~100°27′E)是云南省第二大高原淡水湖泊, 是典型的内陆断陷湖泊, 具有一定的封闭性与半封闭性特点[5].近几十年, 由于人为污染物输入的增加和水资源的过度利用, 洱海的生态系统严重退化[6], 总体水质呈下降趋势, 已由中营养状态向富营养状态转化, 在2001-2002年期间生态系统出现灾变式恶化, 2002年后的总氮(TN)浓度水平是2002年之前的2倍左右, 总磷(TP)浓度总体变化幅度不如TN大, 但近几年也出现缓慢上升趋势[7].目前, TN年平均值在0.6 mg/L左右波动, TP年平均值在0.03 mg/L左右波动, 水质处于Ⅱ~Ⅲ类[8], 是富营养化初期阶段, 夏、秋季是洱海蓝藻水华发生的高风险期[9-10], 洱海在1957-2013年期间洱海浮游植物的密度大约增长了100倍, 从22.4×104 cells/L增长到2043.3×104 cells/L, 自1996年首次暴发鱼腥藻为优势种的蓝藻水华后, 几乎每年洱海湖湾都会发生不同程度蓝藻水华, 在1998、2003、2006、2009、2013年曾发生大面积蓝藻水华[11-13].
为了探讨鲢、鳙在富营养化初期的控藻生态效果, 我们通过在洱海北部红山湾近岸水体构建小型原位控藻围栏, 对比分析围栏内外水环境因子、浮游植物、浮游动物和鱼类生长、摄食等参数, 评估鲢、鳙放养的控藻效果, 从而探究非经典生物操纵在洱海的适宜性, 为轻度富营养化湖泊水库的治理及蓝藻水华的控制提供可靠的依据.
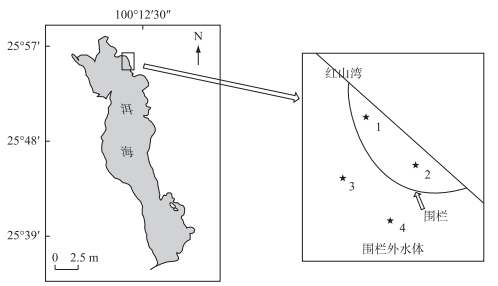
1 研究区域与方法 1.1 研究区域概况红山湾位于洱海北部(25°55′N, 100°10′E), 面积为10.32 km2, 是大理重要的旅游景点, 该湖湾近几年经常暴发蓝藻水华.如图 1所示, 围栏的面积约为0.08 km2, 平均水深为3 m, 围栏的网目规格为2a=3 cm. 2016年3月初投放规格在300 g左右的鲢、鳙鱼种, 投放密度约为20 g/m3, 鲢、鳙比为3:1, 到2016年11月, 鲢增长到850 g左右, 鳙增长到800 g左右, 估算围栏存栏密度为50~60 g/m3.
|
图 1 洱海示意图和红山湾围栏采样点分布 Fig.1 The sketch of Lake Erhai and the location of fish pen in Hongshan Bay |
为了比较鲢、鳙放养对围栏内外水质变化及浮游生物群落结构变化的影响, 在围栏内外布设了4个采样点(图 1), 实验开始的时间是2016年6-11月(蓝藻水华容易发生的夏、秋季).采用Patala's有机玻璃采水器在每个点的0、1.5和2.5 m采集混合水样, 10 L水用64 μm的浮游生物网过滤, 装入50 ml的小方瓶中, 加入2 ml甲醛固定, 作为浮游甲壳动物定量样品.同时取1 L混合水样加入10 ml的鲁哥试剂固定, 作为浮游植物定量样品.浮游动物和浮游植物的观察计数和生物量及个体重量的估算参照章宗涉等[14]的方法, 其中微囊藻群体细胞数根据微囊藻群体最大投影面积与所含细胞数的回归方程模型来估算[15], 丝状藻群体细胞数则根据测量群体总长度与单个细胞长度来估算细胞数.水温(T)、pH、溶解氧(DO)、电导率(Cond)、总溶解性固体(TDS)、氧化还原电位(ORP)等指标用YSI现场测定, 透明度用Secchi透明度盘在采样时原位测定, 总氮(TN)、总磷(TP)、可溶性总氮(DTN)、可溶性总磷(DTP)、氨氮(NH3-N)、硝态氮(NO3--N)、正磷(PO43--P)、叶绿素a(Chl.a)等指标带回实验室用标准方法进行分析[16].
研究期间, 每月对围网内鲢、鳙生长情况进行调查, 每次在围栏内用不同网目大小的丝网捕捞鲢、鳙各30~50尾, 现场测定其全长、体长和体重, 除部分要带回实验室进行其他研究的样本外、其余大部分鱼在测量后放回水中继续养殖.体长的测量长度是吻前端至尾鳍基部的水平直线长度, 全长的测量长度是吻前端至尾鳍末端水平直线长度[17].鲢、鳙体重和全长的关系式可用曲线回归方程表示:
| $ W = {\rm{a}} \cdot {L^{\rm{b}}} $ |
式中, W表示鱼类的体重(g), L表示鱼类的体长(cm).
鲢、鳙的日摄食量用适于估算线性排空的Eggers模型[18]进行估算:
| $ C = 24S \cdot R $ | (1) |
式中, C为日摄食量(%), S为通过24 h实验获得的日平均肠道饱满度(%), R(h-1)为肠道排空率.鲢、鳙的R是根据陈少莲[19]建立的温度和排空率的指数公式估算而得.为了获得鱼类的S和鱼类每天的摄食节律, 在9月25日每隔3 h在围栏内采集鲢、鳙样本各5尾, 迅速解剖取出所有的肠含物, 称重.
通过估算的日摄食量, 利用如下公式计算鲢、鳙对浮游动物和浮游植物的滤食率:
| $ F = 1000C/24B $ | (2) |
式中, F(L/(g ·h))为对浮游动物或浮游植物的滤食率, C(%)为每天鲢、鳙摄食的浮游动物或浮游植物, B(mg/L)为浮游动物或浮游植物在湖水中的生物量[20].
群落优势种选用Mcnaughton优势度指数(Y, Y>0.02确定为优势种), 公式为:
| $ Y = \frac{{{n_i}}}{N}{f_i} $ | (3) |
式中, N为采样点浮游植物总个体数, ni/N为第i种的个体数与样品中总个体数的比值, fi为第i种在各站点出现的频率[21].
1.3 数据处理围栏内数据为点位1~2的平均值, 围栏外数据为点位3~4的平均值.围栏内外差异的显著性采用T检验分析, 用统计软件SPASS 19.0进行分析, 所有的数据在分析前均进行lg (x+1)转换.
2 结果与分析 2.1 鲢、鳙的生长实验开始时鲢、鳙的平均体重分别为308和379 g, 实验结束后鲢、鳙的平均体重分别为898和794 g, 鲢的增长速率大于鳙.鲢、鳙的平均日增重分别为2.8和2.0 g/d(表 1).围栏内养殖鲢、鳙体重和体长的回归方程分别为:鲢W=0.0281 L2.7212(R2=0.9386)、鳙W=0.0034 L3.3131(R2=0.9794).
| 表 1 鲢、鳙的生长情况 Tab. 1 Growth of silver and bighead carps |
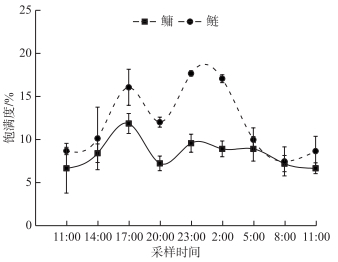
研究结果表明, 鲢、鳙均具有明显的昼夜摄食节律, 其中鲢表现更为明显(图 2), 鲢的摄食高峰发生在23:00-2:00之间, 肠道饱满度为17.66 %; 最小的摄食量发生在凌晨5:00-8:00, 肠道饱满度为8.64 %, 日平均肠道饱满度为11.95 %.鳙的摄食高峰发生在14:00-17:00之间, 肠道饱满度为11.84 %; 最小的摄食量发生在8:00-11:00, 肠道饱满度为6.65 %, 日平均肠道饱满度为8.37 %.
|
图 2 鲢、鳙摄食节律 Fig.2 Feeding rhythms of silver and bighead carps |
根据估算的肠道排空率依据Egger's摄食模型, 估算鲢、鳙的日摄食量消耗, 分别为24.96 %和18.18 %, 鲢的日摄食量需要高于鳙(表 2).通过鲢、鳙每天的日摄食量消耗量和水体浮游生物的生物量估算, 鲢、鳙对浮游植物的平均滤食率分别为3.01和2.19 L/(g ·h);而它们对浮游动物的滤食率则分别为13.54和18.61 L/(g ·h), 鲢对浮游植物的摄食率高于鳙, 而鳙对浮游动物的滤食率则远高于鲢.
| 表 2 用Egger's模型估算的鲢、鳙日摄食量及鲢、鳙对浮游植物和浮游动物的滤食率 Tab. 2 Daily rations of silver and bighead carps estimated by Egger's model and filtration rate for plankton |
围栏内外的温度基本一致, 最高温度出现在7月, 平均为24.4℃, 监测期间的最低温度出现在11月, 平均为19℃.水体透明度6-11份变化幅度不大, 围栏内外的透明度几乎相等, 约为1.4 m. 6-11月围栏内的TP和pH平均值略高于围栏外(表 3). T检验分析的结果显示, 围栏内外所有理化因子的差异都没有统计学意义(P>0.05).
| 表 3 围栏内外水环境参数 Tab. 3 Environmental parameters within and outside fish pen |
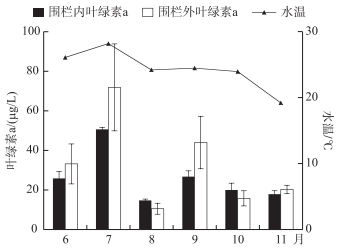
围栏所在水域6-11月的平均温度为24.4℃, Chl.a浓度的高低与水体藻的种类、数量及水质有密切关系, 所以Chl.a浓度在一定程度上能反映水质状况[22].围栏内外Chl.a浓度除8月(雨量大)外均呈现出先升高后下降的趋势, 这与温度的变化趋势一致. 2016年7月围栏内鲢、鳙对Chl.a浓度的削减率为28 %, 9月为40 %, 其他月份削减不明显(图 3).
|
图 3 围栏内外水温和叶绿素a浓度的季节变化 Fig.3 Seasonal variation of water temperature and chlorophyll-a concentration within and outside fish pen |
围栏内外浮游植物种类组成基本呈现相同的趋势变化, 监测期间共鉴定出6门56属, 其中蓝藻门9属, 隐藻门2属, 甲藻门3属, 硅藻门13属, 裸藻门2属, 绿藻门27属, 常见种类主要是蓝藻门、隐藻门、硅藻门和绿藻门的种类, 优势种4门14属(表 4), 优势种在各个月份中既有交叉又有演替.蓝藻门的微囊藻属和伪鱼腥藻在各月均以优势种出现, 隐藻门的种类在6-8月以优势种出现, 9-11月优势种演替为硅藻门的小环藻属和脆杆藻属以及绿藻门的转板藻属和暗丝藻属, 除少数种类外, 9-11月细胞的平均湿重也较6-8月更大.
| 表 4 洱海浮游植物优势度及平均湿重 Tab. 4 Dominance and wet weight of dominant phytoplankton species in the Lake Erhai |
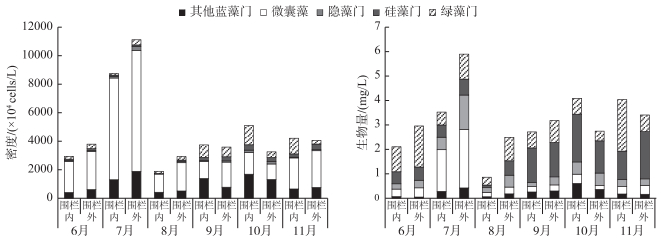
从浮游植物优势种密度和生物量图中可以得出(图 4), 围栏内优势种类组成生物量最高值出现在10月, 为4.08 mg/L;围栏外最高值出现7月, 生物量为5.89 mg/L.围栏内外生物量最低值均出现在8月, 分别为0.86和2.49 mg/L, 围栏内显著低于围栏外.围栏内外密度最高值均出现在7月, 微囊藻为绝对优势种类, 其密度分别达到7.141×107和8.484×107 cells/L; 围栏内外密度最低值均出现在8月, 浮游植物优势种密度分别为1.893×107和2.917×107 cells/L.
|
图 4 围栏内外浮游植物优势种类密度和生物量季节变化 Fig.4 Seasonal variation of density and biomass of phytoplankton dominant species within and outside fish pen |
根据水华发生情况, 对6-8月和9-11月的优势种密度和生物量进行统计分析, 结果显示, 6-8月围栏内优势种密度和生物量均明显低于围栏外, 8月差异达到显著水平, 水华发生期间, 鲢、鳙主要滤食微囊藻和隐藻门的种类, 从而导致围栏内外优势种类密度和生物量的差异明显. 9-11月围栏内优势种密度高于围栏外, 差异没有达到显著水平, 10-11月围栏内优势种生物量高于围栏外, 差异没有统计学意义.鲢、鳙对优势种是绿藻门和硅藻门种类的浮游植物滤食率低是导致这种差异的根本原因.
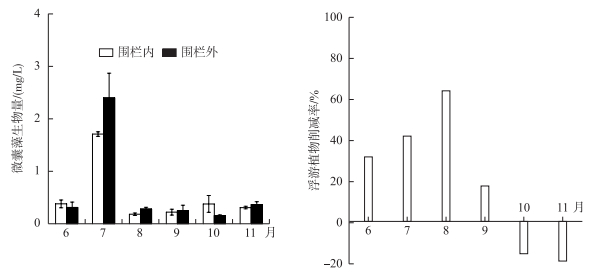
从围栏内外微囊藻生物量季节变化可以看出(图 5), 微囊藻生物量在7月达到生物量峰值(围栏内为1.7 mg/L, 围栏外为2.4 mg/L), 8月开始生物量维持在较低的水平, 除6月和10月外, 其他月份均是围栏外微囊藻生物量高于围栏内, 7月围栏内外差异最大, 且围栏内显著低于围栏外.围栏内鲢、鳙对浮游植物的削减率6-8月逐渐升高, 8月削减率高达64 %, 9-11月削减率逐渐降低, 10和11月削减率甚至为负值, 结合浮游植物优势种种类变化和生物量变化以及浮游植物削减率的变化图可进一步说明, 鲢、鳙主要滤食蓝藻门的微囊藻和隐藻门的一些种类, 对绿藻门和硅藻门的种类滤食率不高.
|
图 5 围栏内外微囊藻生物量季节变化和鲢、鳙对浮游植物生物量削减率的季节变化 Fig.5 Seasonal variation of biomass of Microcystis within and outside fish pen and reduction rate of silver and bighead carps of the phytoplankton biomass |
围栏所在区域的浮游甲壳动物群落结构简单, 种类较少.实验期间, 围栏内外共监测到浮游甲壳动物15种, 其中枝角类8种, 桡足类7种.围栏内外浮游甲壳动物出现的种类并无差异.枝角类主要由透明溞(Daphnia hyalina)、方形网纹溞(Thermocyclops taihokuensis)、长额象鼻溞(Bosmina sp.)、圆型盘肠溞(Chydorus sphaericus)等种类组成, 桡足类主要由无节幼体(nauplius)、广布中剑水蚤(Mesocyclops leuckarti)、温剑水蚤(Thermocyclops taihokuensis)等种类组成, 其中有部分种类是季节性出现.
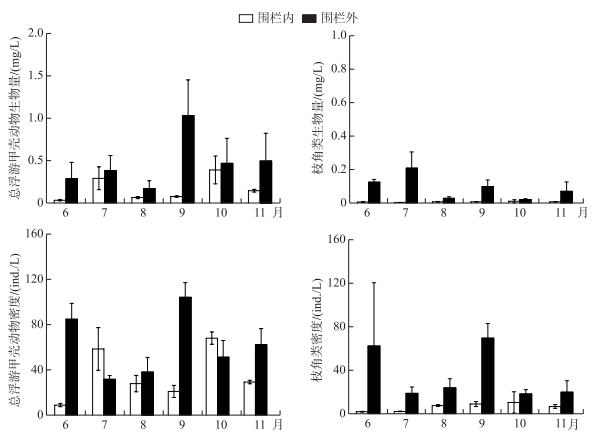
总的来看, 围栏内外浮游甲壳动物的生物量有所差异(图 6).围栏外总的浮游甲壳动物的生物量显著高于围栏内(P < 0.05), 围栏内外浮游甲壳动物6-11月平均生物量分别为0.17和0.47 mg/L, 围栏内最高值出现在10月, 为0.39 mg/L, 围栏外最高值出现在9月, 为1.03 mg/L.围栏外枝角类6-11月的平均生物量为0.09 mg/L, 极显著高于围栏内(0.01 mg/L).就密度而言, 6-11月总浮游甲壳动物的密度围网内外分别为35.5和61.8 ind./L, 差异没有达到显著水平, 6月和9月围栏外总浮游甲壳动物密度显著高于围栏内, 7月和10月则出现围栏内密度高于围栏外的情况, 桡足类无节幼体在这个时间段的大量繁殖是导致这种差异的根本原因.枝角类密度和生物量呈现相同变化, 围栏外密度极显著高于围栏内, 6-11月的平均密度分别为35和6.15 ind./L.
|
图 6 围栏内外浮游甲壳动物和枝角类生物量和密度的季节变化 Fig.6 Seasonal variations of biomass and density of crustacean zooplankton and cladocera within and outside fish pen |
统计发现, 围栏内鲢、鳙体长和体重关系式W=a Lb中b值介于2.5~4.0之间, 说明围栏内的鲢、鳙呈现匀速生长, 生长过程中体型没有较大变化, 围栏生存环境较适宜[23].围栏作为一个开放的系统, 内外水体可以自由交换, 水体的流动性导致围栏内外水体理化因子和浮游生物群落结构差异不明显.首先, 就浮游甲壳动物而言, 研究结果显示, 浮游甲壳动物围网内外群落结构组成差异不显著, 但浮游甲壳动物生物量存在差异(图 6), 围栏内浮游甲壳动物总生物量和枝角类生物量都显著低于围栏外, 证明围栏内圈养的鲢、鳙(最初放养密度为20 g/m3)对浮游动物形成强大的摄食压力. 8月和10月无节幼体大量繁殖, 导致桡足类生物量升高, 主要原因是鲢、鳙滤食了大型甲壳动物, 从而减少了对小型甲壳动物的捕食.太湖梅梁湾大型控藻围栏放养鲢、鳙(最初放养密度为11.4 g/m3)对浮游甲壳动物的生物量产生较大影响, 围栏内浮游甲壳动物的总生物量和枝角类的生物量显著低于围栏外[24], 这与洱海控藻围栏的结果相似, 随着滤食性鱼类和富营养化二者的影响, 浮游甲壳动物逐渐趋于r-对策生长和容易逃脱的种类增多[25], 利用鲢、鳙控藻应设立合理放养密度, 保证水体中浮游甲壳动物生物量维持在一个稳定较高水平, 否则, 生物操纵的效果也会大打折扣.就浮游植物而言, 鲢、鳙对围栏内浮游植物群落结构的影响较大, 在太湖围隔实验中, 在密度相对较低的实验组中, 鲢能有效地降低叶绿素a和总磷浓度[26].本研究中, 鲢、鳙可以降低叶绿素a浓度(图 3), 对以微囊藻为优势种组成的浮游植物有显著的削减效果(图 5).就水体营养盐而言, 本研究中, 围栏内外水体氮、磷没有明显差异(表 3), 一般认为, 鲢、鳙具有较高的磷含量和较低的周转率, 所以其是营养盐库而不是营养盐源, 因此, 放养鲢鳙不是引起湖泊富营养化的主要原因[27], 有研究对长寿湖鲢、鳙生态养殖水体中氮、磷变化进行了监测, 认为不会引起水体富营养化[28].三峡库区水域牧场鲢、鳙驱动的氮、磷循环研究也得出和前两个实验相似的结论, 认为鲢、鳙不会导致水体的富营养化, 而且还能通过鱼产品移除水体的氮、磷,有效抑制水体富营养化过程[29].因此, 我们认为利用鲢、鳙进行生物控藻对水体氮、磷循环影响不大.
3.2 非经典生物操纵在富营养化初期湖泊中的适宜性洱海蓝藻水华的发生与其富营养化程度密切相关, 浮游植物群落结构变化大致反映了洱海水质的变化.围网放养20 g/m3的鲢、鳙对洱海浮游植物群落结构组成和生物量的影响并不能达到统计学差异, 监测期间观察到的优势种从6-11月逐渐由蓝藻门的微囊藻和隐藻转变成以硅藻门的小环藻和绿藻门的丝状藻为优势种, 10-11月, 当水体中浮游植物组成以硅藻们的小环藻和绿藻门的丝状藻为优势种时, 鲢、鳙对藻类水华的削减率并不理想, 因小环藻有一个坚硬的、难以消化的硅酸盐细胞壁, 绿藻门的种类其细胞壁组成中以纤维素为主, 鲢、鳙的肠道内缺乏纤维素酶, 鲢、鳙对硅藻门和绿藻门一些种类的摄食只能通过食道的分解和破碎从而加强肠道的吸收利用率[30-31].鲢、鳙对微囊藻的摄食率也较微囊藻水华发生期明显降低, 初步认为鲢、鳙的食性在这期间发生转变, 营养来源以除了这4个优势藻门类之外的其他浮游植物种类和浮游甲壳动物为主.洱海鲢、鳙的食性结果从数量百分比看, 鲢肠含物中蓝藻门的微囊藻比值最高, 占食物总数的64.85 %, 鳙肠含物中比例最高的也是蓝藻门的微囊藻(68.51 %)[32], 鲢、鳙在洱海能达到控藻效果的放养密度还需进一步探索. Yi等[33]在太湖梅梁湾围隔进行放养鲢鳙密度为50 g/m3的生物控藻试验, 设立了鲢、鳙重量比为1 :0(G1)、1 :1(G2)、1 :2(G3)3个处理组和1个未放鱼的对照组, 结果表明3个处理组的藻浓度都低于对照组, 但G1和G2的藻浓度低于G3, 因此, 他认为在非经典生物操纵中应该提高鲢所占的比例.在洱海, 当枝角类生物量丰富时, 鳙肠含物中以枝角类占绝对优势[32].因此, 利用鲢、鳙在洱海开展非经典生物控藻实验应当减少鳙的比例. Mueller等[34]于2000年8月30日至9月30日开展了控藻实验, 研究结果清楚地表明, 鲢为滤食生物能导致微囊藻的迅速降低并最终消失, 而系统中没有鲢后都会出现微囊藻, 说明鲢可以控制池塘中的微囊藻, 这与本文洱海中鲢、鳙对微囊藻有较高的削减率相似. Radke等[35]认为, 鲢应该主要用于以降低不能被大型牧食性浮游动物所有效控制的令人厌恶的大型藻类(如蓝藻)为主要目的生物操纵, 因此, 鲢似乎最适合养殖在那些生产力高而且缺乏大型枝角类的热带湖泊. Hu等[36]认为, 仅仅用滤食性鱼类去控制藻类和水质短期更有效, 但要想达到长期理想效果, 需结合滤食性鱼类和凶猛肉食性鱼类两者共同去进行生物操纵.因此, 结合洱海的水华发生及水质情况, 如水质继续恶化, 微囊藻水华持续发生, 那么利用鲢、鳙来控制藻类水华是一个积极的选择.
4 结论通过在富营养化初期湖泊——洱海开展非经典操控实验, 监测围栏内外浮游动植物结构及其数量变化, 可知在微囊藻水华发生期间, 鲢、鳙对微囊藻有理想的削减效果, 当水体中浮游植物优势种演变为硅藻门和绿藻门的种类时, 鲢、鳙对浮游植物的削减率下降.但同时二者对浮游甲壳动物也有较高的捕食压力, 鳙对浮游甲壳动物的滤食率要高于鲢, 浮游甲壳动物作为浮游植物的有力捕食者在水体中扮演着重要角色, 近几年洱海大型浮游甲壳动物数量骤减, 对藻类水华控制的效果微乎其微, 因此, 设立鲢、鳙合理放养密度后, 可忽略对浮游甲壳动物的影响.本研究有利于对富营养化初期湖泊藻类水华治理提供科学依据, 需要加强对洱海藻类水华研究的深度, 以期得出有力的依据去佐证非经典生物操纵在洱海的适宜性.
致谢: 感谢龙德火和公莉在野外采样中的帮助.
| [1] |
Chen L, Chen J, Zhang X et al. A review of reproductive toxicity of microcystins. Journal Hazardous Materials, 2016, 301: 381-399. DOI:10.1016/j.jhazmat.2015.08.041 |
| [2] |
Rastogi RP, Sinha RP, Incharoensakdi A. The cyanotoxin-microcystins: Current overview. Reviews in Environmental Science and Bio/Technology, 2014, 13(2): 215-249. |
| [3] |
Wu F, Zhan JY, Deng XZ et al. Influencing factors of lake eutrophication in China—A case study in 22 lakes in China. Ecology and Environmental Sciences, 2012, 22(1): 94-100. [吴锋, 战金艳, 邓祥征等. 中国湖泊富营养化影响因素研究——基于中国22个湖泊实证分析. 生态环境学报, 2012, 22(1): 94-100. DOI:10.3969/j.issn.1674-5906.2012.01.018] |
| [4] |
Liu JK, Xie P. The mystery of the disappearance of blue algae bloom in east lake of wuhan. Resources and Environment in the Yangtze Basin, 1999, 8(3): 312-319. [刘建康, 谢平. 揭开武汉东湖蓝藻水华消失之谜. 长江流域资源与环境, 1999, 8(3): 312-319.] |
| [5] |
Ye C, Jin XC, Wang LQ et al. Design principle and engineering mode of the ecological restoration in the aquatic-terrestrial ecotone of Lake Erhai. China Environmental Science, 2004, 24(6): 717-721. [叶春, 金相灿, 王临清等. 洱海湖滨带生态修复设计原则与工程模式. 中国环境科学, 2004, 24(6): 717-721. DOI:10.3321/j.issn:1000-6923.2004.06.018] |
| [6] |
Ji NN, Wang SR, Zhang L. Characteristics of dissolved organic phosphorus inputs to freshwater lakes: A case study of Lake Erhai, southwest China. Science of the Total Environment, 2017, 601: 1544-1555. |
| [7] |
Chen XH. Study on the recent 20 year eutrophication process and development of nutrient criteria / standards of lake Erhai at its initial stage of eutrophication[Dissertation]. Shanghai: East China Normal University, 2015. [陈小华.富营养化初期湖泊(洱海)的环境演变及营养物基准/标准研究[学位论文].上海: 华东师范大学, 2015.] ]
|
| [8] |
Yin YZ, Chu ZS, Zhao M et al. Spatial and temporal changes in water quality in aquatic-terrestrial ecotone of Lake Erhai. China Environmental Science, 2011, 31(7): 1192-1196. [尹延震, 储昭升, 赵明等. 洱海湖滨带水质的时空变化规律. 中国环境科学, 2011, 31(7): 1192-1196.] |
| [9] |
Han T, Peng WQ, Li HE et al. The evolution of eutrophication and its research progress in Lake Erhai. Journal of China Institute of Water Resources and Hydropower Research, 2005, 3(1): 71-73. [韩涛, 彭文启, 李怀恩等. 洱海水体富营养化的演变及其研究进展. 中国水利水电科学研究院学报, 2005, 3(1): 71-73. DOI:10.3969/j.issn.1672-3031.2005.01.014] |
| [10] |
Hu XZ, Jin XC, Du BH et al. The present situation and dynamic changes of submerged vegetation in Lake Erhai in yunnan province. Research of Environmental Sciences, 2005, 18(1): 1-4. [胡小贞, 金相灿, 杜宝汉等. 云南洱海沉水植被现状及其动态变. 环境科学研究, 2005, 18(1): 1-4. DOI:10.3321/j.issn:1001-6929.2005.01.001] |
| [11] |
Zhu R, Wang H, Chen J et al. Use the predictive models to explore the key factors affecting phytoplankton succession in Lake Erhai, China. Environmental Science and Pollution Research International, 2018, 25(2): 1283-1293. DOI:10.1007/s11356-017-0512-2 |
| [12] |
Dong YX. Research on blue algae plankton bloom in Lake Erhai. Yunnan Environmental Science, 1999, 18(4): 28-31. [董云仙. 洱海蓝藻水华研究. 云南环境科学, 1999, 18(4): 28-31.] |
| [13] |
Chen JL, Hu MM, Zhou HD et al. Studies on population dynamics and the underlying impact factors of phyoplankton during the cyanobacteria bloom in lake Erhai. Acta Hydrobiologica Sinica, 2015, 39(1). [陈建良, 胡明明, 周怀东. 洱海蓝藻水华暴发期浮游植物群落变化及影响因素. 水生生物学报, 2015, 39(1).] |
| [14] |
Zhang ZS, Huang XF. Study methods on freshwater plankton. Beijing: Science Press, 1991: 333-371. [章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991: 333-371.]
|
| [15] |
Shu TT, Chen FZ. A simple method for estimation of cell numbers in the colonial Microcystis. Ecological Science, 2011, 30(5): 553-555. [舒婷婷, 陈非洲. 微囊藻群体细胞数量估算的一种简单方法. 生态科学, 2011, 30(5): 553-555. DOI:10.3969/j.issn.1008-8873.2011.05.015] |
| [16] |
Ministry of Environmental Protection of the People's Republic of China, Editorial Board of Water and Wastewater Monitoring and Analysis Methods eds. Water and Wastewater Monitoring and Analysis Methods: 4th edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法: 第4版.北京: 中国环境科学出版社, 2002. ]
|
| [17] |
Xie CX. Ichthyology. Beijing: China Agricultural Press, 2009: 13-17. [谢从新. 鱼类学. 北京: 中国农业出版社, 2009: 13-17.]
|
| [18] |
Eggers DM. Factors interpreting data obtained by diel sampling of fish stomachs. Journal of the Ournal of the Fisheries Research Board of Canada, 1977, 34: 290-294. |
| [19] |
Chen SL, Hua YY, Zhu ZR et al. Ingestion intensity of silver carp and bighead carp under natural conditions (Ⅱ) annual feeding intensity of silver carp and bighead carp in East Lake, Wuhan. Acta Hydrobiologica Sinica, 1989, 13(2): 114-123. [陈少莲, 华元渝, 朱志荣等. 鲢、鳙在天然条件下的摄食强度(Ⅱ)武汉东湖鲢、鳙周年摄食强度的研究. 水生生物学报, 1989, 13(2): 114-123.] |
| [20] |
Ke ZX, Xie P, Guo L et al. In situ study on the control of toxic Microcystis blooms using phytoplanktivorous fish in the subtropical Lake Taihu of China: A large fish pen experiment. Aquaculture, 2007, 265(1-4): 127-138. DOI:10.1016/j.aquaculture.2007.01.049 |
| [21] |
Mcnaughton SJ. Relationships among functional properties of Californian grassland. Nature, 1967, 216: 168-169. |
| [22] |
Chen YC, Tang L, Zhang DG et al. The spatial and temporal dynamics of chlorophyll a concentrations and its relationship with phosphorus in Lake Dianchi. Journal of Agro-Environment Science, 2008, 27(4): 1555-1560. [陈永川, 汤利, 张德刚等. 滇池叶绿素a的时空变化及水体磷对藻类生长的影响. 农业环境科学学报, 2008, 27(4): 1555-1560. DOI:10.3321/j.issn:1672-2043.2008.04.049] |
| [23] |
Koutrakis ET, Tsikliras AC. Length-weight relationships of fishes from three northern Aegean estuarine systems (Greece). Journal of Applied Ichthyology, 2003, 19: 258-260. DOI:10.1046/j.1439-0426.2003.00456.x |
| [24] |
Ke ZX, Xie P, Guo LG et al. Effects of large bio-manipulation fish pen on community structure of crustacean zooplanktonin Meiliang Bay of Taihu Lake. Chinese Journal of Applied Ecology, 2012, 23(8): 2270-2276. [柯志新, 谢平, 过龙根等. 太湖梅梁湾大型控藻围栏对浮游甲壳动物群落结构的影响. 应用生态学报, 2012, 23(8): 2270-2276.] |
| [25] |
Li Y, Xie P, Zhang J et al. Effects of filter-feeding planktivorous fish and cyanobacteria on structuring the zooplankton community in the eastern plain lakes of China. Ecological Engineering, 2017, 99: 238-245. DOI:10.1016/j.ecoleng.2016.11.040 |
| [26] |
Yi CL, Guo LG, Ni LY et al. Biomanipulation in mesocosms using silver carp in two Chinese lakes with distinct trophic states. Aquaculture, 2016, 452: 233-238. DOI:10.1016/j.aquaculture.2015.11.002 |
| [27] |
Li PP. Ecological stoichiometry of silver and bighead carps and their driven nutrient recycling in Lake Qiandao [Dissertation]. Shanghai: Shanghai Ocean University, 2012. [李培培.千岛湖鲢、鳙的生态化学计量学及其驱动的养分再循环[学位论文].上海: 上海海洋大学, 2012.] ]
|
| [28] |
Li XJ, Tang M, Li Y et al. Role of silver carp and bighead on nitrogen and phosphorus cycle of aquatic ecosystem in Changshou Lake. Freshwater Fisheries, 2018, 48(3): 40-46. [李晓洁, 唐敏, 李云等. 鲢鳙在长寿湖水生态系统氮磷循环中的作用. 淡水渔业, 2018, 48(3): 40-46. DOI:10.3969/j.issn.1000-6907.2018.03.007] |
| [29] |
Xue Y. Nitrogen and phosphorus recycling driven by Silver carp and Bighead carp in the Three Gorges Reservoir Water Ranch [Dissertation]. Chongqing: Southwest University, 2015. [薛洋.三峡库区水域牧场鲢鳙驱动的氮磷循环研究[学位论文].重庆: 西南大学, 2015.] ]
|
| [30] |
Xie P. Gut contents of bighead carp Aristichthys nobilis and the processing and digestion of algal cells in the alimentary canal. Aquaculture, 2001, 195: 149-161. DOI:10.1016/S0044-8486(00)00549-4 |
| [31] |
Xie P. Gut contents of silver carp, Hypophthalmichthys molitrix, and the disruption of a centric diatom, Cyclotella, on passage through the esophagus and intestine. Aquaculture, 1999, 180: 295-305. DOI:10.1016/S0044-8486(99)00205-7 |
| [32] |
Hu CL, Wang SR, Guo LG et al. Study on the food composition of silver carp and bighead in Lake Erhai and the feeding overlap of new silver fish in taihu lake. Acta Hydrobiologica Sinica, 2014, 38(4): 706-713. [胡翠林, 王圣瑞, 过龙根等. 洱海鲢、鳙的食物组成及与太湖新银鱼的食性重叠研究. 水生生物学报, 2014, 38(4): 706-713.] |
| [33] |
Yi CL, Guo LG, Ni LY et al. Silver carp exhibited an enhanced ability of biomanipulation to control cyanobacteria bloom compared to bighead carp in hypereutrophic Lake Taihu mesocosms. Ecological Engineering, 2016, 89: 7-13. DOI:10.1016/j.ecoleng.2016.01.022 |
| [34] |
Mueller CR, Eversole AG, Turker H et al. Effect of Silver Carp Hypophthalmichthys molitrix and freshwater mussel Elliptio complanata filtration on the phytoplankton community of partitioned aquaculture system units. Journal of the World Aquaculture Society, 2010, 35(3): 372-382. |
| [35] |
Radke RJ, Kahl U. Effects of a filter-feeding fish [silver carp, Hypophthalmichthys molitrix (val.)] on phyto- and zooplankton in a mesotrophic reservoir: results from an enclosure experiment. Freshwater Biology, 2002, 47(12): 2337-2344. DOI:10.1046/j.1365-2427.2002.00993.x |
| [36] |
Hu L, Yang Z, Pan X et al. Use of fish species from different trophic levels to control algae and water quality:An enclosure experiment in eutrophic area of Xiaojiang River. PLos One, 2017, 12(3). |
 2019, Vol. 31
2019, Vol. 31 


