(2: 中国科学院大学, 北京 100049)
(3: 暨南大学, 广州 510632)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(3: Jinan University, Guangzhou 510632, P. R. China)
氮是浮游植物生长所需的重要元素,浮游植物对氮的吸收与其生长繁殖密切相关,浮游植物的生长繁殖进而影响着湖泊水质的优劣.硝态氮和铵态氮是太湖中浓度最高的两种无机氮,与浮游植物关系最为密切.目前也有大量针对海洋的研究表明,尿素等溶解态有机氮与赤潮密切相关[1-3].
梅梁湾位于太湖北部,靠近江苏省无锡市,水面面积约129.3 km2,平均水深1.9 m左右[4].自1980s中期以来,因工农业废水和生活污水的大量排入,梅梁湾成为太湖最严重的富营养化水域之一[5].梅梁湾是无锡市的主要水源地,蓝藻水华在春、夏季频频暴发,不仅破坏了湖泊的生态平衡,还严重影响到当地居民生活和生产.
虽然太湖梅梁湾湖区污染严重,蓝藻水华频频暴发,但目前关于氮吸收,尤其是尿素态氮的相关研究还很少[6-7].已有大量研究表明,蓝藻暴发与工、农业生产和城市生活产生的大量营养盐排放进入太湖有关[8-9].还有研究表明,藻类暴发与尿素等的施用有很强的相关性[7, 10].因此,本文分别于冬、春、夏、秋4个季节对太湖梅梁湾水体常规理化指标和浮游植物群落结构进行分析,并利用15N稳定同位素示踪技术研究浮游植物对铵态氮、硝态氮和尿素态氮吸收的动力学特征,以期为蓝藻水华暴发机理研究提供科学依据.
1 实验参数选择与实验方法 1.1 实验参数选择1) 实验日期:在2010年1、4、7、10月中旬分别选择天气晴朗、风浪较小的一天进行实验.
2) 培养时间:相关文献研究表明,在培养最开始,有一个迅速吸收的阶段,15N的结合与时间呈线性关系[11].随培养时间的增加,吸收速率先降低,后恒定[12-13].如果培养时间过长,会出现稀释效应,即由于浮游生物生长所导致的同位素稀释,从而给吸收速率测定带来误差.因此,培养时间要选择吸收速率恒定后的最短时间. Dugdale等[11]对海洋氮吸收实验进行总结,认为2~6 h是最佳培养时间. Gu等[12]对Okeechobee湖进行研究,发现在培养大概2 h后,吸收速率就保持恒定.综上,本实验选择培养时间为2 h.
3) 培养浓度梯度:由于缺乏相关数据,因此本次测定设置的添加物各浓度梯度较大.冬季15NH4Cl、Na15NO3、(15NH2)2CO的浓度梯度均设置为1、5、10、20和50 μmol-N/L,春季最大浓度增加到100 μmol-N/L,夏季和秋季增加到250 μmol-N/L.
1.2 实验方法1) 采样:用采水器采集约0.3 m表层水,其中5 L水样用于水化学指标测定;500 ml水样加5 ml鲁哥试剂固定,用于浮游植物分析;50 ml水样加2 ml甲醛固定,用于浮游动物分析;另外10 L水样用于挂瓶培养测定氮吸收情况.同时,现场用YSI 6600 V2型多参数水质监测仪(美国)、透明度盘对水温(T)、pH、浊度、溶解氧(DO)浓度等物理指标进行测定.
2) 挂瓶培养:水样经80目绢网过滤,以去掉大型浮游动物.每个培养瓶中装入200 ml水样.盖紧盖子,摇匀后,将瓶子按照随机区组设计结果放置于铁架内,用绳子固定好,悬挂于水面下0.3 m处,培养2 h.培养培养后,立即在每个瓶子里加入饱和氯化锌溶液4 ml,以停止浮游植物的生理活动,使其停止对氮的继续吸收.
3) 处理样品:培养后的水样放入避光保温箱中,带回实验室,用预先在450℃马弗炉中灼烧3 h的GF/C膜(已称重并放于对应的培养皿中)过滤,再过滤5 ml去离子水以清洗掉吸附在滤膜上的15N.过滤后的水样装入200 ml的塑料瓶中冷冻保存.过滤后的膜放入相应编号的培养皿中,一并放入70℃的烘箱中,48 h后称重.然后用刀片刮下浮游植物,研磨成粉末,装入离心管中,待用于质谱仪测定同位素.
4) 水化学指标测定:采用过硫酸盐氧化法测定水中总氮(TN)和总磷(TP)浓度,水样用0.45 μm醋酸纤维膜过滤后,滤膜用于叶绿素a(Chl.a)浓度测定,水样用于总溶解态氮(TDN)、总溶解态磷(TDP)、铵态氮(NH4+-N)、硝态氮(NO3--N)、尿素态氮(Urea-N)、亚硝态氮(NO2--N)、溶解性正磷酸盐(PO43--P)浓度测定,其中TN、TP、TDN和TDP浓度测定采用过硫酸盐氧化法[14],尿素浓度测定采用二乙酰一肟法[15],NH4+-N、NO3--N、NO2--N和PO43--P浓度的测定采用微量流动注射分析系统(Skalar-SA1000),Chl.a浓度测定采用丙酮+分光光度法[14].
5) 浮游植物群落:浮游藻类群落参数为门类、优势种属、异形胞数量.优势种属定义为单个样品中生物量至少占总生物量的5 %的种属.鉴定及计数浮游藻类用倒置显微镜视野法,每次计数至少达300个.藻类生物体积根据各藻类相近几何形状的体积公式计算;假定浮游植物藻类的密度为1 g/cm3,计算出水体浮游植物生物量[16].浮游植物种类鉴定参照《中国淡水藻类:系统、分类及生态》[17].
1.3 数据处理1) 吸收速率(V)的计算参照Dugdale等[11]所用的公式:
| $V = \frac{{^{15}{N_{\rm{s}}}{ - ^{15}}{N_{\rm{n}}}}}{{\left( {^{15}{N_{{\rm{enr}}}}{ - ^{15}}{N_{\rm{n}}}} \right)T}} $ | (1) |
式中,15Ns为实测样品的15N丰度;15Nn为15N的天然丰度(0.366 %);15Nenr为加入示踪剂后培养介质初始的15N丰度;T为培养时间(h).
2) 半饱和常数与最大吸收速率通过Sigma Plot 11.0软件拟合米氏(Michaelis-Menten)方程得到:
| $V = \frac{{{V_{\max }} \cdot S}}{{{K_{\rm{s}}} + S}} $ | (2) |
式中,V为底物吸收速率(μmol/(L ·h));Vmax为最大吸收速率(μmol(μg)/(L ·h)),表征细胞对营养离子的吸收潜力;Ks为半饱和常数(μmol/L),表征细胞对营养离子的亲和力;S为底物浓度(μmol/L).
2 结果分析 2.1 理化指标从理化指标来看,太湖梅梁湾水体夏季和秋季温度较高,DO浓度较低.水体中TN浓度除在秋季较低外,其余季节均较高,TDN、NO3--N、NH4+-N和Urea-N浓度在冬季和春季明显高于夏季和秋季,而TP和TDP浓度均为秋季明显高于其他季节.夏季,水体浊度和Chl.a浓度明显高于其他季节(表 1).
| 表 1 太湖梅梁湾水体理化指标的季节变化* Tab. 1 Seasonal variation of physico-chemical parameters in Meiliang Bay of Lake Taihu |
太湖梅梁湾冬、春、夏、秋4个季节浮游植物群落丰度分别为3.04×106、4.51×106、4.92×108和2.34×107 cells/L.从浮游植物群落组成来看,冬季和春季均以硅藻门种类为主,而夏季和秋季则以蓝藻门种类占绝对优势.冬季,硅藻门丰度占浮游植物总丰度的57.39 % (图 1),主要种类有直链硅藻(Melosira spp.)、小环藻(Cyclotella sp.)、针杆藻(Synedra sp.)等;其次为绿藻门,占21.13 %,主要种类有丝藻(Ulothrix spp.)等;蓝藻门占11.62 %,主要为微囊藻(Microcystis spp.);春季,硅藻门丰度最高,占总丰度的50.00 %,主要种类为小环藻,其次为隐藻门,占35.29 %,主要种类有尖尾蓝隐藻(Chroomonas acuta)和啮蚀隐藻(Cryptomonas erosa);绿藻门占14.71 %,种类主要有衣藻(Chlamydomonas sp.)和栅藻(Scenedesmus spp.)等.夏季和秋季则以蓝藻门的微囊藻属占绝对优势,其丰度分别占浮游植物总丰度的99.53 %和97.12 %.

|
图 1 冬季和春季梅梁湾实验点位浮游植物群落结构 Fig.1 Phytoplankton community compositions in the site of Meiliang Bay in winter and spring |
冬季太湖梅梁湾浮游植物群落对NH4+-N的Vmax最大,为0.01 h-1,远高于对Urea-N的Vmax(0.0002 h-1)和NO3--N的Vmax(0.0002 h-1).半饱和常数Ks则为NO3--N>NH4+-N>Urea-N,分别为32.5688、20.2610和2.1219 μmol/L.从拟合的吸收曲线可以看出,浮游植物群落对Urea-N的吸收在添加浓度范围内出现了饱和,而对NH4+-N和NO3--N的吸收速率仍有随着添加浓度增大而升高的趋势(图 2).
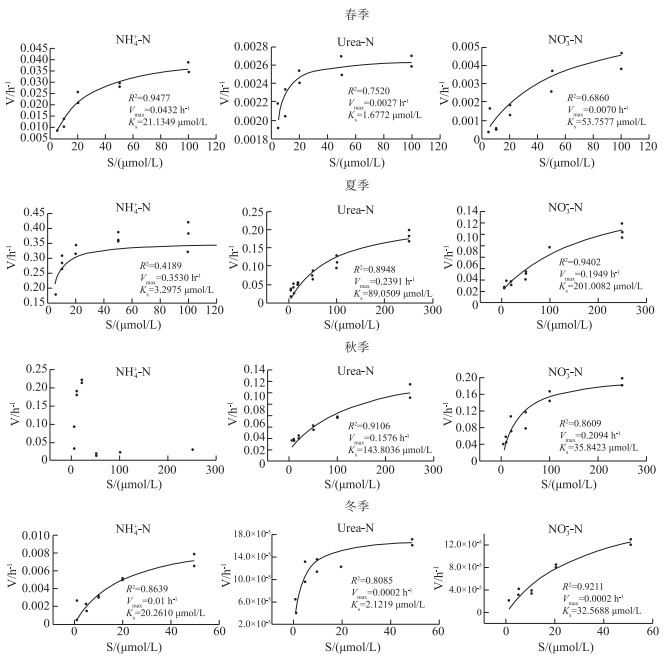
|
图 2 浮游植物群落对铵态氮、尿素态氮和硝态氮吸收动力学曲线的季节变化 Fig.2 Seasonal variations of uptake kinetics curves of ammonium-N, Urea-N and nitrate-N of phytoplankton community |
由于冬季氮吸收动力学实验所设置的最大添加浓度较小,达到最大浓度时吸收速率仍呈现增长的趋势,因此春季氮吸收实验增加了最大添加浓度.与冬季情况相似,春季太湖梅梁湾浮游植物群落对NH4+-N吸收的Vmax为0.0432 h-1,也远高于对Urea-N和NO3--N的Vmax,浮游植物群落对NO3--N的Vmax高于Urea-N,值分别为0.0070和0.0027 h-1.从拟合的吸收曲线可以看出,浮游植物群落对Urea-N的吸收在添加浓度范围内出现了饱和,而对NO3--N的吸收速率仍有随着添加浓度增大而升高的趋势(图 2).
2.3.3 夏季氮吸收动力学曲线夏季太湖梅梁湾浮游植物群落对3种形态氮的Vmax远大于冬季和春季,其中,对NH4+-N的最大吸收速率Vmax最大,为0.3530 h-1,约为冬季的35倍,为春季的8倍左右.与冬季和春季吸收情况相似,浮游植物群落对NH4+-N的Vmax高于对NO3--N和Urea-N的Vmax.半饱和常数Ks则为NO3--N>Urea-N>NH4+-N,分别为201.0082、89.0509和3.2975 μmol/L(图 2).
2.3.4 秋季氮吸收动力学曲线秋季太湖梅梁湾浮游植物群落对NO3--N吸收的Vmax为0.2094 h-1,半饱和常数Ks为35.8423 μmol/L,对Urea-N吸收的Vmax为0.1576 h-1,半饱和常数Ks为143.8036 μmol/L.浮游植物对NH4+-N的吸收不符合米氏方程(图 2).
3 讨论 3.1 浮游植物氮吸收曲线拟合效果米氏方程(Michaelis-Menten equation)表示一个酶促反应的起始速度与底物浓度关系的速度方程.有研究表明,浮游植物对氮的吸收过程符合米氏方程[18].本研究中,冬季和春季,浮游植物对NH4+-N、Urea-N和NO3--N 3种形态氮吸收曲线的拟合效果较好,浮游植物对3种形态氮的吸收不是单纯随着底物浓度的增加而增加,其规律是符合米氏方程的,夏季,对Urea-N和NO3--N吸收也符合同样的规律,这与之前一些学者的研究结论一致[12-13, 19-25].而夏季和秋季,浮游植物对NH4+-N的吸收拟合结果较差或者不符合米氏方程.太湖梅梁湾夏季和秋季浮游植物群落主要为微囊藻(丰度占比分别为99.53 %和97.12 %). Takamura等[19]对日本Kasumigaura湖的研究表明,微囊藻对NO3--N和NH4+-N的最大吸收速率显著高于其他浮游植物.而又有大量研究表明浮游植物优先吸收NH4+-N[20, 26-28].而且,太湖梅梁湾夏、秋季水体的NH4+-N浓度较其他季节低一些(表 1).有可能因为环境中NH4+-N的浓度低以及微囊藻对NH4+-N的吸收速率大两方面原因导致了对NH4+-N吸收的测定误差较大.另外,也有可能是双峰吸收机制(bimodal uptake mechanism)导致的[29-20].本文对这方面所做的研究尚不足以解释,还有待进一步研究.
3.2 浮游植物群落对氮吸收的Vmax与浮游植物群落结构的关系本文结果显示,无论哪个季节(除秋季拟合失败),浮游植物群落对NH4+-N吸收的Vmax均大于另外两种形态氮,这与之前很多学者的研究结果相一致[6, 24, 31-35].这是由于浮游植物吸收的氮均需要转化为低价态的氮才能被自身同化利用,而NH4+-N的同化所消耗能量最小,因此通常认为NH4+-N是浮游植物最倾向吸收的氮.梅梁湾浮游植物群落对Urea-N吸收的Vmax表现为夏季明显高于其他季节,且高于NO3--N;其他季节则小于或等于NO3--N.有研究表明,与NO3--N相比,腰鞭毛虫(Dinoflagellate)和蓝藻主要依靠还原态氮(如NH4+-N和Urea-N等)[2, 36-37]. Berg等[2]甚至通过短期监测也发现,Aureococcus anophagefferens水华暴发期间,浮游植物群落对Urea-N的吸收速率远高于对NH4+-N的吸收速率.梅梁湾夏季浮游植物群落组成以蓝藻门的微囊藻占绝对优势,丰度占总丰度的百分比为99.53 %,这说明随着浮游植物群落由硅藻门占优势向蓝藻门占绝对优势的转变,浮游植物对尿素的吸收喜好增加,与前人的研究结果较为一致.
总体来看,3种形态氮的Vmax均为夏季>秋季>春季>冬季,这可能与浮游植物数量与群落组成有关. Takamura等[19]对日本Kasumigaura湖的研究表明,微囊藻对NO3--N和NH4+-N的最大吸收速率显著高于其他浮游植物.从浮游植物定量分析结果可知,梅梁湾夏季浮游植物丰度最大,为4.92×108 cells/L,群落组成又以微囊藻占绝对优势,因此夏季浮游植物的Vmax最高,这与Takamura等的结论相符[19].冬季浮游植物群落丰度为3.04×106 cells/L,虽然高于春季(4.51×105 cells/L),但两个季节浮游植物群落组成有所不同.太湖梅梁湾冬季浮游植物群落以硅藻门的直链硅藻为主,而春季以硅藻门的小环藻和隐藻门的尖尾蓝隐藻为主.隐藻是介于浮游植物和原生动物之间的一类藻,虽然春季浮游植物丰度较低,但春季隐藻增多,可能是由于隐藻对还原态氮的喜好,导致了对NH4+-N和Urea-N的吸收增加,这还有待进一步实验验证.一些学者认为,在NO3--N突然大量增多的情况下,容易暴发硅藻水华.因为硅藻在NO3--N丰富的环境下,其生理机制有利于自身快速生长[37-38]. Berg等[36]研究发现,春季Biga海湾硅藻丰度与NO3--N浓度呈线性相关,而夏季则与溶解游离氨基酸浓度呈负相关,从而推断硅藻在这一生态系统中不利用溶解性有机氮.然而,本文研究发现,梅梁湾在硅藻较多的冬季,浮游植物群落对NO3--N的吸收反而低于其他季节,这一方面可能与冬季温度较低有关,另一方面,由于之前均为寡营养海洋环境中的研究,而太湖这样的富营养湖泊与海洋的环境因子差别较大.因此,对于湖泊中硅藻的氮吸收特征还有待进一步深入研究.另外,浮游植物对NO3--N和Urea-N吸收的Vmax在夏、秋季高于冬、春季,可能还与水体中的NH4+-N浓度有关.有研究表明,水体中NH4+-N能抑制浮游植物对NO3--N[39-40]和Urea-N的吸收[41].本研究中,太湖梅梁湾水体NH4+-N浓度在夏、秋季节低于冬、春季(表 1),可能正是NH4+-N浓度的降低减弱了浮游植物对NO3--N和Urea-N吸收的抑制作用.
3.3 浮游植物群落对氮吸收的Ks与氮限制的关系本研究发现,太湖梅梁湾浮游植物群落对NH4+-N和NO3--N吸收的Ks很高,与Yang等[7]对太湖的研究结果类似,明显高于以往海洋和其他淡水的研究结果[12, 19-20].这可能与太湖水体中NO3--N和NH4+-N的本底浓度较高有关. Ks是种群在一定条件下对某营养环境长期适应的结果[42].浮游植物对某种形态氮具有较高的Ks表明浮游植物在该种形态氮浓度很低的情况下不能利用这种形态氮,很有可能受其限制[12].由于太湖水体NO3--N和NH4+-N浓度长期居高不下,导致了浮游植物群落对高营养盐环境的适应,如果营养盐浓度降低将会导致浮游植物群落不能够对其进行利用.因此,虽然太湖的NH4+-N和NO3--N浓度较高,但若控制NH4+-N和NO3--N的浓度可能会限制浮游植物的生长.
将3种形态氮4个季节的Ks值进行比较发现,浮游植物对NH4+-N吸收的Ks值在冬、春季高于夏季,对Urea-N吸收的Ks值则夏、秋季高于冬、春季,而对NO3--N吸收的Ks值则夏季显著高于其他3个季节.一般来说,Ks越高表明浮游植物越容易受到限制,而Vmax相对较高,Ks较低则说明对此种底物的吸收亲和力较高[43-44].由此可以看出,冬季和春季梅梁湾浮游植物群落最易受到NO3--N限制,而最不易受到Urea-N的限制;而夏季,则最易受到NO3--N限制,而最不易受到NH4+-N的限制,且浮游植物群落对NH4+-N的亲和力最高.与NO3--N相比,秋季浮游植物更容易受到Urea-N的限制.由此可见,不同季节,容易对浮游植物产生限制作用的氮形态不同.
不同浮游植物种类的Ks值不同,同一地区营养盐浓度的季节变化也会导致浮游植物群落组成的季节更替[42],这也会导致不同季节浮游植物群落对氮吸收的差异.有研究表明,通常沿岸种类具有较高的Ks值,而大洋种类Ks值较小.另外,粒径小的浮游植物细胞通常Ks值也较小[42].浮游植物对3种形态氮吸收的Ks值在各个季节的变化规律均不相同,其原因可能与梅梁湾不同季节浮游植物群落结构不同有关.
3.4 浮游植物群落氮吸收与蓝藻水华暴发的关系很多研究都表明,与无机氮相比,有害藻类(HABs)更喜欢利用有机氮[2, 23, 45].还有研究表明,腰鞭毛虫更喜欢有机氮[46-48]. Glibert等[49]的实验表明,Prorocentru mminimum和Aureococcus anophagefferens对Urea-N的喜好大于无机氮,Berg等[2]通过短期监测也发现,在Aureococcus anophagefferens水华暴发期间,浮游植物群落对Urea-N的吸收速率远大于对NH4+-N的吸收速率. Fan等[48]认为,腰鞭毛虫Prorocentrum minimum对尿素的高度亲和力导致了Neuse河口暴发水华. Kudela等发现[21],赤潮藻Lingulodinium polyedrum吸收的氮中尿素占了很大的比例.还有研究表明,自然和添加的溶解性有机氮输入,尤其是尿素,会刺激赤潮藻Aureococcus anophagefferens的生长[49].梅梁湾常发生的是蓝藻水华,一般以微囊藻水华较为常见.从浮游植物生长旺盛的夏季测定结果来看,梅梁湾浮游植物群落对Urea-N的吸收速率低于对NH4+-N的吸收速率,但是高于对NO3--N的吸收速率.在蓝藻水华暴发之前的春季,对Urea-N的吸收速率也不高,浮游植物对Urea-N的吸收与梅梁湾蓝藻水华的关系并不像与海洋环境中那样密切,可能与梅梁湾水体中营养盐本底浓度高有关.夏季,浮游植物群落对NH4+-N的吸收速率显著升高,因此对于梅梁湾蓝藻水华暴发,NH4+-N作出的贡献可能更大一些.但是,本文通过水化指标分析发现,太湖梅梁湾Urea-N浓度在冬季和春季明显高于夏季和秋季,而梅梁湾湖区蓝藻水华暴发通常从每年的5月中下旬开始出现,这与Glibert等[50]观测到的相类似,发现Urea-N浓度在P. mminimum暴发前显著升高.另外,还有研究表明藻类暴发与尿素等农药的施用有很强的相关性[41].因此,太湖梅梁湾蓝藻水华暴发可能与水体中Urea-N浓度存在一定联系.
4 结论太湖梅梁湾浮游植物群落除了秋季对NH4+-N的吸收不符合米氏方程外,其余均符合.冬季和春季3种形态氮Vmax的大小依次为:NH4+-N>NO3--N>Urea-N,而夏季Vmax为:NH4+-N>Urea-N>NO3--N. 3种形态氮Vmax的季节变化规律为夏季>秋季>春季>冬季. Vmax在不同季节以及不同形态氮之间的差异性与浮游植物群落组成以及水体中NH4+-N浓度关系密切.浮游植物对NH4+-N吸收的Ks值在冬、春季高于夏季,对Urea-N吸收的Ks值则在夏、秋季高于冬、春季,而对NO3--N吸收的Ks值则在夏季显著高于其他3个季节.冬季和春季梅梁湾浮游植物群落最容易受到NO3--N的限制,而最不容易受到Urea-N的限制;而夏季,则最容易受到NO3--N的限制,而最不容易受到NH4+-N的限制,且浮游植物群落对NH4+-N的亲和力最高.与NO3--N相比,秋季浮游植物更容易受到Urea-N的限制.对浮游植物产生限制作用的氮形态存在显著的季节差异.
| [1] |
Paerl HW. Nuisance phytoplankton blooms in coastal, estuarine, and inland waters. Limnology and Oceanography, 1988, 33: 823-847. |
| [2] |
Berg GM, Glibert PM, Lomas MW et al. Organic nitrogen uptake and growth by the chrysophyte Aureococcus anophagefferens during a brown tide event. Marine Biology, 1997, 129: 377-387. DOI:10.1007/s002270050178 |
| [3] |
Lomas MW, Glibert PM, Clougherty D. Elevated organic nutrient ratio sassociated with brown tide blooms of Aureococcus anophagefferens (Pelagophyceae). Journal of Plankton Research, 2001, 23: 1339-1344. DOI:10.1093/plankt/23.12.1339 |
| [4] |
Gao XM, Li YP, Du W et al. Suspended solid settlement characteristics in Meiliang Bay of Lake Taihu:in situ observation. J Lake Sci, 2017, 29(1): 52-58. [高小孟, 李一平, 杜薇等. 太湖梅梁湾湖区悬浮物动态沉降特征的野外观测. 湖泊科学, 2017, 29(1): 52-58. DOI:10.18307/2017.0106] |
| [5] |
Song XL, Liu ZW, Pan HK et al. Phytoplankton community structure in Meiliang Bay and Lake Wutli of Lake Taihu. J Lake Sci, 2007, 19(6): 643-651. [宋晓兰, 刘正文, 潘宏凯等. 太湖梅梁湾与五里湖浮游植物群落的比较. 湖泊科学, 2007, 19(6): 643-651. DOI:10.18307/2007.0604] |
| [6] |
Yang L, Zhang M, Liu ZW. Uptake of various forms of nitrogen by phytoplankton community in spring in Lake Taihu. J Lake Sci, 2011, 23(4): 605-611. [杨柳, 章铭, 刘正文. 太湖春季浮游植物群落对不同形态氮的吸收. 湖泊科学, 2011, 23(4): 605-611. DOI:10.18307/2011.0417] |
| [7] |
Yang J, Gao H, Glibert PM et al. Rates of nitrogen uptake by cyanobacterially-dominated assemblages in Lake Taihu, China, during late summer. Harmful Algae, 2017, 65: 71-84. DOI:10.1016/j.hal.2017.04.001 |
| [8] |
Xu H, Paerl HW, Qin BQ et al. Determining critical nutrient thresholds needed to control harmful cyanobacterial blooms in eutrophic Lake Taihu, China. Environ Sci Technol, 2015, 49(2): 1051-1059. DOI:10.1021/es503744q |
| [9] |
Zhou J, Qin BQ, Han XX et al. Turbulence increases the risk of microcystin exposure in a eutrophic lake (Lake Taihu) during cyanobacterial bloom periods. Harmful Algae, 2016, 55: 213-220. DOI:10.1016/j.hal.2016.03.016 |
| [10] |
Glibert PM, Maranger R, Sobota DJ et al. The haber-Bosch-harmful algal bloom (HB-HAB) link. Environmental Research Letters, 2014, 9(10): 13. |
| [11] |
Dugdale RC, Wilkerson FP. The use of 15N to measure nitrogen uptake in eutrophic oceans; experimental considerations. Limnology and Oceanography, 1986, 31: 673-689. DOI:10.4319/lo.1986.31.4.0673 |
| [12] |
Gu BH, Havens KE, Schelske CL et al. Uptake of dissoved nitrogen by phytoplankton in a eutrophic subtropical lake. Journal of Plankton Research, 1997, 19: 759-770. DOI:10.1093/plankt/19.6.759 |
| [13] |
Presing M, Herodek S, Preston T et al. Nitrogen uptake and the importance of internal nitrogen loading in Lake Balaton. Freshwater Biology, 2001, 46: 125-139. DOI:10.1046/j.1365-2427.2001.00622.x |
| [14] |
Jin XC, Tu QY eds. Specifications for lake eutrophication survey:2nd edition. Beijing: China Environmental Science Press, 1990. [金相灿, 屠清瑛. 湖泊富营养化调查规范:第2版. 北京: 中国环境科学出版社, 1990.]
|
| [15] |
Koroleff F ed. Determination of urea. In: Grasshoff KEMA eds. Methods of seawater analysis: 2nd. New York: VCH Publshers, 1983.
|
| [16] |
Huang ZS, Huang XF eds. Research method of freshwater plankton. Beijing: Science Press, 1991. [章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.]
|
| [17] |
Hu HJ, Wei YX eds. The freshwater algae of China:Systematics, taxonomy and ecology. Beijing: Science Press, 2006. [胡鸿均, 魏印心. 中国淡水藻类——系统、分类及生态. 北京: 科学出版社, 2006.]
|
| [18] |
Zhang GW. Studies ondissovled nitrogen, phytoplankton and nitrogen uptake by phytoplankton in Huguangyan Maar Lake[Dissertation]. Zhanjiang: Guangdong Ocean University, 2014. [张国维.湖光岩玛珥湖溶解态氮与浮游植物及其氮吸收的研究[学位论文].湛江: 广东海洋大学, 2014. ]
|
| [19] |
Takamura N, Iwakuma T, Yasuno M. Uptake of 13C and 15N (ammonium, nitrate and urea) by Microcystis in Lake Kasumigaura. Journal of Plankton Research, 1987, 9: 151-165. DOI:10.1093/plankt/9.1.151 |
| [20] |
Gu BH, Alexander V. Dissolved nitrogen uptake by a cyanobacterial bloom (Anabaena flos-aquae) in a subarctic lake. Applied and Environmental Microbiology, 1993, 59: 422-430. |
| [21] |
Kudela RM, Cochlan WP. Nitrogen and carbon uptake kinetics and the influence of irradiance for a red tide bloom off southern California. Aquatic Microbial Ecology, 2000, 21: 31-47. DOI:10.3354/ame021031 |
| [22] |
Cochlan WP, Bronk DA. Nitrogen uptake kinetics in the Ross Sea, Antarctica. Deep-Sea Research Part Ⅰ-Topical Studies in Oceanography, 2001, 48: 4127-4153. DOI:10.1016/S0967-0645(01)00083-2 |
| [23] |
Herndon J, Cochlan WP. Nitrogen utilization by the raphidophyte Heterosigma akashiwo:Growth and uptake kinetics in laboratory cultures. Harmful Algae, 2007, 6: 260-270. DOI:10.1016/j.hal.2006.08.006 |
| [24] |
Zhang GW, Li CL, Huang XH et al. Uptake of dissolved nitrogen by phytoplankton in spring in Huguangyan Maar Lake. J Lake Sci, 2015, 27(3): 527-534. [张国维, 李长玲, 黄翔鹄等. 湖光岩玛珥湖春季浮游植物对溶解态氮的吸收. 湖泊科学, 2015, 27(3): 527-534. DOI:10.18307/2015.0321] |
| [25] |
Raphael M, Kudela A, William JQL. The potential roal of anthropogenically derived nitrogen in the growth of harmful algae in California, USA. Harmful Algae, 2008, 8: 103-110. DOI:10.1016/j.hal.2008.08.019 |
| [26] |
Gu BH, Alexander V. Seasonal variations in dissolved inorganic nitrogen utilization in a subarctic Alaskan lake. Archiv fur Hydrobiologie, 1993, 126: 273-288. |
| [27] |
Chen M, Huang YP, Qiu YS. Nitrogen uptake rate of the Bering Sea basin using isotope tracer technology. Progress in Natural Science Materials International, 1997, 17: 1672-1684. [陈敏, 黄奕普, 邱雨生. 白令海盆氮吸收速率的同位素示踪. 自然科学进展, 1997, 17: 1672-1684.] |
| [28] |
Mukherjee R, Kumar S, Muduli PR. Spatial variation of nitrogen uptake rates in the largest brackish water lagoon of Asia (Chilika, India). Estuarine, Coastal and Shelf Science, 2018, 1-11. DOI:10.1016/j.ecss.2018.01.012 |
| [29] |
Bronk DA, Sanderson MP, Mulholland MR et al. Organic and inorganic nitrogen uptake kinetics in field populations dominated by Karenia brevis. In: Steidinger K, Vargo GA, Heil CA eds. Harmful Algae 2002. Florida Fish and Wildlife Conservation Commission, Florida Institute of Oceanography and Intergovernmental Oceanographic Commission of UNESCO, St. Petersburg, FL, 2004: 80-82.
|
| [30] |
Bronk DA, See JH, Bradley P et al. DON as a source of bioavailable nitrogen for phytoplankton. Biogeosciences, 2007(4): 283-296. |
| [31] |
Dortch Q. The interaction between ammonium and nitrate uptake in phytoplankton. Marine Ecology Progress Series, 1990, 61: 183-201. DOI:10.3354/meps061183 |
| [32] |
Flynn KJ. Algal carbon-nitrogen metabolism:a biochemical basis for modelling the interactions between nitrate and ammonium uptake. Journal of Plankton Research, 1991, 13: 373-387. DOI:10.1093/plankt/13.2.373 |
| [33] |
Veuger B, Middelburg JJ, Boschker H et al. Microbial uptake of dissolved organic and inorganic nitrogen in Randers Fjord. Estuarine Coastal and Shelf Science, 2004, 61: 507-515. DOI:10.1016/j.ecss.2004.06.014 |
| [34] |
Dugdale RC, Wilkerson FP, Hogue VE et al. The role of ammonium and nitrate in spring bloom development in San Francisco Bay. Estuarine Coastal and Shelf Science, 2007, 73: 17-29. DOI:10.1016/j.ecss.2006.12.008 |
| [35] |
Herndon J, Cochlan WP. Nitrogen utilization by the raphidophyte Heterosigma akashiwo:Growth and uptake kinetics in laboratory cultures. Harmful Algae, 2007, 6: 260-270. DOI:10.1016/j.hal.2006.08.006 |
| [36] |
Berg GM, Balode M, Purina I et al. Plankton community composition in relation to availability and uptake of oxidized and reduced nitrogen. Aquatic Microbial Ecology, 2003, 30: 263-274. DOI:10.3354/ame030263 |
| [37] |
Lomas MW, Glibert PM. Temperature regulation of nitrate uptake:A novel hypothesis about nitrate uptake and reduction in cool-water diatoms. Limnology and Oceanography, 1999, 44: 556-572. DOI:10.4319/lo.1999.44.3.0556 |
| [38] |
Goldman JC. Potential role of large oceanic diatoms in new primary production. Deep Sea Research Part Ⅰ:Oceanographic Research, 1993, 40: 159-168. DOI:10.1016/0967-0637(93)90059-C |
| [39] |
Domingues RB, Barbosa AB, Sommer U et al. Ammonium, nitrate and phytoplankton interactions in a freshwater tidal estuarine zone:potential effects of cultural eutrophication. Aquatic Sciences, 2011, 73(3): 331-343. DOI:10.1007/s00027-011-0180-0 |
| [40] |
L'helguen S, Maguer JF, Caradec J. Inhibition kinetics of nitrate uptake by ammonium in size-fractionated oceanic phytoplankton communities:implications for new production and f-ratio estimates. Journal of Plankton Research, 2008, 30(10): 1179-1188. DOI:10.1093/plankt/fbn072 |
| [41] |
Glibert PM, Wilkerson FP, Dugdale RC et al. Phytoplankton communities from San Francisco Bay Delta respond differently to oxidized and reduced nitrogen substrates-even under conditions that would otherwise suggest nitrogen sufficiency. Frontiers in Marine Science, 2014(1): 1-16. |
| [42] |
沈国英, 施并章. 海洋生态学. 北京: 科学出版社, 2002: 197-198.
|
| [43] |
Reynolds C ed. Ecology of phytoplankton. Cambridge: Cambridge University Press, 2006: 145-175.
|
| [44] |
Zhang X, Yi QT, Xie K et al. Nutrient kinetics of dominant species of phytoplankton in the artificial lakes formed from land subsidence by mining activities in the Huainan coalmine subsidence areas. J Lake Sci, 2018, 30(3): 713-722. [张鑫, 易齐涛, 谢凯等. 淮南采煤塌陷湖泊浮游植物优势种的营养动力学. 湖泊科学, 2018, 30(3): 713-722. DOI:10.18307/2018.0313] |
| [45] |
Lomas MW, Glibert PM, Berg GM et al. Characterization of nitrogen uptake by natural populations of Aureococcus anophagefferens (Chrysophyceae) as a function of incubation duration, substrate concentration, light, and temperature. Journal of Phycology, 1996, 32: 907-916. DOI:10.1111/j.0022-3646.1996.00907.x |
| [46] |
Glibert PM, Terlizzi DE. Cooccurrence of elevated urea levels and dinoflagellate blooms in temperate estuarine aquaculture ponds. Applied and Environmental Microbiology, 1999, 65: 5594-5596. |
| [47] |
Dyhrman ST, Anderson DM. Urease activity in cultures and field populations of the toxic dinoflagellate Alexandrium. Limnology and Oceanography, 2003, 48: 647-655. DOI:10.4319/lo.2003.48.2.0647 |
| [48] |
Fan C, Glibert PM, Alexander J et al. Characterization of urease activity in three marine phytoplankton species, Aureococcus anophagefferens, Prorocentrum minimum, and Thalassiosira weissflogii. Marine Biology, 2003, 142: 949-958. DOI:10.1007/s00227-003-1017-8 |
| [49] |
Gobler CJ, Sanudo-Wilhelmy SA. Effects of organic carbon, organic nitrogen, inorganic nutrients, and iron additions on the growth of phytoplankton and bacteria during a brown tide bloom. Marine Ecology Progress Series, 2001, 209: 19-34. DOI:10.3354/meps209019 |
| [50] |
Glibert PM, Magnien R, Lomas MW et al. Harmful algal blooms in the Chesapeake and coastal bays of Maryland, USA:Comparison of 1997, 1998, and 1999 events. Estuaries, 2001, 24: 875-883. DOI:10.2307/1353178 |
 2019, Vol. 31
2019, Vol. 31 


