枝角类是淡水浮游动物的重要组成部分,不同种类间由于个体大小差别比较大,对食物磷的需求、生活史策略、对鱼类和无脊椎捕食者的敏感性不完全相同[1-4].大型滤食性枝角类通常对小型枝角类有竞争优势[5].这种竞争优势与大型枝角类和小型枝角类采取不同的生活史策略密切相关.大型枝角类通常每窝产卵量高、卵大,但性成熟相对较晚;而小型枝角类则每窝产卵量少、卵小,性成熟相对较早.总体而言,大型枝角类比小型枝角类具有更高的个体生长速率和种群内禀增长率.但是,大型枝角类和小型枝角类之间的竞争还受到捕食、食物数量和质量等因素的调节[6-8].在面对捕食强度或食物质量发生变化时,它们会相应调整生活史策略,尽量降低环境压力变化对其种群增长的影响,维持种群竞争强度.大型枝角类种类只是在早期幼体阶段对无脊椎捕食者的摄食敏感,一旦体长超过1.5 mm,则不容易被无脊椎捕食者捕食.因此,大型枝角类种类通常最大化其幼体的个体生长速度,尽快让其个体大小超出无脊椎捕食者的摄食大小范围,从而降低被无脊椎捕食者捕食的概率[9].小型枝角类种类由于在整个生活史过程对无脊椎捕食都很敏感,它们采取的策略是缩短性成熟时间、提高种群的生殖率.因此,无脊椎捕食者的选择性捕食可加大大型枝角类种类与小型枝角类种类之间的个体大小差异程度,使大型枝角类种类对小型枝角类施以更高的竞争强度.
食物质量,如不饱和脂肪酸含量以及磷含量等,是影响枝角类生活史策略及种间竞争强度的另一个重要因素[3, 8].枝角类不同种类间体内磷含量差别非常大,范围约为干重的0.62 % ~2.49 %,而且其中近一半用于合成核酸[10].由于核酸的含量与蛋白质的合成速率密切相关,核酸含量越高,生长越快[11-13].大型枝角类个体生长速率以及种群内禀增长率之所以高于小型枝角类,就是因为大型枝角类体内磷和RNA含量高于小型枝角类种类[14].因此,大型枝角类比小型枝角类需要从食物中获取更多的磷.个体生长实验表明,食物磷限制会使大型枝角类,如溞属,体内磷以及RNA含量下降,生长减缓[15-16].由于大型枝角类种类和小型枝角类种类体内磷含量不同,在生理上以及行为上调节应对食物磷限制的能力差异也比较大[15, 17-19],它们各生活史参数对食物磷限制的敏感程度可能不同[20].
盔型溞(Daphnia galeata)和脆弱象鼻溞(Bosmina fatalis)分别是中国南方地区流溪河水库大型枝角类和小型枝角类的代表种类,但盔型溞在水库中的密度全年均远低于脆弱象鼻溞[21-22].流溪河水库营养水平属贫-中营养型,食物属磷限制.明瑞梁等比较分析了食物碳磷比对流溪河水库盔型溞和脆弱象鼻溞种间竞争关系的影响,发现食物磷限制加大了盔型溞对脆弱象鼻溞的竞争优势[23],说明盔型溞在水体中密度低于脆弱象鼻溞并不是由于食物磷限制,而是由其他因素,如鱼类的捕食等导致的.基于个体磷含量,盔型溞应该比脆弱象鼻溞对食物磷限制更为敏感,为何磷限制加大了盔型溞对脆弱象鼻溞的竞争优势?我们在明瑞梁等[23]研究的基础上,比较分析食物磷限制对流溪河水库盔型溞和脆弱象鼻溞现生种群优势克隆生活史各参数的影响,试图从生活史角度找出盔型溞对脆弱象鼻溞有竞争优势的原因.
1 材料与方法实验选用的盔型溞和脆弱象鼻溞在2017年5月同时采自流溪河水库的敞水区(大坝附近,枝角类生长高峰期).用孔径113 μm的浮游生物网由水体底部至表层垂直拖取,从采集到的同一份样品中,每个种类均随机挑选出20只,并分别进行单独培养.取它们的下一代进行线粒体CO1基因测序,发现每个种所挑选的20只个体均属于同一个单倍型,表明我们获得的克隆为流溪河水库盔型溞(GenBank序列号:MH746172)和脆弱象鼻溞现生种群的优势克隆.本次实验两个种的克隆与明瑞梁等的实验动物来自同一母体,培养条件也与明瑞梁等的相同[23].为了探讨流溪河水库食物磷限制对盔型溞和脆弱象鼻溞生活史特征的影响,我们基于它们所分布的水体流溪河水库中小于20 μm的颗粒态有机物的碳磷比特征(100~1500)来设计食物蛋白核小球藻(Chlorella pyrenoidosa)的碳磷比,并通过预实验确定培养蛋白核小球藻的BG-11培养基中磷的浓度.将BG-11培养基中磷的浓度分别设置为230、46和11.5 μmol/L,在25℃和光周期L :D=14 h :10 h条件下培养蛋白核小球藻,在对数生长期收集藻液,并将藻液以3000转/min离心10 min,去掉上清液,加无菌蒸馏水再次离心去掉上清液,随后加到适量无氮、无磷的BG-11培养基中,避光4℃保存[23].与此同时,取适量的经过清选的藻液过滤到已称重的为0.22 μm孔径滤膜上,在60℃下烘24 h,称重.用vario EL cube元素分析仪测定小球藻的碳含量;用碱性过硫酸钾消解小球藻样品,采用钼酸铵分光光度法测定磷含量.经测定,3种培养条件下的小球藻碳磷比分别为105、400和1450,分别代表高磷、中磷和低磷食物处理组.
开始实验的前1天,将即将孵出幼溞的母溞转移到经孔径为0.22 μm的滤膜过滤的流溪河水库水中,获取足够数量的龄期小于24 h的幼溞,并随机测量30只新生幼溞体长.实验设计3个食物质量处理组,碳磷比分别为105、400和1450,食物浓度为2 mg C/L;两个动物处理组:盔型溞和脆弱象鼻溞.参照Pajk等的方法[24],采用单个体培养实验,每个处理组设计20个重复,每个重复只投放1只龄期小于24 h的幼溞.培养容器为50 ml的烧杯,实验用水为经孔径为0.22 μm的滤膜过滤的流溪河水库水,体积30 ml.培养条件为:温度25℃,光照强度1200 lx,光周期L :D=12 h :12 h.每天观察母溞怀卵情况,并将母溞转移至新配制的具有2 mg C/L小球藻的过滤水库水中, 记录母溞的存活情况及所产幼仔数并将其移除.由于测量体长的操作会对母溞的生长产生负面影响[25],参照Pajk的方法[24],我们将20个重复中的10个用以测量母溞首次生殖时体长和首次生殖时孵出的幼溞体长,并在测量结束后弃用.剩下的10个重复则用于生命表实验,实验一直持续到母溞全部死亡,实验周期为60 d.
编制生命表,计算首次怀卵时间、特定龄期存活率(lx)、特定龄期生殖率(mx)和平均每窝产仔量等参数.种群内禀增长率(r)根据欧拉方程计算获得:
盔型溞首次产仔时间为4.6~7.2 d,高磷处理组首次产仔时间显著短于中磷和低磷处理组,中磷与低磷处理组首次产仔时间差异不显著;脆弱象鼻溞首次产仔时间为3.4~7.2 d,首次产仔时间随着食物碳磷比的升高而显著延长(图 1A).在高磷和中磷处理组,盔型溞首次产仔时间显著长于脆弱象鼻溞(P < 0.001),但在低磷处理组,首次产仔时间在两个种类间没有差异.种类与食物食量对首次产仔时间的影响存在显著的交互作用,低磷组与高磷组相比,脆弱象鼻溞首次产仔时间延长了112 %,显著高于盔型溞的43 % (P < 0.001).盔型溞和脆弱象鼻溞平均每窝产仔量分别为11.5~15.1和1.6~2.3 ind.,盔型溞平均每窝产仔量在各食物质量条件下均显著高于脆弱象鼻溞(P < 0.001).两个种类平均每窝产仔量均随着食物碳磷比的上升而显著下降(图 1B).种类与食物质量对平均每窝产仔量的影响存在显著的交互作用,低磷处理组与高磷处理组相比,盔型溞平均每窝产仔量减少24 %,小于脆弱象鼻溞的32 % (P < 0.001).
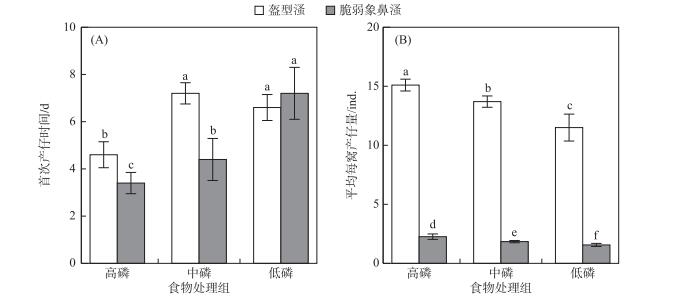
|
图 1 盔型溞和脆弱象鼻溞在各食物质量处理组中的首次产仔时间(A)和平均每窝产仔量(B) (数据均为均值±标准差,标准差线上有相同的字母表示没有显著性差异(P>0.05, Tukey多重比较);下同) Fig.1 Age at first reproduction (A)and average clutch size (B)of Daphnia galeata and Bosmina fatalis (Shown are the mean ± standard deviation based on 10 replicates. For each treatment, data bars carrying similar letter designations (a, b, c, d, e and f)are not statistically significant (P> 0.05, Tukey test), the same below) |
盔型溞和脆弱象鼻溞首次生殖母溞体长分别为1.45~1.67和0.30~0.36 mm,首次生殖母溞体长均随着食物磷碳磷比的升高而显著变小(图 2A).种类与食物质量对首次生殖母溞体长的影响存在显著的交互作用,低磷处理组与高磷处理组相比,盔型溞首次生殖母溞体长减小13 %,显著小于脆弱象鼻溞的18 % (P < 0.001).盔型溞新生幼溞体长为0.65~0.71 mm,高磷处理组新生幼溞体长显著长于中磷和低磷处理组,中磷与低磷处理组新生幼溞体长差异不显著;脆弱象鼻溞新生幼溞体长为0.22~0.23 mm,3个处理组间新生幼溞体长差异均不显著(图 2B).种类与食物质量对新生幼溞体长的影响存在显著的交互作用,在各食物质量条件下,盔型溞新生幼溞体长均显著长于脆弱象鼻溞(P < 0.001).
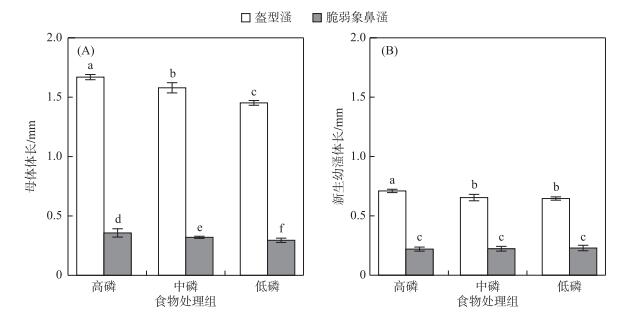
|
图 2 盔型溞和脆弱象鼻溞在各食物质量处理组中的首次产仔时母体体长(A)和新生幼溞体长(B) Fig.2 Body length at first reproduction (A)and body length of newborn neonates (B) of Daphnia galeata and Bosmina fatalis |
盔型溞和脆弱象鼻溞幼溞生长速率分别为0.31~0.52和0.10~0.38 d-1,盔型溞幼溞生长速率在各食物质量条件下均显著高于脆弱象鼻溞幼溞(P < 0.001).两个种类幼溞的生长速率均随着食物碳磷比的升高而显著下降(图 3A).种类与食物质量对幼溞生长速率的影响存在显著的交互作用,低磷处理组与高磷处理组相比,盔型溞幼溞生长速率降低41 %,显著小于脆弱象鼻溞的75 % (P < 0.001).盔型溞种群内禀增长率为0.36~0.46 d-1,高磷处理组种群内禀增长率显著高于中磷和低磷处理组,中磷和低磷处理组种群内禀增长率则没有显著差异;脆弱象鼻溞种群内禀增长率为0.18~0.39 d-1,种群内禀增长率随着食物碳磷比的上升而显著下降(图 3B).种类与食物质量对种群内禀增长率的影响存在显著的交互作用,在各食物质量条件下,盔型溞种群内禀增长率均显著地高于脆弱象鼻溞(P < 0.05).低磷处理组与高磷处理组相比,盔型溞种群内禀增长率降低16 %,显著小于脆弱象鼻溞的55 % (P < 0.001).
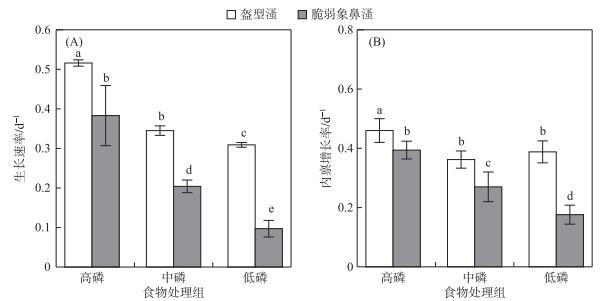
|
图 3 盔型溞和脆弱象鼻溞在各食物质量处理组中的幼溞生长速率(A)和内禀增长率(B) Fig.3 Neonate body growth rate (A)and intrinsic growth rate (B)of Daphnia galeata and Bosmina fatalis |
盔型溞产卵量高、幼体期相对较长、幼体较大且生长快,种群内禀增长率高,表现出大型枝角类种类的生活史特征;脆弱象鼻溞产卵量低、幼体期相对较短、幼体小且生长较慢,种群内禀增长率低,表现出小型枝角类种类的生活史特征[1].枝角类生长的碳磷比阈值在100~400范围内变化,不同种类间差别比较大[26].当食物碳磷比超过碳磷比阈值时,枝角类体内磷和RNA含量下降,生长减缓[27].本研究中,中磷和低磷处理组碳磷比分别为400和1450,盔型溞和脆弱象鼻溞幼体生长速率均显著小于碳磷比为105的高磷处理组.此外,两种枝角类在生活史策略上也做出了调整.在食物磷限制条件下,不论是大型枝角类(盔型溞)还是小型枝角类(脆弱象鼻溞)都延长了性成熟时间,减少了每窝的产卵量,降低了种群内禀增长率和个体生长速率,与文献中其他种类生活史对食物磷限制的响应基本一致[3, 28-29].然而,两种枝角类对生活史策略调整也有不同的地方:盔型溞降低新生幼溞的个体大小,而脆弱象鼻溞不会改变新生幼溞的大小.两种枝角类面对食物磷限制作出的生活史策略调整明显不同于应付无脊椎捕食者的生活史策略调整.无脊椎捕食者受其口裂宽度的限制,只能选择性捕食小于其口裂宽度的猎物(一般体长小于1.5 mm).因此,对于大型枝角类种类而言,它们可以通过快速生长,让体长尽快超出无脊椎捕食者的口裂宽度来降低被捕食的风险[9].但是,对于小型枝角类而言,采取这种生活史策略的调整对于降低其被无脊椎捕食者捕食概率意义不大.小型枝角类种类采取的策略是缩短性成熟时间,提高种群的生殖率[9].它们缩短性成熟时间的策略是不改变新生幼溞大小但降低首次生殖时个体大小,或者产出更大的新生幼溞但不改变首次生殖时个体大小.
虽然盔型溞和脆弱象鼻溞在食物磷限制条件下都延长了性成熟时间,减少产卵量,但是食物磷限制对这些生活史参数的影响程度在两个种类间差别较大.盔型溞体内磷含量高于脆弱象鼻溞,根据生长速率假说[13],盔型溞的幼体生长速率和生殖率应该高于脆弱象鼻溞,而本研究的结果也证明了这一点.高的生长速率和生殖率意味着对食物磷含量要求较高,生长更容易受磷限制.根据生长速率假说,盔型溞生活史各参数受食物磷限制的影响程度可能要高于脆弱象鼻溞.然而,从本研究结果来看,盔型溞生长速率、平均每窝产卵量、首次生殖时间和种群内禀增长率等生活史参数受食物磷限制的影响程度却小于脆弱象鼻溞,与预测的结果相反.这可能与大型枝角类(溞属)和小型枝角类(象鼻溞属)在面对食物磷限制时通过生理和行为上的调节提高磷利用效率的能力不同有关.到目前为至,针对枝角类在食物磷限制下的生理和行为上调整的研究基本上以溞属为对象[15, 17-19].大型溞(D. magna)摄食率随着食物碳磷比的升高而升高,而最高生长速率出现在中等碳磷比[30];在摄食高碳磷比食物时,大型溞通过提搞代谢速率以及溶解性有机碳的排泄来处理掉食物中多余的碳,维持体内的碳磷平衡[31],同时将碱性磷酸酶的活性上调,提高对磷的利用效率[32]. D. pulicaria在食物磷限制条件下,通过提高磷的同化效率和增加摄食率来调节个体生长速率[19]. Elser等研究发现大气氮沉降加剧了挪威湖泊的磷限制程度,大型枝角类溞属各种类相应提高了肠道碱性磷酸酶的活性,而小型枝角类象鼻溞肠道碱性磷酸酶的活性没有发生变化[17].以上研究表明,在食物磷限制条件下,溞属提高磷利用效率的能力可能高于象鼻溞.此外,Prater等研究发现食物磷限制对溞属生长速率、体内磷含量以及磷利用效率的影响在不同种类或同一种类不同基因型间可以存在明显的差别,并且与它们所分布的湖泊中食物磷限制程度差异有关[18].黄琦等发现流溪河水库盔型溞现生种群单倍型呈现低多样性特征,而且单倍型多样性由盔型溞生长季节初期向末期呈下降趋势[33].本研究在盔型溞生长高丰期(5月)从流溪河水库中随机挑取了20只个体,但经线粒体基因测序确定都属于同一单倍型.同样,所挑取的脆弱象鼻溞个体也属于同一单倍型.因此,我们获得的盔型溞和脆弱象鼻溞克隆都是流溪河水库两个种类现生种群的优势克隆,是经过相同的食物磷限制程度和捕食等环境压力的筛选而生存下来的,对水库的食物磷限制比较适应.虽然我们没有获得多个克隆进行实验,但这两个优势克隆间对食物磷限制响应的差异可以代表流溪河水库盔型溞和脆弱象鼻溞两个种之间的差异.此外,Repka研究发现食物质量对盔型溞内禀增长率的影响程度在来自不同营养水平湖泊的克隆间差别比较大,但在同一湖泊的不同克隆间没有差别[34].综上所述,在流溪河水库中,盔型溞提高磷利用效率的能力强于脆弱象鼻溞,导致食物磷限制对盔型溞生活史各参数的影响程度小于脆弱象鼻溞,但具体哪些机制起作用有待下一步的研究.
明瑞梁等比较分析了食物碳磷比对盔型溞和脆弱象鼻溞种间竞争关系的影响,发现在食物中碳不缺条件下,不管食物中磷是否缺乏,盔型溞均比脆弱象鼻溞有竞争优势[23].由于本研究的盔型溞和脆弱象鼻溞与明瑞梁等[23]的实验动物来自同一克隆,而且是在水库中经过相同的食物磷限制条件筛选出来的,本研究的结果从生活史角度阐明了盔型溞不论食物磷限制与否均比脆弱象鼻溞有竞争优势的原因.食物磷限制虽然对盔型溞和脆弱象鼻溞的首次生殖时间、首次生殖时体长、新生幼溞体长、幼体生长率和种群内禀增长率等生活史参数产生影响,但是对两种枝角类的影响程度并不相同.在磷不限制的条件下(碳磷比为105),盔型溞虽然首次生殖时间平均比脆弱象鼻溞长1.2 d,但由于产仔量高,平均每窝产仔量是脆弱象鼻溞的7倍左右,种群内禀增长率比脆弱象鼻溞高出18 %;由于个体大、摄食率高,幼体生长速率比脆弱象鼻溞高出37 %.在食物磷限制的条件下(碳磷比为1450),盔型溞和脆弱象鼻溞首次生殖时间均延长,但在两个种类间没有差异;产仔量下降,但盔型溞平均每窝产仔量仍然是脆弱象鼻溞的7倍左右,因此,盔型溞种群内禀增长率比脆弱象鼻溞高出117 %.另外,虽然食物磷限制使盔型溞的个体变小,但仍然远远大于脆弱象鼻溞,幼体生长速率比脆弱象鼻溞高出210 %.从两种枝角类生活史各参数对食物磷限制的响应看,食物磷限制会加大盔型溞对脆弱象鼻溞的竞争优势,与明瑞梁等的研究结果相符[23].由于本研究和明瑞梁等[23]的研究均是在食物数量不限制的条件下进行的,研究结果只能反映在食物数量不限条件下盔型溞对脆弱象鼻溞有竞争优势.流溪河水库营养水平属贫-中营养型,盔型溞和脆弱象鼻溞的生长可能同时受食物质量和食物数量的限制.在这种情况下,除了鱼类的捕食调节外,食物数量的短缺是否也限制了盔型溞对脆弱象鼻溞在生理和生活史各参数上优势的发挥,导致盔型溞在流溪河水库中密度低于脆弱象鼻溞,还有待进一步研究.
| [1] |
Lynch M. Fitness and optimal body size in zooplankton populations. Ecology, 1977, 58: 763-774. DOI:10.2307/1936212 |
| [2] |
Foran JA. A comparison of the life history features of a temperate and a subtropical Daphnia species. Oikos, 1986, 46: 185-193. DOI:10.2307/3565466 |
| [3] |
Færøvig PJ, Hessen DO. Allocation strategies in crustacean stoichiometry: the potential role of phosphorus in the limitation of reproduction. Freshwater Biology, 2003, 48: 1782-1792. DOI:10.1046/j.1365-2427.2003.01128.x |
| [4] |
Branstrator DK. Contrasting life histories of the predatory cladoceran Leptodora kindtii and Bythotrephes longimanus. Journal of Plankton Research, 2005, 27(6): 569-585. DOI:10.1093/plankt/fbi033 |
| [5] |
Vanni MJ. Competition in zooplankton communities: Suppression of small species by Daphnia pulex. Limnology and Oceanography, 1986, 31(5): 1039-1056. DOI:10.4319/lo.1986.31.5.1039 |
| [6] |
Fulton RS III, Paerl HW. Effects of the blue-green alga Microcystis aeruginosa on zooplankton competitive relations. Oecologia, 1988, 76: 383-389. DOI:10.1007/BF00377033 |
| [7] |
Gliwicz ZM, Wursbaugh WA, Szymanska E. Absence of predation eliminates coexistence: experience from the fish-zooplankton interface. Hydrobiologia, 2010, 653: 103-117. DOI:10.1007/s10750-010-0347-z |
| [8] |
Carotenuto Y, Wichard T, Phnert G et al. Life-history responses of Daphnia pulicaria to diets containing freshwater diatoms: Effects of nutritional quality versus polyunsaturated aldehydes. Limnology and Oceanography, 2005, 50(2): 449-454. DOI:10.4319/lo.2005.50.2.0449 |
| [9] |
Schwartz SS. Life history strategies in Daphnia: A review and predictions. Oikos, 1984, 42: 114-122. DOI:10.2307/3544616 |
| [10] |
Elser JJ, Dobberfuhl DR, MacKay NA et al. Organism size, life history, and N:P stoichiometry. BioScience, 1996, 46(9): 674-684. DOI:10.2307/1312897 |
| [11] |
DeMott WR, Gulati RD, Siewertsen K. Effects of phosphorus-deficient diets on the carbon and phosphorus balance of Daphnia magna. Limnology and Oceanography, 1998, 43: 1147-1161. DOI:10.4319/lo.1998.43.6.1147 |
| [12] |
Vrede T, Andersen T, Hessen D. Phosphorus distribution in three crustacean zooplankton species. Limnology and Oceanography, 1999, 44: 225-229. DOI:10.4319/lo.1999.44.1.0225 |
| [13] |
Elser, Acharya K, Kyle M et al. Growth rate-stoichiometry couplings in diverse biota. Ecology Letters, 2003, 6: 936-943. DOI:10.1046/j.1461-0248.2003.00518.x |
| [14] |
Main TM, Dobberfuhl DR, Elser JJ. N:P stoichiometry and ontogeny of crustacean zooplankton: A test of the growth rate hypothesis. Limnology and Oceanography, 1997, 42: 1474-1478. DOI:10.4319/lo.1997.42.6.1474 |
| [15] |
Plath K, Boersma M. Mineral limitation of zooplankton: stoichiometric constraints and optimal foraging. Ecology, 2001, 82: 1260-1269. DOI:10.1890/0012-9658(2001)082[1260:MLOZSC]2.0.CO;2 |
| [16] |
Elser JJ, Hayakawa K, Urabe J. Nutrient limitation reduces food quality for zooplankton: Daphnia response to seston phosphorus enrichment. Ecology, 2001, 82: 898-903. DOI:10.2307/2680208 |
| [17] |
Elser JJ, Peace AL, Kyle M et al. Atmospheric nitrogen deposition is associated with elevated phosphorus limitation of lake zooplankton. Ecology Letters, 2010, 13: 1256-1261. DOI:10.1111/j.1461-0248.2010.01519.x |
| [18] |
Prater C, Wagner ND, Frost P. Interactive effects of genotype and food quality on consumer growth rate and elemental content. Ecology, 2017, 98: 1399-1408. DOI:10.1002/ecy.1795 |
| [19] |
UrabeJ, Shimizu Y, Yamaguchi T. Understanding the stoichiometric limitation of herbivore growth: the importance of feeding and assimilation flexibilities. Ecology Letters, 2018, 21: 197-206. DOI:10.1111/ele.12882 |
| [20] |
Ferrão-Filho AS, Tessier AJ, DeMott WR. Sensitivity of herbivorous zooplankton to phosphorus-deficient diets: Testing stoichiometric theory and the growth rate hypothesis. Limnology and Oceanography, 2007, 52: 407-415. DOI:10.4319/lo.2007.52.1.0407 |
| [21] |
Lin QQ, Duan SS, Hu R et al. Zooplankton distribution in tropical reservoirs, South China. International Review of Hydrobiology, 2003, 88(6): 602-613. DOI:10.1002/(ISSN)1522-2632 |
| [22] |
Li nQ, Jiang X, Han BP et al. Does stocking of filter-feeding fish for production have a cascading effect on zooplankton and ecological state? A study of fourteen (sub)tropical Chinese reservoirs with contrasting nutrient concentrations. Hydrobiologia, 2014, 736: 115-125. DOI:10.1007/s10750-014-1896-3 |
| [23] |
Ming RL, Liu RQ, Lin QQ. Effect of food quality (C :P ratio)and interspecific competition on population growth of Daphnia galeata and Bosmina fatalis. J Lake Sci, 2019, 31(1): 211-219. [明瑞梁, 刘润强, 林秋奇. 食物质量和种间竞争对盔型溞(Daphnia galeata)和脆弱象鼻溞(Bosmina fatalis)种群增长的影响. 湖泊科学, 2019, 31(1): 211-219. DOI:10.18307/2019.0120] |
| [24] |
Pajk F, Zhang J, Han BP et al. Thermal reaction norms of a subtropical and a tropical species of Diaphanosoma (Cladocera)explain their distribution. Limnology and Oceanography, 2018, 63: 1204-1220. DOI:10.1002/lno.v63.3 |
| [25] |
Rousseaux S, Vanoverbeke J, Aerts J et al. Effects of medium renewal and handling stress on life history traits in Daphnia. Hydrobiologia, 2010, 643: 63-69. DOI:10.1007/s10750-010-0137-7 |
| [26] |
Khattak HK, Prater C, Wagner ND et al. The threshold elemental ratio of carbon and phosphorus of Daphnia magna and its connection to animal growth. Scientific Reports, 2018, 8: 9673. DOI:10.1038/s41598-018-27758-7 |
| [27] |
Prater C, Wagner ND, Frost PC. Seasonal effects of food quality and temperature on body stoichiometry, biochemistry, and biomass production in Daphnia populations. Limnology and Oceanography, 2018, 63: 1727-1740. DOI:10.1002/lno.10803 |
| [28] |
Urabe J, Sterner RW. Contrasting effects of different types of resource depletion on life history traits in Daphnia. Functional Ecology, 2001, 15: 165-174. DOI:10.1046/j.1365-2435.2001.00511.x |
| [29] |
Lukas M, Frost PC, Wacker A. The neonate nutrition hypothesis: Early feeding affects the body stoichiometry of Daphnia offspring. Freshwater Biology, 2013, 58: 2333-2344. |
| [30] |
Plath K, Boersma M. Mineral limitation of zooplankton: Stoichiometric constraints and optimal foraging. Ecology, 2001, 82(5): 1260-1269. DOI:10.1890/0012-9658(2001)082[1260:MLOZSC]2.0.CO;2 |
| [31] |
Darchambeau F, Faerøvig PJ, Hessen DO. How Daphnia copes with excess carbon in its food. Oecologia, 2003, 136: 336-346. DOI:10.1007/s00442-003-1283-7 |
| [32] |
Wojewodzic MW, Kyle M, Elser JJ et al. Joint effect of phosphorus limitation and temperature on alkaline phosphatase activity and somatic growth in Daphnia magna. Physiological Ecology, 2011, 165: 837-846. |
| [33] |
Huang Q, Xu SH, Xu L et al. Haplotype diversity and genetic differentiation of dormant and active populations of Daphnia galeata in Liuxihe Reservoir of Guangdong Province, southern China. J Lake Sci, 2017, 29(5): 1209-1216. [黄琦, 徐少林, 徐磊等. 广东流溪河水库盔型溞(Daphnia galeata)休眠种群与现生种群的单倍型多样性和遗传分化. 湖泊科学, 2017, 29(5): 1209-1216. DOI:10.18307/2017.0519] |
| [34] |
Repka S. Effects of food type on the life history of Daphnia clones from lakes differing in trophic state. Ⅰ. Daphnia galeata feeding on Scenedesmus and Oscillatoria. Freshwater Biology, 1987, 38: 675-683. |
 2019, Vol. 31
2019, Vol. 31 


