(2: 安徽省高校生物环境与生态安全省级重点实验室, 芜湖 241000)
(2: Key Laboratory of Biotic Environment and Ecological Safety in Anhui Province, Wuhu 241000, P. R. China)
在研究进化起源及其后续的生活史特征时,轮虫动物是其中一类较为理想的研究对象[1].轮虫中的蛭态纲是迄今尚未发现有性生殖的后生动物类群,其地理分布十分广泛[2-4].研究表明,蛭态轮虫营专性孤雌生殖,因而具有无基因重组且准确可靠的基因组复制以及高效繁殖的特性[5];蛭态轮虫在地球上至少存活了4千万年,且缺乏有性生殖机制,因而从理论上来说必然难以适应复杂多变的环境[3, 6-7];然而,蛭态轮虫却凭借个体小、数量多、易扩散和抗逆性强等特点而成为特例.正是由于其特殊的繁殖方式和惊人的适应能力,蛭态类轮虫为种群生态学和进化生物学研究提供了独特范例,目前已成为种群遗传学和进化生物学研究的热点之一[7-10].
转轮虫(Rotaria rotatoria)隶属于蛭态纲(Bdelloidea)、蛭态目(Bdelloida)、旋轮科(Philodinidae)、轮虫属,是淡水中常见的蛭态类轮虫之一.研究发现,转轮虫的生态幅及对温度的耐受范围很宽,可以存在于3℃的低温环境中[11],以及在29种栖息环境中以较高的频率出现[12];转轮虫也是重污染水体(如富营养化)的指示生物[13]和深层水体的优势种[14];在以Cephalodella hoodi和Elosa worallii两种轮虫最为丰富的德国酸性矿物质湖泊中(pH≤3),转轮虫依然是其中一个主要的类群[15].众所周知,轮虫种群的发生、分布、数量波动和生态位分化等,都受到各种各样的物理、化学和生物因素的影响[16-17].其中,温度是制约轮虫发生和演化的一个关键性因素.对于大多数轮虫种类来说,其生存、繁殖以及各生长发育阶段历时都受到温度的显著影响,且不同种或种群对温度的耐受程度、对食物的需求和酶促方式均存在差异,可见,在面对不同环境条件时,不同种或种群具有不同的需求[18].例如,针对蛭态类方角粗颈轮虫(Macrotrachela quadricornifera),随着培养温度的升高,其所有品系的繁殖前期缩短,且大部分品系繁殖率增加,但有些栖息于苔藓环境的种群却出现相反响应[19].因此,探究温度对浮游动物生活史参数的影响,对于研究种群动态和进化是必不可少的.
浮游动物栖息于快速变化的环境中,因此不管是在短期还是长期的时间尺度上,食物资源的丰度和质量均存在变数.自然界中,淡水浮游动物(枝角类、桡足类和轮虫)的食物常常受到限制,且相当严重[20].因此,食物是影响轮虫生长发育和种群密度的重要生物因子.通常情况下,轮虫的高密度与环境中存在充足的可供其消费的食物有密切关系[21].有研究发现,大型浮游动物的幼体对食物是高度敏感的,而小型浮游动物的成体则可以通过将生长和产卵量减至最低来耐受食物的匮乏[22].由于水体中氮磷等营养元素的不足可导致藻类停滞生长或繁殖下降,从而引起浮游动物的高死亡率,造成浮游动物的种群数量下降[23].因此,食物密度同样对轮虫的生长发育和种群增长起到至关重要的作用[24].在开展方角粗颈轮虫生活史研究时发现,低食物密度产出较小的后代卵,并延长该轮虫的胚胎发育时间[25];但若进行20天饥饿处理后再恢复正常食物,存活轮虫均可进行繁殖,且其平均寿命、特定年龄繁殖率和存活率与未经饥饿处理组轮虫间无显著差异[26].针对单巢纲轮虫的研究发现,温度、食物密度及其交互作用几乎显著地影响十指臂尾轮虫(Brachionus patulus)所有的生活史参数;食物水平的最直接影响体现在轮虫繁殖力上,但其影响力大小与温度有关[27].因此,研究小型浮游动物的生活史特征对解释植食性浮游动物对环境资源的竞争和利用有着重要意义.
为更好地理解温度和食物密度对蛭态类轮虫生活史特征的影响,解释转轮虫生活史策略对环境变化和食物资源丰度的响应,本实验以转轮虫为研究对象,在3个温度和4个食物密度下对转轮虫的各主要发育阶段历时、生命表参数、存活和繁殖情况进行研究,以加深对蛭态类轮虫生态特征的理解.
1 材料和方法 1.1 轮虫的采集与培养实验用转轮虫采自芜湖市皖南医学院西侧水系(31°17′31″N,118°21′06″E),根据采样水温将轮虫活体置于实验室28±1℃的恒温光照培养箱中单克隆培养,光照强度和光照周期分别为130 lx和光暗比L :D=14 :10,在实验室的保种培养时间为6个月以上.轮虫培养所用培养液为新配置的EPA培养液(pH=7.4~7.8)[28],食物为HB-4培养的、处于指数期增长的斜生栅藻(Scenedesmus obliquus)[29],待其处于指数增长期时离心收集,储存于4℃冰箱中备用,投喂密度为1.0×106 cells/ml.
1.2 轮虫的预培养将转轮虫分别置于24、28和32℃ 3个温度以及0.5、1.0、2.0和4.0×106 cells/ml 4个藻密度进行预培养.预培养过程中,每12 h悬浮一次沉淀于试管底部的藻类食物;每24 h更换轮虫培养液并投喂相应食物密度下的饵料1次,同时去除一部分轮虫个体使种群始终处于指数增长期,预培养时间不少于1周.
1.3 生命表实验分别从预培养的各试管中挑取大量转轮虫成年个体,置于特制的玻璃杯中,并加入含有与预培养密度相同的藻类食物培养液,4 h后于体视显微镜下挑取初生幼体(龄长 < 4 h),并置于带凹孔的24孔培养板中,每孔一只幼体,培养液体积为0.5 ml,放入恒温光照培养箱中进行单个体培养,培养条件与预培养相同,每个温度和食物密度下设置48个重复.实验开始后,每隔24 h更换新鲜培养液和食物;在幼体成熟为母体并产下第1只幼体前,每隔3 h于显微镜下观察轮虫生长情况,而后,每隔12 h观察记录母体的存活情况和所产幼体数,并移去幼体;实验至全部个体死亡为止.
1.4 参数的定义与计算方法基于实验记录,统计获得轮虫的繁殖前期、繁殖期、繁殖后期历时和后代产量等;统计得到各生活史参数,包括特定年龄存活率(age-specific survivorship, lx)、特定年龄繁殖率(age-specific fecundity, mx)、生命期望(life expectancy at hatching, e0)、净生殖率(net reproductive rate, R0)、世代时间(generation time, T)、种群内禀增长率(intrinsic rate of population growth, rm)和平均寿命(mean lifespan, L).生命表参数的定义和计算参照Krebs[30]和Pianka[31]的方法,即:特定年龄存活率为轮虫在X年龄组开始时的存活个体百分数;特定年龄繁殖率为轮虫在X年龄组期间平均每个个体所产的后代数;生命期望值为各轮虫个体出生时平均生命期望的估计值,即种群在未来所能存活的平均时长;净生殖率是种群经过一个世代后的净增长率,计算公式为
采用SPSS 22.0分析软件和Excel对数据进行分析,对所得数据作正态性分布检验(Kolmogorov-Smirnov)后,对符合正态分布的各组数据进行方差齐性检验(Levene),并通过双因素方差分析(Two-way ANOVA)检查食物密度、温度及两者间的交互作用对各参数影响的显著性,以α为0.05检验差异显著性;采用多重比较(LSD检验)分析各参数的平均数在各组间(食物密度间和温度间)的差异显著性.
2 结果双因素方差分析结果表明,温度对所有生活史参数均具有显著性影响(P≤0.001),食物密度只对于轮虫繁殖期历时、繁殖后期历时、生命期望和平均寿命有着显著影响,对其他参数无显著性影响;温度和食物密度的交互作用对大多数生活史参数具有显著影响,但对繁殖前期、繁殖期历时和内禀增长率未见显著作用(表 1).
| 表 1 温度和食物密度及其交互作用对转轮虫生活史参数的影响(双因素方差分析) Tab. 1 The two-way ANOVAs results of temperature, food density and their interaction on life history parameters of Rotaria rotatoria |
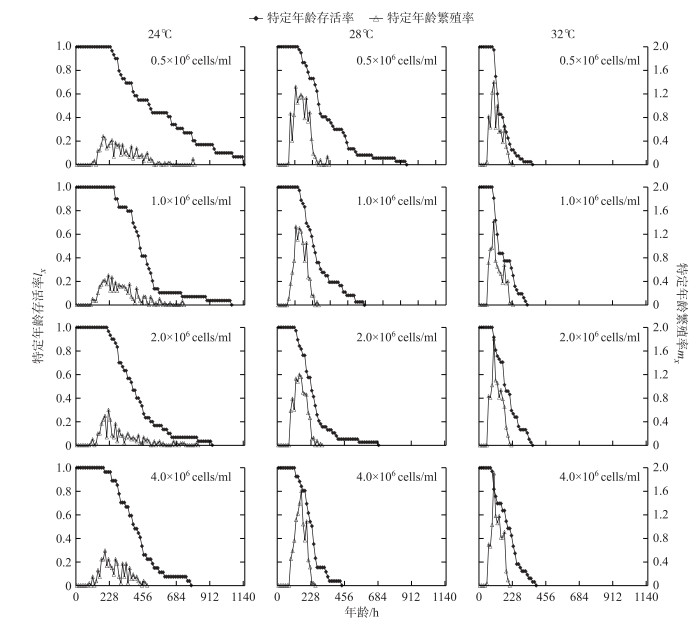
根据生命表数据得到3个温度4个食物密度下的特定年龄繁殖率和存活率曲线(图 1).由图可见,在各食物密度和温度下,轮虫在开始的72 h内全部存活.无论食物密度如何,随着温度的升高,轮虫开始死亡的时间逐渐前移;在低食物密度下(0.5×106和1.0×106 cells/ml),3个温度间轮虫起始死亡时间差异显著,而高食物密度下(2.0×106和4.0×106 cells/ml),仅24和28℃之间有显著差异(图 1).随着温度的升高,轮虫死亡的速度也逐渐加快(图 2);24℃下,食物密度为0.5×106 cells/ml时,特定年龄存活率曲线降低得最慢,轮虫在第47.5天时才全部死亡;32℃下,轮虫死亡的速度最快.在24和28℃下,特定年龄存活率曲线的下降速率随着食物密度增加而加快;32℃下特定年龄存活率曲线的下降速率在各食物密度间未见显著差异(图 1和图 2).
|
图 1 不同温度和食物密度下转轮虫的特定年龄存活率(lx)和特定年龄繁殖率(mx)曲线 Fig.1 Age-specific survivorship (rhombus) and fecundity curves (triangle) for Rotaria rotatoria at different temperatures and food densities |

|
图 2 转轮虫的特定死亡与繁殖时间 (图中字母A、B和C或a、b和c为多重比较(SNK-q检验)组间显著性.其中,A、B和C表示某一参数内同一食物密度下不同温度间存在显著差异性,a、b和c表示某一参数内同一温度下不同食物密度间存在显著差异性,A、B和C或a、b和c依次表示平均值逐渐递减) Fig.2 Specific death and reproduction time for Rotaria rotatoria |
在各食物密度下,随着温度的升高,轮虫的起始繁殖时间逐渐前移,但同一温度下4个食物密度间未见显著差异.随着温度的升高,轮虫的特定年龄繁殖率高峰值出现时间也提前;32℃下的繁殖高峰值出现得最早且最大(在食物密度为4.0×106 cells/ml的条件下mx为1.91),其下降速率也是最快的;24℃下的高峰值出现得最晚且最低(在食物密度为0.5×106 cells/ml的条件下mx为0.48),其下降速率也是最慢的.在24和32℃下,特定年龄繁殖率的高峰值出现时间随着食物密度的增加无显著差异;在28℃下,特定年龄繁殖率曲线的高峰值出现时间随着食物密度的增加而推迟(图 1和图 2).
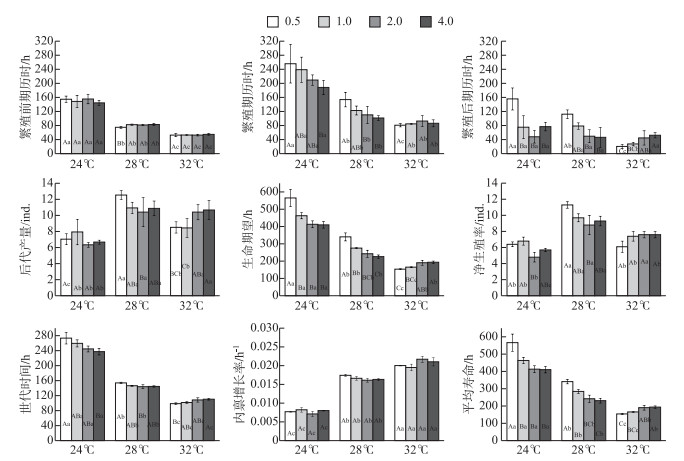
多重比较结果表明,温度在各个食物密度下对生活史参数的影响极为显著.随着温度的升高,无论食物密度如何,各发育阶段历时及生命期望均显著降低或具有降低趋势;而转轮虫内禀增长率却出现相反的变化趋势,即随着温度的升高而升高;转轮虫的两个增长参数(后代产量和净生殖率)在28℃下最大,在32℃下比在24℃下稍大(但两者间有些食物密度下无显著差异).通过比较发现,在0.5×106 cells/ml的食物密度下,转轮虫的大多数生活史参数(尤其是各发育阶段历时及生命期望)在3个温度间的差异最为显著(图 3).
|
图 3 不同食物密度(×106 cells/ml)和温度下转轮虫的生活史参数(均数±标准误) (多重比较(SNK-q检验)中不同字母A、B和C表示同一温度不同食物密度组存在显著差异,a、b和c表示同一食物密度不同温度组存在显著差异,A、B和C或a、b和c依次表示平均值逐渐递减) Fig.3 Life history parameters of Rotaria rotatoria exposed to different temperatures at four food densities (×106 cells/ml) (Mean ± SE) |
就食物密度的影响而言,转轮虫繁殖期历时、繁殖后期历时、生命期望、世代时间、平均寿命在24℃和28℃下随着食物密度的增加而显著降低或有降低趋势,但这些参数在32℃下却随食物密度的增加而升高.随着食物密度的变化,净生殖率和内禀增长率在24℃时1.0×106 cells/ml下相对最高,而在2.0×106 cells/ml下最低;28℃时在0.5×106 cells/ml食物密度下最高;32℃时在4.0×106 cells/ml食物密度下最高.生殖前期和内禀增长率在3个温度下各食物密度间无显著差异(图 3).
3 讨论温度是一种无时无处不在起作用的重要生态因子,任何生物都是生活在具有一定温度的外界环境中并受温度变化的影响.一般说来,生物体内的生理生化反应会随着温度的升高而加快,从而加快生长发育速度[32-34].本研究中,随着温度的升高,轮虫的发育速度加快,起始繁殖时间逐渐前移,繁殖期缩短,寿命减小,轮虫开始死亡的时间逐渐前移,全部死亡速度也逐渐加快,但内禀增长率却随着温度的升高而增加,可见,这是轮虫体内能量分配权衡(trade-off)的结果,即在不利条件下,转轮虫通过提高内禀增长率来补偿寿命和繁殖期历时的缩短,这符合生活史对策中的r策略,该结果与蛭态类方角粗颈轮虫(Macrotrachela quadricornifera)对温度变化的响应一致[19].生物对温度的适应范围是它们长期在一定温度下存活所形成的生理适应.由于本研究所用的实验对象是在28℃下自然水体中采集,并在实验室该温度下长期保种培养的,因而本实验中转轮虫的后代产量和净增值率在28℃下最大,此时轮虫种群稳定,这说明浮游动物在实验室的长期驯化对其长存和繁殖具有明显益处.
生物的生存和繁殖依赖于各种生态因子的综合作用,这些生态因子之间是相互影响的,当某一生态因子(如资源)处于有限状态或不足时,即会增加对基础代谢生理调节的代价,从而对其他因子的耐受范围可能随之缩小.本研究中,在较低食物密度下(0.5×106 cells/ml),温度对转轮虫大多数生活史参数(尤其是各发育阶段历时及生命期望)的影响更加显著,3个温度间轮虫的起始死亡时间也差异明显;而在2.0×106和4.0×106 cells/ml食物密度下,部分生命表参数对温度变化的响应减弱.
就食物密度而言,转轮虫繁殖期历时、繁殖后期历时、生命期望、世代时间、平均寿命在24和28℃下随着食物密度的增加而显著降低或有降低趋势,但在32℃下却随食物密度的增加而升高.该结果表明,24和28℃下低食物密度有利于轮虫的存活和繁殖,但在高温下高食物密度有利.我们认为,24和28℃是转轮虫相对适宜生长的温度,此时较低的藻浓度可使轮虫繁殖速度加快,而浓度过高反使其在生长代谢过程中产生毒素积累,从而降低溶解氧浓度,改变pH值,抑制轮虫的繁殖,针对有性生殖轮虫则会增加混交率,这在董婧等[35]关于褶皱臂尾轮虫(Brachionus plicatilis)的种群增长实验中得到了证实.然而,在高温条件下,由于基础代谢速率的快速增加,转轮虫对食物的需求量增大,因此高食物密度可以延长轮虫的繁殖期历时、生命期望、世代时间和平均寿命等.本研究中,在24和28℃下,特定年龄存活率曲线的下降速率随着食物密度增加而加快;随着食物密度的变化,净生殖率和内禀增长率在24℃时食物密度为1.0×106 cells/ml时相对最高,而在食物密度为2.0×106 cells/ml时最低,在28℃时食物密度为0.5×106 cells/ml时最高;32℃时净生殖率和内禀增长率在食物密度为4.0×106 cells/ml时最高.这均表明藻密度对转轮虫生长和繁殖的影响力与培养温度密切相关.
转轮虫的繁殖方式为卵胎生(ovoviviparity)[36],这是生物对不良环境长期适应而形成的繁殖方式,在此方式下,母体对胚胎起到更多的保护和孵化作用,这是动物进化的结果.在已知的轮虫种类中,椎轮属(Notommata)、晶囊轮属(Asplanchna)和异尾轮属(Trichocerca)中的一些种类被报道过具有此类生殖方式;大部分蛭态类轮虫都是卵生,但也有胎生的现象[37-38].卵生的蛭态类产出不分段的、细胞核通常清晰可见的卵,而出现分段并聚集在轮虫体内的则可称为胎生(卵胎生)[39].本实验中,我们发现在转轮虫母体死亡后,还有一个或者多个幼体在体内继续发育而后出生的现象,而且这样的现象在高温环境中(32℃)更容易出现,而在24和28℃下却很少发现.这也说明,卵胎生轮虫和枝角类在不良环境中可通过控制卵的释放和发育时间来调节繁殖速度,直至达到有利环境,这是其应对不利条件的适应方式[40].
4 结论基于生命表技术,本研究发现,温度和食物密度在转轮虫生活史过程中扮演着极其重要的角色.温度对转轮虫的各生命表参数具有极显著影响,食物密度以及温度和食物密度的交互作用显著地影响着轮虫的主要发育阶段历时和生命期望.随着温度的增长,轮虫的发育速度加快,各主要发育阶段历时缩短,寿命减小,死亡加快,但内禀增长率增加.在两个较低温度下,低食物密度有利于轮虫的存活和繁殖,转轮虫的各主要发育阶段历时随着食物密度的增加而缩短,但在高温下高食物密度对轮虫有利,轮虫的繁殖期历时和寿命随食物密度的增加而增加.在较低食物密度下,温度对转轮虫生活史参数的影响更加显著.
| [1] |
Min GS, Park JK. Eurotatorian paraphyly: Revisiting phylogenetic relationships based on the complete mitochondrial genome sequence of Rotaria rotatoria (Bdelloidea: Rotifera: Syndermata). BMC genomics, 2009, 10(1): 533. DOI:10.1186/1471-2164-10-533 |
| [2] |
Clément P. The phylogeny of rotifers: molecular, ultrastructural and behavioural data. Hydrobiologia, 1993, 255/256(1): 527-544. DOI:10.1007/BF00025882 |
| [3] |
MarkWelch D, Meselson M. Evidence for the evolution of bdelloid rotifers without sexual reproduction or genetic exchange. Science, 2000, 288(5469): 1211-1215. DOI:10.1126/science.288.5469.1211 |
| [4] |
Segers H. Global diversity of rotifers (Rotifera) in freshwater. Hydrobiologia, 2008, 595(1): 49-59. DOI:10.1007/s10750-007-9003-7 |
| [5] |
Ricci C, Caprioli M, Fontaneto D. Stress and fitness in parthenogens: is dormancy a key feature for bdelloid rotifers?. BMC Evolutionary Biology, 2007, 7(Suppl 2): S9. DOI:10.1186/1471-2148-7-S2-S9 |
| [6] |
Birky CW. Bdelloid rotifers revisited. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(9): 2651-2652. DOI:10.1073/pnas.0308453101 |
| [7] |
Fontaneto D, Barraclough TG. Do species exist in asexuals? Theory and evidence from bdelloid rotifers. Integrative and Comparative Biology, 2015, 55(2): 253-263. DOI:10.1093/icb/icv024 |
| [8] |
Smith JM. Evolution: Contemplating life without sex. Nature, 1986, 324(6095): 300-301. |
| [9] |
Mark Welch D, Ricci C, Meselson M. Bdelloid rotifers: progress in understanding the success of an evolutionary scandal//Schön I, Martens K, van Dijk P eds. Lost Sex: The evolutionary biology of parthenogenesis. New York: Springer, 2009: 259-279. https://www.researchgate.net/publication/227071796_Bdelloid_Rotifers_Progress_in_Understanding_the_Success_of_an_Evolutionary_Scandal
|
| [10] |
Fussmann GF. Rotifers: excellent subjects for the study of macro- and microevolutionary change. Hydrobiologia, 2011, 662(1): 11-18. DOI:10.1007/s10750-010-0515-1 |
| [11] |
Van der Land J. Notes on Microturbellaria from freshwater habitats in the Netherlands. Zoologische Mededelingen, 1965, 40(27): 235-251. |
| [12] |
Pejler B, Bērziŋš B. On choice of substrate and habitat in bdelloid rotifers. Hydrobiologia, 1993, 255(1): 333-338. |
| [13] |
Harikrishna BA. Study on the quality of water in some streams of Cauvery river. E-Journal of Chemistry, 2008, 5(2): 377-384. DOI:10.1155/2008/234563 |
| [14] |
Klimowicz H. Rotifers of the near bottom zone of lakes Mikołajskie and Tałtowisko. Polish Archives of Hydrobiology, 1972, 19(2): 167-178. |
| [15] |
Deneke R. Review of rotifers and crustaceans in highly acidic environments of pH values≤ 3. Hydrobiologia, 2000, 433(1/2/3): 167-172. |
| [16] |
Galkovskaja G. Planktonic rotifers and temperature. Hydrobiologia, 1987, 147(1): 307-317. DOI:10.1007/BF00025759 |
| [17] |
Nogrady T, Wallace RL, Snell TW. Rotifera, Vol. 1. Biology, ecology and systematics//Dumont HJ, Nogrady T eds. Guides to the identification of the microinvertebrates of the continental waters of the world. The Hague: SPB Academic Publishing, 1993.
|
| [18] |
Ricci C. Ecology of bdelloids: how to be successful. Hydrobiologia, 1987, 147(1): 117-127. DOI:10.1007/BF00025734 |
| [19] |
Ricci C. Comparison of five strains of a parthenogenetic species, Macrotrachela quadricornifera (Rotifera, Bdelloidea). Hydrobiologia, 1991, 211(2): 147-155. DOI:10.1007/BF00037370 |
| [20] |
Kirk KL. Life-history responses to variable environments: starvation and reproduction in planktonic rotifers. Ecology, 1997, 78(2): 434-441. DOI:10.1890/0012-9658(1997)078[0434:LHRTVE]2.0.CO;2 |
| [21] |
Gulati RD. Zooplankton structure in the Loosdrecht lakes in relation to trophic status and recent restoration measures. Hydrobiologia, 1990, 191(1): 173-188. DOI:10.1007/BF00026051 |
| [22] |
Romanovsky Y. Food limitation and life-history strategies in cladoceran crustaceans. Ergebnisse Der Limnologie, 1985, 21: 363-372. |
| [23] |
Gliwicz ZM. Daphnia growth at different concentrations of blue-green filaments. Archiv für Hydrobiologie, 1990, 120(1): 51-65. |
| [24] |
Mikschi E. Rotifer distribution in relation to temperature and oxygen content. Hydrobiologia, 1989, 186(1): 209-214. |
| [25] |
Santo N, Caprioli M, Orsenigo S et al. Egg size and offspring fitness in a bdelloid rotifer. Hydrobiologia, 2001, 446(1): 71-74. |
| [26] |
Ricci C, Perletti F. Starve and survive: stress tolerance and life-history traits of a bdelloid rotifer. Functional Ecology, 2006, 20(2): 340-346. DOI:10.1111/j.1365-2435.2006.01082.x |
| [27] |
Sarma SSS, Rao TR. The combined effects of food and temperature on the life history parameters of Brachionus patulus Muller (Rotifera). International Review of Hydrobiology, 1991, 76(2): 225-239. DOI:10.1002/iroh.19910760207 |
| [28] |
Peltier WH, Weber CI eds. Methods for measuring the acute toxicity of effluents to freshwater and marine organisms. EPA/600/4-85/013. Cincinnati: United States Environmental Protect Agency, 1985.
|
| [29] |
Li SH, Zhu H, Xia YC et al. The mass culture of unicellular green algae. Acta Hydrobiologica Sinica, 1959, 4: 462-472. [黎尚豪, 朱蕙, 夏宜琤等. 单细胞绿藻的大量培养试验. 水生生物学集刊, 1959, 4: 462-472.] |
| [30] |
Krebs CJ. Ecology. The experimental analysis of distribution and abundance: 3rd. New York: Harper & Row, 1985.
|
| [31] |
Pianka ER. Evolutionary Ecology: 3rd. New York: Harper & Row, 1988.
|
| [32] |
Pourriot R. Les rotifers-Biologie//Barnabé G ed. Aquaculture. Vol 1. Technique et Documentation. Paris: Lavorisier, 1986.
|
| [33] |
Sun RY, Li B, Zhuge Y, Shang YC eds. General ecology. Beijing: High Education Press, 1993. [孙儒泳, 李博, 诸葛阳等.普通生态学.北京: 高等教育出版社, 1993. ]
|
| [34] |
Xi YL, Huang XF. Effect of temperature on the experimental population dynamics of Brachionus urceolaris. Oceanologia and Limnologia Sinica, 2000, 31(1): 23-28. [席贻龙, 黄祥飞. 温度对壶状臂尾轮虫实验种群动态的影响. 海洋与湖沼, 2000, 31(1): 23-28. DOI:10.3321/j.issn:0029-814X.2000.01.004] |
| [35] |
Dong J, Yu YH, Zhao YH et al. Effects of temperature and food on population growth and reproduction of rotifer, Brachionus plicatilis. Modern Journal of Animal Husbandry and Veterinary Medicine, 2014, 4: 35-39. [董婧, 于业辉, 赵莹莹等. 温度和食物对褶皱臂尾轮虫种群增长及繁殖的影响. 现代畜牧兽医, 2014, 4: 35-39. DOI:10.3969/j.issn.1672-9692.2014.07.011] |
| [36] |
Wang JJ. The freshwater rotifers in china. Beijing: Science Press, 1961. [王家辑. 中国淡水轮虫志. 北京: 科学出版社, 1961.]
|
| [37] |
Pennak RW. Fresh-water invertebrates of the United States: 3rd. New York: Wiley and Sons, 1989.
|
| [38] |
Kutikova LA. Bdelloid rotifers (Rotifera, Bdelloidea) as a component of soil and land biocenoses. Biology Bulletin of the Russian Academy of Sciences, 2003, 30(3): 271-274. DOI:10.1023/A:1023811929889 |
| [39] |
Ricci C, Melone G. Key to the identification of the genera of bdelloid rotifers. Hydrobiologia, 2000, 418(1): 73-80. DOI:10.1023/A:1003840216827 |
| [40] |
Keen R, Miller T. Daily timing of hatching of a rotifer, Keratella cochlearis. Hydrobiologia, 1977, 56(2): 127-128. DOI:10.1007/BF00023350 |
 2019, Vol. 31
2019, Vol. 31 

