(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)
(3: 湖南省农业科学院, 长沙 410125)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
(3: Hunan Academy of Agricultural Sciences, Changsha 410125, P. R. China)
超微型浮游藻类是细胞粒径≤3 μm的所有浮游藻类的统称,简称超微藻(picophytoplankton).超微藻广泛分布于海洋和淡水生态系统中,根据其细胞特性可分为超微蓝藻(picocyanobacteria,PCY)和超微真核藻(photosynthetic picoeukaryotes,PPEs).超微藻组成复杂多样,自被发现以来,一直是海洋生态系统研究的热点[1].有关淡水生境中超微藻的研究起步相对较晚,目前国内该方面的研究主要集中在武汉东湖、太湖、巢湖和长江中下游等湖泊中[2-3],而其它湖泊流域相关研究甚少.超微藻个体微小、比表面积大,因此能更高效的获取、利用资源进行生长繁殖,对水体的初级生产力具有重要贡献[4-5].作为微食物环的一个关键起始环节,PPEs潜在的混合营养代谢对浮游细菌的种群具有重要调控作用[6]. PPEs群落组成受环境影响变化明显,有研究发现,PPEs的丰度随营养条件升高而升高,其多样性随营养水平的增加而降低,且某些种群只存在于特定的营养水平中,譬如Cyclotella atomus是一种营养耐受的硅藻类群,在营养水平较高的湖泊中较为常见[7];而Chlamydomonassp.和P. malhamensis是具有异养能力的混合营养体,在营养水平较低的条件下具有优势[8-9],因此PPEs的群落结构还可作为水体营养状态的判断依据.
白洋淀又名西淀,被称为华北之肾,位于我国华北平原海河流域中部,是华北地区最大的内陆浅水湖泊,总面积362.8 km2[10]. 93 %行政区隶属于保定市安新县,保定市区是白洋淀上游最大的城市点源,而安新县则是白洋淀周边最大的面源.由于生态缺水和大量工业、生活污水排放,导致生态系统对污染的自净能力逐渐降低,湖水质量逐年恶化,湖泊富营养化程度日益严峻[11].白洋淀浮游藻类群落结构与水质评价的研究结果表明,浮游藻类密度逐年上升,以至于多数水域处于富营养状态,大部分水质已经恶化处于中度污染状态[12].迄今为止,尚未有白洋淀超微型浮游藻类的报道.本研究对白洋淀不同区域的环境因子及超微藻群落结构进行详细调查,分析白洋淀超微真核藻的种类组成、丰度及优势种等,并探讨白洋淀超微真核藻群落变化的原因.研究结果为白洋淀湖泊生态系统的评估与诊断,生物多样性保护等方面提供理论依据.
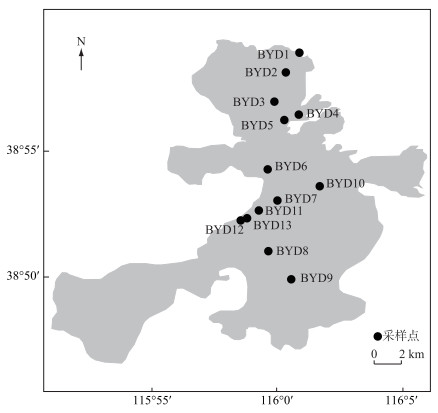
1 材料与方法 1.1 样品采集及水体理化参数测定根据白洋淀的水文条件和环境特征,共设置13个采样点(图 1),通过GPS系统准确定位,于2017年5月进行水样采集.用有机玻璃采水器采集表层(水面以下0.5 m)、中层和底层(离湖底0.5 m)的混合湖水,冷冻保存.现场使用戊二醛固定(终浓度为1 %)部分水样,液氮速冻后保存于-20℃冰箱中,用于后续的流式细胞分析.现场采用多功能水质探测仪Yellow Spring Instruments(YSI 6600,USA)测定水平透明度(SD)、水深(D)、温度(T)、溶解氧浓度(DO)、盐度(SAL)、pH、氧化还原电位(ORP)等.带回实验室的水样,用于测定水体营养盐和叶绿素a(Chl.a). Chl.a浓度采用丙酮法测定[13-14],总氮(TN)、硝态氮(NO3--N)、铵态氮(NH4+-N)、总磷(TP)、溶解性总氮(TDN)和溶解性总磷(TDP)浓度的测定方法参照《水和废水监测分析方法》[14].
|
图 1 白洋淀采样点位分布 Fig.1 Distribution of the sampling sites in Lake Baiyangdian |
为克服单一因子评价水平富营养化程度的片面性,我们采用了修正后的卡尔森营养状态指数(TSIM)法[15]分析了白洋淀13个采样点位的营养状态,TSIM能够较详细地描述水体营养状况变化,进一步提高水质监测与评价质量.根据水体中SD、Chl.a、TP浓度水平计算TSIM值:
| $ ~TSI(Chl.a)=10(\text{ln}~Chl.a/\text{ln }2.5+2.46) $ | (1) |
| $ TSI(SD)=10((2.34-1.82\text{ ln}~SD)/\text{ln }2.5+2.46) $ | (2) |
| $ TSI(TP)=10((1.32\text{ ln}~TP-3.28)/\text{ln }2.5+2.46)~ $ | (3) |
| $ TS{{I}_{M}}=\sum{TSI(i)/n} $ | (4) |
式中,TSI(i)代表TSI(SD)、TSI(TP)、TSI(Chl.a),若其中某项数值缺失,可按剩下两项值求TSIM,n代表求和项数.
当TSIM < 30时,为贫营养状态;当30≤TSIM≤50时,为中营养状态;当50 < TSIM ≤100时,为富营养状态.在同一营养状态下,指数值越高,其营养状态越高.
1.3 流式细胞仪计数与分选流式细胞仪超微藻计数方法,参照李胜男等[16]研究.分选时,将戊二醛固定、液氮速冻保存的样品室温解冻,经300目筛绢过滤后,根据不同类群的超微藻所含色素的自发荧光特性,结合散射光(SSC和FSC)信号表征细胞大小,通过流式细胞仪分选出10万~15万个PPEs细胞,加入180 μl Lysis Buffer(Tris-HCl,pH 8;EDTA-Na2 2 mmol/L;Triton X-100,1.2 %),后将样品保存于-20℃,直至DNA提取.
1.4 分选样品DNA的提取、目标序列扩增及Hiseq高通量测序利用DNeasy Blood & Tissue Kit试剂盒(Qiagen)提取样品DNA,提取方法按照试剂盒说明书进行,用于后续目标片段扩增和高通量测序.
采用真核通用引物对EK-NSF573: 5′-CGCGGTAATTCCAGCTCCA-3′,Ek-NSR951: 5′-TTGGYRAATGCTTTCGC-3′,对检测区域18S rRNA V4区进行高保真PCR扩增25个循环.设置3个重复实验,同时以标准的细菌/细菌基因组DNA Mix作为阳性对照.扩增反应程序及反应体系参考李胜男[17]等研究方法.随后将同一样本的3个平行扩增产物混合,加入等体积的核酸纯化磁珠Agencourt AMpure XP(Beckman)进行纯化.各样本添加特异性标签序列后,对文库进行定量、混合和质量检测,随后采用Illumina HiSeq高通量测序平台,2×250 bp的双端测序策略对文库进行测序.
1.5 序列分析及注释测序所得原始序列的质量控制和聚类过程如下:a.使用TrimGalore软件去除末端质量低于20的序列、去除adapter序列、长度小于100的序列;b.使用FLASH2软件进行双端合并,得到有效序列;c.使用mothur v.1.39.3软件去除序列两端引物;d.使用usearch软件去除总碱基错误率大于2的序列以及长度小于100 bp的序列;e.使用UPARSE软件去除singleton序列和Chimera序列,将序列按照98 %的相似度聚类到不同的OTUs(Operational Taxonomic Units)中,共得到373个OTUs,最后根据Silva数据库对聚类后的OTUs进行注释. OTUs注释完成后,删除被归为植物(Streptophyta)的OTUs.根据PPEs各OTUs所含序列的相对比例,我们将PPEs OTUs分为优势OTUs(所含序列数在各样品总序列数中所占的平均比例≥0.1 %)和稀有OTUs(所含序列数在各样品总序列数中所占的平均比例 < 0.1 %).
1.6 数据分析采用修正后的卡尔森营养状态指数法,计算各点位的营养指数.采用SPSS 16.0软件进行相关统计分析,采用Origin 8.5,ArcGIS 9.3和R语言软件绘图.
2 结果 2.1 环境因子分析共设置13个采样点位(图 1),白洋淀平均深度为2.42 m,采样期间平均水温在22℃左右,水体平均pH值为8.26,偏碱性,水体较为清澈,透明度为1 m左右,DO浓度均值为8.80 mg/L.其它理化因子变化梯度较大,如TN(0.90~3.29 mg/L)、TDN(0.41~2.14 mg/L)、TP(0.03~0.23 mg/L)、TDP(0.004~0.1 mg/L)、NO3--N(0.11~1.25 mg/L)、ORP(283.9~394.8 mV).一般认为,当TN浓度超过0.5 mg/L、TP浓度超过0.05 mg/L时,水体易出现富营养化[18],相较而言,白洋淀大部分区域的TN、TP值都已达到发生富营养化的氮、磷浓度条件.
2.2 营养状态评价各采样点位TSIM指数及营养状态如表 1所示,因实验操作问题,缺失6个采样点(BYD8~BYD13点位)的Chl.a数据. 13个采样点位主要分为中营养和富营养两个营养水平,其中南部沿岸区域(BYD6~BYD8、BYD11~BYD13点位)及BYD2点位为富营养状态,而其他点位为中营养状态.
| 表 1 白洋淀不同点位的富营养化指数 Tab. 1 The trophic states of the sampling sites in Lake Baiyangdian |
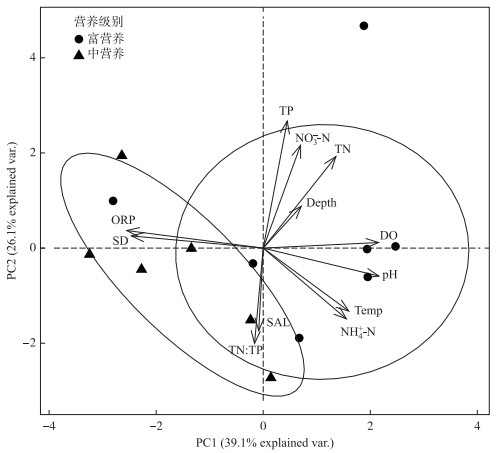
不同采样点位环境因子的主成分分析(principal components analysis,PCA)结果表明,中营养与富营养水域点位分别聚成两类(图 2),说明TSIM法能较好区分白洋淀不同营养水平水域环境因子变化.其中,中营养状态水域SD和ORP值较高,而富营养状态水域具有较高的营养盐浓度、DO和pH值.
|
图 2 白洋淀主要环境因子PCA分析图 Fig.2 PCA analysis diagram of main environmental factors in Lake Baiyangdian |
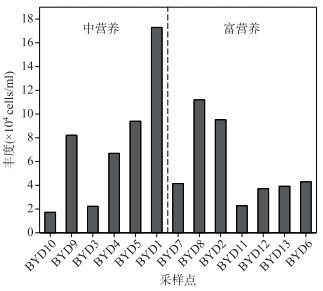
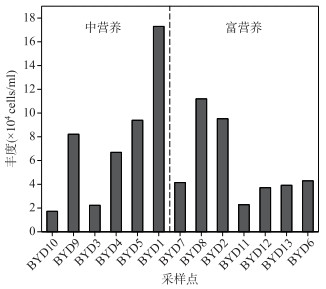
白洋淀PPEs的丰度范围为1.73×104~1.73×105 cells/ml,均值为7.59×104 cells/ml. PPEs丰度最大值出现在BYD1点位,最小值位于营养水平最低的BYD10点位.在中营养状态水域,PPEs丰度随营养水平增加呈逐步上升趋势;而在富营养状态水域,PPEs丰度随营养水平上升逐渐降低.总体上,随着营养水平的升高,PPEs丰度呈现先增加后降低的变化趋势,在中营养水域丰度最高(图 3).
|
图 3 白洋淀不同点位超微真核藻(PPEs)的丰度 Fig.3 PPEs abundance in different sampling sites of Lake Baiyangdian |
为进一步分析不同营养状态下,运用多元逐步回归对PPEs丰度变化解释度最高的关键环境因子进行分析,得到中营养和富营养状态下PPEs丰度变化的两个模型,结果如表 2所示.在中营养水平下,对PPEs丰度变化解释度最高的环境因子为TDP和TN/TP,且都呈显著正相关,解释度高达97.3 % (P < 0.01),表明中营养水平下,PPEs丰度随水体中磷浓度以及氮磷比的升高而增加;而在富营养水平中,SAL为PPEs丰度变化的关键影响因子,解释度为79.5 %,PPEs丰度与SAL呈显著正相关.
| 表 2 两种营养状态下超微真核藻丰度变化的逐步回归模型 Tab. 2 Stepwise regression model of PPEs abundance under two trophic states |
对白洋淀13个点位的流式分选样品进行高通量测序,共得到29086条高质量PPEs18S rDNA序列,聚为73个OTUs(98 %相似度).白洋淀水体中PPEs的OTU数在2~22范围内变化,Shannon多样性指数变化范围为0.54~2.49,其中PPEs多样性指数最低的点位为营养水平最低的BYD10点位,最高的为富营养的BYD2点位. PPEs的OTU数在中营养和富营养水平中无显著性差异,但富营养水平中PPEs的Shannon多样性指数显著高于中营养水平(P < 0.05)(图 4).
|
图 4 白洋淀超微真核藻的OTU数、Simpson、Shannon多样性指数 Fig.4 OTU numbers and diversity indexes in mesotrophic and eutrophic lake regions in Lake Baiyangdian |
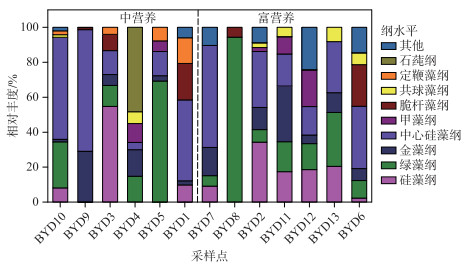
白洋淀所有73个PPEs OTUs的分类信息如表 3所示,其中27个和19个OTUs分别属于绿藻门(Chlorophyta)和硅藻门(Bacillariophyta),占总序列数的81.3 %.绿藻门主要以绿藻纲Chlorophyceae(16个OTUs)为主要优势类群,此外,还包括部分小豆藻纲Mamiellophyceae、平藻纲Pedinophyceae、共球藻纲Trebouxiophyceae和石莼纲Ulvophyceae(共11个OTUs)序列.硅藻门主要包括硅藻纲(Bacillariophyceae)和中心硅藻纲(Coscinodiscophyceae),其中硅藻纲序列相对较少,但多样性更为丰富,包括12个OTUs.除绿藻和硅藻外,金藻纲(Chrysophyceae)也是白洋淀中超微藻的主要优势类群,共检测到18个金藻OTUs,占总序列数的9.64 %.白洋淀中检测到的其他丰度较低的PPEs类群还包括甲藻纲(Dinophyceae)、定鞭藻纲(Haptophyceae)、硅鞭藻纲(Dictyochophyceae)、黄群藻纲(Synurophyceae)等.虽然绿藻纲(16 OTUs)和中心硅藻纲(4 OTUs)占总OTUs数仅为27 %,但是它们贡献了超过50 %的序列数.
| 表 3 白洋淀自养超微藻的分类信息 Tab. 3 Taxonomic composition of OTUs retrieved from flow cytometry sorted samples collected in Lake Baiyangdian |
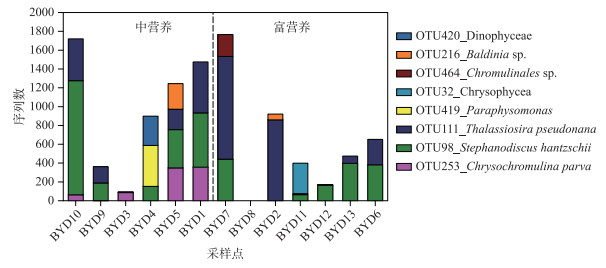
不同营养水平中超微真核藻的群落组成差异明显(图 5).定鞭藻纲的唯一OTU253 Chrysochromulina parva仅存在于中营养水平湖区中(P < 0.01,图 6),且在该水平上随着营养水平的升高优势度逐渐增加.甲藻纲Dinophyceae相对丰度在中营养水平湖区中显著高于富营养水平湖区(P < 0.05),其中的两个优势OTU216 Baldinia sp.和OTU420 Dinophyceae sp.丰度均远高于富营养水平点位(图 6).其他PPEs类群,在纲水平上,绿藻纲、金藻纲、四爿藻纲(Chlorodendrophyceae)、硅藻纲和共球藻纲(Trebouxiophyceae)等,相对丰度在白洋淀富营养和中营养水平湖区中无显著性差异(图 5),但在更低分类水平上(OTU水平),群落组成差异明显.中营养水平湖区中,绿藻纲主要以栅列藻科(Scenedesmaceae)的OTUs为主,而在富营养水平中则主要以红球藻科(Haematococcaceae)的Chlorogonium属OTUs为优势.在中营养水平湖区中共检测到9个金藻纲OTUs,其中OTU419对应的Paraphysomona sp.丰度最高;而在富营养水平中的检测到的14个金藻纲OTUs,主要以OTU32 Chrysophycea sp.和OTU464 Chromulinale sp.为优势种.中心硅藻纲中OTU111 Thalassiosira pseudonana在富营养水平中丰度更高,而OTU98 Stephanodiscus hantzschii则在中营养水平中相对丰度更高,为白洋淀超微真核藻的主要优势种(图 6).
|
图 5 白洋淀不同营养状态湖区超微真核藻在纲水平的相对丰度 Fig.5 The main class composition of PPEs under two trophic states in Lake Baiyangdian |
|
图 6 白洋淀两种营养状态湖区差异显著的OTU组成 Fig.6 The major OTUs composition with significant difference under two trophic states in Lake Baiyangdian |
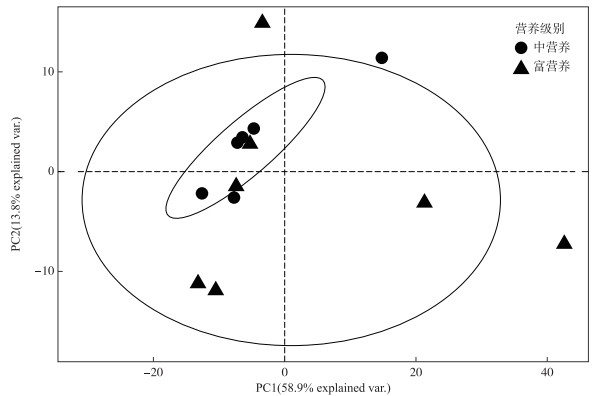
利用PCA分析了白洋淀不同营养水平水域中PPEs群落主要优势OTUs的组成变化,结果表明前两轴共累计解释了72.7 %的PPEs群落组成变化(图 7).相对于富营养水域而言,中营养状态水域各点位间的PPEs群落优势OTUs组成更为相似,而富营养水域各点位PPEs群落优势OTUs组成差异较大,表明富营养水体中PPEs优势物种差异较大,群落结构更为复杂.利用Bioenv函数筛选出对PPEs群落组成变化解释率最高的环境因子组合,结果表明TDN、TDP、TN/TP、NO3--N、DO 5个环境因子解释率最高,为43.1 %.
|
图 7 白洋淀优势OTUs的PCA分析 Fig.7 PCA analysis diagram of dominant OTUs in Lake Baiyangdian |
白洋淀水体营养状态调查结果表明,白洋淀水域大致呈中营养和富营养两种状态.中营养状态的水域主要集中在北部烧车淀和东南部大湖淀.这些水域水体透明度高,采样中发现了大面积沉水植被的覆盖,主要包括菹草(Potamogeton crispus)、狐尾藻(Myriophyllum verticillatum)和黄丝草(Potamogeton maackianus).富营养状态的水域主要为临近村庄的湖区,由于受到人类生活污染的影响,富营养化程度高,个别点位受到畜禽养殖的影响,污染严重,最高富营养指数达到了66以上.
白洋淀不同营养状态水域PPEs细胞丰度及多样性差别显著,这表明营养盐对PPEs的群落组成分布有着非常重要的影响,尤其是氮磷比.王建等[19]和Kruk等[20]研究也发现超微藻数量随着湖泊TN/TP的升高而升高,且氮为超微藻生长的主要限制因子.这与本研究结果较为相似,在白洋淀中营养水域,PPEs丰度随营养水平增加呈逐步上升,且多元回归分析表明PPEs丰度主要跟水体中的磷浓度及TN/TP有关,并在中营养水域中随两者的升高而增加.其中虽然BYD9点营养状态值低,但PPEs丰度相对较高,这可能是受其它环境因子的影响. Lepère等在Bourget湖调查中发现寄生真菌Chytrids作为一个重要的环境因素存在,对超微藻的丰度及群落演替具有调控作用[21].而在富营养水域PPEs丰度主要与SAL有关,且与SAL呈正相关,珠江口的超微型浮游藻类研究结果也发现,且无论在夏季还是在冬季,其正相关性始终存在,说明盐度是影响超微浮游藻类一个极其重要的影响因子[22].盐度对浮游藻类的影响主要表现在渗透压方面[23].
群落物种多样性反映了群落特有的物种组成和个体密度特征.已有研究表明,在不同营养水平的湖区,浮游藻类的生物量及物种的多样性也有所不同,营养盐水平高的湖区其物种的多样性相对较低[9].谢薇薇[24]对长江中下游各湖泊的PPEs研究发现,中营养湖泊PPEs的丰度相对较少,但多样性却更为丰富;而富营养化湖泊PPEs虽然数量较多,其丰度约为中营养湖泊的4~5倍,但多样性较低.这与本研究结果略有不同,在白洋淀富营养水域共发现56个PPEs OTUs,中营养水域36个,且富营养水域Shannon多样性指数显著高于中营养水域(P < 0.05),这可能是因为白洋淀富营养水域和中营养水域除营养盐指数有差别外,还有别的理化因子(如pH、ORP等因子)也存在着显著差异,可能对PPEs的多样性指数也有影响.
本研究发现白洋淀绿藻和不等鞭毛藻类丰度极高,为优势类群,这与先前我们在太湖、鄱阳湖、抚仙湖的调查结果一致[24-26].在OTU水平上,PPEs群落结构在白洋淀不同营养状态的湖区差异明显.绿藻纲中,中营养水域主要以栅列藻科的OTUs为主,而富营养水体中则主要以红球藻科Chlorogonium属的OTUs为优势类群;金藻纲中,中营养水域主要以OTU419(Paraphysomona sp.)丰度最高,而在富营养水平水体中OTU32(Chrysophycea sp.)和OTU464(Chromulinale sp.)为优势种.此外,白洋淀中营养水域另一类丰度较高的类群——定鞭藻纲,研究发现其在微型浮游生物以及超微型浮游生物的生物量中占相当大的比例[27-28].定鞭藻纲大多数属在海洋浮游生物中具有代表性,淡水生境中也发现该类群,目前报道有十几种,包括Hymenomonas roseola、Prymnesium、Chrysochromulina等[29-30],Chrysochromulina属的C. parva正是此次发现丰度高且普遍存在于中营养状态水域中的物种,说明C. parva更为适应低营养生态位.另外,中营养水平中甲藻纲相对丰度显著高于富营养水平(P < 0.05),相关研究也表明甲藻纲以及定鞭藻纲在营养状态较低的水平中丰度较高[21, 31-34].因此超微真核藻对水体的营养状态有很好的指示作用.
Bioenv分析结果表明对白洋淀PPEs群落组成变化解释率最高的环境因子组合为TDN、TDP、TN/TP、NO3--N、DO,说明营养盐仍是导致白洋淀PPEs群落组成变化最主要的影响因子,这与大多数的研究结果一致[35-36].此外,相关研究指出超微藻的组成和种群丰度还与风浪、捕食等环境因子有关[37-40].因此,在今后PPEs的研究中,应加强对湖泊形态、气候特征、周边环境状况的调查,并与室内模拟试验相结合,探索PPEs数量及群落变化的关键影响因子.
4 结论1) 根据营养指数,白洋淀可以分为中营养和富营养两个营养状态湖区,超微真核藻的丰度范围为1.73×104~1.73×105 cells/ml,在中营养水域,丰度与营养盐浓度呈正相关,在富营养水域,丰度与盐度呈正相关.
2) 白洋淀超微真核藻群落结构在中营养和富营养水域存在显著差异,中营养水域主要类群为栅列藻科、Paraphysomona sp.、定鞭藻纲和甲藻纲,而富营养水域主要类群为红球藻科、Chrysophycea sp.、Chromulinale sp..因此超微真核藻能有效指示水体营养状态.
| [1] |
Szelag-Wasielewska E. Autotrophic picoplankton dynamics in a small shallow lake. Hydrobiologia, 1999, 408: 301-306. |
| [2] |
Xie WW, Gong Y, Wang ZW et al. Study on genetic diversity of eukaryotic supermicroalgae in lake by flow cytometry sorting technique. Environmental Science, 2013, 34(4): 1485-1491. [谢薇薇, 龚伊, 王志伟等. 利用流式细胞仪分选技术研究湖泊真核超微藻的遗传多样性. 环境科学, 2013, 34(4): 1485-1491.] |
| [3] |
Wang J, Lin WL. Preliminary study on the ecology of picoplankton in Donghu Lake, Wuhan. J Lake Sci, 1998, 10(4): 71-76. [王建, 林婉莲. 武汉东湖超微藻生态学的初步研究. 湖泊科学, 1998, 10(4): 71-76. DOI:10.18307/1998.0411] |
| [4] |
Grob C, Hartmann M, Zubkov MV et al. Invariable biomass-specific primary production of taxonomically discrete picoeukaryote groups across the Atlantic Ocean. Environmental Microbiology, 2011, 13(12): 3266-3274. DOI:10.1111/j.1462-2920.2011.02586.x |
| [5] |
Li WKW. Primary production of prochlorophytes, cyanobacteria, and eukaryotic ultraphytoplankton-measurements from flow cytometric sorting. Limnology and Oceanography, 1994, 39(1): 169-175. DOI:10.4319/lo.1994.39.1.0169 |
| [6] |
Hartmann M, Zubkov MV, Scanlan DJ et al. In situ interactions between photosynthetic picoeukaryotes and bacterioplankton in the Atlantic Ocean:evidence for mixotrophy. Environmental Microbiology Reports, 2013, 5(6): 835-840. DOI:10.1111/1758-2229.12084 |
| [7] |
Yang XD, Dong XH, Gao G et al. Relationship between surface sediment diatoms and summer water quality in shallow lakes of the middle and lower reaches of the Yangtze River. Journal of Integrative Plant Biology, 2005, 47(2): 153-164. DOI:10.1111/j.1744-7909.2005.00035.x |
| [8] |
Poerschmann J, Spijkerman E, Langer U. Fatty acid patterns in Chlamydomonas sp. as a marker for nutritional regimes and temperature under extremely acidic conditions. Microbial Ecology, 2004, 48(1): 78-89. DOI:10.1007/s00248-003-0144-6 |
| [9] |
Lefranc M, Thenot A, Lepere U et al. Genetic diversity of small eukaryotes in lakes differing by their trophic status. Applied and Environmental Microbiology, 2005, 71(10): 5935-5942. DOI:10.1128/AEM.71.10.5935-5942.2005 |
| [10] |
Cheng L. Analysis of water environment status of Baiyangdian Lake. Water Science and Engineering Technology, 2016(5): 50-52. [程磊. 白洋淀水环境现状分析. 水科学与工程技术, 2016(5): 50-52. DOI:10.3969/j.issn.1672-9900.2016.05.019] |
| [11] |
Wang Y, Liu LS, Shu YM et al. Evaluation of phytoplankton community structure and water quality in Baiyangdian Lake. J Lake Sci, 2011, 23(4): 575-580. [王瑜, 刘录三, 舒俭民等. 白洋淀浮游植物群落结构与水质评价. 湖泊科学, 2011, 23(4): 575-580. DOI:10.18307/2015.0501] |
| [12] |
Jin L, Li LW, Zhou Y et al. Evaluation of phytoplankton community and water quality in three typical waters of Baiyangdian. Journal of Hebei University:Natural Science, 2017, 37(3): 329-336. [金磊, 李林钰, 周杨等. 白洋淀三大典型水域浮游植物群落及水质评价. 河北大学学报:自然科学版, 2017, 37(3): 329-336.] |
| [13] |
Songliao River Basin Water Environment Monitoring Center ed. Determination of chlorophyll in water quality by spectrophotometry. Beijing: China Water Resources and Hydropower Press, 2012: 9A4. [松辽流域水环境监测中心. 水质叶绿素的测定分光光度法. 北京: 中国水利水电出版社, 2012: 9A4.]
|
| [14] |
Ministry of Environmental Protection of the People's Republic of China, Editorial Board of Water and Wastewater Monitoring and Analysis Methods. Water and Wastewater Monitoring and Analysis Methods. 4th edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002.]
|
| [15] |
Shu JH. Discussion on evaluation method of lake eutrophication degree in China. Environmental Pollution and Prevention and Control, 1990(5): 2-7. [舒金华. 我国湖泊富营养化程度评价方法的探讨. 环境污染与防治, 1990(5): 2-7.] |
| [16] |
Li SN, Wang XJ, Zhou J et al. Methods for counting microplankton by flow cytometry. J Lake Sci, 2015, 27(5): 757-766. [李胜男, 王秀娟, 周建等. 利用流式细胞仪计数微型浮游生物的方法. 湖泊科学, 2015, 27(5): 757-766. DOI:10.18307/2015.0501] |
| [17] |
Li SN, Shi XL, Xie WW et al. Genetic diversity of photosynthetic picoeukaryotes in the middle and lower reaches of the Yangtze River. Environmental Science, 2013, 34(9): 3416-3422. [李胜男, 史小丽, 谢薇薇等. 长江中下游湖泊超微型真核藻类遗传多样性研究. 环境科学, 2013, 34(9): 3416-3422.] |
| [18] |
Melack JM, Kilham P, Fisher TR. Responses of phytoplankton to experimental fertilization with ammonium and phosphate in an african soda lake. Oecologia, 1982, 52(3): 321-326. DOI:10.1007/BF00367954 |
| [19] |
Wang J, Xie P, Gao CDZ. The horizontal distribution of different types of ultramicroalgae and its environmental significance. Kunming: The Abstract Collection of the Eleventh Academic Symposium of the Chinese Algae Society, 2001. [王建, 谢平, 高村典子. 超微藻不同类型水体分布状况及其环境意义. 昆明: 中国藻类学会第十一次学术讨论会, 2001.]
|
| [20] |
Kruk M, Kobos J, Nawrocka L et al. Positive and negative feedback loops in nutrient phytoplankton interactions related to climate dynamics factors in a shallow temperate estuary(Vistula Lagoon, southern Baltic). Journal of Marine Systems, 2018, 180: 49-58. DOI:10.1016/j.jmarsys.2018.01.003 |
| [21] |
Lepere C, Domaizon I, Debroas D. Unexpected importance of potential parasites in the composition of the freshwater small-eukaryote community. Applied and Environmental Microbiology, 2008, 74(10): 2940-2949. DOI:10.1128/AEM.01156-07 |
| [22] |
Zhang X, Huang XP, Shi Z et al. Spatial and temporal distribution of ultraplankton in the pearl river estuary and its relationship with environmental factors. Acta Ecologica Sinica, 2013, 33(7): 2200-2211. [张霞, 黄小平, 施震等. 珠江口超微型浮游植物时空分布及其与环境因子的关系. 生态学报, 2013, 33(7): 2200-2211.] |
| [23] |
Chen ZF. Study on the culture of Chaetoceros sinensis-Ⅰ. Salinity, the effect of phosphate and nitrate concentration on growth and reproduction. Chinese Journal of Oceanography, 1982(5): 608-616. [陈贞奋. 牟氏角毛藻的培养研究——Ⅰ.盐度、磷酸盐和硝酸盐浓度对生长繁殖的作用. 海洋学报:中文版, 1982(5): 608-616.] |
| [24] |
Xie WW. Genetic diversity of eukaryotic ultramicroalgae in freshwater lakes[Dissertation]. Nanjing: Nanjing Agricultural University, 2013. [谢薇薇.淡水湖泊真核超微藻遗传多样性研究[学位论文].南京: 南京农业大学, 2013. ]
|
| [25] |
Li SN. Community structure characteristics of ultra-low phytoplankton and its response to elevated CO2 in eutrophic lakes[Dissertation]. Nanjing: Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, 2017. [李胜男.富营养化湖泊超微型浮游藻类群落结构特征及其对CO2升高的响应[学位论文].南京: 中国科学院南京地理与湖泊研究所, 2017. ]
|
| [26] |
Zhou J. Temporal and spatial distribution characteristics of ultra-low phytoplankton in Poyang Lake[Dissertation]. Nanjing: Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, 2016. [周建.鄱阳湖超微型浮游藻类时空分布特征研究[学位论文].南京: 中国科学院南京地理与湖泊研究所, 2016. ]
|
| [27] |
Masquelier S, Foulon E, Jouenne F et al. Distribution of eukaryotic plankton in the English Channel and the North Sea in summer. Journal of Sea Research, 2011, 66(2): 111-122. DOI:10.1016/j.seares.2011.05.004 |
| [28] |
Thomsen HA. Haptophytes as components of marine phytoplankton. The Haptophyte Algae, 1994, 51(1): 187-208. |
| [29] |
Nicholls KH ed. Haptophyte algae. Freshwater algae of North America. Oxford: Academic Press, 2015: 587-605.
|
| [30] |
Manton I, Peterfi L. Observations on the tine structure of coccoliths, scales and the protoplast of a freshwater coccolithophorid, Hymenomonas roseola Stein, with supplementary observations on the protoplast of Cricosphaera carterae. Proceedings of the Royal Society of London Series B Biological Sciences, 1969, 172(1026): 1-15. DOI:10.1098/rspb.1969.0008 |
| [31] |
Lepere C, Domaizon I, Hugoni M et al. Diversity and dynamics of active small microbial eukaryotes in the anoxic zone of a freshwater Meromictic Lake(Pavin, France). Frontiers in Microbiology, 2016, 130(7): 1-11. |
| [32] |
Lepere C, Boucher D, Jardillier L et al. Succession and regulation factors of small eukaryote community composition in a lacustrine ecosystem(Lake pavin). Applied and Environmental Microbiology, 2006, 72(4): 2971-2981. DOI:10.1128/AEM.72.4.2971-2981.2006 |
| [33] |
Kirkham AR, Lepere C, Jardillier LE et al. A global perspective on marine photosynthetic picoeukaryote community structure. Isme Journal, 2013, 7(5): 922-936. DOI:10.1038/ismej.2012.166 |
| [34] |
Bouman HA, Ulloa O, Barlow R et al. Water-column stratification governs the community structure of subtropical marine picophytoplankton. Environmental Microbiology Reports, 2011, 3(4): 473-482. DOI:10.1111/j.1758-2229.2011.00241.x |
| [35] |
Winder M. Photosynthetic picoplankton dynamics in Lake Tahoe:temporal and spatial niche partitioning among prokaryotic and eukaryotic cells. Journal of Plankton Research, 2009, 31(11): 1307-1320. DOI:10.1093/plankt/fbp074 |
| [36] |
Luis Otero-Ferrer J, Cermeno P, Bode A et al. Factors controlling the community structure of picoplankton in contrasting marine environments. Biogeosciences, 2018, 15(20): 6199-6220. DOI:10.5194/bg-15-6199-2018 |
| [37] |
Jeppesen E, Sondergaard M, Sortkjaer O et al. interactions between phytoplankton, zooplankton and fish in a shallow, hypertrophic lake-A study of phytoplankton collapses in Lake Sobygard, Denmark. Hydrobiologia, 1990, 191(11): 149-164. |
| [38] |
Collado-Fabbri S, Vaulot D, Ulloa O. Structure and seasonal dynamics of the eukaryotic picophytoplankton community in a wind-driven coastal upwelling ecosystem. Limnology and Oceanography, 2011, 56(6): 2334-2346. DOI:10.4319/lo.2011.56.6.2334 |
| [39] |
Chang J, Lin KH, Chen KM et al. Synechococcus growth and mortality rates in the East China Sea:range of variations and correlation with environmental factors. Deep-Sea Research Part Ⅰ-Topical Studies in Oceanography, 2003, 50(67): 1265-1278. |
| [40] |
Rajaneesh KM, Mitbavkar S, Anil AC. Influence of short-term hydrographic variations during the north-east monsoon on picophytoplankton community structure in the eastern Arabian Sea. Continental Shelf Research, 2017, 146: 28-36. DOI:10.1016/j.csr.2017.08.008 |
 2019, Vol. 31
2019, Vol. 31 

