重金属在水体中不易降解,只能以不同形态在水、底质、生物之间迁移转化,使得重金属污染具有持久性、生物富集性和高毒性等特点[1].天然水体水中镉浓度不超过0.01 mg/L,然而,随着全球工业的迅速发展,近些年来重金属镉的产量和用量不断增加,大量的镉通过工业“三废”排入自然环境中对生态环境和人身体健康造成严重危害[2]. 2012年广西龙江宜州拉浪段发现重金属镉超标,污染事件造成大约133万尾鱼苗和4万kg成鱼死亡[3].此外,镉通过食物链以生物积累或生物放大作用,使人的肾脏、肝脏、骨骼等器官发生病变,造成贫血、高血压、神经痛骨质松软肾炎和分泌失调等病症,而危害人体健康[4].因此重金属污染引起的生态问题已成为全球生态和环境科学关注的热点[5].
藻类在水生生态系统中占有重要地位,地球上90 %的光合作用由藻类进行[6].研究表明,重金属镉抑制了螺旋藻(Spirulina)、四尾栅藻(Scenedesmus quadricauda)和湛江等鞭金藻(Isochrysis zhangjiangensis)的生长和叶绿素a含量[7-8]. Cheng等发现随着镉浓度的增加,小球藻(Chlorella vulgaris)细胞色素如:类胡萝卜素、叶绿素a和叶绿素b含量均逐渐减少,且镉影响小球藻光合作用的电子传递系统,阻碍其蛋白质的合成[9].此外,苏甜等发现镉处理72 h后羊角月牙藻(Selenastrum capricornutum)的光合系统Ⅱ(PSII)反应中心受体侧PQ(质体醌)库变小,QA(初级醌受体)还原次数下降,使其电子传递链受阻[10]. Mallick研究发现,暴露于镉环境12 h后斜生栅藻(Scenedesmus obliquus)的PSII各项光合活性参数都有显著下降趋势[11].然而,Zhou等研究表明高浓度、短时间(48 h)镉胁迫对铜绿微囊藻毒性影响不在PSII和PSⅠ等部位[12].因此,尽管前人在藻类对镉的响应方面已做了大量的工作,但是这些研究主要探讨了短时间(< 72 h)镉胁迫对藻的毒性效应及抗氧化酶活性的影响.由于Cd浓度及处理时间的不同产生的结论也呈现出较大的差异性.同时,不同研究表明镉对藻类的毒性位点及效应也存在明显的差异[13].因此,探讨镉胁迫对藻类的毒理效应,特别是探讨镉作用位点及作用特征将为重金属镉作用机制及治理提供重要的现实意义.
拟柱孢藻作为一类新型丝状水华蓝藻,被认为是热带、亚热带地区的特征性种类,且具有较强的入侵性[14].近些年来,在我国的广东、山东、浙江等地区水体中也有发现[15].聂利华等研究认为拟柱孢藻能够快速有效地吸附重金属、降低重金属污染,从而达到改善水质的功效[16].然而,针对拟柱孢藻对重金属镉胁迫响应及机制研究未见报道.因此,本研究以拟柱孢藻为受试材料,研究了拟柱孢藻暴露于不同浓度镉96 h后其PSII光合传递链以及能量分配的变化,并探讨镉毒害的作用靶点及藻类光合能量分配响应方式,旨在揭示拟柱孢藻在镉环境下的光合系统响应机制.研究对于解析水生生态系统镉的毒性效应特征,揭示其对水环境生物介质生理特性响应,具有一定的科学意义.
1 材料与方法 1.1 实验材料及处理本研究对象为水华蓝藻——拟柱孢藻(Cylindrospermopsis raciborskii FACHB 1096),来源于中国科学院水生生物研究所淡水藻种库.藻种纯化后,置于MA液体培养基(Ichimura,1979)中进行培养,培养条件为:温度25±1℃,光强25 μmol/(m2 ·s),光照周期12 h :12 h.培养至对数期后,6000转/min离心10 min获得藻种为实验用藻.实验在250 ml锥形瓶中进行,以灭菌后的MA配置氯化镉(分析纯)培养基.结合已有镉对其他蓝藻毒性效应的研究[10, 13]及前期预实验结果,设置了0.2、0.5、1、5、10和20 mg/L共6个处理组,并以0 mg/L作为对照组.每个组设置3个重复.初始接种藻OD680值约为0.16(藻密度约为2.9×107 cells/L),将接种好的锥形瓶置于培养箱中在上述条件下培养.每天摇晃锥形瓶2~3次,保持藻的悬浮状态,同时调换锥形瓶在培养箱中的位置保证受光均匀.
1.2 叶绿素a含量及比生长速率的测定每天定时取新鲜藻样,测定生长(OD值)和叶绿素a含量(Chl.a). Chl.a含量的提取参照Nusch等的方法,用90 %丙酮抽提[17].比生长速率(μ)计算公式为:μ=(lnW2-lnW1)/(t2-t1). W1表示t1时的细胞数,W2表示t2时的细胞数,细胞数通过浮游植物计数框计数[18].
1.3 叶绿素荧光及参数测定根据生长及叶绿素变化,镉处理96 h后,对不同处理组的叶绿素荧光采用植物效率分析仪(Handy-Plant Efficiency Analyzer,Hansatech,UK)进行测定.每个样品取2 ml藻液于上样管中,暗适应20 min后上机测量,收集10 μs至2 s的荧光信号,直接获得相关荧光参数(Ft、F20 μs、F100 μs、F300 μs、F2 ms、tFM),根据这些参数利用JIP-测定(JIP-test)分析叶绿素a荧光瞬变现象的多相增长[19].其他荧光参数及JIP-测定公式如表 1所示[13, 19, 33].
| 表 1 选取的荧光参数及其意义和计算方法 Tab. 1 Selected fluorescence parameters and their significance and calculation |
Strasser等以生物膜中能量流动理论为基础,通过计算能量流和能量比率来衡量给定物理状态下样品材料内部变化,建立了高度简化的能量流动模型[20].依照该模型,天线色素(Chl)吸收的能量(ABS)中一小部分主要以热能和荧光(F)的形式耗散,大部分则被反应中心(RC)所捕获(TR),在反应中心激发能被转化为还原能,将QA还原为QA-,从而产生电子传递(ET),把传递的电子用于光合作用或其他途径.运用该模型并参照前人的研究[21-22],以拟柱孢藻光合机构单位面积以及单位活性反应中心的比活性参数为主建立了拟柱孢藻的光合作用能量通路模型.
1.5 数据处理实验统计数据使用SPSS 22.0软件进行单因素方差分析(One-way ANOVA)以及LSD多重比较.同组不同小写字母之间表示差异显著,P < 0.05.使用Origin 9.0软件绘图.
2 结果 2.1 单位细胞叶绿素a含量和比生长速率Cd2+处理96 h后,与对照组相比,0.2、0.5和1 mg/L处理组拟柱孢藻比生长速率显著升高(P < 0.05),而当Cd2+浓度>1 mg/L时,拟柱孢藻比生长速率分别为对照组的77.87 %、66.13 %和64.35 % (P < 0.01,图 1A).不同浓度Cd2+处理96 h后,与对照组相比,0.2 mg/L处理组拟柱孢藻单位细胞叶绿素a含量与对照组差异不显著,当Cd2+浓度大于0.5 mg/L时拟柱胞藻单位细胞叶绿素a含量显著下降.当Cd2+>1 mg/L时,拟柱孢藻单位细胞叶绿素a比对照组分别下降了51.75 %、59.42 %和60.22 % (P < 0.01,图 1B).

|
图 1 不同浓度Cd2+处理拟柱孢藻96 h比生长速率(A)和叶绿素a含量(B) Fig.1 Growth rate(μ, A)and Chl.a content (B) of Cylindrospermopsis raciborskii in 96 h-treatments under different concentrations of Cd2+ |
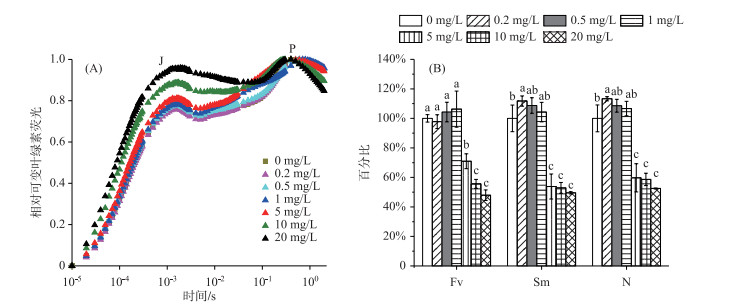
与对照组相比,在0.2mg/L和0.5 mg/L Cd2+处理组中,拟柱孢藻相对可变荧光曲线变化不明显,而在Cd2+浓度为5、10和20 mg/L处理组中,其相对可变荧光显著高于对照组,且J相极显著升高.各处理组中J相到P相的相对可变荧光都呈现先下降后上升的趋势.
进一步对JIP-测定的基础叶绿素荧光参数进行分析,结果表明:随着Cd2+浓度的增加,可变荧光(Fv)在Cd2+浓度 < 1 mg/L时略有上升,在Cd2+浓度>1 mg/L开始下降,在5 mg/L处理组中不到对照组的70 % (P < 0.01,图 2B). N表示从开始照光到到达FM的时间段内QA被还原的次数,Sm表示PSII受体侧的电子传递体.与对照组相比,在Cd2+高于5 mg/L时,拟柱孢藻N、Sm比对照组分别下降了40.32 %和46.19 % (P < 0.01). 20 mg/L Cd2+处理组中,拟柱孢藻的N和Sm分别只有对照组的52.51 %和49.53 %.
|
图 2 不同浓度Cd2+处理拟柱孢藻96 h叶绿素荧光诱导动力学曲线(A)和基础叶绿素荧光参数(B) Fig.2 Fast fluoresence transient curves(A)and chlorophyll fluorescence parameters(B) of Cylindrospermopsis raciborskii after 96 h-culture at different cadmium concentrations |
不同浓度Cd2+处理96 h后,拟柱孢藻PSII反应中心(RC)及其光合性能和量子产率均发生变化(图 3A,3B).当拟柱孢藻在5、10和20 mg/L Cd2+培养时,RC/CSo(表示单位受光面积反应中心的数量)分别只有对照组的67.95 %、57.79 %和55.38 % (P < 0.01).与对照组相比,高于5 mg/L Cd2+处理时,PIABS(表示以吸收光能为基础的性能指数)和DFABS(表示以吸收光能为基础的推动力)均受到极显著的抑制(P < 0.01,图 3A).在10 mg/L Cd2+处理时,PIABS和DFABS分别只有对照组的25.19 %和142.92 % (对照组,DFABS=-1.3897 < 0).同时,最大光化学效率(φPo)、用于电子传递的量子产额(φEo)、反应中心捕获的激子中用来推动电子传递链中超过QA的其他电子传递的量子产额(ψo)等随着Cd2+浓度增加都呈现下降趋势,当Cd2+浓度>5 mg/L时,φEo和ψo与对照组呈现极显著差异(P < 0.01),当Cd2+浓度>10 mg/L时,φPo与对照组呈现极显著差异(P < 0.01).而用于热耗散的量子比率(φDo)随着Cd2+浓度增加而增大,在10 mg/L Cd2+处理组中为对照组的115.18 % (P < 0.01,图 3B).

|
图 3 不同浓度Cd2+处理拟柱孢藻96 h后(OJIP)荧光参数与对照组的百分比(性能指数(A);量子产额(B);能量参数(C)) Fig.3 Quantum yield distribution ratio of chlorophyll fluorescence in Cylindrospermopsis raciborskii treated with different cadmium concentrations for 96 h(Performance index(A); Quantum yield(B); Energy parameters(C)) |
不同浓度Cd2+处理96h后,拟柱孢藻PSII单位反应中心的能量参数发生了不同的变化(图 3C).在Cd2+浓度>5 mg/L处理组中,单位反应中心吸收的光能(ABS/RC)、单位反应中心耗散的能量(DIo/RC)和反应中心捕获的用于还原QA的能量(TRo/RC)随着Cd2+浓度的增加而增大,在5 mg/L Cd2+处理时,ABS/RC、DIo/RC和TRo/RC分别达到了对照组的108.24 %、109.88 %和106.04 %,且随着Cd2+浓度的增加表现为极显著的增大(P < 0.01).然而,单位反应中心捕获的用于电子传递的能量(ETo/RC)则随着Cd2+浓度的增加而下降,在5 mg/L Cd2+处理时仅为对照组的91.67 % (P < 0.05).
此外,与对照组相比,单位面积吸收的光能(ABS/CSm)、单位面积电子传递的量子产额(ETO/CSm)、单位面积捕获的光能(TRO/CSm)在Cd2+(< 1 mg/L)处理组中变化不明显.在5 mg/L Cd2处理组中,ABS/CSm、ETO/CSm和TRO/CSm分别只有对照组的72.50 %、61.29 %和70.92 % (P < 0.01).而单位面积的热耗DIO/CSm则无明显变化(图 3C).
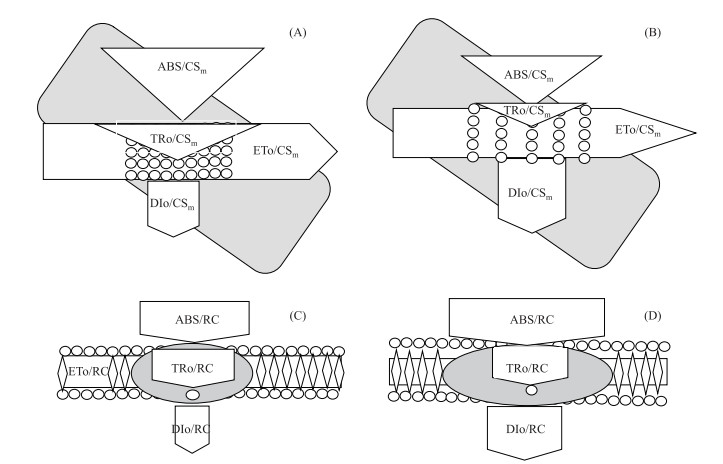
2.4 PSII能量分配分析以拟柱孢藻光合机构单位面积以及单位活性反应中心的比活性参数为主建立了拟柱孢藻的光合作用能量通路模型(图 4).在藻体能量通路模型中,与对照组相比,高于5 mg/L Cd2+处理96 h后拟柱孢藻PSII在光能吸收方面产生了较为明显的变化(图 4A,B).单位面积吸收的光能(ABS/CSm)减少,单位面积上用来还原QA的能量(TRO/CSm)以及电子传递的量子产额(ETO/CSm)也降低.不同的是单位面积的热耗散(DIO/CSm)变化不大,只是略微出现了上升(P >0.05).在类囊体能量通路模型中(图 4C,D),相比于对照组,5 mg/L Cd2+处理96 h后, 拟柱孢藻PSII单位活性反应中心吸收的能量(ABS/RC)、单位活性反应中心的热耗散(DIO/RC)和单位活性反应中心捕获的用于还原QA(TRO/RC)的能量比对照组分别增加了8.24 %、9.88 %和6.04 %.单位活性反应中心捕获的用于电子传递的能量(ETO /RC)则下降了8.33 %.
|
图 4 拟柱孢藻光合作用能量通路分配模型: (A)和(B)分别为拟柱孢藻细胞能量通路模型对照组、Cd2+处理组;(C)和(D)分别为拟柱孢藻类囊体能量通路模型对照组、Cd2+处理组 Fig.4 Energy pipeline of the PSII behavior of Cylindrospermopsis raciborskii: (A) and (B) were control group and group treated by Cd2+ in algae model of Cylindrospermopsis raciborskii; (C) and (D) were control group and group treated by Cd2+ in thylakoid membrance model of Cylindrospermopsis raciborskii |
刘易见等认为低浓度范围内的污染物可引起自由基含量在一定范围内升高,从而调动藻类生理生化代谢和繁殖的积极性,表现为藻细胞生长的刺激效应[23].本研究发现,Cd2+小于0.2 mg/L对拟柱孢藻的影响较小,甚至比生长速率显著高于对照组(图 1A),表明低浓度的镉对拟柱孢藻生长具有一定的刺激作用.然而,刘璐等对铜绿微囊藻和斜生栅藻(Scenedesmus obliquus)以及李建宏对椭圆小球藻(Chlorella ellipsoidea)镉毒性效应的研究都表明高浓度Cd2+对藻类产生了明显的毒性效应[24-25].本研究也发现随着Cd2+浓度的升高(>5 mg/L),与对照组相比,拟柱孢藻比生长速率显著降低,生长受到明显的抑制(图 1A),支持了前人的研究结果.叶绿素a既是天线色素也是参与光反应的中心色素[26-27]. Stobart研究表明镉离子能够抑制原叶绿素酸脂还原酶及其底物的合成从而影响叶绿体合成叶绿素[28].刘国峰等发现藻类受逆境胁迫后,光合色素功能受损、部分分解,造成其含量下降[29],严重影响藻类的光合作用.本研究也发现,拟柱孢藻暴露于Cd2+(>0.5 mg/L)环境中时,单位细胞叶绿素a含量明显下降(图 1B),表明拟柱孢藻细胞内叶绿素a合成受阻或部分分解.较高浓度的Cd2+(>5 mg/L)超出了细胞正常耐受的浓度,使光合作用系统受到不可修复的破坏,抑制叶绿素的合成,从而影响到藻细胞的生长和繁殖.
3.2 镉对拟柱孢藻叶绿素荧光的影响Zhou等研究结果表明高浓度Cd2+胁迫对铜绿微囊藻光合作用的抑制位点不在PSII或PSⅠ等部位,只是抑制了光合色素CPC和APC的合成[12].然而,许多研究表明光合作用对重金属胁迫非常敏感,类囊体膜是进行光合作用的主要场所[30].色素蛋白复合体PSII镶嵌在类囊体膜内,是探讨重金属对浮游植物胁迫的重要位点[31]. Peralesvela等研究发现,外界胁迫能够降低藻类PSII活性,改变PSII反应中心结构,导致不参与电子传递的封闭反应中心数量增加,进而导致FV的降低[32].因此,FV的降低通常被认为是PSII供体侧电子传递被抑制的一种表征.本研究发现,Cd2+处理拟柱孢藻96 h后,在0.2 mg/L和0.5 mg/L Cd2+处理组中,FV变化不明显,而当Cd2+>5 mg/L时,FV呈现极显著的下降,在20 mg/L Cd2+处理组时仅为对照组的50 % (图 2B),表明较高浓度Cd2+不仅对拟柱孢藻PSII供体侧的电子供体产生了毒害作用,而且还降低了捕光色素的含量. Strasser等发现PSII受体侧电子传递受阻是植物逆境下发生光抑制的原因之一,主要是电子经由Pheo传给QA生成QA-时间为250~300 ps,而电子由QA-传递到QB却需要100~200 μs,因此逆境条件下QA-向QB电子传递容易受阻,即易造成QA-的积累,而J点恰好反映了QA-的积累情况[33-34].本研究中,J点升高暗示较高浓度Cd2+(>5 mg/L)可能破坏了PSII反应中心,使其部分降解或失活,这些失活的反应中心作为一个能量陷阱,吸收光能,但不能将吸收的能量用于电子传递链,阻遏了QA-向QB的电子传递,造成QA-大量积累.
冉小飞等研究发现微囊藻受到高浓度镉处理后,受体侧Sm和N均出现了大幅度的减小[13].本研究中在5 mg/L Cd2+处理组中Sm大幅下降(图 2B),表明拟柱孢藻PSII受体侧PQ库变小,QA的还原效率增加,还原次数(N)下降.光合性能指数PIABS和推动力DFABS不仅可以反映PSII反应中心对光能的捕获情况,而且可以反映PSII反应中心下游的电子传递情况[35].研究表明浮游植物在受到外界胁迫时,光合机构被破坏,PIABS会显著下降[36].本研究中Cd2+(< 1 mg/L)处理组中,拟柱孢藻PSII反应中心性能指数PIABS和推动力DFABS变化不明显(P >0.05).随着Cd2+浓度的增加,PIABS和DFABS均出现了明显的下降,在20 mg/L处理组中PIABS相比于对照组趋近于0(图 3A),表明拟柱孢藻的光合机构被极大的破坏,光合效率大幅下降.而φPo、φEo和ψo等参数主要反映了PSII受体侧的变化,当Cd2+大于5 mg/L时,φEo、ψo均出现了不同程度的下降(P < 0.01),进一步说明了较高浓度Cd2+对PSII受体侧电子传递产生了抑制作用,使PSII的功能受损.推测PSII是Cd2+胁迫的主要作用位点.因此,大于5 mg/L Cd2+对拟柱孢藻光合作用的光化学活性特别是对PSII电子传递链,有显著的抑制作用,导致初级光反应和氧化还原反应被抑制. PSII反应中心部分降解或失活以及电子传递链受阻可能导致镉对拟柱孢藻光合作用中心产生毒害的原因.
3.3 镉对拟柱孢藻能量分配的影响藻类照光后,PSII捕光色素将捕获的光量子传递给反应中心(P680),使其受激发处于第一激发单线态(P680*),P680*很不稳定,将受激发产生的电子传递给P680受体侧的去镁叶绿素(Pheo),生成P680+Pheo-,然后Pheo-将电子传递给初级醌受体(QA)、次级醌受体(QB)及质体醌(PQ)等.生成的P680+可以从P680的供体侧夺取电子,并最终导致H2O的裂解[18].藻类光合机构捕获光能推动电子传递的同时,还有一部分能量以热和荧光的形式耗散.正常情况下,单位面积藻体吸收光能用于还原QA的能量(TRO/CSm)、电子传递的量子产额(ETO/CSm)、热耗散(DIO/CSm)能量分配比较稳定[37].本研究中,Cd2+处理96 h后.与对照组相比,在高于5 mg/L处理组中表征单位面积拟柱孢藻光合机构活性的RC/CSO、ABS/CSm、TRO/CSm、ETO/CSm都出现了显著的下降,而单位面积的热耗散(DIO/CSm)略有增加(图 3C).表明较高浓度Cd2+使拟柱孢藻单位面积活性反应中心数量下降,导致单位面积上捕获的光能减少,可以用来推动电子传递链的能量也减少,PSII光学活性被显著抑制,因此用于固定CO2和用于其他途径的能量减少,影响到整个光合作用进程,表现为藻体生长的抑制.但Müller等发现胁迫导致藻类PSII反应中心数量降低时,类囊体可以通过增强剩余有活性反应中心的功能来维持光能供应[38].本研究中随着镉浓度的增加,拟柱孢藻单位活性反应中心吸收的能量(ABS/RC)大幅增加(图 3C).其原因可能是长时间以及较高浓度的镉处理使拟柱孢藻PSII反应中心数量下降,藻体为适应逆境迫使剩余有活性反应中心的功能增强,以保证逆境下光能的正常供应.然而,吸收过多的光能会使PSII反应中心压力增大,诱发PSII发生光抑制.夏建荣等发现大型海藻通过增加光能的耗散来避免光合机构暴露在过高光强下受到损害[39].梁英等研究发现逆境下光能的重新分配增强了塔胞藻(Pyramidomonas sp.)类囊体PSII光合自我调节能力,减轻了过剩光能对光合系统的伤害[40].本研究发现拟柱孢藻单位活性反应中心吸收的能量增加的同时,单位活性反应中心的热耗散(DIO/RC)也表现出极显著的增大,在10 mg/L Cd2+处理时达到了对照组的228.2 %.同时单位活性反应中心捕获的用于还原QA(TRO/RC)的能量也显著增加.表明拟柱孢藻为了应对Cd2+的毒害,剩余有活性的反应中心的耗能效率确实增强了.因此,拟柱孢藻长时间处于较高浓度镉环境中时,虽然藻个体表现为光合作用受阻,但PSII剩余有活性反应中心的光能分配发生了明显的变化,剩余有活性的反应中心效率提升的同时,通过增加热能和荧光的形式耗散过剩光能(图 4).
植物以及藻类光合作用主要有以下两个过程组成:(1)光能被吸收后,用于生产ATP和NADPH;(2)利用NADPH的还原力和ATP化学能进行CO2的固定[41].光合作用PSII电子传递的抑制和反应中心的部分失活将不可避免影响这两个过程,从而抑制光合作用速率.本研究中,当拟柱孢藻长时间受到较高浓度Cd2+处理时,相比于对照组,单位面积藻体对于光能的吸收和利用出现了明显的下降,使得个体表现为受到了生理损伤,但类囊体剩余的有活性反应中心则表现为对光能的吸收利用增强,同时热耗散也明显增加(图 4),推测可能是拟柱孢藻个体对于外界胁迫的生理响应,以剩余有活性反应中心功能增强的方式来缓解不利环境.从而保证逆境下拟柱孢藻光合机构的正常功能.这种逆境下光能的重新分配可能是拟柱孢藻对于外界胁迫的响应及自我保护机制.
浮游植物是湖泊生态系统的初级生产者,处于食物链的最低端,受重金属污染的影响程度较大.本研究表明拟柱孢藻能够改变PSII的能量分配增加自身的耐镉能力(图 4),使得其能够富集更大量的镉.这种富集效应通过食物链的累积和放大作用影响了水生生态系统,甚至影响人类健康.王颖雪等研究表明,太湖春季重金属与优势种呈正相关,而夏季和冬季重金属与优势种呈负相关,且3个季度重金属与蓝藻和绿藻的相关性最高[42],表明浮游植物的种类数量不同,其重金属含量也不尽相同.先前研究发现拟柱孢藻在我国水体呈现出增长的态势,并形成水华[11, 18].本研究发现低浓度的镉对拟柱孢藻生长有促进作用,且拟柱孢藻能够调整自身能量分配增强耐镉能力(图 1~图 4),暗示拟柱孢藻对水体重金属镉的分布及浓度具有一定的调节作用.此外,拟柱孢藻水华发生,增加了光合呼吸,使得水体温度、pH、溶解氧等环境理化指标改变,也容易导致沉积物金属的释放,因此,将进一步对镉产生更为复杂的耦合效应.因此,对水体重金属的研究不仅要考虑到水体优势种类型,而且需要考虑优势种对重金属的累积及解毒能力.
4 结论1) 低浓度Cd2+(< 0.2 mg/L)对拟柱孢藻生长及叶绿素a含量影响不大,而Cd2+浓度>0.5 mg/L时显著抑制了拟柱孢藻叶绿素a的合成.较高浓度Cd2+(>5 mg/L)抑制了拟柱孢藻的生长.
2) 较高浓度Cd2+(>5 mg/L)使PSII单位反应中心数量减少,阻碍了PSII受体侧电子传递链,使得PSII反应中心性能下降.
3) 拟柱孢藻通过改变细胞及类囊体的能量分配,提高剩余有活性反应中心的功能来缓解重金属镉对光合机构的损伤.
| [1] |
Liang LH, Zhong GM, Huang L et al. Levels of cadmium exposure via drinking water, food and air in residents living in environmental cadmium-contaminated areas in Guangxi. Practical Preventive Medicine, 2018, 25(11): 1340-1343. [梁林涵, 钟格梅, 黄林等. 广西环境镉污染重点地区居民饮用水、食物和空气镉暴露量调查. 实用预防医学, 2018, 25(11): 1340-1343. DOI:10.3969/j.issn.1006-3110.2018.11.015] |
| [2] |
Guo J, Yao Y, Zhao XX et al. Pollution status of lead and cadmium ions in Grain and its harm to human. Grain Science and Technology and Economy, 2018, 43(3): 33-35. [郭健, 姚云, 赵小旭等. 粮食中重金属铅离子、镉离子的污染现状及对人体的危害. 粮食科技与经济, 2018, 43(3): 33-35.] |
| [3] |
Xiao Q. The pain of cadmium pollution in Longjiang River. Pearl River Water Transport, 2012, 3(1): 40-43. [肖蔷. 龙江镉污染之痛. 珠江水运, 2012, 3(1): 40-43. DOI:10.3969/j.issn.1672-8912.2012.01.017] |
| [4] |
Mountouris A, Voutsas E, Tassios D. Bioconcentration of heavy metals in aquatic environments:the importance of bioavailability. Marine Pollution Bulletin, 2002, 44(10): 1136-1141. DOI:10.1016/S0025-326X(02)00168-6 |
| [5] |
Li B, Li PJ, Wang J et al. Toxicity assessment of soil contaminated by heavy metals using algae growth inhibition test. Chinese Journal of Applied Ecology, 2002, 13(3): 331-334. [李彬, 李培军, 王晶等. 重金属污染土壤毒性的斜生栅藻生长抑制实验诊断. 应用生态学报, 2002, 13(3): 331-334. DOI:10.3321/j.issn:1001-9332.2002.03.018] |
| [6] |
Sun H. Toxic effect of cadmium water on chlorococcum and adsorption efficiency of Chlorococcum to cadmium[Disserrtation]. Harbin: Harbin Institute of Technology, 2017. [孙辉.水中镉对绿藻的毒性效应以及绿藻对镉的吸附效能研究[学位论文].哈尔滨: 哈尔滨工业大学, 2017. ]
|
| [7] |
Qiu CE, Kuang QJ, Bi YH et al. The effect of Cd2+ on the growth and physiological characteristics of Chlorococcum sp. Acta Hydrobiologica Sinica, 2007, 31(1): 141-145. [邱昌恩, 况琪军, 毕永红等. Cd2+对绿球藻生长及生理特性的影响研究. 水生生物学报, 2007, 31(1): 141-145.] |
| [8] |
Wong SL, Nakamoto L, Wainwright JF. Identification of toxic metals in affected algal cells in assays of wastewaters. Journal of Applied Phycology, 1994, 6(4): 405-414. DOI:10.1007/BF02182157 |
| [9] |
Cheng GF, Qiu HC, Chang ZY. The effect of cadmium on the growth and antioxidant response for freshwater algae Chlorella vulgaris. Springer Plus, 2016, 5(1): 1290-1298. DOI:10.1186/s40064-016-2963-1 |
| [10] |
Su T, Li YG, Ou RK et al. Toxic effects of Cd2+on the photosynthesis and antioxidase activity of Selenastrum capricornutum. Ecological Science, 2014, 33(2): 301-306. [苏甜, 李义刚, 欧瑞康等. 镉离子对羊角月牙藻光合作用及其抗氧化酶的毒性影响. 生态科学, 2014, 33(2): 301-306.] |
| [11] |
Mallick N, Mohn FH. Use of chlorophyll fluorescence in metal-stress research:a case study with the green microalga Scenedesmus. Ecotoxicology and Environmental Safety, 2003, 55(1): 64-69. DOI:10.1016/S0147-6513(02)00122-7 |
| [12] |
Zhou WB, Juneau P, Qiu BS. Growth and photosynthetic responses of the bloom-forming cyanobacterium Microcystis aeruginosa to elevated levels of cadmium. Chemosphere, 2006, 65(10): 1738-1746. DOI:10.1016/j.chemosphere.2006.04.078 |
| [13] |
Ran XF, Liu R, Bai F et al. The response on the growth and photosystem Ⅱ of Microcystis aeruginosa to cadmium, a heavy metal. Acta Hydrobiologica Sinica, 2015, 39(3): 627-632. [冉小飞, 刘瑞, 白芳等. 微囊藻生长及光合系统Ⅱ对重金属镉的响应. 水生生物学报, 2015, 39(3): 627-632.] |
| [14] |
Zhao L, Lei LM, Peng L et al. Seasonal dynamic and driving factors of Cylindrospermopsis raciborskii in Zhenhai Reservoir, Guangdong Province. J Lake Sci, 2017, 29(1): 193-199. [赵莉, 雷腊梅, 彭亮等. 广东省镇海水库拟柱孢藻(Cylindrospermopsis raciborskii)的季节动态及驱动因子分析. 湖泊科学, 2017, 29(1): 193-199. DOI:10.18307/2017.0121] |
| [15] |
Li ZL, Yu JW, Yang M et al. Cyanobacterial population and harmful metabolites dynamics during a bloom in Yanghe Reservoir, North China. Harmful Algae, 2010, 9(5): 481-488. DOI:10.1016/j.hal.2010.03.003 |
| [16] |
Nie LH, Li XS, Lin ZS et al. Biosorption of heavy metals by Cylindrospermopsis raciborskii. Journal of Hydroecology, 2017, 38(1): 41-45. [聂利华, 李训仕, 林壮森等. 拟柱孢藻对水体重金属的生物富集作用研究. 水生态学杂志, 2017, 38(1): 41-45.] |
| [17] |
Nush E. Comparison of different methods for chlorophyll and phaeopigment determination. Archiv für Hydrobiologie Beiheft Ergebnisse der Limnologie, 1980, 14: 14-36. |
| [18] |
Bai F, Liu R, Yang YJ et al. Dissolved organic phosphorus use by the invasive freshwater diazotroph cyanobacterium, Cylindrospermopsis raciborskii. Harmful Algae, 2014, 39: 112-120. DOI:10.1016/j.hal.2014.06.015 |
| [19] |
Li PM, Gao HY, Strasser RJ. Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study. Journal of Plant Physiology and Molecular Biology, 2005, 31(6): 559-566. [李鹏民, 高辉远, Strasser RJ. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用. 植物生理与分子生物学学报, 2005, 31(6): 559-566.] |
| [20] |
Strasser BJ, Strasser RJ. Measuring fast fluorescence transients to address environmental questions:the JIP-test. Photochemistry Photobiology, 1995, 61: 32-42. DOI:10.1111/j.1751-1097.1995.tb09240.x |
| [21] |
Appenroth KJ, Stockela J, Srivastava A et al. Multiple effects of chromatic on the photosynthetic apparatus of Spirodela polyrhiza as probed by OJIP chlorophyll a fluorescence measurements. Environmental Pollution, 2001, 115(1): 49-64. DOI:10.1016/S0269-7491(01)00091-4 |
| [22] |
Srivastava A, Juttner F, Strasser RJ. Action of the allelo-chemical, fischerellin A, on photosystem Ⅱ. Biochimica et Biophysica Acta, 1998, 1364(3): 326-336. DOI:10.1016/S0005-2728(98)00014-0 |
| [23] |
Liu YJ, Yan W, Liu CC et al. The acute toxic effect of anthracene and cadmium on Karenia mikimotoi Hansen. Ecological Science, 2016, 35(4): 47-51. [刘易见, 颜韦, 刘春辰等. 蒽和镉对米氏凯伦藻的生长及叶绿素a、丙二醛含量的影响. 生态科学, 2016, 35(4): 47-51.] |
| [24] |
Liu L, Yan H, Xia WT et al. Toxic effect of cadmium on Microcystis aeruginosa and Scenedesmus obliquus. China Environmental Science, 2014, 34(2): 478-484. [刘璐, 闫浩, 夏文彤等. 镉对铜绿微囊藻和斜生栅藻的毒性效应. 中国环境科学, 2014, 34(2): 478-484.] |
| [25] |
Li JH, Hao YT, Wen YP. Physiccal responses to Cd2+ stress in Chlorella ellipsoidea. Acta Hydrobiologica Sinica, 2004, 28(6): 659-663. [李建宏, 浩云涛, 翁永萍. Cd2+胁迫条件下椭圆小球藻的生理应答. 水生生物学报, 2004, 28(6): 659-663. DOI:10.3321/j.issn:1000-3207.2004.06.013] |
| [26] |
Björkman O. Responses to different quantum flux densities. Physiological Plant Ecology, 1981, 12: 57-107. |
| [27] |
Stirbet A. Chlorophyll a fluorescence induction:a personal perspective of the thermal phase, the J-I-P rise. Photosynthesis Research, 2012, 113(1-3): 15-61. DOI:10.1007/s11120-012-9754-5 |
| [28] |
Stobart AK, Griffiths WT, Ameen-Bukhari I et al. The effect of Cd2+ on the biosynthesis of chlorophyll in leaves of barley. Physiologia Plantarum, 1985, 63(3): 293-298. DOI:10.1111/j.1399-3054.1985.tb04268.x |
| [29] |
Liu GF, He Jun, Yang YZ et al. Ecological effects of algae blooms cluster:The impact on chlorophyll and photosynthesis of the water Hyacinth. Environmental Science, 2015, 36(8): 2887-2894. [刘国锋, 何俊, 杨轶中等. 藻华聚集的生态效应:对凤眼莲叶绿素和光合作用的影响. 环境科学, 2015, 36(8): 2887-2894.] |
| [30] |
Sbihi K, Cherifi O, El Gharmali A et al. Accumulation and toxicological effects of cadmium, copper and zinc on the growth and photosynthesis of the fresh water diatom Planothidium lanceolatum(Brébisson) ange-Bertalot:a laboratory study. Journal of Material Environment Sciences, 2012, 3(3): 497-506. |
| [31] |
Li L, Yuan L, Song LN et al. Effects of cadmium stress on chlorophyll fluorescence parameters of Lemna minor L. Acta Scientiae Circumstantiae, 2010, 30(5): 1062-1068. [李伶, 袁琳, 宋丽娜等. 镉对浮萍叶绿素荧光参数的影响. 环境科学学报, 2010, 30(5): 1062-1068.] |
| [32] |
Peralesvela HV, García RV, Gómezjuárez EA et al. Streptomycin affects the growth and photochemical activity of the alga Chlorella vulgaris. Ecotoxicology and Environmental Safety, 2016, 132: 311-317. DOI:10.1016/j.ecoenv.2016.06.019 |
| [33] |
Strasser RJ. Polyphasic chlorophyll a fluorescence transients. Photosynthesis Research, 1997, 52(2): 147-155. |
| [34] |
Xia JR, Li YJ, Zou DH. Effects of salinity stress on PSⅡ in Ulva lactuca as probed by chlorophyll fluorescence measurements. Aquatic Botany, 2004, 80(2): 129-137. DOI:10.1016/j.aquabot.2004.07.006 |
| [35] |
Baumann HA, Morrison L, Stengel DB. Metal accumulation and toxicity measured by PAM Chlorophyll fluorescence in seven species of marine macroalgae. Ecotoxicology and Environmental Safety, 2009, 72(4): 1063-1075. DOI:10.1016/j.ecoenv.2008.10.010 |
| [36] |
Zhou XJ. The physiological effects of salinity stress onfresh Spirulina platensis[Dissertation]. Nanjing: Nanjing Agricultural University, 2015. [邹晓娟.盐胁迫对淡水螺旋藻的生理效应[学位论文].南京: 南京农业大学, 2015. ]
|
| [37] |
Platt T, Gallegos CL, Harrison WG. Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton. Publications-Astronomical Society of Japan, 1980, 57(57): 341-345. |
| [38] |
Müller P, Li XP, Niyogi KK. Non-photochemical quenching:A response to excess light energy. Plant Physiology, 2001, 125(4): 1558-1566. DOI:10.1104/pp.125.4.1558 |
| [39] |
Xia JR, Zhou DH. Effects of desiccation on PSⅡ performance in Ulva Lactuca assessed with OJIP chlorophyll a fluorescence transients. Marine Science Bulletin, 2007, 26(4): 50-55. [夏建荣, 邹定辉. 利用OJIP叶绿素a荧光评估干出对石莼(Ulva lactuca)光系统Ⅱ的影响. 海洋通报, 2007, 26(4): 50-55. DOI:10.3969/j.issn.1001-6392.2007.04.006] |
| [40] |
Liang Y, Feng LX, Tian CY et al. Effects of salt stress on the growth and chlorophyll fluorescence of Pyramidomonas sp. Periodical of Ocean University of China, 2006, 36(5): 726-732. [梁英, 冯力霞, 田传远等. 盐胁迫对塔胞藻生长及叶绿素荧光动力学的影响. 中国海洋大学学报, 2006, 36(5): 726-732.] |
| [41] |
Wang SF. Study on biochemical structure of algae and its representations[Dissertation]. Chongqing: Chongqing University, 2008. [王淑芳.藻类物质生化结构的测试及其表征[学位论文].重庆: 重庆大学, 2008. ]
|
| [42] |
Wang YX, Wang PF, Wang C et al. Seasonal variation and distribution characteristics of heavy metals in phytoplankton of different parts of Lake Taihu. J Lake Sci, 2015, 27(2): 258-265. [王颖雪, 王沛芳, 王超等. 太湖浮游植物中重金属含量的季节变化特征及湖区差异. 湖泊科学, 2015, 27(2): 258-265. DOI:10.18307/2015.0209] |
 2019, Vol. 31
2019, Vol. 31 

