(2: 天津农学院, 天津市水产生态及养殖重点实验室, 天津 300384)
(3: 上海海洋大学水产与生命学院, 上海 201306)
(4: 上海海洋大学生态与环境学院, 上海 201306)
(2: Tianjin Agricultural University, Tianjin Key Lab of Aqua-Ecology and Aquaculture, Tianjin 300384, P. R. China)
(3: College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, P. R. China)
(4: Ecology and Environmental Science, Shanghai Ocean University, Shanghai 201306, P. R. China)
河流具有高度的环境异质性和微生物群落多样性,是碳氮等元素转化的重要场所.浮游细菌作为河流生态系统中的重要组成部分在河流生物地球化学循环中发挥着重要作用[1],其中包括固氮、脱氮、固碳、硫化物氧化[2]和降解水体污染物[3]等多种功能.已有研究表明,河流浮游细菌群落组成受时间、空间、温度、氮、磷、pH、溶解氧等[4-5]环境因子的影响,在时空分布上呈现显著差异,而细菌群落组成差异又决定了细菌群落在河流生态系统中发挥不同的功能.因此,阐明浮游细菌群落时空分布及其环境响应机制,有助于深入了解河流内部环境变化规律,揭示细菌群落组成与河流生态系统功能之间的关系.目前有很多学者对河流生态系统中的浮游细菌群落进行了研究,例如九龙江[4]、密西西比河[6]、长江[7]、东江[8]等,然而迄今为止,有关我国珠江下游浮游细菌群落的研究仍鲜有报道.
珠江是中国南方最大的水系,是中国境内第三长河流.珠江是沿江地区人们生活、农业、工业用水的主要来源[9].珠江下游流经人口密集、经济发达的珠三角城市群和粤港澳大湾区,常年受工农业污染以及居民生活污水排放的影响,珠江下游生态环境遭到严重破坏.近年研究表明,珠江流域不同地区都存在污染物浓度逐年升高的趋势[10],且珠江下游河网区域重金属污染程度较高[11],这极大限制了珠江水资源的可持续利用.目前有关珠江流域生态环境的相关研究主要涉及土壤[12]、水质[13]、浮游植物[14]和底栖动物[15],有关浮游细菌群落的研究相对较少.
高通量测序技术因其快速、准确、大批量、并且免于实验室培育等优点[16-17],已经成为环境微生物学和微生物生物地理学的主要研究技术手段,并被广泛应用于湿地、土壤和生物膜等复杂环境中微生物群落结构的研究[18-20].本文采用16S rDNA扩增子测序方法对珠江下游采集的水体样品进行高通量测序,结合多种生信统计方法,探索珠江下游浮游细菌群落动态变化,以期更全面地了解珠江下游水体状况.我们假设,珠江下游浮游细菌受环境因子影响将在群落结构上呈现明显差异,这种差异有助于确定珠江下游浮游细菌群落与环境特征之间的关系.因此,本文旨在了解珠江下游浮游细菌群落多样性及分布情况;确定影响浮游细菌群落多样性及分布的关键驱动因子,为珠江流域水生生态环境保护以及珠江水域污染的生态预警,提供科学资料和理论依据.
1 材料与方法 1.1 调查时间和站位于2016年6月(丰水期)和2016年12月(枯水期)对珠江下游水域进行野外调查.在该水域共布设16个采样站位,基本覆盖了西江沿线、珠三角河网中部和广州市周边,具体站位如图 1所示.包括封开(FK)、德庆(DQ)、肇庆(ZQ)、青岐(QQ)、左滩(ZT)、外海(WH)、新围(XW)、小榄(XL)、小塘(XT)、北滘(BJ)、榄核(LH)、横沥(HL)、陈村(CC)、市桥(SQ)、莲花山(LHS)、珠江桥(ZJQ).其中封开、德庆、肇庆、青岐、左滩、外海、新围位于西江沿线,小榄、小塘、北滘、榄核、横沥、陈村和市桥位于珠三角河网中部,珠江桥和莲花山位于广州市周边.
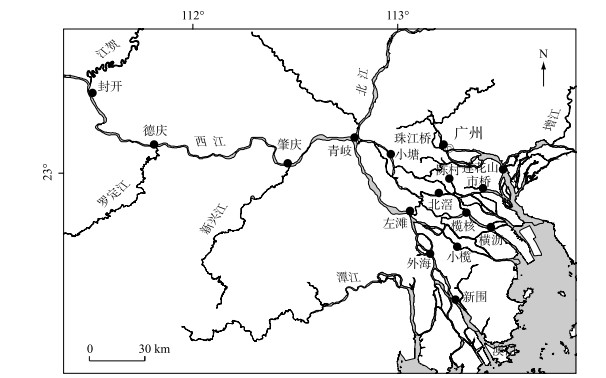
|
图 1 珠江下游调查部位分布 Fig.1 Sampling sites in the downstream of Pearl River |
使用5 L有机玻璃采水器采集表层(距离水面0.5 m)水样3 L.其中2 L水样采集后立即转移到无菌取样袋中(TWIRL EM®,LABPLAS INC.,Quebec,Canada),放于4℃冰箱下冷藏,尽快运回实验室.取1.5 L水样等分为3份(生物学重复,避免误差),分别经200 μm尼龙膜(NY-05,Switzerland)初滤去除大型浮游生物和杂质,再通过0.22 μm孔径的聚碳酸酯滤膜(PALL,USA)过滤,并迅速将滤膜转移至10 mL无菌离心管,保存在-80℃条件下用于DNA提取.其余样品等分为2份,一份经0.45 μm孔径醋酸纤维素滤膜(Whatman,USA)过滤后保留水样;另一份按照《水质样品的保存和管理技术规定》(HJ 493-2009)标准加入固定剂于4℃保存,用于水化学分析.
1.3 环境因子数据收集使用YSI Professional Plus手持多参数水质分析仪(YSI INC.,USA)现场测定水温(WT)、pH、溶解氧(DO)、氧化还原电位(ORP)、化学需氧量(COD)和盐度(S)参数;透明度盘测定透明度(SD);经0.45 μm滤膜过滤和加固定剂的水样,按照《海洋监测规范第4部分:海水分析》(GB 17378.4-2007)规定的方法,测定磷酸盐(PO43--P)、总磷(TP)、硝酸盐(NO3--N)、亚硝酸盐(NO2--N)、铵盐(NH4+-N)、氨(NH3-N)、总氮(TN)和硅酸盐(SiO42--Si)等浓度.环境因子显著性分析采用Excel中的单因素方差分析法.
1.4 DNA提取、聚合酶链式反应(PCR)和高通量测序水体样品总DNA采用DNeasy PowerWater® Kit试剂盒(MO BIO Laboratories,United States)提取,按照生产商提供的说明书进行操作.用分光光度计(NanoDrop ND-2000,USA)检测DNA纯度和浓度,并通过1 %琼脂糖凝胶电泳进行观察.利用515正向引物(5′-GTGCCAGCMGCCGCGG-3′)和806反向引物(5′-GGACTACHVGGGTWTCTAAT-3′)[21]扩增细菌16S rRNA基因的V4高变区.在含有10 μL 5× TransStart®FastPfu Fly缓冲液,5 μL dNTPs(2.5 mmol/L),2 μL正向引物(5 μmol/L),2 μL反向引物(5 μmol/L),1 μL TransStart®FastPfu Fly DNA聚合酶,2.5 μL模板DNA(25 ng)和27.5 μL ddH2O的50 μL PCR混合物中构建扩增子文库. PCR反应条件为:95℃ 1 min;95℃ 30 s,55℃ 30 s,72℃ 45 s,共27个循环;72℃ 10 min;4℃终止反应.对每份样品所制备的一式3份的PCR产物等体积混合,进一步通过1 %琼脂糖凝胶检测PCR产物纯化效果,最后在Illumina二代测序平台(Illumina Inc,CA,USA)进行测序.
1.5 生信分析双向测序完成后下机的测序片段(reads)经FLASH(version 1.2.11)[22]组装,并由QIIME(version 1.8.0)[23]拼接.本文利用UCHIME(version 4.1)[24]识别并去除嵌合序列(chimeric sequences),由UPARSE(version 7.0.1001)[25]进行可操作分类单元(OTU,operational taxonomic units)聚类(序列一致性设定为97 %),以0.8置信度阈值对OTU进行注释,并将所有叶绿体、真核生物、未知序列以及OTU单体(singleton)去除.
通过RStudio程序包vegan的diversity函数计算香农-威尔指数(Shannon-Wiener index)和Chao 1指数(Chao 1 index).采用非度量多维尺度(NMDS,nonmetric multidimensional scaling)和相似性分析(ANOSIM,analysis of similarities)方法分析细菌群落组间差异及时空分布特征.基于群落Bray-Curtis相异度,采用RStudio程序包vegan和grid进行CCA/RDA分析,评估细菌与环境因子之间的关系.
1.6 功能预测分析使用PICRUSt软件,基于OTU的物种注释和丰度信息,将KEGG数据库中已有基因组的原核生物16S rRNA序列与SILVA[26]数据库中16S rRNA序列进行关连,然后将KEGG数据库已有的原核物种基因组进行序列打断,利用UProC(version 1.2.0)对所有基因组的KO序列进行统计.最后利用16S的拷贝数对物种数目进行校正,最终实行KEGG预测以及KO丰度统计,从而获得所测基因的功能预测信息.原始数据上传到NCBI-SRA数据库,登陆号:PRJNA550236.
2 结果与分析 2.1 珠江下游水体理化特征珠江下游16个站位的水体理化特征如表 1所示.季节特征显示,WT、SD和ORP的季节间差异比较明显,P值均小于0.01.丰水期的WT和ORP明显高于枯水期,SD则相反;营养盐(PO43--P、TP、NO3--N、NO2--N、NH4+-N、NH3-N、TN、SiO42--Si)浓度一般呈现枯水期高于丰水期的规律.空间分布特征显示,广州市周边站位的营养盐浓度一般明显高于其他站位(P < 0.05),DO则相反(P < 0.01).且DO浓度的空间分布格局基本呈现沿西江沿线站位、珠三角河网中部、广州市周边递减的趋势,COD与其相反.其他环境因子的空间分布未呈现明显规律.
| 表 1 珠江下游表层水体环境特征 Tab. 1 Characteristics of water environment factors in the downstream of Pearl River |
测序结果显示,质量过滤后,珠江下游16个站位所采集的48个表层水样品,一共获得4389036个有效reads,并注释268004个OTUs,平均每个样本的OTU数目为3125±1632.
在门分类水平上,检测到的前15个门类,季节特征显示变形菌(Proteobacteria)在丰水期和枯水期均为最优势门类(图 2),相对百分比分别为50.04 %和52.62 %.此外,丰水期优势门类的多样性高于枯水期,除了两个季节均占优势的变形菌、放线菌(Actinobacteria)和拟杆菌(Bacteroidetes)外,厚壁菌(Firmicutes)和蓝细菌(Cyanobacteria)在丰水期的个别站位也会形成较大的优势(图 2A).空间特征显示,变形菌在丰水期的空间分布呈现河网中部的相对丰度高于西江沿线和广州市周边(图 2A),而其在枯水期的空间分布则呈相反趋势(图 2B).此外,厚壁菌在丰水期的西江沿线和河网中部的个别站位,相对丰度会超过变形菌(图 2A).
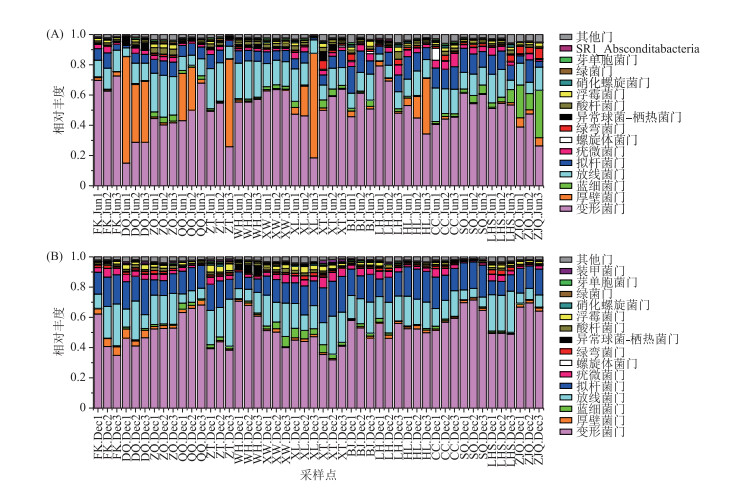
|
图 2 珠江下游浮游细菌丰水期(A)和枯水期(B)各门的相对丰度 (FK.Jun:封开丰水期;FK.Dec:封开枯水期;其他类同) Fig.2 Relative abundance of each phylum of bacterioplankton in wet season(A)and dry season (B) in the downstream of Pearl River |
在纲分类水平上,β-变形菌(Betaproteobacteria)在丰水期和枯水期均为最优势菌纲(图 3),相对百分比分别为27.89 %和25.62 %.此外,丰水期特有的优势菌纲有芽孢杆菌(Bacilli)和蓝细菌(Cyanobacteria)(图 3A),而枯水期特有的优势菌纲有黄杆菌(Flavobacteriia)和ε-变形菌(Epsilonproteobacteria)(图 3B).空间特征显示,丰水期放线菌呈西江沿线>河网中部>广州市周边的趋势,α-变形菌(Alphaproteobacteria)、γ-变形菌(Gammaproteobacteria)和芽孢杆菌在西江沿线和河网中部个别站位成为最优势菌纲(图 3A),蓝细菌在广州市周边站位相对丰度明显升高;枯水期β-变形菌在西江沿线的相对丰度波动较大,而在河网中部和广州市周边站位较稳定(图 3B).
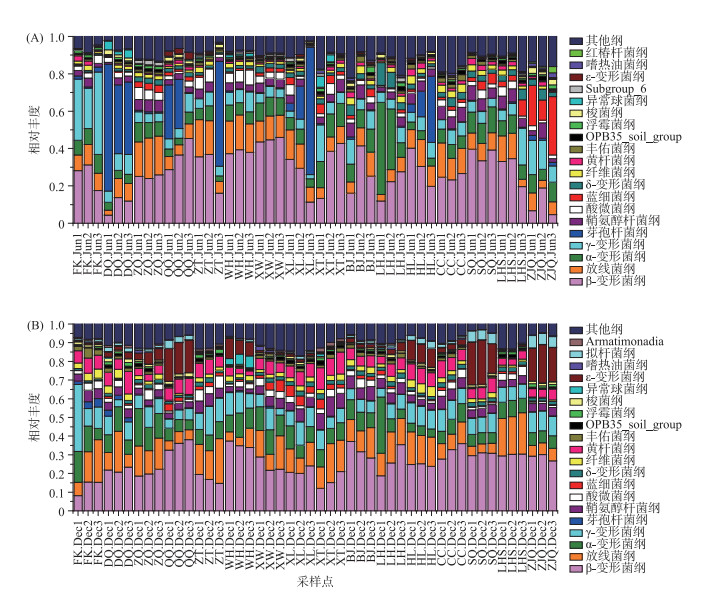
|
图 3 珠江下游浮游细菌丰水期(A)和枯水期(B)各纲的相对丰度 (FK.Jun:封开丰水期;FK.Dec:封开枯水期; 其他类同) Fig.3 Relative abundance of each class of bacterioplankton in wet season(A) and dry season (B) in the downstream of Pearl River |
Shannon-Wiener指数和Chao 1指数分析结果显示,珠江下游浮游细菌群落的季节差异不明显,丰水期略高于枯水期(图 4).
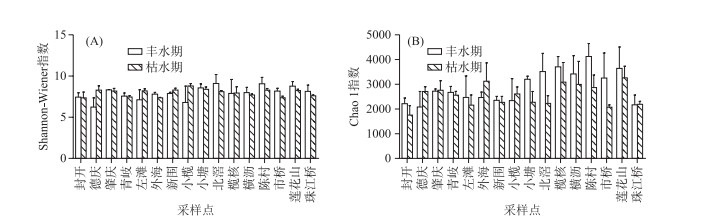
|
图 4 珠江下游浮游细菌Shannon-Wiener(A)和Chao 1(B)多样性指数 Fig.4 Shannon-Wiener(A) and Chao 1(B)indexes of bacterioplankton along the downstream of Pearl River |
采用基于归一化OTUs丰度的NMDS分析方法,并结合ANOSIM的R值进行β多样性分析. ANOSIM是显示组间差异和组内差异的一个参数. β多样性分析结果表明,珠江下游浮游细菌群落结构在空间尺度上无显著差异(R=0.033,P=0.331),而在时间尺度上呈现显著性差异(R=0.222,P=0.001).所有站位被分为4组,丰水期和枯水期可以明显区分开,组1和组3为丰水期站位,组2和组4除丰水期的青岐和市桥两个站位外,均为枯水期站位(图 5).其次每个季节在空间上可以分为两个组群,丰水期的组1站位位于西江三角洲,组3位于北江三角洲;枯水期的组2大部分站位位于广州市周边,组4大部分位于西江沿线和珠三角河网中部.

|
图 5 珠江下游浮游细菌群落NMDS分析(Jun_ZJQ:丰水期珠江桥,其余类同) Fig.5 NMDS analysis of bacterioplankton community in the downstream of Pearl River |
对纲水平细菌群落与环境因子进行RDA分析(图 6).方差分析检验(ANOVA test)结果显示,轴1(P=0.001)和轴2(P=0.035)对关联性的影响显著.轴1和轴2的特征值分别为13.052和9.572,分别可解释所有环境因子影响的30.02 %和22.02 %,可较好地解释细菌群落组成与环境因子之间的关系. WT(R2=0.200, P < 0.01)、DO(R2=0.136, P < 0.01)、PO43--P(R2=0.095, P < 0.01)、SiO42--Si(R2=0.076, P < 0.05)、TP(R2=0.072, P < 0.05)和SD(R2=0.072, P < 0.05)是驱动细菌群落变化最显著的环境因子(P < 0.05).基于轴1的关联性结果显示,WT和SD是影响季节差异的重要因素,将丰水期和枯水期分开;基于轴2的关联性结果显示,DO、COD和营养盐(PO43--P、SiO42--Si、TP)是影响空间差异的重要因素,将组1和组3分开、组2和组4分开.

|
图 6 珠江下游浮游细菌群落与环境因子的RDA分析 (Jun_FK:丰水期封开,其余类同;绿色站位代表丰水期站位,粉色站位代表枯水期站位) Fig.6 RDA analysis between bacterioplankton community and environment factors in the downstream of Pearl River |
将前15纲的细菌群落与环境因子进行RDA分析(图 7),轴1(P=0.034)和轴2(P=0.621)对关联性的影响较大.轴1和轴2的特征值分别为2.235和0.880,分别可解释所有环境因子影响的44.43 %和17.49 %.基于轴1的关联性结果显示,芽孢杆菌纲与WT呈正相关,而黄杆菌纲与其相反.基于轴2的关联性结果显示,α-变形菌纲与DO呈负相关,与COD和营养盐(PO43--P、TP、NO3--N、NO2--N、NH4+-N、NH3-N、TN、SiO42--Si)均呈正相关,而芽孢杆菌纲与其恰好相反.放线菌纲与TP和PO43--P均呈负相关.
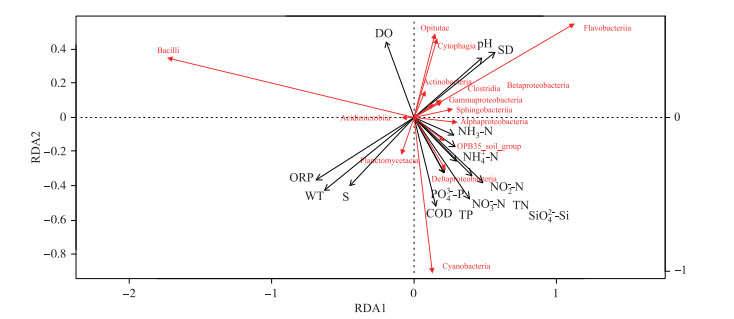
|
图 7 珠江下游浮游细菌前15纲与环境因子的RDA分析 Fig.7 RDA analysis between the first 15 classes of bacterioplankton community and environment factors in the downstream of Pearl River |
功能预测结果(热图)显示,空间分布上大多数样品中,功能谱的相对丰度是相似的.转运体(Transporters)、ABC转运体(ABC transporters)、DNA修复和重组蛋白(DNA repair and recombination proteins)和双组分系统(two-component system)等是珠江下游浮游细菌群落所表达的主要功能.季节分布上,丰水期所有站位的相对丰度高于枯水期,其中转运体和ABC转运体的相对丰度丰水期明显高于枯水期(图 8).
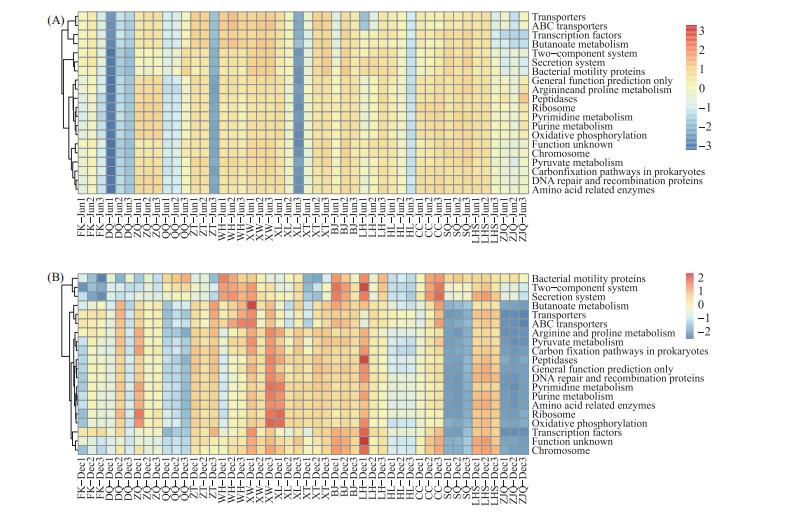
|
图 8 丰水期(A)和枯水期(B)细菌功能预测相对丰度热图 Fig.8 Heat map of bacterial function prediction relative abundance in wet season(A) and dry season(B) |
珠江下游浮游细菌群落结构组成显示,在门分类水平上,变形菌门、放线菌门、拟杆菌门、厚壁菌门、疣微菌门和蓝细菌门是珠江下游的优势菌门.国内外大型江河生态系统的研究结果(表 2)与本研究的结果一致.在纲分类水平上,β-变形菌、放线菌、α-变形菌和γ-变形菌的相对丰度在两个季节均排名前四位,这与国内外多数淡水生态系统的调查结果也是一致的[27-30].
| 表 2 国内外基于16S rRNA测序的河流细菌群落组成及影响因子研究结果* Tab. 2 Bacteria communities and the influencing factors in domestic and oversea rivers based on 16S rRNA |
本研究结果显示,浮游细菌群落相似性组成的季节间差异明显,NMDS结果可以将丰水期和枯水期明显区分开(图 5).纲水平的相对丰度图显示(图 3),芽孢杆菌和黄杆菌在两个季节分布差异较明显. RDA分析的结果显示,WT和SD是影响季节间差异的重要因素(图 6). Lv等[31]在黄河三角洲,以及Ma等[32]对海河的研究均表明,温度是导致细菌群落结构季节性变化的一个主要原因.分析认为,由于每种细菌群落都有自己的最适温度范围,且温度可影响细菌的生长速率和新陈代谢[33-35],丰水期水温高,适宜细菌生长,而枯水期水温相对较低,会抑制细菌的增殖和代谢[36],从而抑制细菌生长.芽孢杆菌最适生长温度为37℃[37],而此次采样的WT范围为18.0~33.8℃,还未达到芽孢杆菌的最适温度,因此随着WT的升高,芽孢杆菌增加.而黄杆菌的最适生长温度为25℃[38],低于芽孢杆菌的最适生长温度,因此两者呈现出的结果不同.除WT的影响外,Jeon等[39]研究发现,厚壁菌门中的芽孢杆菌纲是沙尘细菌的优势菌群.丰水期,大量降雨将山体泥沙和岸边泥沙卷入河流地表水中,沙尘细菌的引入从而导致芽孢杆菌纲相对丰度显著提高.而黄杆菌纲属拟杆菌门,拟杆菌门被认为可以降解高分子量有机化合物[40],枯水期降雨量减少,雨水对河流的稀释度降低,导致人为输入的有机物含量相对增加,因此促进了黄杆菌纲的增加.然而,相对丰度较高的细菌种群在两个季节的差异不明显.分析原因在于:(1)两个季节的水温差异不大,平均值相差小于10℃.寇文伯等[41]对鄱阳湖浮游细菌的研究发现,7月和10月的水温差异不大,浮游细菌群落的群落结构组成变化也不大. (2)丰水期频繁降雨导致径流量增大,水体混合程度高,透明度降低,这有助于大量附着细菌进入表层水体,造成细菌多样性和丰度增加;然而,径流量增大对浮游细菌群落也会产生稀释作用,导致多样性和丰度减小;枯水期径流量小,稀释作用减弱,但是透明度增大对浮游细菌产生的沉降损失作用增强.因此从整体上看细菌群落组成变化显著,但相对丰度较高的细菌种群较稳定,所占比例并没有发生显著变化.
NMDS结果也显示,空间分布存在明显差异,16个站位可分为3个区域:西江沿线、珠三角河网中部和广州市周边.相对丰度图显示,丰水期放线菌呈西江沿线>河网中部>广州市周边的趋势,α-变形菌、γ-变形菌和芽孢杆菌在西江沿线和河网中部个别站位成为最优势菌纲(图 3A),蓝细菌在广州市周边站位相对丰度明显升高;枯水期β-变形菌在西江沿线的相对丰度波动较大,而在河网中部和广州市周边站位较稳定(图 3B). RDA结果显示,DO、COD和营养盐(TP、SiO42--Si、PO43--P)是影响空间差异的重要因素. DO与大部分西江沿线和部分河网站位呈正相关(图 6).吴娅等[42]对三峡库区典型支流的研究也发现,DO是影响该水域浮游细菌丰度空间分布的主要限制因子,分析认为,不同细菌的最适需氧量不同,DO浓度高,适宜好氧菌生长;反之,适宜厌氧菌生长. Newton等[43]的研究发现,放线菌的丰度往往随着氧浓度的降低而降低;芽孢杆菌属好氧细菌,并能有效减少水体有机物耗氧,间接增加水体DO,降低水中COD[44],因此这2种细菌丰度均随DO浓度的升高而升高,在西江沿线相对丰度较高.薛彬等[45]对DO与营养盐(无机氮、活性磷酸盐)的相关性研究表明,DO与各营养盐无论表底层均呈明显的负相关关系.营养盐浓度高,可为细菌提供营养源,有利于细菌的生长繁殖.郑金秀等[46]对大宁河与香溪河细菌群落分布的研究表明,α-变形菌纲与氮、磷呈正相关,因此在营养盐浓度较高的榄核,α-变形菌纲的相对丰度达到最大值. COD是衡量水中有机污染物和还原性无机污染程度的一个综合指标,COD越高,说明水中污染物浓度越高,可为细菌生长提供充足的营养.分析发现,COD与珠三角河网中部和广州市周边地区呈正相关. Burkill[47]和Iturrlaga等[48]曾报道蓝细菌易被小型浮游动物捕食,浮游动物受水质影响较大,水质恶化,浮游动物种类减少.水质监测结果表明,珠江桥的TN和DO均处于劣V类水平,浮游动物种群减少,且营养物质充足,蓝细菌丰度升高,因此在广州市周边地区,蓝细菌丰度达到最高.营养盐(TP、SiO42--Si、PO43--P)对浮游细菌群落的影响也很重要. RDA结果显示,TP和PO43--P与丰水期西江沿线站位呈负相关,与枯水期站位和部分丰水期珠三角河网中部和广州市周边站位呈正相关.丰水期干流水质较好,当TP和PO43--P浓度过低,会限制浮游细菌的生产力和氧消耗.边园琦等[49]对花神湖和紫霞湖的研究显示,放线菌在贫营养湖泊水体中占绝对优势.出现这种情况可能是由于水体中某一元素可利用量不足以维持异养细菌生长进行生物合成的需要,限制了放线菌对磷元素的利用,因此在TP和PO43--P浓度较低的西江沿线,放线菌纲相对丰度较大.在以往研究中,对SiO42--Si的研究还很少,本研究结果显示出,蓝细菌纲与SiO42--Si浓度呈正相关,其中赵海萍等[50]对渤海湾浮游细菌的研究和昝帅君等[51]对辽河口的研究同样表明,蓝细菌与SiO42--Si浓度呈显著正相关,因此SiO42--Si对广州市周边站位影响较大.相对丰度图显示,枯水期β-变形菌纲在珠三角河网中部和广州市周边相对丰度较稳定,但在西江沿线,波动较大,这可能是因为枯水期西江沿线径流量大,水体交换能力强,因此物种丰度波动较大.
功能预测分析表明,转运体、ABC转运体、DNA修复和重组蛋白、双组分系统在细菌功能预测中排名前四.转运体和ABC转运体均为细胞膜上的一种蛋白,参与跨膜运输功能.其中ABC转运体在细菌中可参与营养物质的摄取或细菌毒素的分泌[52]. DNA修复蛋白可随时纠正和修复损伤,保持DNA结构、功能完整性[53];DNA重组又可参与DNA修复,并维持遗传的多样性[54].双组分系统信号转导机制,可应对多种环境变化、代谢和细胞周期信号,感应pH、养分、氧化还原状态、渗透压力和抗生素的双组分系统等[55]. Lv等[31]对黄河三角洲功能预测分析表明,低温细菌群落功能受损.本研究结果同样显示出,丰水期所有站位的相对丰度高于枯水期,其中转运蛋白和ABC转运蛋白的差异明显.分析原因(1)枯水期温度低,浮游细菌数量低于丰水期,从而导致功能预测丰度降低. (2)转运蛋白是一种蛋白质,ABC转运蛋白是一种ATP酶,温度降低会抑制蛋白质和酶的活性,微生物群落在低温下活性也较低,降低了微生物代谢[56].
4 结论1) 珠江下游浮游细菌主要菌门为变形菌门、放线菌门、拟杆菌门、厚壁菌门、疣微菌门和蓝细菌门.优势菌纲为β-变形菌纲、放线菌纲、α-变形菌纲、γ-变形菌纲、芽孢杆菌纲和黄杆菌纲.
2) 珠江下游浮游细菌群落结构存在季节和空间变化,多样性指数丰水期高于枯水期,空间分为3个区域:西江沿线、珠三角河网中部和广州市周边.
3) 水温(WT)、溶解氧(DO)、磷酸盐(PO43--P)、硅酸盐(SiO42--Si)、总磷(TP)、透明度(SD)是驱动细菌群落变化最显著的环境因子,WT和SD是影响季节差异的重要因素,DO、COD和营养盐(PO43--P、SiO42--Si、TP)是影响空间差异的重要因素.
4) 功能预测分析表明,转运体(Transporters)、ABC转运体(ABC transporters)、DNA修复和重组蛋白(DNA repair and recombination proteins)、双组分系统(two-component system)、嘌呤代谢(Purine metabolism)等是珠江下游浮游细菌群落所表达的主要功能,其中转运体和ABC转运体丰水期明显高于枯水期.
| [1] |
Jiang JG, Shen YF. Development of the microbial communities in Lake Donghu in relation to water quality. Environmental Monitoring and Assessment, 2007, 127(1/2/3): 227-236. DOI:10.1007/s10661-006-9275-9 |
| [2] |
Araya R, Tani K, Takagi T et al. Bacterial activity and community composition in stream water and biofilm from an urban river determined by fluorescent in sity hybridization and DGGE analysis. FEMS Microbiology Ecology, 2003, 43(1): 111-119. DOI:10.1016/s0168-6496(02)00394-x |
| [3] |
Li Y, Li DY. Correlation between the distribution of bacterioplankton and the environmental factors in the Yangtze River estuary and its adjacent seas. Marine Science Bulletin, 2007, 26(6): 9-19. [李云, 李道季. 长江口邻近海域浮游细菌分布与环境因子的关系. 海洋通报, 2007, 26(6): 9-19. DOI:10.3969/j.issn.1001-6392.2007.06.002] |
| [4] |
Liu LM, Yang J, Yu XQ et al. Patterns in the composition of microbial communities from a subtropical river: Effects of environmental, spatial and tenmporal factors. PLoS ONE, 2013, 8(11): 1-10. |
| [5] |
Jordaan K, Bezuidenhout CC. Bacterial community composition of an urban river in the North West Province, South Africa, in relation to physico-chemical water quality. Environmental Science and Pollution Research, 2016, 23(6): 5868-5880. DOI:10.1007/s11356-015-5786-7 |
| [6] |
Payne JT, Millar JJ, Jackson CR et al. Patterns of variation in diversity of the Mississippi river microbiome over 1, 300 kilometers. PLoS ONE, 2017, 12(3): e0174890. DOI:10.1371/journal.pone.0174890 |
| [7] |
Liu ZL, Koshikawa H, Ning XR et al. Bacterioplankton production in dilution zone of the Changjiang(Yangtze) Estuary. China Ocean Press, 2001, 20(1): 131-139. |
| [8] |
Liu Z, Huang S, Sun G et al. Phylogenetic diversity, composition and distribution of bacterioplankton community in the Dongjiang River, China. FEMS Microbiology Ecology, 2012, 80(1): 30-44. DOI:10.1111/j.1574-6941.2011.01268.x |
| [9] |
Qian Y. The water supply and its development in the Pearl River[Dissertation]. Nanjing: Hohai University, 2005. [钱燕.珠江水资源利用及发展[学位论文].南京: 河海大学, 2005. ]
|
| [10] |
Wang YP. Characteristics of water quality and heavy metals in guangdong section of the Pearl River Basin[Dissertation]. Guangzhou: South China University of Technology, 2012. [王益平.珠江流域广东段河水水质和重金属污染特征研究[学位论文].广州: 华南理工大学, 2012. ]
|
| [11] |
Xie WP, Wang SB, Zhu XP et al. Residues and potential ecological risk assessment of metal in sediments from lower reaches and estuary of Pearl River. Environmental Science, 2012, 33(6): 1808-1815. [谢文平, 王少冰, 朱新平等. 珠江下游河段沉积物中重金属含量及污染评价. 环境科学, 2012, 33(6): 1808-1815.] |
| [12] |
Han L, Gao ZQ, Bai JH et al. PAHs in surface wetland soils of the Pearl River Delta affected by urbanization:Levels, sources, and toxic risks. Journal of Agro-Environment Science, 2019, 38(3): 609-617. [韩玲, 高照琴, 白军红等. 城市化背景下珠江三角洲典型湿地土壤多环芳烃(PAHs)的含量、来源与污染风险评价. 农业环境科学学报, 2019, 38(3): 609-617. DOI:10.11654/jaes.2018-1535] |
| [13] |
Liu XD, Zhang XY, Liu H. Assessment of water quality and analysis on pollution characteristics in the Pearl River Basin in the past 10 years. Environmental Science Survey, 2018, 37(1): 67-70. [刘晓丹, 张雪雁, 刘珩. 珠江流域近10 a水质状况评价及污染特征分析. 环境科学导刊, 2018, 37(1): 67-70.] |
| [14] |
Wang C, Li XH, Lai ZN et al. Temporal and spatial pattern of the phytoplankton biomass in the Pearl River Delta. Acta Ecologica Sinica, 2013, 33(18): 5835-5847. [王超, 李新辉, 赖子尼等. 珠三角河网浮游植物生物量的时空特征. 生态学报, 2013, 33(18): 5835-5847. DOI:10.5846/stxb201305191112] |
| [15] |
Li ZF, Xie J, Wang GJ et al. Community characteristics of the macrozoobenthos and bioassessment of water quality in aquaculture ponds of the Pearl River Delta. J Lake Sci, 2017, 29(4): 124-134. [李志斐, 谢骏, 王广军等. 珠江三角洲养殖池塘底栖动物群落结构及水质生物学评价. 湖泊科学, 2017, 29(4): 124-134. DOI:10.18307/2017.0413] |
| [16] |
Caporaso JG, Lauber CL, Walters WA et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms. The Isme Journal, 2012, 6(8): 1621-1624. DOI:10.1038/ismej.2012.8 |
| [17] |
Walters W, Hyde ER, Berglyons D et al. Improved bacterial 16S rRNA gene(V4 and V4-5)and fungal internal transcribed spacer marker gene primers for microbial community surveys. Msystems, 2016, 1(1): e00009-15. DOI:10.1128/mSystems.00009-15 |
| [18] |
Wei JM, Cui LJ, Li W et al. Characteristics of bacterial communities in surface-flow constructed wetlands. Environmental Science, 2016, 37(11): 4357-4365. [魏佳明, 崔丽娟, 李伟等. 表流湿地细菌群落结构特征. 环境科学, 2016, 37(11): 4357-4365. DOI:10.13227/j.hjkx.201602108] |
| [19] |
Liu Y, Huang YM, Zeng QC. Soil bacterialcommunities under different vegetation types in the Loess Plateau. Environmental Science, 2016, 37(10): 3931-3938. [刘洋, 黄懿梅, 曾全超. 黄土高原不同植被类型下土壤细菌群落特征研究. 环境科学, 2016, 37(10): 3931-3938. DOI:10.13227/j.hjkx.2016.10.035] |
| [20] |
Chao YQ, Mao YP, Wang ZP et al. Diversity and functions of bacterial community in drinking water biofilms revealed by high-throughput sequencing. Scientific Reports, 2015, 5: 10044. DOI:10.1038/srep10044 |
| [21] |
Caporaso JG, Lauber CL, Walters WA et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample. Proceedings of the National Academy of Sciences, 2011, 108(Supplement_1): 4516-4522. DOI:10.1073/pnas.1000080107 |
| [22] |
Magoč T, Salzberg SL. FLASH: fast length adjustment of short reads to improve genome assemblies. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [23] |
Caporaso JG, Kuczynski J, Stombaugh J et al. QⅡME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [24] |
Edgar RC, Haas BJ, Clemente JC et al. UCHIME improves sensitivity and speed of chimera detection. Bioinformatics, 2011, 27(16): 2194. DOI:10.1093/bioinformatics/btr381 |
| [25] |
Edgar RC. UPARSE: highly accurate OTU sequences from microbial amplicon reads. Nature Methods, 2013, 10(10): 996. DOI:10.1038/NMETH.2604 |
| [26] |
Quast C, Pruesse E, Yilmaz P et al. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools. Nucleic Acids Research, 2013, 41(D1): 590-596. DOI:10.1093/nar/gks1219 |
| [27] |
Wang P, Chen B, Li CQ et al. Bacterial communities in Nanchang section of the Ganjiang River in wet seaon. China Environmental Science, 2016, 36(8): 2453-2462. [王鹏, 陈波, 李传琼等. 赣江南昌段丰水期细菌群落特征. 中国环境科学, 2016, 36(8): 2453-2462. DOI:10.3969/j.issn.1000-6923.2016.08.027] |
| [28] |
Liu LM, Yang J, Yu XQ et al. Bacterioplankton diversity in Xiamen Houxi river watershed along an urban-rural gradient and its relation to environmental factors. Chinese Journal of Appled and Environmental Biology, 2012, 18(4): 591-598. [刘乐冕, 杨军, 余小青等. 厦门后溪流域沿城乡梯度浮游细菌多样性及其与环境因子的关系. 应用与环境生物学报, 2012, 18(4): 591-598. DOI:10.3724/SP.J.1145.2012.00591] |
| [29] |
Read DS, Gweon HS, Bowes MJ et al. Catchment-scale biogeography of riverine bacterioplankton. The ISME Journal, 2015, 9(2): 516-526. DOI:10.1038/ismej.2014.166 |
| [30] |
Jordaan K, Bezuidenhout CC. Bacterial community composition of an urban river in the North West Province, South Africa, in relation to physico-chemical water quality. Environmental Science and Pollution Research, 2016, 23(6): 5868-5880. DOI:10.1007/s11356-015-5786-7 |
| [31] |
Lv XF, Ma B, Yu J et al. Bacterial community structure and function shift along a successional series of tidal flats in the Yellow River Delta. Scientific Reports, 2016, 6: 36550. DOI:10.1038/srep36550 |
| [32] |
Ma LL, Mao GN, Liu J et al. Spatial-temporal changes of bacterioplankton community along an exhorheic river. Frontiers in Microbiology, 2016, 7: 250. DOI:10.3389/fmicb.2016.00250 |
| [33] |
Adams HE, Crump BC, Kling GW. Temperature controls on aquatic bacterial production and community dynamics in arctic lakes and streams. Environmental Microbiology, 2010, 12(5): 1319-1333. DOI:10.1111/j.1462-2920.2010.02176.x |
| [34] |
Sieburth JM. Seasonal selection of estuarine bacteria by water temperature. Journal of Experimental Marine Biology and Ecology, 1967, 1(1): 98-121. DOI:10.1016/0022-0981(67)90009-3 |
| [35] |
Xiao H, Zhang Z, Zhang Y et al. Distribution characteristics of bacterioplankton in spring and autumn in costal waters of south Shandong. Periodical of Ocean University of China, 2009, 39(4): 652-656. [肖慧, 张喆, 张艳等. 春秋季山东南部近岸浮游细菌生态分布. 中国海洋大学学报, 2009, 39(4): 652-656.] |
| [36] |
Cao XY, Xu HM, Wang SC et al. Seasonal variation of bcaterioplankton community structure and its relationship with environmental factors of Mochou Lake and Zixia Lake in Nanjing. Chemistry and Bioengineering, 2016, 33(12): 19-26. [曹新益, 徐慧敏, 王司辰等. 南京莫愁湖与紫霞湖浮游细菌群落结构的季节性变化及其与环境因子的关系. 化学与生物工程, 2016, 33(12): 19-26. DOI:10.3969/j.issn.1672-5425.2016.12.004] |
| [37] |
Yang YH, Li SC, Hu Y et al. Research on growth conditions and physiological tolerance features of Bacillus species AF1 with multifunction. Journal of Chongqing University of Technology: Natural Science, 2015, 29(8): 78-83. [杨艳红, 李世川, 胡燕等. 多功能芽孢杆菌AF1的生长条件与生理耐受特性研究. 重庆理工大学学报:自然科学版, 2015, 29(8): 78-83.] |
| [38] |
Leng Y. Diversity and potential applications of the Yak Dung-Degrading Microbes in the Qinghai-Tibet Plateau[Dissertation]. Lanzhou: Lanzhou Jiaotong University, 2014. [冷艳.青藏高原牦牛粪降解微生物多样性及其应用研究[学位论文].兰州: 兰州交通大学, 2014. ]
|
| [39] |
Jeon EM, Kim HJ, Jung K et al. Impact of Asian dust events on airborne bacterial community assessed by molecular analyses. Atmospheric Environment, 2011, 45(25): 4313-4321. DOI:10.1016/j.atmosenv.2010.11.054 |
| [40] |
Drury B, Rosi-Marshall E, Kelly JJ. Wastewater treatment effluent reduces the abundance and diversity of benthic bacterial communities in urban and suburban rivers. Applied and Environmental Microbiology, 2013, 79(6): 1897-1905. DOI:10.1128/AEM.03527-12 |
| [41] |
Kou WB. Transition in bacterial communities among hydrological changes and different regions in the surface water of Poyang Lake[Dissertation]. Nanchang: Nanchang University, 2016. [寇文伯.鄱阳湖表层水体细菌群落在不同水文时期、不同区域间的变化[学位论文].南昌: 南昌大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10403-1016256067.htm ]
|
| [42] |
Wu Y, Wang YC, Hu MM et al. Ecological distribution and its influencing factors of bacterioplankton in the typical tributaries of Three Gorges Reservoir. Chinese Journal of Ecology, 2016, 34(4): 1060-1065. [吴娅, 王雨春, 胡明明等. 三峡库区典型支流浮游细菌的生态分布及其影响因素. 生态学杂志, 2016, 34(4): 1060-1065.] |
| [43] |
Newton RJ, Jones SE, Eiler A et al. A guide to the natural history of freshwater lake bacteria. Microbiology and Molecular Biology Reviews, 2011, 75(1): 14-49. DOI:10.1128/MMBR.00028-10 |
| [44] |
Hu YM, Ge XY, Liang YX. Water purification functions of the strain Bacillus subtilis FY99-01. Journal of Huazhong Agricultural University, 2006, 25(4): 404-407. [胡咏梅, 葛向阳, 梁运祥. 枯草芽孢杆菌FY99-01菌株的净水作用. 华中农业大学学报, 2006, 25(4): 404-407. DOI:10.3321/j.issn:1000-2421.2006.04.016] |
| [45] |
Xue B, Zhu JP, Li TJ et al. Distribution of dissolved oxygen and nutrients and its relationship around shengsi islands of Zhejiang. Guangzhou Chemical Industry, 2016, 44(17): 150-151. [薛彬, 朱敬萍, 李铁军等. 嵊泗海域溶解氧与营养盐分布特征及其相关性研究. 广州化工, 2016, 44(17): 150-151. DOI:10.3969/j.issn.1001-9677.2016.17.053] |
| [46] |
Zheng JX, Hu JX, Chi SY et al. Distribution of bacterial communities in Daning River and Xiangxi River. Environmental Science & Technology, 2016, 39(8): 171-177. [郑金秀, 胡菊香, 池仕运等. 大宁河与香溪河细菌群落分布. 环境科学与技术, 2016, 39(8): 171-177.] |
| [47] |
Burkill PH, Leakey RJG, Owens NJP et al. Synechococcus and its importance to the microbial foodweb of the northwestern Indian Ocean. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 1993, 40(3): 773-782. DOI:10.1016/0967-0645(93)90057-T |
| [48] |
Iturriaga R, Mitchell BG. Chroococcoid cyanobacteria: a significant component in the food web dynamics of the open ocean. Marine Ecology Progress, 1986, 28(3): 291-297. DOI:10.3354/meps028291 |
| [49] |
Bian YQ, Xing P, Li HB et al. Analysis on bacterioplankton community structure in two oligotrophic lakes, Huashen Lake and Zixia Lake. Ecological Science, 2010, 29(2): 109-115. [边园琦, 邢鹏, 李化炳等. 贫营养湖泊花神湖和紫霞湖浮游细菌群落结构分析. 生态科学, 2010, 29(2): 109-115. DOI:10.3969/j.issn.1008-8873.2010.02.003] |
| [50] |
Zhao HP, Li QX, Tao JH. Distribution characteristics of bacterioplankton in Bohai Bay and its environmental influence factors. Water Resources Protection, 2018, 34(5): 92-98. [赵海萍, 李清雪, 陶建华. 渤海湾浮游细菌分布特征及环境影响因素. 水资源保护, 2018, 34(5): 92-98.] |
| [51] |
Zan SJ, Fan JF, Ming HX et al. Associated and free-living bacteria community structure and diversity of Liaohe estuary. Marine Environmental Science, 2016, 35(4): 594-599. [昝帅君, 樊景凤, 明红霞等. 辽河口浮游细菌和附着细菌群落结构及多样性分析. 海洋环境科学, 2016, 35(4): 594-599.] |
| [52] |
Feng ZY, Liu DF, Cui YD. Progress on research of ATP-binding cassette transporters in Escherichia coli. Chinese Journal of Zoonoses, 2018, 34(10): 86-91, 102. [冯振月, 刘德福, 崔玉东. 大肠杆菌ABC转运体研究进展. 中国人兽共患病学报, 2018, 34(10): 86-91, 102.] |
| [53] |
Dong YP, Zhang D, Han SX. Recent advances in DNA damage repair mechanism. Chinese Journal of Radiation Oncology, 2017, 26(9): 1103-1108. [董怡萍, 张丹, 韩苏夏. DNA损伤修复机制的研究进展. 中华放射肿瘤学杂志, 2017, 26(9): 1103-1108. DOI:10.3760/cma.j.issn.1004-4221.2017.09.025] |
| [54] |
Tang BH. Medical molecular biology. Beijing: China Traditional Chinese Medicine Press, 2014: 48-53. [唐炳华. 医学分子生物学. 北京: 中国中医药出版社, 2014: 48-53.]
|
| [55] |
Hao YH, Zhang W, Chen M. Research progress on two component system of bacteria. Journal of Agricultural Science and Technology, 2012, 14(2): 67-72. [郝艳华, 张维, 陈明. 细菌双组分系统的研究进展. 中国农业科技导报, 2012, 14(2): 67-72. DOI:10.3969/j.issn.1008-0864.2012.02.11] |
| [56] |
Yu Y, Wang H, Liu J et al. Shifts in microbial community function and structure along the successional gradient of coastal wetlands in Yellow River Estuary. European Journal of Soil Biology, 2012, 49: 1-21. DOI:10.1016/j.ejsobi.2011.08.006 |
| [57] |
Zhao MM, Fan TT, Xue LG. Water quality monitoring in Lanzhou section of the Yellow River based on diversity of the Planktonic bacteria system. Journal of Lanzhou Jiaotong University, 2018, 37(2): 98-103. [赵萌萌, 范桃桃, 薛林贵. 基于浮游细菌系统多样性的黄河兰州段水质检测. 兰州交通大学学报, 2018, 37(2): 98-103. DOI:10.3969/j.issn.1001-4373.2018.02.016] |
| [58] |
Wang P, Wang X, Wang C et al. Shift in bacterioplankton diversity and structure: Influence of anthropogenic disturbances along theYarlung Tsangpo River on the Tibetan Plateau, China. Scientific Reports, 2017, 7(1): 12529. DOI:10.1038/s41598-017-12893-4 |
| [59] |
Cheng B, Wang X, Xu YQ et al. Bacterioplankton community structure in the Lancang River Basin and the analysis of its driving environmental factors. Environmental Science, 2018, 39(8): 186-196. [程豹, 望雪, 徐雅倩等. 澜沧江流域浮游细菌群落结构特征及驱动因子分析. 环境科学, 2018, 39(8): 186-196. DOI:10.13227/j.hjkx.201711014] |
| [60] |
Xiao HY, Wang P, Liu JZ et al. Characteristics of bacterial community in Le'an River in winter based on high-throughput sequencing. Acta Microbiologica Sinica, 2019, 59(1): 187-200. [肖汉玉, 王鹏, 刘君政等. 基于高通量测序的乐安江冬季细菌群落特征分析. 微生物学报, 2019, 59(1): 187-200.] |
| [61] |
Sun W, Xia C, Xu M et al. Seasonality affects the diversity and composition of bacterioplankton communities in Dongjiang river, a drinking water source of Hong Kong. Frontiers in Microbiology, 2017, 8: 1644. DOI:10.3389/fmicb.2017.01644 |
| [62] |
Tang J, Xu XR, Shang CY et al. Association of bacterial diversity in city area of Nanming river with environmental factors. Acta Microbiologica Sinica, 2015, 55(8): 95-104. [唐婧, 徐小蓉, 商传禹等. 南明河城区河段细菌多样性与环境因子的关系. 微生物学报, 2015, 55(8): 95-104.] |
| [63] |
Yang CM, Wu YQ, Wang YL et al. Microbial community structure characteristics and its key driving factors in surface sediments along Nanfei River. China Environmental Science, 2018, 38(9): 3552-3561. [杨长明, 吴亚琼, 王育来等. 南淝河表层沉积物细菌群落结构特征及驱动因素. 中国环境科学, 2018, 38(9): 3552-3561. DOI:10.3969/j.issn.1000-6923.2018.09.042] |
| [64] |
Payne JT, Millar JJ, Jackson CR et al. Patterns of variation in diversity of the Mississippi river microbiome over 1, 300 kilometers. PLoS ONE, 2017, 12(3): e0174890. DOI:10.1371/journal.pone.0174890 |
 2020, Vol. 32
2020, Vol. 32 


