(2: 水利部信息中心, 北京 100053)
(2: Information Center of the Ministry of Water Resources, Beijing 100053, P. R. China)
氯苯甲醚类化合物(chloroanisoles,CAs)是由不同个数氯取代茴香醚苯环上的氢而形成的,共包含19种化合物,按氯取代个数可分为一氯苯甲醚(chloroanisole,CA)、二氯苯甲醚(dichloroanisole,DCA)、三氯苯甲醚(trichloroanisole,TCA)、四氯苯甲醚(tetrachloroanisole,TeCA)和五氯苯甲醚(pentachloroanisole,PCA)[1].例如葡萄酒和饮用水中普遍存在和亟待去除的嗅味物质(如2, 4, 6-TCA),以及具有远距离迁移属性的持久性有机物PCA.环境中CAs主要来自于氯酚类化合物(chlorophenols,CPs)及其他与CAs结构相似的氯代烃(如六氯苯、林丹和五氯硝基苯等)[1].特别是五氯酚(PCP)曾被长期作为灭藻剂、杀虫剂、杀菌剂、除草剂和木材防腐剂等被施放到环境中[2-3].
目前,PCP与PCA已被斯德哥尔摩公约列为优先控制的持久性有机污染物,其具有持久性、难降解和可远距离迁移的特点.实地条件下PCP会发生甲基化作用形成PCA,并且PCP和PCA都会渗入到沉积物中并累积[3-4];二者均有肝毒性、致癌性、免疫毒性、神经毒性和生殖毒性[3],易沿食物链富集,在脂肪等生物组织中积累[5],最终可能会对水生生态和人类健康造成危害[3, 6].在地表水、沉积物、水生生物、松针、土壤、空气中均能检测到PCA[2, 7-8],由于存在较大毒性,PCA环境风险较其他CAs更受到研究者的重视.环境中的PCP会转化为氯化程度较低的CPs和CAs,如一氯苯酚、二氯苯酚、三氯苯酚、四氯苯酚、TeCA和PCA[9-10].由于缺乏已知的人为来源,通常认为PCP的微生物甲基化是环境中PCA的唯一来源[3, 8].而在有氧环境下,真菌可以将CPs甲基化为CAs[10-11];另有研究表明,在厌氧条件下,PCA会经过脱甲基作用形成PCP[12].另外,饮用水消毒过程也会产生CAs. 2-CA、4-CA、2, 4-DCA、2, 6-DCA、2, 3, 6-TCA和2, 3, 4, 6-TeCA等具有土霉味,是影响葡萄酒质量、引起饮用水嗅味事件和造成空气嗅味污染的物质. CAs研究主要集中于葡萄酒[13-15]、饮用水[16-18]和空气[5, 19-20]中的污染,而对于水环境中的CAs研究较为欠缺.
湖泊是地表水体的重要组成部分,在供水、调蓄、渔业、旅游和维持生态系统多样性及物质循环等方面具有重要意义,同时湖泊还是许多有毒有害物质的重要蓄积库及二次污染源[5, 19-20].洞庭湖处于湖南省北部长江中游荆江南岸,是我国第二大淡水湖[21],也曾是血吸虫重要的滋生繁殖地,历史上血吸虫病流行的重灾区[22].自1950s开始,我国大量使用PCP来遏制洞庭湖区血吸虫病传播,谭大等[23]报道2003年湖南是我国钉螺面积最大的省份,环洞庭湖区的岳阳、常德和益阳是全国四大PCP消费城市;益阳市血吸虫病流行村个数占湖南省的28 %,PCP消费量占全国消费量的9.89 %.益阳市南县是历史上典型的血吸虫病疫区,洞庭湖支流澧水、藕池河和沱江流经南县汇入洞庭湖.目前,该区域的PCP浓度接近我国《地表水环境质量标准》(GB 3838 —2002)对PCP的标准限值,其潜在的污染风险不可忽视[10]. PCP的施放对水生环境与人类健康危害极大,现虽已停用但其影响仍在持续,目前已经受到了国内学者的关注[10, 24-25],而对于其降解转化造成的CAs污染却鲜有研究.
本研究以南县澧水、藕池河、沱江和内河为研究区,运用气相色谱-质谱联用仪(gas chromatography-mass spectrometer,GC-MS)技术测定分析研究区表层水与沉积物CAs的赋存状况,讨论空间分布特征及区域CAs的污染风险,以期为保护当地居民用水安全、维护洞庭湖水域生态健康与安全提供科学依据.
1 材料与方法 1.1 研究区和样品采集湖南省益阳市南县是典型的血吸虫病湖沼型流行区,为湖南省6个血吸虫病重度流行县之一,茅草街镇处在湘、资、沅、澧、赤磊洪道、藕池西支和沱江这七大水系交汇处,澧水、藕池河和沱江是位于该区的主要洞庭湖支流.该区属亚热带季风湿润气候区,年平均温度16~18℃,多年平均降水量1200~1600 mm[26].澧水发源于湖南省桑植县杉木界,流域内降水量年内变化大,暴雨径流量大,山高坡陡,河谷深切,广大中下游区植被稀少,荒山迹地,生态效益低下,是湖南省水土流失严重地区之一[26-27].藕池河由长江藕池口发源,分化为东中西三支,河道淤塞萎缩快,行洪能力差;断流时间长,两岸用水矛盾突出[28].沱江属季节性河流,每年只有6 —8月涨水时才能通航,10月至翌年4月份基本断流,河泥沙淤积严重.
样品采集于2016年11月(枯水期),在洞庭湖的3条支流和内河布设了45个采样点(图 1),其中,澧水(LS)布设12个采样点,藕池河(OCH)11个采样点,沱江(TJ)19个采样点,内河(NH)3个采样点.每个采样点取水面以下5 cm处水样400 mL,采集表层0~5 cm的沉积物400 g,每个采样点采集样品后均放入装有冰块的保温箱中快速运回实验室.水样使用0.45 μm微孔滤膜过滤,除去藻类和细菌,使水样更稳定,放入4℃的冷藏室进行保存.
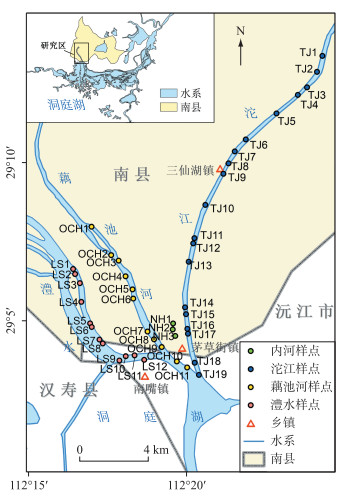
|
图 1 采样点位置 Fig.1 Location of sampling sites |
甲醇、正己烷、丙酮均为农残级(J.T.Baker公司,USA);氯化钠为分析纯(国药集团化学试剂有限公司),使用前置于400℃的马弗炉中2 h,然后放于干燥器中密闭保存、备用;无水硫酸钠为分析纯(国药集团化学试剂有限公司,使用前置于600℃的马弗炉中6 h,然后放于干燥器中密闭保存、备用);超纯水(经MILLIQ系统纯化,电阻率为18.2 MΩ·cm);12种CAs标准品(纯度≥98 %,Dr.Ehrenstorfer公司,Germany);萃取头(85 μm羧乙基/聚二甲基硅氧烷,Supelco公司,USA);硅藻(Agilent公司,USA);活化硅胶(Merck,Darmstadt,Germany,使用前置于550℃的马弗炉中6 h,然后于干燥器中密闭保存、备用).
马弗炉(余姚市亚星仪器表有限公司);PC-420D-数字型磁力加热搅拌装置(Corning公司,USA);15 mL固相微萃取专用样品瓶(Supelco公司,USA);气相色谱—质谱仪(6890GC/5975MS,Agilent公司,USA);色谱柱DB-5MS(30 m×250 μm×0.25 μm,Agilent公司,USA),加速溶剂萃取仪(300,DIONEX,USA);旋转浓缩仪(LABOROTA 4000,Heidolph公司,Germany);冷冻干燥机(Alpha 2-4,Christ公司,Germany);氮吹仪(N-EVAP-12,Organomation公司,USA).
1.3 样品预处理取10 mL地表水样品,用磁力搅拌装置进行升温,转速为1150 r/min.待水浴温度达到恒定80℃时,用顶空固相微萃取法进行萃取,萃取时间为40 min,设置搅拌速度1150 r/min.萃取后立即转移至气相色谱—质谱仪检测.
每个沉积物称重0.3 kg,除去大的颗粒物和植物后,经冷冻干燥处理,研磨过200目筛备用.准确称取10 g过筛沉积物样品和足量硅藻到加速溶剂萃取仪进行萃取,萃取溶剂为正己烷和丙酮(1 :1,V/V).萃取完成后,于旋转浓缩仪中旋转蒸发至3~5 mL,过活化硅胶小柱,用20 mL正己烷洗脱,洗脱液旋转蒸发至3~5 mL,用氮吹仪氮吹至近干,用甲醇清洗定容后待GC-MS检测.
1.4 GC-MS测定气相色谱—质谱仪采取无分流进样方式,使用DB-5MS毛细管柱,载气为氦气;恒流1.5 mL/min;进样时间:2 min;进样口温度:300℃;检测器温度:280℃;程序升温:初始温度50℃,保持1 min,5℃/min升温至180℃,保持1 min,20℃/min升温至285℃.采用SIM模式下无分流进样方式进行检测,电子轰击源(EI);电子能量为70 eV;离子源温度为230℃;传输杆温度为250℃;溶剂延迟:9 min;总离子扫描(TIC)质量数范围为:90~300 m/z;扫描时间为9.0~33.25 min.
1.5 质量保证与控制排除背景干扰:玻璃器皿依次用洗漆剂、重铬酸钾洗液浸泡,用自来水、去离子水漂洗,再用供箱烘干,使用前分别用甲醇、丙酮、二氯甲烷润洗.每10个样品添加一个溶剂空白和程序空白,避免背景污染.
标准曲线与检出限:运用外标法定量,水样标准曲线质量浓度梯度为1、5、10、20和50 ng/L,沉积物标准曲线含量梯度为5、10、62.5、125、250、500和1000 ng/g.样品的最低检测限(LOD)以3倍信噪比(S/N)计算得到[29],水样方法检出限小于0.19 ng/L,沉积物样品方法检出限小于0.09 ng/g,线性复相关系数均满足r2>0.98(表 1).
| 表 1 12种CAs化合物的检出限与加标回收率 Tab. 1 Detection limit and recovery rate of 12 CAs |
准确度和精密度:为保证方法的准确性与可靠性,实验过程中进行了加标回收率实验.依据样品加标回收率原理,配置两种不同含量的CAs混合标准样(水样为10和50 ng/L,沉积物样品为50和500 ng/g)进行回收率实验,每个水平重复6次.表层水的加标回收率实验中,回收率范围为95.5 % ~115.1 %,相对标准偏差不大于14 %;沉积物的实验中,回收率范围为87.7 % ~106.6 %,相对标准偏差不大于17 % (表 1).
1.6 数据分析运用SPSS 22.0统计分析软件对45个采样点检测数据进行处理与分析,用Origin 9软件进行绘图分析.
2 结果与讨论 2.1 整体CAs浓度分布特征为了便于分析,将CAs按氯原子取代数分为CA、DCA、TCA、TeCA和PCA. 表 2中总结了各采样点表层水与沉积物中不同CAs的范围、平均值、标准差和检出率.在澧水、藕池河、沱江河采样点的表层水和沉积物中均能检测出CAs.本研究将各支流的五类CAs的平均浓度的加和视为该支流的总CAs浓度.从整体上看,澧水、藕池河和沱江表层水中总CAs分别为18.94、8.83和4.14 ng/L,澧水表层水中总CAs高出藕池河两倍之多;3条河流沉积物中CAs分别为2.86、3.61和4.07 ng/g.
| 表 2 洞庭湖各支流CAs Tab. 2 Statistical results of CAs of the three tributaries of Lake Dongting |
通过Pearson相关分析(表 3)可知,表层水中不同氯取代个数CAs两两之间均存在显著相关关系(P<0.05),沉积物中仅有部分CAs间(CA与DCA、DCA与PAC、TCA与TeCA、TCA与PCA和TeCA与PCA)存在显著相关关系(P<0.05).这表明表层水中不同氯取代个数CAs间存在相互影响,而沉积物中高氯取代CAs(TCA、TeCA和PCA)之间的相互联系较强,而高氯与低氯取代(CA和DCA)之间的相互联系较弱.
| 表 3 不同氯取代个数CAs间的Pearson相关系数 Tab. 3 Pearson's correlation coefficients of different CAs |
通过ANOVA单因素方差分析以及最小显著性差异法(LSD)检验(表 4)可知,3条河流表层水的CAs浓度之间存在显著性差异(P=0.00<0.05),而沉积物CAs之间不存在显著性差异(P=0.68>0.05).这说明,3条河流的沉积物总CAs仍处于同一污染水平;而各支流表层水总CAs则体现出不同水平的污染程度,澧水表层水CAs浓度最高,其受污染最严重.吴正勇等[10]对本区域酚类化合物的研究表明,澧水中PCP的浓度均为3条河流最高,考虑CAs与PCP的转化关系,本研究的结果与吴正勇等的研究结果一致.
| 表 4 不同支流CAs间的LSD检验 Tab. 4 Comparisons between CAs of different tributaries using the least significant difference (LSD) method |
为了解研究区CAs的总体分布,我们依据3条支流所有采样点表层水和沉积物的CAs,通过K平均值聚类分析将42个样点分为5类(图 2,表 5).第1类仅包含1个样点(OCH9),其特点为表层水中的CAs浓度相对较低,主要为CA;沉积物中的CAs含量相对较高,以高氯取代的CAs为主,尤其是PCA.研究区约50 %的采样点聚集至第2类,表层水和沉积物中的CAs均相对较少,其中CA贡献较高,整体上CAs污染程度相对较低.第3类分布在藕池河和澧水下游,其特点为:表层水CAs浓度相对处于中高水平,各CAs贡献较为平均;沉积物CAs含量相对较低,而以高氯取代的CAs为主.而第4类主要分布在澧水上游,特点为表层水CAs浓度相对较高,以高氯取代的CAs为主;沉积物CAs含量相对较低,各类CAs贡献较为平均.约43 %的采样点聚集至第3、4类,其表层水CAs污染程度相对均较高而沉积物CAs污染较低.第5类仅包含TJ9,其表层水CAs浓度相对处于中低水平,CA的贡献较高;沉积物CAs含量相对较高,主要为CA.可见,表层水CAs浓度高的点位个数比沉积物的多,表明研究区CAs污染的主要表现为表层水污染,水体是污染物的主要赋存介质.
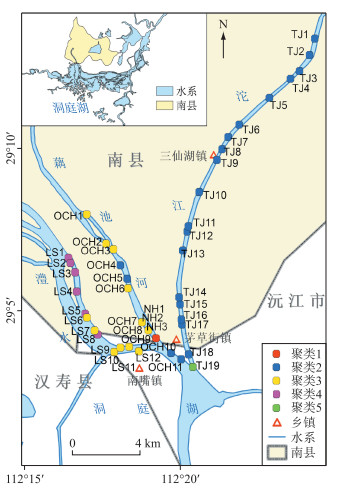
|
图 2 采样点聚类分布 Fig.2 Clustering results for all sampling sites |
| 表 5 所有采样点最终聚集中心 Tab. 5 Final clustering center for all sampling sites |
澧水表层水中不同CAs均能被检出,各个采样点的高氯取代CAs浓度较高,三者共占总CAs浓度的73.75 %,其中TCA平均浓度最高.沉积物中,仅TCA检出率达到100 %;高氯取代CAs共占总量的68.89 %,其中PCA平均含量最高.澧水表层水和沉积物中的CAs污染物均以高氯取代CAs为主(图 3). TCA是水中土霉味的主要来源,其嗅阈值小于4 ng/L[1],澧水表层水中的TCA浓度接近或超过该值,其造成的水体嗅味污染需要引起重视.
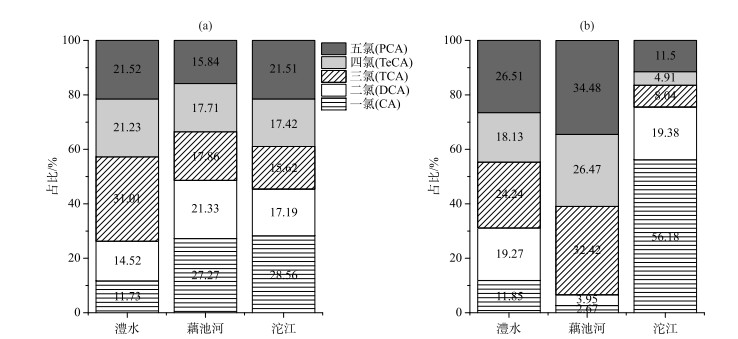
|
图 3 三条支流表层水(a)和沉积物(b)中CAs组成及占比 Fig.3 Proportion of CAs in surface water (a) and sediment (b) along three tributaries |
藕池河中不同CAs均能被检出,各个采样点表层水中CA浓度最高,占比为27.27 %,DCA次之,占比为21.33 %;高氯CAs共占总浓度的51.41 %.沉积物中除OCH8、OCH9样点之外,各CAs含量均 < 1 ng/g,CA、DCA检出率较低,高氯取代CAs检出率均为100 %,三者含量较高,共占比高达93.38 %.可见,藕池河表层水中的CAs污染物以低氯取代CAs占比较高(图 3),而沉积物中的CAs污染物以高氯取代CAs占比较高.结合澧水采样点分析可知,随着氯原子数目的增加,由于CAs的蒸气压降低,沸点升高,辛醇—水分配系数增大,亲脂性随之升高且水溶性降低[5],化合物被分配到沉积物的趋势也随之增加[30].
沱江各个采样点表层水中检出率为100 %的污染物为CA、DCA和PCA,其中CA占比最高,达28.26 %,超出其他CAs浓度的30 % ~80 %;高氯CAs占54.55 %.沉积物中CA占比最高,达56.18 %;高氯CAs占24.44 %.可以看出CA是沱江表层水和沉积物中的主要污染物(图 3).在沱江表层水与沉积物中,CA均最高,其可能原因有二:(1)沱江PCP使用较少、浓度较低,高氯CAs已逐渐降解为低氯CAs;(2)沱江可能存在其他CA的污染源.
内河采样点较少,CAs检出率也较低.内河表层水中仅NH1采样点检测到PCA的存在,浓度为0.31 ng/L.内河沉积物中CA、DCA平均含量分别为1.58和0.75 ng/g,高氯取代CAs很少检测到,仅NH2采样点检测到2, 3, 6-TCA 0.05 ng/g,NH1采样点检测到PCA 0.35 ng/g. NH1~NH3采样点的CA和DCA含量都有上升,NH3采样点为内河排污口,可以推断该河流CAs污染来自排污口排放的污水.研究表明,当饮用水中出现苯甲醚时,苯甲酸和氯发生反应生成CA、DCA、TCA[30].因此,内河CAs可能来自于PCP的降解以及居民用水中苯甲醚的转化.
2.3 各支流CAs空间分布特征 2.3.1 表层水从上游至下游,澧水和藕池河的表层水中CAs浓度呈现波动下降的趋势(图 4a1,4b1).澧水上游采样点LS1~LS4以及藕池河上游采样点OCH1、OCH2的河道狭窄,水流速度快,不易于悬浮物沉降;下游河道变宽,水流速度相对减慢,水量变大,水中的污染物得到了稀释;而且水流减慢有利于悬浮物沉降,因此污染物在下游由表层水向沉积物中转移[30].
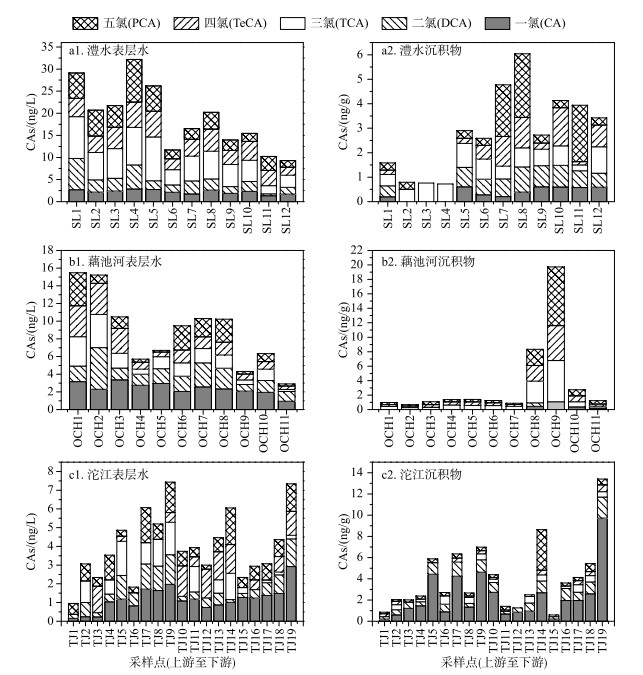
|
图 4 三条支流表层水和沉积物中CAs分布特征 Fig.4 Distribution characteristics of CAs in surface water and sediment along three tributaries |
而由于沱江表层水中CAs浓度较低,并且采样时间为枯水期,水流流速慢,不利于污染物扩散,从上游到下游表层水各CAs(CA除外)浓度有波动但无明显趋势,仅CA浓度呈现波动上升趋势,河道中可能存在CA的污染源(图 4c1).采样点TJ19位于沱江洞庭湖交汇口,有研究表明在干旱季节河流底流流速较高,并且有河水倒灌的影响,河口附近的区域在干旱季节有机氯农药累积的风险较高[31].
2.3.2 沉积物澧水沉积物中CAs有上升的趋势(图 4a2). LS2~LS4采样点CAs总含量较低,基本只有TCA. LS2~LS4样点处在澧水下游的沙洲(再西洲)的东侧,该段河道较窄,水流速度较快,不利于污染物沉积[32]. LS7、LS8和LS11样点PCA含量较高,这两个样点位于八角山村,居民人口较周围区域多,为了防治人畜感染血吸虫病,曾大量施用含PCP农药[10],存在较大的安全隐患. LS10~LS12样点南边是南嘴镇,可能曾施放过PCP;并且位于河道转弯处,LS12样点靠近茅草街大桥,污染物易随泥沙在该处沉积,因此沉积物中CAs含量也较高[33].
藕池河沉积物中,除OCH8、OCH9样点之外,从上游到下游各CAs含量无明显变化趋势,且均小于1 ng/g(图 4b2). OCH8、OCH9样点沉积物中污染物浓度较高,尤其是高氯CAs,说明该处可能存在污染源. OCH8样点(茅草街大桥)、OCH9样点(拓普造纸厂)的CAs含量远高于周围其他点,于OCH9样点处达到峰值,说明该点是一个CAs污染源.其沉积物中高浓度CAs可能主要由造纸厂施用的PCP木材防腐剂等降解产物进入沉积物造成的[3]. OCH8样点CAs含量较高,一方面可能因为OCH9样点污染物的扩散,另一方面因为茅草街大桥具一定的阻碍作用[34],导致水流变慢,易于污染物沉积.
沱江沉积物中各CAs(CA除外)含量从上游到下游有波动但无明显趋势,和表层水变化较为一致(图 4c2).通过Pearson相关性分析可知,沱江表层水与沉积物中的CAs呈显著相关性(P<0.05),相关系数为0.538.这可能与沱江枯水期多断流、水流流速较慢有关,该条件有利于污染物在固液两相间的分配达到平衡[35].入水口淤泥、积沙的环境为钉螺的繁衍创造了良好的条件,为了更好地消灭钉螺,大量使用含有PCP的农药灭螺;同时水中携带大量的污染物随泥沙在此聚集,也是出水口CAs浓度较高的原因[36-37].在沱江表层水与沉积物中,CA浓度均为最高,其可能原因为:(1)沱江PCP使用较少,水和沉积物中PCP原始浓度较低[10],高氯CAs已逐渐降解为低氯CAs;(2)沱江可能存在其他CA污染源.
综上所述,沉积物中各CAs含量的空间变化在三支流间差异较大,可能受到河道自然形状和沿岸人类活动类型的影响.
2.4 PCA赋存状况与生态风险为了更好地了解研究区域表层水和沉积物中CAs的赋存现状,将本研究结果与国内外已有研究进行对比.由于国内外关于环境中的CAs报道较少,由于PCA是CAs中毒性最强、环境风险最大的物质,有一些研究报道了PCA的环境浓度,但数量有限(表 6).其中,本研究澧水表层水中的PCA浓度水平高于我国长江地区和瑞典Stenungsund地区,藕池河和沱江表层水中的PCA浓度水平与瑞典Stenungsund地区的研究相近;由于美国Leary Weber Ditch和Morgan Creek地区属于农业集水区,距离污染源较近,且距离PCP释放的时间较短,PCA浓度远高于本研究以及其他研究的报道.藕池河沉积物中的PCA最大含量8.13 ng/g为所有地区中最高的,美国Mississippi River的7.4 ng/g位居第二,我国沱江和澧水沉积物中的PCA含量低于美国Mississippi River,略高于我国黄海、长江以及瑞典和埃及等地.本研究与其他研究可能存在时间与空间上的差异,但从整体上看本研究区PCA的赋存量处于普通水平.
| 表 6 国内外水体与沉积物中PCA的比较 Tab. 6 Levels of PCA in surface water and sediment samples from various regions |
由于国内外关于CAs毒性研究主要集中于PCA,而PCA也是CAs中毒性最强、环境风险最大的物质,因此仅讨论PCA的生态风险.鱼类的PCA急性半数致死浓度(LC50)为650 μg/L~1.2 mg/L,无脊椎动物PCA的LC50为10~27 μg/L[3].而对于斑马鱼(Danio rerio)幼体,在受精后96 h暴露下LC50为21.8 μg/L,并且观察到了亚致死作用,引起发育畸形、出血或影响心脏功能,说明PCA具有一定的发育毒性[45].本研究区各点位表层水的PCA浓度为0.18~9.63 μg/L,大部分点位低于上述浓度,仅一个点位接近无脊椎动物的LC50下限,因此目前来看,研究区PCA对水生生物不会造成太大的影响,但也可能影响其生殖与发育. PCA对于陆生生物也具有一定的毒性,小鼠(mice)口服PCA的LC50为318~331 mg/kg,大鼠(rat)口服PCA的LC50≥ 500 mg/kg[46]. PCA与雄性大鼠良性嗜铬细胞瘤(肾上腺肿瘤)发病率和雄性小鼠良性嗜铬细胞瘤(肾上腺肿瘤)和血管肉瘤(急速扩张性肝癌)发病率呈相关性[3].从慢性角度来看,PCA属于环境内分泌干扰物,可能会作用于内分泌系统,从而导致肝中毒、致癌,具有免疫毒性、生殖毒性和神经毒性[3].
PCA溶于水,在土壤以及沉淀物中不具备移动性或移动性较低,已有实验室条件下研究发现PCA会从水中挥发,但不会从土壤中挥发[2].目前已有多项研究在空气中监测到了PCA以及其他持久性有机物(常见的有机氯农药、多氯联苯、六氯丁二烯、六氯环己烷等)[2]. PCA和PCP之间存在相互转化关系,二者还可能与其他持久性有机污染物相互作用产生毒性(如六氯苯、林丹及其异构体和全氟辛烷磺酸等),不能排除PCA与其他持久性有机物对人体造成叠加危害的可能[3, 47].尽管有研究指出PCA不会在人体内进行生物累积,因为它会迅速代谢(脱甲基)为PCP,然后经代谢排出体外[3],但PCA经过环境迁移后很可能会通过大气或水体进入人体,就目前人体中检测到的PCA浓度,不能排除其毒性会使人体产生相关的不良反应[3].因此,PCA对人类健康和环境存在的潜在风险不可忽视.
3 结论综上所述,本研究测定洞庭湖疫区澧水、藕池河和沱江3条支流表层水和沉积物中的CAs并分析了研究区CAs的分布特征和生态风险,研究表明:(1)澧水、藕池河和沱江表层水中总CAs体现出不同水平的污染程度,污染程度为澧水>藕池河>沱江;就沉积物中总CAs浓度而言,3支流处于相同污染水平.研究区CAs污染的主要表现为表层水的污染,水体是污染物的主要赋存介质. (2)澧水表层水和沉积物中的CAs污染物以高氯取代CAs(TCA、TeCA和PCA)为主,分别占73.75 %和68.89 %;藕池河表层水中的低氯取代CAs占比较高(48.59 %),而沉积物中以高氯取代CAs为主(93.38 %);沱江表层水和沉积物中的CAs污染物均以CA为主,分别占28.26 %和75.56 %. (3)空间分布上,从上游到下游澧水和藕池河的表层水中CAs呈现波动下降的趋势;澧水沉积物中CAs呈上升趋势,藕池河沉积物中CAs无明显变化趋势;沱江表层水和沉积物中CA呈波动上升趋势,其他CAs有波动但无明显变化趋势. (4)本研究区水中的PCA浓度对水生生物不会造成太大的影响,但其对人类健康和环境的潜在风险不可忽视.
| [1] |
Ren M, Zhao GF, Wang XY et al. Research progress of chloroanisoles pollutants in the environment. Journal of Environmental Engineering Technology, 2017, 7(3): 357-365. [任敏, 赵高峰, 王晓燕等. 环境中氯苯甲醚类污染物研究进展. 环境工程技术学报, 2017, 7(3): 357-365. DOI:10.3969/j.issn.1674-991X.2017.03.050] |
| [2] |
United Nations Environment Program (UNEP) ed. Pentachloroanisole (PCA). Canada: Government of Canada, 2012.
|
| [3] |
United Nations Environment Program (UNEP). Report of the Persistent Organic Pollutants Review Committee on the work of its ninth meeting. Addendum: Risk profile on pentachlorophenol and its salts and esters. Rome: Persistent Organic Pollutants Review Committee, 2013.
|
| [4] |
Duodu GO, Goonetilleke A, Ayoko GA. Comparison of pollution indices for the assessment of heavy metal in Brisbane River sediment. Environmental Pollution, 2016, 219: 1077-1091. DOI:10.1016/j.envpol.2016.09.008 |
| [5] |
Lorentzen JC, Juran SA, Nilsson M et al. Chloroanisoles may explain mold odor and represent a major indoor environment problem in Sweden. Indoor Air, 2016, 26(2): 207-218. DOI:10.1111/ina.12207 |
| [6] |
Liu DH, Tao YQ, Zhou WZ. Distribution and accumulation of persistent organic pollutants in aquatic organisms of Chinese lakes. J Lake Sci, 2018, 30(3): 581-596. [刘东红, 陶玉强, 周文佐. 持久性有机污染物在中国湖泊生物中分布与富集的研究进展. 湖泊科学, 2018, 30(3): 581-596. DOI:10.18307/2018.0301] |
| [7] |
Jiang X, Martens D, Schramm KW et al. Polychlorinated organic compounds (PCOCs) in waters, suspended solids and sediments of the Yangtse River. Chemosphere, 2000, 41(6): 901-905. DOI:10.1016/S0045-6535(99)00435-X |
| [8] |
Kylin H, Svensson T, Jensen S et al. The trans-continental distributions of pentachlorophenol and pentachloroanisole in pine needles indicate separate origins. Environmental Pollution, 2017, 229: 688-695. DOI:10.1016/j.envpol.2017.07.010 |
| [9] |
United States Environmental Protection Agency (US EPA). Pentachlorophenol environmental fate and transport assessment. Washington DC: Office of Prevention, Pesticides, and Toxic Substances, 2008.
|
| [10] |
Wu ZY, Zhao GF, Zhou HD et al. Pollution characteristics and potential risks of phenolic compounds in schistosomiasis epidemic areas. Environmental Science, 2012, 33(5): 1682-1686. [吴正勇, 赵高峰, 周怀东等. 典型血吸虫病疫区表层水中酚类化合物的污染特征及潜在风险. 环境科学, 2012, 33(5): 1682-1686. DOI:10.13227/j.hjkx.2012.05.045] |
| [11] |
Coque JJR, Alvarez-Rodriguez ML, Larriba G. Characterization of an inducible chlorophenol O-methyltransferase from Trichoderma longibrachiatum involved in the formation of chloroanisoles and determination of its role in cork taint of wines. Applied and Environmental Microbiology, 2003, 69(9): 5089-5095. DOI:10.1128/aem.69.9.5089-5095.2003 |
| [12] |
Murthy NBK, Kaufman DD, Fries GF. Degradation of pentachlorophenol (PCP) in aerobic and anaerobic soil. Journal of Environmental Science and Health, Part B, 1979, 14(1): 1-14. DOI:10.1080/03601237909372110 |
| [13] |
Pizarro C, Pérez-Del-Notario N, Sáenz-Mateo A et al. A simple and sensitive Vortex assisted liquid-liquid microextraction method for the simultaneous determination of haloanisoles and halophenols in wines. Talanta, 2014, 128: 1-8. DOI: 0.1016/j.talanta.2014.04.005.
|
| [14] |
Giacosa S, Gabrielli M, Torchio F et al. Relationships among electrolyzed water postharvest treatments on winegrapes and chloroanisoles occurrence in wine. Food Research International, 2019, 120: 235-243. DOI: 0.1016/j.foodres.2019.02.034.
|
| [15] |
Carasek E, Cudjoe E, Pawliszyn J. Fast and sensitive method to determine chloroanisoles in cork using an internally cooled solid-phase microextraction fiber. Journal of Chromatography A, 2007, 1138(1/2): 10-17. DOI:10.1016/j.chroma.2006.10.092 |
| [16] |
Li Y, Zhang XJ, Chen C. Review on the tastes and odors compounds in drinking water of China. Chinese Journal of Environmental Science, 2009, 30(2): 583-588. [李勇, 张晓健, 陈超. 我国饮用水中嗅味问题及其研究进展. 环境科学, 2009, 30(2): 583-588. DOI:10.3321/j.issn:0250-3301.2009.02.045] |
| [17] |
Zhang KJ, Zhou XY, Zhang TQ et al. Kinetics and mechanisms of formation of earthy and musty odor compounds: Chloroanisoles during water chlorination. Chemosphere, 2016, 163: 366-372. DOI: 0.1016/j.chemosphere.2016.08.051.
|
| [18] |
Bai XZ, Qu ZP, Li B et al. Distribution of typical taste and odor compounds and possible formation of 2, 4, 6-trichloroanisole in drinking water treatment plants. Water, Air, and Soil Pollution, 2017, 228(8): 296. DOI: 0.1007/s11270-017-3474-6.
|
| [19] |
Schreitmueller J, Ballschmiter K. Air-water equilibrium of hexachlorocyclohexanes and chloromethoxybenzenes in the north and south Atlantic. Environmental Science & Technology, 1995, 29(1): 207-215. DOI: 0.1021/es00001a027.
|
| [20] |
Hoferkamp L, Hermanson MH, Muir DCG. Current use pesticides in Arctic media; 2000-2007. Science of the Total Environment, 2010, 408(15): 2985-2994. DOI: 0.1016/j.scitotenv.2009.11.038.
|
| [21] |
Xiong J, Yu FQ, Tian Q et al. The evolution of water quality and nutrient condition in Lake Dongting in recent 30 years. J Lake Sci, 2016, 28(6): 1217-1225. [熊剑, 喻方琴, 田琪等. 近30年来洞庭湖水质营养状况演变特征分析?. 湖泊科学, 2016, 28(6): 1217-1225. DOI:10.18307/2016.0607] |
| [22] |
Chen MX, Xiang SJ, Guo JX et al. Investigation on epidemic tendency of schistosomiasis in Dongting Lake areas. Modern Preventive Medicine, 2011, 38(3): 404-405, 411. [陈明雄, 向世杰, 郭劲霞等. 洞庭湖疫区血吸虫病流行趋势的研究. 现代预防医学, 2011, 38(3): 404-405, 411.] |
| [23] |
Tan D, Zhang JB. Estimates of PCP-Na consumption in districts and provinces in China by the top-down calculation method. Environmental Pollution and Control, 2008, 30(3): 17-20. [谭大, 张剑波. Top-down法计算中国五氯酚钠消费分布. 环境污染与防治, 2008, 30(3): 17-20. DOI:10.3969/j.issn.1001-3865.2008.03.006] |
| [24] |
Zhang B, Zheng MH, Liu PY et al. Distribution of pentachlorophenol in Dongting Lake environmental medium. China Environmental Science, 2001, 21(2): 165-167. [张兵, 郑明辉, 刘芃岩等. 五氯酚在洞庭湖环境介质中的分布. 中国环境科学, 2001, 21(2): 165-167. DOI:10.3321/j.issn:1000-6923.2001.02.018] |
| [25] |
Yang PH, Chen XY, Zhang XH et al. Pollution characteristics of pentachlorophenol in multi environment medium of Poyang Lake wetland during low water periods. Environmental Pollution & Control, 2019, 41(3): 261-265. [杨平华, 陈小艳, 张新华等. 鄱阳湖湿地枯水期多种环境介质中五氯酚的污染特征. 环境污染与防治, 2019, 41(3): 261-265.] |
| [26] |
Liu BW, Song N, Geng SH et al. Evolution characteristics and impacting factors of annual runoff and sediment in Lishui River during 1955-2009. Bulletin of Soil and Water Conservation, 2014, 34(6): 360-363. [刘碧维, 宋楠, 耿胜慧等. 1955-2009年澧水流域径流泥沙演变及影响因素. 水土保持通报, 2014, 34(6): 360-363.] |
| [27] |
Li JB. The erosive intensity and the migrating characters of the materials in the Lishui watershed. Journal of Soil and Water Conservation, 1990, 4(2): 62-69. [李景保. 澧水流域物质侵蚀强度及其迁移特征. 水土保持学报, 1990, 4(2): 62-69.] |
| [28] |
Fang CM, Cao WH, Lu W et al. The analysis of Ouchi River's heavy deposit and rapid reduction of discharge and sediment caused by Jingjiang truncation. Journal of Sediment Research, 2002(2): 40-45. [方春明, 曹文洪, 鲁文等. 荆江裁弯造成藕池河急剧淤积与分流分沙减少分析. 泥沙研究, 2002(2): 40-45. DOI:10.3321/j.issn:0468-155X.2002.02.007] |
| [29] |
Cacho JI, Campillo N, Viñas P et al. Stir bar sorptive extraction polar coatings for the determination of chlorophenols and chloroanisoles in wines using gas chromatography and mass spectrometry. Talanta, 2014, 118: 30-36. DOI:10.1016/j.talanta.2013.09.047 |
| [30] |
Olaniran AO, Igbinosa EO. Chlorophenols and other related derivatives of environmental concern:Properties, distribution and microbial degradation processes. Chemosphere, 2011, 83(10): 1297-1306. DOI:10.1016/j.chemosphere.2011.04.009 |
| [31] |
Chen L, Xiao YC, Li YY et al. Construction of the hydrological condition-persistent organic pollutants relationship in the Yangtze River Estuary. Journal of Hazardous Materials, 2018, 360: 544-551. DOI:10.1016/j.jhazmat.2018.08.045 |
| [32] |
Liu J, Li ZW, Xu QW et al. Erosion-deposition processes of the bar head in Tiebanzhou Island in the lower Yangtze River. Resources and Environment in the Yangtze Basin, 2019, 28(9): 2219-2229. [刘晶, 李志威, 许清文等. 长江下游铁板洲洲头冲淤变化规律. 长江流域资源与环境, 2019, 28(9): 2219-2229.] |
| [33] |
Hu XF, Wang ZW, Song XX et al. Concentrations and ecological risk assessment of heavy metals in surface sediments from tributaries of Yuqiao Reservoir. Journal of Agro-Environment Science, 2013, 32(6): 1210-1218. [胡晓芳, 王祖伟, 宋晓旭等. 于桥水库上游支流沉积物重金属含量及生态风险评价. 农业环境科学学报, 2013, 32(6): 1210-1218. DOI:10.11654/jaes.2013.06.018] |
| [34] |
Trueheart ME, Dewoolkar MM, Rizzo DM et al. Simulating hydraulic interdependence between bridges along a river corridor under transient flood conditions. Science of the Total Environment, 2020, 699: 134046. DOI:10.1016/j.scitotenv.2019.134046 |
| [35] |
Lei P, Zhang H, Wang C et al. Migration and diffusion for pollutants across the sediment-water interface in lakes:A review. J Lake Sci, 2018, 30(6): 1489-1508. [雷沛, 张洪, 王超等. 沉积物-水界面污染物迁移扩散的研究进展. 湖泊科学, 2018, 30(6): 1489-1508. DOI:10.18307/2018.0602] |
| [36] |
Pan FJ, Wang HZ, Wang LY et al. Research on spatial disparity and breeding environment characteristics of Oncomelania hupensis in plain lakes:A case study in Gongan County of Hubei Province, China. Resources and Environment in the Yangtze Basin, 2019, 28(8): 1965-1976. [潘方杰, 王宏志, 王璐瑶等. 平原湖区钉螺分异规律及孳生环境特征研究——以湖北公安县为例. 长江流域资源与环境, 2019, 28(8): 1965-1976. DOI:10.11870/cjlyzyyhj201908020] |
| [37] |
Wang XD, Chen XF, Huang F et al. Impact of hydrology on the spread of Oncomelania to southern coast of Yangtze estuary in Jiangsu Province. China Tropical Medicine August, 2013, 13(8): 960-963. [王学东, 陈新峰, 黄峰等. 长江水文对长江河口段苏南沿岸区域钉螺影响的研究. 中国热带医学, 2013, 13(8): 960-963.] |
| [38] |
Alvarez DA, Cranor WL, Perkins SD et al. Chemical and toxicologic assessment of organic contaminants in surface water using passive samplers. Journal of Environmental Quality, 2008, 37(3): 1024. DOI:10.2134/jeq2006.0463 |
| [39] |
IVL. Screening av pentaklorfenol (PCP) i miljön. IVL Swedish Environmental Research Institute, 2002.
|
| [40] |
Barakat AO, Mostafa A, Wade TL et al. Assessment of persistent organochlorine pollutants in sediments from Lake Manzala, Egypt. Marine Pollution Bulletin, 2012, 64(8): 1713-1720. DOI:10.1016/j.marpolbul.2012.03.022 |
| [41] |
Barakat AO, Mostafa A, Wade TL et al. Spatial distribution and temporal trends of persistent organochlorine pollutants in sediments from Lake Maryut, Alexandria, Egypt. Marine Pollution Bulletin, 2012, 64(2): 395-404. DOI:10.1016/j.marpolbul.2011.12.019 |
| [42] |
Barakat AO, Kim M, Qian Y et al. Organochlorine pesticides and PCB residues in sediments of Alexandria Harbour, Egypt. Marine Pollution Bulletin, 2002, 44(12): 1426-1434. DOI:10.1016/s0025-326x(02)00313-2 |
| [43] |
Oh JR, Choi HK, Hong SH et al. A preliminary report of persistent organochlorine pollutants in the Yellow Sea. Marine Pollution Bulletin, 2005, 50(2): 217-222. DOI:10.1016/j.marpolbul.2004.11.035 |
| [44] |
Rostad CE, Pereira WE, Leiker TJ. Distribution and transport of selected anthropogenic lipophilic organic compounds associated with Mississippi River suspended sediment, 1989-1990. Archives of Environmental Contamination and Toxicology, 1999, 36(3): 248-255. DOI:10.1007/s002449900468 |
| [45] |
Cheng Y, Ekker M, Chan HM. Relative developmental toxicities of pentachloroanisole and pentachlorophenol in a zebrafish model (Danio rerio). Ecotoxicology and Environmental Safety, 2015, 112: 7-14. DOI:10.1016/j.ecoenv.2014.10.004 |
| [46] |
United Nations Environment Program (UNEP). Supporting information on pentachlorophenol and its salts and esters. United Nations Environment Program, 2013.
|
| [47] |
Rauert C, Harner T, Schuster JK et al. Air monitoring of new and legacy POPs in the Group of Latin America and Caribbean (GRULAC) region. Environmental Pollution, 2018, 243: 1252-1262. DOI:10.1016/j.envpol.2018.09.048 |
 2020, Vol. 32
2020, Vol. 32 

