(2: 生态环境部海河流域北海海域生态环境监督管理局生态环境监测与科学研究中心, 天津 300170)
(2: Center of Eco-environmental Monitoring and Scientific Research, Administration of Ecology and Environment of Haihe River Basin and Beihai Sea Area, Ministry of Ecology and Environment of People's Republic of China, Tianjin 300170, P. R. China)
浮游植物是水环境中的初级生产者和食物链的基础环节, 其群落结构包括种类组成、数量分布、优势种及群落特征等能对水环境的变化做出最直接的响应, 因而常被用作评价湖泊生态状态的重要指标[1], 常见方法有优势种评价法与种类多样性指数法.浮游植物的群落结构受水体中温度、pH和营养盐等环境因子的直接影响[2].此外在人类活动、水文条件及营养输入等因素影响下, 各湖泊浮游植物群落结构的时空变化及主导因素各不相同.严广寒等[3]研究表明西洞庭湖浮游植物多样性指数为三口水系 < 湖区 < 四口水系, 影响浮游植物分布的关键因素是水温和pH值; 钱奎梅等[4]研究表明鄱阳湖浮游植物群落季节变化显著, 产生影响的主要环境因子为水位变化、水温、透明度、电导率、悬浮物浓度和亚硝态氮浓度.因此深入研究浮游植物的时空变化特征及影响因素, 对于湖泊的生态环境监测及管理具有重要意义[4].
目前, 分析浮游植物群落与环境因子间复杂关系的方法有很多, 包括典型对应分析(CCA)、冗余分析(RDA)、主成分分析(PCA)、Pearson相关性分析和协惯量分析等[5-6]. Pearson相关性分析用于衡量两个变量之间的相关关系, 采用Pearson相关性分析法可以同时分析出影响生物群落指标的关键因素以及生物群落指标与环境因子的响应关系.
白洋淀(38°10'~40°00'N, 113°40'~116°20'E)位于河北省雄安新区, 水域面积366 km2, 为华北平原最大的淡水湖.白洋淀作为雄安新区辖区内最重要的水体功能区, 有利于新区生态城市建设, 改善新区城市气候, 为城市提供水资源, 对未来新区城市的建设和发展具有不可忽视的作用.近几十年来由于受气候变化和人类活动的影响, 白洋淀淀区的生态环境发生了很大的变化, 水源明显减少, 污染严重, 泥沙淤积严重, 湖泊水域和湿地面积急剧萎缩[7].已有资料显示, 白洋淀淀区水体表现为严重的富营养化, 水生态也发生了改变甚至破坏, 具体表现为耐污物种出现和生物多样性破坏等.比如最早是冯建社[8]于1996年在白洋淀鉴定出浮游植物8门170种; 之后沈会涛等[9]于2006年在白洋淀共观察到浮游植物8门155种, 优势种以蓝藻、绿藻和隐藻为主, 此时淀区已表现出一定程度的浮游植物种类减少的趋势; 王瑜等[10]于2009年在白洋淀共检出浮游植物8门133种, 优势种以蓝藻和绿藻为主, 物种多样性持续下降.近年来, 关于白洋淀浮游植物的相关调查研究鲜有报道, 但白洋淀淀区由于雄安新区的建设以及数次生态补水, 浮游植物生存的外部条件发生了一定程度变化, 因此对淀区浮游植物群落指标与水环境因子的研究显得尤为重要.本研究基于2018年5月和8月白洋淀的水文、水质以及浮游植物数据, 分析浮游植物群落结构和环境因子的时空分布, 通过Pearson相关性分析得到白洋淀浮游植物群落结构与环境因子相关关系, 并对白洋淀淀区水质及富营养化程度进行评价, 以期为白洋淀水资源管理及水生态保护提供理论基础.
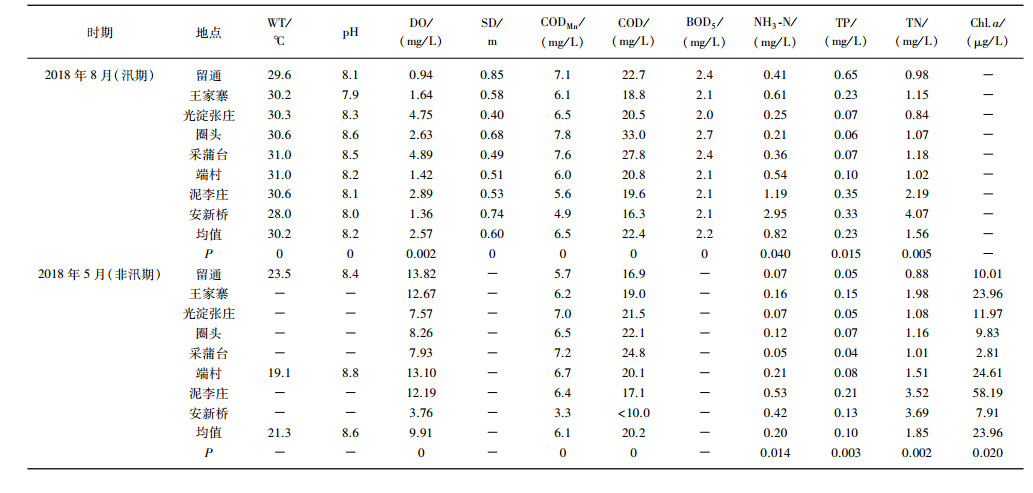
1 材料与方法 1.1 样点布设与采样时间在白洋淀共设置了8个采样点, 分别是留通、王家寨、光淀张庄、圈头、采蒲台、端村、泥李庄和安新桥(图 1).于2018年非汛期(5月)和汛期(8月)对白洋淀的8个点进行2次采样.
|
图 1 白洋淀采样点分布及分区示意 Fig.1 Distribution and zoning of sampling sites in the Lake Baiyangdian |
环境因子共11项, 包括水温(WT)、酸碱度(pH)、透明度(SD)、溶解氧(DO)、高锰酸盐指数(CODMn)、化学需氧量(COD)、五日生化需氧量(BOD5)、氨氮(NH3-N)、总磷(TP)、总氮(TN)和叶绿素a(Chl.a).样品分析方法参照《水和废水监测分析方法》 [11].
浮游植物采样方法参照《水和废水监测分析方法》[11], 浮游植物定性样品用25#浮游生物网(200目), 在水下0.15 m处作" ∞"字型拖曳3 min, 收集到的浮游植物装入100 mL标本瓶中, 加3 mL福尔马林固定带回分析; 浮游植物定量样品则取1 L水样于样品瓶中, 加15 mL鲁哥氏液固定, 带回实验室静置后分析.
浮游植物镜检在蔡司Scope A1显微镜下进行, 定性样品分类主要依据形态学分类方法, 种类鉴定参照《中国淡水藻类——系统、分类及生态》[12]; 定性样品带回实验室静置24 h, 然后浓缩至30 mL, 用浮游生物计数框对其进行计数, 根据浓缩倍数计算藻细胞丰度.
1.3 数据分析 1.3.1 白洋淀环境因子相关性分析通过Kolmogorov-Smirnow(K-S)正态分布检验, 判断环境因子是否符合正态分布.结果显示, 水环境因子均符合正态分布.因而利用SPSS 20.0统计软件对白洋淀淀区水环境因子的时空变化进行t检验; 通过Pearson相关性分析法对环境因子进行分析, 相关性较强的2个环境因子只保留其中1个.根据筛选出的环境因子对采样点进行水质评价, 并对8个采样点进行分区.
1.3.2 白洋淀淀区浮游植物群落特征指标采用Shannon-Wiener多样性指数、Margalef物种丰富度指数、Pielou均匀度指数、物种多样性阈值、生物丰度和优势度对浮游植物的群落特征进行分析[13-16], 各指数的计算公式列于表 1.
| 表 1 群落特征指数* Tab. 1 Community characteristic index |
通过Pearson相关性分析方法利用SPSS 20.0统计软件进行相关性分析, 其中R值表示相关性大小, P值表示两个变量间的显著性, 一般要求P < 0.05有意义, R的绝对值一般在0.7~1.0之间, 为强相关, 在0.3~0.7之间为弱相关, 0.3以下认为没有相关性.相关性分析时由于群落多样性指数与环境因子的单位不统一, 因此需对群落多样性指数与环境因子数据进行标准差标准化处理.
1.3.4 综合营养状态指数评价参考湖泊富营养化评价方法及分级标准[17], 根据Chl.a、TP、TN、SD和CODMn的测定结果, 运用综合营养状态指数法对白洋淀生态系统健康状况进行评价.综合营养状态指数计算公式为:
| $ TLI\left( \Sigma \right) = \Sigma {W_j} \cdot TLI\left( j \right) $ | (1) |
式中, TLI(∑)表示综合营养状态指数; TLI(j)代表第 j 种参数的营养状态参数; Wj为第j种参数的营养状态指数的相关权重, 详细计算公式见参考文献[17].
参考《中国水资源公报》[18]中湖泊、水库富营养化评分与分类标准将湖泊营养状态分成5级, 同一营养状态下, 指数值越高, 其营养程度越严重:贫营养, TLI(∑) < 30;中营养, 30 ≤ TLI(∑) ≤ 50;轻度富营养, 50 < TLI(∑) ≤ 60;中度富营养, 60 < TLI(∑) ≤ 70;重度富营养, TLI(∑)>70.
2 结果 2.1 白洋淀环境因子相关性分析白洋淀水体DO、NH3-N、CODMn、COD、TP和TN在汛期的平均浓度分别为2.57、0.82、6.50、22.40、0.23和1.56 mg/L, 非汛期的平均浓度分别为9.91、0.20、6.10、20.20、0.10和1.85 mg/L(表 2).环境因子在汛期与非汛期存在显著差异, NH3-N、CODMn、COD和TP浓度在汛期高于非汛期, DO和TN浓度在汛期低于非汛期. t检验分析结果(表 2)显示白洋淀环境因子存在显著的空间异质性.在汛期各采样点水体的DO、CODMn、COD、TN浓度存在极显著差异(P < 0.01), NH3-N和TP浓度存在显著差异(P < 0.05);在非汛期各采样点水体的DO、CODMn、COD、TP和TN浓度存在极显著差异(P < 0.01), NH3-N浓度存在显著差异(P < 0.05).
| 表 2 2018年5月和8月白洋淀8个采样点水体理化指标 Tab. 2 Physical and chemical indexes of 8 sampling sites in the Lake Baiyangdian in May and August, 2018 |
汛期白洋淀水体各环境指标的Pearson分析结果(附录Ⅰ)显示, DO浓度仅与SD呈现显著相关性, 由于DO是衡量水体自净能力的一个较为重要的指标[19], 因此保留. COD与pH、CODMn、BOD5呈现出极显著相关, 其中COD、CODMn和BOD5均可反映水体受污染程度, 故本文保留CODMn. TN与NH3-N浓度呈极显著相关, 与WT呈现显著相关性, 与DO浓度等无显著相关性, 故保留. TP浓度仅与SD呈现显著相关性, 因此予以保留.汛期, 共筛选出DO、CODMn、TN、TP浓度4个主要环境因子.
非汛期白洋淀水体各环境指标的Pearson分析结果(附录Ⅱ)显示, DO浓度与其他环境因子均无相关性, 故保留. CODMn与COD呈现出极显著相关性, 因此本文保留CODMn. Chl.a是浮游植物进行光合作用的主要色素, 对浮游植物的生长起到重要作用, 与NH3-N和TP浓度均呈显著正相关, 并且NH3-N、TN和TP浓度三者间呈现出极显著相关性, 因此保留NH3-N和TP浓度.非汛期, 共筛选出DO、CODMn、NH3-N和TP浓度4个主要环境因子.
2.2 白洋淀区域划分根据我国《地表水环境质量标准》以及筛选出的主要环境因子, 用单因子评价法对白洋淀淀区不同时期不同地点的水质进行分级评价, 结果如图 1所示.按照水质评价结果对8个采样点进行分区, 留通水质汛期为Ⅴ类, 非汛期为Ⅲ类, 汛期和非汛期水质评价结果差异较大, 且非汛期水质较优, 故为A区; 光淀张庄、采蒲台、圈头和王家寨水质大体为Ⅳ类水, 评价结果相近, 在所有采样点中水质处于中等, 故为B区; 端村为Ⅴ类水, 故为水质较差区即C区; 安新桥和泥李庄水质最差, 达到劣Ⅴ类, 故为水质差区即D区, 分区示意如图 1所示.
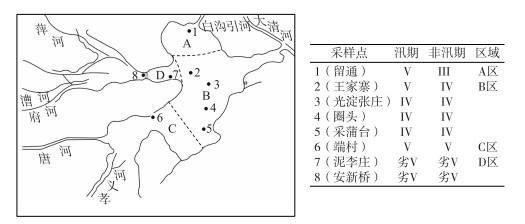
2.3 白洋淀浮游植物的群落结构 2.3.1 白洋淀汛期和非汛期浮游植物的种类组成白洋淀研究区域汛期共检出浮游植物5门38种, 其中以绿藻门种类最为丰富, 为16种, 占藻种总数的42.1%;其次是硅藻门有11种, 占29.0%.另外, 蓝藻门7种, 占18.4%, 裸藻门3种, 占7.9%, 甲藻门1种, 占2.6%(图 2).
|
图 2 白洋淀浮游植物物种组成 Fig.2 Phytoplankton species composition in the Lake Baiyangdian |
非汛期共检出浮游植物6门43种, 其中以绿藻门种类最为丰富, 为20种, 占藻种总数的46.5%;其次是硅藻门有12种, 占27.9 %.另外, 蓝藻门6种, 占14.0%, 裸藻门3种, 占7.0%, 甲藻门1种, 占2.3%, 金藻门1种, 占2.3 %(图 2).
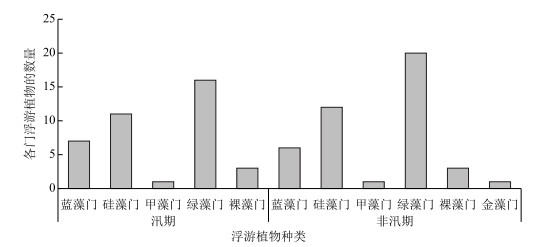
2.3.2 白洋淀浮游植物丰度及优势种汛期浮游植物的丰度在415.30×105~1018.14×105 cells/L之间, 非汛期浮游植物丰度在249.62×105~454.21×105 cells/L之间, 不同时空的浮游植物绝对丰度及相对组成呈现显著差异(图 3).
|
图 3 白洋淀浮游植物丰度的时空分布(甲藻门在该区域数量极少, 较难定量测量, 但在汛期的安新桥以及非汛期的泥李庄、光淀张庄、采蒲台等地均有出现) Fig.3 Spatial and temporal distribution of phytoplankton density in the Lake Baiyangdian |
优势种群通过汛期和非汛期两个时期不同地点不同浮游植物所占百分比以及在所有地点的出现率共同分析, 即优势度(Y), 认为Y>0.02为优势种.汛期和非汛期不同地点的浮游植物优势种及优势度详见表 3.经统计汛期浮游植物优势种群共有6种, 分别为铜绿微囊藻(Microcystis aeruginosa)、微小平裂藻(Merismopedia tenuissima)、类颤鱼腥藻(Anabaena osicellariordes)、集星藻(Actinastrum hantzschii)、大螺旋藻(Spirulina major)和四尾栅藻(Scenedesmus quadricauda), 其中圈头最多有4种, 铜绿微囊藻在8个研究地点均有出现, 微小平裂藻出现了6次; 非汛期浮游植物优势种群共有10种, 分别为铜绿微囊藻、四角十字藻(Crucigenia quadrata)、二形栅藻(Scenedesmus dimorphus)、湖生卵囊藻(Oocystis lacustris)、小型色球藻(Chroococcus minor)、四尾栅藻、微小平裂藻、小席藻(Phormidum tenus)、尖针杆藻(Synedra acusvar)和小球藻(Chlorella vulgaris), 其中光淀张庄最多有7种, 铜绿微囊藻出现8次, 四角十字藻出现5次.汛期与非汛期优势种主要是β-中营养型、α-β-中富营养型、α-富营养型指示种[20].
| 表 3 白洋淀不同地点浮游植物优势种及优势度 Tab. 3 Dominant phytoplankton species and dominance degree at different sites in the Lake Baiyangdian |
总体而言, 从时间上看, 汛期浮游植物丰度除端村外均大于非汛期, 汛期优势种以蓝藻为主, 有少量绿藻; 非汛期优势种以蓝、绿藻居多, 有少量的硅藻.从空间上看, 在汛期D区浮游植物丰度最大, C区最小, 其中端村丰度最小, 安新桥丰度最大; 在非汛期C区浮游植物丰度最大, A区最小, B、D区处于中等, 其中留通丰度最小, 端村的丰度最大.各区域优势种情况相似, 均以蓝、绿藻为主(图 3).
2.3.3 白洋淀浮游植物群落特征指数及水质评价白洋淀浮游植物Shannon-Wiener多样性指数汛期在0.584~1.514之间, 均值为1.115, 非汛期在0.709~1.828之间, 均值为1.258(图 4).根据Shannon-Wiener多样性指数评价等级[21]:0~1为重污型; 1~3为中污型; >3为清洁-寡污型.因此, 白洋淀淀区均处于中污染状态.
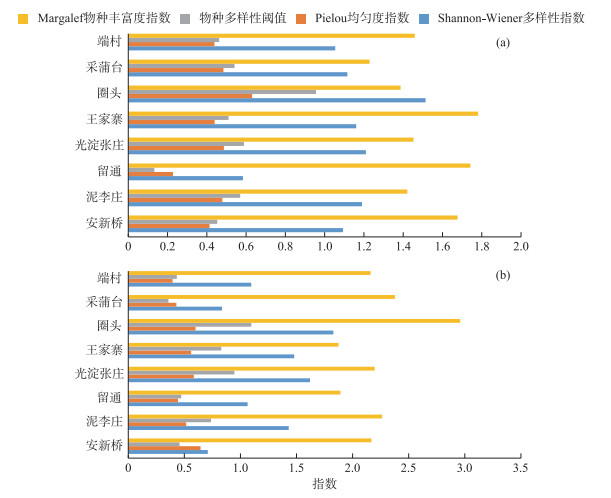
|
图 4 汛期(a)和非汛期(b)白洋淀浮游植物群落特征指数 Fig.4 Index of phytoplankton community characteristics in the Lake Baiyangdian in flood season (a) and non-flood season (b) |
白洋淀浮游植物Pielou均匀度指数汛期在0.228~0.631之间, 均值为0.450, 非汛期在0.395~0.645之间, 均值为0.522(图 4).按照Pielou均匀度指数评价等级[21]:0~0.3为重污型; 0.3~0.5为中污型; 0.5~0.8为清洁-寡污型; 0.8~1.0为清洁型.因此, 白洋淀淀区在汛期处于中污染状态下, 在非汛期处于清洁-寡污状态下.
白洋淀浮游植物物种多样性阈值汛期在0.133~0.956之间, 均值为0.527, 非汛期在0.358~1.097之间, 均值为0.666(图 4).
白洋淀浮游植物Margalef物种丰富度指数汛期在1.229~1.782之间, 均值为1.518, 非汛期在1.874~2.959之间, 均值为2.236(图 4).按照Margalef物种丰富度指数评价等级[21]:0~1为重污染型; 1~2为中污染型; 2~3为轻污染型; >3为清洁型.因此, 白洋淀淀区在汛期处于中污染状态下, 在非汛期处于轻污染状态下.
总体而言, 汛期浮游植物群落特征指数均值均小于非汛期, 汛期处于中污染状态下, 非汛期处于轻污染状态下.从空间上看, 汛期A区即留通的物种多样性和均匀度最低, B区最高, 其中圈头的物种多样性和均匀度最高, C、D区处于中等; 非汛期B区物种多样性和均匀度最高, 其余区域相似.
2.4 白洋淀浮游植物群落特征与水环境因子的响应关系Pearson相关性分析结果(表 4)表明, 汛期浮游植物群落Shannon-Wiener多样性指数、Pielou均匀度指数、物种多样性阈值与TP浓度均呈显著负相关(P < 0.05), Margalef物种丰富度与DO浓度呈显著负相关(P < 0.05);非汛期浮游植物群落Shannon-Wiener多样性指数、Pielou均匀度指数、物种多样性阈值均与CODMn、TP浓度呈显著正相关(P < 0.05), Margalef物种丰富度与TP浓度呈显著负相关(P < 0.05).
| 表 4 白洋淀浮游植物群落指标与环境因子的相关性 Tab. 4 Correlation between phytoplankton community index and environmental factors in the Lake Baiyangdian |
浮游植物群落结构受水体营养盐浓度、水动力学特征、浮游动物觅食压力、水文动态的直接作用, 除此之外, 时间与地理空间变化的影响也不容忽视[2].从时间来看, 2018年白洋淀汛期共观察到浮游植物5门38种, 非汛期共观察到6门43种.在非汛期浮游植物的种类及门类高于汛期, 非汛期出现了汛期未出现的金藻门, 且群落组成也存在较大差异.白洋淀浮游植物丰度与优势种在汛期与非汛期也表现出明显不同.白洋淀汛期各采样点浮游植物群落组成以蓝藻门及少量的绿藻门占优势, 其中主要优势种为蓝藻门的铜绿微囊藻和微小平裂藻, 二者相对丰度之和为85.8%, 非汛期各采样点浮游植物群落组成以蓝、绿藻门及少量的硅藻门占优势, 其中主要优势种为蓝藻门的铜绿微囊藻和绿藻门的四角十字藻, 二者的相对丰度之和为74.7%, 汛期优势种相对丰度更高.从绝对数量上说, 汛期主要优势种丰度大于非汛期.可见汛期与非汛期的浮游植物群落结构存在着一定的差异, 造成这些差异的原因可能与两个时期的环境差异有关:首先, 水温是影响浮游植物生长、发育、群落组成和丰度变化等重要的环境因子[22], 在10~30℃条件下硅藻均有出现, 绿藻在18~30℃下均能生长良好, 蓝藻能在40℃的高水温下生长[23].白洋淀非汛期和汛期的平均水温分别为21.3和30.2℃, 随着水温升高, 浮游植物由非汛期的蓝、绿藻门为主向汛期的蓝藻门为主转变, 汛期浮游植物丰度大于非汛期, 优势种相对丰度更高.此外, 水温增加会使DO浓度降低并促进沉积物中氮、磷等营养物质释放, 导致浮游植物群落结构变化.其次, 水位波动可以调节浮游植物群落结构, 汛期比非汛期水位波动频繁, 可能会抑制某些浮游植物的生长[4], 导致汛期浮游植物种类少于非汛期.最后, 水量对浮游植物有重要影响.汛期水量增加, 会冲刷土壤中的营养盐或者造成沉积物中的营养物质再悬浮, 从而导致营养盐浓度升高影响浮游植物群落结构的变化.
从空间来看, 4个区域浮游植物的群落结构与水质关联性较强. D区域为入淀河流汇入口, 接受来自府河、萍河等排放的城市尾水和安新县的工业及生活尾水, 水体富营养化程度高, 汛期、非汛期均为劣Ⅴ类. C区域端村为曾为淀区养鱼区, 由于水体停留时间长, 长期积累的营养物质导致端村水质较差, 汛期和非汛期均为Ⅴ类水.以上两个区域水质均较差, 浮游植物群落结构也比较相似, 多样性和均匀度数值相近. A区汛期水质为Ⅴ类水, 物种多样性和均匀度在所有采样点中最差, 非汛期水质为Ⅲ类水, 水质较汛期变好, 物种多样性指数和均匀度也有所提高, 两个时期的差异可能是由于汛期入淀河流携带营养物质过多引起的. B区处于淀区中心, 旅游业发达, 受人类活动影响较大, 水质总体处于Ⅳ类水, 但水质优于C区和D区, 物种多样性和均匀度也相应较高.可见水质是影响浮游植物的群落结构的重要因素, 上游水系是白洋淀水域的主要污染来源之一.
3.2 白洋淀浮游植物群落与环境因子的关系浮游植物群落结构在不同水体具有不同的特征, 其演替规律是众多环境因子在时间和空间上相互影响的结果[24].影响水体中浮游植物群落结构的环境因子很多, 国内学者陆续开展关于白洋淀浮游植物与环境因子的相关性研究:沈会涛等[9]在2006年通过对白洋淀浮游植物数据和环境因子数据进行典范相关分析, 发现pH和TP浓度是影响浮游植物分布的关键因素; 李亚蒙等[25]通过典型对应分析方法得出2008年TP浓度和pH是影响白洋淀硅藻种群分布的关键因素; 王瑜等[10]在2009年对白洋淀浮游植物细胞丰度与环境因子进行Pearson相关性分析, 得出DO、Chl.a和TP浓度是关键因素; 金磊等[26]在2013年根据白洋淀典型水域的浮游植物出现的相对频度和相对丰度进行冗余分析, 发现TP、TN、pH和DO浓度是影响浮游植物分布的关键因素.本研究通过Shannon-Wiener多样性指数、Pielou均匀度指数、物种多样性阈值和Margalef物种丰富度4个浮游植物群落特征指数与主要环境因子进行Pearson相关性分析, 发现白洋淀汛期与非汛期的关键因素存在差异, 影响汛期浮游植物群落特征的关键因素为TP和DO浓度, 影响非汛期浮游植物群落特征的关键因素为CODMn和TP浓度.不同研究所选取的浮游植物指标以及分析方法的不同可能导致研究结果的不同, 但可以发现TP浓度均为影响浮游植物的关键因素.磷是浮游植物群落发展的关键因子, 磷的供给促进了浮游植物的生长.有实验结果表明, 在磷浓度较高时绿藻占优势, 随着磷浓度降低, 硅藻逐渐占优势[27].汛期TP浓度高于非汛期, 促进了绿藻的生长, 不利于硅藻的发展, 从而导致汛期浮游植物物种多样性、均匀度与丰富度降低.由前述可知, 非汛期Chl.a浓度与TP浓度呈现出显著正相关, Chl.a是浮游植物生长状况的直接体现指标, 因此非汛期TP浓度对浮游植物的生长起到促进作用, 这与上述结论相符.汛期水温较高有利于浮游植物生物量增加, 其繁殖、生长过程中的耗氧则导致水中DO浓度降低, 因此浮游植物对DO的竞争使DO成为影响浮游植物群落结构的关键因素. CODMn是反映水体受到有机污染物和还原性无机物污染程度的综合指标, 与浮游植物的生长呈显著正相关关系[28], 非汛期CODMn低于汛期, 成为浮游植物生长的限制因素.因此可以通过控制有机污染物和磷的排放改善白洋淀的水质.
3.3 白洋淀水质评价根据Shannon-Wiener多样性指数、Pielou均匀度指数和Margalef物种丰富度指数进行评价, 白洋淀汛期水质处于中污染状态, 非汛期处于轻污染状态.根据优势种评价法, 白洋淀淀区汛期与非汛期优势种均以指示水体富营养状态的绿藻和蓝藻为主.根据Reynolds浮游植物功能类群的划分[29]:铜绿微囊藻属于M, 适合的生境为低纬度的小型富营养湖; 微小平裂藻和小型色球藻属于Lo, 该类群具有广适性; 类颤鱼腥藻属于H1, 适合的生境为富营养分层浅水湖泊; 大螺旋藻属于S2, 适合的生境为浅浑浊混合层; 集星藻、四尾栅藻、四角十字藻和二形栅藻属于J, 适合的生境为混合的高富营养的浅水水体; 小席藻属于S1, 适合的生境为透明度较低的混合水体; 湖生卵囊藻和小球藻属于F, 适合的生境为中富营养型湖泊; 尖针杆藻属于D, 适合的生境为较浑浊的浅水水体.这些优势类群的广泛分布也说明了白洋淀水体的富营养化程度较高, 水体较浑浊, 透明度较低.但单一的浮游植物评价方法不够全面, 故结合综合营养状态指数(TLI(Σ))进行评价.白洋淀大部分检测点TLI(Σ)值均在50分以上, 平均值为52, 处于中度富营养化水平.综合几种评价方法, 可以看出白洋淀水体处于富营养化状态.
将白洋淀2005年以来的浮游植物调查资料进行对比(表 5), 其中2005-2006年[30]和2009年[10]调查资料均为白洋淀汛期与非汛期的平均数据, 发现2018年浮游植物丰度大幅度上升, 分别是2006年和2009年的10.3倍和2.6倍.由于本次采样时间处于藻类的生长繁殖期, 温度升高以及水体营养盐的增加均可促进浮游植物的生长; 但浮游植物门类减少, 且指示水质清洁的黄藻门未检测到, 说明白洋淀水质恶化, 富营养化程度加深; 此外, 指示水体富营养化的隐藻门也未检测到, 物种数显著减少, 与2009年相比减少了0.6倍, 表明浮游植物的物种多样性降低, Shannon- Wiener多样性指数、Pielou均匀度指数和Margalef物种丰富度等指标的显著下降也证实了这一点.因此从浮游植物群落结构的角度来看, 相比2009年, 白洋淀水体富营养化有逐年加重的趋势.这可能是由于白洋淀近年来降水量减少、泥沙淤积、河湖连通性被破坏, 导致水体停留时间较长、交换缓慢, 此外围淀造田、围淀养鱼、尾水排放等均导致水体有机质不断累积, 淀区富营养化持续加深.
| 表 5 白洋淀浮游植物群落结构变化* Tab. 5 Changes of phytoplankton community structure in the Lake Baiyangdian |
1) 白洋淀研究区域汛期共检出浮游植物5门38种, 非汛期共检出浮游植物6门43种, 均以绿藻门种类最为丰富.汛期浮游植物优势种群共有6种, 分别为蓝藻门的铜绿微囊藻、微小平裂藻、类颤鱼腥藻、大螺旋藻以及绿藻门的集星藻、四尾栅藻; 非汛期浮游植物优势种群共有10种, 分别为蓝藻门的铜绿微囊藻、小色球藻、微小平裂藻、小席藻, 绿藻门的四角十字藻、二形栅藻、湖生卵囊藻、四尾栅藻、小球藻以及硅藻门的尖针杆藻.白洋淀汛期浮游植物的丰度在415.30×105~1018.14×105 cells/L之间, 非汛期浮游植物丰度在249.62×105~454.21×105 cells/L之间.
2) 汛期Shannon-Wiener多样性指数、Pielou均匀度指数、物种多样性阈值和Margalef物种丰富度均值分别为1.115、0.450、0.527和1.518, 非汛期分别为1.258、0.522、0.666和2.236.浮游植物多样性的时间规律为汛期 < 非汛期.
3) 浮游植物群落特征与水质关联性较强, 水质较好区域(如淀区中心)物种多样性指数和均匀度均较高, 反正在水质较差区域(如府河、孝义河等汇入口)物种多样性指数和均匀度较低.
4) 影响汛期浮游植物群落特征的关键因素为TP和DO浓度, 影响非汛期浮游植物群落特征的关键因素为CODMn和TP浓度, 因此不同时期需对不同环境因子予以关注, 以保证淀区浮游植物多样性及水生态健康.
5) 白洋淀水质整体处于富营养化状态, 并且富营养化程度持续加深, 因此需采取措施保护水质, 防治水污染, 控制污染物排放总量.
5 附录附录Ⅰ~Ⅱ见电子版(DOI:10.18307/2020.0317).
| 附录Ⅰ 汛期白洋淀环境因子间的相关性矩阵 Appendix Ⅰ Correlation matrix between environmental factors in the Lake Baiyangdian in flood season |
| 附录Ⅱ 非汛期白洋淀环境因子间的相关性矩阵 Appendix Ⅱ Correlation matrix between environmental factors in the Lake Baiyangdian in non-flood season |
| [1] |
Wang ZF, Zhang W, Yang L et al. Characteristics of phytoplankton community and its relationship with environmental factors in different regions of Yilong Lake, Yunnan province, China. Environmental Science, 2019, 40(5): 2249-2257. [王振方, 张玮, 杨丽等. 异龙湖不同湖区浮游植物群落特征及其与环境因子的关系. 环境科学, 2019, 40(5): 2249-2257. DOI:10.13227/j.hjkx.201810157] |
| [2] |
Yang SQ, Zu TX, Wang HB et al. Relationship between the structure of phytoplankton community and environmental factors in the Zhangye section of Heihe River. J Lake Sci, 2019, 31(1): 159-170. [杨宋琪, 祖廷勋, 王怀斌等. 黑河张掖段浮游植物群落结构及其与环境因子的关系. 湖泊科学, 2019, 31(1): 159-170. DOI:10.18307/2019.0115] |
| [3] |
Yan GH, Yin XY, Wang X et al. Effects of environmental factors on the composition of phytoplankton community in Sankou of the Yangtze River and the Western Dongting Lake. China Environmental Science, 2019, 39(6): 2532-2540. [严广寒, 殷雪妍, 汪星等. 长江三口-西洞庭湖环境因子对浮游植物群落组成的影响. 中国环境科学, 2019, 39(6): 2532-2540. DOI:10.3969/j.issn.1000-6923.2019.06.036] |
| [4] |
Qian KM, Liu BG, Chen YW. Long term dynamics of phytoplankton functional groups in Lake Poyang during 2009-2016. J Lake Sci, 2019, 31(4): 1035-1044. [钱奎梅, 刘宝贵, 陈宇炜. 鄱阳湖浮游植物功能群的长期变化特征(2009-2016年). 湖泊科学, 2019, 31(4): 1035-1044. DOI:10.18307/2019.0402] |
| [5] |
Xu J, He P, Wang Q et al. Relationship between distribution of submerged macrophyte and water environment factors in Baiyangdian Lake in summer. Wetland Science, 2013, 11(4): 488-494. [徐杰, 何萍, 王钦等. 夏季白洋淀沉水植物分布与水环境因子的关系. 湿地科学, 2013, 11(4): 488-494. DOI:10.3969/j.issn.1672-5948.2013.04.013] |
| [6] |
Zhang B, Zhang JT, Suriguga guga et al. A comparison of co-inertia analysis and canonical correspondence analysis in plant community ordination. Chinese Journal of Plant Ecology, 2009, 33(5): 842-851. [张斌, 张金屯, 苏日古嘎等. 协惯量分析与典范对应分析在植物群落排序中的应用比较. 植物生态学报, 2009, 33(5): 842-851. DOI:10.3773/j.issn.1005-264x.2009.05.002] |
| [7] |
Zhang MY. Research on ecological environment change in Baiyangdian watershed based on RS, GIS and landscape pattern analysis[Dissertation]. Nanjing: Nanjing Normal University, 2004. [张明阳.基于RS、GIS和景观格局分析的白洋淀流域生态环境变化研究[学位论文].南京: 南京师范大学, 2004. ]
|
| [8] |
Feng JS. Phytoplankton and water quality assessment in the Lake Baiyangdian. Jiangsu Environmental Science and Technology, 1999(2): 27-29. [冯建社. 白洋淀浮游植物与水质评价. 江苏环境科技, 1999(2): 27-29.] |
| [9] |
Shen HT, Liu CQ. Canonical correspondence analysis of phytoplankton community and its environmental factors in the Lake Baiyangdian. J Lake Sci, 2008, 20(6): 773-779. [沈会涛, 刘存歧. 白洋淀浮游植物群落及其与环境因子的典范对应分析. 湖泊科学, 2008, 20(6): 773-779. DOI:10.18307/2008.0616] |
| [10] |
Wang Y, Liu LS, Shu JM et al. Community structure of phytoplankton and the water quality assessment in Lake Baiyangdian. J Lake Sci, 2011, 23(4): 575-580. [王瑜, 刘录三, 舒俭民等. 白洋淀浮游植物群落结构与水质评价. 湖泊科学, 2011, 23(4): 575-580. DOI:10.18307/2011.0413] |
| [11] |
Editorial board of "monitoring and analysis methods of water and wastewater", Ministry of Environmental Protection of the People's Republic of China eds. Monitoring and analysis methods of water and wastewater: 4th edition. Beijing: China Environmental Science Press, 2005. [国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法: 第4版.北京: 中国环境科学出版社, 2005. ]
|
| [12] |
Hu HJ, Wei YX eds. Chinese freshwater algae-System, classification and ecology. Beijing: Science Press, 2006. [胡鸿均, 魏印心.中国淡水藻类——系统, 分类及生态.北京: 科学出版社, 2006. ]
|
| [13] |
Wang X, Sun M, Wang J et al. Microcystis genotype succession and related environmental factors in Lake Taihu during cyanobacterial blooms. Microb Ecol, 2012, 64(4): 986-999. DOI:10.1007/s00248-012-0083-1 |
| [14] |
Long ZY. Study on relationship between macrobenthos and water quality response of small and medium-sized shallow lakes in western Jilin Province[Dissertation]. Changchun: Northeast Normal University, 2018. [龙振宇.吉林西部中小型浅水湖泊大型底栖动物与水质响应关系研究[学位论文].长春: 东北师范大学, 2018. ]
|
| [15] |
Cai JL, Su Y, Wen H et al. Characteristics of macrozoobenthic assemblages and their relationship with aquatic environmental factors in streams of Lake Dianchi watershed in the flood season. Environmental Science, 2011, 32(4): 982-989. [蔡佳亮, 苏玉, 文航等. 滇池流域入湖河流汛期大型底栖动物群落特征及其与水环境因子的关系. 环境科学, 2011, 32(4): 982-989. DOI:10.13227/j.hjkx.2011.04.002] |
| [16] |
Xiong L, Liu DY, Wang JL et al. Phytoplankton community structure in Lake Taiping of Anhui Province. J Lake Sci, 2016, 28(5): 1066-1077. [熊莲, 刘冬燕, 王俊莉等. 安徽太平湖浮游植物群落结构. 湖泊科学, 2016, 28(5): 1066-1077. DOI:10.18307/2016.0517] |
| [17] |
Wang MC, Liu XQ. Evaluate method and classification standard on lake eutrophication. Environmental Monitoring in China, 2002, 18(5): 47-49. [王明翠, 刘雪芹. 湖泊富营养化评价方法及分级标准. 中国环境监测, 2002, 18(5): 47-49. DOI:10.3969/j.issn.1002-6002.2002.05.018] |
| [18] |
The Ministry of Water Resources of the People's Republic of China ed. China water resource bulletin. Beijing: China Water & Power Press, 2005. [中华人民共和国水利部.中国水资源公报.北京: 中国水利水电出版社, 2005. ]
|
| [19] |
Liu LF, Xu ZX, Yin XW et al. Response of aquatic organism richness to physiochemical factors at different regions in Jinan City. J Lake Sci, 2019, 31(4): 998-1011. [刘麟菲, 徐宗学, 殷旭旺等. 济南市不同区域水生生物与水环境因子的响应关系. 湖泊科学, 2019, 31(4): 998-1011. DOI:10.18307/2019.0406] |
| [20] |
Kuang QJ, Hu ZY, Zhou GJ et al. Investigation on phytoplankton in Xiangxi river watershed and the evaluation of its water quality. Journal of Wuhan Botanical Research, 2004(6): 507-513. [况琪军, 胡征宇, 周广杰等. 香溪河流域浮游植物调查与水质评价. 武汉植物学研究, 2004(6): 507-513. DOI:10.3969/j.issn.2095-0837.2004.06.007] |
| [21] |
Wu TH, Liu JS, Deng JM et al. Community structure of phytoplankton and bioassessment of water quality in a large water-carrying lake, Lake Hongze. J Lake Sci, 2019, 31(2): 440-448. [吴天浩, 刘劲松, 邓建明等. 大型过水性湖泊——洪泽湖浮游植物群落结构及其水质生物评价. 湖泊科学, 2019, 31(2): 440-448. DOI:10.18307/2019.0213] |
| [22] |
Li Y, Li QH, Chen WS et al. Dynamic changes of metazooplankton community structure in Sanbanxi Reservoir, Guizhou Province. J Lake Sci, 2016, 28(2): 340-349. [李钥, 李秋华, 陈文生等. 贵州三板溪水库后生浮游动物群落结构的动态变化. 湖泊科学, 2016, 28(2): 340-349. DOI:10.18307/2016.0214] |
| [23] |
Fang LJ, Liu DF, Yang ZJ et al. Effects of water temperature on the phytoplankton community structure. Environmental Science & Technology, 2014, 37(S2): 45-50. [方丽娟, 刘德富, 杨正健等. 水温对浮游植物群落结构的影响实验研究. 环境科学与技术, 2014, 37(S2): 45-50.] |
| [24] |
Jun S, Wang DB, Zhou JH et al. Community structures of phytoplankton and its relationship with environmental factors in the Lhasa River. Acta Ecologica Sinica, 2019, 39(3): 787-798. [君珊, 王东波, 周健华等. 拉萨河流域浮游植物群落结构特征及与环境因子的关系. 生态学报, 2019, 39(3): 787-798.] |
| [25] |
Li YM, Zhao Q, Feng GP et al. The diatom assemblages and their response to different environments of Baiyangdian Lake, China. Acta Ecologica Sinica, 2010, 30(17): 4559-4570. [李亚蒙, 赵琦, 冯广平等. 白洋淀硅藻分布及其与水环境的关系. 生态学报, 2010, 30(17): 4559-4570.] |
| [26] |
Jin L, Li LY, Zhou Y et al. Phytoplankton community and water quality analysis of three typical waters in Baiyangdian Lake. Journal of Hebei University:Natural Science Edition, 2017, 37(3): 329-336. [金磊, 李林钰, 周杨等. 白洋淀三大典型水域浮游植物群落及水质评价. 河北大学学报:自然科学版, 2017, 37(3): 329-336.] |
| [27] |
Liu JP, Qu L, Liu XQ et al. Effects of different nutrient conditions on the growth of algae in surface water. Environmental Engineering, 2016, 34(S1): 407-410. [刘俊鹏, 屈亮, 刘信勇等. 不同营养条件对地表水藻类生长的影响. 环境工程, 2016, 34(S1): 407-410.] |
| [28] |
Yu Y, Peng FL, Sun C et al. Analysis on the characteristics and impact factors of water bloom in the lake. Environmental Monitoring in China, 2017, 33(2): 88-94. [于洋, 彭福利, 孙聪等. 典型湖泊水华特征及相关影响因素分析. 中国环境监测, 2017, 33(2): 88-94.] |
| [29] |
Reynolds CS, Huszar V, KruK C et al. Towards a functional classication of the freshwater phytoplankton. Journal of Plankton Research, 2002, 24(5): 417-428. DOI:10.1093/plankt/24.5.417 |
| [30] |
Chen HT. The ecological study of phytoplankton community in the Baiyangdian Lake[Dissertation]. Baoding: Hebei University, 2007. [沈会涛.白洋淀浮游植物的群落生态学研究[学位论文].保定: 河北大学, 2007. ]
|
 2020, Vol. 32
2020, Vol. 32