(2: 南京林业大学生物与环境学院, 江苏省环境工程重点实验室, 南京 210037)
(3: 中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 210008)
(2: Key Laboratory of Environmental Engineering of Jiangsu Province, College of Biology and the Environment, Nanjing Forestry University, Nanjing 210037, P. R. China)
(3: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
近年来全球淡水湖泊富营养化加剧,浮游藻类和水生植物过度生长,引起广泛关注[1].藻类和植物的生长、衰亡、裂解等过程会释放大量的自生源可溶有机质(DOM)进入湖泊水体,造成背景浓度显著升高[2]. DOM的结构复杂,富含蛋白质、腐殖质和多糖等亲水、疏水物质,这些组分内部的化学基团赋予DOM很强的生物、化学活性[3].其中,化学吸附是影响DOM浓度、组成及结构的重要环境行为之一[4].
DOM在沉积物界面的吸附行为不仅是影响湖泊碳库的关键因素,而且也可改变沉积物的有机组成,从而影响无机、有机污染物的生物地球化学循环[5-6].针铁矿是沉积物中普遍存在的一种较稳定的铁氧化矿物,由进入湖区沉积物上层的铁质溶解,在氧化条件下形成三价态,并与氧、氢氧根离子结合形成,在太湖、滇池等富营养化湖泊中分布广泛[7-8].同时,因其比表面积较高,反应活性较强,针铁矿对DOM及有机污染物等具有很强的吸附潜力[6]. DOM中不同分子对矿物的亲和力不同,因此与矿物接触时亲和力较高的分子通常优先被吸附,而亲和力较弱的分子仍留在水相中,从而造成非均质吸附.据文献报道[9-10],富含芳香族、羧基以及疏水物质的DOM对铁铝氧化物的亲和力很强;也有研究表明针铁矿对胡敏酸中大分子组分的吸附能力较强[11],而DOM中氧基含量低(醇和醚)的小分子组分不易被氢氧化铁吸附[10].然而,目前针铁矿对自生源DOM的吸附研究很少.与腐殖质相比,藻源DOM(ADOM)和草源DOM(MDOM)相对新鲜,富含类蛋白物质,腐殖度很低,因此它们与针铁矿的相互作用可能不同于以往的腐殖质研究.特别是,随着蓝藻水华暴发和水生植物过度生长加剧,ADOM和MDOM已成为湖泊碳库的重要来源,有必要深入研究它们在泥水界面的吸附行为.
三维荧光光谱法(EEM)是一种快速、灵敏、无损地分析DOM组成和结构变化的常用方法[12-14].不过由于DOM的EEM图谱复杂,不同荧光物质的荧光峰可能重叠,导致后续分析困难.近年来,EEM结合平行因子分析(EEM-PARAFAC)可从多个EEM数据集中提取最小残差的独立荧光组分,有利于跟踪分析不同DOM组分的环境行为[3, 15],也为研究DOM组分在针铁矿表面的吸附分离特征提供了契机.本研究选取太湖藻型湖区的铜绿微囊藻(Microcystis aeruginosa)和草型湖区的马来眼子菜(Potamogeton malaianus)作为代表,通过批量实验考察针铁矿对ADOM和MDOM的吸附行为,运用吸附动力学和吸附等温线模型分析DOM的吸附过程,并结合EEM-PARAFAC解析不同DOM组分的非均质吸附特征,为理解富营养化湖泊中自生源DOM与沉积物矿物的相互作用及对污染物迁移转化的影响特征提供理论依据.
1 材料和方法 1.1 针铁矿和DOM的制备以Fe(NO3)3和NaOH为原料,按碱性法制备针铁矿[16].该方法制备的针铁矿颗粒尺寸大于天然针铁矿[17].经X射线衍射和红外光谱鉴定,合成产物主要为α-FeOOH.经N2吸附BET法测定针铁矿的表面积为45.08 m2/g(ASAP 2020, Micromeritics, USA).
于2017年8月在太湖梅梁湾和胥口湾分别采集铜绿微囊藻浆和马来眼子菜作为浮游藻类和水生植物样本.采集后去除杂质,经冻干、研磨后,添加5 g样本到含有1 L Milli-Q水的无机玻璃瓶中,于室温下避光振荡[14].经5天后,DOM释放量达到峰值时,离心、过滤(0.7 μm玻璃纤维滤膜,预烧)上清液,将滤液置于4℃条件下透析以去除无机盐和小分子有机物.透析袋孔径为3500 D[18],透析时间为24 h,重复3次.经测定,透析过程中ADOM和MDOM的DOC浓度损失分别为15%和11%.最终,将得到的2种DOM溶液冻存备用.
1.2 吸附动力学和等温线分别取30 mL的ADOM和MDOM溶液(DOC浓度为30 mg/L)置于一系列50 mL无机玻璃管中,同时添加1.30 g/L针铁矿、0.01 mol/L NaCl及100 mg/L NaN3(微生物抑制剂),用HCl和NaOH调节pH值为7.0±0.2.用聚四氟乙烯塞封口后,在25℃条件下避光振荡(120 r/min).分别于第0.25、0.5、1、2、4、6、12、24 h取出样品,离心、过滤(0.45 μm玻璃纤维滤膜)上清液,测定滤液的DOC浓度.
在相同实验条件下,以针铁矿浓度为1.30 g/L,DOC浓度为0~70 mg/L,开展针铁矿对ADOM和MDOM的吸附等温线研究.依据动力学实验结果设定平衡时间为8 h,待吸附平衡后取出样品,离心、过滤上清液,测定最终滤液的DOC浓度和EEM光谱.以DOC浓度为零作为对照组.另外,收集离心管中残留的针铁矿样品,测定红外光谱.本研究中实验均设置3个平行样,取平均值.
1.3 分析方法DOC浓度通过总有机碳分析仪检测不可吹脱有机碳(TOC-Vcph,岛津)测得. DOM吸收光谱由UV-Vis光谱仪(UV-2550,岛津)测定,检测单元长度1 cm,波长范围200~800 nm,间隔1 nm,狭缝宽度1 nm,扫描速度210 nm/min.根据254 nm处的吸收值和DOC浓度计算SUVA254[19].运用指数函数对275~295和350~400 nm的吸收光谱进行非线性拟合得到S275-295和S350-400,计算两者的比值为SR[19]. EEM光谱通过荧光光谱仪(F-7000,日立)测定,灯源为700 V氙灯,扫描发射波长250~550 nm,间隔1 nm,扫描激发波长200~450 nm,间隔5 nm,扫描速度2400 nm/min,激发和发射狭缝带宽均为5 nm,以Milli-Q水作为空白参比.采用MATLAB的drEEM工具箱对EEM光谱依次进行水拉曼散射峰校正、内滤效应校正及瑞利散射效应校正,并将校正后的荧光强度标准化为Raman Unit 275 nm(RU275)消除灯源的日常误差[20].通过计算激发波长为254 nm,发射扫描区域分别为435~480和300~345 nm的荧光强度比值获得腐殖度指数(HIX)[19].将吸附前后的针铁矿样品冻干、混匀,通过Smart iTR ATR Nicolet iS 10 FTIR光谱仪(Thermo Nicolet, USA)采集红外光谱,扫描波长4000~650 cm-1,扫描次数64次,分辨率4 cm-1.使用Nicolet OMNIC软件(Thermo, USA)对采集的红外光谱进行平滑处理和基线校正,并转换成吸光度.
1.4 数值分析 1.4.1 EEM-PARAFAC分析PARAFAC分析是通过交替最小二乘法把所有样品的EEM数据矩阵分解成3个线性项和1个残留数组,进而分离出数学和化学独立的组分(每个组分代表单独或强烈共变化的荧光团)[20].矩阵公式为:
| $ {X_{ijk}} = \sum\nolimits_{f = 1}^F {{a_{if}} \cdot {b_{if}} \cdot {c_{kf}} + {e_{ijk}}} $ | (1) |
式中,i=1、2、…、I; j = 1、2、…、J; k = 1、2、…、K;f为某个荧光组分;F为荧光组分总数目;e为残差.用drEEM工具箱对EEM进行运算,并用残差分布和“S4T6C3”算法验证模型有效性.设定每个荧光组分的最大荧光强度(Fmax)与其浓度呈固定比例.
1.4.2 吸附动力学模型采用伪一级动力学模型拟合吸附过程,该模型已广泛用于考察无机矿物固相界面的吸附行为[21],公式为:
| $ {Q_{\rm{t}}} = {Q_{\rm{e}}}(1 - {{\rm{e}}^{_{ - {k_t} \cdot t}}}) $ | (2) |
式中,Qt为t(h)时针铁矿对DOM的吸附量(mg/g),Qe为平衡时针铁矿对DOM的吸附量(mg/g),kt为伪一级动力学常数(h-1).
1.4.3 吸附等温线模型分别采用Langmuir和Freundlich模型拟合吸附等温线,其中前者适于描述匀质表面的吸附数据,而后者适于表征非匀质表面的吸附行为[22-23]. Langmuir和Freundlich模型如式(3)和式(4)所示:
| $ {Q_{\rm{e}}} = \frac{{{Q_{\max }} \cdot {K_{\rm{L}}} \cdot {C_{\rm{e}}}}}{{1 + {K_{\rm{L}}} \cdot {C_{\rm{e}}}}} $ | (3) |
| $ {Q_{\rm{e}}} = {K_{\rm{f}}} \cdot C_{\rm{e}}^N $ | (4) |
式中,Qe为平衡浓度为Ce(mg/L)时针铁矿对DOM的吸附量(mg/g),Qmax为饱和吸附量(mg/g),KL为与吸附力有关的Langmuir吸附平衡常数(L/mg),Kf为Freundlich吸附平衡常数((mg/g)/(mg/L)N),N为非线性系数.
2 结果与讨论 2.1 DOM表征2种DOM的UV-Vis光谱如图 1a所示,随波长增加,DOM的吸光度逐渐降低. MDOM的吸光度高于ADOM,表明含有更多的芳香物质和官能团.与此一致,ADOM的SUVA254显著低于MDOM(表 1).通常SUVA254 < 3 L/(mg·m)说明254 nm处主要为无吸收的脂肪族物质,但也可能存在一定的芳香性结构,而>3 L/(mg·m)则意味着具有相当含量的芳香疏水物质[19]. SR值一般与DOM平均分子量呈反比,故ADOM的平均分子量较高,这可能与藻体释放的生物大分子有关.如图 1b和1c所示,2种DOM的EEM图谱中主要荧光峰的发射波长均小于380 nm,与羟基、氨基等官能团相关.据文献报道[3],类腐殖荧光团的发射波长往往大于380 nm,而小于380 nm的荧光团主要为类蛋白物质. MDOM的HIX值高于ADOM,这与前人研究发现藻型湖区沉积物DOM中类蛋白物质含量高于草型湖区沉积物DOM的报道一致[24].
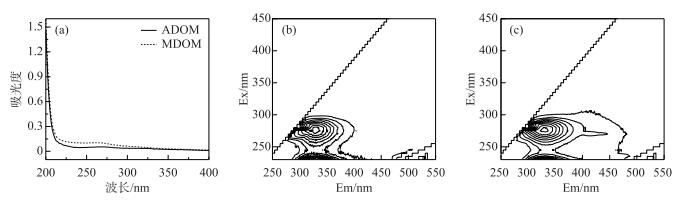
|
图 1 ADOM和MDOM的光谱图:(a)UV-Vis光谱,(b)和(c)EEM光谱 Fig.1 Spectra of ADOM and MDOM: (a) UV-Vis spectra, (b) and (c) EEM spectra |
| 表 1 ADOM和MDOM的光谱特征 Tab. 1 Optical characteristics of ADOM and MDOM |
运用EEM-PARAFAC分析共得到4个荧光组分,经半检验分析证实该模型有效(图 2).参考前人研究基于荧光峰的位置识别荧光组分[15, 25],组分C1在Ex 240, 260/ Em 440 nm处存在两个荧光峰,可归为类富里酸组分.组分C2分别在Ex 230, 265/Em 302 nm处中存在荧光峰,与类蛋白物质中的类酪氨酸组分相似.组分C3的两个荧光峰分别位于Ex 230, 275/Em 332 nm,可归为类色氨酸物质.组分C4的荧光峰位于Ex 280, 360/Em 448 nm,与类胡敏酸物质的荧光特征相似.这4个荧光组分均已在太湖水体中检出[2],说明浮游藻类和水生植物是DOM的重要来源.根据各个组分的Fmax值,发现类蛋白组分(C2和C3)是ADOM和MDOM的主要荧光物质,分别占总荧光组分的93%和70%,而类腐殖质物质,尤其是长发射波长的类腐殖质组分的含量很低.与陆源输入为主的河流、污水及土壤DOM等相比[25-27],藻源和草源DOM相对新鲜,类蛋白含量高,腐殖度低.这些特有的组分特征可能导致它们与针铁矿的吸附作用区别于典型陆源DOM的研究.
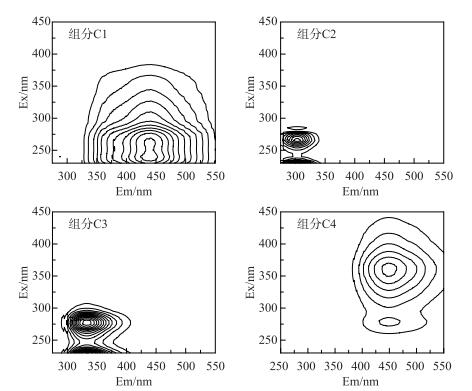
|
图 2 PARAFAC组分的EEM光谱 Fig.2 EEM spectra of PARAFAC components |
如图 3a所示,随时间推移,针铁矿对2种DOM的吸附量先快速升高,而后逐渐平衡,表观吸附平衡时间为8 h,与前人报道相近[11].初期的快吸附阶段主要为表面吸附,受DOM浓度和针铁矿固相活性位点的双重影响,而慢平衡阶段则因有效吸附位点被逐渐占据而趋于平衡.采用伪一级动力学方程较好地拟合了针铁矿对ADOM和MDOM的吸附过程(R2= 0.96)(表 2). ADOM的Kt值和Qe值均高于MDOM,表明针铁矿不仅对ADOM的吸附速率快,且平衡吸附量也较高.虽然ADOM和MDOM都是自生源DOM,但其组分结构不同,故对针铁矿的吸附亲和力也不同.
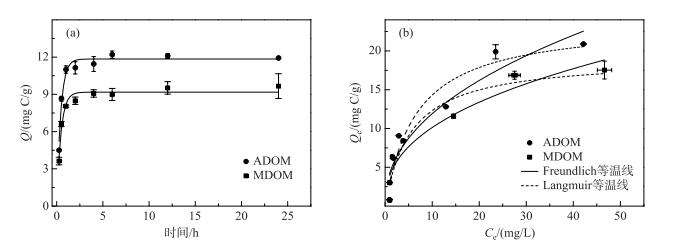
|
图 3 针铁矿对ADOM和MDOM的吸附动力学(a)和吸附等温线(b) Fig.3 Adsorption kinetics (a) and adsorption isotherms (b) of ADOM and MDOM on goethite |
| 表 2 针铁矿对ADOM和MDOM的吸附动力学和吸附等温线拟合结果 Tab. 2 Fitting results of adsorption kinetics and isotherms of ADOM and MDOM on goethite |
不同初始浓度下2种DOM的平衡吸附量如图 3b所示.随着初始浓度增加,平衡吸附量先剧烈升高,然后逐渐趋于饱和.该过程说明DOM极易被针铁矿吸附,但吸附能力有限. Langmuir等温线模型拟合性较好(R2 ≥ 0.92),其中ADOM的Qmax较高,KL值较低,表明其对针铁矿的亲和力高于MDOM,这与吸附动力学结果一致.同时,Freundlich等温线模型也较好地拟合了吸附过程(R2 ≥ 0.91).与Langmuir相比,Freundlich模型更适于描述非匀质表面的吸附数据,且N < 1,这是由于针铁矿表面的吸附位点不均匀以及DOM的组成复杂,导致吸附非线性很强.通常DOM在介质上的吸附过程均呈非线性,且分子量大、疏水性强的DOM含有更多的共轭双键,疏水作用和范德华力的吸引点位增多,从而更易被吸附[22].本研究中,针铁矿对平均分子量较高、芳香度较低的ADOM的吸附量高于MDOM,这虽与前人研究发现胡敏酸中高摩尔质量、低芳香度的组分优先被针铁矿吸附的报道一致[11],但ADOM中类胡敏酸和类富里酸组分含量远低于MDOM,说明类腐殖组分并非吸附量的决定性因素,可能更应归因于DOM中其他组分的差异.不同DOM组分的固有组成和结构使其在介质表面的吸附机制不同.据报道,蛋白质和核酸分子主要依靠电子作用力吸附到针铁矿表面[28],而蛋白质分子末端的磷酸基也可通过配位基交换与铁矿物表面形成磷铁键[17].此外,含硫的氨基酸(如半胱氨酸)也能与铁氧化物发生强烈相互作用[29].因此,2种DOM中较为丰富的类蛋白组分可能是造成针铁矿对其吸附量差异的主要原因.
2.4 PARAFAC组分的吸附进一步分析吸附过程中DOM结构及PARAFAC组分的变化.经针铁矿吸附后,2种DOM中类蛋白组分C2、C3的相比比例显著下降,而类腐殖酸组分C1、C4的相对比例明显升高(图 4a). DOM浓度和类蛋白组分的同步降低表明针铁矿吸附了DOM中大量的类色氨酸和类酪氨酸组分,而对类富里酸和类胡敏酸组分的吸附量有限,从而C1、C4的相对比例显著升高.与此一致,残留DOM的SUVA254和SR均显著高于原始DOM,证实芳香度较高、平均分子量较低的DOM组分保留在液相中(图 4b).进一步拟合PARAFAC组分的吸附等温线,发现2种DOM中C2、C3的Kf值均显著高于C1和C4,证实了针铁矿对类蛋白组分的吸附量高于类腐殖组分(表 3).不过,由于ADOM和MDOM中类腐殖组分的初始含量远低于类蛋白组分,故两种组分的吸附量差异并非完全由吸附亲和力决定,也与初始浓度密切有关.根据吸附等温线,在一定浓度范围内,吸附质的吸附量与其初始浓度呈正比.前人研究大多采用标准腐殖质或以腐殖质为主要成分的DOM,吸附过程由腐殖质主导[9, 11].然而,在以蛋白质、多糖和脂类为主要成分的微生物胞外聚合物研究中发现蛋白质在针铁矿吸附过程中占主要作用,特别是含有芳香性氨基酸的蛋白质分子更易被吸附[17].本研究中自生源DOM的主要荧光组成(C2、C3)均为类芳香族氨基酸组分(类酪氨酸和类色氨酸),所以呈现出较强的吸附特征.此外,与类蛋白物质相比,C1、C4的N值更接近于1,说明类腐殖物质在针铁矿上的吸附近似线性.这可能是由于类蛋白物质受吸附点位限制效应影响较大,在负荷较低时更易被针铁矿吸附,所以吸附呈非线性[30].被吸附DOM中类蛋白组分和类腐殖组分的比值(C2+C3)/(C1+C4)变化也证实了这一趋势[15].如图 4c所示,随吸附量升高,被吸附DOM部分的(C2+C3)/(C1+C4)显著降低.这表明吸附初期针铁矿表面有效位点较多,类蛋白物质几乎完全被吸附到针铁矿表面,而随着针铁矿表面被越来越多的DOM分子覆盖,受吸附点位(如配位基团)限制效应影响,类蛋白物质的吸附程度逐渐下降.
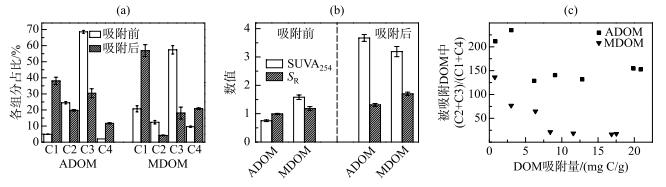
|
图 4 吸附前后ADOM和MDOM中4个PARAFAC组分的相对比例(a),吸附前后ADOM和MDOM的SUVA254和SR变化(b),以及被吸附DOM中蛋白类组分与腐殖类组分的比值随DOM吸附量的变化(c) Fig.4 Proportions of four PARAFAC components in ADOM and MDOM before and after adsorption(a), SUVA254 and SR values of ADOM and MDOM before and after adsorption (b), and (C2+C3)/(C1+C4) ratios of adsorbed DOM with increasing adsorption amount(c) |
| 表 3 针铁矿吸附4个PARAFAC组分的Freundlich等温线参数 Tab. 3 Freundlich isotherm parameters of four PARAFAC components adsorbed on goethite |
C3的Kf值高于C2,而C2的N值比C3更接近于1,意味着类色氨酸物质对针铁矿的亲和力高于类酪氨酸物质,且吸附非线性更强.通常,荧光光谱红移表明DOM组分中具有更多的饱和凝聚结构,分子质量更高. C3的发射波长长于C2,即类色氨酸组分具有较大的分子量和较高的结构缩合度.前人采用尺寸排阻色谱指出蛋白质中的高摩尔质量分子和磷酸大分子优先被针铁矿吸附[28],而富有胺基和羧化物的复杂氨基酸对针铁矿的亲和力也通常高于结构简单的氨基酸[31].此外,针铁矿对蛋白质中的芳香氨基酸组分吸附能力强于非芳香组分[17],而C3的芳香度较强,因此吸附量更高.
尽管2种DOM中C4的相对含量低于C1,但其Kf值仍较高,说明与类富里酸组分相比,类胡敏酸组分更易被针铁矿吸附.这种非均质吸附特征与2种组分的分子量、基团差异及疏水性有关.胡敏酸结构密实,平均分子质量较大,含有更多与针铁矿具有亲和力的反应基团(如羧基等)[9].相较而言,富里酸分子尺寸较小,酸度较高[32].此外,C4的疏水性强于C1,更有利于通过疏水作用与针铁矿相互作用.不过,ADOM和MDOM中大量类蛋白物质的竞争吸附也可能影响针铁矿对类富里酸和类胡敏酸组分的吸附亲和力[33].总体而言,针铁矿对DOM的非均质吸附与组分含量、分子质量、芳香度、及表面有效位点密切相关.同时,这种非均质吸附也意味着虽然DOM是一种由类蛋白物质和类腐殖质物质通过弱离散力聚集的超分子组合体[33],但一旦与针铁矿接触,这种超分子组合体极易解体,从而不同组分产生非线性吸附.
2.5 红外光谱针铁矿吸附2种DOM前后的红外光谱如图 5所示.原始针铁矿在1230和3094 cm-1波长处存在表面—OH的弯曲振动和伸缩振动特征峰,1373 cm-1处存在针铁矿的特征峰(Fe-OH弯曲模态)[34].而针铁矿吸附DOM后,其红光光谱发生明显变化,证明针铁矿吸附DOM属于化学作用.位于3094 cm-1的吸收峰强度降低,说明针铁矿表面的—OH参与吸附过程. 1770 cm-1处的—COOH特征峰强度升高,表明羧基是吸附过程中重要官能团.有文献指出DOM中羧基和羟基之间的配位交换是矿物吸附的机制之一[35]. 1550 cm-1处的氨基II的N—H弯曲和C—N伸缩振动特征峰的强度均升高,证实吸附DOM后针铁矿表面被蛋白类物质覆盖. 1373 cm-1处的特征峰消失,意味着DOM中的活性基团与针铁矿发生配位交换作用.以上结果表明氨基、羧基与表面活性基团(如羟基)的配位交换及络合是ADOM和MDOM与针铁矿结合的重要机制.

|
图 5 针铁矿吸附DOM前后的红外光谱 Fig.5 Infrared spectra of goethite before and after DOM adsorption |
针铁矿吸附DOM后其表面有机组分发生非均质改变,影响其生物化学活性.针铁矿优先吸附ADOM和MDOM中的类蛋白物质,这可能是前人研究发现太湖沉积物DOM富含蛋白类组分的重要原因之一[26].通常,类蛋白物质的生物活性高于类腐殖物质[27],因此针铁矿吸附的大量蛋白类组分可为其表面附着的微生物提供碳源和能量,进而改变群落结构和功能.此外,DOM也可能影响针铁矿对重金属及有机污染物的吸附作用.据文献报道[36],基于类蛋白物质对新型有机污染物(特别是抗生素)具有很强的络合作用,针铁矿吸附DOM后其表面的有效吸附位点增加,从而污染物的钝化作用增强.但是,因存在无机离子的干扰可能性,分子光谱(尤其是吸收和荧光光谱)仅能够提供针铁矿与DOM相互作用的宏观信息,具有一定的不确定性.未来有必要采用更准确的手段(如高分辨率质谱和同位素等)对ADOM和MDOM的吸附特征进一步探究.总体而言,蓝藻水华暴发和水生植物过量生长产生的自生源DOM可以覆盖沉积物矿物表面,对湖泊沉积物的生物地球化学行为具有重要影响.
3 结论1) ADOM和MDOM类蛋白组分含量均高于类腐殖组分,且ADOM中类蛋白质组分含量更高.
2) 针铁矿对2种DOM的吸附过程符合伪一级动力学,其中类蛋白物质含量更高的ADOM吸附速率更快;Langmuir和Freundlich吸附等温线可表征吸附热力学,且ADOM的饱和吸附量高于MDOM.
3) DOM中不同组分的吸附量与组分浓度和结构有关,类蛋白物质是针铁矿吸附ADOM和MDOM过程中的优势组分,其中分子量较大、芳香度较高的类色氨酸组分的吸附量高于类酪氨酸组分.
4) DOM中氨基、羧基等官能团是与针铁矿发生界面吸附反应的重要活性基团.
| [1] |
Wang YP, Zhu GW, Hong DL et al. Environmental characteristics of sediment-water interface of phytoplankton and macro-phyte dominated zones in Lake Taihu. J Lake Sci, 2013, 25(2): 199-208. [王永平, 朱广伟, 洪大林等. 太湖草/藻型湖区沉积物-水界面环境特征差异. 湖泊科学, 2013, 25(2): 199-208. DOI:10.18307/2013.0204.] |
| [2] |
Zhou YQ, Jeppesen E, Zhang YL et al. Chromophoric dissolved organic matter of black waters in a highly eutrophic Chinese lake:Freshly produced from algal scums? Journal of Hazardous Materials, 2015, 299:222-230. Journal of Hazardous Materials, 2015, 299: 222-230. DOI:10.1016/j.jhazmat.2015.06.024 |
| [3] |
Ishii SKL, Boyer TH. Behavior of reoccurring PARAFAC components in fluorescent dissolved organic matter in natural and engineered systems:A critical review. Environmental Science & Technology, 2012, 46(4): 2006-2017. |
| [4] |
Avneri-Katz S, Young RB, Mckenna AM et al. Adsorptive fractionation of dissolved organic matter (DOM) by mineral soil:Macroscale approach and molecular insight. Organic Geochemistry, 2017, 103: 113-124. DOI:10.1016/j.orggeochem.2016.11.004 |
| [5] |
Liang P, Li YC, Zhang C et al. Effects of salinity and humic acid on the sorption of Hg on Fe and Mn hydroxides. Journal of Hazardous Materials, 2013, 244: 322-328. |
| [6] |
Guo XT, Zhang J, Ge JH et al. Sorption and photodegradation of tylosin and sulfamethazine by humic acid-coated goethite. Rsc Adv, 2015, 122(5): 100464-100471. |
| [7] |
Hung ZC, Liu GB. Characteristics of ferruginous concretions in modern sediments of the Taihu Lake:Implications for the origin of Lake Taihu. Acta Sedimentologica Sinica, 2014, 32(3): 503-509. [黄志诚, 刘冠邦. 太湖现代沉积物中铁质结核特征:对太湖形成机制的探讨. 沉积学报, 2014, 32(3): 503-509.] |
| [8] |
Zhang XZ, Wang YF, Lei HY. Authigenic mineralogy, depositional environments and evolution of fault-bounded lakes of the Yunnan Plateau, south-western China. Sedimentology, 1996, 43(2): 367-380. DOI:10.1046/j.1365-3091.1996.d01-10.x |
| [9] |
Safiur RM, Whalen M, Gagnon GA. Adsorption of dissolved organic matter (DOM) onto the synthetic iron pipe corrosion scales (goethite and magnetite):Effect of pH. Chemical Engineering Journal, 2013, 234: 149-157. DOI:10.1016/j.cej.2013.08.077 |
| [10] |
Lv J, Zhang S, Wang S et al. Molecular-scale investigation with ESI-FT-ICR-MS on fractionation of dissolved organic matter induced by adsorption on iron oxyhydroxides. Environmental Science & Technology, 2016, 50(5): 2328-2336. |
| [11] |
Qin X, Liu F, Wang G et al. Fractionation of humic acid upon adsorption to goethite:Batch and column studies. Chemical Engineering Journal, 2015, 269: 272-278. DOI:10.1016/j.cej.2015.01.124 |
| [12] |
Huang CC, Li YM, Wang Q et al. Components optical property of CDOM in Lake Taihu based on three-dimensional excitation emission matrix fluorescence. J Lake Sci, 2010, 22(3): 375-382. [黄昌春, 李云梅, 王桥等. 基于三维荧光和平行因子分析法的太湖水体CDOM组分光学特征. 湖泊科学, 2010, 22(3): 375-382. DOI:10.18307/2010.0309.] |
| [13] |
Sun W, Gong XL, Chen Y et al. Photochemical degradation of the algae-derived dissolved organic matter in Lake Taihu. J Lake Sci, 2018, 30(1): 91-101. [孙伟, 巩小丽, 陈煜等. 太湖藻源溶解性有机质光化学降解研究. 湖泊科学, 2018, 30(1): 91-101. DOI:10.18307/2018.0109.] |
| [14] |
Yang L, Hur J. Critical evaluation of spectroscopic indices for organic matter source tracing via end member mixing analysis based on two contrasting sources. Water Research, 2014, 59: 80-89. DOI:10.1016/j.watres.2014.04.018 |
| [15] |
Lee B, Seo Y, Hur J. Investigation of adsorptive fractionation of humic acid on graphene oxide using fluorescence EEM-PARAFAC. Water Research, 2015, 73: 242-251. DOI:10.1016/j.watres.2015.01.020 |
| [16] |
Schwertmann U, Cornell RM. Iron oxides in the laboratory:Preparation and characterization. Weinheim:WILEY-VCH, 2000. |
| [17] |
Liu X, Eusterhues K, Thieme J et al. STXM and NanoSIMS investigations on EPS fractions before and after adsorption to goethite. Environmental Science & Technology, 2013, 47(7): 3158-3166. |
| [18] |
Wang L, Liang N, Li H et al. Quantifying the dynamic fluorescence quenching of phenanthrene and ofloxacin by dissolved humic acids. Environmental Pollution, 2015, 196: 379-385. DOI:10.1016/j.envpol.2014.10.029 |
| [19] |
Hansen AM, Kraus TEC, Pellerin BA et al. Optical properties of dissolved organic matter (DOM):Effects of biological and photolytic degradation. Limnology and Oceanography, 2016, 61(3): 1015-1032. DOI:10.1002/lno.10270 |
| [20] |
Murphy KR, Stedmon CA, Graeber D et al. Fluorescence spectroscopy and multi-way techniques. Analytical Methods, 2013, 23(5): 6557-6566. |
| [21] |
Wu P, Wen Y, Xiang Y et al. Sorption of pyrene by clay minerals coated with dissolved organic matter (DOM) from landfill leachate. Journal of Chemistry, 2015, 2015: 1-10. |
| [22] |
Gu B, Schmitt J, Chen Z et al. Adsorption and desorption of different organic matter fractions on iron oxide. Geochimica et Cosmochimica Acta, 1995, 59(2): 219-229. DOI:10.1016/0016-7037(94)00282-Q |
| [23] |
Wu H, Lin Y, Wu J et al. A preliminary study of surface adsorption of iron oxide minerals for phenol and DOM. Earth Science Frontiers, 2008, 15(6): 133-141. DOI:10.1016/S1872-5791(09)60013-0 |
| [24] |
Xu H, Yu G, Yang L et al. Combination of two-dimensional correlation spectroscopy and parallel factor analysis to characterize the binding of heavy metals with DOM in lake sediments. Journal of Hazardous Materials, 2013, 263: 412-421. DOI:10.1016/j.jhazmat.2013.09.042 |
| [25] |
Cory RM, Kaplan LA. Biological lability of streamwater fluorescent dissolved organic matter. Limnology and Oceanography, 2012, 57(5): 1347-1360. DOI:10.4319/lo.2012.57.5.1347 |
| [26] |
Saadi I, Borisover M, Armon R et al. Monitoring of effluent DOM biodegradation using fluorescence, UV and DOC measurements. Chemosphere, 2006, 63(3): 530-539. DOI:10.1016/j.chemosphere.2005.07.075 |
| [27] |
Fu QL, He JZ, Blaney L et al. Roxarsone binding to soil-derived dissolved organic matter:Insights from multi-spectroscopic techniques. Chemosphere, 2016, 155: 225-233. DOI:10.1016/j.chemosphere.2016.04.033 |
| [28] |
Omoike A, Chorover J. Adsorption to goethite of extracellular polymeric substances from Bacillus subtilis. Geochimica et Cosmochimica Acta, 2006, 70(4): 827-838. DOI:10.1016/j.gca.2005.10.012 |
| [29] |
Vieira A P, Berndt G, de Souza Junior IG et al. Adsorption of cysteine on hematite, magnetite and ferrihydrite:FT-IR, Mössbauer, EPR spectroscopy and X-ray diffractometry studies. Amino Acids, 2011, 40(1): 205-214. DOI:10.1007/s00726-010-0635-y |
| [30] |
Lee BM, Hur J. Adsorption behavior of extracellular polymeric substances on graphene materials explored by fluorescence spectroscopy and two-dimensional fourier transform infrared correlation spectroscopy. Environmental Science & Technology, 2016, 50(14): 7364-7372. |
| [31] |
Noren K, Loring JS, Persson P. Adsorption of alpha amino acids at the water/goethite interface. Journal of Colloid and Interface Science, 2008, 319(2): 416-428. DOI:10.1016/j.jcis.2007.11.046 |
| [32] |
Kaiser K, Zech W. Competitive sorption of dissolved organic matter fractions to soils and related mineral phases. Soil Science Society of America Journal, 1997, 61: 64-69. DOI:10.2136/sssaj1997.03615995006100010011x |
| [33] |
Romera-Castillo C, Chen M, Yamashita Y et al. Fluorescence characteristics of size-fractionated dissolved organic matter:implications for a molecular assembly based structure? Water Research, 2014, 55:40-51. Water Research, 2014, 55: 40-51. DOI:10.1016/j.watres.2014.02.017 |
| [34] |
Liu J, Zhu RL, Xu TY et al. Interaction of polyhydroxy fullerenes with ferrihydrite:adsorption and aggregation. Journal of Environmental Sciences, 2018, 64: 1-9. DOI:10.1016/j.jes.2017.06.016 |
| [35] |
Gu B, Schmitt J, Chen Z et al. Adsorption and desorption of natural organic matter on iron oxide:mechanisms and models. Environmental Science & Technology, 1994, 28(1): 38-46. |
| [36] |
Bai LL, Cao CC, Wang CH et al. Roles of phytoplankton-and macrophyte-derived dissolved organic matter in sulfamethazine adsorption on goethite. Environmental Pollution, 2017, 230: 87-95. DOI:10.1016/j.envpol.2017.06.032 |
 2020, Vol. 32
2020, Vol. 32 

