(2: 中国科学院藻类生物学重点实验室, 武汉 430072)
(3: 中国科学院大学, 北京 100049)
(4: 江西省水利科学研究院, 南昌 330029)
(2: Key Laboratory of Algal Biology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P. R. China)
(3: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(4: Jiangxi Provincial Institute of Water Sciences, Nanchang 330029, P. R. China)
水体富营养化的防治是保护饮用水源地的重要内容,因为水体富营养化导致的水生态问题就是蓝藻水华的形成和暴发.蓝藻水华暴发最直接的生态风险和危害就是会产生对其他生物有毒的蓝藻毒素以及具有刺激性气味的异味物质.我国常见的蓝藻水华类型主要有微囊藻(Microcystis)水华、长孢藻(Dolichospermum)水华、束丝藻(Aphanizomenon)和拟柱孢藻(Cylindrospermopsis)水华等.其中微囊藻水华的研究最为关注,因为世界上超过85%以上的蓝藻水华都是微囊藻为优势种的水华,如我国的太湖、滇池[1-2];国外的维多利亚湖和伊利湖[3-4].然而随着蓝藻水华研究的深入,许多水体报道了其他蓝藻水华,或是其他蓝藻水华和微囊藻水华的季节交替现象,如韩国的汉江饮用水源地就暴发了长孢藻水华[5].长孢藻被认为是除微囊藻外的最易引发蓝藻水华的类群,与其他水华蓝藻相比,长孢藻属包含更多的种类,并且许多种类不仅被报道具有产微囊藻毒素、鱼腥藻毒素、拟柱孢藻毒素能力[6],而且能够产生多种异味物质即土腥素(geosmin)、2-甲基异茨醇(2-MIB)[7],长孢藻在水体的出现能够对水生生物以及人类健康具有潜在的威胁.
长孢藻是丝状具异形胞蓝藻,广泛生活在淡水水体.长孢藻属是Wacklin等[8] 2009年根据DNA序列和分子生物学系统证据,把具有气囊的浮游性的鱼腥藻,从鱼腥藻属(Anabaena)分离出来,形成一个独立的新属.所以目前的鱼腥藻属的种类都属于细胞无气囊结构的附着性丝状蓝藻.长孢藻属作为念珠藻目束丝藻科下的一个分支,目前在分类学上被认可的种类有55种之多[9],但在基于16S rRNA基因分子序列和系统发育分析结果发现,长孢藻属下的许多同种类的不同藻株常常无法很好地形成一簇,因此难以同形态学的鉴定结果相符[10],而16S rRNA和23S rRNA基因的转录间隔区(ITS)为在进化上高度变异,为高变区[11],其二级结构的差异可以用于原核生物同属下种的区分.因此,对水体中形成水华的长孢藻的鉴定中,有必要结合其形态学特征和分子遗传特性进行鉴定,同时对其是否具有产毒和产异味能力进行甄别,对判断水体是否具有长孢藻水华的生态风险及其预警是具有重要意义的.
位于江西九江市的柘林湖通过修河与鄱阳湖相连,其库区总容量79.2×108 m3,水域面积308 km2,连接修河流域面积9340 km2,是鄱阳湖最大的入湖湖库[12].柘林湖作为九江市的主要水源地,亦为其城乡生活污水及工业废水的去向,是集饮水源与废水为一体的湖库,其局部湖区水生态有逐步退化的迹象. 2015年,作为柘林湖3个大型饮用水源地的东渡水源地被指出存在长孢藻水华[13],其水体散发出的明显土腥异味,表明柘林湖湖区的饮用水存在着安全风险.因此有必要对在柘林湖湖中能够引发水华暴发的长孢藻种类进行更为深入的研究,特别是从水体分离长孢藻藻株为起点的形态特征和分子特征的研究,进行准确的鉴定.因此本研究对柘林湖不同区域采集新鲜水样进行初步判断鉴定,并从中分离纯化培养获得长孢藻藻株,利用其形态学特征和16S rRNA基因的系统发育及16S-23S rRNA的ITS基因的二级结构比对,对所获得的长孢藻进行准确的鉴定.通过与鄱阳湖中分离的长孢藻藻种对比,推断鄱阳湖长孢藻的可能发生源,进一步分析长孢藻水华的扩散路径,从而消除异地蓝藻水华而引起的大范围的蓝藻暴发.同时检测其是否具有产毒产异味的潜力,为柘林湖的水质管理与水体利用提供科学依据.
1 材料与方法 1.1 样品的采集于2019年4-12月,分别在柘林湖的西海燕码头(29°15′53″N,115°6′21″E)、宋溪湾(29°15′53″N,115°6′21″E)、东渡取水口(29°15′41″N,115°7′39″E)、巾口码头(29°18′37″N,115°15′35″E)、排污口(29°16′41″N,115°8′58″E)、柘林库大坝(29°12′34″N,115°29′34″E)共设置6个采样点.使用25#浮游生物网对水表至0.5 m深的表层水以20~30 cm/s的速度缓慢以“∞”形来回拖动浮游生物网富集水表浮游植物.
1.2 藻株分离及培养采用经典的毛细管分离法:将巴氏吸管置于酒精灯上,加热制为不同孔径的毛细管(Psateur Micropipette),把采集的混有长孢藻的水样滴在凹形玻璃片凹处,置于解剖镜下用毛细管吸取单根藻丝于含有CT培养基的24孔板中.在温度25℃,光照强度为30 μmol protons/(m2·s),光照周期为12 h:12 h(L:D)的光照培养箱中培养约30天,并于倒置显微镜下观察24孔板,将获得长孢藻纯藻株的培养孔转接至含有10 mL CT培养基的玻璃试管中进行保种.
1.3 藻株的形态观察使用外接数码相机(DS-Ri1)的Nikon Eclipse 80i型光学显微镜,观察长孢藻藻株形态,并通过附带的分析软件NIS-Elements D3.2对不同类型的细胞(营养细胞、异形胞、厚壁孢子)进行测量.
1.4 藻株的DNA提取、PCR及克隆对藻株生物量进行低速离心富集,使用传统的CTAB法提取藻株DNA.选取16S rRNA、16S-23S rRNA间的ITS基因(引物如表 1)进行PCR扩增,PCR反应体系为50 μL,即:5~10 ng模板DNA,1 U Taq DNA聚合酶,2×PCR缓冲液(含1.5 mmol/L MgCl2,10 pmol引物,200 mmol/L dNTPs),dd H2O补足体系.反应条件为:94℃预变性3 min,接着35个循环反应,94℃变性30 s,55℃退火30 s,72℃延伸30 s,72℃终延伸5 min. PCR扩增产物经过1%琼脂糖凝胶电泳检测,切下目的片段,通过BioFlux胶回收试剂盒回收.用pMD-18T载体进行连接,转入大肠杆菌DH5α感受态细胞,挑取具氨苄抗性的阳性克隆进行测序.
| 表 1 本研究所用的引物序列 Tab. 1 Primers used in this study |
将获得的序列在NCBI上进行BLAST比对,然后在GenBank(http://www.ncbi.nlm.nih.gov)数据库中获得的相关基因序列,用MAFFTv.7.321进行多重序列比对[16],运用Mega v7.0.14软件选择序列保守区,用于系统发育树的构建.系统发育树的构建选择最大似然法(ML),用Mrmodeltest v.2.3软件对多重序列比对结果选择核酸替代模型(GTR+I+G)[17]进行贝叶斯(BI)和最大似然法(ML)分析,利用iqtree(http://iqtree.cibiv.univie.ac.at/)进行ML进化树的构建[18],步展值(Bootstrap value)设置为1000,获得的进化树,采用Figtree v1.4.4软件展示. ITS二级结构的构建:采用BioEdit v. 7.1.3软件[19]找出ITS保守的D1-D1'、Box-B和V3螺旋,使用Mfold 3.1构建二级结构[20].本研究藻株的16S rRNA和ITS序列提交给Algae-Hub数据库,编号为AH_C000003~AH_C000026.
1.6 藻株的毒素合成基因与产异味基因检测对柘林湖长孢藻藻株使用表 2引物对进行PCR扩增以检测长孢藻藻藻株是否具有微囊藻毒素基因(mcyE)、鱼腥藻毒素-a基因(ATXs)、拟柱孢藻毒素基因(cyrJ)以及产异味的土腥素基因(geosmin).
| 表 2 蓝藻毒素合成基因和土腥素合成基因引物序列 Tab. 2 Sequences of the primers for cyanotoxin synthesis genes and geosimin synthesis gene |
从柘林湖中共分离24株长孢藻(表 3),形态学鉴定如下(图 1).

|
图 1 光学显微镜下长孢藻的形态:(a~b)近亲长孢藻,(c)卷曲长孢藻,(d)浮游长孢藻,(e~f)螺旋长孢藻 Fig.1 Filamentous form of Dolichospermum under light microscope: (a-b) D. affine; (c) D. circinale; (d) D. planctonicum; (e-f) D. spiroides |
| 表 3 柘林湖长孢藻藻株的形态特征 Tab. 3 Morphological features of Dolichospermum strains isolated from the Lake Zhelin |
藻丝呈直线,单生,自由漂浮状态,部分藻丝略弯,具有较厚的胶鞘.营养细胞具有气囊,呈圆或扁圆形,直径为7.04~11.24 μm.异形胞单个间生,呈圆形,直径为8.72~11.24 μm.厚壁孢子为椭圆形,多数藻丝单个间生,部分藻丝含多个,长为14.93~24.97 μm,宽为8.54~13.71 μm.
2.1.2 近亲长孢藻(D. affine)藻丝自由漂浮,呈直或略弯状,聚群而居,相互之间形成束状,具有胶鞘.营养细胞具有气囊,藻丝中间,营养细胞呈球形或者近球性,两端渐细,且末端营养细胞呈圆柱状,直径为3.53~7.01 μm,异形胞近球形,略大于营养细胞,直径为5.78 μm.
2.1.3 卷曲长孢藻(D. circinale)藻丝自由漂浮,螺旋盘绕,少数呈直线状,大多数不具有胶鞘.营养细胞具有气囊,呈球形或者扁球形,长略小于宽,直径为8.76~10.65 μm,藻丝螺旋直径为37.4~119.3 μm.
2.1.4 螺旋长孢藻(D. spiroides)藻丝单生,呈自由漂浮状态,藻丝呈有规律的螺旋弯曲,具有胶鞘,营养细胞具有气囊,球形或扁球形,直径为6.29~8.81 μm,且宽略大于长.部分藻丝具有多个异形胞,且异形胞近球形,为7.01~7.63 μm.藻丝的螺间距为8.1~35.6 μm,螺旋直径为27.9~45.2 μm.
2.2 分子系统分析24株长孢藻共获得24条长孢藻的16S rRNA基因序列,多序列比对构建长度为1001 bp的矩阵.通过观察16S rRNA基因构建的ML系统发育树(图 2),发现两株近亲长孢藻CHAB5815、CHAB5828与Dolichospermum affine NIES-1641的相似度均超过99%,并很好的聚在一支上.螺旋长孢藻CHAB5816、CHAB5822与未知种名长孢藻CHAB5818的形态差异很大,却聚在同一支上.卷曲长孢藻CHAB5805、CHAB5807聚在一支上,而浮游长孢藻CHAB5801、CHAB5802、CHAB58010、CHAB5831虽属同一种,但在ML系统发育树是并系类群,与日本的浮游长孢藻相距甚远,表明不同地域的各种长孢藻相互混杂,不能将长孢藻属下的不同种类很好地区分.

|
图 2 基于16S rRNA基因构建的ML系统发育树 Fig.2 ML phylogenetic tree based on 16S rRNA sequences |
本研究选取24株长孢藻的ITS基因构建二级结构,来比较长孢藻的种间差异. ITS序列中的D1-D1'、Box-B和V3螺旋用以区分同属间不同种(表 4).
| 表 4 长孢藻ITS二级结构差异(浮游长孢藻为对照) Tab. 4 Comparison of secondary structures of ITS of 16S-23S rRNA among Dolichospermum species(D. planctonicum as control) |
在D1-D1'区域中(图 3),浮游长孢藻(CHAB5801、CHAB5802、CHAB5810)、螺旋长孢藻(CHAB5808、CHAB5809、CHAB5816)、卷曲长孢藻(CHAB5805、CHAB5807)和近亲长孢藻(CHAB5815、CHAB5828)的D1-D1'螺旋结构都具有4个环状结构,且由70个碱基组成,尽管4种长孢藻物种其D1-D1'螺旋结构碱基对不同,但其D1-D1'螺旋结构相同.长孢藻CHAB5804的D1-D1'螺旋结构由68个碱基组成,紧接着基部茎的二,三双侧环状结构(3 bp,3 bp)小于浮游长孢藻的二,三双侧环状结构(5 bp,9 bp).长孢藻CHAB5804与浮游长孢藻的藻株形态虽同为直链型,但两者的D1-D1'的螺旋结构差异较大.
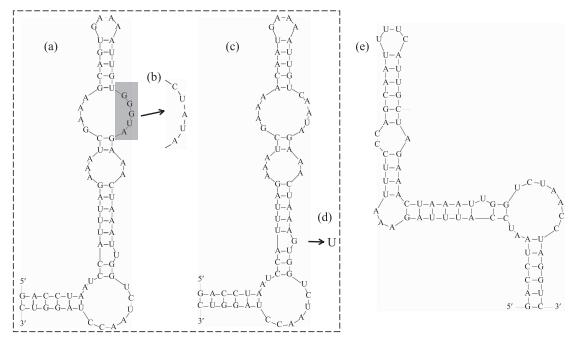
|
图 3 长孢藻的ITS二级结构(D1-D1' helix)(a:浮游长孢藻,b:螺旋长孢藻,c:近亲长孢藻,d:卷曲长孢藻,e:长孢藻CHAB5804) Fig.3 Secondary structures of the D1-D1' helix in Dolichospermum strains(a: D. planctonicum, b: D. spiroides, c: D. affine, d: D. circinale, e: Dolichospermum sp. CHAB5804) |
在Box-B区域中(图 4),浮游长孢藻(CHAB5801、CHAB5802、CHAB5810)和近亲长孢藻(CHAB5815、CHAB5828)的结构相同,都由28个碱基组成,且具有2个环状结构,但其Box-B螺旋结构的碱基不同.螺旋长孢藻(CHAB5808、CHAB5809、CHAB5816)的Box-B螺旋结构也是由28个碱基组成,且具有2个环状结构,但其顶端环状结构(7 bp)大于浮游长孢藻、近亲长孢藻的顶端环状结构(5 bp).卷曲长孢藻(CHAB5805、CHAB5807)的Box-B螺旋结构由35个碱基组成,具有两个环状结构,分别为4 bp的顶端环状结构和7 bp的双侧环状结构,与其他种类的长孢藻的环状结构差异较大.总的来说,浮游长孢藻、近亲长孢藻的Box-B结构相同,且与螺旋长孢藻、卷曲长孢藻的Box-B的螺旋结构差异较大,而螺旋长孢藻和卷曲长孢藻的Box-B螺旋结构差异明显.
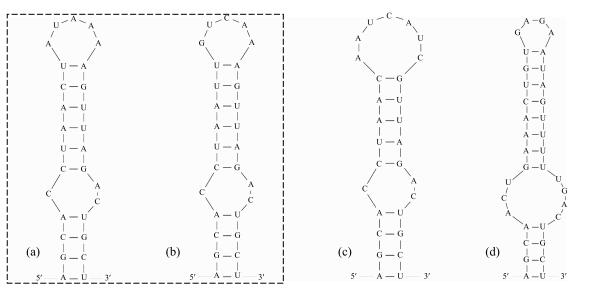
|
图 4 长孢藻的ITS二级结构(Box-B helix)(a:浮游长孢藻,b:近亲长孢藻,c:螺旋长孢藻,d:卷曲长孢藻 Fig.4 Secondary structures of the Box-B helix in Dolichospermum strains(a: D. planctonicum, b: D. affine, c: D. spiroides, d: D. circinale) |
在V3区(图 5),浮游长孢藻(CHAB5801、CHAB5802、CHAB5810)和近亲长孢藻(CHAB5815、CHAB5828)具有相同的结构,其底部为6 bp的环状结构,随后连接1个未成环的5 bp的半成环结构,再紧接着为6 bp的双侧环状结构,且其环状结构两侧分别连接1个7 bp、4 bp的环状结构,但浮游长孢藻和近亲长孢藻组成V3螺旋结构的碱基不同.螺旋长孢藻(CHAB5808、CHAB5809、CHAB5816)的V3螺旋结构与浮游长孢藻、近亲长孢藻的V3螺旋结构略有差异,螺旋长孢藻的V3螺旋结构水平方向为6 bp的环状结构,小于浮游长孢藻、近亲长孢藻水平方向的环状结构(5 bp).卷曲长孢藻(CHAB5805、CHAB5807)与浮游长孢藻、近亲长孢藻、螺旋长孢藻的V3螺旋结构差异较大,其底部为6 bp的环状结构,随之为21 bp的未成环结构,紧接着为一6 bp的双侧环状结构,顶端为一4 bp的环状结构.长孢藻CHAB5804的V3螺旋结构与卷曲长孢藻的V3螺旋结构相似,但其顶端为一6 bp的环状结构,且紧接着顶端环状结构的双侧环状结构的碱基为8 bp.

|
图 5 长孢藻的ITS二级结构(V3 helix)(a:浮游长孢藻,b:螺旋长孢藻,c:近亲长孢藻,d:卷曲长孢藻,e:长孢藻CHAB5804) Fig.5 Secondary structures of the V3 helix in Dolichospermum strains(a: D. planctonicum, b: D. spiroides, c: D. affine, d: D. circinale, e: Dolichospermum sp. CHAB5804) |
对长孢藻毒素合成基因及产异味基因进行PCR扩增,24株长孢藻均未发现微囊藻毒素、鱼腥藻毒素及拟柱孢藻毒素的合成基因;长孢藻是土腥味的主要生产者,Tsujimura等在2003年首次报道乌克兰长孢藻能够产生geosmin[25],且在维多利亚州[26]、韩国汉河[27]依次发现乌克兰长孢藻,卷曲长孢藻均有产异味基因,而本研究的浮游长孢藻CHAB5801、CHAB5810、CHAB5824、CHAB5831以及卷曲长孢藻CHAB5825也均检测出产异味基因(图 6).
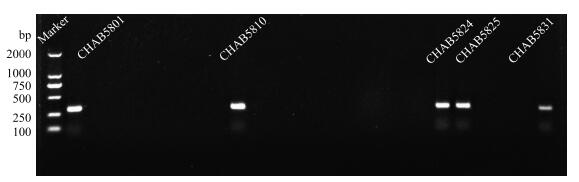
|
图 6 长孢藻geosmin基因扩增电泳图 Fig.6 Electrophoresis results from geosmin gene of Dolichospermum |
长孢藻的藻丝形态及细胞形态具有较高的多样性,大多数的长孢藻具有气囊,可调节细胞浮力,营浮游生活,所以也是水华蓝藻的一大类群. 2009年Wacklin等[8]建立长孢藻属时,提出区分长孢藻属和鱼腥藻属的形态学依据是藻丝细胞是否有气囊.藻丝的特征、异形胞、厚壁孢子的形态及是否有胶被是鉴定长孢藻属下不同种类的主要形态学特征[28],然而这些特征会因环境条件和培养时期的不同而变化[29]但是在缺少某些特征的情况下,我们综合藻丝形态和形式,营养细胞和异形胞的形态和大小等特征以鉴定到种的水平.本研究中的近亲长孢藻是唯一的藻丝成束的直型长孢藻;而卷曲长孢藻具有螺旋直径巨大的特征,这些特征比较独特地对应到种的水平.
基于16S rRNA基因序列构建的分子系统发育分析,测序所得的所有长孢藻藻株的序列都聚在长孢藻属的一支,与附着的鱼腥藻类群完全分离,说明长孢藻与鱼腥藻确实存在本质的DNA分子序列的差别.柘林湖的近亲长孢藻序列与日本的近亲长孢藻NIES-1641聚在一起,而浮游长孢藻属于并系类群,且没有与日本的浮游长孢藻NIES814聚在一起,可能由于环境因素等多方面原因导致浮游长孢藻不同的特性[30],从而引起序列差异性.从形态上来看,长孢藻CHAB5816、CHAB5822为螺旋长孢藻,和未知种名的长孢藻CHAB5818(直链型)在16S rRNA基因的系统发育聚在同一支上,说明16S rRNA基因可以用于长孢藻属的水平上的鉴定,而其种类的区分并不能单根据16S rRNA基因序列来确定.
通过显微观察藻类细胞形态,能够根据其营养细胞、异形胞及厚壁孢子鉴定长孢藻的种类,然而对于没有明显特征的藻株,却只能定义到属,并且16S rRNA基因支持这个属水平的鉴定.以前大量的研究表明,蓝藻许多属内的种类之间,可以利用16S-23S rRNA之间高度变异性的ITS基因间隔区的二级结构差异来进行鉴定[31].其中D1-D1'、Box-B和V3区域可以根据螺旋结构的不同来分离许多蓝藻属内的不同种类[32-34].但是在长孢藻属内并没有相关的研究.本研究从柘林湖所获得的24株长孢藻藻株中,大多数浮游长孢藻、螺旋长孢藻、卷曲长孢藻和近亲长孢藻的D1-D1'结构相似,而个别长孢藻Dolichospermum sp. CHAB5804的D1-D1'结构与其他23株长孢藻的D1-D1'差异较大,说明长孢藻属内的D1-D1'螺旋结构同时兼有保守性和多样性,对于长孢藻属内种水平的区分还是存在一定的局限性.在Box-B、V3区域中,浮游长孢藻和近亲长孢藻螺旋结构相同,但与螺旋长孢藻、卷曲长孢藻不同,说明Box-B、V3螺旋结构可以区分藻丝形态为直、弯的长孢藻.然而Hye等[35]发现新种Dolichospermum hangangense,其藻丝呈直线,并且与浮游长孢藻在Box-B螺旋结构不同,这与我们得出的结论不同,可能是因为柘林湖环境因子差别小,导致柘林湖的长孢藻分子结构差异较小.
因此,16S rRNA基因不能很好地在长孢藻的种水平进行区分,同时16S-23S rRNA也存在一定的局限性,而多位点序列分型(Multilocus sequence typing,MLST)作为微生物株系间多样性的工具,能够区分5500亿个多位点基因型,具有高分辨率,目前,MLST在蓝藻中只有少数用于微囊藻种间差异的研究[36-37],因此我们可以期待今后利用MLST区分长孢藻的种水平.
长孢藻是多种蓝藻毒素及异味物质的潜在生产者[38],如微囊藻毒素不仅具有肝毒性,还是潜在的遗传毒性致癌物[39-40].长孢藻所产生的异味物质多为土腥素,目前科学上关于土腥素对人体健康是否产生影响还不明确,但它仍然被认为是导致饮用水不安全的主要异味物质[41].柘林湖是九江市主要的水源地,确定湖水水体中是否含有蓝藻毒素及异味物质对柘林湖作为饮用水水源地的意义至关重要. 2015年柘林湖东渡水源地发生了长孢藻水华[13],其优势种类鉴定为水华长孢藻,为主要的水华.本研究对2019年49月间从柘林湖分离获得的24株长孢藻均检测无蓝藻毒素,并不代表着柘林湖不存在产蓝藻毒素的长孢藻,其原因可能为采样点的区域局限性.而在24株长孢藻中就发现共5株(20.83%)包括4株浮游长孢藻、1株卷曲长孢藻含有土腥素,说明柘林湖饮用水可能存在着被长孢藻异味污染的威胁.
鄱阳湖流域内湖库资源众多,柘林湖作为鄱阳湖最大的入湖湖库,是鄱阳湖流域内最大的调节湖库.以前的研究发现鄱阳湖的长孢藻种类主要有水华长孢藻、卷曲长孢藻、螺旋长孢藻[42]、与本文中研究的部分长孢藻的种类相同,存在着柘林湖中的长孢藻对鄱阳湖中的长孢藻的种源贡献的可能.对于鄱阳湖的长孢藻的种源追溯和输移路径问题,在今后的研究中将选择变异性更高的基因片段或者ITS更长的区域,基于高通量测序技术以获得柘林湖以及鄱阳湖长孢藻的大量基因型,对于这些基因型的深入比较分析,结合将来对鄱阳湖里分离的长孢藻藻种的分子特征和比较研究,可以对上述问题更加深入的认识和诠释.本研究的方法和结果,不仅对柘林湖的水华蓝藻的多样性以及潜在的生态风险提供了科学的基础资料,也在流域层面上为鄱阳湖的水生态系统研究和保护提供了一定的科学基础.
| [1] |
Wu Y, Li L, Gan N et al. Seasonal dynamics of water bloom-forming Microcystis morphospecies and the associated extracellular microcystin concentrations in large, shallow, eutrophic Dianchi Lake. Journal of Environmental Science, 2014, 26: 1921-1929. DOI:10.1016/j.jes.2014.06.031 |
| [2] |
Liu MZ, Ma JR, Kang L et al. Strong turbulence benefits toxic and colonial cyanobacteria in water:A potential way of climate change impact on the expansion of harmful algal blooms. Science of the Total Environment, 2019, 679: 613-622. |
| [3] |
Bbosa NB, Oyoo WS. Seasonal variations of phytoplankton species in Lake Victoria and the influence of iron and zinc ions on the dominant species identified during 2006-2007 studies. Lakes and Reservoirs:Research and Management, 2013, 18: 259-273. DOI:10.1111/lre.12035 |
| [4] |
Andersson AF, Riemann L, Bertilsson S et al. Pyrosequencing reveals contrasting seasonal dynamics of taxa within Baltic Sea bacterioplankton communities. Microbial Population and Community Ecology, 2010, 4: 171-181. |
| [5] |
Kim KH, Park C, Yoon Y et al. Harmful cyanobacterial material production in the North Han River (South Korea):genetic potential and temperature-dependent properties. International Journal of Environmental Research and Public Health, 2018, 15(3): 4-17. |
| [6] |
Kim KH, Yoon Y, Hong YH et al. Application of metagenome analysis to characterize the molecular diversity and saxitoxin-producing potentials of a cyanobacterial community:a case study in the North Han River, Korea. Applied Biological Chemistry, 2018, 61(2): 153-161. DOI:10.1007/s13765-017-0342-4 |
| [7] |
Liu X, Lu X, Chen Y. The effects of temperature and nutrient ratios on Microcystis blooms in Lake Taihu, China:an 11-year investigation. Harmful Algae, 2011, 10(3): 337-343. DOI:10.1016/j.hal.2010.12.002 |
| [8] |
Wacklin P, Hoffmann L, Komárek J. Nomenclatural validation of the genetically revised cyanobacterial genus Dolichospermum (Ralfs ex Bornet et Flahault) comb. nova. Fottea, 2009, 9: 59-64. DOI:10.5507/fot.2009.005 |
| [9] |
Hye JC. Morphological characterization and molecular phylogenetic analysis of Dolichospermum hangangense (Nostocales, Cyanobacteria) sp. nov. from Han River, Korea. Algae, 2018, 33(2): 143-156. DOI:10.4490/algae.2018.33.5.2 |
| [10] |
Gugger MF, Hoffmann L. Polyphyly of true branching cyanobacteria (Stigonematales). International Journal of Systematic and Evolutionary Microbiology, 2004, 54: 349-357. DOI:10.1099/ijs.0.02744-0 |
| [11] |
Mares J, Johansen JR, Hauer T et al. Taxonomic resolution of the genus Cyanothece (Chroococcales, Cyanobacteria) with a treatment on Gloeothece and three new genera, Crocosphaera, Rippkaea, and Zehria. Journal of Phycology, 2019, 55(3): 578-610. DOI:10.1111/jpy.12853 |
| [12] |
Li YM, Ai W, Luo Z et al. Distribution, relationship and significance of phytoplankton, chlorophyll-a and environment variables in spring season of the Zhelin Reservoir, Jiangxi Province. J Lake Sci, 2017, 29(3): 625-636. [李懿淼, 艾威, 罗章等. 江西柘林水库春季浮游藻类、叶绿素a与环境因子的分布、关系及意义. 湖泊科学, 2017, 29(3): 625-636. DOI:10.18307/2017.0311] |
| [13] |
Dai GF, Liu HL. Spatio-temporal variation of algae andeutrophic status of Lake Zhelin, Jiangxi Province. J Lake Sci, 2015, 27(2): 275-281. [戴国飞, 刘慧丽. 江西柘林湖富营养化现状与藻类时空分布特征. 湖泊科学, 2015, 27(2): 275-281. DOI:10.18307/2015.0211] |
| [14] |
Edward U, Rogall T. Isolation and direct complete nucleotide determination of entire genes.Characterication of a gene coding for 16S Ribosomal RNA.. Nucleic Acids Research, 1989, 17(19): 7843-7853. DOI:10.1093/nar/17.19.7843 |
| [15] |
Iteman I, Rippka R. Comparison of conserved structural and regulatory domains within divergent 16S rRNA-23S rRNA spacer sequences of cyanobacteria. Microbiology, 2000, 146(6): 1275-1286. DOI:10.1099/00221287-146-6-1275 |
| [16] |
Katoh K, Standley DM. MAFFT multiple sequence alignment software version 7:improvements in performance and usability. Molecular Biology and Evolution, 2013, 30(4): 772-780. DOI:10.1093/molbev/mst010 |
| [17] |
Darriba D, Taboada GL, Doallo R et al. ModelTest 2:more models, new heuristics and parallel computing. Nature Methods, 2012, 9(8): 772. |
| [18] |
Trifinopoulos J, Nguyen LT, von Haeseler A et al. W-IQ-TREE:a fast online phylogenetic tool for maximum likelihood analysis. Nucleic Acids Research, 2016, 44(W1): 232-235. DOI:10.1093/nar/gkw256 |
| [19] |
Hall TA. BioEdit:a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic Acid Symp Ser, 1999, 41: 95-98. |
| [20] |
Zuker M. Mfold web server for nucleic acid folding and hybridization prediction. Nucleic Acids Research, 2003, 31: 3406-3415. DOI:10.1093/nar/gkg595 |
| [21] |
Rantala A, Fewer DP, Hisbergues M et al. Phylogenetic evidence for the early evolution of microcystin synthesis. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101: 568-573. DOI:10.1073/pnas.0304489101 |
| [22] |
Ballot A, Fastner J, Lentz M et al. First report of anatoxin-a-producing cyanobacterium Aphanizomenon issatschenkoi in northeastern Germany. Toxicon, 2010, 56: 964-971. DOI:10.1016/j.toxicon.2010.06.021 |
| [23] |
Mihali TK, Kellmann R, Muenchhoff J et al. Characterization of the gene cluster responsible for cylindrospermopsin biosynthesis. Applied and Environmental Microbiology, 2008, 74: 716-722. DOI:10.1128/AEM.01988-07 |
| [24] |
Wang ZJ. The studies on genes responsible for synthesis of earthy-musty odorants in cyanobacteria and their ecological application. Wuhan:Institute of Hydrobiology, Chinese Academy of Sciences, 2012. [王中杰. 蓝藻土霉异味物质合成基因的研究及其生态应用. 武汉:中国科学院水生生物研究所, 2012.] |
| [25] |
Tsujimura S, Okubo T. Development of Anabaena blooms in a small reservoir with dense sediment akinete population, with special reference to temperature and irradiance. Journal of Plankton Research, 2003, 25(9): 1059-1067. DOI:10.1093/plankt/25.9.1059 |
| [26] |
John N, Koehler AV, Ansell BRE et al. An improved method for PCR-based detection and routine monitoring of geosmin-producing cyanobacterial blooms. Water Research, 2018, 136: 34-40. DOI:10.1016/j.watres.2018.02.041 |
| [27] |
Kim K, Park C, Yoon Y et al. Harmful cyanobacterial material production in the North Han River (South Korea):Genetic potential and temperature-dependent properties. International Journal of Environmental Research and Public Health, 2018, 15(3): 444. DOI:10.3390/ijerph15030444 |
| [28] |
Mishra S, Bhargava P, Adhikary SP et al. Weighted morphology:a new approach towards phylogenetic assessment of Nostocales (Cyanobacteria). Protoplasma, 2015, 252(1): 145-163. DOI:10.1007/s00709-014-0629-9 |
| [29] |
Watanabe M, Niiyama Y, Tuji A. Studies on planktonic blue-green algae 10 Classifcation of planktonic Anabaena with coiled trichomes maintained in the national science museum, Tokyo. National Science Museum, 2004, 30: 135-149. |
| [30] |
Duenrut C, Wichien Y, Gunjana T. Morphology, genetic diversity, temperature tolerance and toxicity of Cylindrospermopsis raciborskii (Nostocales, Cyanobacteria) strainsfrom Thailand and Japan. FEMS Microbiology Ecology, 2004, 48: 345-355. DOI:10.1016/j.femsec.2004.02.014 |
| [31] |
Wang XY, Sun MJ, Wang JM et al. Microcystis Genotype succession and related environmental factors in Lake Taihu during Cyanobacterial blooms. Microbial Ecology, 2012, 64(2): 986-999. |
| [32] |
Iteman I, Rippka R, Herdman M. Comparison of conserved structural and regulatory domains within divergent 16S rRNA-23S rRNA spacer sequences of cyanobacteria. Microbiology, 2000, 146: 1275-1286. DOI:10.1099/00221287-146-6-1275 |
| [33] |
Sciuto K, Moro I. Detection of the new cosmopolitan genus Thermoleptolyngbya (Cyanobacteria, Leptolyngbyaceae) using the 16S rRNA gene and 16S-23S ITS region. Molecular Phylogenetics and Evolution, 2016, 105: 15-35. DOI:10.1016/j.ympev.2016.08.010 |
| [34] |
Li Z, Brand J. Leptolyngbya nodulosa sp. nov (Oscillatoriaceae), a subtropical marine cyanobacterium that produces a unique multicellular structure. Phycologia, 2007, 46: 396-401. DOI:10.2216/06-89.1 |
| [35] |
Hye JC, Jae-Hyoung J. Morphological characterization and molecular phylogenetic analysis of Dolichospermum hangangense (Nostocales, Cyanobacteria) sp. nov. from Han River, Korea. Algae, 2018, 33(2): 143-156. DOI:10.4490/algae.2018.33.5.2 |
| [36] |
Tanabe Y, Kasai F, Watanabe MM. Multilocus sequence typing (MLST) reveals high genetic diversity and clonal population structure of the toxic cyanobacterium Microcystis aeruginosa. Microbiology, 2007, 153(11): 3695-3703. DOI:10.1099/mic.0.2007/010645-0 |
| [37] |
Liu MS, Cai FF, Wang YL et al. Genetic diversity and phylogenetic analysis of Microcystis in Poyang Lake based on MLST. China Environmental Science, 2019, 39(7): 3081-3087. [柳满森, 蔡芳芳, 王一郎等. 基于MLST鄱阳湖微囊藻的遗传多样性及其系统发育. 中国环境科学, 2019, 39(7): 3081-3087. DOI:10.3969/j.issn.1000-6923.2019.07.046] |
| [38] |
Xiong ZP, Song GF. A newly recorded species of fillamentous cyanobacterium-Dolichospermum mendotain in China. Acta Hydrobiologiga Sinica, 2017, 41(1): 238-243. [熊志鹏, 宋高飞. 丝状蓝藻长孢藻属的中国一新记录中——蒙氏长孢藻. 水生生物学报, 2017, 41(1): 238-243.] |
| [39] |
Grosse Y, Baan R, Straif K. Carcinogenicity of nitrate, nitrite, and cyanobacterial peptide toxins. Lancet Oncol, 2006, 7(8): 628-629. DOI:10.1016/S1470-2045(06)70789-6 |
| [40] |
Svirčev Z, Drobac D, Tokodi N. Toxicology of microcystins with reference to cases of human intoxications and epidemiological investigations of exposures to cyanobacteria and cyanotoxins. Archives of Toxicology, 2017, 91(2): 621-650. DOI:10.1007/s00204-016-1921-6 |
| [41] |
Shang LX, Feng MH. Co-occurrence of Microcystins and taste-and-odor compounds in drinking water source and their removal in a full-scale drinking water treatment plant. Toxins, 2018, 1-17. |
| [42] |
Xia L, Kui MQ. Spatial and seasonal variation in N-2-fixing cyanobacteria in Poyang Lake from 2012 to 2016:roles of nutrient ratios and hydrology. Aquatic Sciences, 2019, 81(3): 1-12. |
 2020, Vol. 32
2020, Vol. 32 


