(2: 中国石油大学(北京)重质油国家重点实验室, 北京 102249)
(2: State Key Laboratory of Heavy Oil Processing, China University of Petroleum, Beijing 102249, P. R. China)
工业革命以来,由于人类活动的加剧,导致温室气体浓度迅速上升,引发了一系列的气候和环境问题,全球碳循环受到了世界各国政府和学术界的广泛关注[1].内陆水体虽然只占据不到1 %的全球面积,但其在全球有机碳的运输、转化和储存过程中具有重要的作用[2].内陆水体每年从陆地接收2.9×1015 g碳,其中约有0.6×1015 g碳被埋藏在内陆水体系统,1.4×1015 g碳是以气体形式释放到大气,而0.9×1015 g碳通过径流被输送到海洋[3].湖泊作为重要的内陆水体要素,在全球碳循环中也扮演着重要的角色.据统计,湖泊每年的碳埋藏量约相当于海洋碳埋藏量的25 % ~58 % [4],湖泊每年的CO2排放量约相当于陆地河流向海洋输入碳的50 % [5].近年来,工农业活动和城市化导致了区域的点源和面源污染,加剧了湖泊富营养化,这不仅对湖泊生态系统造成了严重破坏[6-7],也改变了湖泊的碳循环模式[8].湖泊藻华暴发-消退的周期过程影响着湖泊有机碳循环和碳源-碳汇结构[9].首先,湖泊藻华暴发浮游藻类生产力显著增加,直接导致沉积物中碳埋藏有机碳增加[8].藻华消退之后,部分有机质进一步选择性的转化和降解并以二氧化碳和甲烷的形式释放回大气,而另一部分以相对惰性有机质的形式保存在水体和沉积物之中.因此,研究富营养化湖泊的碳循环动态变化,明晰其有机碳收支和碳源-碳汇结构,具有重要的理论和现实意义[10].
溶解性有机质(dissolved organic matter, DOM)通常是指可以通过0.45 μm滤膜的有机质,是水体有机碳循环动态过程的最直接参与者[11-15]. DOM来源于生物分泌物和残体碎屑[16],是由糖类、蛋白质类、脂类、木质素、腐殖酸等化合物组成的复杂混合体[17],其浓度和分子组成受复杂的生物反应和非生物反应的影响[18-20].因此,不同分子组成的DOM有着不同的生物可利用性和矿化稳定性,也具有不同的生物地球化学过程和归宿[21-23].精细描述湖泊富营养化背景下藻华暴发-消退周期过程的DOM分子特征演化,可以更好地理解富营养化背景下湖泊碳库的动态变化.
DOM分子组成的表征,重点在于利用谱学技术对DOM的化学键、官能团及分子空间构型进行刻画.傅立叶变换离子回旋共振质谱(Fourier transform ion cyclotron resonance mass spectrometry, FT-ICR MS)可从复杂DOM混合物中解析出数千种精确分子式,从而可以对DOM分子组成进行定性(化学活性)和半定量(相对浓度)判定[24-25].范氏图(氧碳原子数量比值O/C为x轴,氢碳原子数量比值H/C为y轴)和Kendrick质量偏差图(Kendrick质量为x轴,Kendrick质量偏差为y轴)等是使用FT-ICR MS数据来定性评价不同类别DOM分子组成差异的常用工具[26].不仅如此,研究者们已经建立了一系列划分不同DOM分子类别的标准[27-29].该技术已经广泛应用于海洋、河流、湖泊等环境介质DOM分子转化的表征及影响因素的解析[14, 17, 27, 30-33].
太湖是我国第三大淡水湖泊(水域面积2338 km2,平均水深1.9 m),兼具有调蓄、灌溉、航运、旅游和养殖等功能[34].随着城市化水平的发展,太湖成为了我国东部富营养化最严重的湖泊之一[35].太湖蓝藻水华最早可以追溯到20世纪50年代,太湖五里湖区夏季出现了大量蓝藻、隐藻、硅藻和绿藻并存的现象[36].此后,藻华逐渐向梅梁湾和竺山湾等区域扩展,持续时间延长,蓝藻开始占绝对优势[37]. 2007年太湖藻华尤为严重,引发了无锡市饮用水危机,各级政府加大了对太湖的治理力度,包括控源截污、内源清淤、引水冲调、水生态修复等[38].然而,2017年太湖又一次出现大面积的藻华,远超过2009-2016年的平均水平,表现为藻华首次暴发时间总体提前约30天[39],全年藻华次数和平均面积升高[40].其主要原因可能是,在营养盐充足的背景下,温度升高、风速较低、日照时间增长均会导致每年藻华首次暴发时间提前和暴发持续时间的延长[41].但是,与太湖蓝藻暴发与消退相关的碳循环研究依然处于起步阶段.目前仅有少数针对太湖DOM分子组成的动态变化研究,例如,在对比藻华暴发期与消退期DOM分子组成和结构方面,Zhang等[9]通过FT-ICR MS和核磁共振光谱技术,分析检测了2007年6月和2007年11月梅梁湾一个点位的DOM分子组成,发现从2007年6月到2007年11月,DOM中的小质量数分子和CHON类分子比例增加,分子多样性提高.在分析藻源DOM的生物可利用性方面,Bai等[42]通过四级推流式生物膜反应装置,验证了DOM生物可利用性与微生物群落特征间的关系,发现藻源DOM中活性/半活性分子可占总有机分子的79 %,DOM的分子活性与分解细菌群落多样性呈反比.在分析浮游藻类对水体DOM贡献方面,Liu等[43]通过FT-ICR MS和荧光技术,对太湖不同湖区的水体DOM和藻源DOM进行了对比分析,证实了藻类和水体DOM的关联性.
本研究进一步以太湖藻华暴发严重的梅梁湾为研究区域,采集2017-2018年藻华暴发-消退周期的表层水体,通过FT-ICR MS技术,解析藻华暴发-消退周期DOM的分子变化特征,进而理解浮游藻类对水体DOM的影响及其在区域碳循环中的角色.
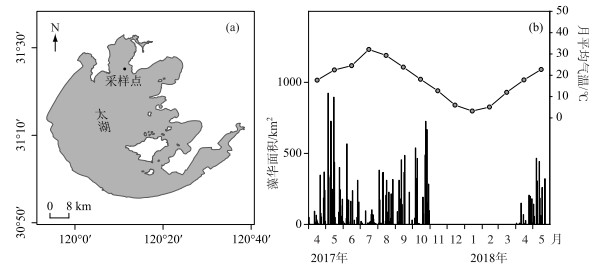
1 材料与方法本研究于2017年5月、6月、8月、11月以及2018年1月、3月、5月在太湖梅梁湾(31°25′27.21″N;120°11′17.58″E)进行采样(图 1a),共采集7个表层水样,图 1b藻华面积来自江苏环境监测网太湖蓝藻遥感监测数据(2017年11月至2018年3月无记录,数据来源于http://www.jsem.net.cn/mrygyt/thlz/);月平均温度来自无锡市气象局统计信息.由于温度是影响藻华暴发的一个关键因素[41],藻华多暴发在平均20℃左右的月份.根据太湖蓝藻遥感监测数据[39],4-10月是藻华暴发期,11月-次年3月是藻华消退期(图 1b).因此,本研究中,2017年5月、6月、8月和2018年5月采集的水样属于藻华暴发期,而2017年11月、2018年1月和3月采集的水样属于消退期.
|
图 1 太湖梅梁湾采样点(a)及2017年4月-2018年5月太湖藻华面积及月平均温度(b) Fig.1 Sampling site in Meiliang Bay of Lake Taihu (a); algal bloom area of Lake Taihu and monthly average temperature from April 2017 to May 2018 (b) |
利用采水器在水下0.5 m内采集水样,随后避光低温保存,当天迅速带回实验室分析.然后依次利用0.7 μm预灼烧的玻璃纤维滤纸(Whatman)和0.2 μm的聚碳酸酯滤膜(Millipore)进行过滤,过滤后水样使用优级纯盐酸将pH值调节为2,在4℃避光条件下保存并尽快进行后续分析.
预酸化的过滤水样可以直接使用高温催化氧化溶解态有机分析仪(TOC-L analyzer, Shimadzu)测定溶解性有机碳(DOC)和溶解性总氮(TDN)浓度. DOC和TDN的测试误差小于2 %.碳同位素和FT-ICR MS分析需要较高浓度的DOM,因此,我们利用固相萃取(SPE)进行富集浓缩[44].具体而言,取~800 mL预酸化的过滤水样,调节流速5 mL/min通过500 mg的Agilent Bond Elut PPL固相萃取柱,再用pH值为2的水溶液冲洗固相萃取柱,保证去除无机盐之后,用高纯氮气将固相萃取柱吹干.之后用约4 mL甲醇溶液洗脱已经吹干的固相萃取柱,获得浓缩的SPE-DOM.
之后根据样品的DOC浓度和萃取过程的回收率(以50 %计)[9]进行换算,取有机碳含量约为30~50 ng的SPE-DOM样品置于锡杯,低温蒸发去除甲醇之后,通过Thermo-Fisher MAT 253气相色谱-同位素质谱仪(GC-IRMS)测得SPE-DOM的碳同位素值(δ13CDOM), 每个样品重复测试2~3次,保证标准偏差小于0.2 ‰,文章使用数据为所测样品的平均值[32].同时,将SPE-DOM样品调至浓度为50 mg/L后,利用中国石油大学重质油国家重点实验室的9.4T型Apex-Ultra X FT-ICR MS在负离子电喷雾(electron spray ionization, ESI)模式下进行测试分析,质量采集范围为200~800 Da,质谱图叠加次数为128次,所有信噪比大于4且检测误差小于1 ppm的质谱峰被挑选并解析为分子式.针对解析出的分子信息,目前已有多位研究者建立了一系列标准来区分不同分子属性的DOM分子类别[27-29].例如,Koch和Dittmar[28]提出芳香度指数(aromaticity index, AI)以对FT-ICR MS检测出的化合物进行分类(公式(1)):AI值大于0.5的化合物为芳香族化合物,大于0.67的化合物为聚合芳香族化合物. Koch和Dittmar[31]同时考虑到50 %的氧原子通常存在于羰基官能团的假设,提出了修正的芳香度指数(AImod)(公式(2)).结合H/C比值以及AI,可以对FT-ICR MS检测到的分子进行更细致的分类[33]:当分子1.5≤H/C≤2.0时,定义为脂肪族类化合物;当H/C<1.5且AI≤0.50时,定义为高不饱和类化合物;当0.5<AI≤0.66时,定义为类多酚类化合物;当AI>0.66时,定义为多环芳香族化合物.根据等效双键数(double-bond equivalent, DBE)(公式(3))与C、H、O元素的比值(DBE/C比值在0.30~0.68之间,DBE/H比值在0.20~0.95之间,DBE/O比值在0.77~1.75之间),可以确定富羧酸脂环类化合物(carboxyl-rich alicyclic molecules, CRAM)——一类广泛分布于DOM中的惰性分子[13].
| $ AI = \frac{{1 + C - O - S - 0.5H}}{{C - O - S - H}} $ | (1) |
| $ A{I_{\bmod }} = \frac{{1 + C - 0.5O - S - 0.5H}}{{C - 0.5O - S - H}} $ | (2) |
| $ DEB = \frac{{2 + 2C - H + N}}{2} $ | (3) |
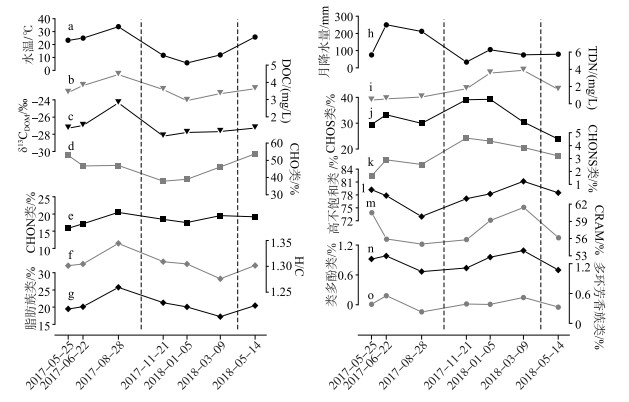
2017年5月至2018年5月采集的表层水体的DOC浓度波动范围为2.95~4.45 mg/L,平均值为3.60 mg/L,最高值出现在2017年8月,最低值出现在2018年1月(图 2b).样品的δ13CDOM波动范围为-28.2 ‰ ~-24.4 ‰,平均值为-27.1 ‰,最高值出现在2017年8月(偏正),最低值出现在2017年11月(图 2c).样品的TDN浓度波动范围为0.42~3.88 mg/L,平均值为1.80 mg/L,最高值出现在2018年3月,最低值出现在2017年5月(图 2i).因此,藻华暴发期表现为高的DOC浓度和低的TDN浓度,藻华消退期表现为低的DOC浓度和高的TDN浓度.这说明DOC主要受藻类有机质输入增加的影响,而TDN可能受外源冬季污水输入以及内源微生物矿化、分解与反硝化作用减少的影响[45].
|
图 2 太湖梅梁湾2017年5月至2018年5月表层水体DOM分子参数 (虚线为藻华暴发期与消退期样品界线) Fig.2 Molecular parameters of surface DOM in Meiliang Bay of Lake Taihu (The dotted line is the boundary between the algal blooming and disappearance period) |
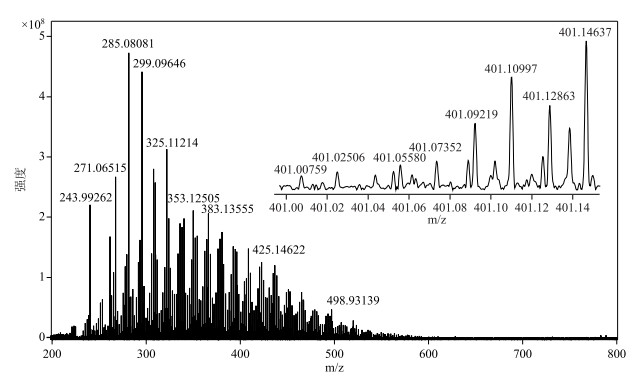
通过FT-ICR MS分析,每个DOM样品可以解析出个数4000~8000不等、质荷比(m/z)分布在200~800的有机化合物分子式(图 3). DOM分子通过强度加权平均计算得到的H/C比值波动范围为1.28~1.34,O/C比值波动范围为0.45~0.47,AImod波动范围为0.21~0.24.从时间序列上看,H/C比值在暴发期相对增加,AImod在消退期相对增加,O/C比值变化趋势不明显(表 1).
|
图 3 典型太湖梅梁湾DOM的FT-ICR MS质谱图(2017年6月为例) Fig.3 FT-ICR MS mass spectra of DOM from Meiliang Bay of Lake Taihu (sample collected on June, 2017 as an example) |
| 表 1 太湖梅梁湾2017年5月-2018年5月基于FT-ICR MS分析的DOM分子参数特征 Tab. 1 Molecular characteristics of DOM based on FT-ICR MS analysis in Meiliang Bay of Lake Taihu collected from May 2017 to May 2018 |
根据元素组成DOM可分为四类化合物:只含有碳、氢、氧的CHO类化合物;只含有碳、氢、氧、硫的CHOS类化合物;只含有碳、氢、氧、氮的CHON类化合物;含有碳、氢、氧、氮、硫的CHONS类化合物.总体而言,CHO类化合物在DOM中占比最多,占所有类别分子强度的37.9 % ~53.0 %,其次为CHOS类化合物(23.8 % ~39.2 %)、CHON类化合物(15.9 % ~20.5 %)、CHONS类化合物(1.7 % ~4.6 %).从时间序列上看,CHO类化合物占比在藻华暴发期相对增加,而CHOS、CHONS类化合物占比在藻华消退期相对增加,CHON类化合物变化不明显(图 2d,2e,2j,2k).
除根据元素组成进行DOM元素组成分类外,我们还按照化合物的分子结构进行了分类统计[33].其中,高不饱和类化合物在DOM中占比最多(73.0 % ~81.1 %);CRAM化合物为主要结构组分(55.0 % ~61.4 %).其次为脂肪族类化合物(17.2 % ~25.8 %);类多酚类化合物(0.7 % ~1.1 %);多环芳香族类化合物(0.2 % ~0.6 %).从时间序列上看,脂肪族类化合物在暴发期相对增加,而高不饱和类化合物和CRAM化合物在消退期相对增加,类多酚类化合物和多环芳香族类化合物占比相对稳定(图 2g,2l,2m,2n, 2o).
3 讨论 3.1 太湖藻华暴发期DOM分子特征藻华暴发期(2017年5月、6月、8月和2018年5月)太湖梅梁湾表层水体的DOC浓度高,δ13CDOM值(-27.3 ‰ ~-24.4 ‰)指示DOM为湖泊自生和陆源输入的混合来源[46-47],CHO类化合物占比高,H/C比值高,脂肪族类化合物占比高.脂肪族类化合物由类脂质、类多肽、氨基糖等分子组成,是易为微生物利用的活性分子,具有高度的生物可利用性并且能够被微生物快速利用[48-50].因此,藻华暴发期间表层水体DOM主要表现为较高的DOC浓度、较多的自生物质来源和较强的生物活性.尽管太湖的夏季降水量较大(图 2h),在增加陆源DOM输入的同时,也缩短了水体滞留时间,会减缓藻华暴发导致的脂肪族类化合物相对含量的增加[33, 51].但是,我们的结果表明,在富营养化藻华的背景下,降雨对脂肪族类化合物相对含量的影响属于次要因素.同时,藻华暴发期脂肪族类化合物的大量输入,其效应较为复杂,表现为总细菌丰度升高[52],但细菌群落多样性下降[42, 53].尽管活性DOM经过微生物代谢之后转变为惰性结构[12],但在藻华暴发期脂肪族类化合物大量输入的背景下,该作用属于次要因素.因此,藻华暴发期水体DOM在含量上表现为DOC浓度升高,在分子组成上表现为CHO类化合物、以脂肪族类化合物为代表的活性组分占比增加.
从藻华暴发初期(2017年5月)到藻华暴发强烈期(2017年8月,基于DOC浓度判断,图 2b),随着藻华的持续发生和加剧,浮游藻类大量增殖,活体蓝藻细胞通过生物活动分泌释放的胞内代谢产物包含脂肪族类化合物[42],超过微生物的降解量,导致DOM库中的活性组分含量上升.这直观的表现为2017年8月水体DOC浓度最高、δ13CDOM值偏正约3 ‰ (-24.4 ‰ vs -27.3 ‰)、H/C比值最高、脂肪族类化合物占比最高.但是,藻华暴发强烈期水体的CHO类化合物在DOM中占比,相较于藻华暴发初期并没有明显变化,说明仅仅依靠元素组成的分类方式,并不能很好的表征持续性藻华导致活性组分增加的过程.总体来看,藻类释放的DOM与太湖水体经过了初步降解的DOM库在分子组成的大类上有一定的相似性,但是化学性质更为活性.
3.2 太湖藻华消退期DOM分子特征藻华消退期表层水体(2017年11月-2018年3月)相较于藻华暴发期DOC浓度降低,DOM在分子组成也上发生了变化,主要表现为H/C比值降低、芳香度增加(表 1);CHO类化合物占比降低、CHOS、CHONS类化合物占比增加;脂肪族类化合物占比降低、高不饱和类化合物和CRAM化合物占比增加(图 2).其中CHOS、CHONS类化合物一部分来源于CHO化合物通过与硫化物反应形成类木质素的CHOS化合物,另一部分源于人类活动产生的表面活性剂化合物,如磺基苯基羧酸类化合物[54].高不饱和类化合物主要为酚类结构化合物,可能来源于木质素降解的中间产物[55];CRAM化合物被认为是经微生物代谢和光降解等一系列转化之后形成的一类惰性结构化合物[13, 56].类多酚类化合物主要为多酚类化合物和带有脂肪链的多环芳香族化合物[28],主要来源于维管植物[33];多环芳香族化合物主要来源于燃烧物质[57].上述变化均表明,藻华消退期主要表现为活性组分的减少和惰性组分的增加.
在藻华消退期间,藻类进入休眠状态后沉入湖底,其对表层水体DOM的直接影响大幅下降.因此,有机质降解可能是藻华消退期表层水体DOM分子组成变化的最重要过程.伴随多肽类、糖类等活性组分优先降解,惰性组分相对耐降解而得以留存于DOM库内,成为DOM的主要贡献者.异养微生物作用也促进了藻类有机质转化为CRAM等惰性分子[9].同时,冬季风浪扰动等水动力条件的增强,会导致部分湖底的藻类残体和沉积物上泛,可能也带来了一部分惰性的有机质.除此之外,尽管消退期的降水较弱,但冬季本身是流域的排污期[45],可能带来了大量的难降解的陆源有机质(如木质素等分子).然而,δ13CDOM除了2017年8月由于藻华极强导致迅速偏正以外,其他时间点的值比较相近,基本排除了陆源输入的显著影响.所以,藻华消退期表层水体惰性组分增加的主要原因可能为内源负荷的减弱,而陆源负荷的增加为次要原因.
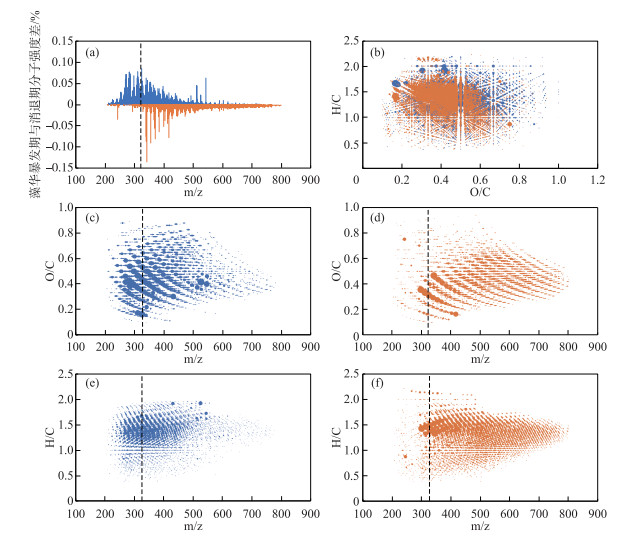
3.3 太湖藻华暴发期与消退期的DOM特征分子差异综上所述,太湖水体的溶解性有机质分子组成在藻华暴发期受藻类有机质输入控制,在消退期受藻类有机质降解的影响.为了进一步明晰并统计藻华暴发期与消退期的特征化合物,我们将样品识别的所有分子根据质谱峰强进行均一化处理,统计各个分子在暴发期与消退期的平均相对强度,并进行差值计算.当分子的相对强度差值为正数时,指示其为暴发期的相对特征化合物(图 4a,蓝色),当分子的相对强度差值为负数时,指示其为消退期的相对特征化合物(图 4a,橙色).结合前面提到的藻华暴发-消退周期DOM分子的活性和惰性特征,可以发现暴发期DOM以活性小分子(m/z=200~325)为特征,消退期DOM以惰性大分子(m/z=325~800)为特征.除此之外,太湖藻华消退期DOM还包含部分小分子量的化合物(m/z=200~325).这些消退期DOM小分子量的化合物有两种可能来源:1)未得以降解的小分子活性化合物;2)微生物降解生成的小分子化合物[14, 58-60].为明晰这一问题,我们将暴发期与消退期分子量小于325的化合物进行对比(图 4c, 4d, 4e, 4f),可以发现暴发期的小分子特征化合物饱和度高(H/C比值高)、含氧量高(O/C比值高),在范式图中(图 4b)分布于类氨基糖、类糖类分子区域[27],指示了新鲜分子的贡献.相对于暴发期,消退期的特征分子向更高不饱和(H/C比值小于1)、更低含氧量(O/C比值小于0.5)转移,在范式图中分布于聚合芳香族化合物分子区域[27].导致这一变化的原因可能是由于微生物代谢消耗了高含氧的分子并产生了低含氧的分子[42].其实,在m/z> 325的质量数范围,亦可以看到太湖梅梁湾藻华暴发期到消退期的分子组成层面上的类似变化,但由于随着分子量的增大,所有化合物的O/C比值趋于0.4,而H/C比值趋于1.4(图 4c, 4d, 4e, 4f),即使分子特征有区别也很难从范氏图中辨别出来(图 4b).因此,m/z= 200~325的分子可能更适合表征太湖梅梁湾藻华暴发期到消退期DOM的分子组成变化.
|
图 4 太湖梅梁湾藻华暴发期(蓝色)与消退期(橙色)表层水体DOM的特征分子信息 (虚线所示为m/z=325;a:藻华暴发期与消退期分子强度差;b:暴发期与消退期特征分子范式图;c:暴发期特征分子m/z vs O/C;d:消退期特征分子m/z vs O/C;e:暴发期特征分子m/z vs H/C;f:消退期特征分子m/z vs H/C;图中圆形标记大小与分子强度相关) Fig.4 Molecular characteristics of surface DOM in Meiliang Bay of Lake Taihu between the algal-blooming period (blue) and algal-disappearance period (orange) (The dotted line represents m/z=325; a: the difference of intensity between the algal-blooming period and algal-disappearance period; b: the Van Krevelen diagram of the algal-blooming period and the algal-disappearance period; c: m/z vs O/C of the algal-blooming period; d: m/z vs O/C of the algal-disappearance period; e: m/z vs H/C of the algal-blooming period; f: m/z vs H/C of the algal-disappearance period; circular marker size is related to the intensity) |
本研究与Zhang等[9]的研究结果有所差别.具体而言,Zhang等[9]发现2007年6月到2007年11月太湖梅梁湾水体DOM中,小质量数分子和CHON类分子比例增加,分子多样性提高.我们认为,两个研究结果的差异可能来自样品的特殊性.首先,Zhang等[9]分析的2个样品采自2007年,而本研究的样品采自2017-2018年,10年的跨度可能导致水体DOM性质具有较大差异.其次,太湖流域6月份为梅雨季节,降雨量较大,太湖水位相对较高,对蓝藻密度具有一定的稀释作用,一定程度上减小了蓝藻大规模聚集的程度[61],因此6月份不是藻华最强的时候.而11月份,蓝藻刚开始死亡和下沉,不是藻华最弱的时候,藻华暴发期的信号可能还残留于11月份的水体中.所以Zhang等[9]对比6月和11月的样品,未必能够表征藻华暴发到消退的过程.不仅如此,尽管Zhang等[9]采样点位也在梅梁湾,但更靠近岸边,在6月强降水的季节,可能受到强烈的陆源输入的影响,对其是否可以确认为藻华暴发期的端元信号存在疑问.事实上,本研究获得的FT-ICR MS谱图和Liu等[43]报道的太湖梅梁湾水体DOM的FT-ICR-MS谱图相近,而与Zhang等[9]报道的FT-ICR MS谱图差异较大.但不论如何,本研究结果清楚地说明了浮游藻类在太湖水体DOM的分子组成变化中扮演着重要的角色.后续仍需要开展更多太湖DOM分子组成时空变化的相关工作来验证本研究的结论.
4 结论1) 在藻华暴发期,显著增加的浮游藻类生产力,使太湖表层水体的DOM从量到分子组成均发生剧烈改变.在含量上DOC浓度升高,在分子组成上CHO类化合物、以脂肪族化合物为代表的活性组分占比增加.在藻华消退期,随着藻类的消亡,藻类有机质对DOM直接贡献减少,持续进行的有机质降解过程,使得DOC浓度下降,CHOS、CHONS类化合物和CRAM化合物等惰性分子占比增加.
2) 藻华暴发期与消退期的分子差异体现在:暴发期以相对高饱和度和高含氧的小质量数分子为特征,而消退期以大质量数分子和相对低饱和度和低含氧的小质量数分子为特征.
3) FT-ICR MS可以有效表征藻华暴发-消退周期内DOM的分子组成变化,今后仍需结合其他分析技术综合分析颗粒态有机质和DOM的变化,为进一步分析富营养化背景下有机碳的来源构成、转化及归宿提供科学依据.
致谢: 感谢中国科学院太湖湖泊生态系统研究站为本研究提供实验仪器设备支持.
| [1] |
Bauer JE, Cai W, Raymond PA et al. The changing carbon cycle of the coastal ocean. Nature, 2013, 504: 61-70. DOI:10.1038/nature12857 |
| [2] |
Cole JJ, Prairie YT, Caraco NF et al. Plumbing the global carbon cycle:Integrating inland waters into the terrestrial carbon budget. Ecosystems, 2007, 10(1): 172-185. DOI:10.1007/s10021-006-9013-8 |
| [3] |
Tranvik LJ, Downing JA, Cotner JB et al. Lakes and reservoirs as regulators of carbon cycling and climate. Limnology and Oceanography, 2009, 54(6part2): 2298-2314. DOI:10.4319/lo.2009.54.6_part_2.2298 |
| [4] |
Zigah PK, Minor EC, Werne JP. Radiocarbon and stable-isotope geochemistry of organic and inorganic carbon in Lake Superior. Global Biogeochemical Cycles, 2012, 26(1): [GB1023]. DOI:10.1029/2011GB004132 |
| [5] |
Cole JJ, Caraco NF, Kling GW et al. Carbon dioxide supersaturation in the surface waters of lakes. Science, 1994, 265(5178): 1568-1570. DOI:10.1126/science.265.5178.1568 |
| [6] |
Paerl HW, Paul VJ. Climate change:Links to global expansion of harmful cyanobacteria. Water Research, 2012, 46(5): 1349-1363. DOI:10.1016/j.watres.2011.08.002 |
| [7] |
Wang CH, Jiang HL. Chemicals used for in situ immobilization to reduce the internal phosphorus loading from lake sediments for eutrophication control. Critical Reviews in Environmental Science and Technology, 2016, 46(10): 947-997. DOI:10.1080/10643389.2016.1200330 |
| [8] |
Pacheco F, Roland F, Downing J. Eutrophication reverses whole-lake carbon budgets. Inland Waters, 2014, 4(1): 41-48. DOI:10.5268/iw-4.1.614 |
| [9] |
Zhang FF, Harir M, Moritz F et al. Molecular and structural characterization of dissolved organic matter during and post cyanobacterial bloom in Taihu by combination of NMR spectroscopy and FTICR mass spectrometry. Water Research, 2014, 57: 280-294. DOI:10.1016/j.watres.2014.02.051 |
| [10] |
Canadell J, Mooney HA. Ecosystem metabolism and the global carbon cycle. Trends in Ecology & Evolution, 1999, 14(6): 249. DOI:10.1016/s0169-5347(99)01601-8 |
| [11] |
Kujawinski EB, Hatcher PG, Freitas MA. High-resolution fourier transform ion cyclotron resonance mass spectrometry of humic and fulvic acids:Improvements and comparisons. Analytical Chemistry, 2002, 74(2): 413-419. DOI:10.1021/ac0108313 |
| [12] |
Koch BP, Witt M, Engbrodt R et al. Molecular formulae of marine and terrigenous dissolved organic matter detected by electrospray ionization Fourier transform Ion cyclotron resonance mass spectrometry. Geochimica et Cosmochimica Acta, 2005, 69(13): 3299-3308. DOI:10.1016/j.gca.2005.02.027 |
| [13] |
Hertkorn N, Benner R, Frommberger M et al. Characterization of a major refractory component of marine dissolved organic matter. Geochimica et Cosmochimica Acta, 2006, 70(12): 2990-3010. DOI:10.1016/j.gca.2006.03.021 |
| [14] |
Tremblay LB, Dittmar T, Marshall AG et al. Molecular characterization of dissolved organic matter in a North Brazilian mangrove porewater and mangrove-fringed estuaries by ultrahigh resolution Fourier Transform-Ion Cyclotron Resonance mass spectrometry and excitation/emission spectroscopy. Marine Chemistry, 2007, 105(1/2): 15-29. DOI:10.1016/j.marchem.2006.12.015 |
| [15] |
Dvorski SEM, Gonsior M, Hertkorn N et al. Geochemistry of dissolved organic matter in a spatially highly resolved groundwater petroleum hydrocarbon plume cross-section. Environmental Science & Technology, 2016, 50(11): 5536-5546. DOI:10.1021/acs.est.6b00849 |
| [16] |
Wetzel RG. Death, detritus, and energy flow in aquatic ecosystems. Freshwater Biology, 1995, 33(1): 83-89. DOI:10.1111/j.1365-2427.1995.tb00388.x |
| [17] |
Nebbioso A, Piccolo A. Molecular characterization of dissolved organic matter (DOM):A critical review. Analytical and Bioanalytical Chemistry, 2013, 405(1): 109-124. DOI:10.1007/s00216-012-6363-2 |
| [18] |
Zimmermann-Timm H. Characteristics, dynamics and importance of aggregates in rivers-an invited review. International Review of Hydrobiology, 2002, 87(2/3): 197-240. DOI:10.1002/1522-2632(200205)87:2/3197::aid-iroh197>3.0.co;2-7 |
| [19] |
Kujawinski EB, del Vecchio R, Blough NV et al. Probing molecular-level transformations of dissolved organic matter:Insights on photochemical degradation and protozoan modification of DOM from electrospray ionization Fourier transform Ion cyclotron resonance mass spectrometry. Marine Chemistry, 2004, 92(1/2/3/4): 23-37. DOI:10.1016/j.marchem.2004.06.038 |
| [20] |
Simon M, Grossart HP, Schweitzer B et al. Microbial ecology of organic aggregates in aquatic ecosystems. Aquatic Microbial Ecology, 2002, 28: 175-211. DOI:10.3354/ame028175 |
| [21] |
Hedges JI, Keil RG, Benner R. What happens to terrestrial organic matter in the ocean?. Organic Geochemistry, 1997, 27(5/6): 195-212. DOI:10.1016/s0146-6380(97)00066-1 |
| [22] |
Azam F, Malfatti F. Microbial structuring of marine ecosystems. Nature Reviews Microbiology, 2007, 5(10): 782-791. DOI:10.1038/nrmicro1747 |
| [23] |
Canuel EA, Hardison AK. Sources, ages, and alteration of organic matter in estuaries. Annual Review of Marine Science, 2016, 8(1): 409-434. DOI:10.1146/annurev-marine-122414-034058 |
| [24] |
Marshall AG. Milestones in Fourier transform Ion cyclotron resonance mass spectrometry technique development. International Journal of Mass Spectrometry, 2000, 200(1/2/3): 331-356. DOI:10.1016/s1387-3806(00)00324-9 |
| [25] |
Sleighter RL, Hatcher PG. The application of electrospray ionization coupled to ultrahigh resolution mass spectrometry for the molecular characterization of natural organic matter. Journal of Mass Spectrometry, 2007, 42(5): 559-574. DOI:10.1002/jms.1221 |
| [26] |
Kim S, Kramer RW, Hatcher PG. Graphical method for analysis of ultrahigh-resolution broadband mass spectra of natural organic matter, the van krevelen diagram. Analytical Chemistry, 2003, 75(20): 5336-5344. DOI:10.1021/ac034415p |
| [27] |
Sleighter RL, Hatcher PG. Molecular characterization of dissolved organic matter (DOM) along a river to ocean transect of the lower Chesapeake Bay by ultrahigh resolution electrospray ionization Fourier transform Ion cyclotron resonance mass spectrometry. Marine Chemistry, 2008, 110(3/4): 140-152. DOI:10.1016/j.marchem.2008.04.008 |
| [28] |
Koch BP, Dittmar T. From mass to structure:An aromaticity index for high-resolution mass data of natural organic matter. Rapid Communications in Mass Spectrometry, 2006, 20(5): 926-932. DOI:10.1002/rcm.2386 |
| [29] |
Seidel M, Beck M, Riedel T et al. Biogeochemistry of dissolved organic matter in an anoxic intertidal creek bank. Geochimica et Cosmochimica Acta, 2014, 140: 418-434. DOI:10.1016/j.gca.2014.05.038 |
| [30] |
Nebbioso A, Piccolo A. Molecular characterization of dissolved organic matter (DOM):A critical review. Analytical and Bioanalytical Chemistry, 2013, 405(1): 109-124. DOI:10.1007/s00216-012-6363-2 |
| [31] |
Bhatia MP, Das SB, Longnecker K et al. Molecular characterization of dissolved organic matter associated with the Greenland ice sheet. Geochimica et Cosmochimica Acta, 2010, 74(13): 3768-3784. DOI:10.1016/j.gca.2010.03.035 |
| [32] |
Wang K, Pang Y, He C et al. Optical and molecular signatures of dissolved organic matter in Xiangxi Bay and mainstream of Three Gorges Reservoir, China:Spatial variations and environmental implications. Science of the Total Environment, 2019, 657: 1274-1284. DOI:10.1016/j.scitotenv.2018.12.117 |
| [33] |
Kellerman AM, Dittmar T, Kothawala DN et al. Chemodiversity of dissolved organic matter in lakes driven by climate and hydrology. Nature Communications, 2014, 5: 3804. DOI:10.1038/ncomms4804 |
| [34] |
Qin B ed. Lake Taihu, China: dynamics and environmental change. Springer Science & Business Media, 2008.
|
| [35] |
Yang GS, Ma RH, Zhang L et al. Lake status, major problems and protection strategy in China. J Lake Sci, 2010, 22(6): 799-810. [杨桂山, 马荣华, 张路等. 中国湖泊现状及面临的重大问题与保护策略. 湖泊科学, 2010, 22(6): 799-810. DOI:10.18307/2010.0601] |
| [36] |
Liu X. Long-term dynamics of cyanobacteria related to environmental factors in Lake Taihu[Dissertation]. Wuhan: Huazhong University of Science & Technology, 2012.[ [刘霞.太湖蓝藻水华中长期动态及其与相关环境因子的研究[学位论文].武汉: 华中科技大学, 2012.] ]
|
| [37] |
Ma RH, Kong FX, Duan HT et al. Spatio-temporal distribution of cyanobacteria blooms based on satellite imageries in Lake Taihu, China. J Lake Sci, 2008, 20(6): 687-694. [马荣华, 孔繁翔, 段洪涛等. 基于卫星遥感的太湖蓝藻水华时空分布规律认识. 湖泊科学, 2008, 20(6): 687-694. DOI:10.18307/2008.0605] |
| [38] |
Gu X, Zeng Q, Mao Z et al. Water environment change over the period 2007-2016 and the strategy of fishery improve the water quality of Lake Taihu. J Lake Sci, 2019, 31(2): 305-318. [谷孝鸿, 曾庆飞, 毛志刚等. 太湖2007-2016十年水环境演变及"以渔改水"策略探讨. 湖泊科学, 2019, 31(2): 305-318. DOI:10.18307/20190201] |
| [39] |
Shi K, Zhang YL, Zhang YB et al. Phenology of phytoplankton blooms in a trophic lake observed from long-term MODIS data. Environmental Science & Technology, 2019, 53(5): 2324-2331. DOI:10.1021/acs.est.8b06887 |
| [40] |
Luo XC, Hang X, Cao Y et al. Dominant meteorological factors affecting cyanobacterial blooms under eutrophication in Lake Taihu. J Lake Sci, 2019, 31(5): 1248-1258. [罗晓春, 杭鑫, 曹云等. 太湖富营养化条件下影响蓝藻水华的主导气象因子. 湖泊科学, 2019, 31(5): 1248-1258. DOI:10.18307/2019.0512] |
| [41] |
Zhang M, Duan HT, Shi XL et al. Contributions of meteorology to the phenology of cyanobacterial blooms:Implications for future climate change. Water Research, 2012, 46(2): 442-452. DOI:10.1016/j.watres.2011.11.013 |
| [42] |
Bai LL, Cao CC, Wang CH et al. Toward quantitative understanding of the bioavailability of dissolved organic matter in freshwater lake during cyanobacteria blooming. Environmental Science & Technology, 2017, 51(11): 6018-6026. DOI:10.1021/acs.est.7b00826 |
| [43] |
Liu SS, He ZQ, Tang Z et al. Linking the molecular composition of autochthonous dissolved organic matter to source identification for freshwater lake ecosystems by combination of optical spectroscopy and FT-ICR-MS analysis. Science of the Total Environment, 2020, 703: 134764. DOI:10.1016/j.scitotenv.2019.134764 |
| [44] |
Dittmar T, Koch B, Hertkorn N et al. A simple and efficient method for the solid-phase extraction of dissolved organic matter (SPE-DOM) from seawater. Limnology and Oceanography:Methods, 2008, 6(6): 230-235. DOI:10.4319/lom.2008.6.230 |
| [45] |
Wu YL, Xu H, Yang GJ et al. Progress in nitrogen pollution research in Lake Taihu. J Lake Sci, 2014, 26(1): 19-28. [吴雅丽, 许海, 杨桂军等. 太湖水体氮素污染状况研究进展. 湖泊科学, 2014, 26(1): 19-28. DOI:10.18307/2014.0103] |
| [46] |
Hood E, Fellman J, Spencer RGM et al. Glaciers as a source of ancient and labile organic matter to the marine environment. Nature, 2009, 462(7276): 1044-1047. DOI:10.1038/nature08580 |
| [47] |
Spencer RGM, Guo WD, Raymond PA et al. Source and biolability of ancient dissolved organic matter in glacier and lake ecosystems on the Tibetan Plateau. Geochimica et Cosmochimica Acta, 2014, 142: 64-74. DOI:10.1016/j.gca.2014.08.006 |
| [48] |
Hopkinson C, Buffam I, Hobbie J et al. Terrestrial inputs of organic matter to coastal ecosystems:An intercomparison of chemical characteristics and bioavailability. Biogeochemistry, 1998, 43(3): 211-234. DOI:10.1023/A:1006016030299 |
| [49] |
Søndergaard M, Middelboe M. A cross-system analysis of labile dissolved organic carbon. Marine Ecology Progress Series, 1995, 118: 283-294. DOI:10.3354/meps118283 |
| [50] |
D'Andrilli J, Cooper WT, Foreman CM et al. An ultrahigh-resolution mass spectrometry index to estimate natural organic matter lability. Rapid Communications in Mass Spectrometry, 2015, 29(24): 2385-2401. DOI:10.1002/rcm.7400 |
| [51] |
Stubbins A, Spencer RGM, Chen HM et al. Illuminated darkness:Molecular signatures of Congo River Dissolved organic matter and its photochemical alteration as revealed by ultrahigh precision mass spectrometry. Limnology and Oceanography, 2010, 55(4): 1467-1477. DOI:10.4319/lo.2010.55.4.1467 |
| [52] |
Niu Y, Shen H, Chen J et al. Phytoplankton community succession shaping bacterioplankton community composition in Lake Taihu, China. Water Research, 2011, 45(14): 4169-4182. DOI:10.1016/j.watres.2011.05.022 |
| [53] |
Zhang W, Zhou YQ, Jeppesen E et al. Linking heterotrophic bacterioplankton community composition to the optical dynamics of Dissolved organic matter in a large eutrophic Chinese lake. Science of the Total Environment, 2019, 679: 136-147. DOI:10.1016/j.scitotenv.2019.05.055 |
| [54] |
Melendez-Perez JJ, Martínez-Mejía MJ, Barcellos RL et al. A potential formation route for CHOS compounds in dissolved organic matter. Marine Chemistry, 2018, 202: 67-72. DOI:10.1016/j.marchem.2018.03.006 |
| [55] |
Stenson AC, Marshall AG, Cooper WT. Exact masses and chemical formulas of individual suwannee river fulvic acids from ultrahigh resolution electrospray ionization Fourier transform Ion cyclotron resonance mass spectra. Analytical Chemistry, 2003, 75(6): 1275-1284. DOI:10.1021/ac026106p |
| [56] |
Lam B, Baer A, Alaee M et al. Major structural components in freshwater dissolved organic matter. Environmental Science & Technology, 2007, 41(24): 8240-8247. DOI:10.1021/es0713072 |
| [57] |
Dittmar T, Koch BP. Thermogenic organic matter dissolved in the abyssal ocean. Marine Chemistry, 2006, 102(3/4): 208-217. DOI:10.1016/j.marchem.2006.04.003 |
| [58] |
Kim S, Kaplan LA, Hatcher PG. Biodegradable dissolved organic matter in a temperate and a tropical stream determined from ultra-high resolution mass spectrometry. Limnology and Oceanography, 2006, 51(2): 1054-1063. DOI:10.4319/lo.2006.51.2.1054 |
| [59] |
Einsiedl F, Hertkorn N, Wolf M et al. Rapid biotic molecular transformation of fulvic acids in a Karst aquifer. Geochimica et Cosmochimica Acta, 2007, 71(22): 5474-5482. DOI:10.1016/j.gca.2007.09.024 |
| [60] |
Schmidt F, Elvert M, Koch BP et al. Molecular characterization of dissolved organic matter in pore water of continental shelf sediments. Geochimica et Cosmochimica Acta, 2009, 73(11): 3337-3358. DOI:10.1016/j.gca.2009.03.008 |
| [61] |
Liu JT, Yang YS, Gao JF et al. Characteristics of cyanobacteria bloom grading and its temporal and spatial variation in Taihu lake. Resources and Environment in the Yangtze Basin, 2011, 20(2): 156-160. [刘聚涛, 杨永生, 高俊峰等. 太湖蓝藻水华分级及其时空变化. 长江流域资源与环境, 2011, 20(2): 156-160.] |
 2020, Vol. 32
2020, Vol. 32 

