(2: 中国科学院大学, 北京 100049)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
磷是地表水环境中重要的营养元素之一,其循环转化直接影响着水体水质、初级生产力水平及浮游植物的种群演替[1-2].在自然环境中,磷仅有一个稳定同位素(31P),无法用以示踪其来源与循环过程[3].幸运的是,磷通常以磷酸盐的形式存在,而磷酸盐中磷与氧紧密结合,P-O键能为359.8 kJ/mol,在地表自然温度和pH等无机环境下几乎不会水解发生氧原子交换,由此可以借助磷酸盐氧同位素(δ18OP)组成进行磷的来源示踪[4].在一定的生物或酶作用下,磷酸盐还可与周围水体发生氧同位素交换,进而使δ18OP趋于同位素平衡分馏值,基于此也能推断磷的生物地球化学循环过程[5-6].
随着δ18OP测试技术与同位素比值质谱仪(IRMS)的快速发展,近年来已在海洋、河流、湖泊、湿地等地表水体中磷的迁移转化研究领域得到了广泛的应用[7-15].目前对水体δ18OP的前处理方法主要是从海水体系中演变而来,一种为先用氢氧化钠和氯化镁反应生成絮状氢氧化镁沉淀,吸附并富集水中的可溶性磷酸盐(SRP),该方法称为镁共沉淀法(MAGIC),再用硝酸溶解后加入铈盐生成磷酸铈沉淀进行纯化,再经阳离子交换树脂去除Ce3+[16];另一种通过磷钼酸铵和磷酸铵镁沉淀纯化PO43-,再用阴阳离子交换树脂去除金属离子和有机质[17],二者最后均转化成磷酸银(Ag3PO4)进行δ18OP的测定.总体来看,这些方法通常操作过程繁琐,耗时较长,生成Ag3PO4受pH影响较大[18-19].淡水环境样品中的PO43-浓度一般较低,而有机质和Cl-、Ca2+、Mg2+等含量较高,非常容易干扰Ag3PO4的生成和δ18OP的准确分析[20-22].因此有必要对现有δ18OP分析前处理方法在地表淡水环境样品中的适用性加以检验,并进行相应地改进研究,以期建立一种更为高效、准确,且适宜于淡水样品δ18OP分析的前处理方法.
1 实验部分 1.1 试剂与材料试剂:磷酸二氢钾(KH2PO4)、六水硝酸镁(Mg(NO3)2·6H2O)、氯化镁(MgCl2)、氢氧化钠(NaOH)、乙酸钾(CH3COOK)、浓硝酸(HNO3)、醋酸(CH3COOH)、浓氨水(NH3 ·H2O)、30 %双氧水(H2O2)从国药集团化学试剂有限公司购买,均为分析纯以上;硝酸银(AgNO3,99.9 %)购买自Alfa Aesar公司,硝酸铈(Ce(NO3)3 ·6H2O,99.5 %)从Acros Organics公司获得.
材料:50 mL普通离心管、50 mL黑色不透光离心管(Argos Technologies)、250 ml聚乙烯瓶、阳离子交换树脂(Biorad AG 50W-X8,H+型,100-200目).
标准试剂:包括购买自Alfa Aesar公司的Ag3PO4(简称alfa,99.9 %,GR),两种实验室内部Ag3PO4标准KL(δ18OP=11.3 ‰)和KH(δ18OP=20.0 ‰),3种国际原子能机构(International Atomic Energy Agency,IAEA)的含氧标准物质NBS127(BaSO4,δ18O=9.3 ‰)、601(Benzoic Acid,δ18O=23.3 ‰)和USG-32(KNO3,δ18O=25.7 ‰).
模拟实验溶液配制:根据我国地表水湖库Ⅱ类、Ⅴ类以及污水一级A标准的总磷(TP)浓度阈值[23-24],设置3种梯度系列磷溶液,浓度分别为0.02、0.2和0.5 mg/L,使用KH2PO4和超纯水进行配制.其中,浓度为0.02 mg/L的样品配制50 L,浓度为0.2和0.5 mg/L的溶液各配制20 L.
污水样品:采自贵阳市某污水处理厂两份平行样品,标记为1#-1和1#-2.采集20 L,现场立即用0.45 μm醋酸纤维滤膜过滤后,冷藏运回实验室进行δ18OP分析前处理实验.经分析,水样TP浓度为1.3 mg/L,溶解态反应磷(SRP)为0.8 mg/L,溶解性有机碳(DOC)浓度为50±7 mg/L.
1.2 实验方法δ18OP分析的前处理参照McLaughlin方法[16],主要包括3个步骤:①添加NaOH和MgCl2,通过MAGIC共沉淀法富集溶液中的SRP;②用HNO3溶解上述Mg(OH)2沉淀,后加入Ce(NO3)3生成CePO4沉淀,再次富集磷,通过Biorad AG 50W-X8树脂除去Ce3+;③加入AgNO3溶液生成Ag3PO4沉淀,并用H2O2去除有机质的干扰.
在此基础上,我们验证了该方法在上述不同浓度模拟磷溶液以及污水样品的δ18OP测定情况,并针对主要的不足之处,进行了如下改进(图 1):①将MAGIC步骤使用的MgCl2替换为Mg(NO3)2,减少Cl-的干扰,从而降低减少氯化银(AgCl)杂质的生成. ②对比不同pH值条件下Ag3PO4的生成情况,探讨Ag3PO4生成过程的最佳pH值.③进行室内暗光实验,并使用黑色不透光离心管,降低AgNO3及生成Ag3PO4可能的遇光分解效应,尽量提高样品的纯度,确保δ18OP的测试准确.
对于较大体积的含磷模拟溶液与污水样品,按照图 1的δ18OP前处理流程,由于每个样品在MAGIC步骤生成的Mg(OH)2沉淀过多,视情况分成了2~4组同时进行后续实验.
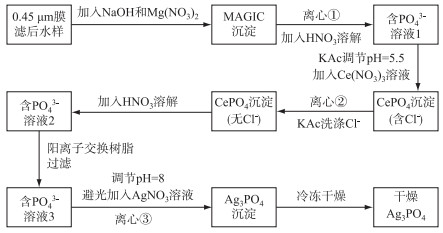
|
图 1 改进的淡水样品δ18OP前处理流程示意图 ①②③处测定磷的回收率 Fig.1 Schematic diagram of the improved pretreatment methods for δ18OP analysis in freshwater samples The phosphorus recovery rate was determined in ①②③ steps, respectively |
水样及溶液磷浓度的测定:高磷浓度的样品采用钼锑抗分光光度法测量(适用浓度范围为0.01~0.6 mg/L),低磷浓度的样品采用磷钼杂多酸孔雀绿分光光度法测量(适用浓度范围0.001~0.3 mg/L)[24].
δ18OP分析:称取0.45~0.50 mg的Ag3PO4样品包入银舟,高温裂解后,在氦气载气下,Ag3PO4裂解释放的O2与石墨发生反应生成CO,CO通过连续流系统载入IRMS测量δ18OP值,同时每隔5个样品插入氧同位素标准物质,以判断数据的稳定性. δ18OP值均是相对于VSMOW.
为验证Ag3PO4样品的纯度,使用X射线衍射技术(XRD,Empyream,荷兰),样品质量不少于200 mg,使用玛瑙研钵磨细过325目筛,制成长×宽在3 cm×3 cm以内、上下表面至少一面平整、厚度不超过3 mm的薄片,上机对生成的Ag3PO4样品进行图谱分析,以获得其成分、结构、形态等信息.
为测定Ag3PO4样品中有机质的含量,称取约300 mg的Ag3PO4样品包入锡舟,进入燃烧管在纯氧氛围下静态充分燃烧,燃烧的最后阶段再通入定量的动态氧气以保证所有的有机物和无机物都完全燃烧,使用有机元素分析仪(vario Macro cube,德国)对样品进行元素分析,以获得其C、H、O、N等元素的含量.
2 结果与讨论 2.1 δ18OP测试方法的准确度与精密度通过3种IAEA含氧标准物质NBS127、601和USG-32的多点校准(图 2),测量的KH δ18OP值为20.0 ‰ ±0.2 ‰,KL δ18OP值为11.3 ‰ ±0.2 ‰,与内部标准值相一致. Alfa磷酸银的δ18OP值为20.4 ‰ ±0.4 ‰.另外,从多次标准物质平行分析的结果来看,NBS127的δ18O值为9.3 ‰ ±0.2 ‰,601的δ18O值为23.3 ‰ ±0.2 ‰,USG-32的δ18O值为25.7 ‰ ±0.2 ‰,实验过程中分析误差均小于0.5 ‰,精密度高,进一步证明了本实验室仪器对于测试δ18OP的可靠性.从图 2也可以发现,KL和NBS127的δ18O值较为偏负,alfa和KH的δ18O值很接近,601和USG的δ18O值更偏正.

|
图 2 不同标准样品的δ18O测量值 Fig.2 δ18O values of different standard samples |
此外,本文还总结了目前已发表的淡水环境样品中不同环境介质中δ18OP组成特征[4-15].河流δ18OP为8.6 ‰ ~17.2 ‰,湖泊δ18OP为8.4 ‰ ~17.1 ‰,地下水δ18OP为9.0 ‰ ~15.1 ‰,污水δ18OP为8.4 ‰ ~18.4 ‰,洗涤剂δ18OP为13.3 ‰ ~18.6 ‰,化粪池δ18OP为13.2 ‰ ~14.5 ‰.通常,不同水体δ18OP的变化范围有所不同,主要与磷的来源组成以及生物活动程度等密切相关[4, 15].相对而言,地下水δ18OP相对偏负,而湖泊、河流等受人类活动的影响,δ18OP偏正.污水、化粪池中受洗涤剂等含磷物质输入所致,微生物活动也较为剧烈,δ18OP更趋于平衡值.
自然界淡水样品δ18OP值大多介于8 ‰ ~20 ‰之间,可以使用KL/NBS127、alfa-Ag3PO4/KH及601/USG-32 3对标准物质组合进行δ18OP的分析校正,也可以简化使用NBS127、601和USG-32进行校准(图 2),这3种标准目前已多用于环境样品的δ34S、δ13C、δ15N分析.
2.2 模拟淡水样品的分析 2.2.1 磷的回收率我们对比了不同磷浓度和不同处理方法的样品各步骤回收率的差异(表 1).结果表明,在MAGIC和CePO4两步骤磷的回收率较高,而离子交换树脂步骤较低,导致最终生成Ag3PO4的磷回收率为57.0 % ~86.4 %,这是因为在树脂分离过程中一部分磷滞留在洗脱柱上.随着含磷模拟溶液磷浓度的升高,磷的回收率显著提高.对于高磷浓度的样品,丢失的部分占比较小,对整体回收率的影响不大;但对低浓度的样品,丢失部分占比较大,对整体回收率的影响也较大.因此,对于低浓度磷酸盐的淡水样品,需采集大体积的样品进行多次MAGIC预富集,并重复进行Biorad AG 50W-X8树脂柱洗脱处理,以确保磷的回收率[17-18].值得注意的是,使用Mg(NO3)2进行MAGIC沉淀与原先的MgCl2处理对磷回收率的影响并不大.
| 表 1 δ18OP前处理各步骤中磷的回收率 Tab. 1 The phosphorus recovery rate in each step of the δ18OP pretreatment methods |
我们使用KH2PO4纯水配制的3种磷浓度为0.02、0.2、0.5 mg/L的溶液进行δ18OP前处理实验,对比使用MgCl2和Mg(NO3)2进行MAGIC沉淀.由于A2实验组中原溶液磷浓度过低,因此生成的Ag3PO4沉淀较少,无法进行多次测量.对于其他含磷模拟溶液经不同前处理生成的Ag3PO4样品,均在IRMS上进行3次以上的δ18OP测试.
由图 3可见,采用MgCl2进行MAGIC沉淀的3个不同浓度系列的磷溶液最后生成的Ag3PO4样品δ18OP平均值为12.28 ‰,明显偏离KH2PO4和AgNO3溶液直接合成的Ag3PO4的δ18OP值(13.1 ‰),尤其是C1组标准偏差高达0.7 ‰.这可能由于Cl-未能彻底去除,最后生成的Ag3PO4含有AgCl,进而导致数据测量的偏差.目前去除Cl-的方法为使用缓冲溶液(使用KAc和HAc将pH调解为5.6的超纯水)洗涤3遍[21],我们建议多洗涤几遍,并用AgNO3溶液鉴定是否仍有残留Cl-.
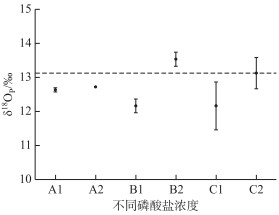
|
图 3 不同含磷浓度模拟溶液使用MgCl2和Mg(NO3)2进行MAGIC沉淀后的δ18OP数据对比 A1、B1、C1与A2、B2、C2样品所示同表 1,虚线表示用KH2PO4直接合成Ag3PO4的δ18OP值 Fig.3 Comparison of δ18OP values in different P-containing solutions by MAGIC precipitation with MgCl2 and Mg(NO3)2 A1, B1, C1 and A2, B2 and C2 represent samples same as Tab. 1. The black dashed line indicates the δ18OP value of Ag3PO4 through direct synthesis with KH2PO4 |
使用Mg(NO3)2替代后,Ag3PO4样品δ18OP的平均值为13.18 ‰,更接近于用KH2PO4和AgNO3溶液直接合成的Ag3PO4的δ18OP值,并且最大标准偏差为0.46 ‰ (C2组),在该仪器分析方法可接受的范围之内(<0.5 ‰).实验证明,使用Mg(NO3)2替代MgCl2进行MAGIC沉淀后,可有效减少Cl-的干扰,大大提高Ag3PO4的纯度,使δ18OP测定结果更加接近真实值.
2.3 生成Ag3PO4样品的XRD分析由2.2节可见,传统方法使用MgCl2进行MAGIC沉淀,可能会导致Cl-的不完全去除,最后生成AgCl杂质,使得样品不纯.同时,研究还表明,如果不进行严格的避光操作,AgNO3和Ag3PO4光解也会产生Ag单质,同样也会影响最终样品的纯度及δ18OP值[21].按照Blake法[25],加入银氨溶液后加热使氨水挥发析出Ag3PO4,亮黄色的结晶浮于溶液表面.而在McLaughlin法[16],调节pH至7.0~8.0,加入AgNO3溶液,迅速生成黄色的Ag3PO4沉淀,但沉淀随时间慢慢变暗.我们于是对Mg(NO3)2替代实验后Ag3PO4的生成实验分为室内正常光照和地下室暗光及使用黑色不透光离心管盛放Ag3PO4加以比较研究,并对改进前后的Ag3PO4样品进行XRD检验,判断是否产生上述Ag3PO4的光解现象.
从图 4可以看出,与直接合成Ag3PO4相比,使用MgCl2进行MAGIC沉淀最终的样品中,由于Cl-的未完全去除,的确含有AgCl杂质.在Mg(NO3)2实验组未避光样品中确实检测到Ag单质的存在,而严格避光处理后样品较为纯净,没有发现Ag单质.前人研究表明,造成Ag单质的生成主要有两点原因:一是加入AgNO3溶液生成Ag3PO4沉淀后,一少部分AgNO3附着在Ag3PO4表面,在NH3·H2O还原作用下转变为Ag单质;二是Ag3PO4在有水和光照条件下也会在表面分解产生灰黑色的Ag单质[16-17].Ag单质的存在会导致上机时氧元素信号偏低,增大测试的数据误差[21].
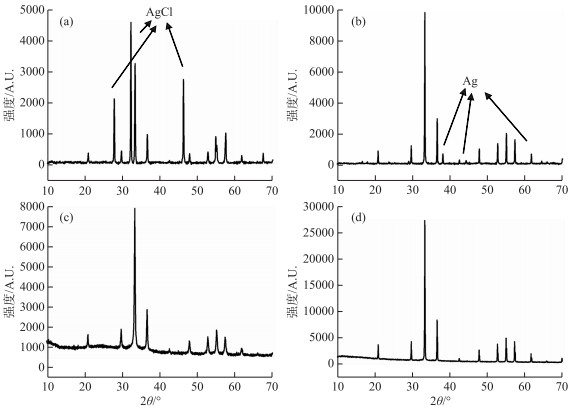
|
图 4 前处理方法改进前后样品的XRD图谱 (a:使用MgCl2进行MAGIC沉淀且未完全去除Cl-;b:使用Mg(NO3)2进行MAGIC沉淀,但未完全避光;c:使用Mg(NO3)2进行MAGIC沉淀且避光处理;d:直接合成Ag3PO4) Fig.4 XRD patterns of samples before and after the improvement methods (a: MgCl2 was used for MAGIC precipitation and Cl- was not completely removed; b: MAGIC precipitation was performed with Mg(NO3)2, but not completely avoided light; c: MAGIC precipitation with Mg(NO3)2 using the dark treatment; d: direct synthesis of Ag3PO4) |
为此,有人使用氨水重结晶和缓慢微沉淀法有效减少Ag单质[26-27]的产生,可用10 mL浓氨水溶解Ag3PO4,通过0.2 μm聚碳酸酯膜收集溶液,在过滤过程中,灰黑色杂质被去除,因为它们不会溶解在氨水中.过滤的溶液收集在50 mL离心管中,40℃下烘干,进一步发现氨水蒸发后重新沉淀出亮黄色Ag3PO4. Xu等[27]进一步指出要尽量缩短氨水重结晶的时间,最好在沉淀后半小时内完成.尽管高浓度NH4NO3重复冲洗可以降低Ag单质的影响,但通常建议避免这种措施,因为随着pH值的变化,不溶性AgO可能会形成,进而导致Ag3PO4的污染.况且前人方法操作繁琐、耗时较长,且在生成Ag3PO4后进行操作,会对样品造成一定的损失.相比之下,本文采用暗光实验结合避光处理,直接避免了Ag单质的生成且更加经济快捷.此外,为了防止AgNO3与Ag3PO4的光解,应尽量控制AgNO3的投加量,不要太过量,混合溶液中Ag :P浓度比例不宜超过13[26].
2.4 污水样品分析 2.4.1 pH值对Ag3PO4生成的影响研究在δ18OP分析的前处理中,pH值条件对于Ag3PO4生成至关重要,常用的实验方法中Ag3PO4生成的pH条件一般为7.0~8.0[16, 27]. Mine等的研究表明Ag3PO4沉淀的适合pH范围较宽,为7.0~10.0[26].但是,究竟Ag3PO4生成的最佳pH值条件是多少目前仍然不清楚.因此,我们采用污水样品,设置了3组pH值,分别为pH=7.0、8.0和9.0,每组pH值分别设置3组平行实验,对比不同pH条件下生成Ag3PO4的情况.
我们发现pH=9.0时几乎没有生成Ag3PO4沉淀,pH值为7.0和8.0时均可快速生成Ag3PO4沉淀,但pH=8.0时生成量为pH=7.0时的1.5~3倍.同时,从δ18OP结果来看(图 5),样品1#-1在pH=7.0和8.0时,δ18OP平均值分别为15.9 ‰和15.7 ‰,样品1#-2对应15.2 ‰和15.6 ‰,所有数据最大标准偏差为0.44 ‰,可以看出这两个pH条件下对δ18OP值的差别影响不大.
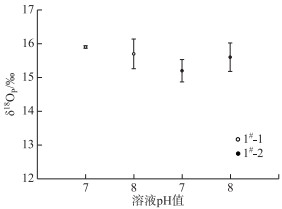
|
图 5 溶液pH=7.0、8.0时不同样品的δ18OP值 Fig.5 δ18OP values of different samples at solutions pH = 7.0 and 8.0 |
研究表明,当溶液pH低于7.0时,Ag3PO4难以完全沉淀,且已生成的沉淀也易在酸性条件下溶解[26].当pH值过高时,特别是pH大于9.0时,可能生成AgOH沉淀,最后转化为Ag2O,进而影响δ18OP值的准确性[28].为此,我们建议pH=8.0为Ag3PO4生成的最佳条件,这与Dettman等[29]提出的快速微沉淀法条件非常吻合.
2.4.2 有机质的去除为了验证Ag3PO4中有机质的去除程度,我们分析了4个样品中C、N的元素含量(表 2).其中,Alfa公司购买的Ag3PO4的C、N含量最低,直接合成的Ag3PO4的C、N含量也较低,分别为0.564 %和0.078 %.C1为使用MgCl2对模拟溶液C1进行MAGIC沉淀生成的Ag3PO4,而样品1#为使用Mg(NO3)2进行MAGIC沉淀生成的Ag3PO4,二者含C量接近,与直接合成的Ag3PO4相当.经计算,样品1#的DOC去除率达到90 %以上.此外,C1与1#两个样品的N含量均较高,表明H2O2对N的去除效果不够理想. Grimes等[30]和张秀梅等[22]也发现该方法对有机质的去除效率没有Colman的方法[17]高,因为后者特别增加了针对有机质除去阴离子交换树脂的步骤.为此,对于一些有机质含量较高的工业废水与生活污水样品,建议参照卢阳阳等[19]改进的McLaughlin法,在除去Ce3+后,采用阴离子交换树脂去除有机质的干扰. Xu等[27]使用XAD-2树脂去除有机物,制备的Ag3PO4中C、N含量分别为0.226 % ±0.033 %和0.030 % ±0.006 %,对有机物的去除率较高. Liu等[21]向湖泊沉积物样品提取液中加入无磷活性炭粉振荡30 min后过滤去除有机质,发现该方法效果良好,而且可以避免磷的损失,也是一个适用的简便选择.
| 表 2 Ag3PO4样品中C、N含量 Tab. 2 C and N contents in Ag3PO4 samples |
本研究针对现有淡水样品δ18OP前处理方法的局限性,采用Mg(NO3)2代替MgCl2进行MAGIC沉淀,有效降低AgCl的生成,特别是严格的避光操作可避免Ag3PO4光解生成Ag单质,提高样品的纯度.同时,优化调节Ag3PO4生成溶液pH值为8.0,使沉淀过程快速完全进行,确保了样品δ18OP分析结果的可靠性.
研究结果证明,改进的δ18OP前处理方法解决了目前淡水样品δ18OP前处理过程存在的操作步骤繁琐、产生AgCl杂质干扰及Ag3PO4光解等不良影响,既简化了磷酸盐的富集、纯化过程,又保证了δ18OP分析的准确性,是一种适宜于淡水样品δ18OP前处理方法,有望极大地推动淡水环境中磷的来源示踪与生态环境效应研究.
| [1] |
Schelske CL. Eutrophication:Focus on phosphorus. Science, 2009, 324: 722. DOI:10.1126/science.324_722 |
| [2] |
Huser BJ, Futter M, Lee JT et al. In-lake measures for phosphorus control:The most feasible and cost-effective solution for long-term management of water quality in urban lakes. Water Research, 2016, 97: 142-152. DOI:10.1016/j.watres.2015.07.036 |
| [3] |
Paytan A, McLaughlin K. Tracing the sources and biogeochemical cycling of phosphorus in aquatic systems using isotopes of oxygen in phosphate//Handbook of Environmental Isotope Geochemistry. Berlin Heidelberg:Springer, 2011. DOI:10.1007/978-3-642-10637-8_21 |
| [4] |
Davies CL, Surridge BWJ, Gooddy DC. Phosphate oxygen isotopes within aquatic ecosystems:Global data synthesis and future research priorities. Science of the Total Environment, 2014, 496: 563-575. DOI:10.1016/j.scitotenv.2014.07.057 |
| [5] |
Liang Y, Blake RE. Oxygen isotope studies of biogeochemical cycling of phosphorus. Organic Geochemistry, 2006, 37: 1263-1277. DOI:10.1016/j.orggeochem.2006.03.009 |
| [6] |
O'Neil JR, Vennemann TW, McKenzie WF. Effects of speciation on equilibrium fractionations and rates of oxygen isotope exchange between (PO4)aq and H2O. Geochimica et Cosmochimica Acta, 2003, 67(17): 3135-3144. DOI:10.1016/S0016-7037(02)00970-5 |
| [7] |
Elsbury KE, Paytan A, Ostrom NE et al. Using oxygen isotopes of phosphate to trace phosphorus sources and cycling in Lake Erie. Environmental Science & Technology, 2009, 43(9): 3108-3114. DOI:10.1021/es8034126 |
| [8] |
Jaisi DP, Blake RE. Tracing sources and cycling of phosphorus in Peru Margin sediments using oxygen isotopes in authigenic and detrital phosphates. Geochimica et Cosmochimica Acta, 2010, 74(11): 3199-3212. DOI:10.1016/j.gca.2010.02.030 |
| [9] |
McLaughlin K, Kendall C, Silva SR et al. Phosphate oxygen isotope ratios as a tracer for sources and cycling of phosphate in North San Francisco Bay, California. Journal of Geophysical Research:Biogeosciences, 2006, 111(3): G03003. DOI:10.1029/2005JG000079 |
| [10] |
Pistocchi C, Tamburini F, Gruau G et al. Tracing the sources and cycling of phosphorus in river sediments using oxygen isotopes:Methodological adaptations and first results from a case study in France. Water Research, 2017, 111: 346-356. DOI:10.1016/j.watres.2016.12.038 |
| [11] |
Granger SJ, Heaton THE, Pfahler V et al. The oxygen isotopic composition of phosphate in river water and its potential sources in the Upper River Taw catchment, UK. Science of the Total Environment, 2017, 574: 680-690. DOI:10.1016/j.scitotenv.2016.09.007 |
| [12] |
Tonderski K, Andersson L, Lindström G et al. Assessing the use of δ18O in phosphate as a tracer for catchment phosphorus sources. Science of the Total Environment, 2017, 607/608: 1-10. DOI:10.1016/j.scitotenv.2017.06.167 |
| [13] |
Yuan HZ, Li Q, Kukkadapu RK et al. Identifying sources and cycling of phosphorus in the sediment of a shallow freshwater lake in China using phosphate oxygen isotopes. Science of the Total Environment, 2019, 676: 823-833. DOI:10.1016/j.scitotenv.2019.04.322 |
| [14] |
Lin JJ, Chen ZG, Liu GS. The preconcentration, separation and purification of phosphate for the seawater dissolved phosphate oxygen isotope composition analysis. Journal of Xiamen University:Natural Science, 2010, 49(2): 238-241. [林继军, 陈志刚, 刘广山. 应用于磷酸盐氧同位素测定的海水中溶解态磷酸盐的富集、分离与纯化. 厦门大学学报:自然科学版, 2010, 49(2): 238-241.] |
| [15] |
Tian LY, Guo QJ, He HJ et al. Progress on phosphate oxygen isotope technology in environmental science. Chinese Journal of Ecology, 2016, 35(7): 1947-1956. [田丽艳, 郭庆军, 何会军等. 磷酸盐氧同位素技术在环境科学中的研究进展. 生态学杂志, 2016, 35(7): 1947-1956.] |
| [16] |
McLaughlin K, Silva S, Kendall C et al. A precise method for the analysis of δ18O of dissolved inorganic phosphate in seawater. Limnology and Oceanography:Methods, 2004, 2(7): 202-212. DOI:10.4319/lom.2004.2.202 |
| [17] |
Colman AS. The oxygen isotope composition of dissolved inorganic phosphate and the marine phosphorus cycle[Dissertation]. Connecticut: Yale University, 2002.
|
| [18] |
Cid-Andres AP. A review on useful concepts for stable isotope of oxygen in phosphate (δ18OP) extraction, purification and analysis of freshwater samples and other potential phosphate sources. Microchemical Journal, 2015, 123: 105-110. DOI:10.1016/j.microc.2015.05.021 |
| [19] |
Lu YY, Zheng ZZ, Yin XJ et al. The measurement of oxygen isotope composition of dissolved inorganic phosphate in seawater. Acta Geoscientica Sinica, 2012, 33(6): 961-966. [卢阳阳, 郑珍珍, 尹希杰等. 海水溶解磷酸盐氧同位素组成的测定. 地球学报, 2012, 33(6): 961-966.] |
| [20] |
Tcaci M, Barbecot F, Helie J et al. A new technique to determine the phosphate oxygen isotope composition of freshwater samples at low ambient phosphate concentration. Environmental Science and Technology, 2019, 53(17): 10288-10294. DOI:10.1021/acs.est.9b00631 |
| [21] |
Liu Y, Wang JF, Chen JG et al. Pretreatment method for the analysis of phosphate oxygen isotope (δ18OP) of different phosphorus fractions in freshwater sediments. Science of the Total Environment, 2019, 685: 229-238. DOI:10.1016/j.scitotenv.2019.05.238 |
| [22] |
Zhang XM, Wang YR, Ma SZ et al. Comparison of pretreatment methods of oxygen isotope composition of phosphate in lake sediments. J Lake Sci, 2017, 29(2): 512-520. [张秀梅, 王亚蕊, 马书占等. 湖泊沉积物中磷酸盐氧同位素前处理方法对比. 湖泊科学, 2017, 29(2): 512-520. DOI:10.18307/2017.0227] |
| [23] |
Discharge standard of pollutants for municipal wastewater treatment plants. Beijing: Ministry of Ecology and Environment of the People's Republic of China, 2016. GB/T 18918-2016. [城镇污水处理厂污染物排放标准.北京: 中华人民共和国生态环境部, 2016. GB/T 18918-2016. ]
|
| [24] |
Editorial Board of "Water and wastewater monitoring and analysis methods", Ministry of Environmental Protection of the People's Republic of China ed. Water and wastewater monitoring and analysis methods:. 4th edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法:: 第4版. 北京: 中国环境科学出版社, 2002.]
|
| [25] |
Blake RE, Chang SJ, Lepland A. Phosphate oxygen isotopic evidence for a temperate and biologically active Archaean ocean. Nature, 2010, 464(7291): 1029-1032. DOI:10.1038/nature08952 |
| [26] |
Mine AH, Waldeck A, Olack G et al. Microprecipitation and δ18O analysis of phosphate for paleoclimate and biogeochemistry research. Chemical Geology, 2017, 460: 1-14. DOI:10.1016/j.chemgeo.2017.03.032 |
| [27] |
Xu ZF, Huang T, Yin XJ. Improvements in the preparation of phosphate for oxygen isotope analysis from soils and sediments. PLoS One, 2018, 13(9): e0204203. DOI:10.1371/journal.pone.0204203 |
| [28] |
Biedermann G, Sillén LG, Lindberg B et al. Studies on the hydrolysis of metal ions. part 30. A critical survey of the solubility equilibria of Ag2O. Acta Chemica Scandinavica, 1960, 14: 717-725. DOI:10.3891/acta.chem.scand.14-0717 |
| [29] |
Dettman DL, Kohn MJ, Quade J et al. Seasonal stable isotope evidence for a strong Asian monsoon throughout the past 10.7 m.y. Geology, 2001, 26(1): 31. DOI:10.1130/0091-7613(2001)0290031:ssiefa>2.0.co;2 |
| [30] |
Grimes V, Pellegrini M. A comparison of pretreatment methods for the analysis of phosphate oxygen isotope ratios in bioapatite. Rapid Communications in Mass Spectrometry, 2013, 27(3): 375-390. DOI:10.1002/rcm.6463 |
 2021, Vol. 33
2021, Vol. 33 

