(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008)
(3: 中国科学院大学中丹学院, 北京 100049)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
(3: Sino-Danish College, University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
鱼类是浅水湖泊食物网的重要组成部分,对于生态系统的结构和功能有着重要的影响[1].例如,浮游生物食性鱼类对大型浮游动物(如Daphnia spp.)的捕食会降低浮游动物对浮游植物的牧食压力,通过“下行控制”促进浮游植物生长和湖泊富营养化[2];底栖生物食性鱼类(如鲤, Cyprinus carpio)对底层食物的摄食会扰动沉积物,造成沉积物再悬浮,增加水体浊度和沉积物的营养盐释放,进而通过“上行效应”影响湖泊生态系统[3].
鲫(Carassius auratus)属于鲤科、鲫属,是一种中小型的底栖杂食性鱼类,广泛分布于我国各类水体[4-5].鲫具有较强的食性可塑性,食谱广[6].在特定生境中,底栖动物、浮游生物和沉水植物都能作为其主要食物支持其种群发展[7-8];同时鲫也具有较强的环境适应能力(如耐低氧、高温)且繁殖能力强[4, 9-10].因此在草型、藻型浅水湖泊中均易占据优势.例如,2004年太湖鱼类资源调查表明,鲫是仅次于梅鲚的优势鱼类,占鱼类总重量的8.4 % [5].在湖北长湖,鲤、鲫是排名前两位的优势鱼类(2014年调查),均占鱼类总生物量的20 %以上[11].对长江中下游近40个亚热带浅水湖泊的鱼类群落结构调查发现,鲫是该地区最重要的鱼类之一,其出现率高达70 %、平均生物量占比达27 % (于谨磊等,未发表数据).此外,在实施过鱼类清除的惠州西湖、无锡五里湖、武汉内沙湖,鲫种群都能够迅速恢复,成为优势鱼类[4, 8].
文献资料表明,鲫对浅水湖泊生态系统的影响有两种主要途径:1)作为底栖杂食性鱼类,鲫可以扰动沉积物,促进沉积物再悬浮,从而影响水体营养盐和光照水平,通过“上行效应”影响湖泊生态系统[12-14];2)鲫也可以捕食浮游动物,削弱其对浮游植物的牧食压力,通过“下行控制”影响藻类生长和湖泊营养盐循环[15].因此,对于浅水湖泊,鲫对生态系统的影响可能既有“上行效应”途径,也有“下行控制”途径,但二种途径的相对重要性还有待阐明.
基于此,我们设计了一个户外双因素中宇宙实验(因素1:有、无鲫;因素2:能、否扰动沉积物),通过在沉积物上方添加隔网的方式,比较鲫在能接触沉积物和不能接触沉积物两种情况下对水体浊度、营养盐和浮游生物生物量的影响.
1 材料与方法 1.1 实验设置本实验在中国科学院太湖湖泊生态系统研究站(位于无锡梅梁湾,31°24′13″N, 120°13′56″E)的实验平台上进行,实验于2019年8月6日开始,9月11日结束,共计36 d.实验期间水体温度变化范围为23.6~31.5℃,平均温度为27.8℃.实验设置了双因素:鲫(有、无两个水平)和隔网(有、无两个水平,有隔网的处理组鲫无法接触到沉积物),共4个处理组.每个处理组设4个重复,共16个实验单元.实验容器为定制的400 L大型玻璃钢实验桶(桶高90 cm,上直径为80 cm,下直径为69 cm).实验隔网为8 mm孔径的聚乙烯硬质隔网,裁剪成圆形后通过扎带固定在定制的不锈钢圆环(71 cm直径)上.实验用的鲫,购于浙江湖州鲫养殖场,实验前一周,将鲫暂养在盛有湖水的钢化玻璃桶中.
实验开始前20天,分别向每个实验桶加入10 cm厚的沉积物和300 L湖水后静置.沉积物和湖水均采集于太湖梅梁湾.沉积物经过孔径3 mm的筛网去除螺、贝等软体动物,充分混匀后分装入各实验桶.湖水采集后,先注入长宽各4 m,深度2.5 m的水泥池中混匀,再经过孔径64 μm的浮游生物网过滤后注入各实验桶中.
实验开始时(2019年8月6日),首先将准备好的隔网卡在钢化玻璃桶的内壁,固定位置为沉积物上方10 cm处.然后,挑选相同规格的鲫,添加到相应的处理组中,有鱼处理组的每个实验桶均添加2尾,每尾鱼的平均湿重为(1.70±0.13)g,平均体长为(4.83±0.18)cm,每个桶对应鲫的生物量约为(11.36±0.11)g/m3.实验期间每天观察鱼类的生长状况,死掉的鲫,用相同规格的鲫替换.实验结束时,无隔网组鲫的平均湿重为每尾(3.65±1.05)g、有网组鲫的平均湿重为每尾(3.12±1.33)g.
1.2 采样与指标测定实验期间,每5天采集一次水样(2019年8月11日受台风”利奇马”影响采样推迟一天),采样时间为上午8:00至9:00之间.采样前首先利用水下光量子仪(MQ-510)分别测定6个水深处(水面下0、0.1、0.2、0.3、0.4、0.5 m,均位于隔网上方)的水体光照强度(μmol/(m2 ·s)),计算光衰减系数Kd[16].
Kd计算公式为:
| $ K_{\mathrm{d}}=-\frac{1}{z} \ln \frac{E(z)}{E(0)} $ | (1) |
式中, Kd为光学衰减系数;z为深度;E(z)为z深度处的辐照度;E(0)为起始面辐照度.光照测定后,利用3 L柱状采水器采集12 L混合水样,在塑料桶内混匀后,取2 L水样带回实验室分析.实验室内, 先取500 mL水样测定总氮(TN)、总磷(TP)和叶绿素a(Chl.a)浓度,测定方法依据《湖泊富营养化调查规范》[17];另取1 L水样,先经过60 μm浮游生物网过滤去除浮游甲壳动物,然后滤液经一张提前烘干称重的GF/C膜过滤(过滤水样体积200~500 mL),再在烘箱中以104℃烘干4 h后称重,计算总悬浮物(TSS)浓度.最后在马弗炉内以550℃烧2 h,之后放入干燥器中冷却后再次称重,以此测定无机悬浮物(ISS)浓度[17].在本实验中,ISS浓度能够反映鲫扰动引起的沉积物再悬浮程度.
实验结束时,采集10 L水样,经过64 μm浮游生物网过滤,将滤液收集到50 mL小白瓶中,加入2 mL鲁戈试剂保存.实验室内,按照浮游动物分类方法[18], 在40~100倍显微镜下对甲壳类浮游动物和轮虫进行分类、计数和体长测量.浮游动物的生物量通过体长-体重公式换算.
1.3 统计分析光衰减系数、TN、TP、Chl.a和TSS、ISS浓度等时间序列数据采用两因素重复测量方差分析(rmANOVA)进行比较,如果交互作用显著,则进行简单效应分析,分别比较能、否接触沉积物情况下鲫对各指标的影响.采用两因素方差分析(two-way ANOVA)比较实验结束时浮游动物生物量在各处理组间的差异.在进行方差分析之前,对所有数据进行正态性和方差齐性检验.统计分析利用SPSS 21.0软件进行.
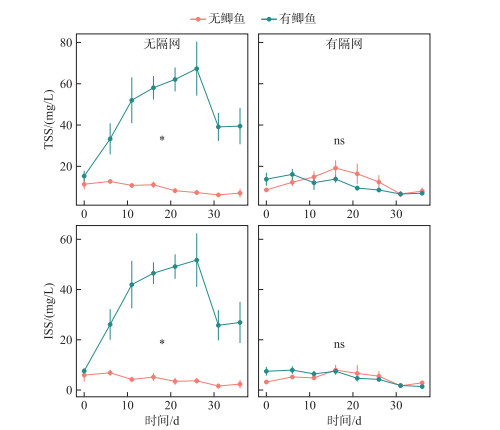
2 结果与分析 2.1 水体悬浮物浓度和光照鲫和隔网对水体悬浮物浓度具有显著的交互作用(表 1).在无隔网(能接触沉积物)条件下,鲫组TSS和ISS浓度分别是无鱼组的5.6倍和11.4倍,而在有隔网(不能接触沉积物)条件下,鲫对两个指标的影响均不显著(图 1, 表 1).
| 表 1 水体光照、营养盐和叶绿素a浓度的重复测量方差分析结果 Tab. 1 Results of repeated measures analysis of variance (rmANOVA) for water clarity, nutrients and chlorophyll-a concentration based on time-weighted data during the experiment |
|
图 1 实验期间4个处理组总悬浮物(TSS)和无机悬浮物(ISS)浓度变化(平均值±标准误,*代表P < 0.05, ns代表差异不显著;下同) Fig.1 Changes of total suspended solids (TSS) and inorganic suspended solids (ISS) in four treatments during the experimental period (mean ± SE, * represent P < 0.05, ns represent not significant; The sames below) |
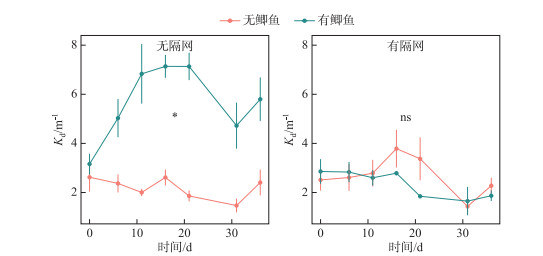
光衰减系数与悬浮物浓度变化趋势相同,在无隔网条件下,有鲫组水体光衰减系数Kd显著高于无鱼组,而在有隔网的条件下,鲫对Kd的影响不显著(图 2,表 1).
|
图 2 实验期间4个处理组光衰减系数Kd变化 Fig.2 Changes of light attenuation coefficient (Kd) in four treatments during the experimental period |
鲫和隔网对水体TN和TP具有显著的交互作用(表 1).在无隔网条件下,鲫显著提高了水体TN和TP浓度(P < 0.05;图 3);然而,在有隔网的条件下,有鱼组TN和TP浓度明显低于无鱼组(P < 0.05;图 3).

|
图 3 实验期间4个处理组营养盐变化 Fig.3 Changes of nutrient concentrations in four treatments during the experimental period |
隔网的存在显著提高了水体浮游植物Chl.a浓度(表 1).无论是有鱼还是无鱼条件下,隔网组Chl.a浓度都要明显高于对应的无隔网组(图 4).在无隔网的条件下,有鱼组Chl.a浓度略高于无鱼组;在有隔网的条件下,有鱼组水体Chl.a浓度要低于无鱼组(图 4),但是重复测量方差分析(rmANOVA)表明鲫,以及鲫与隔网的交互作用对浮游植物Chl.a浓度的影响均不显著(表 1).实验中的第10~25天之间,在有隔网的条件下,有鱼组水体Chl.a浓度显著低于无鱼组(P < 0.05)(图 4).

|
图 4 实验期间4个处理组叶绿素a浓度变化 Fig.4 Changes of chlorophyll-a concentration in four treatments during the experimental period |
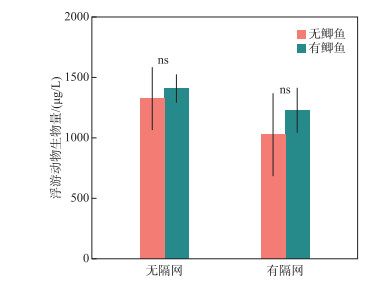
实验结束时,4个处理组浮游动物均以哲水蚤(Sinocalanus dorrii)为主,占各处理组浮游动物总生物量的70 %以上.枝角类包括秀体溞(Diaphanosoma sp.)、网纹溞(Ceriodaphnia sp.)、尖额溞(Alona sp.)和象鼻溞(Bosmina longirostris),无大型枝角类.轮虫以方形臂尾轮虫(Brachionus quadridentatus)、螺形龟甲轮虫(Keratella cochlearis)和月形腔轮虫(Lecane sp.)为优势种类.有隔网的处理组浮游动物生物量略低于无隔网的处理组(图 5),但鲫和隔网,以及二者的交互作用对浮游动物总生物量的影响均不显著(P>0.05;图 5).
|
图 5 实验结束时4个处理组浮游动物生物量(ns代表差异不显著) Fig.5 Zooplankton biomass of the four treatments at the end of the experiment (ns represent not significant) |
鲫主要通过吞食沉积物后排出无机颗粒,保留有机质的方式摄取食物[15].对于浅水湖泊,鲫的这种摄食方式容易造成较强的沉积物再悬浮,提升水体浊度,促进沉积物营养盐释放,从而提高水体营养水平,通过“上行效应”促进浮游植物生长.此外,也有研究表明鲫(尤其是幼鱼)同样能够摄食浮游动物,降低浮游动物对浮游植物的牧食压力,从而通过“下行效应”影响浮游植物生长和营养盐循环[7, 19].对于富营养浅水湖泊,两种途径对生态系统影响的相对重要性还有待阐明.本研究通过在沉积物上方设置隔网的方式,比较能、否接触沉积物条件下鲫对水体光照、营养盐和浮游生物生物量的影响.结果发现鲫只有在能够接触沉积物(无隔网)的条件下,才会对水质产生显著的负面影响,表现为水体浊度和营养盐浓度大幅升高(图 1~图 3).而在有鱼和无鱼条件下,浮游动物和浮游植物生物量均无明显差异(图 4,图 5),这些结果说明了在本实验中,鲫扰动沉积物引起的“上行效应”是其对生态系统产生负面影响的主要途径.
在无隔网条件下,鲫显著提高了水体的总悬浮物和无机悬浮物浓度(图 1),反映了一个鱼类引起的沉积物再悬浮过程.这一过程也是导致有鱼组水体光照降低(图 2)以及营养盐浓度升高(图 3)的主要原因,与He等[7, 19]等类似的鲫实验结果一致.本研究中有鱼组水体Chl.a浓度并没有随着营养水平的提高而随之上升(图 4),这一点与以往的研究结果不同[7, 19],这可能是因为本实验中鱼类扰动导致的高浊度条件(图 2)抑制了浮游植物在高营养水体中的生长.国外对鲤鱼(C. carpio)的研究中也曾报道过类似的现象,例如Wahl等[20-21]进行的围隔实验发现在富营养的水体中,添加高密度鲤鱼明显提高了水体浊度,而浮游植物的生物量反而降低.因此,鱼类(如鲤、鲫等)扰动对浮游植物生长的影响是水体光照和营养盐变化条件下的共同结果,取决于鱼类密度以及环境本底浓度等.
在有隔网的条件下,鲫不能接触沉积物,只能通过排泄和捕食过程影响生态系统,本研究发现在这种情况下,鲫对水体悬浮物浓度和光照的的影响均不明显(图 1,图 2).相反,有鱼组水体的TN、TP浓度均明显降低,这可能要归因于鲫对水体有机颗粒物的直接摄食.尽管统计学差异不显著,但是本研究发现有隔网条件下,有鱼组水体Chl.a浓度从第10~25天要明显低于无鱼组(图 4).野外调查研究也表明鲫除了能够摄食底栖动物和浮游动物等动物性饵料外,也能够取食植物饵料,如高等水生植物和浮游植物[8, 19].刘恩生分析了太湖鲫的肠道内含物,发现在7—12月,微囊藻占太湖鲫食物体积的90 %左右[22].袁兆祥等研究发现体长4 cm的鲫主要以大型浮游动物、藻类和有机碎屑为食,并且藻类的贡献随鲫体长的增加而进一步提升[23].王晓平等研究表明,鲫会摄食水绵(绿藻门丝状藻类)[24].本研究中,鲫在无法接触到底层食物的条件下可能会直接摄食浮游植物,其对浮游植物的移除导致了水体TN和TP浓度的降低,该现象在滤食性鱼类(如鲢、鳙)研究中较为普遍[25].
4 结论1) 在鲫能接触沉积物的条件下,鲫引起的沉积物再悬浮显著提高了水体的无机和有机悬浮物浓度,导致水体的光照强度降低,水体TN和TP浓度显著升高.
2) 在鲫不能接触沉积物的条件下,鲫的存在对水体悬浮物浓度和光照的影响不明显,但是显著降低了水体的TN和TP浓度.
3) 两种条件下,鲫对浮游植物叶绿素a浓度和浮游动物总生物量的影响均不明显.
| [1] |
Jeppesen E, Søndergaard M, Lauridsen TL et al. Biomanipulation as a restoration tool to combat eutrophication. Advances in Ecological Research, 2012, 47(2012): 411-488. DOI:10.1016/B978-0-12-398315-2.00006-5 |
| [2] |
Jeppesen E, Meerhoff M, Jacobsen BA et al. Restoration of shallow lakes by nutrient control and biomanipulation the successful strategy varies with lake size and climate. Hydrobiologia, 2007, 581: 269-285. DOI:10.1007/s10750-006-0507-03 |
| [3] |
Fischer JR, Krogman RM, Quist MC. Influences of native and non-native benthivorous fishes on aquatic ecosystem degradation. Hydrobiologia, 2013, 711(1): 187-199. DOI:10.1007/s10750-013-1483-z |
| [4] |
Gao J, Liu ZW, Jeppesen E. Fish community assemblages changed but biomass remained similar after lake restoration by biomanipulation in a Chinese tropical eutrophic lake. Hydrobiologia, 2014, 724(1): 127-140. DOI:10.1007/s10750-013-1729-9 |
| [5] |
Liu ES, Liu ZW, Bao CH. The changes of catches of Carassius auratus and relationship with environment in Lake Taihu, China. J Lake Sci, 2007, 19(3): 345-350. [刘恩生, 刘正文, 鲍传和. 太湖鲫鱼数量变化的规律及与环境间关系的分析. 湖泊科学, 2007, 19(3): 345-350. DOI:10.18307/2007.0318] |
| [6] |
Le PQ. Fauna Sincia Osteichthyes Cypriniformes Ⅲ. Beijing: Science Press, 2000. [乐佩琦. 中国动物志·硬骨鱼纲鲤形目(下卷). 北京: 科学出版社, 2000.]
|
| [7] |
He H, Hu E, Yu JL et al. Does turbidity induced by Carassius carassius limit phytoplankton growth? A mesocosm study. Environmental Science and Pollution Research, 2017, 24(5): 5012-5018. DOI:10.1007/s11356-016-8247-z |
| [8] |
Yu JL, Liu ZW, He H et al. Submerged macrophytes facilitate dominance of omnivorous fish in a subtropical shallow lake: Implications for lake restoration. Hydrobiologia, 2016, 775(1): 97-107. DOI:10.1007/s10750-016-2717-7 |
| [9] |
González-Bergonzoni I, Meerhoff M, Davidson TA et al. Meta-analysis shows a consistent and strong latitudinal pattern in fish omnivory across ecosystems. Ecosystems, 2012, 15(3): 492-503. DOI:10.1007/s10021-012-9524-4 |
| [10] |
Jeppesen E, Meerhoff M, Holmgren K et al. Impacts of climate warming on lake fish community structure and potential effects on ecosystem function. Hydrobiologia, 2010, 646(1): 73-90. DOI:10.1007/s10750-010-0171-5 |
| [11] |
He YF, Li HC, Wang XG et al. Spatial-temporal variation of fish community structure in Lake Changhu. Resources and Environment in the Yangtze Basin, 2016, 25(2): 265-273. [何勇凤, 李昊成, 王旭歌等. 长湖鱼类群落结构的时空变化. 长江流域资源与环境, 2016, 25(2): 265-273.] |
| [12] |
Bernes C, Carpenter SR, Gårdmark A et al. What is the influence of a reduction of planktivorous and benthivorous fish on water quality in temperate eutrophic lakes? A systematic review. Environmental Evidence, 2015, 4(1): 1-28. DOI:10.1186/s13750-015-0032-9 |
| [13] |
Richardson MJ, Whoriskey FG, Roy LH. Turbidity generation and biological impacts of an exotic fish Carassius auratus, introduced into shallow seasonally anoxic ponds. Journal of Fish Biology, 1995, 47(4): 576-585. DOI:10.1111/j.1095-8649.1995.tb01924.x |
| [14] |
Meijer ML, Haan MW, Breukelaar AW et al. Is reduction of the benthivorous fish an important cause of high transparency following biomanipulation in shallow lakes?. Hydrobiologia, 1990, 200/201: 303-315. DOI:10.1007/bf02530348 |
| [15] |
Liu ZW, Hu JR, Zhong P et al. Successful restoration of a tropical shallow eutrophic lake: Strong bottom-up but weak top-down effects recorded. Water Research, 2018, 146: 88-97. DOI:10.1016/j.watres.2018.09.007 |
| [16] |
Zhang YL, Qin BQ, Chen WM et al. Analysis on distribution and variation of beam attenuation coefficient of Taihu Lake's water. Advances in Water Science, 2003, 14(4): 347-353. [张运林, 秦伯强, 陈伟民等. 太湖水体光学衰减系数的分布及其变化特征. 水科学进展, 2003, 14(4): 347-353.] |
| [17] |
Jin XC, Tu QY. Lake eutrophication investigation specification: The second edition. Beijing: China Environmental Science Press, 1990. [金相灿, 屠清瑛. 湖泊富营养化调查规范: 第二版. 北京: 中国环境科学出版社, 1990.]
|
| [18] |
Zhou LB, Chen FZ. Effect of sediment resuspension on predation of planktivorous fish on zooplankton. J Lake Sci, 2015, 27(5): 911-916. [周礼斌, 陈非洲. 沉积物再悬浮对食浮游动物鱼类捕食浮游动物的影响. 湖泊科学, 2015, 27(5): 911-916. DOI:10.18307/2015.0518] |
| [19] |
Gu J, Jin H, He H et al. Effects of small-sized crucian carp (Carassius carassius) on the growth of submerged macrophytes: Implications for shallow lake restoration. Ecological Engineering, 2016, 95: 567-573. DOI:10.1016/j.ecoleng.2016.06.118 |
| [20] |
Wahl DH, Wolfe MD, Jr Santucci VJ et al. Invasive carp and prey community composition disrupt trophic cascades in eutrophic ponds. Hydrobiologia, 2011, 678(1): 49-63. DOI:10.1007/s10750-011-0820-3 |
| [21] |
Badiou PHJ, Goldsborough LG. Ecological impacts of an exotic benthivorous fish, the common carp (Cyprinus carpio L.), on water quality, sedimentation, and submerged macrophyte biomass in wetland mesocosms. Hydrobiologia, 2015, 755(1): 107-121. DOI:10.1007/s10750-015-2220-6 |
| [22] |
Liu ES. A study on diet composition of dominant fishes in Lake Taihu. Journal of Fisheries of China, 2008, 32(3): 395-401. [刘恩生. 太湖主要鱼类的食物组成. 水产学报, 2008, 32(3): 395-401.] |
| [23] |
Yuan ZX, Wu BJ, Wang YZ et al. Study on feeding habits of Chuzhou crucian carp. Hebei Fisheries, 2010(1): 7-9. [袁兆祥, 吴泊君, 汪永忠等. 滁州鲫鱼食性的初步研究. 河北渔业, 2010(1): 7-9.] |
| [24] |
Wang XP, Wang YB, Yang GJ et al. The effects of different fish species on growth of submerged macrophytes. J Lake Sci, 2016, 28(6): 1354-1360. [王晓平, 王玉兵, 杨桂军等. 不同鱼类对沉水植物生长的影响. 湖泊科学, 2016, 28(6): 1354-1360. DOI:10.18307/2016.0621] |
| [25] |
Chen SL, Liu XF, Hua L. The role of silver carp and bighead in the cycling of nitrogen and phosphorus in the east lake ecosystem. Acta Hydrobiologica Sinica, 1991, 15(1): 8-26. [陈少莲, 刘肖芳, 华俐. 鲢、鳙在东湖生态系统的氮、磷循环中的作用. 水生生物学报, 1991, 15(1): 8-26.] |
 2021, Vol. 33
2021, Vol. 33 


