(2: 安徽大学湿地生态保护与修复安徽省重点实验室, 合肥 230601)
(3: 淮南师范学院生物工程学院, 淮南 232038)
(2: Anhui Province Key Laboratory of Wetland Ecosystem Protection and Restoration, Anhui University, Hefei 230601, P. R. China)
(3: College of Biological Engineering, Huainan Normal University, Huainan 232038, P. R. China)
动物群落具有十分复杂的结构,是物种间相互作用的结果[1-2].集团(Guild)被认为是构建群落的基本功能单元[3-4].研究者普遍认为群落的结构和群落的组织过程,就是相似的物种集团(同资源种团)通过竞争资源,形成资源利用格局的结果[1, 5-9].同属一个集团的物种彼此在资源利用上会有明显的重叠,所以同属一个集团的物种间比属不同集团的物种间彼此更易产生竞争[10].
集团的结构和生态位特征可以用于量化动物群落组织过程[2].集团划分的主要依据是资源位的利用情况.物种利用资源的宽度和重叠,在群落结构的分析中非常重要,前者表示物种生态特化的程度,后者表示种间潜在的相互作用水平.目前,研究群落的资源利用格局大部分是在生态位理论的框架下,通过计算生态位宽度(niche breadth)和生态位重叠度(niche overlap)两个指标来进行的[1, 8-9, 11]. Hutchinson从空间和资源利用等多方面考虑,提出了多维生态位(multidimensional niche)概念[12].基于这一定义,生态位宽度就是指物种对一定资源利用的程度.生态位重叠度是指两个或者多个物种在利用同一资源上重叠的状况.所以,生态位宽度和生态位重叠为探讨群落的生态过程如对共享资源的竞争提供了一个间接的途径[13].在研究资源利用格局时,通常选择栖息地的利用空间、利用时间以及食性组成3个重要生态位维度,从而更好地理解群落结构形成与群落组织的过程.由于食性数据的缺乏,为了避免研究物种的食性,在假设物种使用不同的觅食行为能反映不同的食物类型[14]的基础上,大多数研究采用取食行为(feeding behavior)代替食物类型对集团进行划分[5, 7-9, 14-15].
水鸟是湿地生态系统的重要指示类群,其群落结构的维持和稳定取决于湿地环境质量.食物资源丰富度和可获得性是越冬水鸟生态的最重要的制约因素,直接体现在群落各集团结构组成和生态位的变化.近几年随着长江中下游流域湖泊资源的过度利用,湿地严重退化,越冬水鸟的适宜栖息地不断丧失,在严酷寒冷的越冬期食物、空间等资源极其有限,使越冬水鸟无论种间还是种內竞争更加激烈[16-17].因此研究水鸟集团结构和生态位对于水鸟越冬生态的理解和加强湿地管理具有重要意义.升金湖是长江中下游的一个具有代表性的浅水通江湖泊,是越冬水鸟的重要聚集区.近年来,由于高强度养殖活动,湖泊退化严重,影响了水鸟群落结构及其稳定性.
目前国内外对陆地和水鸟的集团结构和生态位研究均较多,其中对水鸟的集团结构和生态位的研究多集中在海滨湿地[5, 15]和湖泊湿地[8-9]两种湿地类型的越冬水鸟群落上. Gatto和Liordos分别对阿根廷巴塔哥尼亚海岸的海滨湿地和希腊境内的地中海海滨湿地上的水鸟群落进行了集团结构和生态位的研究,认为海滨湿地中各觅食生境(浅水到岸线潮汐带渐变的生境)中水的含量是觅食集团间资源分割最重要的划分因素,集团间水鸟生态位重叠度较低,各集团间资源分割较为明显,集团内生态位重叠虽然较高,但水鸟集团内通过利用不同的觅食生境区域,产生了生态位分离,从而达到共存[5, 18].例如Liordos研究表明,浅水集团内的水鸟物种通过利用不同深度的水域从而达到进一步的生态位分离[18]. Pérez-Crespo等于2013年研究墨西哥一个陆缘湖泊湿地的水鸟群落,利用觅食行为、栖息地利用和栖息地利用时间3个生态维度,对水鸟群落进行集团划分,通过对比基于零模型的集团结构,探讨了水鸟群落集团结构的生态形成机制,得出竞争因素可能不是群落构建的唯一因素,中性理论的随机因素也可能参与其中[8]. Chatterjee等于2020年对印度一个湖泊湿地的越冬水鸟群落进行了研究,水鸟群落的集团结构和生态位特征是两个重要的指标,表征湿地承载水鸟物种能力的指标[9].国内越冬水鸟群落的研究很广泛,特别是在长江中下游地区的湖泊湿地和入海口的海滨湿地.这些研究分析了群落的组成与多样性、栖息地的评价和利用、栖息地的演变对群落的影响、空间分布、季节动态[19-25].然而,越冬水鸟群落的集团结构研究较少[7].因此,需要对水鸟群落结构进行更多的研究.
本文旨在通过升金湖越冬水鸟的觅食生境和觅食行为的观察,对水鸟群落的集团结构进行划分,分析越冬水鸟各集团种间的生态位宽度和生态位重叠度特征,探讨食物资源配置对越冬水鸟集团结构的影响,为越冬水鸟及期栖息地管理提供科学依据.
1 研究方法 1.1 研究地点升金湖(30°16′~30°26′N, 116°58′~117°11′E)位于安徽省长江南岸的池州市境内,是长江中下游地区典型的浅水通江湖泊之一,分上湖、中湖和下湖三个部分.水位在夏季(6-8月,雨季)上升到最高(17 m),湖泊面积达到最大(14000 hm2),在冬季(12月-次年2月,旱季)水位下降到最低的10 m,湖泊面积达到最小(3400 hm2).湖泊所在地区属北亚热带湿润带,年平均气温16.1℃,1月份平均气温4.0℃.年平均降雨量为1600 mm.升金湖沉水植物优势种包括金鱼藻(Ceratophyllum demersum)、马来眼子菜(Potamogeton malaianus)和苦草(Vallisneria spiralis);漂浮植物优势种包括芡实(Euryale ferox)、莕菜(Nymphoides peltatum);湖泊岸边植物优势种包括虉草(Phalaris arundinacea)、单性苔草(Carex unisexualis)、灰化苔草(Carex cinerascens)、朝天委陵菜(Potentilla supine)和酸模叶蓼(Polygonum lapathifolium)[26].湖泊周围农田主要种植水稻、棉花和油菜.冬季湖水退去,泥滩暴露,为越冬水鸟提供各种觅食栖息地,是东亚-澳大利西亚迁徙水鸟重要的停歇和越冬地,每年在此越冬的水鸟占整个长江中下游湿地水鸟总数的5 % ~10 %,越冬水鸟的种类超过60种,数量超过5万只,其中数量较多的有豆雁(Anser fabalis)、白额雁(Anser albifrons)、白琵鹭(Platalea leucorodia)、小天鹅(Cygnus columbianus)、白头鹤(Grus monacha)等[27].升金湖于1986年被批准为省级自然保护区,于1997年成为国家级自然保护区,2015年列入国际重要湿地名录.
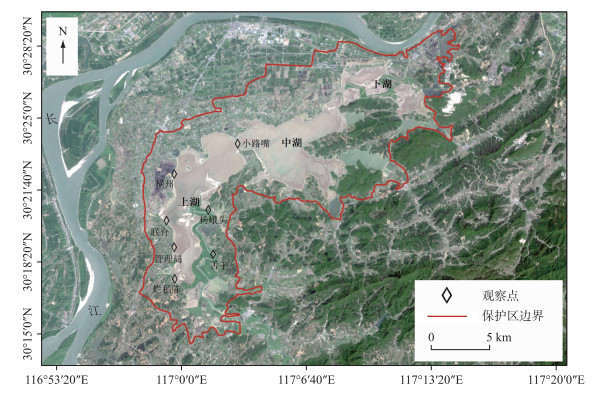
本研究区域位于升金湖上湖,沿湖泊岸线设置调查样线,在样线上设置观察点.升金湖水鸟大多数分布在上湖,根据水鸟和觅食生境的分布情况,本研究共设置7个具有代表性的观察点(图 1).
|
图 1 升金湖水鸟调查地点 Fig.1 Study sites of waterbird survey at Lake Shengjin |
水鸟的调查时间为2014年12月至2015年3月,每月进行4次,共16次,调查时间为7:00-11:00和13:00-17:00.每次调查从不同的位置和方向开始, 以避免顺序影响.在观察点之间切换时,将鸟群和个别鸟类的移动情况考虑在内,以避免重复收集同一个体的信息.在每个观察点使用定点计数法,观察半径为500 m.以双筒(8×42)和单筒(16/52×80)望远镜进行扫描取样法记录水鸟的觅食行为和觅食生境数据.
每次调查在2 d内完成,在每个观察点观察不少于2 h,各观察点计数时每30 min扫描一次,即每次调查对每个观察点的扫描次数不少于4次.记录观察范围内各水鸟个体的觅食行为和觅食生境.
由于对同一个体的连续观测的样本并不是独立的,会受时间自相关的影响(每次观测通常与以前的观测相关[28]).为了观测到每个物种尽可能多的代表性个体并避免对同一个体的连续观测,调查采用初始观察法(即每次扫描时只记录各水鸟个体的第一次觅食行为和觅食生境),扫描4次则记录4次.这种方法根据同一物种更多的个体抽样的初始观察,确定该物种具有代表性的觅食特征[8-9, 15].
1.3 觅食行为的划分将觅食行为方式定义如下:(D)潜水取食,整个身体潜入水面下取食;(PM)用喙深入泥滩中两边挖掘取食;(HS)头部入水取食, 可以是运动也可以静止取食;(BS)喙部入水取食,可以是运动也可以静止取食;(NS)颈部入水取食, 可以是运动也可以静止取食;(FL)在运动中喙部分入水滤取水中的食物;(PC)在水里、泥滩或草滩上的间歇的啄食的方式取食;(UP)取食时倒立垂直入水,身体不完全入水, 尾部和腿部在水面以上[29].
1.4 觅食生境划分觅食生境的划分参照Pöysä对生境的划分[29], 根据水深和植被两种因素划分的水鸟觅食生境.每个月测量一次水深,具体测量方法是在每个观察点位置从湖岸边朝湖中心每隔100 m放置一根有浮标记号的铅坠绳,每个观察点放置5条记号绳.此外每月还监测湖中心的深度,以跟踪水位的变化.
划分了9种觅食生境:(1)水深大于30 cm的开阔水域中心区,有植被(DWV)或者无植被(DW);(2)水深大于10 cm小于30 cm的开阔水域边缘区,有植被(MWV)或者无植被(MW);(3)水深小于10 cm的沿湖岸线浅水区,有植被(SWV)或(SW)无植被;(4)紧邻浅水区的泥滩湿地,有植被(MUV)(即草滩)或者无植被(MU)(即泥滩);(5)紧邻湖边周围的水稻田(RF).
1.5 数据分析将观察到的取食记录建立数据矩阵,舍弃记录次数少于10次的鸟种.为了观测到每个物种尽可能多的代表性个体并且避免对同一个体的连续观测,我们只使用每个个体记录的第一次进食行为.数据将分为3个矩阵:觅食生境(31种×9种生境变量)、觅食行为(31种×8种觅食行为变量)、两种同时存在(31种×57种觅食行为与生境变量的组合).矩阵的每一行代表一个不同的物种.每一列代表一个不同的变量(资源或生态位).每个记录表示取食个体的数量.然后将矩阵项计算为物种对任何特定资源观察利用的比例.这些比例的计算方法是将所有资源的计数(行)相加,然后将每个资源计数(原始矩阵中的一个条目)除以其总数(行总数).因此对于每种鸟,最终矩阵行中各项的和为1.0.这些一维(觅食生境和觅食行为)和二维矩阵用于建立群落生态位宽度和生态位重叠.
1.6 集团的划分采用聚类分析的方法划分集团.为了减少变量分布的峰度,我们将原始矩阵进行数据转换(角变换y=arcsine x0.5)[8].将上述经过数据转换后的二维矩阵(觅食生境和觅食行为组合的二维矩阵)输入生态学软件PC-ORD 5.0进行聚类分析,聚类方法采用欧式距离的离差平方和法.
1.7 生态位的宽度和生态位重叠利用前面提到的单维和二维的原始矩阵(觅食生境(31种×9种生境变量)、觅食行为(31种×8种觅食行为变量)、两种同时存在(31种×57种觅食行为与生境变量的组合))来计算生态位宽度(每个物种)和生态位重叠(所有物种之间的重叠).
采取Levins指数和Pianka指数分别计算生态位宽度[30]和生态位重叠指数[31]. Levins生态位宽度指数:B =(1/ΣPi2),Pi是物种i利用每列资源的比例.当每列至少有一个计数时B最大;当所有计数都在同列时B最小. Pianka指数:Ojk = (ΣPij Pik)/(ΣPij2 ΣPik2)1/2,Pij和Pik分别是物种j和物种k利用i资源的相对比例. Pianka指数取值范围从0 (两个物种之间没有共同使用的资源)到1(资源使用完全重叠).
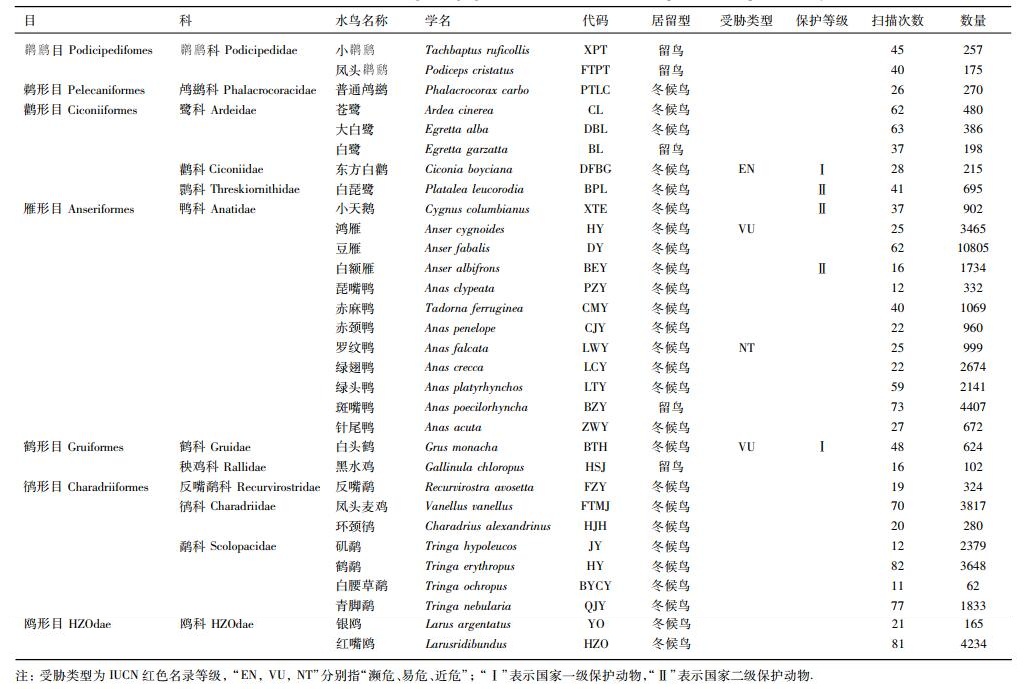
2 结果 2.1 水鸟群落集团结构及其组成本研究共涉及7目12科31种水鸟,其中28种冬候鸟和3种留鸟.鹈形目有1科1种,
记录的鸟类中被列入《世界自然保护联盟濒危物种红色名录》(IUCN)的有4种.其中,濒危(EN)1种:东方白鹳(Ciconia boyciana);易危(VU)2种:鸿雁(Anser cygnoides)、白头鹤;近危(NT)1种:罗纹鸭(Anas falcata).列入《中国重点保护名录》(PROT)的鸟类有5种.其中,Ⅰ级保护的有2种:东方白鹳、白头鹤;Ⅱ级保护的有3种:白琵鹭、小天鹅、白额雁.
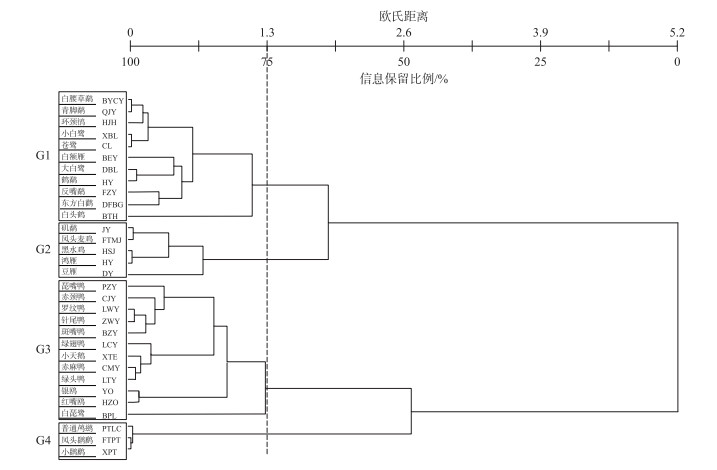
根据觅食行为和生境利用特征(附表Ⅱ),通过聚类分析,在欧氏距离1.3处,可将水鸟群落结构划分为4个觅食集团(图 2). (G1)浅水啄食集团(pickers in shallow-water)、(G2)草滩啄食集团(pickers in grassland)、(G3)泛化种集团(generalists)和(G4)深水潜水集团(divers)包含的物种数分别为11种、5种、12种和3种.这4个觅食集团分别主要利用4种不同水深类型的觅食生境类型:浅水泥滩区、草滩、中水区和深水区.利用浅水和中水的集团包含的物种数较多,而利用深水和草滩的集团包含的物种数较低.
|
图 2 基于觅食行为和觅食生境两维生态位的水鸟集团聚类分析 (所有水鸟物种之间的平均欧氏距离用虚线表示(平均值为1.3)(集团代码(G1)浅水啄食集团;(G2)草滩啄食集团;(G3)广食性集团;(G4)深水潜水觅食集团) Fig.2 Cluster analysis of waterbird guild based on the niche dimensions of feeding technique and feeding habitat (The average Euclidean distance between all species pairs is indicated by a dashed line (mean value is 1.3). Guild codes for the obtained guilds are(G1) pickers in shallow-water; (G2) pickers in grassland; (G3) generalists; and (G4) divers) |
第1集团(G1)浅水啄食集团,主要是一些鸻鹬类、鹭类和鹤鹳类,这些涉禽主要在无植被的浅水区和泥滩区觅食,包括白腰草鹬(Tringa ochropus)、青脚鹬(T. nebularia)、鹤鹬(T. erythropus)、反嘴鹬(Recurvirostra avosetta)、环颈鸻(Charadrius alexandrinus)、白鹭(Egretta garzetta)、苍鹭(Ardea cinerea)、大白鹭(Egretta alba)、白额雁、东方白鹳、白头鹤.该集团鸟类觅食行为使用频率最高的是间歇型啄食行为方式(PC),其次是用喙深入泥滩中两边挖掘取食的行为方式(PM),平均使用频率分别为86.5 %和9.9 %;集团鸟类觅食生境使用频率最高的是浅水区(SW),其次是泥滩(MU),平均使用频率分别为44.2 %和39.1 %.所以,该集团鸟类是采用较为特化和单一的觅食行为,并主要利用浅水和泥滩的觅食生境的水鸟集团.
第2集团(G2)草滩啄食集团,主要是一些在湿地草滩区觅食的种类,种类包括矶鹬(Tringa hypoleucos)、凤头麦鸡(Vanellus vanellus)、黑水鸡(Gallinula chloropus)、鸿雁(Anser cygnoides)和豆雁.该集团鸟类觅食行为全部采用单一的间歇型啄食行为方式(PC),使用频率为100.0 %;集团鸟类觅食生境使用频率最高的是草滩(MUV),其次是泥滩(MU),平均使用频率分别为68.6 %和15.4 %.所以,该集团鸟类是采用单一的啄食行为,并主要利用草滩的觅食生境的水鸟集团.
第3集团(G3)广食性集团,主要是一些鸭类和鸥类,在水域里通过喙、头、脖子和身体倒立垂直入水取食的方式,种类包括琵嘴鸭(Anas clypeata)、赤颈鸭(A. penelope)、罗纹鸭(A. falcate)、斑嘴鸭(A. poecilorhyncha)、针尾鸭(A. acuta)、赤麻鸭(Tadorna ferruginea)、绿翅鸭(A. crecca)、绿头鸭(A. platyrhynchos)、银鸥(Larus argentatus)、红嘴鸥(L. ridibundus)、小天鹅、白琵鹭.该集团鸟类属于泛化种,使用各种觅食行为,使用频率较高的有颈部入水取食(NS)、头部入水取食(HS)和身体倒立垂直入水取食(UP)3种方式,平均使用频率分别为26.8 %、25.3 %和21.1 %;集团鸟类觅食生境使用频率最高的是中水区(MW),其次是深水区(DM),平均使用频率分别为41.3 %和30.4 %.所以,该集团鸟类是采用各种觅食行为,并主要利用中水区和深水区觅食生境的水鸟集团.
第4集团(G4)深水潜水觅食集团,主要是一些特化为深水区和中水区潜水取食的水鸟,包括普通鸬鹚(Phalacrocorax carbo)、小䴙䴘(Tachybaptus ruficollis)、凤头䴙䴘(Podiceps cristatus).该集团鸟类觅食行为使用频率最高的是潜水取食行为方式(D),平均使用频率为99.3 %;集团鸟类觅食生境使用频率最高的是深水区(DW),其次是中水区(MW),平均使用频率分别为74.7 %和17.1 %.所以,该集团是采用较为特化和单一的潜水觅食行为,并主要利用深水区觅食的水鸟集团.
2.2 觅食集团的生态位特征越冬水鸟群落所有物种的平均生态位宽度为4.19(两个维度)、2.14(觅食生境)和1.88(觅食行为)(表3).根据觅食生境和觅食行为二维矩阵计算的生态位宽度,最宽的水鸟物种是赤麻鸭,其次是绿头鸭,最窄的是黑水鸡,其次是鸿雁.根据觅食生境计算的觅食生态位宽度,最宽的是白鹭和苍鹭,其次是赤麻鸭和红嘴鸥,最窄的是黑水鸡,其次是鸿雁.根据觅食行为计算的觅食生态位宽度,最宽的是绿头鸭,其次是赤麻鸭,最窄的是凤头䴙䴘、小䴙䴘、白琵鹭、豆雁、鸿雁、黑水鸡、凤头麦鸡、矶鹬、鹤鹬、大白鹭、白额雁、苍鹭、白鹭、环颈鸻、青脚鹬和白腰草鹬,其次是普通鸬鹚.
根据觅食生境和觅食行为二维矩阵计算的生态位宽度,G3广食性集团的平均生态位宽度最宽,远高于总体所有水鸟物种的平均生态位宽度和其它集团的平均生态位宽度;G2草滩啄食集团平均生态位宽度最窄.根据觅食生境计算的生态位宽度,G1浅水啄食集团平均生态位宽度最宽,其次是相差不大的G3广食性集团;G2草滩啄食集团平均生态位宽度最窄,其次是相差不大的G4深水潜水觅食集团.根据觅食行为计算的生态宽度,G3广食性集团平均生态位最宽,远高于其它3个集团和总体所有水鸟物种的平均生态位宽度;G1浅水啄食集团、G2草滩啄食集团和G4深水潜水觅食集团的平均生态位宽度都非常窄,远低于G3广食性集团平均生态位.总之,G3广食性集团的生态位宽度无论在哪个维度上都表现的较宽,在生境利用和觅食行为上都表现出很大的灵活性.
越冬水鸟群落所有物种之间的平均生态位重叠度为0.35(觅食行为)、0.41(生境利用)和0.20(两个维度)(附表Ⅲ,Ⅳ).相对于单维生态位重叠程度,二维生态位重叠程度较低,其中单维中的觅食生境维度的生态位重叠度较其它维度高. G1集团中,白鹭和苍鹭之间的生态位重叠最高,白头鹤和鹤鹬之间的生态位重叠最低. G2集团中,鸿雁和黑水鸡之间的生态位重叠最高,豆雁和凤头麦鸡之间的生态位重叠最低. G3集团中,罗纹鸭和斑嘴鸭之间的生态位重叠最高,白琵鹭和红嘴鸥、银鸥、小天鹅之间的生态位重叠最低. G4集团中,凤头䴙䴘和小䴙䴘之间的生态位重叠最高,凤头䴙䴘和普通鸬鹚之间的生态位重叠最低.
集团间生态位重叠低,集团内生态位重叠高.同一集团内物种间的生态位重叠度平均值为0.83(觅食行为)、0.78(生境利用)和0.68(两个维度),远高于集团间的生态位重叠值0.27(觅食行为)、0.32(生境利用)和0.07(两个维度)(表 2).根据觅食生境和觅食行为二维矩阵计算的生态位重叠度,G4集团最高,其次是G1集团和G2集团. G3集团的生态位重叠度(0.49)最低,低于其它特化集团内物种的生态位重叠度(0.60~0.99).
| 表 1 各集团水鸟的觅食生态位宽度 Tab. 1 The niche breadth of waterbirds foraging guild |
| 表 2 各集团内、集团间生态位重叠值 Tab. 2 Mean overlap values of inter-guild and intra-guild niche |
升金湖越冬水鸟各集团种间的生态位有以下4个特征:1)升金湖越冬水鸟群落被划分的4个觅食集团,其中G3集团的生态位宽度远高于其余3个特化集团;2)升金湖越冬水鸟的觅食行为较特化,在觅食生境方面却较宽化;3)同一集团内物种间的生态位重叠远高于集团间的生态位重叠;4)泛化集团内物种的生态位重叠度低于其它特化集团内物种的生态位重叠度.
3 讨论 3.1 食物资源对水鸟群落集团结构的影响本研究通过2个觅食生态维度——1个水平(觅食生境)生态维度和1个垂直(觅食行为)生态维度,描述和分析了升金湖越冬水鸟群落的集团结构和资源利用格局.鸟类群落集团结构和生态位特征的研究不仅有助于我们构建一个评估生态系统产品和服务的生态指标,而且有助于从另一个角度来检测和评估不断变化的环境条件[32-33].水鸟是湿地生态系统的重要指示类群,其群落结构的维持和稳定直接反映了湿地环境的质量.所以研究湿地水鸟的群落集团结构和生态位特征对于湿地的管理和质量评估具有十分重要的意义.
食物资源在不同水深区域的空间配置直接决定水鸟群落觅食集团的划分.湿地适宜的理化条件促进了多种植被和相关生物群落的发生和发展[32-33],能为越冬觅食的水鸟提供各种水深的觅食生境.水深是水鸟群落觅食集团间资源分割最重要的划分因素[34-37].水深除限制水鸟进入觅食栖息地外,还会影响水鸟的净能量摄取量,水深越大觅食效率越低.与在较浅的水深处获得更高的净能量相比,水鸟在水深较深处获得较少的净能量,这鼓励更多的水鸟在浅水处觅食[38-39].大量研究表明浅水有更多的有机物和水下植物床,能提供更丰富的食物资源[39-40].所以浅水比深水能容纳更多的物种.有些研究表明决定水鸟群落觅食集团划分的主要因素就是食物资源的区域空间配置[5, 15, 41].本研究也得出类似的结果:升金湖越冬水鸟被划分的4个觅食集团, 基本按照不同水深进行觅食生境的资源分割, 划分为草滩区、浅水泥滩区、中水区和深水区.其中,主要利用浅水区觅食生境的水鸟集团G1具有较为丰富的物种多样性(11种).本研究还发现不仅浅水区觅食的水鸟集团具有较高的多样性,中水区觅食的水鸟集团(12种)也具有丰富的物种多样性.这可能是升金湖食物资源丰富度或者可获得性降低,导致越冬水鸟能利用浅水的两个集团(G1和G3)间竞争释放的结果. G3集团大部分是鸭类, 偏好水下植被丰富的湿地觅食,能采用喙入水、头入水、颈入水和倒立身体入水等觅食行为在不同水深处觅食.随着越冬季食物资源丰富度和可获得性的降低,觅食效率较高的浅水区竞争日趋激烈,导致泛化种集团G3的水鸟物种被迫选择觅食效率其次的中水区.
食物资源的波动会影响群落的觅食集团构成,特别是特化集团的组成.生态位宽度较宽的集团物种能利用多种觅食行为和觅食生境,被认为是泛化种(generalists).而生态位宽度较窄的集团物种,仅能利用单一的觅食行为和觅食生境的集团物种是特化种(specialists)[39].当食物资源(觅食生境)波动时,对于生态位较宽的泛化种集团而言影响较小,但对于特化种集团影响较大.本研究中, 升金湖越冬水鸟可分为3个特化种集团,1个广食性集团.如特化集团G1主要是是一些鸻鹬类、鹭类和鹤鹳类等涉禽.这些涉禽利用啄食行为适时地开发具有特定特征地区中的食物资源,如泥滩区和浅水区[40],这些物种的存在和丰富度是受限于湖泊水位的有规律的波动[8].相比之下泛化种集团在觅食行为和觅食生境两个维度上都有更宽的生态位宽度,受影响较小.如G3集团主要是鸭类和鸥类等游禽,其利用喙、头、颈、身体倒置等部位深入水面,在湖泊的深水区、中水区和浅水区等不同深度的多个觅食生境觅食,可有效减缓食物资源的波动带来的影响.
3.2 食物资源对水鸟群落的生态位特征的影响食物资源的波动会影响特化集团物种的觅食生态位宽度.觅食生态位有觅食行为和觅食生境两个重要的维度,是影响水鸟群落集团结构及其资源分割的主要影响因素[7-8, 11, 18, 41-42].食物资源受限时,水鸟可能选择两种觅食策略-调整觅食行为和选择新的觅食生境.大多研究表明,特化集团的水鸟多采取选择新的觅食生境这一觅食策略,从而在生态位宽度上表现出水鸟觅食行为较特化,而觅食生境却较宽化的生态位特征[8, 42].本研究中,升金湖在冬季初期由于黄湓闸的放水捕鱼,湖泊水位降低,暴露了湖滩湿地,食物资源可获得性极高,冬季后期由于湖滩暴露时间过长干旱板结,造成湖底沉水植物退化,草滩土地硬度增大,使水鸟的食物资源减少且获得性变差.由于升金湖在整个冬季食物资源空间配置的波动变化,导致了水鸟物种采取选择开发新的觅食生境的觅食策略,在生态位上表现为觅食生境的生态位宽度大于觅食行为的生态位宽度.如G1集团选取更多的觅食生境,从而导致该集团中水鸟的觅食生境生态位宽度最大. G1集团主要利用的生境除了主要的浅水区和泥滩外,还有水稻田、草滩和中水区等.在冬季后期在食物资源有限的情况下,竞争的压力变大,该集团很多水鸟都比以往增加了水稻田的觅食生境利用率, 如白头鹤[42-43].
食物资源在不同水深的区域空间配置及其波动影响群落集团间和集团内物种生态位的重叠.食物资源在不同水深的区域空间配置,降低了集团间物种觅食生态位的重叠,食物资源的波动增加了集团内物种觅食生态位的重叠.所以群落集团表现出同一集团内物种间的生态位重叠远高于集团间物种之间的生态位重叠的特征.生态位重叠回答了水鸟物种如何对群落资源进行空间划分的问题.集团间生态位重叠取决于各集团间在觅食行为和觅食生境两个维度上的重叠度.水深因素将食物资源划分为不同空间区域,将觅食生境分割开, 在觅食生境利用上降低集团间相互竞争.各集团内的水鸟物种在各自的空间区域内利用不同的觅食行为共同利用生境资源.食物资源波动时, 集团内的水鸟物种会产生激烈的竞争,生态位重叠度较高.很多类似的研究表明在同一个集团内的物种之间存在强烈的竞争[8, 39, 41],这样的集团通常为物种数中等或者小的集团[9, 18].除去生境资源过剩的情况,一般认为群落的集团结构是通过激烈的种间竞争产生的[33].本研究也得出类似的结果,同一集团内物种间的生态位重叠远高于集团间物种间的生态位重叠.另外,特化种集团内的水鸟物种生态位重叠度(0.60~0.99)高于泛化种集团内水鸟物种的生态位重叠度(0.48).由于泛化种具有较宽的生态位宽度,同样的资源压力下,比起特化集团泛化集团内部竞争程度更低.
本研究结果还表明:越冬水鸟中的受胁物种和最大数量的物种主要在G1集团和G2集团中. G1浅水啄食集团中,集团鸟类觅食生境使用频率最高的是浅水区和泥滩;G2草滩啄食集团中,集团鸟类觅食生境使用频率最高的是草滩和泥滩.所以,浅水、泥滩和草滩生境对于保护物种具有十分重要的意义.
4 结论从升金湖越冬水鸟觅食集团的结构和生态位特征可以反映出升金湖水鸟群落集团结构的划分主要受食物资源空间配置及其可利用性的影响,水深是最重要的资源分割因素.升金湖水鸟群落在湖泊湿地生境退化的情况下,食物资源的波动对特化种集团影响较大, 对泛化种集团影响较小.所以维持越冬水鸟群落集团结构稳定的关键是维持特化种集团的觅食生境要求.浅水湿地生境是升金湖的越冬水鸟群落特化集团主要利用的觅食生境.因此保护浅水湿地生境是保持升金湖越冬水鸟群落稳定的关键.
5 附录附表Ⅰ~Ⅳ见电子版(DOI:10.18307/2021.0216).
| 附表Ⅰ 本研究涉及的31种水鸟物种观察扫描次数及观察的数量 Appendix Ⅰ Number of scanning, foraging observations for 31 waterbird species in the present study |
| 附表Ⅱ 各集团水鸟觅食行为利用频率和生境利用频率 Appendix Ⅱ Percentages of utilization of feeding techniques and habitats by waterbirds from differen guilds |
| 附表Ⅲ 分别基于水鸟觅食行为和觅食生境的一维生态位重叠值 Appendix Ⅲ Niche overlap in one niche dimension of waterbird species based on feeding technique and habitat use respectively |
| 附表Ⅳ 基于水鸟觅食行为和觅食生境的二维生态位重叠值 Appendix Ⅳ Niche overlap in two niche dimension of waterbird species based on both feeding technique and habitat use |
| [1] |
Winemiller KO, Pianka ER. Organization in natural assemblages of desert lizards and tropical fishes. Ecological Monographs, 1990, 60(1): 27-55. DOI:10.2307/1943025 |
| [2] |
Palmer TM, Stanton ML, Young TP. Competition and coexistence:Exploring mechanisms that restrict and maintain diversity within mutualist guilds. The American Naturalist, 2003, 162(S4): 63-79. DOI:10.1086/378682 |
| [3] |
Simberloff D, Dayan T. The guild concept and the structure of ecological communities. Annual Review of Ecology and Systematics, 1991, 22(1): 115-143. DOI:10.1146/annurev.es.22.110191.000555 |
| [4] |
Hawkins CP, MacMahon JA. Guilds:the multiple meanings of a concept. Annual Review of Entomology, 1989, 34(1): 423-451. DOI:10.1146/annurev.en.34.010189.002231 |
| [5] |
Gatto A, Quintana F, Yorio P. Feeding behavior and habitat use in a waterbird assemblage at a marine wetland in coastal Patagonia, Argentina. Waterbirds, 2008, 31(3): 463-471. DOI:10.1675/1524-4695-31.3.463 |
| [6] |
Liu B, Zhou LZ, Wang WG et al. Seasonal dynamics of the avian guild structure of mountain secondary forest in Dabieshan mountain. Zoological Research, 2009, 30(3): 277-287. [刘彬, 周立志, 汪文革等. 大别山山地次生林鸟类群落集团结构的季节变化. 动物学研究, 2009, 30(3): 277-287.] |
| [7] |
Chen JY, Zhou LZ. Guild structure of wintering waterbird assemblages in shallow lakes along Yangtze River in Anhui Province, China. Acta Ecologica Sinica, 2011, 31(18): 5323-5331. [陈锦云, 周立志. 安徽沿江浅水湖泊越冬水鸟群落的集团结构. 生态学报, 2011, 31(18): 5323-5331.] |
| [8] |
Pérez-Crespo M, Fonseca J, Pineda-López R et al. Foraging guild structure and niche characteristics of waterbirds in an epicontinental lake in Mexico. Zoological Studies, 2013, 52(1): 54. DOI:10.1186/1810-522x-52-54 |
| [9] |
Chatterjee A, Adhikari S, Pal S et al. Foraging guild structure and niche characteristics of waterbirds wintering in selected sub-Himalayan wetlands of India. Ecological Indicators, 2020, 108: 105693. DOI:10.1016/j.ecolind.2019.105693 |
| [10] |
Yang G, Xu J, Wang Y et al. The influence of vegetation structure on bird guilds in an urban park. Acta Ecologica Sinica, 2015, 35(14): 4824-4835. [杨刚, 许洁, 王勇等. 城市公园植被特征对陆生鸟类集团的影响. 生态学报, 2015, 35(14): 4824-4835.] |
| [11] |
Pöysä H, Poysa H. Resource utilization pattern and guild structure in a waterfowl community. Oikos, 1983, 40(2): 295. DOI:10.2307/3544594 |
| [12] |
Hutchinson GE. Homage to santa Rosalia or why are there so many kinds of animals?. The American Naturalist, 1959, 93(870): 145-159. DOI:10.1086/282070 |
| [13] |
MacNally RC. On assessing the significance of interspecific competition to guild structure. Ecology, 1983, 64(6): 1646-1652. DOI:10.2307/1937517 |
| [14] |
Wiens JA. The ecology of bird communities. Cambridge: Cambridge University Press, 1992.
|
| [15] |
Green AJ. Comparative feeding behaviour and niche organization in a Mediterranean duck community. Canadian Journal of Zoology, 1998, 76(3): 500-507. DOI:10.1139/z97-221 |
| [16] |
Jiang HX, Xu WB, Qian FW et al. Impact of habitat evolvement and human disturbance on wintering water birds in Shengjin Lake of Anhui Province, China. Chinese Journal of Applied Ecology, 2007, 18(8): 1832-1836. [江红星, 徐文彬, 钱法文等. 栖息地演变与人为干扰对升金湖越冬水鸟的影响. 应用生态学报, 2007, 18(8): 1832-1836.] |
| [17] |
Wang Y, Fan BL, Ding YR et al. The current situation and discussion on wetland ecological restoration of the middle and lower Yangtze River. China Water Resources, 2011(13): 4-6. [王越, 范北林, 丁艳荣等. 长江中下游湿地生态修复现状与探讨. 中国水利, 2011(13): 4-6. DOI:10.3969/j.issn.1000-1123.2011.13.002] |
| [18] |
Liordos V. Foraging guilds of waterbirds wintering in a Mediterranean coastal wetland. Zoological Studies, 2010, 49(3): 311-323. |
| [19] |
He WY, Shao MQ, Zhi YJ et al. Waterbird diversity in three reclamation regions of Poyang Lake. Chinese Journal of Ecology, 2019, 38(9): 2765-2771. [何文韵, 邵明勤, 植毅进等. 鄱阳湖三个垦殖场的水鸟多样性. 生态学杂志, 2019, 38(9): 2765-2771.] |
| [20] |
Yang L, Dong B, Wang Q et al. Habitat suitability change of water birds in Shengjinhu national nature reserve, Anhui Province. J Lake Sci, 2015, 27(6): 1027-1034. [杨李, 董斌, 汪庆等. 安徽升金湖国家级自然保护区水鸟生境适宜性变化. 湖泊科学, 2015, 27(6): 1027-1034. DOI:10.18307/2015.0606] |
| [21] |
Xia SX, Liu GH, Yu XB et al. Importance assessment of wintering habitats for migratory waterfowl in Lake Poyang. J Lake Sci, 2015, 27(4): 719-726. [夏少霞, 刘观华, 于秀波等. 鄱阳湖越冬水鸟栖息地评价. 湖泊科学, 2015, 27(4): 719-726. DOI:10.18307/2015.0421] |
| [22] |
Fan XZ, Zhang LQ, Yuan L et al. An analysis on spatio-temporal dynamics of suitable habitats for waterbirds based on spatial zonation at Chongming Dongtan, Shanghai. Acta Ecologica Sinica, 2011, 31(13): 3820-3829. [范学忠, 张利权, 袁琳等. 基于空间分带的崇明东滩水鸟适宜生境的时空动态分析. 生态学报, 2011, 31(13): 3820-3829.] |
| [23] |
Zhang B, Yuan X, Pei EL et al. Change of waterbird community structure after the intertidal mudflat reclamation in the Yangtze River Mouth:A case study of NanHui Dongtan area. Acta Ecologica Sinica, 2011, 31(16): 4599-4608. [张斌, 袁晓, 裴恩乐等. 长江口滩涂围垦后水鸟群落结构的变化——以南汇东滩为例. 生态学报, 2011, 31(16): 4599-4608.] |
| [24] |
Yang XT, Niu JY, Luo ZK et al. The impact of natural succession process on waterbird community in a abandoned fishpond at Chongming Dongtan, China. Acta Ecologica Sinica, 2013, 33(13): 4050-4058. [杨晓婷, 牛俊英, 罗祖奎等. 崇明东滩抛荒鱼塘的自然演替过程对水鸟群落的影响. 生态学报, 2013, 33(13): 4050-4058.] |
| [25] |
Zhang N, Li YK, Shan J et al. Community structure, abundance and spatial distribution of water birds wintering in Poyang Lake wetland. J Lake Sci, 2019, 31(1): 183-194. [张娜, 李言阔, 单继红等. 鄱阳湖枯水期延长背景下越冬水鸟群落结构、丰富度及其空间分布格局. 湖泊科学, 2019, 31(1): 183-194. DOI:10.18307/2019.0117] |
| [26] |
Xu LL, Xu WB, Sun QY et al. Flora and vegetation in Shengjin Lake. Journal of Wuhan Botanical Research, 2008, 26(3): 264-270. [许李林, 徐文彬, 孙庆业等. 升金湖植物区系及其群落演变. 武汉植物学研究, 2008, 26(3): 264-270. DOI:10.3969/j.issn.2095-0837.2008.03.010] |
| [27] |
Barter M, Lei G, Cao L. Waterbird survey of the middle and lower Yangtze River Floodplain (February 2005). Beijing: China Forestry Publishing House, 2006. [马克·巴特(Mark Barter), 雷刚, 曹垒等. 长江中下游水鸟调查报告(2005年2月). 北京: 中国林业出版社, 2006.]
|
| [28] |
Hejl SJ, Verner J, Bell GW. Sequential versus initial observations in studies of avian foraging. Studies in Avian Biology, 1990, 13(13): 166-173. |
| [29] |
Pöysä H. Temporal and spatial dynamics of waterfowl populations in a wetland area-A community ecological approach. Ornis Fennica, 1984, 61(4): 99-108. |
| [30] |
Levins R. Evolution in changing environments:Some theoretical explorations. Princeton: Princeton University Press, 1968.
|
| [31] |
Pianka ER. The structure of lizard communities. Annual Review of Ecology and Systematics, 1973, 4(1): 53-74. DOI:10.1146/annurev.es.04.110173.000413 |
| [32] |
Cintra R. Waterbird community composition in relation to lake physical traits and wetland limnological conditions in the Amazon basin. Hydrobiologia, 2019, 826(1): 43-65. DOI:10.1007/s10750-018-3676-y |
| [33] |
Chatterjee A, Adhikari S, Mukhopadhyay SK. Effects of waterbird colonization on limnochemical features of a natural wetland on buxa tiger reserve, India, during wintering period. Wetlands, 2017, 37(1): 177-190. DOI:10.1007/s13157-016-0851-7 |
| [34] |
Jin X, Ren XT, Peng HB et al. Habitat use and factors affecting distribution of wintering waterbirds in the wetland restoration area at Chongming Dongtan. Chinese Journal of Zoology, 2013, 48(5): 686-692. [金欣, 任晓彤, 彭鹤博等. 崇明东滩鸟类栖息地优化区越冬水鸟的栖息地利用及影响因子. 动物学杂志, 2013, 48(5): 686-692.] |
| [35] |
Zhang Y, Xie HB, Zeng WB et al. Analysis on the waterbird community structure and its habitat on the artificial wetlands in spring in Chongming Dongtan, China. Chinese Journal of Zoology, 2014, 49(4): 490-504. [张姚, 谢汉宾, 曾伟斌等. 崇明东滩人工湿地春季水鸟群落结构及其生境分析. 动物学杂志, 2014, 49(4): 490-504.] |
| [36] |
Zhang SX, Wang RX, Shen JX et al. Potential relationship of wintering waterbirds community composition and water-level fluctuation in lake Erhai. Asian Journal of Ecotoxicology, 2018, 13(4): 143-148. [张淑霞, 王荣兴, 沈建新等. 洱海冬季水鸟群落结构与水位变化的潜在关系. 生态毒理学报, 2018, 13(4): 143-148.] |
| [37] |
Wang XY, Jiang B, Tian ZF et al. Impact of water level changes in Lake Caizi (Anhui Province) on main wetland types and wintering bird habitat during wintering period. J Lake Sci, 2018, 30(6): 1636-1645. [王晓媛, 江波, 田志福等. 冬季安徽菜子湖水位变化对主要湿地类型及冬候鸟生境的影响. 湖泊科学, 2018, 30(6): 1636-1645. DOI:10.18307/2018.0615] |
| [38] |
Kushlan JA. Sympatric foraging of little egrets and snowy egrets in Barbados, west Indies. Waterbirds, 2007, 30(4): 609-612. DOI:10.1675/1524-4695(2007)030[0609:SFOLEA]2.0.CO;2 |
| [39] |
Elafri A, Belhamra M, Houhamdi M. Comparing habitat preferences of a set of waterbird species wintering in coastal wetlands of North Africa:Implication for management. Ekológia (Bratislava), 2017, 36(2): 158-171. DOI:10.1515/eko-2017-0014 |
| [40] |
Skagen SK, Knopf FL. Migrating shorebirds and habitat dynamics at a prairie wetland complex. The Wilson Bulletin, 1994, 106(1): 91-105. |
| [41] |
Jaksić FM, Medel RG. Objective recognition of guilds:Testing for statistically significant species clusters. Oecologia, 1990, 82(1): 87-92. DOI:10.1007/bf00318537 |
| [42] |
Zhou B, Zhou LZ, Chen JY et al. Diurnal time-activity budgets of wintering hooded cranes (Grus monacha) in Shengjin lake, China. Waterbirds, 2010, 33(1): 110-115. DOI:10.1675/063.033.0114 |
| [43] |
Zhao FJ, Zhou LZ, Xu WB. Habitat utilization and resource partitioning of wintering hooded cranes and three goose species at Shengjin Lake. Chinese Birds, 2013, 4(4): 281-290. DOI:10.5122/cbirds.2013.0032 |
 2021, Vol. 33
2021, Vol. 33