(2: 中国科学院水生生物研究所, 武汉 430072)
(3: 中国科学院大学, 北京 100049)
(2: Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P. R. China)
(3: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
种子库(seed bank或seed pool)是指土壤基质中有活力种子的总和,是过去植物的“记忆库”[1],广义的种子库(繁殖体库)还包括土壤基质表面及基质中具有繁殖能力的种子、果实、无性繁殖体和其他能再生的植物组织的总称[2-3].虽然种子库的研究早已起于达尔文的池塘底泥种子采集萌发实验[4],但研究淡水种子库成学科式发展也仅仅有40年左右[5-7].由于淡水湿地种子库在受损湿地或湖泊生态系统中恢复和重建方面的作用日益受到国内外生态学者的重视[5-10],在我国持续加大对天然湿地保护和退化湿地恢复建设的背景下,湿地或湖泊种子库研究已成研究热点并凸显其生态作用意义,有很大一部分研究聚焦于长江中下游富营养化浅水湖泊[9-14].在高原浅水湖泊生态系统面临严重威胁及亟待工程技术与生态修复情势下[15],加强高原富营养化湖泊种子库的调查与研究有利于当前的湖泊生态修复及生态多样性保护工作.
历史上滇池被誉为“高原明珠”,风光旖旎,人文和谐.然而,伴随着滨湖城市大量的人口增加、大规模的城镇化、工农业化以及旅游化的迅猛发展,湖泊水环境遭到前所未有的污染和破坏,带来生态系统失衡、污染物生物地球化学循环滞阻、生物多样性及生态系统功能服务减弱等问题. “九五”以来滇池即已被列为国家重点治理的“三河三湖”,随着滇池保护力度的加强及污染防治工作的持续推进,滇池还被列入我国13个重点保护水系之一[16],全国面临重大生态环境问题及区域特征重点保护湖泊之一[17],以及云南九大高原湖泊重点治理之一[16].在越来越多的滇池湿地建设及湖泊本身的生态修复及保护进程中亟待进行水生植被的恢复.湿地种子库作为水生植物埋藏在底泥中的潜在种群,其在水生植被群落形成和恢复中起着重要的作用[4, 12].在国内,地处华中、华东的长江中下游地区的淡水湿地和浅水湖泊成为种子库研究热点地区[4, 8-9, 11-12, 14].这样,受污染胁迫下的湿地种子库现状研究和恢复尤为迫切和重要,特别是高原地区受损湖泊的生态脆弱性凸显了可利用种子库进行潜在植被种群、群落和基本生态系统的构建和稳定.
目前在国内高原富营养化湖泊的种子库研究中,在滇池已有现状分布及恢复标准研究[18],以及大理洱海的一些研究.本研究基于滇池北部长期受污染和富营养化困扰的大伯口水域种子库规模、空间分布格局特征、种子库萌发、种子库植被恢复的应用潜力,聚焦在区域小尺度的水生态系统上,尽可能多的调查和采集了种子库空间参数和2014-2016连续3年的时间尺度演变参数,试图突出种子库在小尺度水生态系统上的现状与恢复能力的关系,进一步为高原富营养化湖泊种子库利用与恢复、种子库萌发与幼苗建群适宜生境以及水生植被恢复、湿地保护和管理作出基础支撑和策略指导.
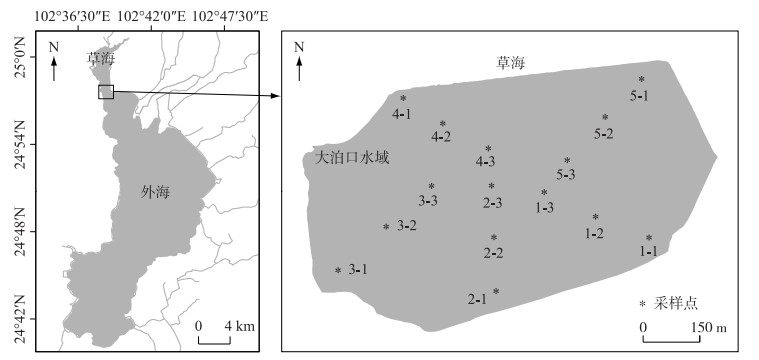
1 研究区域滇池作为高原富营养化湖泊的典型代表,其以半封闭、交换周期长、高敏感及人-自交互作用强等特征成为特殊的富营养化湖泊治理对象之一,并受到长期的关注和研究.滇池大泊口水域(24°57′48.62″~24°57′53.72″N, 102°38′34.00″~102°38′35.72″E)位于滇池草海南岸与外海交界处(图 1),水域面积为0.57 km2,年平均水位在1886.48 m,目前为半封闭性水域,在北面毗连草海的柳堤上存有3个小型水闸,大泊口水域水位稍高于草海水位,可通过水闸控制向草海输水,湖岸分布有中山杉、柳等乔灌木,近水带或淹水带有丰度较高的芦苇、菖蒲、茭草、香蒲等挺水植物分布,可削弱泥沙冲刷和扰动带来的影响,即在研究区域和时间内,尽量地排除了不利水文情势和复杂污染源对研究过程的干扰,核心点在于研究对象-大泊口水域早期成型于草海与外海水流置换区域,选择的区域对于滇池目前或以后的生态修复具有一定的示范性.
|
图 1 滇池大泊口水域底泥采样示意 Fig.1 Schematic diagram of sampling sites in Dabokou wetland of Lake Dianchi |
水生植被的调查方法采用法瑞学派植物群落调查和群落分析[19-20],样地主要覆盖以群落生态外貌为显著特征的水域,沿着岸边平均设置5个样点,从每个样点各向湖心布设1条样带(样带1、样带2、样带3、样带4、样带5),再在每条带上设置2个样点,样点之间平均间隔150 m,每个样点为1个调查样方,1条样带上含有3个样方,全水域总共15个样方(1-1、1-2、1-3、2-1、2-2、2-3、3-1、3-2、3-3、4-4、5-1、5-2、5-3,如图 1所示).每个样方为7 m×7 m的大小,对特征种为优势种的植物群落进行群聚度/多优度排序,并同时收集和记录相关水环境特征值(水温(℃)、水深(cm)、透明度(cm)、底泥厚度(cm)等),使用的调查仪器为GPS、长7 m船只、HQ30D便携式溶解氧测定仪(HACH corp., USA)、标杆、萨氏透明度盘等.
2.2 原位种子库采样在15个调查样点,利用横截面积直径为8 cm的有机玻璃柱状底泥采样器,采集底泥沉积物[12],每个样点重复采样5次,每次采样共采集75个样品,每个样点采样面积为251.2 cm2.每次采样使采集柱压实充满(深度≥35 cm),卸下含底泥的柱子,使接口段的间隙水溢流后再用推泥器小心推出泥柱,推出的泥柱用标尺测量长度并分段为0~5和5~30 cm的底泥样品,分装标记后带回实验室.分别于2014、2015、2016年11月各开展1次种子库采样.
2.3 漂洗法利用孔径150 μm筛网和孔径48 μm筛网组合筛选底泥样品,先用孔径150 μm筛网在直径1.5 m大盆中把底泥样品漂洗,滤掉淤泥和部分泥沙,拣选出肉眼可见或粒径较大的种子,滤液泥沙过孔径48 μm筛网,盛有剩余粗渣样品的孔径150 μm筛网叠加在孔径48 μm筛网上,重复浣洗,并保留筛过的粗渣和过网泥沙,做为下一步的萌发实验的基质,筛选出来的种子进行显微种类鉴定(OLYMPUS CX31)及活力鉴定[21-22],并浸没于装有自来水的罐中,置于-4℃、无光条件下保存[23-26],储存在这样的环境中能打破种子的休眠期,利于萌发实验的出苗率[27].收集剩下的包含其他种子、繁殖体及其他植物组织结构的泥团并分别对应标记,这部分包含微小或不能被网筛选出来的种子作为萌发基质,通过温室控制萌发实验进一步出苗成株来鉴定物种种类和数量.
2.4 温室控制幼苗萌发法根据Bernhardt[21, 26]等种子幼苗萌发法改进研究,首先,把每个次级样品(即过粗细网筛漂洗剩余的泥团)重新组成样品,作为萌发淤泥基底.然后把底质移入铺有碎石(厚3 cm)的塑料薄层盒(长×宽:30 cm×50 cm,高:10 cm),包含种子和繁殖体的基质厚度约为4 cm,再在萌发底质上均匀铺设一层灭过菌、厚度为2 cm的细沙.所有的萌发盒子编号并摆在可以控制光强、温度及湿度的温室内,温度条件控制在18~25℃,湿度控制在60 % ~90 %.萌发过程中每隔两天加注水使盒子里的水位保持恒定.种子萌发分两批进行,即第一批持续3个月后清除底质中的已鉴定的种苗,又继续3个月萌发过程观察,新种苗萌发并形成植株后再进行鉴定和统计.
3 数据分析统计每个样点通过漂洗方法采集到的种子数量及分层进行萌发实验后出苗的数量及物种鉴定,获得每年的平均种子库密度大小来研究种子库的规模及特征[28],用种子库空间分布异质性运用离散系数(变异系数)(V/m),及种子Lloyd平均拥挤指数(m*)来研究其空间分布格局[12, 29].
| $ {m^{*}} = 1/N\sum\limits_{i = 1{\rm{ }}}^Q {{X_i}\left( {{X_i} - 1} \right)} {\rm{ }} $ | (1) |
式中,Xi为第i个土样中该物种的种子数,Q为底泥样品的数目,N=∑Xi.
研究种子库与水生植被关系的主要评价指标是Sørensen相似性系数(SC)[9, 30],公式为:
| $ SC = 2w/{\rm{ }}(A + B) $ | (2) |
式中,A表示土壤种子库中的物种数,B表示地表覆盖植被的物种数,w表示种子库和覆盖植被共有的物种数.
4 结果 4.1 种子库组成、规模及分布格局经底泥种子筛选鉴定及幼苗萌发鉴定,2014年种子库共有5种大型水生植物,分别为篦齿眼子菜(Potamogeton pectinatus)、微齿眼子菜(Potamogeton maackianus)、金鱼藻(Ceratophyllum demersum)、苦草(Vallisneria gigantean Graebn.)及大型藻类轮藻门的轮藻属(Chara)藻类. 2015年有5种大型水生植物,分别为篦齿眼子菜、微齿眼子菜、金鱼藻、马来眼子菜(Potamogeton malainus)及轮藻. 2016年有7种水生植物,分别为篦齿眼子菜、微齿眼子菜、金鱼藻、马来眼子菜、黑藻(Hydrilla verticillata)、海菜花(Ottelia acuminata)及轮藻.种子库物种逐年呈增多趋势,优势属为眼子菜属,新增种属主要为水鳖科,2017年新增的海菜花为示范工程中人工回植的沉水植物.
2014-2016年平均种子库密度逐年增长率为20.35 % ~34.13 %,2014年平均种子库密度为(546.67±538.23)粒/m2,2015年平均种子库密度为(826±894.20)粒/m2,2016年平均种子库密度为(1682±1810.32)粒/m2(图 2),随着时间的推移,总平均种子库密度增大.

|
图 2 2014-2016年种子库各组成密度分布及变化 Fig.2 Distribution and changes of components of seed banks during 2014-2016 |
从底泥分层获取种子情况来看,2014年与2015年和2016年相比,种子主要集中于表层底泥(0~5 cm),随着时间的推移,种子库主要分布于深层底泥(5~30 cm),这样随着时间尺度的空间分布改变推测可能由于上层种子容易萌发成植被,或是上覆水的扰动影响,而且滇池为湖泊演化后期,调查区域的底泥沉积层比较软和厚,以黑淤泥为主的基质更容易使种子往深处沉淀等.诸多复杂的水文情势和扰动影响因素在本研究中将略去,这部分工作可以在以后的专门研究中进行验证和分析.
此外,从形成种子和其他形式的繁殖体分类来看(图 2及表 1),2014年经过幼苗萌发统计的平均幼苗密度(290.67±611.41)株/m2与底泥中筛选的平均种子密度(256.00±478.04)粒/m2相比相差不大外,即通过底泥温室内调控萌发成株的繁殖体库和通过肉眼和显微观测鉴定的种子库是相当的.但是在底泥种子库和幼苗萌发实验中,物种组成有很大的差异性,主要因素是萌发物种是在适宜条件下的控制实验,良好的水环境特征设置具有普适性(有些不能在目前的滇池水环境中萌发或继续处于休眠状态),萌发了比底泥种子库中多的物种或几乎筛选不到的物种,例如,在底泥种子筛选过程中很少能找到金鱼藻、马来眼子菜等植物的种子,但在萌发过程中或后期的移植成株鉴别中出现,像轮藻属的萌发率、密度和出现频率都显著超出底泥中能鉴别到种子存量(轮藻主要以繁殖体出现).这表明了在受到打破休眠及适宜条件下,底泥中埋藏的种子重新萌发,具有历史植被的“记忆”特征.
| 表 1 2014-2016年平均种子密度与平均幼苗密度的比较分析 Tab. 1 Comparative analysis of density of mean seeds and mean seedlings during 2014-2016 |
2014年有5个物种,2016年有5个物种,2016年有7个物种,离散系数显示只有篦齿眼子菜有显著的聚集分布格局(2014V/m=1.99,P<0.05;2016V/m =1.55,P<0.05),而其他几个物种种子属于均匀分布格局(表 2).平均拥挤指数最高为篦齿眼子菜,出现在2016年(1.26).而平均拥挤指数与平均密度的线性关系(m*/m)可以看出,所有物种的斜率都小于1,即表明物种种子在底泥中属于均匀分布格局.
| 表 2 水生植物的离散系数和Lloyd平均拥挤指数的评估 Tab. 2 Estimation of variance mean ratio(V/m) and Lloyd index of mean crowding(m*) |
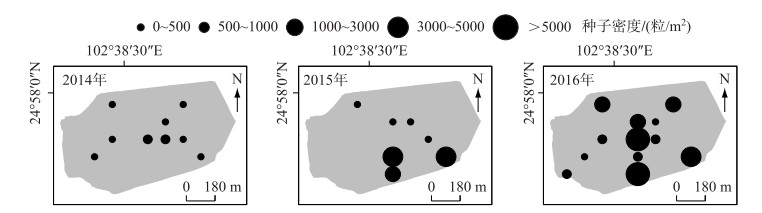
此外,随着时间的推移,种子库的数量级大小在增加,500粒/m2以上的点位明显增多,分布水域更广,而且有向岸边浅水水域分布密集的趋势(图 3).说明滇池大泊口目前水生植被能形成“种子雨”的能力很高,并且扩散趋势明显.
|
图 3 2014-2016年调查示范种子数量级分布状况 Fig.3 Distribution of seed banks in investigation during 2014-2016 |
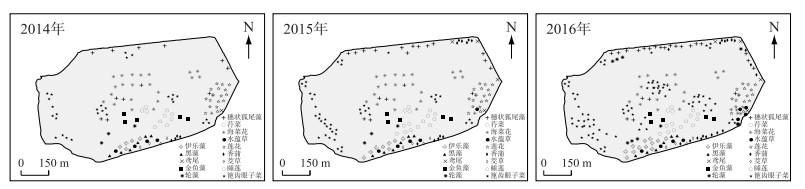
调查显示区域内地表覆盖水生植物多达11科17种,其中沉水植物11种,分别为眼子菜科的篦齿眼子菜、马来眼子菜、微齿眼子菜,水鳖科的黑藻、伊乐藻(Elodea nuttallii)、苦草(Vallisneria gigantean Graebn.)、水蕴草(Egria densa)及海菜花,小二仙草科的穗状狐尾藻(Myriophyllum spicatum L.),金鱼藻科的金鱼藻和轮藻属.挺水植物有4种,分别为莲科的荷花(Nelumbo nucifera),香蒲科的狭叶香蒲(Typha angustifolia),禾本科的茭草(Zizania latifolia)及鸢尾科的鸢尾(Iris tectorum).浮叶植物有2种,分别为睡莲科的睡莲(Nymphaea tetragona)及龙胆科的荇菜(Nymphoides peltatum).植被覆盖以沉水植物为主,优势群丛为篦齿眼子菜、穗状狐尾藻和金鱼藻.
沉水植物三年来在水生植被中占比89 %以上,覆盖水域最广(表 3).地表植被主要类别为眼子菜科和水鳖科的种属.
| 表 3 2014-2016年地表覆盖水生植被及优势群丛面积分布情况 Tab. 3 Distribution of aboveground vegetation and dominant ecological association proportion during 2014-2016 |
各水生植物在水域空间布局上主要为均匀分布外,在小尺度上穗状狐尾藻及篦齿眼子菜有显著的聚集格局,小样方上的调查中其群聚度/多优度基本在2.2以上,但随着时间尺度的增加,水生植被的群丛和分布范围在明显扩大(图 4).地表水生植被这样的分布方式与种子库空间分布格局分析是对应的.
|
图 4 2014-2016年的地表水生植物分布状况 Fig.4 Aquatic vegetation distribution during 2014-2016 |
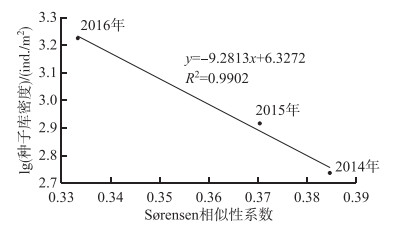
种子库和地表水生植被的Sørensen相似性系数研究显示目前滇池大泊口水域的SC系数比较低,在0.3333~0.3846之间(图 5),2014年相似性系数为0.3846,2015年相似性系数为0.3703,2016年相似性系数则为0.3333,总体波动不大,略呈下降趋势. 3年Sørensen相似性系数与底泥种子库的密度呈线性负相关(R2=0.9902,P<0.05),说明在时间尺度增加上,虽然种子库的密度大小在增加,但是底泥中种子与地表共有植物越来越少.即目前地表许多植被生长并非全部来源与底泥中种子的萌发来完成演替,或者少量的优势种群大量演替达到比较单一的种子数量,从而扩充了平均种子库密度.
|
图 5 2014-2016年Sørensen相似性系数与种子库密度相关性 Fig.5 Correlation between Sørensen similarity index and seed banks density during 2014-2016 |
滇池地处北纬亚热带气候带,从气候带影响结果来看,大泊口种子库与植被相似性系数平均为0.3628±0.0265,与1900-2012年间筛选的种子库文献中亚热带气候带类型下的Sørensen相似性系数[31]统计结果(0.3730±0.034)基本吻合,显明了滇池种子库亚热带气候条件影响下的特征.又分别与湖泊湿地类型下的Sørensen相似性系数统计结果(n=15,mean±s.d.=0.5070±0.038)和草本群落类型下的Sørensen相似性系数统计结果(n=65,mean±s.d.=0.4870±0.023)[32]比较,滇池大泊口Sørensen相似性系数都处于低水平状态.说明目前以大泊口水域为代表的湿地水生植被并非主要来源于底泥种子库的萌发与潜种群演替,其他繁殖方式、贡献方式(湿地工程建设等人工干扰)或生物(水禽、鱼类等)和物理因素(风、水流)等加剧了地表水生植被的演替而使相似性降低.很好地说明了湿地种子库与地表植被的相似性随着植物群落演替过程的发展而呈下降趋势[30-34].
滇池是一个受人类活动高度干扰的湿地,存在许多入侵水生植物,人工湿地建设移植景观水生植物现象也比较普遍,加上水环境并未能达到使底泥休眠种子萌发的适宜条件,这样的环境特征造成了一方面耐污物种、先锋物种或入侵物种的大量繁殖带来的年度种子库密度的增加,另一方面地表覆盖的水生植被与底泥共有种类的减少,即使优势物种的大尺度建群和繁殖对底泥种子库数量持续增长贡献较大,但是种子物种多样性在减少.
4.3 种子库的恢复潜力2014-2016年种子库密度增长显著(图 6). 2014-2016年总平均种子库密度分别为546.6、826和1682粒/m2. 2014-2016年每年的总盖度调查(分别为10.05 %、12.5 %、13 %)一定程度上反映了群落植被茂密程度及光合作用面积大小,间接指示能产生多少种子的能力,与种子库密度做对比分析可以明显的对应关系.

|
图 6 2014-2016年总平均种子库密度趋势变化 Fig.6 Trend change of grand mean of seed banks density during 2014-2016 |
在持续增长的种子库密度中主要以耐污种篦齿眼子菜等为主,能同时在底泥种子库和地表植被中占很大比值,而种子的萌发实验表明在适宜的温室控制条件下,生长出一些目前并不能在湖泊中形成优势种群的植被,例如轮藻属、黑藻及马来眼子菜等历史上优势植被,此类植被对水环境的要求比较高,像透明度年平均值为33.18 cm、悬浮物浓度平均值为28.41 mg/L、叶绿素a浓度平均值0.1057 mg/L等重要水环境因素(图 7)严重抑制了历史优势物种的萌发和物种建群.虽然目前水环境依然不属于乐观状态,但历史优势物种的种子仍然较好的保存于底泥种子库中,一旦在适宜的控制条件下,依然可以恢复接近于原来的群落.例如,在试验控制条件下,配置的非生物因素和生物因素驱动了美洲苦草(Vallisneria americana)群落的恢复和演替[35].所以在目前的水环境中,只要环境因子变动或/和种子萌发的生态幅重叠都有很大的可能驱动“水下森林”的形成,甚至一些长期休眠的种子也能形成植被.
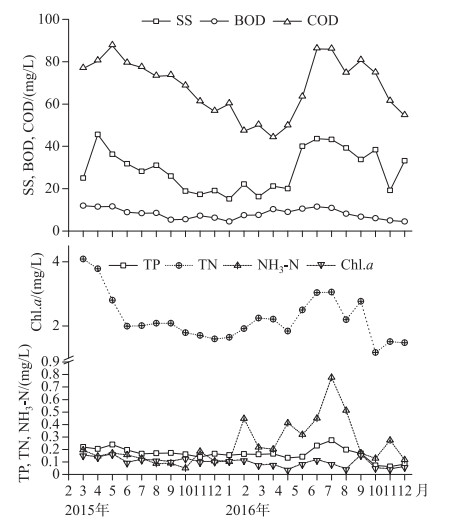
|
图 7 主要水环境特征值变化 Fig.7 Dominant characteristic values of water environment |
此次研究基于受威胁严重的高原富营养化湖泊-滇池大泊口湿地的种子库现状和地表水生植被的动态演替,在连续三年的时间尺度上揭示其种子库组成和规模、时空特征及可恢复力.主要研究结果如下:
1) 其总平均种子库密度2014年为546.67粒/m2,2015年为826粒/m2,2016年为1682粒/m2. “种子雨”年形成率在20.35 % ~34.13 %之间,区域种子库密度在显著增长,耐污及适应性较强的当前优势种属贡献较大,如篦齿眼子菜、金鱼藻等.
2) 垂直方向上主要分布于深层淤泥中(5~30 cm),3年来种子库在平面维度上表现为:种子库规模越来越大,500粒/m2数量级以上的种子库分布增多,与地表覆盖植被群落盖度的增大响应密切;空间格局分析显示优势群丛篦齿眼子菜等呈现为聚集分布,其他大多呈现均匀分布格局.
3) 滇池大泊口水生植被与种子库平均相似性系数SC=0.3628±0.0265(其中SC2014=0.3846, SC2015=0.3704, SC2016=0.3333),与湖泊类型的种子库文献对比中发现:滇池在所处气候亚热带类型的相似性系数与文献统计结果较吻合,而在湖泊湿地和草本群落类型上维持在较低水平.说明目前滇池的植物群落演替过程较快.
自淡水湿地种子库成为种子生态学与土壤学的研究热点以来[2, 4, 31],认识到在气候变化、水污染、生态系统服务功能减弱、人工干扰强烈、物种入侵等各种条件对湿地的胁迫越来越明显的情势下,土壤种子库在时空尺度上的生态和演化作用逐渐凸显,基于此的种子库基本结构与功能、潜力与恢复研究在逐渐增加[27, 31-37].基于在前人的一些研究及对高度富营养化湖泊湿地种子库关注,摸底了滇池典型修复区域种子库的规模现状、格局分布模式,虽然生境内现存水生植被物种多样性并不算高,除极少物种能聚集分布外,大部分处于均匀分布状况,埋藏的种子库还是比较乐观,一些连续3年在现场极少能被调查的植物,在受控的萌发实验中能大量萌发和生长,体现在幼苗萌发成株与大伯口底泥种子库中物种种类和萌发差异两个方面.在种子库与现存植被关系发面也说明了目前滇池的植被演替速度快,耐污种属占据优势生态位,这与水环境条件相符.随着滇池的各项治理措施和恢复工作有序进行,与1990s末或治理初期相比,水环境得到较大改善,种子库规模修复和恢复水生植被群落功能成为不错的选择,以“师法自然”的原则,让种子库成为原生驱动湖泊水生态系统修复的新引擎.
致谢: 感谢Oscar Omondi Donde博士(Department of Environmental Science, Egerton University, Egerton, Kenya.)对文章的校正!感谢云南(昆明)滇池保护治理与生态修复刘永定院士工作站提供的帮助.
| [1] |
Caver PB. Seed banks-memory in soil. Canadian Journal of Soil Science, 1995, 75(1): 11-13. DOI:10.4141/cjss95-003 |
| [2] |
Cui NX, Wu J, Cheng SP et al. Research progress of seed bank for restoration of wetland vegetation. J Lake Sci, 2013, 25(1): 1-8. [崔娜欣, 吴娟, 成水平等. 湿地种子库及其植被恢复研究进展. 湖泊科学, 2013, 25(1): 1-8. DOI:10.18307/2013.0101] |
| [3] |
Poiani KA, Johnson WC. Effect of hydroperiod on seed-bank composition in semipermanent prairie wetlands. Canadian Journal of Botany, 1989, 67(3): 856-864. DOI:10.1139/b89-115 |
| [4] |
Li W, Liu GH, Zhou J et al. Studies on the seed bank of freshwater wetland:A review. Acta Ecologica Sinica, 2002, 22(3): 395-402. [李伟, 刘贵华, 周进. 淡水湿地种子库研究综述. 生态学报, 2002, 22(3): 395-402. DOI:10.3321/j.issn:1000-0933.2002.03.016] |
| [5] |
van der Valk AG, Davis CB. The seed banks of prairie glacial marshes. Canadian Journal of Botany, 1976, 54(15): 1832-1838. DOI:10.1139/b76-197 |
| [6] |
van der Valk AG, Davis CB. A reconstruction of the recent vegetational history of a prairie marsh, Eagle Lake, Iowa, from its seed bank. Aquatic Botany, 1979, 6: 29-51. DOI:10.1016/0304-3770(79)90049-4 |
| [7] |
van der Valk AG, Davis CB. The role of seed banks in the vegetation dynamics of prairie glacial marshes. Ecology, 1978, 59(2): 322-335. DOI:10.2307/1936377 |
| [8] |
Chen ZY, Lei ZX, Zhou J et al. A preliminary study of winter seed bank of dominant submerged macrophytes in Lake Liangzi. Acta Hydrobiologica Sinica, 2001, 25(2): 152-158. [陈中义, 雷泽湘, 周进等. 梁子湖优势沉水植物冬季种子库的初步研究. 水生生物学报, 2001, 25(2): 152-158. DOI:10.3321/j.issn:1000-3207.2001.02.008] |
| [9] |
Liu GH, Li W, Wang XL et al. Relationship between seed banks and standing vegetation in Huli marsh, Chaling, Hu'nan Province. Acta Ecologica Sinica, 2004, 24(3): 450-456. [刘贵华, 李伟, 王相磊等. 湖南茶陵湖里沼泽种子库与地表植被的关系. 生态学报, 2004, 24(3): 450-456. DOI:10.3321/j.issn:1000-0933.2004.03.009] |
| [10] |
Hou ZY, Xie YH, Yu XY et al. Research method, content, and prospect on seed bank of freshwater wetland. Chinese Journal of Ecology, 2008, 27(8): 1400-1405. [侯志勇, 谢永宏, 于晓英等. 淡水湿地种子库的研究方法、内容与展望. 生态学杂志, 2008, 27(8): 1400-1405.] |
| [11] |
Ye C, Liu J, Yu HC et al. General seed banks and seedling banks of 3 dominant submerged macrophyte community in east Taihu Lake. Ecology and Environment, 2008(3): 1091-1095. [叶春, 刘杰, 于海婵等. 东太湖3种沉水植物群落区底泥种子库与幼苗库. 生态环境, 2008(3): 1091-1095. DOI:10.3969/j.issn.1674-5906.2008.03.042] |
| [12] |
Liu GH, Liu YP, Li W. Small-scale heterogeneity in seed bank of a freshwater marsh. Acta Ecologica Sinica, 2006, 26(8): 2739-2743. [刘贵华, 刘幼平, 李伟. 淡水湿地种子库的小尺度空间格局. 生态学报, 2006, 26(8): 2739-2743. DOI:10.3321/j.issn:1000-0933.2006.08.042] |
| [13] |
Liu GH, Li W, Zhou J et al. How does the propagule bank contribute to cyclic vegetation change in a lakeshore marsh with seasonal drawdown?. Aquatic Botany, 2006, 84(2): 137-143. DOI:10.1016/j.aquabot.2005.08.005 |
| [14] |
Hou ZY, Chen XS, Xie YH et al. Characteristics of soil seed bank and its relationship with aboveground vegetation in Lake Dongting. J Lake Sci, 2012, 24(2): 287-293. [侯志勇, 陈心胜, 谢永宏等. 洞庭湖湿地土壤种子库特征及其与地表植被的相关性. 湖泊科学, 2012, 24(2): 287-293. DOI:10.18307/2012.0218] |
| [15] |
Li GB, Li L, Pan M et al. The degradation cause and pattern characteristics of Lake Dianchi ecosystem and new restoration strategy of ecoregion and stepbystep implementation. J Lake Sci, 2014, 26(4): 485-496. [李根保, 李林, 潘珉等. 滇池生态系统退化成因、格局特征与分区分步恢复策略. 湖泊科学, 2014, 26(4): 485-496. DOI:10.18307/2014.0401] |
| [16] |
He KD. Comprehensive evaluation and trend analysis for water quality of Dianchi Lake. Yangtze River, 2012, 43(12): 37-41. [贺克雕. 滇池水质状况综合评价及变化趋势分析. 人民长江, 2012, 43(12): 37-41. DOI:10.3969/j.issn.1001-4179.2012.12.011] |
| [17] |
Yang GS, Ma RH, Zhang L et al. Lake status, major problems and protection strategy in China. J Lake Sci, 2010, 22(6): 799-810. [杨桂山, 马荣华, 张路等. 中国湖泊现状及面临的重大问题与保护策略. 湖泊科学, 2010, 22(6): 799-810. DOI:10.18307/2010.0601] |
| [18] |
Lu J, Wang HB, Pan M et al. Using sediment seed banks and historical vegetation change data to develop restoration criteria for a eutrophic lake in China. Ecological Engineering, 2012, 39: 95-103. DOI:10.1016/j.ecoleng.2011.11.006 |
| [19] |
Braun-Blanquet J. Pflanzensoziologie. Vienna: Springer Vienna, 1964. DOI:10.1007/978-3-7091-8110-2
|
| [20] |
Westhoff V, van der Maarel E. The Braun-Blanquet approach//Whittaker RH ed. Ordination and classification of communities. Dr. W. Junk, the Hague, 1973: 617-626.
|
| [21] |
Bernhardt KG, Hurka H. Dynamik Des Samenspeichers in einigen mediterranen Kulturboden. Weed Research, 1989, 29(4): 247-254. DOI:10.1111/j.1365-3180.1989.tb00909.x |
| [22] |
Thompson K, Bakker JP, Bekker RM. The soil seed banks of Northwest Europe: methodology, density and longevity. Cambridge, UK: Cambridge Univ. Press, 1997.
|
| [23] |
Muenscher WC. Storage and germination of seeds of aquatic plants. Cornell Univ Agr Exp St Bull, 1936, 652. |
| [24] |
Muenscher WC. The germination of seeds of Potamogeton. Annals of Botany, 1936, os-50(4): 805-821. |
| [25] |
Muenscher WC. Aquatic plants of the US. Comstock Publishing Associates, Ithaca, NY. 1944.
|
| [26] |
Boedeltje G, ter Heerdt GNJ, Bakker JP. Applying the seedling-emergence method under waterlogged conditions to detect the seed bank of aquatic plants in submerged sediments. Aquatic Botany, 2002, 72(2): 121-128. DOI:10.1016/S0304-3770(01)00224-8 |
| [27] |
Rosbakh S, Hülsmann L, Weinberger I et al. Bleaching and cold stratification can break dormancy and improve seed germination in Cyperaceae. Aquatic Botany, 2019, 158: 103128. DOI:10.1016/j.aquabot.2019.103128 |
| [28] |
Bernhardt KG, Koch M, Kropf M et al. Comparison of two methods characterising the seed bank of amphibious plants in submerged sediments. Aquatic Botany, 2008, 88(2): 171-177. DOI:10.1016/j.aquabot.2007.10.004 |
| [29] |
Vandvik V, Klanderud K, Meineri E et al. Seed banks are biodiversity reservoirs:Species-area relationships above versus below ground. Oikos, 2016, 125(2): 218-228. DOI:10.1111/oik.02022 |
| [30] |
Kuchler AW, Mueller-Dombois D, Ellenberg H. Aims and methods of vegetation ecology. Geographical Review, 1976, 66(1): 114. DOI:10.2307/213332 |
| [31] |
Sørensen T. A method of establishing groups of equal amplitude in plant sociology based on similarity of species content and its application to analyses of the vegetation on Danish commons. Det. Kongelige Danske Videnskabernes Selskab. Biologiske Skrifter(Cop-enhagen), 1948, 5(4): 1-34. |
| [32] |
Liu QY, Jiang M, Lv XG et al. A review of similarity between soil seed bank and aboveground vegetation in wetlands. Acta Ecologica Sinica, 2014, 34(24): 7465-7474. [刘庆艳, 姜明, 吕宪国等. 湿地土壤种子库与地上植被相似性关系研究评述. 生态学报, 2014, 34(24): 7465-7474.] |
| [33] |
Grandin U. Short-term and long term variation in seed/vegetation relations along an environmental and successional gradient. Ecography, 2008, 24(6): 731-741. DOI:10.1111/j.1600-0587.2001.tb00534.x |
| [34] |
Lu ZJ, Li LF, Jiang MX et al. Can the soil seed bank contribute to revegetation of the drawdown zone in the Three Gorges Reservoir Region?. Plant Ecology, 2010, 209(1): 153-165. DOI:10.1007/s11258-010-9732-y |
| [35] |
Kupsky BG, Dornbush ME. Experimental test of abiotic and biotic factors driving restoration success of Vallisneria americana in the Lower Bay of Green Bay. Journal of Great Lakes Research, 2019, 45(2): 340-349. DOI:10.1016/j.jglr.2019.01.006 |
| [36] |
Erfanzadeh R, Hendrickx F, Maelfait JP et al. The effect of successional stage and salinity on the vertical distribution of seeds in salt marsh soils. Flora-Morphology, Distribution, Functional Ecology of Plants, 2010, 205(7): 442-448. DOI:10.1016/j.flora.2009.12.010 |
| [37] |
Thompson K, Grime JP. Seasonal variation in the seed banks of herbaceous species in ten contrasting habitats. The Journal of Ecology, 1979, 67(3): 893. DOI:10.2307/2259220 |
 2021, Vol. 33
2021, Vol. 33 

