沉水植物在湿地中起着重要作用(如吸附沉积物和周围水体中的营养物质,降低水体浊度,为其他生物提供氧气、食物和庇护所等)[1]. 浅水湖泊中沉水植物占据从湖底到湖面的空间,对水生生态系统中的物质循环和能量流动有重要贡献,对中营养和富营养湖泊生态系统的恢复至关重要[2]. 然而当沉水植物死亡和分解时,植物残体会释放出大量的营养物质,导致水质季节性恶化[3]. 植物的分解是一个复杂的过程,受到植物残体的化学性质[4]和外部因素[5]的影响,例如温度,氮、碳和磷的含量以及植物残体中快速和慢速可分解有机物的比例[6]. 微生物在植物腐解过程中发挥着重要作用,其有助于凋落物降解植物残体和难降解物质,包括纤维素和木质素[7-8]. Zhang等[2]发现在淡水湖泊湿地中不同时间参与水生植物分解的微生物种类和数量不同. 因此,阐述水生凋落物分解的相关机理对水环境管理和保护具有重要意义.
我国是肥料施用大国,农业生产系统通常使用无机化肥. 有研究表明,三峡库区典型农业小流域水体氮浓度变化范围为1.37~17.66 mg/L,平均浓度为6.28 mg/L[9],滇池菜地沟渠水地表径流总氮(TN)浓度为5.27~21.01 mg/L[10]. 上述研究说明氮类化肥的不合理施用会导致周边水体氮的浓度迅速升高并保持较高水平. 反硝化作用是水体生态系统中不可或缺的脱氮途径[11]. 本课题组[12]前期研究检测到马来眼子菜(Potamogeton malaianus)在腐解过程中其表面附着的生物膜中与反硝化作用相关的功能基因如氨单加氧酶(amoA)、周质硝酸还原酶(napA)、膜结合硝酸还原酶(narG)、亚硝酸盐还原酶(nirK),表明携带有这些基因的微生物可能参与了氮的转化. 然而关于持续较高氮水平对植物腐败过程和相关氮循环微生物的影响机制仍不清楚.
本研究以轮叶黑藻(Hydrilla verticillata)残体为研究对象,通过室内模拟试验设置水体总氮浓度ρ(TN)为8和16 mg/L,探究两种氮浓度下水生植物腐败过程中营养盐变化与残体表面微生物群落氮循环基因的响应,以期为水环境管理和保护提供理论依据.
1 材料与方法 1.1 试验材料试验所用的轮叶黑藻和表层沉积物(0~5 cm)取自江苏省南京市高淳水生植物基地. 将获取的沉积物放置通风处晾干后研磨并过孔径为0.15 mm的网筛,以去除底泥内的残体及杂物. 选取健康轮叶黑藻植株,用去离子水将植物样品洗净后用剪刀将植株茎叶剪成3 cm大小的片段,放置于105℃恒温干燥箱烘10 min,随后在80℃烘干至恒重.
1.2 试验设计试验时间为2016年11月24日-2017年4月18日,共计146 d. 环境温度变化范围为4.36~22.77℃. 以5 L聚丙烯塑料桶(15 cm×25 cm×21 cm)作为反应器,桶内铺设500 mL干燥底泥和4 L自来水,以添加硝酸盐和铵盐(1 ∶1)配置维持水体总氮浓度分别为8和16 mg/L. 静置3 d后,微调各组试验桶以保证同一条件下水体的各项指标一致. 称取20 g植物样品放入微米网袋(孔径为25 μm,规格为20 cm×20 cm)并放在反应器中,保持网袋在沉积物表面. 以不加植物作为对照,每个处理设置3个平行反应器,试验在相对避光条件下进行. 每周采集水样分析水体营养盐的变化,在第28、35、42、49、56、96和146天采集植物样品,晾干后于80℃下烘干至恒重以测定其残体量. 采样时注意尽量避免引起水体扰动.
1.3 指标测定利用多参数水质分析仪(HQ30d,美国HACH公司)检测上覆水电导率(EC)和温度,自动测定仪(FJA-6)检测上覆水氧化还原电位(ORP)和溶解氧(DO)浓度. 水体TN、总磷(TP)、氨氮(NH3-N)及高锰酸盐指数(IMn)的测定均采用国际标准法;TN浓度的测定采用碱性过硫酸钾消解紫外分光光度法(GB11894-1989). TP浓度测定采用钼酸铵分光光度法(GB 11893-1989). NH3-N浓度测定采用纳氏试剂分光光度法(HJ 535-2009). IMn的测定采用高锰酸钾滴定法(GB 11892-1989). 水体总有机碳(TOC)浓度的测定采用燃烧氧化-非色散红外吸收法(HJ501-2009). 植物总有机碳(TOC)含量采测定用TOC分析仪(multi 3100). 植物全氮(TN)含量测定采用过硫酸钾消化法[13]. 水体溶解性有机质(DOM)浓度测定过程为[14]:水样通过0.45 μm滤膜(GF/F,Whatman,英国)后放置于荧光分光光度计(F-7000,日本Hitachi公司). 仪器的主要性能参数:激发波长为200~500 nm,狭缝宽为5 nm;发射波长为200~500 nm,狭缝宽为1 nm.
1.4 生物膜样品采集植物表面附着生物膜样品采集过程[15]:分别于第28、35、42、49、56、96和146天采集微米网袋中的植物样品进行附着微生物分析. 将约20 g植物残体直接放入500 mL无菌塑料广口瓶中,其中含有灭菌的400 mL 50 mmol/L磷酸盐缓冲盐(PBS,pH=7.4)溶液和一些无菌玻璃珠. 将混合物用超声波处理3 min后,放入恒温摇床,在震速225 r/min、4℃下震荡30 min,然后在超声波下处理3 min. 悬浮样品通过50 μm的筛网以去除植物碎屑,8000 r/min离心10 min,转移底部沉淀物至2 mL离心管中,超低温(-80℃)冷冻保存待用.
1.5 DNA提取和荧光定量PCR使用PowerBiofilm DNA分离试剂盒(MoBio Laboratories,USA)按照操作说明提取生物膜总基因组DNA,用NanoDrop 1000分光光度计(Thermo Scientific,USA)测定待测DNA样品浓度. 对结构基因CTO-16S rDNA,功能基因氨单加氧酶(amoA)、周质硝酸还原酶(napA)、膜结合硝酸还原酶(narG)以及亚硝酸盐还原酶(nirK)的总拷贝数(表 1)在每个处理重复的样本中使用其特定的引物对进行检测. 定量聚合酶链反应(qPCR)采用MyiQ2实时荧光定量PCR仪(BIO-RAD),荧光染料SYBR-Green法. qPCR反应体系为20 μL,包括supermix(10 μL)、上下游引物(0.5 μL)、DNA模板(1 μL)、超纯水(8 μL). qPCR扩增包括40个循环. 所用基因引物序列见表 1. 上述5个基因的标准曲线所用的基因片段插入到质粒载体中,含对应基因片段的载体制备过程在生工生物工程(上海)股份有限公司完成. 根据所含基因片段质粒载体的含量,最高含量为108,10倍梯度稀释后用于制作标准曲线,采用的标准曲线效率在90 % 以上,相关性(R2)在0.99以上,定量植物生物膜中amoA、CTO、napA、narG和nirK基因的拷贝数[16].
| 表 1 本试验中所用基因引物序列 Tab. 1 The sequence of primers used in this study |
采用Olson指数衰减模型描述两种氮浓度下轮叶黑藻生物量随时间消减的过程[18]:Wt=W0·e-kt,其中Wt为经过一定的分解时间t后植物的干重,W0为植物的初始干重,k为分解速率常数(d-1). 采样SPSS 19及Origin 9.0软件做数据的处理. 使用One-way ANOVA和Pearson相关性指数进行统计检验. 运用“circlize”包通过R Studio软件绘制弦图. 采用CANOCO(Version 4.5)进行冗余分析(RDA),分析氮循环基因与环境因子间的相关性.
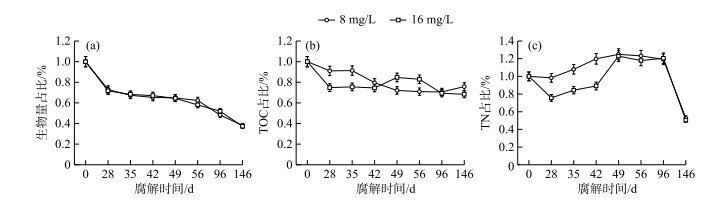
2 结果与分析 2.1 植物残体生物量及体内碳、氮含量变化特征轮叶黑藻腐解过程中的生物量变化如图 1a所示,试验初期,植物生物量快速降低,到第146天试验结束时,水体TN浓度为8和16 mg/L条件下植物所剩余质量分别为初始值的38.15 % 和37.3 %. 到试验结束时,有植物组植物残体中TOC含量均降低(图 1b). 从植物残体TN含量的变化可见,有植物组轮叶黑藻体内TN含量随时间呈波浪状起伏,第28天后开始缓慢上升,平稳之后在第96天下降. 整个试验过程中,总氮浓度为8 mg/L的处理组植物体内含氮量均高于16 mg/L处理组(图 1c).
|
图 1 轮叶黑藻腐解过程中植物残体生物量(a)、总有机碳(b)和全氮(c)的变化 Fig.1 Changes in percentages of the biomass (a), TOC (b) and TN (c) in plant residue during the decomposition of Hydrilla verticillata |
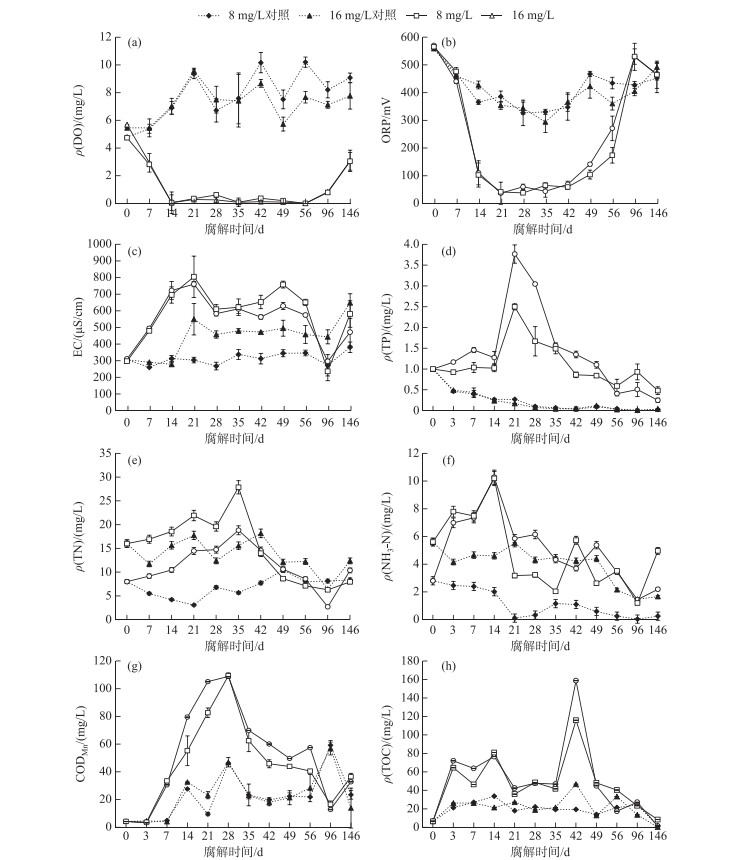
整个腐解过程上覆水营养物质和环境因子的变化如图 2所示. 植物腐败过程中,水体内DO浓度和ORP迅速下降,且在第14~56天期间维持在很低水平(接近0 mg/L);而相对电导率的变化趋势则与其相反. 与对照组相比,有植物组水体中TP、TN、NH3-N、CODMn和TOC浓度显著增高,其中TP、TN、NH3-N和CODMn浓度分别在第21、35、14和28天达到峰值,而TOC浓度在第42天达到峰值.
|
图 2 轮叶黑藻腐解过程上覆水中营养物质和水环境指标的变化 Fig.2 Change of nutrients and environment indexes in overlying water during the decomposition of Hydrilla verticillata |
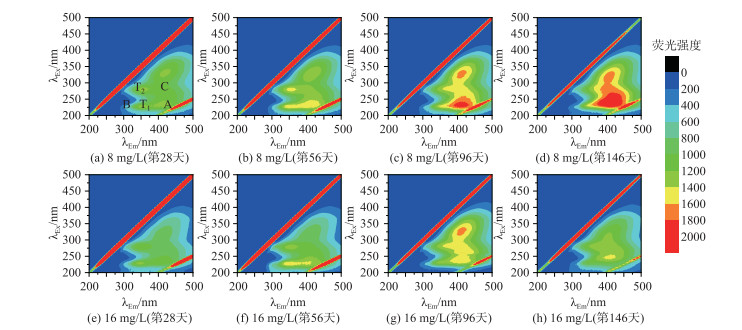
图 3反映的是两种氮浓度下植物腐解过程中水体DOM三维荧光光谱,结合表 2[14, 19]可知,两种氮浓度下的腐解植物在腐解过程中DOM的荧光峰主要有5类:类蛋白荧光峰(T1、T2峰)、紫外类富里酸峰(A峰)、可见类富里酸峰(C峰)以及被认为是紫外类富里酸在形成更复杂的可见类富里酸的过程中形成的过渡类酪氨酸峰(B峰). 植物腐解过程中,色氨酸类蛋白质(T1峰)的荧光峰强度在第56天较强. 随着植物的不断腐解,紫外类富里酸(A峰)、可见类富里酸(C峰)和微生物代谢产物(T2峰)3种物质的荧光峰强度增加.
|
图 3 轮叶黑藻腐解过程中水体溶解性有机质的荧光光谱(λEx为激发波长, λEm为发射波长) Fig.3 Fluorescence spectrum of dissolved organic matter in overlying water during the decomposition of Hydrilla verticillata |
| 表 2 溶解性有机质的主要荧光峰及相应位置 Tab. 2 Major fluorescence peaks and their spectral position of dissolved organic matter |
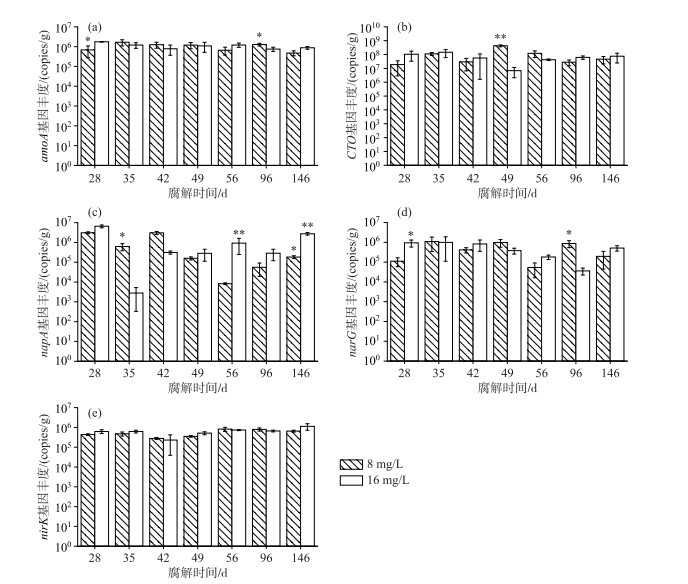
轮叶黑藻腐解过程中植物附着微生物膜的5个氮循环基因丰度的变化如图 4所示,结构基因CTO-16S rDNA的丰度在TN浓度为16 mg/L条件下大于TN浓度为8 mg/L条件下(除了第49和56天),丰度范围在6.85×106 ~4.28×108 copies/g之间(图 4b). 在腐解49 d后,TN浓度为8 mg/L的处理组内硝酸盐还原基因napA的丰度低于TN浓度为16 mg/L的处理组(图 4c). 为探究氮水体对生物膜内氮循环基因的影响,本文分析了4个氮循环功能基因,即氨氧化基因(amoA)、反硝化基因(nirK)以及硝酸盐还原基因(napA、narG)的丰度(图 5). TN浓度为16 mg/L条件下附着生物膜内的4个基因丰度总体上大于TN浓度为8 mg/L时的基因丰度,分别占总基因丰度的59 % 和41 %.
|
图 4 氮循环相关基因绝对丰度(星号表示总氮浓度8 mg/L与16 mg/L处理具有显著差异;*:P < 0.05;* *:P < 0.01) Fig.4 Abundance of nitrogen cycling genes in biofilm (The asterisks indicate the significant difference between TN concentration of 8 and 16 mg/L; *: P < 0.05; * *: P < 0.01) |

|
图 5 氮循环相关功能基因绝对丰度与样品之间关系弦图 Fig.5 Chordal graph of relation between the abundance of nitrogen cycling functional genes and samples |
选取氮循环相关基因绝对丰度(amoA、CTO、narG、napA、nirK)与环境因子(水体DO、TN、CODMn浓度及植物TOC含量)进行去趋势对应分析(DCA),其最大梯度长0.369,故环境因子与氮循环相关基因绝对丰度更接近线性模型,对氮循环相关基因绝对丰度与环境因子进行RDA分析. 结果(表 3)显示,轴1和轴2的特征值分别为0.259和0.019,物种-环境累计变异百分比为85.9 %,说明轴1和轴2能解释氮循环相关基因绝对丰度与环境因子的分布情况.
| 表 3 氮循环相关基因绝对丰度与环境因子的RDA结果 Tab. 3 Redundancy analysis of nitrogen cycling genes abundance and environmental factors |
通过RDA分析(图 6)发现,在两种氮浓度下轮叶黑藻附着生物膜的amoA基因丰度皆与DO浓度呈显著负相关(8和16 mg/L处理组的Pearson相关指数分别为-0.78和-0.74,P < 0.05). 氨氧化基因amoA和CTO 与NH3-N浓度呈负相关. 反硝化基因narG、napA、 nirK 的丰度与水体DO、(CODMn浓度及植物TOC含量和植物残体生物量均存在相关性,且nirK 与植物体内的TOC含量密切相关(8和16 mg/L处理组的Pearson相关指数分别为-0.73和-0.71, P < 0.05).
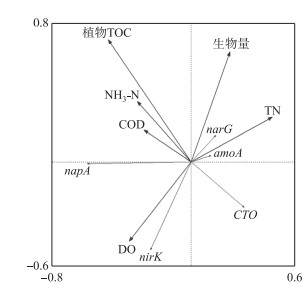
|
图 6 植物生物膜氮循环相关基因绝对丰度与环境因子的RDA分析 Fig.6 Redundancy analysis of nitrogen cycling genes abundance and environmental factors |
轮叶黑藻腐解初期为快速释放期,此阶段以细胞溶解性大分子有机物(如溶解性糖、蛋白质、DNA等)的释放为主,之后进入缓慢分解期[20]. 到第146天试验结束时,水体TN浓度为8和16 mg/L的条件下植物的分解速率常数分别为0.0066和0.0068 d-1,t50分别为105.01和102.62 d. 结果表明,与TN浓度为8 mg/L相比,TN浓度为16 mg/L时轮叶黑藻腐解速率稍微有影响,但是差异不大. 轮叶黑藻残体内TN含量呈现先降低后升高再降低的趋势,植物腐解初期,扩散作用下可溶性无机盐流失导致植物TN含量下降,之后微生物固定作用对植物TN的累积率大于同期植物残体损失率致,使植物TN含量增加,随着植物残体腐解,植物残体的碳被逐渐释放,大量营养物质使植物残体表面微生物增加,加快对植物体内全氮的分解利用[14].
凋落物分解过程中上覆水DOM在养分循环中起着重要作用. 结果显示轮叶黑藻腐解分离得到的荧光物质主要为类蛋白质和类腐殖质[21]. 水体DOM组分类蛋白质(含类酪氨酸和类色氨酸物质)的增加可能归因于植物或微生物蛋白质的降解;而难降解的紫外类富里酸(A)和可见类富里酸(C)等物质增加可能归因于植物表面附着微生物的影响. 本课题组[12]前期研究发现,在微生物作用过程中,植物残体表面附着的优势菌如厚壁菌门(Firmicutes)(例如厌氧菌属(Anaerovorax)、梭菌属(Clostridiales)和瘤球菌科(Ruminococcaceae)等)对有机物的分解和降解起到非常重要的作用,螺旋体门(Spirochaetes)(例如密螺旋体属(Treponema))是木质化有机物的关键降解物,这些微生物有助于难降解物质的降解,使得后期轮叶黑藻的分解速率常数降低.
3.2 轮叶黑藻腐解过程对水体的影响水体DO浓度是影响水生植物生长、腐解的重要环境因子,ORP是一项综合性指标,能反映水体中所有物质的宏观氧化-还原性,与水体DO浓度密切相关[22]. 本研究发现,在轮叶黑藻腐解初期,植物迅速氧化分解消耗水中DO,使得试验组水体DO浓度与ORP迅速降低,厌氧条件下沉水植物的腐烂分解会引起水质营养水平升高. Reddy和Sacco[23]研究苔草(Carex)和萍篷草属(Nuphar)的腐解过程发现,厌氧条件下可溶性磷的释放率高于有氧条件. 此外,植物腐解过程中低DO浓度水体中NH3-N、亚硝态氮、硝态氮和TP浓度高于高DO浓度水体[24]. 随着残体腐解过程有机物质向水体大量释放,使得电导率随着残体易溶性物质释放速率的变化而变化.
水生植物腐烂分解过程通常分为3个阶段:淋溶作用、微生物作用和微生物破碎化阶段[5]. 在淋溶作用下,细胞内溶解性物质包括蛋白质、溶解性糖类、DNA和细胞质等,使水体营养物质浓度在短时间内上升. 与对照相比,本研究中轮叶黑藻残体腐解前期的淋溶分解是引起水体TOC、CODMn和TP浓度升高的主要因素,在马来眼子菜[12]分解过程中也发现了类似的结果. 本研究中,在植物腐解前期,植物中的磷主要以无机磷酸盐的形式迅速淋溶于水中,而磷酸盐会以沉淀的形式进入沉积物,造成水体TP浓度的降低,最后恢复至初始水平. 轮叶黑藻腐解前期,水体内氮和磷浓度迅速增加,表明试验前期植物体内所含的氮被不断地释放出来. 试验结束时,植物腐解释放到水体中的氮在硝化、反硝化作用及微生物的吸收利用下逐渐降低并恢复至初始水平. CODMn浓度在第28天上升至峰值可能是由于有机碳自身吸附沉淀与解吸附尚未达到平衡,且沉积物中的有机碳在微生物作用下发生矿化作用,再次向水体释放. 然而在进入缓慢腐解阶段前,随着植物腐解速率变慢,加上微生物自身新陈代谢作用将水体的碳源以CH4、CO2等气体形式产生损失或通过自身吸附沉降方式向底泥转移等,因此,水体CODMn浓度继续下降[25]. 碳是构成植物有机体的主要元素,本研究中有植物组水体中TOC浓度在第42天达到峰值,可能是因为轮叶黑藻体内存在大量化学性质不活泼的物质[26].
3.3 轮叶黑藻腐解过程表面附着微生物氮循环基因的变化氮循环过程的第1步和决定步骤是氨氧化[27]. 具有氨氧化功能的amoA基因来源于氨氧化古菌(ammonia-oxidizing archaea,AOA)和氨氧化细菌(ammonia-oxidizing bacteria,AOB)[28],它在生态系统的氮循环过程中扮演着至关重要的生物地球化学的角色[29]. CTO片段是16S rDNA上的一段氨氧化菌特异性片段,是亚硝化单胞菌和亚硝化螺旋菌中的一种[30]. 本研究中在两种氮浓度下轮叶黑藻附着生物膜的amoA基因丰度总体上变化不大,变化范围为:4.76×105~1.76×106 copies/g,其中在第28和96天差异较为显著;然而,CTO基因丰度总体大于 amoA丰度,仅仅在第49天存在显著差异. Hermansson等[31]研究发现在未施过氮肥的土壤中氨氧化菌的数量是施过氮肥的土壤中的3倍. 本研究为保持硝态氮平衡,定期向上覆水内补加氨氮,相较体积较小的植物残体来讲氨氮对AOA和AOB始终处于饱和状态;另外水体DO浓度始终较低. 因此,低DO浓度条件下,氨氮对 amoA基因丰度的影响不大.
氮负荷一定程度上增加了反硝化基因(nirK、narG、napA)的丰度,基因丰度在总氮浓度为16 mg/L时总体上大于TN浓度为8 mg/L时,总体上在第28、49、56、96和146天. 基因narG和napA可以将硝酸盐转化为亚硝酸盐,这些基因分别编码两种异化硝酸还原酶Nar(膜蛋白)和NAP(周质结合蛋白)的亚基[32]. 亚硝酸盐可以由亚硝酸还原酶Nir作用转变为NO或者N2O,而nirK是最常用的标记基因[32]. 本研究中,这些反硝化基因在所有的样品中被检出,表明这些基因可能参与了反硝化过程. narG、napA和nirK的丰度已被用来解释湿地中的转化机制[15]. 这些结果总体暗示本研究中携带有硝化反硝化基因的微生物参与了氮的转化.
3.4 轮叶黑藻腐解过程中氮循环基因与环境条件的响应本研究中amoA在两种氮浓度下轮叶黑藻附着生物膜的基因丰度皆与DO浓度呈显著负相关. 这与Yan等[33]研究的沉水植物植物表面附着生物膜amoA丰度与水体DO浓度呈正相关相矛盾. 事实上,植物腐解过程中水体长期处于缺氧状态且amoA基因丰度变化不大. 因此,尽管数据显示DO浓度与 amoA基因丰度之间呈负相关,但并不能说明本研究中amoA基因受DO影响. 试验过程中植物体内TOC含量与水体DO浓度呈正相关,这与Han等[12]研究马来眼子菜腐解过程的结果一致,且植物表面附着生物膜amoA丰度随着腐解时间的推移而增加. 随着植物腐解过程,植物体内的营养元素被逐渐释放到水体中,水体中大量的营养元素供给细菌的生长所需的碳源和氮源,从而使得细菌密度增加. 氨氧化菌的数量与NH3-N去除率直接相关,且其菌群数量越多,氨氮去除率越高[34].
本研究中narG和napA绝对丰度与水体CODMn浓度和植物TOC含量呈相关性,反硝化基因nirK与植物的残体生物量、植物TOC含量、水体CODMn浓度均有相关性. Barnes等[35]的研究表明,高浓度的电子供体(如可降解有机碳)可能会促进反硝化作用. 硝化、反硝化作用的能力与硝化和反硝化细菌(或基因)的丰度密切相关[36]. 植物腐解过程中的有机物质刺激了生物膜中反硝化微生物的生长. 试验组水体DO浓度范围为0.06~5.70 mg/L,平均DO浓度为0.26 mg/L,试验过程中水体处于缺氧状态,研究表明,DO浓度范围在3~5 mg/L时有利于反硝化作用,过低或过高通常不利于反硝化过程[11]. 植物腐解过程中大量营养物质释放,使水体碳、氮、磷浓度在短期内升高.
本研究中,轮叶黑藻腐解过程中残体表面生物膜硝化反硝化基因分布较多,氮负荷刺激了沉水植物表面附着的生物膜生长和amoA、napA、narG和nirK 基因丰度[33]. 不同分解阶段附生细菌群落与养分之间存在着复杂的相互作用. 有研究报告显示,随着时间的推移,河流生态系统中腐败叶片上的细菌群落迅速变化,叶片化学物质可能会影响细菌群落[37]. 根据Tax4fun分析[12],附生细菌群落可能的功能随着分解过程而改变. 本研究结果表明,植物腐解过程中植物中的碳、磷含量和植物残体生物量都会减少,且上覆水中的碳、磷含量会在试验结束时恢复至初始水平.
4 结论1) 到第146天试验结束时,水体TN浓度为8和16 mg/L的处理组植物的分解速率常数分别为0.0066和0.0068 d-1,水体氮浓度对轮叶黑藻腐解速率有一定的影响,高氮浓度略有利于轮叶黑藻的腐解.
2) 两种氮浓度下轮叶黑藻腐解初期会向水体释放大量的有机物质,在微生物的作用下使得水体DO浓度、ORP迅速降低,CODMn、TP浓度迅速增加,其后由于微生物作用及植物腐解过程的稳定化,水质基本恢复初始水平. 植物腐解过程中水体DOM主要包括紫外类富里酸、可见类富里酸、色氨酸类蛋白质和酪氨酸类蛋白质.
3) 轮叶黑藻腐解过程中,氮循环基因amoA、CTO、nirK、napA、narG与植物TOC含量和水体CODMn浓度都存在相关性.
上述研究结果进一步表明:两种氮浓度对轮叶黑藻残体及残体表面生物膜硝化反硝化基因丰度造成一定影响,继而对植物的腐解和水环境造成影响. 因此在协调水生植物与河湖之间的生态平衡时,一定要注意合理使用无机化肥,防止水生植物腐解释放营养物质导致水体富营养化及底泥有机质过量累积,产生潜在的二次污染.
| [1] |
Han B, Zhang SH, Wang PF et al. Effects of water flow on submerged macrophyte-biofilm systems in constructed wetlands. Scientific Reports, 2018, 8(1): 2650. DOI:10.1038/s41598-018-21080-y |
| [2] |
Zhang LS, Zhang SH, Lv X et al. Dissolved organic matter release in overlying water and bacterial community shifts in biofilm during the decomposition of Myriophyllum verticillatum. Science of the Total Environment, 2018, 633: 929-937. DOI:10.1016/j.scitotenv.2018.03.275 |
| [3] |
Assunção AWDA, Souza BP, Cunha-Santino MB et al. Formation and mineralization kinetics of dissolved humic substances from aquatic macrophytes decomposition. Journal of Soils and Sediments, 2018, 18(4): 1252-1264. DOI:10.1007/s11368-016-1519-x |
| [4] |
Sariyildiz T. Litter decomposition of Picea orientalis, Pinus sylvestris and Castanea sativa trees grown in Artvin in relation to their initial litter quality variables. Turkish Journal of Agriculture and Forestry, 2003, 27(4): 237-243. |
| [5] |
Corstanje R, Reddy KR, Portier KM. Typha latifolia and Cladium jamaicense litter decay in response to exogenous nutrient enrichment. Aquatic Botany, 2006, 84(1): 70-78. DOI:10.1016/j.aquabot.2005.07.013 |
| [6] |
Mendelssohn IA, Sorrell BK, Brix H et al. Controls on soil cellulose decomposition along a salinity gradient in a Phragmites australis wetland in Denmark. Aquatic Botany, 1999, 64(3/4): 381-398. DOI:10.1016/S0304-3770(99)00065-0 |
| [7] |
Zhang Y, Dong SK, Gao QZ et al. Soil bacterial and fungal diversity differently correlated with soil biochemistry in alpine grassland ecosystems in response to environmental changes. Scientific Reports, 2017, 7: 43077. DOI:10.1038/srep43077 |
| [8] |
Zhang Y, Dong SK, Gao QZ et al. Climate change and human activities altered the diversity and composition of soil microbial community in alpine grasslands of the Qinghai-Tibetan Plateau. Science of the Total Environment, 2016, 562: 353-363. DOI:10.1016/j.scitotenv.2016.03.221 |
| [9] |
Liu YY, Shi S, Mu ZJ et al. Dynamic changes of water nitrogen and phosphorus concentrations in a typical small agricultural watershed of the Three-Gorges Reservoir region. Journal of Southwest University: Natural Science Edition, 2014, 36(11): 157-163. [刘园园, 史书, 木志坚等. 三峡库区典型农业小流域水体但磷浓度动态变化. 西南大学学报: 自然科学版, 2014, 36(11): 157-163.] |
| [10] |
Pu HJ, Zhang NM, Yang ZX et al. Characteristics and influence factors of water body nitrogen in Baoxiang River watershed of Dianchi Lake area. Bulletin of Soil and Water Conservation, 2009, 29(6): 123-125. [普惠娟, 张乃明, 杨振兴等. 滇池宝象河流域水体氮素特征及影响因素. 水土保持通报, 2009, 29(6): 123-125.] |
| [11] |
Ji B, Yang K, Zhu L et al. Aerobic denitrification: A review of important advances of the last 30 years. Biotechnology and Bioprocess Engineering, 2015, 20(4): 643-651. DOI:10.1007/s12257-015-0009-0 |
| [12] |
Han B, Addo FG, Mu XY et al. Epiphytic bacterial community shift drives the nutrient cycle during Potamogeton malaianus decomposition. Chemosphere, 2019, 236: 124253. DOI:10.1016/j.chemosphere.2019.06.223 |
| [13] |
Smart MM, Rada RG, Donnermeyer GN. Determination of total nitrogen in sediments and plants using persulfate digestion. An evaluation and comparison with the Kjeldahl procedure. Water Research, 1983, 17(9): 1207-1211. DOI:10.1016/0043-1354(83)90063-5 |
| [14] |
Zhang SH, Zhang LS, Han B et al. Changes of nutrients and enzyme activity during the decomposition process of Hydrilla verticillatum. Journal of Hohai University: Natural Sciences, 2019, 47(2): 95-101. [张松贺, 张丽莎, 韩冰等. 轮叶黑藻腐解过程营养物质释放及微生物胞外酶活性变化规律. 河海大学学报: 自然科学版, 2019, 47(2): 95-101.] |
| [15] |
Zhang SH, Pang S, Wang PF et al. Responses of bacterial community structure and denitrifying bacteria in biofilm to submerged macrophytes and nitrate. Scientific Reports, 2016, 6: 36178. DOI:10.1038/srep36178 |
| [16] |
Mu XY, Lv X, Liu W et al. Biofilms attached to Myriophyllum spicatum play a dominant role in nitrogen removal in constructed wetland mesocosms with submersed macrophytes: Evidence from 15N tracking, nitrogen budgets and metagenomics analyses. Environmental Pollution, 2020, 266: 115203. DOI:10.1016/j.envpol.2020.115203 |
| [17] |
Kowalchuk GA, Stephen JR, De Boer W et al. Analysis of ammonia-oxidizing bacteria of the beta subdivision of the class Proteobacteria in coastal sand dunes by denaturing gradient gel electrophoresis and sequencing of PCR-amplified 16S ribosomal DNA fragments. Applied and Environmental Microbiology, 1997, 63(4): 1489-1497. DOI:10.1128/AEM.63.4.1489-1497.1997 |
| [18] |
Olson JS. Energy storage and the balance of producers and decomposers in ecological systems. Ecology, 1963, 44(2): 322-331. DOI:10.2307/1932179 |
| [19] |
Zhang H, Cui KP, Zhang Q et al. Spectral analysis and source analysis of dissolved organic matter in Pai river. Research of Environmental Sciences, 2019, 32(2): 227-234. [张欢, 崔康平, 张强等. 派河水体中DOM的光谱分析及其来源解析. 环境科学研究, 2019, 32(2): 227-234.] |
| [20] |
König R, Hepp LU, Santos S. Colonisation of low- and high-quality detritus by benthic macroinvertebrates during leaf breakdown in a subtropical stream. Limnologica, 2014, 45: 61-68. DOI:10.1016/j.limno.2013.11.001 |
| [21] |
Yao J, Yang F, Zhang YM et al. Research on the dissolved organic matter of Hydrilla verticillata's leaf and stem decomposition. China Environmental Science, 2017, 37(11): 4294-4303. [姚佳, 杨飞, 张毅敏等. 黑藻叶、茎腐解释放溶解性有机物的特性. 中国环境科学, 2017, 37(11): 4294-4303. DOI:10.3969/j.issn.1000-6923.2017.11.035] |
| [22] |
Wang SP, Chen JW, Liu YH et al. Distribution characteristics of submerged plants in urban rivers and its influencing factors: A case of Ningbo urban rivers. J Lake Sci, 2019, 31(4): 1064-1074. [王苏鹏, 陈吉炜, 刘意恒等. 城区河流中沉水植物分布特征及其影响因素分析——以宁波城区内河为例. 湖泊科学, 2019, 31(4): 1064-1074. DOI:10.18307/2019.0414] |
| [23] |
Reddy KR, Sacco PD. Decomposition of water hyacinth in agricultural drainage water. Journal of Environmental Quality, 1981, 10(2): 228-234. DOI:10.2134/jeq1981.00472425001000020022x |
| [24] |
Hai TN, Yakupitiyage A. The effects of the decomposition of mangrove leaf litter on water quality, growth and survival of black tiger shrimp (Penaeus monodon Fabricius, 1798). Aquaculture, 2005, 250(3/4): 700-712. DOI:10.1016/j.aquaculture.2005.04.068 |
| [25] |
Tang ZK, Zhang YM, Yang F et al. Migration and transformation of phosphorus nutrients in the decomposition process of three aquatic plants. Acta Scientiae Circumstantiae, 2019, 39(3): 716-721. [汤志凯, 张毅敏, 杨飞等. 3种水生植物腐解过程中磷营养物质迁移、转化过程研究. 环境科学学报, 2019, 39(3): 716-721. DOI:10.13671/j.hjkxxb.2018.0398] |
| [26] |
Davis SE Ⅲ, Corronado-Molina C Ⅲ, Childers DL Ⅲ et al. Temporally dependent C, N, and P dynamics associated with the decay of Rhizophora mangle L. leaf litter in oligotrophic mangrove wetlands of the Southern Everglades. Aquatic Botany, 2003, 75(3): 199-215. DOI:10.1016/S0304-3770(02)00176-6 |
| [27] |
Lau SCK, Liu WT. Recent advances in molecular techniques for the detection of phylogenetic markers and functional genes in microbial communities. FEMS Microbiology Letters, 2007, 275(2): 183-190. DOI:10.1111/j.1574-6968.2007.00853.x |
| [28] |
Francis CA, Beman JM, Kuypers MMM. New processes and players in the nitrogen cycle: The microbial ecology of anaerobic and archaeal ammonia oxidation. The ISME Journal, 2007, 1(1): 19-27. DOI:10.1038/ismej.2007.8 |
| [29] |
Beman JM, Francis CA. Diversity of ammonia-oxidizing Archaea and bacteria in the sediments of a hypernutrified subtropical estuary: Bahía del tóbari, Mexico. Applied and Environmental Microbiology, 2006, 72(12): 7767-7777. DOI:10.1128/aem.00946-06 |
| [30] |
Böttcher B, Koops HP. Growth of lithotrophic ammonia-oxidizing bacteria on hydroxylamine. FEMS Microbiology Letters, 1994, 122(3): 263-266. |
| [31] |
Hermansson A, Lindgren PE. Quantification of ammonia-oxidizing bacteria in arable soil by real-time PCR. Applied and Environmental Microbiology, 2001, 67(2): 972-976. DOI:10.1128/AEM.67.2.972-976.2001 |
| [32] |
Levy-Booth DJ, Prescott CE, Grayston SJ. Microbial functional genes involved in nitrogen fixation, nitrification and denitrification in forest ecosystems. Soil Biology and Biochemistry, 2014, 75: 11-25. DOI:10.1016/j.soilbio.2014.03.021 |
| [33] |
Yan LY, Zhang SH, Lin D et al. Nitrogen loading affects microbes, nitrifiers and denitrifiers attached to submerged macrophyte in constructed wetlands. Science of the Total Environment, 2018, 622/623: 121-126. DOI:10.1016/j.scitotenv.2017.11.234 |
| [34] |
Biesterfeld S, Russell P, Figueroa L. Linking nitrifying biofilm structure and function through fluorescentin situ hybridization and evaluation of nitrification capacity. Water Environment Research, 2003, 75(3): 205-215. DOI:10.2175/106143003x140980 |
| [35] |
Barnes RT, Smith RL, Aiken GR. Linkages between denitrification and dissolved organic matter quality, Boulder Creek watershed, Colorado. Journal of Geophysical Research: Biogeosciences, 2012, 117(G1): G01014. DOI:10.1029/2011JG001749 |
| [36] |
He F, Wu ZB, Tao J et al. Nitrification and denitrification in the integrated vertical flow constructed wetlands. Environmental Science, 2005, 26(1): 47-50. [贺锋, 吴振斌, 陶菁等. 复合垂直流人工湿地污水处理系统硝化与反硝化作用. 环境科学, 2005, 26(1): 47-50. DOI:10.13227/j.hjkx.2005.01.011] |
| [37] |
Wymore AS, Liu CM, Hungate BA et al. The influence of time and plant species on the composition of the decomposing bacterial community in a stream ecosystem. Microbial Ecology, 2016, 71(4): 825-834. DOI:10.1007/s00248-016-0735-7 |
 2021, Vol. 33
2021, Vol. 33 

