(2: 中国科学院重庆绿色智能技术研究院, 重庆 400714)
(3: 中国科学院大学重庆学院, 重庆 400714)
(2: Chongqing Institute of Green and Intelligent Technology, Chinese Academy of Sciences, Chongqing 400714, P. R. China)
(3: Chongqing School, University of Chinese Academy of Sciences, Chongqing 400714, P. R. China)
甲烷(CH4)是大气里的气体成分之一,对气候会产生强烈的温室效应,是仅次于二氧化碳(CO2)的第二重要温室气体(greenhouse gas, GHG)[1]. 自17世纪以来,快速增长的人类活动使得CH4排放量快速增加[1],目前全球大气CH4平均浓度已达1.87 μatm[2],且近10年其浓度年均增速为7.1×10-3 μatm/a[2],呈现出增速加快趋势,CH4对全球温室效应的影响在逐步扩大. 内陆水体(inland waters)主要包括湖泊、河流、水库和浅水池塘等,通常情况下不包含自然湿地(natural wetland). 尽管内陆水体占地球水生态系统总面积很小,但它们仍显著影响着全球碳收支平衡,是全球大气温室气体的重要贡献者[3-4].
水体中CH4浓度随时间和深度的变化是CH4产生与消耗平衡的最终结果(CH4动态平衡). 传统认为,CH4在水体底部或沉积层严格厌氧环境下由产甲烷古菌产生并释放进入水体. 产生的CH4向上覆水运输过程中易被甲烷氧化菌大量利用与消耗,从而明显减少水-气界面的CH4扩散通量,最终未被消耗的CH4释放进入大气[5]. 甲烷氧化菌(methane-oxidizing bacteria,MOB)由氧是否作为电子受体划分为好氧甲烷氧化菌和厌氧甲烷氧化菌两类. 内陆水体中,CH4的氧化过程主要是由好氧甲烷氧化菌介导的,而这一氧化过程可能会消耗尽全部的水体CH4产量[6-8]. 在好氧甲烷氧化菌影响因素方面,好氧甲烷氧化过程除自身生物生境偏好的影响外也会受到一系列非生物因素影响,并最终影响内陆水体中CH4收支. 本文尝试对当前好氧甲烷氧化过程的微生物生理生态、全球范围内内陆水体好氧甲烷氧化速率、主要影响因素等进行汇总整理,并从生物因素、非生物因素两个方面,对当前内陆水体好氧甲烷氧化研究进展进行探讨.
1 好氧甲烷氧化菌作用机理及类别好氧甲烷氧化菌是甲基营养细菌的一个分支,MOB广泛分布于各种水体环境中[9]. 其中甲烷单加氧酶(Methane monooxygenase,MMO),包括可溶性甲烷单加氧化酶(soluble MMO, sMMO)和颗粒性甲烷单加氧化酶(particulate MMO,pMMO),是推动微生物代谢层面上CH4氧化的关键[10-12]. 两类MMO会催化氧化CH4为甲醇(CH3OH),CH3OH会被进一步氧化为甲醛(HCHO). 而后HCHO通过戊糖-磷酸核酮糖(RuMP)途径或者丝氨酸(Serine)途径进一步反应被转化为甲酸或者细胞质,最终所有的反应会将CH4反应成为CO2,好氧甲烷氧化菌具体代谢过程如图 1所示. 目前普遍认为,sMMO仅存在于少数的甲烷氧化菌中,pMMO存在于几乎所有已知的甲烷氧化菌中[13-14]. 最初,基于生理、形态、超微结构和化学分类学特征,好氧甲烷氧化菌被分为Type Ⅰ型与Type Ⅱ型两大类. Type Ⅰ型好氧甲烷氧化菌特征是:(ⅰ)以RuMP作为反应途径去同化产生的甲醛; (ⅱ)细胞内主要含有16-C脂肪酸;(ⅲ)胞内膜形态呈现为束状分布;Type Ⅱ型好氧甲烷氧化菌特征是(ⅰ)以Serine作为反应途径去同化产生的甲醛;(ⅱ)细胞内的优势脂肪酸为18-C脂肪酸; (ⅲ)胞内膜分布在菌内细胞壁的周围[15]. 对16S rRNA基因序列的系统进化分析也证实了上述分类,进一步将Type Ⅰ型和Type Ⅱ型好氧甲烷氧化菌分别归于γ-变形菌和α-变形菌[16].

|
图 1 好氧甲烷氧化菌代谢过程化学反应路径 Fig.1 Chemical reaction path in metabolic process of aerobic methane-oxidizing bacteria |
随研究深入,好氧甲烷氧化菌的分类系统更加细化. 目前,γ-变形菌纲(Gammaproteobacteria,约16属,也称之为Type Ⅰ型). α-变形菌纲(Alphaproteobacteria,约6属,Type Ⅱ型)被划分为IIa型和IIb型好氧甲烷氧化菌[17-18];γ-变形菌(Type Ⅰ型)的划分方式仍然存在一定分歧,一般的划分方式是将Methylococcaceae科划分为Ia型和Ib型,Methylothermaceae科划分为Ic型好氧甲烷氧化菌[19]. 在2007年的Nature报道的3株极端嗜酸(pH<2)的好氧甲烷氧化菌,它们均属于疣微菌门(Verrucomicrobia,目前已知2属),这种新发现细菌被划分为Ⅲ型好氧甲烷氧化菌[20-22],而其相应的循环途径(CBB)是将CO2作为碳源供给自己的代谢活动,且这种CO2的利用除从自身产出的也可以利用水环境中的,这与NC10门厌氧甲烷氧化菌的代谢过程是相同的. 现阶段,内陆水体中好氧甲烷氧化菌研究大多围绕γ-变形菌和α-变形菌的生态位分化展开. 在此基础上,好氧甲烷氧化菌系统分类研究则更加强化了对菌种的地理空间分布及生境偏好研究,这为内陆水体中CH4氧化的分析过程提供新思路.
2 内陆水体好氧甲烷氧化菌生境偏好好氧甲烷氧化菌最早发现于20世纪初,但直到1970s,才对其进行了广泛的分离和鉴定,以便进行详细的生理分析. 大多数已知的好氧甲烷氧化菌在中等酸碱度(pH 5~8)以及温度范围(20~35℃)下生长最好,同时随着生物化学进步嗜冷(生长<15℃)、嗜热(生长>40℃)、嗜碱(pH>9.0)和嗜酸(pH<5)的特殊好氧甲烷氧化菌在极端水环境中被逐渐分离出来[23-24]. 对于非极端条件下内陆水体而言,温度和溶解氧(DO)浓度、CH4浓度联系紧密,三者构成了好氧甲烷氧化菌活性变化与代谢区域的直接影响因素,因而研究好氧甲烷氧化菌生境时往往伴随着三大影响因素的研究[25-28].
内陆水体中Type Ⅰ型好氧甲烷氧化菌通常被认为是CH4氧化的"先锋队". 在一些水体表层沉积物中Type Ⅰ型好氧甲烷氧化菌的pmoA基因拷贝量甚至比Type Ⅱ型好氧甲烷氧化菌高1~2个数量级[29-30]. Type Ⅱ型好氧甲烷氧化菌则更像是CH4氧化的"常备军". 尽管Type Ⅱ型好氧甲烷氧化菌不常占优,但却呈现出对生境胁迫(温度、DO、pH等)的高耐受性,具有更强的"弹性"或稳定性以应对生境变化[31]. 故有研究者倾向于将Type Ⅰ型好氧甲烷氧化菌的生存策略归纳为"C型"(竞争者),而Type Ⅱ型好氧甲烷氧化菌的生存策略则是更接近于"S型"(胁迫耐受者)[32].
2.1 好氧甲烷氧化菌的温度偏好Shivaji等[33]认为每种类型的好氧甲烷氧化菌都有适宜生长的温度,温度的变化也可能导致好氧甲烷氧化菌群落的结构发生变化,同时有研究表明降水与温度的相互作用对部分好氧甲烷氧化菌丰度带来明显变化[34]. 同时温度也会影响好氧甲烷氧化菌的酶活性,如羟丙酮酸还原酶、己糖磷酸合酶、甲酸脱氢酶和核糖二磷酸羧化酶活性等[35]. 尽管Type Ⅰ型好氧甲烷氧化菌和Type Ⅱ型好氧甲烷氧化菌在较宽的温度范围内都具有活性[36],但通常情况下,Type Ⅱ型好氧甲烷氧化菌在高于15℃的温度下生长较好[37-38],Type Ⅰ型好氧甲烷氧化菌则在低温(5~15℃)下更有利[24],例如在南极分离的Methylomonas scandinavica就属于耐低温菌[39-40]. 但Type Ⅰ型好氧甲烷氧化菌不止一个属种可以适应高温环境,其中Methylococcus和Methylocaldum就是一类特殊的耐热菌,而Type Ⅰ型中的Methylothermus thermalis最高活性下的温度超过了55℃[41]. 而拥有高耐受性的Type Ⅱ型好氧甲烷氧化菌也存在耐低温的菌种[42].
2.2 好氧甲烷氧化菌的溶解氧浓度偏好内陆水体不同类别的好氧甲烷氧化菌群落分布会受到DO浓度的明显影响,有研究发现分层明显的水体中,地表水和中层水主要由Type Ⅱ型好氧甲烷氧化菌主导,而Type Ⅰ型好氧甲烷氧化菌在深水中占主导[43]. 在内陆水体中,所有好氧甲烷氧化菌很少出现在水体表层,这是因为水体表层过高的DO浓度会抑制好氧甲烷氧化菌活性,所以通常好氧甲烷氧化菌丰度最高处发生在沉积物或水体内的好氧-厌氧交界处,即DO浓度和CH4浓度梯度相交处[44]. 然而Pavin湖中的缺氧层中检测到了Methylobacter属好氧甲烷氧化菌[45],且部分的培养实验表明Type Ⅱ型好氧甲烷氧化菌更适应极端缺氧条件. 同时原位实验发现,Type Ⅰ型好氧甲烷氧化菌在极端缺氧环境中有不同属的存在. 例如Kalyuzhnaya等[46-48]研究发现,Methylobacter alcaliphilum strain 20Z在DO含量小于5 % 时,好氧甲烷氧化菌的活性会受抑制使反应速率下降,Methylobacter trichosporium OB3b与Methylobacter parvus OBBP对于DO含量变化响应不明显,而Methylobacter trichosporium最适DO含量在1.6 % ~18 % 之间. 这一系列研究表明好氧甲烷氧化菌,特别是Methylobacter属在低DO含量条件下具有更高的活性. 而从生物因子角度解释[49],好氧甲烷氧化菌产生活性氧产物(包括超氧阴离子自由基、过氧化氢和羟基自由基)作为代谢过程中的副产物,这会对细胞结构造成氧化损伤,因此大量好氧甲烷氧化菌生存于DO浓度更低且CH4浓度更高的水体深层,既满足了基本的氧需求也满足反应底物浓度的需求. 而在缺氧情况下,Oswald等[28]通过放射性示踪实验揭示了CH4氧化的光诱导作用下,看似缺氧的水层存在DO,并且在同一区域发现了Methylobacter属的好氧甲烷氧化菌[50]. 而在瑞士LagodiCadagno湖,研究者发现光穿透好氧区到达缺氧区,好氧甲烷氧化菌可以利用藻类光合作用所产生的DO在缺氧区内进行好氧甲烷氧化过程[51]. 这意味着光通过水中生物进行隐性光合作用,可以扩大适合好氧甲烷氧化菌的氧化带,从而推动好氧甲烷氧化菌的代谢反应.
2.3 好氧甲烷氧化菌的甲烷浓度偏好好氧甲烷氧化菌的代谢过程活性也会受限于CH4浓度,其浓度和可利用性是影响代谢过程的关键因素之一,低CH4浓度会导致整体的好氧甲烷氧化菌氧化活性下降[52-53]. Type Ⅰ型好氧甲烷氧化菌对CH4浓度变化响应较Type Ⅱ型好氧甲烷氧化菌明显[54],在相对适宜的水环境条件下占优. 而Crevecoeur等[9]在加拿大魁北克自然水域的研究中发现Type Ⅱ型好氧甲烷氧化菌在极端的CH4浓度下(过高或过低)倾向于占优. 其原因可能是Type Ⅱ型好氧甲烷氧化菌对生境胁迫的高耐受性,在极端CH4浓度下尤为重要[31]. 因而Type Ⅰ型好氧甲烷氧化菌可能在支持其快速生长的稳点环境中占主导地位,而Type Ⅱ型好氧甲烷氧化菌则更能承受环境的波动影响,并逐渐在极端环境下占主导地位.
2.4 好氧甲烷氧化菌的其他环境因子偏好好氧甲烷氧化菌本身被认为是低速慢生长的细菌[55],通常需要几周时间实现倍增[56]. 有研究发现多个相似湖泊的对比下,PO43-浓度高的湖泊其好氧甲烷氧化菌丰度也更高[57]. 这是由于所有生物都需要磷来进行细胞分裂、能量转化和细胞生命维持,因此好氧甲烷氧化菌可能会因异养细菌的快速生长而无法竞争营养,而当细菌生长竞争激烈的情况下更高的PO43-浓度可以使好氧甲烷氧化菌不受磷的限制. 除了磷和微生物群落之间的相互作用以外,其他营养盐可能进一步增强了好氧甲烷氧化菌的生长和影响随后的CH4氧化. 因具备固氮功能或具有好氧反硝化能力,部分好氧甲烷氧化菌同N循环亦具有密切关联性[58-59],但无机氮浓度(NH4+或NO3-)一直以来对于CH4氧化的影响是矛盾的,既有抑制现象也有刺激现象[15, 60]. 而对于好氧甲烷氧化菌代谢过程,MMO会受Cu可用性的限制,同时代谢过程中的酶也会受到环境的影响[61-62]. 对于菌种本身来说,溶解性有机碳(DOC)浓度过高会导致好氧甲烷氧化菌丰度更高,且可能会出现更高的Type Ⅱ型好氧甲烷氧化菌比例[63]. Ho等[64]表明,无论组成群落的好氧甲烷氧化菌具体情况如何,一个多样化好氧甲烷氧化菌群落对于刺激CH4氧化都具有重要意义.
3 内陆水体好氧甲烷氧化速率数据分析 3.1 同位素测试甲烷氧化速率方法好氧甲烷氧化菌对不同重量碳元素的CH4分子利用程度不同,所以出现了在氧化一部分CH4分子后,剩余的CH4分子中13CH4相对富集的情况[65],这样的过程叫做同位素分馏. 同位素在动力学上的差异使我们可以利用CH4在氧化前后δ13C比值的差异来定量地表示CH4氧化的速率.
在前期探索中,许多研究者发现CH4的氧化符合Rayleigh蒸馏公式[65],Coleman等[66]在1981年发表的文章中推导并定义了一套CH4氧化公式,该公式与Rayleigh公式本质上相同,都是对分馏系数α的探讨,后续在研究CH4氧化速率中使用的分馏系数α含义也来源于此. 之后在2002年Bastviken等[5]比较了当时主流的几种CH4氧化测试方法,发现14C、13C和质量平衡模型都能展示相同的规律,之后很多文献[6-8]使用13C法来测量CH4氧化速率的公式大多是基于此,本文章的文献调查采用的好氧甲烷氧化速率也是基于此. 但是在自然界,并不是所有的地区都存在一个较高且合适的CH4浓度,同时也不能忽视好氧水体自生产CH4现象[67]. 传统的测试方法在测量更低CH4浓度条件下的氧化速率时就无法得到精确的数据,并且在水体自身产生CH4的情况下会低估氧化速率. 而采用放射性同位素3H标记的CH4分子可以在CH4浓度非常低的情况下测得CH4氧化速率. 但在实际操作中,放射性同位素3H受本身造价以及更严格的控制条件要求并未大范围运用在内陆水体中,而主要利于海水的CH4氧化测试.
3.2 全球内陆水体好氧甲烷氧化速率调查统计本文调查收集了好氧甲烷氧化速率(methane oxidation rate,MOX)研究全球范围内数据共40余篇文献,文献均来自于Web of Science中公开发表的文献,搜索关键词为Methane oxidation、Aerobic methane oxidation、Aerobic methane-oxidizing bacteria、Methane oxidation rate. 对检索到的文献进行分类,删除海洋、河流入海口、土壤研究. 文献调查含39个湖泊、1个河流、2个水库. 此外,为方便比较,文献检索中增加了7个河口与海岸案例(图 2).
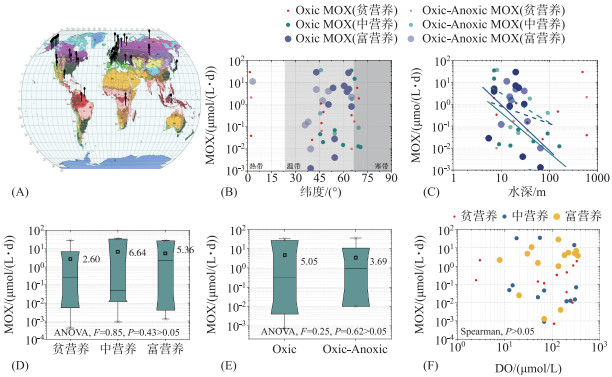
|
图 2 全球内陆水体好氧甲烷氧化速率分析 Fig.2 Analysis of aerobic methane oxidation rate in inland waters around the world |
图 2中,A为相关检索案例在全球的分布情况,本图在Kottek等[68]的柯本气候图底图上修改;图 2B为不同纬度水体中MOX分布;C为不同水深MOX分布;Oxic MOX代表在好氧环境下MOX(DO>2 mg/L);Oxic-Anoxic表示水体中好氧-缺氧界面的MOX(DO=2 mg/L临界值);图 2C中直线代表水深与Oxic MOX线性拟合结果(P<0.05),虚线代表水深与Oxic-Anoxic MOX线性拟合结果(P<0.05);图 2D为不同营养状态下MOX的统计,包含了Oxic和Oxic-Anoxic两种情况;图 2E为好氧环境(Oxic)、好氧-缺氧界面间(Oxic-Anoxic)的MOX统计;图 2F为不同营养状态水体DO浓度与MOX的关系. 为方便作图表达,删除了若干个极端数据值(洪水爆发期、河流入海口海水倒灌等多种使水体短时间发生剧烈变化的情况).
MOX测定的研究案例,大部分集中在北纬30°~75°的温带和寒带地区(图 2B),且主要位于北美与欧洲(图 2A). 湖泊是开展内陆水体好氧甲烷氧化研究的主要对象. 但大体上,纬度差异并未影响不同内陆水体的MOX. 例如,位于北纬45°加拿大的Morency湖泊[69]和北纬71°俄罗斯的Lena河流[70]对比研究发现,Lena河外来输入有机质浓度较低且本身底物产CH4能力较低,MOX为0.000419 μmol/(L ·d),比Morency湖泊少4个数量级;北纬65°N,属寒带气候的俄罗斯Svetloe湖MOX为0.0009 μmol/(L ·d)[71]比北纬46°属温带气候的美国俄勒冈州Spirit湖[72]MOX小3个数量级. 虽然Svetloe湖营养物质更丰富,即便如此,排除掉少数数量级相差过大水体,对主要数量级上的MOX做线性回归依然发现纬度对MOX无显著性相关. 营养状态、DO浓度变化亦未显著影响MOX变化(图 2E、F),但在中-富营养水体中MOX均值略高于贫营养水体(图 2D). 富营养化的湖泊高光合速率、有机物生产力使得产CH4底物浓度上升,而缺乏营养物质输入的贫营养湖过低CH4浓度限制着水体的CH4氧化[57, 73]. 在不同水深MOX分布中(图 2C),发现贫营养水体MOX与水深无显著相关(P>0.05),而中-富营养水体MOX与水深显著负相关(Spearman,P<0.05),其原因可能是CH4由底部产生直至上覆水过程中,由于水体过深导致气体在水柱中停留时间过长的综合作用下整个水柱CH4氧化发生明显改变[74].
4 不同类型内陆水体好氧甲烷氧化过程研究进展不同类型水体具有明显差异的水文条件、水环境条件与水生态特征,所处地理区域及所受人类社会活动影响大小的不同,故本小节将对不同类型内陆水体(湖泊、河流、水库为主)以及其他内陆水环境好氧甲烷氧化过程进行综述,以期对不同内陆水体好氧甲烷氧化变化情况有更加明晰的把握.
4.1 湖泊中的好氧甲烷氧化过程CH4的产生与氧化问题已在湖泊中进行了广泛研究,CH4是湖泊中碳代谢的主要产物,在湖泊中产生的CH4被氧化的比例可能很大(30 % ~90 %). 垂向分层通常是深水湖泊的一个属性,溶解物质的积累导致上、下层间的密度差异阻止了其完全混合,相应的DO分层情况也十分明显[75];而在一些存在湖面倾覆现象的湖泊,湖水因为水体混合导致深层储存的CH4向湖面移动,也会因为CH4富集引发好氧甲烷氧化菌的大量繁殖与生态演替同步对过量释放的CH4进行消耗[76]. 好氧甲烷氧化过程是一种需氧过程,准确的说在通常情况下是一种微需氧过程. CH4氧化受到DO浓度的限制[77]. 在深层厌氧的大型湖泊中本身的MOX大小往往取决于CH4氧化层(好氧甲烷氧化菌聚集并进行代谢的微氧区域)的深度,CH4氧化层区域越广,MOX就越高,这种氧化层的差异在季节性分层中尤为明显[78]. 而与深水湖相比,浅水湖水分层不易出现,很多水体全年水柱都是有氧状态[79],这也使得可能经过计算后水体无明显的好氧甲烷氧化过程,导致部分浅水湖对好氧甲烷氧化菌研究需要延展到沉积物中.
虽然DO是好氧甲烷氧化过程所必需的物质,但过高浓度会影响好氧甲烷氧化菌的活性从而降低MOX[80]. 研究资料[25-28]表明最高MOX情况通常出现在低DO浓度区域,并伴随较高CH4浓度,而湖泊表层DO浓度过高MOX显得会极为微小甚至无法检测. 有研究者[80-81]发现低DO浓度与高有机物沉积速率相结合,会导致"新鲜"有机物更好地埋藏在沉积物中,有利于CH4生成. 同时湖泊水体的水柱缺氧时的水柱分层阻碍了底部水和地表水之间的交换,这又会进一步促进底部水中CH4的积累. 然而湖泊中微氧并不总是能观察到最高CH4浓度,其原因可能是过高MOX导致CH4净产出量减少,这也解释了为什么可能在深水湖泊出现MOX大于CH4产生速率的情况.
对低纬度热带湖泊、温带湖泊和北方湖泊进行比较,与大多数生物代谢过程一样,CH4氧化也会表现出温度依赖特点[25],一年四季的高水温可能会使好氧甲烷氧化菌有着更高的活性,因此常常能观察到低纬度热带湖泊MOX大于后者[78, 82],且通常较高温度下可以观察到水体有着较快的MOX周转率[52]. 而高纬度湖泊占地球上所有湖泊的很大一部分,一年中的很多个月都可能被冰覆盖,冰融化时期CH4排放占全年CH4排放的比例较大,高MOX也会出现在此阶段[77]. 这主要是因为冻土中DOC大量输入所带来的营养物质能够提高水体CH4浓度[74]. 例如yedoma类型冻土(主要出现在西伯利亚、阿拉斯加和加拿大西北部以前未冰化地区一种富含有机物的冻土)由于温度升高冻土融化会带来大量的产CH4底物[77].
内陆湖泊中Type Ⅰ型好氧甲烷氧化菌主导着整个湖泊和水柱层的CH4氧化活动,对CH4循环有着更显著的作用,例如Washington、Constance湖以及其他湖泊[30, 43, 83],同时也发现Type Ⅰ型好氧甲烷氧化菌通常是温带湖泊中上层细菌群落的重要组成部分[24],对于逃逸到水体中上层的CH4起主要的消耗作用. 对部分湖泊中上层水样进行功能基因测序,发现Type Ⅰ型好氧甲烷氧化菌中的Methylobacter属占主导地位[45, 84-85],而在Rotsee湖和Zug湖中,利用稳定同位素标记与单细胞成像质谱联用,发现Type Ⅰ型甲烷氧化菌中的Crenothrix polyspora参与了氧跃层以下的CH4氧化过程[86]. 一些低纬度热带湖泊中虽然表层的好氧甲烷氧化菌是以Type Ⅱ型为主,但在营养程度更高的深层水体与底部沉积物依然是好氧甲烷氧化菌更为富集[87]. 而在湖泊沉积物中Methylomonas、Methylosinus、Methylocystis等多种Type Ⅰ型好氧甲烷氧化菌是CH4氧化过程的主要贡献者[30, 83, 88].
4.2 河流中的好氧甲烷氧化过程河流水文水动力条件明显不同于其他内陆水体,且受人类社会活动影响较大. 相对于大气,许多河流表层的CH4和CO2都过饱和,河流也因此成为了快速的碳循环场所. 虽然一部分碳最终被输入到海洋,但更多的碳在河流中代谢并以CH4气体的形式流失到大气中[89],由于这种快速的异源输入,河流向大气排放CH4的潜力在不断接受社会影响下对大气中的温室气体影响日益加重. 河流砾石河床会对CH4生产做出快速的响应,即CH4的氧化,从而减轻CH4通过沉积物层的扩散(清水河流水柱CH4氧化层一般可以忽略不计),所以一旦CH4处于河流沉积物中上层,可渗透的有氧砾石河床便成为减少CH4扩散排放的最终屏障. 而由于不同河流水体之间的水力条件差异较大且水体本身周转周期较快,同时河流一般无法像水库以及湖泊出现特别明显的水分层现象,微氧区域很难出现在河流水体中.
在所有水层中,表层水体接受的光辐射强度最大,河流由于其水深较浅受到光照影响也就最为明显. 光辐射强度过大会抑制好氧甲烷氧化菌的活性[28],使得在昼夜循环中MOX表现出较大的差异. 同时由于水体光辐射强度会受到DOC浓度的影响而加快衰减,因而上部光照充足的水层中DOC浓度是光照对MOX影响的重要预测因子,但是在光线抑制不再是有效驱动因素的黑暗深层水中会被DO浓度所取代[25]. 河流沿程光照条件复杂、微氧区域分散、DOC输入来源众多(很多河流靠近人类生活生产),所以单条河流好氧甲烷氧化菌生境的研究对整个河流生态体系代表性意义并不大,更多对河流的研究都集中在了MOX与其影响因素上.
CH4作为好氧甲烷氧化菌主要的碳源能量,MOX与CH4生产率是相辅相成的,且MOX对CH4浓度变化响应最为敏感[27, 69]. 当河流中的DO浓度满足好氧甲烷氧化菌需求,CH4浓度对MOX的影响明显高于DO浓度. 与在许多湖泊和土壤中一样,CH4异养作用在河床沉积物中也受底物限制,因此MOX随CH4浓度的增加基本呈线性增加[8]. 中小型河流中,河床砾石级配对MOX有一定影响. Shelley等[8]发现粗砂砾河床MOX因CH4底物浓度较低而受限;在较细的泥沙淤积区域MOX显著升高(细颗粒沉积物由于其密集的形态拥有更大的CH4容量,会同时生成CH4和氧化CH4),受温度影响显著,并超过CH4产生速率. 若河流受光条件不佳甚至受到遮挡,河流MOX则显著升高约78 % [90];而在Elbe河的研究发现,好氧甲烷氧化过程主要存在于河床,MOX在上游山区河段明显强于下游低地河段[91-92]. Barbosa等[82]对河流的季节性研究则发现,河流由于季节性枯水与丰水在水位和流量上有很大波动,使MOX有显著改变. 而其中部分河流季节性丰水期会发现夏、秋季CH4总损失量会高于春、冬季[52, 82],且季节性降雨所导致的水温变化可直接影响微生物代谢率,例如产甲烷菌和甲烷氧化菌. 而由于咸水中存在的物理、化学机理,河流入海口处的盐度和悬浮颗粒物浓度能强烈影响MOX,有研究表明水体中盐度能对MOX产生一定抑制作用,而悬浮颗粒物浓度对MOX表现为积极影响[52].
4.3 水库中的好氧甲烷氧化过程水库是受人为影响下的大型内陆水体,由于其产CH4底物与CH4的来源丰富,CH4的生产、运输、氧化过程更为复杂. 水库CH4主要排放途径分为三类:浅水区气泡释放、水-气界面扩散释放、水轮机和溢洪道下游的消气释放. 与湖泊相同,由于热带地区水库水温较高,有利于有机物的降解,CH4生产和氧化高于相似条件下的温带、北方水库,同时MOX也相应很高[27, 93]. 水库由于其调蓄作用导致其水力条件季节性变化明显,而季节变化带来的温度变化有时会严重影响CH4在亚热带和热带水库的深层区域中的生产,使得CH4氧化受CH4浓度限制[94]. 同时在春季和夏季,有的水库强分层,DO渗透并不够,好氧甲烷氧化菌只能在更小的范围内活动[93]. 这与Lofton等[95]提出的特定基质-温度相互作用理论相吻合,只有CH4处于饱和条件下MOX受到温度的影响能明显观察到,即在限制CH4浓度时温度对MOX影响并不明显,因此MOX还依赖于一套与温度相互关联的其他环境变量,这在温度分层和氧分层尤为明显的深水水库十分重要. 同时温度对底层水中CH4氧化的影响可能受到水中DO浓度的调节,而在低氧条件下,温度变化没有明显影响CH4氧化[25]. 且由于水库的水分层现象,在不同水层运输过程中CH4向上扩散和DO向下渗透都会受到一定的影响[96]. 因此在水库水分层与混合不同阶段会发现CH4浓度和DO浓度有相当大的差异,好氧甲烷氧化菌生长区域也会因此受限. Type Ⅰ型甲烷氧化菌和Type Ⅱ型好氧甲烷氧化菌在水库中因DO构成的氧化层中均有广泛的分布. 在亚热带水库(Little Nerang Dam、Lake Baroon和Lake Wivenhoe)可以发现丰富Type Ⅰ型好氧甲烷氧化菌(如Crenothrix polyspora、Methylomonas、Methylocaldum)[93]. 而位于法属圭亚那的Petit-Saut Reservoir则观察到了Type Ⅱ型好氧甲烷氧化菌占据着主要的CH4氧化活动[27].
水库拥有着特殊水利条件与消落带涨落情况,这使得水库有着高外来输入有机碳的特点. 低中营养内陆水体中陆地来源的DOC会明显影响水体的颜色,水体颜色变化比温跃层深度更能减少光的穿透,达到光抑制作用[97],使得表层光照强度下降从而提高表层MOX,并由于表层水DO的更多消耗进一步导致缺氧性水层扩展到了较浅的深度,形成深层水体缺氧状态. 因此控制水库等内陆水体的CH4氧化有2个尤为重要的变量——DO浓度和有效光辐射,这两者会受到水体中DOC浓度的影响,从而使得DOC浓度间接影响MOX. 同时,水库底部的有机物本身矿化过程所导致的耗氧也会影响CH4通过好氧甲烷氧化菌被氧化. 而对于菌种本身来说,DOC浓度过高通常会伴随着更高的好氧甲烷氧化菌丰度,且可能会出现更高的Type Ⅱ型好氧甲烷氧化菌比例[63].
4.4 其他内陆水环境的好氧甲烷氧化过程湿地生态系统是陆地自然生态系统与水体自然生态系统的特殊过渡型生态系统. 湿地生态系统占内陆面积不超过10 %,含碳量占内陆总储存碳量的18 % [98],但向大气释放CH4总量却占据了全球自然生态系统的CH4排放总量的30 % 左右[99]. 好氧甲烷氧化菌在湿地生态系统中约能氧化掉其CH4产量的一半左右,但无法像内陆水体一样提供更为广的好氧甲烷氧化菌生存区域而导致部分湿地其CH4氧化可能是由厌氧微生物介导,同时湿地水文条件也决定了湿地生态系统有着较高的CH4逃逸率,使其成为了自然生态系统主要的排放源之一[82]. 目前湿地发现的好氧甲烷氧化菌主要为α-变形菌和γ-变形杆菌,并未发现Verrucomicrobia门. 其中属于Type Ⅱ型好氧甲烷氧化菌最先由McDonald团队发现,同时揭示了偏酸性湿地的主要菌种来源是Methylosinus和Methylocystis,后者发现在偏酸性湿地处于更加常见的位置[100-102]. 而后Type Ⅰ型好氧甲烷氧化菌也在一些自然湿地被逐步发现[103],其中Kip等[104]首次发现了适应酸性湿地环境的Type Ⅰ型好氧甲烷氧化菌. 在大量的湿地研究中Methylocystis通常占据着主要的CH4氧化工作,在偏酸性湿地基本也是Type Ⅱ型好氧甲烷氧化菌;而在极端寒冷条件下的湿地生态系统中Type Ⅰ型好氧甲烷氧化菌占比更大. 相应的,我国对于若尔盖湿地、日干乔湿地等地区近些年也开启了相应的研究,发现Type Ⅰ型好氧甲烷氧化菌占比更大,且Methylobacter、Methylocystis 两类菌种是主要的CH4氧化参与者[17, 105].
浅水池塘作为内陆水体的一部分其碳动态关注度也在逐渐升高[106]. 这类小型浅层水系统其系统特征会影响CH4排放以及氧化,并能从一定程度上解释部分地区CH4排放被低估的现象有可能来自于浅水池塘[107]. 例如,在人为活动影响下的水产养殖池是强温室气体CH4排放源,通常其气泡形态排放的CH4占比会明显高于其他水体[108-109]. 而其他内陆环境,例如森林、草原甚至垃圾填埋场也会发现好氧甲烷氧化菌的身影,但由于其不容易满足好氧甲烷氧化菌生存与代谢环境使得好氧甲烷氧化菌无法大量氧化CH4的产出.
5 内陆水体好氧甲烷氧化过程对全球碳循环的贡献内陆水体作为全球CH4预算的重要来源,自然生态中考虑到开放水域和植物介导的通量, 湖泊生态系统被认为对总的自然CH4排放有6 % ~16 % 的贡献[110]. 河流向大气释放CH4年均总量约为26.8 Tg/a; 水库向大气释放CH4年均总量约为17.7 Tg/a[4, 111], 两者分别占全球内陆水体向大气释放CH4总量的16 %、22 %. 内陆水体对大气温室气体的贡献是CH4在水环境中"源"与"汇"动态平衡下的结果,也就是产甲烷菌产出与甲烷氧化菌氧化共同调节下的整体反馈. 实际上来自于水体产生的CH4总量远大于监测到输入大气的CH4总量. 但由于两类菌在温室效应下温度抬升的响应不同,这种"源"与"汇"的动态平衡始终以"源"大于"汇"的正向反馈为主,形成了全球变暖正反馈回路机制[112]. 即温度抬升刺激"源"大于"汇"的动态平衡导致CH4排放进一步增加继续扩大全球变暖,这样CH4反馈回路也同步反映在了全球碳循环的反馈回路中. 在最近的研究中,通过将甲烷氧化菌对CH4的敏感程度进行划分,所展现出的CH4高敏性甲烷氧化菌对全球碳循环的CH4"汇"有着更为明显作用,使得好氧甲烷氧化过程对全球碳循环的贡献日渐明晰[113]. 而随着研究者不断对极端生境下新类型甲烷氧化菌以及更多兼性甲烷氧化菌的发现,也对全球碳收支运算提出了更高更精细的要求,推动着人类对CH4循环、碳循环的进一步认知.
从菌种本身来看,好氧甲烷氧化菌广泛的分布在内陆水体(湖泊、河流、水库、浅水池塘)、湿地、森林、草原等陆地生态系统环境中. 菌群以碳源作为生产代谢的能源,其介导的好氧甲烷氧化过程是全球碳循环重要的微生物调节. 一方面,好氧甲烷氧化过程理想情况下几乎可以氧化掉所有水体底部产生的CH4,是CH4由水体向大气释放过程中的"生物过滤器"和"最后屏障"[114-116]. 另一方面,好氧甲烷氧化过程使CH4成为水生生态系统中重要的碳源[117]. 它直接促进了好氧甲烷氧化菌的增殖,并逐渐丰富形成了以"好氧甲烷氧化菌-浮游或底栖动物"为核心的微食物环[118-119],对水生生态系统结构功能产生显著影响[120].
6 展望尽管目前对不同类型好氧甲烷氧化菌的生境偏好已有基本轮廓,但对于动态水文环境如何影响好氧甲烷氧化菌菌群建构与生态功能迄今仍鲜有报道,这成为了当前动态水文环境下好氧甲烷氧化过程水文生态机制仍不明晰的关键制约因素,特别是突发的极端因素变化(如气温骤变、强降雨、季节性干旱、洪涝等),从而导致好氧甲烷氧化菌的生存条件改变,需要更多细致的研究. 且在当前内陆水体好氧甲烷过程研究中,超过90 % 的研究案例集中于水文环境相对稳定的湖泊或湿地系统,而在流动性较强或水动力条件较为复杂的水体中,好氧甲烷氧化过程的研究积累却极为有限. 这一块重要的内陆水体组成部分数据上的空白,是今后研究内陆水体好氧甲烷氧化过程需要补充的重要内容.
| [1] |
Wuebbles DJ, Hayhoe K. Atmospheric methane and global change. Earth-Science Reviews, 2002, 57(3/4): 177-210. DOI:10.1016/S0012-8252(01)00062-9 |
| [2] |
Dlugokencky E. NOAA/ESRL. US, 2019.
|
| [3] |
Bastviken D, Tranvik LJ, Downing JA et al. Freshwater methane emissions offset the continental carbon sink. Science, 2011, 331(6013): 50. DOI:10.1126/science.1196808 |
| [4] |
Stanley EH, Casson NJ, Christel ST et al. The ecology of methane in streams and rivers: patterns, controls, and global significance. Ecological Monographs, 2016, 86(2): 146-171. DOI:10.1890/15-1027 |
| [5] |
Bastviken D, Ejlertsson J, Tranvik L. Measurement of methane oxidation in lakes: A comparison of methods. Environmental Science & Technology, 2002, 36(15): 3354-3361. DOI:10.1021/es010311p |
| [6] |
Thottathil SD, Reis PCJ, Del Giorgio PA et al. The extent and regulation of summer methane oxidation in northern lakes. Journal of Geophysical Research: Biogeosciences, 2018, 123(10): 3216-3230. DOI:10.1029/2018JG004464 |
| [7] |
Saarela T, Rissanen AJ, Ojala A et al. CH4 oxidation in a boreal lake during the development of hypolimnetic hypoxia. Aquatic Sciences, 2020, 82(2). DOI:10.1007/s00027-019-0690-8 |
| [8] |
Shelley F, Abdullahi F, Grey J et al. Microbial methane cycling in the bed of a chalk river: oxidation has the potential to match methanogenesis enhanced by warming. Freshwater Biology, 2015, 60(1): 150-160. DOI:10.1111/fwb.12480 |
| [9] |
Crevecoeur S, Ruiz-González C, Prairie YT et al. Large-scale biogeography and environmental regulation of methanotrophic bacteria across boreal inland waters. Molecular Ecology, 2019, 28(18): 4181-4196. DOI:10.1111/mec.15223 |
| [10] |
Semrau JD, Dispirito AA, Gu WY et al. Metals and methanotrophy. Applied and Environmental Microbiology, 2018, 84(6). DOI:10.1128/AEM.02289-17 |
| [11] |
Chan SI, Yu SSF. Copper protein constructs for methane oxidation. Nature Catalysis, 2019, 2(4): 286-287. DOI:10.1038/s41929-019-0268-9 |
| [12] |
Guggenheim C, Brand A, Bürgmann H et al. Aerobic methane oxidation under copper scarcity in a stratified lake. Scientific Reports, 2019, 9. DOI:10.1038/s41598-019-40642-2 |
| [13] |
Hakemian AS, Rosenzweig AC. The biochemistry of methane oxidation. Annual Review of Biochemistry, 2007, 76: 223-241. DOI:10.1146/annurev.biochem.76.061505.175355 |
| [14] |
Hwang IY, Hur DH, Lee JH et al. Batch conversion of methane to methanol using Methylosinus trichosporium OB3b as biocatalyst. Journal of Microbiology and Biotechnology, 2015, 25(3): 375-380. DOI:10.4014/jmb.1412.12007 |
| [15] |
Hanson RS, Hanson TE. Methanotrophic bacteria. Microbiological Reviews, 1996, 60(2). DOI:10.1128/MMBR.60.2.439-471.1996 |
| [16] |
Bowman JP, Sly LI, Nichols PD et al. Revised taxonomy of the methanotrophs-description of methylobacter gen-nov, emendation of Methylococcus, validation of Methylosinus and Methylocystis species, and a proposal that the family methylococcaceae includes only the group-i methanotrophs. International Journal Systematic Bacteriology, 1994, 44(2): 375-375. DOI:10.1099/00207713-44-2-375 |
| [17] |
Deng YC, Cui XY, Luke C et al. Aerobic methanotroph diversity in Riganqiao peatlands on the Qinghai-Tibetan Plateau. Environmental Microbiology Reports, 2013, 5(4): 566-574. DOI:10.1111/1758-2229.12046 |
| [18] |
Dumont MG, Luke C, Deng YC et al. Classification of pmoA amplicon pyrosequences using BLAST and the lowest common ancestor method in MEGAN. Frontiers in Microbiology, 2014, 5. DOI:10.3389/fmicb.2014.00034 |
| [19] |
Knief C. Diversity and habitat preferences of cultivated and uncultivated aerobic methanotrophic bacteria evaluated based on pmoA as molecular marker. Frontiers in Microbiology, 2015, 6. DOI:10.3389/fmicb.2015.01346 |
| [20] |
Dunfield PF, Yuryev A, Senin P et al. Methane oxidation by an extremely acidophilic bacterium of the phylum Verrucomicrobia. Nature, 2007, 450(7171). DOI:10.1038/nature06411 |
| [21] |
Van Teeseling MCF, Pol A, Harhangi HR et al. Expanding the verrucomicrobial methanotrophic world: Description of three novel species of Methylacidimicrobium gen. nov. Applied Environmental Microbiology, 2014, 80(21): 6782-6791. DOI:10.1128/AEM.01838-14 |
| [22] |
Pol A, Heijmans K, Harhangi HR et al. Methanotrophy below pH 1 by a new Verrucomicrobia species. Nature, 2007, 450(7171): 874-917. DOI:10.1038/nature06222 |
| [23] |
Deng YC, Che RX, Wu YB et al. A review of the physiological and ecological characteristics of methanotrophs and methanotrophic community diversity in the natural wetlands. Acta Ecologica Sinica, 2015, 35(14): 4579-4591. [邓永翠, 车荣晓, 吴伊波等. 好氧甲烷氧化菌生理生态特征及其在自然湿地中的群落多样性研究进展. 生态学报, 2015, 35(14): 4579-4591. DOI:10.10.5846/stxb201305060936.[] |
| [24] |
Sundh I, Bastviken D, Tranvik LJ. Abundance, activity, and community structure of pelagic methane-oxidizing bacteria in temperate lakes. Applied and Environmental Microbiology, 2005, 71(11): 6746-6752. DOI:10.1128/AEM.71.11.6746-6752.2005 |
| [25] |
Thottathil SD, Reis PCJ, Del Giorgio PA et al. The extent and regulation of summer methane oxidation in northern lakes. Journal of Geophysical Research-Biogeosciences, 2018, 123(10): 3216-3230. DOI:10.1029/2018JG004464 |
| [26] |
Lin JL, Joye SB, Scholten JCM et al. Analysis of methane monooxygenase genes in mono lake suggests that increased methane oxidation activity may correlate with a change in methanotroph community structure. Applied Environmental Microbiology, 2005, 71(10): 6458-6462. DOI:10.1128/AEM.71.10.6458-6462.2005 |
| [27] |
Guerin F, Abril G. Significance of pelagic aerobic methane oxidation in the methane and carbon budget of a tropical reservoir. Journal of Geophysical Research-Biogeosciences, 2007, 112(G3). DOI:10.1029/2006JG000393 |
| [28] |
Oswald K, Milucka J, Brand A et al. Light-dependent aerobic methane oxidation reduces methane emissions from seasonally stratified lakes. Public Library of Science, 2015, 10(7). DOI:10.1371/journal.pone.0132574 |
| [29] |
Deutzmann JS, Wörner S, Schink B. Activity and diversity of methanotrophic bacteria at methane seeps in eastern lake constance sediments. Applied and Environmental Microbiology, 2011, 77(8): 2573-2581. DOI:10.1128/AEM.02776-10 |
| [30] |
Costello AM, Auman AJ, Macalady JL et al. Estimation of methanotroph abundance in a freshwater lake sediment. Environmental Microbiology, 2002, 4(8): 443-450. DOI:10.1046/j.1462-2920.2002.00318.x |
| [31] |
Henckel T, Roslev P, Conrad R. Effects of O2 and CH4 on presence and activity of the indigenous methanotrophic community in rice field soil. Environmental Microbiology, 2000, 2(6): 666-679. DOI:10.1046/j.1462-2920.2000.00149.x |
| [32] |
Ho A, Kerckhof FM, Luke C et al. Conceptualizing functional traits and ecological characteristics of methane-oxidizing bacteria as life strategies. Environmental Microbiology Reports, 2013, 5(3): 335-345. DOI:10.1111/j.1758-2229.2012.00370.x |
| [33] |
Shivaji S, Kumari K, Kishore KH et al. Vertical distribution of bacteria in a lake sediment from Antarctica by culture-independent and culture-dependent approaches. Research in Microbiology, 2011, 162(2): 191-203. DOI:10.1016/j.resmic.2010.09.020 |
| [34] |
Horz HP, Rich V, Avrahami S et al. Methane-oxidizing bacteria in a California upland grassland soil: Diversity and response to simulated global change. Applied and Environmental Microbiology, 2005, 71(5): 2642-2652. DOI:10.1128/AEM.71.5.2642-2652.2005 |
| [35] |
Medvedkova KA, Khmelenina VN, Trotsenko YA. Sucrose as a factor of thermal adaptation of the thermophilic methanotroph Methylocaldum szegediense O-12. Microbiology, 2007, 76(4): 500-502. DOI:10.1134/S0026261707040170 |
| [36] |
Trotsenko YA, Khmelenina VN. Aerobic methanotrophic bacteria of cold ecosystems. FEMS Microbiology Ecology, 2005, 53(1): 15-26. DOI:10.1016/j.femsec.2005.02.010 |
| [37] |
Urmann K, Lazzaro A, Gandolfi I et al. Response of methanotrophic activity and community structure to temperature changes in a diffusive CH4/O2 counter gradient in an unsaturated porous medium. FEMS Microbiology Ecology, 2009, 69(2): 202-212. DOI:10.1111/j.1574-6941.2009.00708.x |
| [38] |
Mohanty SR, Bodelier PLE, Conrad R. Effect of temperature on composition of the methanotrophic community in rice field and forest soil. FEMS Microbiology Ecology, 2007, 62(1): 24-31. DOI:10.1111/j.1574-6941.2007.00370.x |
| [39] |
Graef C, Hestnes AG, Svenning MM et al. The active methanotrophic community in a wetland from the High Arctic. Environmental Microbiology Reports, 2011, 3(4): 466-472. DOI:10.1111/j.1758-2229.2010.00237.x |
| [40] |
Liebner S, Wagner D. Abundance, distribution and potential activity of methane oxidizing bacteria in permafrost soils from the Lena Delta, Siberia. Environmental Microbiology, 2007, 9(1): 107-117. DOI:10.1111/j.1462-2920.2006.01120.x |
| [41] |
Tsubota J, Eshinimaev BT, Khmelenina VN et al. Methylothermus thermalis gen. nov., sp. nov., a novel moderately thermophilic obligate methanotroph from a hot spring in Japan. International Journal of Systematic and Evolutionary Microbiology, 2005, 55: 1877-1884. DOI:10.1099/ijs.0.63691-0 |
| [42] |
Dedysh SN, Knief C, Dunfield PF. Methylocella species are facultatively methanotrophic. Journal of Bacteriology, 2005, 187(13): 4665-4670. DOI:10.1128/JB.187.13.4665-4670.2005 |
| [43] |
Reis PCJ, Thottathil SD, Ruiz-GonzaLez C et al. Niche separation within aerobic methanotrophic bacteria across lakes and its link to methane oxidation rates. Environmental Microbiology, 2020, 22(2): 738-751. DOI:10.1111/1462-2920.14877 |
| [44] |
Rudd J, Hamilton R. Factors controlling rates of methane oxidation and distribution of methane oxidizers in a small stratified lake. Archiv für Hydrobiologie, 1975, 75(4): 522-538. |
| [45] |
Biderre-Petit C, Jézéquel D, Dugat-Bony E et al. Identification of microbial communities involved in the methane cycle of a freshwater meromictic lake. FEMS Microbiology Ecology, 2011, 77(3): 533-545. DOI:10.1111/j.1574-6941.2011.01134.x |
| [46] |
Ren T, Amaral JA, Knowles R. The response of methane consumption by pure cultures of methanotrophic bacteria to oxygen. Canadian Journal of Microbiology, 1997, 43(10): 925-928. DOI:10.1139/m97-133 |
| [47] |
Kalyuzhnaya MG, Yang S, Rozova ON et al. Highly efficient methane biocatalysis revealed in a methanotrophic bacterium. Nature Communications, 2013, 4. DOI:10.1038/ncomms3785 |
| [48] |
Rostkowski KH, Pfluger AR, Criddle CS. Stoichiometry and kinetics of the PHB-producing Type Ⅱ methanotrophs Methylosinus trichosporium OB3b and Methylocystis parvus OBBP. Bioresource Technology, 2013, 132: 71-77. DOI:10.1016/j.biortech.2012.12.129 |
| [49] |
Steinle L, Maltby J, Treude T et al. Effects of low oxygen concentrations on aerobic methane oxidation in seasonally hypoxic coastal waters. Biogeosciences, 2017, 14(6): 1631-1645. DOI:10.5194/bg-14-1631-2017 |
| [50] |
Kadnikov VV, Savvichev AS, Mardanov AV et al. Microbial communities involved in the methane cycle in the near-bottom water layer and sediments of the meromictic subarctic Lake Svetloe. Antonie van Leeuwenhoek International Journal of General and Molecular Microbiology, 2019, 112(12): 1801-1814. DOI:10.1007/s10482-019-01308-1 |
| [51] |
Milucka J, Kirf M, Lu L et al. Methane oxidation coupled to oxygenic photosynthesis in anoxic waters. The ISME journal, 2015, 9(9): 1991-2002. DOI:10.1038/ismej.2015.12 |
| [52] |
Matoušů A, Osudar R, Šimek K et al. Methane distribution and methane oxidation in the water column of the Elbe estuary, Germany. Aquatic Sciences, 2016, 79(3): 443-458. DOI:10.1007/s00027-016-0509-9 |
| [53] |
Lei D, Liu J, Zhang JW et al. Methane oxidation in the water column of xiangxi Bay, Three Gorges Reservoir. Clean-Soil Air Water, 2019, 47(9). DOI:10.1002/clen.201800516 |
| [54] |
Lambrecht N, Katsev S, Wittkop C et al. Biogeochemical and physical controls on methane fluxes from two ferruginous meromictic lakes. Geobiology, 2020, 18(1): 54-69. DOI:10.1111/gbi.12365 |
| [55] |
Van Bodegom P, Stams F, Mollema L et al. Methane oxidation and the competition for oxygen in the rice rhizosphere. Applied and Environmental Microbiology, 2001, 67(8): 3586-3597. DOI:10.1128/AEM.67.8.3586-3597.2001 |
| [56] |
Horz HP, Raghubanshi AS, Heyer E et al. Activity and community structure of methane-oxidising bacteria in a wet meadow soil. FEMS Microbiology Ecology, 2002, 41(3): 247-257. DOI:10.1016/S0168-6496(02)00300-8 |
| [57] |
Denfeld BA, Ricão Canelhas M, Weyhenmeyer GA et al. Constraints on methane oxidation in ice-covered boreal lakes. Journal of Geophysical Research: Biogeosciences, 2016, 121(7): 1924-1933. DOI:10.1002/2016JG003382 |
| [58] |
Semrau JD, Dispirito AA, Yoon S. Methanotrophs and copper. FEMS Microbiology Reviews, 2010, 34(4): 496-531. DOI:10.1111/j.1574-6976.2010.00212.x |
| [59] |
Zhu J, Wang Q, Yuan MD et al. Microbiology and potential applications of aerobic methane oxidation coupled to denitrification (AME-D) process: A review. Water Research, 2016, 90: 203-215. DOI:10.1016/j.watres.2015.12.020 |
| [60] |
Bastviken D. Methane// Likens GE ed. Encyclopedia of inland waters. Oxford: Academic Press, 2009: 783-805.
|
| [61] |
Semrau JD, Zolandz D, Lidstrom ME et al. The role of copper in the pmmo of Methylococcus capsulatus bath—a structural vs catalytic function. Journal of Inorganic Biochemistry, 1995, 58(4): 235-244. DOI:10.1016/0162-0134(94)00056-G |
| [62] |
Ferenci T, Strom T, Quayle JR. Purification and properties of 3-hexulose phosphate synthase and phospho-3-hexuloisomerase fromMethylococcus-capsulatus. Biochemical Journal, 1974, 144(3): 477-486. DOI:10.1042/bj1440477 |
| [63] |
Yang YY, Chen JF, Tong TL et al. Eutrophication influences methanotrophic activity, abundance and community structure in freshwater lakes. Science of the Total Environment, 2019, 662: 863-872. DOI:10.1016/j.scitotenv.2019.01.307 |
| [64] |
Ho A, De Roy K, Thas O et al. The more, the merrier: heterotroph richness stimulates methanotrophic activity. The ISME Journal, 2014, 8(9): 1945-1948. DOI:10.1038/ismej.2014.74 |
| [65] |
Whiticar MJ. Carbon and hydrogen isotope systematics of bacterial formation and oxidation of methane. Chemical Geology, 1999, 161(1-3): 291-314. DOI:10.1016/S0009-2541(99)00092-3 |
| [66] |
Coleman DD, Risatti JB, Schoell M. Fractionation of carbon and hydrogen isotopes by methane-oxidizing bacteria. Geochimica et Cosmochimica Acta, 1981, 45(7): 1033-1037. DOI:10.1016/0016-7037(81)90129-0 |
| [67] |
Yang L. Research process on "methane paradox" phenomenon in lake surface waters. Chinese Journal of Ecology, 2020, 39(14): 1338-1348. [杨乐. 湖泊表层水体"甲烷悖论"现象研究进展. 生态学杂志, 2020, 39(14): 1338-1348. DOI:10.13292/j.1000-4890.202004.033.[] |
| [68] |
Kottek M, Grieser J, Beck C et al. World map of the Köppen-Geiger climate classification updated. Meteorologische Zeitschrift, 2006, 15(3): 259-263. DOI:10.1127/0941-2948/2006/0130 |
| [69] |
Thottathil SD, Reis PCJ, Prairie YT. Methane oxidation kinetics in northern freshwater lakes. Biogeochemistry, 2019, 143(1): 105-116. DOI:10.1007/s10533-019-00552-x |
| [70] |
Bussmann I, Hackbusch S, Schaal P et al. Methane distribution and oxidation around the Lena Delta in summer 2013. Biogeosciences, 2017, 14(21): 4985-5002. DOI:10.5194/bg-14-4985-2017 |
| [71] |
Savvichev AS, Kokryatskaya NM, Zabelina SA et al. Microbial processes of the carbon and sulfur cycles in an ice-covered, iron-rich meromictic lake Svetloe (Arkhangelsk region, Russia). Environmental Microbiology, 2017, 19(2): 659-672. DOI:10.1111/1462-2920.13591 |
| [72] |
Lilley MD, Baross JA, Dahm CN. Methane production and oxidation in lakes impacted by the May 18, 1980 eruption of mount st. Helens. Global Biogeochemical Cycles, 1988, 2(4): 357-370. DOI:10.1029/GB002i004p00357 |
| [73] |
Yang H, X ie, P, Ni LY. Underestimation of CH4 emission from freshwater lakes in China. Environmental Science and Technology, 2011, 45(10): 4203-4204. DOI:10.1021/es2010336 |
| [74] |
Delsontro T, Beaulieu JJ, Downing JA. Greenhouse gas emissions from lakes and impoundments: Upscaling in the face of global change. Limnology and Oceanography Letters, 2018, 3(3): 64-75. DOI:10.1002/lol2.10073 |
| [75] |
Boehrer B, Schultze M. Stratification of lakes. Reviews of Geophysics, 2008, 46(2). DOI:10.1029/2006RG000210 |
| [76] |
Mayr MJ, Zimmermann M, Dey J et al. Growth and rapid succession of methanotrophs effectively limit methane release during lake overturn. Communications Biology, 2020, 3(1). DOI:10.1038/s42003-020-0838-z |
| [77] |
Martinez-Cruz K, Sepulveda-Jauregui A, Walter Anthony KW et al. Geographic and seasonal variation of dissolved methane and aerobic methane oxidation in Alaskan lakes. Biogeosciences, 2015, 12(15): 4595-4606. DOI:10.5194/bg-12-4595-2015 |
| [78] |
Roland FAE, Morana C, Darchambeau F et al. Anaerobic methane oxidation and aerobic methane production in an east African great lake (Lake Kivu). Journal of Great Lakes Research, 2018, 44(6): 1183-1193. DOI:10.1016/j.jglr.2018.04.003 |
| [79] |
Utsumi M, Nojiri Y, Nakamura T et al. Oxidation of dissolved methane in a eutrophic, shallow lake: Lake Kasumigaura, Japan. Limnology and Oceanography, 1998, 43(3): 471-480. DOI:10.4319/lo.1998.43.3.0471 |
| [80] |
Marotta H, Pinho L, Gudasz C et al. Greenhouse gas production in low-latitude lake sediments responds strongly to warming. Nature Climate Change, 2014, 4(6): 467-470. DOI:10.1038/NCLIMATE2222 |
| [81] |
Bange HW, Bergmann K, Hansen HP et al. Dissolved methane during hypoxic events at the Boknis Eck Time Series Station (Eckernförde Bay, SW Baltic Sea). Biogeosciences Discussions, 2009, 6(6): 11463-11477. |
| [82] |
Barbosa PM, Farjalla VF, Melack JM et al. High rates of methane oxidation in an Amazon floodplain lake. Biogeochemistry, 2018, 137(3): 351-365. DOI:10.1007/s10533-018-0425-2 |
| [83] |
Deutzmann JS, Schink B. Anaerobic oxidation of methane in sediments of lake constance, an oligotrophic freshwater lake. Applied and Environmental Microbiology, 2011, 77(13): 4429-4436. DOI:10.1128/AEM.00340-11 |
| [84] |
Blees J, Niemann H, Wenk CB et al. Micro-aerobic bacterial methane oxidation in the chemocline and anoxic water column of deep south-Alpine Lake Lugano (Switzerland). Limnology and Oceanography, 2014, 59(2): 311-324. DOI:10.4319/lo.2014.59.2.0311 |
| [85] |
Kojima H, Iwata T, Fukui M. DNA-based analysis of planktonic methanotrophs in a stratified lake. Freshwater Biology, 2009, 54(7): 1501-1509. DOI:10.1111/j.1365-2427.2009.02199.x |
| [86] |
Oswald K, Graf JS, Littmann S et al. Crenothrix are major methane consumers in stratified lakes. ISME Journal, 2017, 11(9): 2124-2140. DOI:10.1038/ismej.2017.77 |
| [87] |
Zigah PK, Oswald K, Brand A et al. Methane oxidation pathways and associated methanotrophic communities in the water column of a tropical lake. Limnology and Oceanography, 2015, 60(2): 553-572. DOI:10.1002/lno.10035 |
| [88] |
Valentine DL, Reeburgh WS. New perspectives on anaerobic methane oxidation. Environmental Microbiology, 2000, 2(5): 477-484. DOI:10.1046/j.1462-2920.2000.00135.x |
| [89] |
Battin TJ, Luyssaert S, Kaplan LA et al. The boundless carbon cycle. Nature Geoscience, 2009, 2(9): 598-600. DOI:10.1038/ngeo618 |
| [90] |
Shelley F, Ings N, Hildrew AG et al. Bringing methanotrophy in rivers out of the shadows. Limnology and Oceanography, 2017, 62(6): 2345-2359. DOI:10.1002/lno.10569 |
| [91] |
Matoušů A, Rulík M, Tušer M et al. Methane dynamics in a large river: a case study of the Elbe River. Aquatic Sciences, 2018, 81(1). DOI:10.1007/s00027-018-0609-9 |
| [92] |
Bednařík A, Blaser M, Matoušů A et al. Sediment methane dynamics along the Elbe River. Limnologica, 2019, 79. DOI:10.1016/j.limno.2019.125716 |
| [93] |
Musenze RS, Fan L, Grinham A et al. Methane dynamics in subtropical freshwater reservoirs and the mediating microbial communities. Biogeochemistry, 2016, 128(1/2): 233-255. DOI:10.1007/s10533-016-0206-8 |
| [94] |
Lopes F, Viollier E, Thiam A et al. Biogeochemical modelling of anaerobic vs. aerobic methane oxidation in a meromictic crater lake (Lake Pavin, France). Applied Geochemistry, 2011, 26(12): 1919-1932. DOI:10.1016/j.apgeochem.2011.06.021 |
| [95] |
Lofton DD, Whalen SC, Hershey AE. Effect of temperature on methane dynamics and evaluation of methane oxidation kinetics in shallow Arctic Alaskan lakes. Hydrobiologia, 2013, 721(1): 209-222. DOI:10.1007/s10750-013-1663-x |
| [96] |
Hofmann H. Spatiotemporal distribution patterns of dissolved methane in lakes: How accurate are the current estimations of the diffusive flux path?. Geophysical Research Letters, 2013, 40(11): 2779-2784. DOI:10.1002/grl.50453 |
| [97] |
Houser JN. Water color affects the stratification, surface temperature, heat content, and mean epilimnetic irradiance of small lakes. Canadian Journal of Fisheries and Aquatic Sciences, 2006, 63(11): 2447-2455. DOI:10.1139/F06-131 |
| [98] |
Saengkerdsub S, Ricke SC. Ecology and characteristics of methanogenic archaea in animals and humans. Critical Reviews in Microbiology, 2014, 40(2): 97-116. DOI:10.3109/1040841X.2013.763220 |
| [99] |
Saunois M, Bousquet P, Poulter B et al. The global methane budget 2000-2012. Earth System Science Data, 2016, 8(2): 697-751. |
| [100] |
Mcdonald IR, Hall GH, Pickuy RW. Methane oxidation potential and preliminary analysis of methanotrophs in blanket bog peat using molecular ecology techniques. FEMS Microbiology Ecology, 1996, 21: 197-211. DOI:10.1016/S0168-6496(96)00056-6 |
| [101] |
Mcdonald IR, Murrell JC. The particulate methane monooxygenase gene pmoA and its use as a functional gene probe for methanotrophs. FEMS Microbiology Letters, 1997, 156(2): 205-210. DOI:10.1111/j.1574-6968.1997.tb12728.x |
| [102] |
Chen Y, Dumont MG, Neufeld JD et al. Revealing the uncultivated majority: Combining DNA stable-isotope probing, multiple displacement amplification and metagenomic analyses of uncultivated Methylocystis in acidic peatlands. Environmental Microbiology, 2008, 10(10): 2609-2622. DOI:10.1111/j.1462-2920.2008.01683.x |
| [103] |
Chen Y, Dumont MG, Mcnamara NP et al. Diversity of the active methanotrophic community in acidic peatlands assessed by mRNA and SIP-PLFA analyses. Environmental Microbiology, 2008, 10(2): 446-459. DOI:10.1111/j.1462-2920.2007.01466.x |
| [104] |
Kip N, Ouyang WJ, Van Winden J et al. Detection, isolation, and characterization of acidophilic methanotrophs from sphagnum mosses. Applied and Environmental Microbiology, 2011, 77(16): 5643-5654. DOI:10.1128/AEM.05017-11 |
| [105] |
Yun JL, Zhuang GQ, Ma AZ et al. Community structure, abundance, and activity of methanotrophs in the Zoige Wetland of the Tibetan Plateau. Microbial Ecology, 2011, 63(4): 835-843. DOI:10.1007/s00248-011-9981-x |
| [106] |
Holgerson MA. Drivers of carbon dioxide and methane supersaturation in small, temporary ponds. Biogeochemistry, 2015, 124(1/2/3): 305-318. DOI:10.1007/s10533-015-0099-y |
| [107] |
Natchimuthu S, Selvam BP, Bastviken D. Influence of weather variables on methane and carbon dioxide flux from a shallow pond. Biogeochemistry, 2014, 119(1-3): 403-413. DOI:10.1007/s10533-014-9976-z |
| [108] |
Chen Y, Dong SL, Wang F et al. Carbon dioxide and methane fluxes from feeding and no-feeding mariculture ponds. Environmental Pollution, 2016, 212: 489-497. DOI:10.1016/j.envpol.2016.02.039 |
| [109] |
Yang P, Zhang YF, Yang H et al. Ebullition was a major pathway of methane emissions from the aquaculture ponds in southeast China. Water Research, 2020, 184: 116-176. DOI:10.1016/j.watres.2020.116176 |
| [110] |
Bastviken D, Cole J, Pace M et al. Methane emissions from lakes: Dependence of lake characteristics, two regional assessments, and a global estimate. Global Biogeochemical Cycles, 2004, 18(4). DOI:10.1029/2004GB002238 |
| [111] |
Deemer BR, Harrison JA, Li SY et al. Greenhouse gas emissions from reservoir water surfaces: A new global synthesis. Bioscience, 2016, 66(11): 949-964. DOI:10.1093/biosci/biw117 |
| [112] |
Zhu YZ, Purdy KJ, Eyice O et al. Disproportionate increase in freshwater methane emissions induced by experimental warming. Nature Climate Change, 2020, 10(7). DOI:10.1038/s41558-020-0824-y |
| [113] |
Oh Y, Zhuang QL, Liu LC et al. Reduced net methane emissions due to microbial methane oxidation in a warmer Arctic. Nature Climate Change, 2020, 10(4). DOI:10.1038/s41558-020-0734-z |
| [114] |
Morana C, Borges AV, Roland FAE et al. Methanotrophy within the water column of a large meromictic tropical lake (Lake Kivu, East Africa). Biogeosciences, 2015, 12(7): 2077-2088. DOI:10.5194/bg-12-2077-2015 |
| [115] |
Oswald K, Milucka J, Brand A et al. Aerobic gammaproteobacterial methanotrophs mitigate methane emissions from oxic and anoxic lake waters. Limnology and Oceanography, 2016, 61(S1). DOI:10.1002/lno.10312 |
| [116] |
Sawakuchi HO, Bastviken D, Sawakuchi AO et al. Oxidative mitigation of aquatic methane emissions in large Amazonian rivers. Global Change Biology, 2016, 22(3): 1075-1085. DOI:10.1111/gcb.13169 |
| [117] |
Bastviken D, Ejlertsson J, Sundh I et al. Methane as a source of carbon and energy for lake pelagic food webs. Ecology, 2003, 84(4): 969-981. DOI:10.1890/0012-9658(2003)084[0969:MAASOC]2.0.CO;2 |
| [118] |
Brankovits D, Pohlman JW, Niemann H et al. Methane- and dissolved organic carbon-fueled microbial loop supports a tropical subterranean estuary ecosystem. Nature Communications, 2017, 8: 1835. DOI:10.1038/s41467-017-01776-x |
| [119] |
Schilder J, Van Hardenbroek M, Bodelier P et al. Trophic state changes can affect the importance of methane-derived carbon in aquatic food web. Proceedings of the Royal Society B-Biological Sciences, 2017, 284(1857). DOI:10.1098/rspb.2017.0278 |
| [120] |
Sanseverino AM, Bastviken D, Sundh I et al. Methane carbon supports aquatic food webs to the fish level. PLoS One, 2012, 7(8). DOI:10.1371/journal.pone.0042723 |
 2021, Vol. 33
2021, Vol. 33 


