(2: 中国科学院大学, 北京 100049)
(3: 中国长江三峡集团有限公司, 北京 100038)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(3: China Three Gorges Corporation, Beijing 100038, P. R. China)
淡水水体富营养化最典型的表征之一是蓝藻水华的形成. 近年来,蓝藻水华分布扩张范围大,直接或间接地影响到区域人类健康,是湖泊、河流和一些河口生态系统最明显的威胁之一[1]. 十多年来,国内外已有大量关于蓝藻水华的研究报道. 探讨淡水蓝藻水华暴发及其优势维持机制是十多年来学术界的热点. 通常认为,蓝藻在长期的进化过程中发展了一套独特的形态和生理生化特征,由此产生的高效适应性策略为其在种群竞争中提供了非同寻常的优势,是形成水华的前提[2]. 值得关注的是,发生蓝藻水华的典型藻种(如微囊藻(Microcystis)、鱼腥藻(Anabaena)、束丝藻(Aphanizomenon)等)在野外自然条件下主要以群体/聚集体(colony/aggregation)形式出现,而在长期实验室内培养过程中却常常以单细胞(unicellular)或单链(filament)的形态存在[3],即使在室内通过控制条件使其达到高生物量,也难以观察到藻类细胞形成野外常见的群体/聚集体进而形成水华的现象. 尽管普遍观点认为,蓝藻的形态可塑性(morphological plasticity)是帮助其在各种不同生境包括极端恶劣的环境中繁衍的重要策略[4],但目前有关蓝藻形态的研究主要集中在蓝藻群体/聚集体形成的内在机制以及外在影响因子等问题[5],而对蓝藻形态可塑性的关键,即包裹于蓝藻细胞外的功能性结构层——胶被,其如何支撑蓝藻适应变化环境,仍有待深入探索.
近些年,随着技术进步和成果的积累,研究者加深了胶被在蓝藻形态响应、聚集和水华形成中作用的了解[6]. 但大量的研究仅仅是将胶被视为一种细胞分泌的胞外聚合物(extracellular polymeric substance,EPS),在物质层面上对其进行表观分析[7],并没有意识到蓝藻胶被的自然生理功能. 尽管近些年已经有多篇关于蓝藻EPS的综述论文[8-9],但是直到目前还没有蓝藻胶被生物学功能及相关的分子调控机制研究的总结报道. 本文尝试以淡水蓝藻胶被为对象,首先分析文献来源及回顾已有研究成果,进而介绍胶被的特点、产生机理,并着力于阐述胶被生物学功能及其分子调控机制的研究进展,最后评述该研究领域未来的发展趋势,期待本文为更深入开展淡水蓝藻水华暴发和优势维持机理研究提供参考.
1 文献来源及分析方法本综述检索的英文论文来源于Web of Science TM核心合集Science Citation Index Expand (SCI-Expand),主题检索式"TS=('cyanobacteria') AND ('EPS' OR 'extracellular polymeric substances' OR 'exopolysaccharides' OR 'surface coat' OR 'gelatinous' OR 'mucilaginous' OR 'mucilage' OR 'sheath' OR 'capsule' OR 'slime')",检索年份为所有年份(1900-2020年);检索中文论文来源于中国学术期刊网络数据总库(中国知网,CNKI),主题检索式为"SU ='蓝藻'+ SU =('胶被'+'胞外聚合物'+'胞外多糖'+'鞘'+'荚膜'+'粘液'),检索范围限制为核心期刊. 根据上述检索方法共检索到英文论文1041篇和中文论文41篇,其中英文论文包含69篇综述(review)和964篇研究型文章(article). 对检索到的中文论文继续添加'功能'或'合成'作为主题关键词,分别仅搜索到1篇及3篇论文,故本文对中文文献不再进行详细分析,仅作为补充参考.
对检索到的英文论文关键词信息进行分析,除了"EPS"、"cyanobacteria"、"microalgae"、"biofilm"等基本关键词,出现频次较多的关键词为"Microcystis aeruginosa"、"Synechocystis"、"Nostoc"、"growth"、"photosynthesis"、"nitrogen-fixation"、"diversity"、"biosynthesis"和"scytonemin",说明主要受到关注的蓝藻为铜绿微囊藻、集胞藻和念珠藻;主要的研究方向包括胶被对蓝藻生长、固氮和光合作用的影响以及胶被的生物合成和种类等. 进一步通过引用关系网络分析,发现本领域内最关键的两篇论文为De Philippis和Vincenzini[10],以及Pereira等[8]分别于1998年和2009年发表的综述,论文初步归纳出胶被的主要生理功能包括抗逆性(干旱、辐射、氧化、生物矿化、捕食等)及参与蓝藻滑动. 继续添加"function"作为关键词并排除"'terrestrial' OR 'soil' OR 'desert' OR 'marine'"等主题检索词后,检索到英文论文55篇,包含3篇综述和51篇研究型文章,分析关键词发现胶被功能的研究还涉及到生物吸附、生物修复及群体形成.
另一方面,在原检索式中添加"biosynthesis"作为关键词并排除"'terrestrial' OR 'soil' OR 'desert' OR 'marine'"等主题检索词后,共检索到英文论文47篇,包含5篇综述及42篇研究型文章. 引用关系网络分析显示关键文章为Pereira团队分别于2009[8]、2013[11]及2015年[12]发表的3篇论文,论文中引用了细菌EPS的合成途径包括Wzy途径、ABC转运蛋白途径以及合成酶途径,提出蓝藻胶被合成可能含有类似的通路. 进一步添加"'molecular regulation' OR 'molecular mechanism'"作为关键词后,检索到英文论文13篇,包含3篇综述及10篇研究型文章. 对胶被合成及调控相关论文的分析发现,蓝藻胶被合成还未有确定通路,且对于其调控的研究多集中于胶被EPS产量变化,微观分子的调控机制还有待探索.
综上,对筛选出的淡水蓝藻胶被各项功能及合成途径关键词分别进行了梳理,论文汇总情况见图 1,结果显示对蓝藻胶被的研究多集中于胶被对外界环境因子(如pH、温度和金属离子等)的响应,且部分关于某些环境胁迫的论文仅有实验观察到促进或抑制胶被分泌,而对于胶被的具体功能未有详细阐释. 另外,关于蓝藻胶被的合成通路及分子调控机制的论文寥寥可数,仍需进一步探索. 据此,本综述以当前淡水蓝藻胶被一般性认识为切入点逐层次展开.
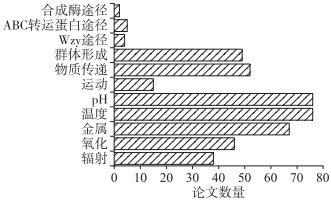
|
图 1 关于淡水蓝藻胶被生物学功能及合成途径的SCI论文数量 Fig.1 Number of articles about the biological functions and biosynthetic of surface coats of cyanobacteria in freshwaters published in SCI journals |
胶被是一种广泛存在于微生物以及一些植物和动物细胞周围的功能性结构. 蓝藻的胶被包裹于细胞或藻丝或群体外,并伴随着蓝藻细胞的生长繁殖不断形成、分泌或部分释放于周围水体中. 其主要来源于细胞质内的致密颗粒逐渐分泌到细胞外,均匀分布于整个细胞表面,或从细胞的某一端点挤出以进行定向运动[13].
目前普遍认为,蓝藻胶被根据形态可分为鞘(sheath)、荚膜(capsule)以及粘液(slime)[10],淡水水体中常见具有胶被的蓝藻及其胶被类型归纳见表 1. 鞘层薄而均匀,在光学显微镜下直接观察可见;荚膜通常是一层厚而粘稠的结构,与细胞表面紧密相连,轮廓清晰,结构上下连贯,不含颗粒,用印度墨水染色后光学显微镜下观察可见;粘液是最外一层,分散在细胞周围,不能反映细胞的形状(图 2). 亦有学者根据蓝藻EPS与细胞结合的紧密程度,将其分为紧密结合型(tightly bound extracellular polymers,TB-EPS)、松散结合型(loosely bound extracellular polymers,LB-EPS)和溶解型(soluble extracellular polymers,S-EPS)[14].
| 表 1 淡水水体中部分常见具有胶被的蓝藻及其胶被类型 Tab. 1 Some common cyanobacteria embedded in different types of surface coats in freshwaters |
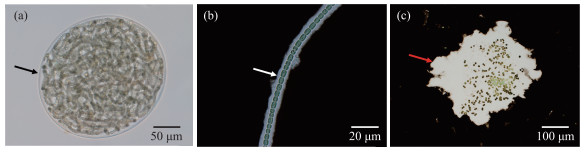
|
图 2 蓝藻的不同胶被形态:(a)FACHB-599念珠藻;(b)FACHB-82鱼腥藻;(c)FACHB-2427微囊藻(a:未染色,鞘:黑箭头;b,c:印度墨水染色,荚膜:白箭头,粘液:红箭头) Fig.2 Cyanobacteria embedded in different types of surface coats: (a) Nostoc sp. FACHB-599; (b) Anabaena sp. FACHB-82; (c) Microcystis sp. FACHB-2427 (a: unstained, sheath: black arrow; b, c: stained with India ink, capsule: white arrow, slime: red arrow) |
蓝藻胶被的主要成分为多糖和蛋白质,及少量核酸、脂类、腐殖酸等,并富含羧基、氨基、脂基等有机官能团[27]. 各组分具有不同的空间分布特征,如紧密结合型胶被中多糖含量较高,松散结合型则蛋白质和腐殖酸含量较高,溶解型主要是亲水性有机物,含有大量的羧基、羟基、氨基等官能团[28]. 胶被的组分对其物化特性也有一定的影响. 如野外自然环境和室内培养的微囊藻其表面电荷均带负电,这是由于官能团(如羧基)的解离,使胶被在接近中性pH时带负电[29]. 而胶被中存在的乙酰基、肽基和去氧基糖(例如海藻糖和鼠李糖),使得胶被具有疏水性[30]. 此外,大量酸性多糖使得胶被具有很强的粘附性,促进藻细胞的聚集和群体形成[31].
3 淡水蓝藻胶被的生物学功能胶被的形成和保留毫无疑问可为生物体带来一定的益处,这也在文献中得到证实[32]. 目前,对淡水蓝藻胶被生物学功能的认识主要包括以下4个方面:(1)胶被作为保护屏障抵御外界胁迫;(2)胶被参与蓝藻营养物质的传递、吸收和储存;(3)胶被参与蓝藻运动迁移过程;(4)胶被对蓝藻聚集和水华形成起到一定作用. 现分别归纳分析如下:
3.1 胶被作为保护屏障抵御外界胁迫已有的研究表明,胶被对紫外线辐射、氧化、有毒化合物和原生动物的捕食等不利环境因素具有防御作用[8]. 许多生活在高太阳辐射环境中的蓝藻已被证实其鞘中含有伪枝藻素(scytonemin)、霉菌素样氨基酸(mycosporine-like amino acids,MAAs)等吸收紫外线的色素[33];近年对于淡水中极端嗜热蓝藻的研究还发现其胞外胶被中存在另一种屏蔽紫外线的色素——胶球藻素(gloeocapsin)[34];Ehling-Schulz等[35]的实验结果表明,紫外线可诱导念珠藻胶被多糖的分泌增加,以及这些色素在胶被中的累积,使得胶被成为阻止有害紫外线辐射穿透的屏障. 早期的研究发现,胶被为蓝藻细胞提供了低氧化还原的微环境,这种微环境可以使蓝藻避免环境中氧气的危害[10],后有实验证明缺乏胶被的集胞藻对氧化应激高度敏感,推测胶被可通过吸收或散射太阳辐射、清除周围环境中的活性氧以及改变微生物群落结构的完整性或表面电荷来减少氧化应激[36]. 由于胶被中含有多种带负电荷的官能团,其对环境中的金属阳离子被证实存在两方面的作用:一是可螯合富集在环境中浓度较低但对蓝藻生长有重要作用的金属离子[37],例如铜绿微囊藻胶被表面更多的负电荷增加了其在诸如铁离子等微量元素富集中的竞争力,能一定程度上解释它能长时间、大规模在湖泊水体中占据优势的原因[6];二是胶被作为一种保护结构防止细胞直接与环境中的有毒重金属接触[38],重金属纳米颗粒会诱导胶被分泌增加用于保护细胞维持完整结构[39]. 而当蓝藻处于浮游动物的摄食压力下时,一方面形成大的群体细胞可抵御捕食者,减少死亡率;另一方面蓝藻群体凝胶状粘液胶被的存在,可机械地干扰浮游动物的摄食作用,这种黏稠的多糖影响了浮游动物摄食和消化蓝藻的能力,在胶被的保护下藻类在通过浮游动物的肠道后仍能保持完整的细胞结构,导致浮游动物对其同化效率很低[40]. 此外,对极端野外环境(如极地冰川、酸性河流等)的样品调查发现,环境条件强烈影响藻类胶被的组成,例如胶被中半乳糖的含量与温度呈现明显负相关关系,而极酸性条件会使得胶被分泌增多且其中甲基葡萄糖占比升高,证明藻类会通过调节胶被特性来适应不同的环境压力[41]. 因此,胶被作为蓝藻细胞感应外界环境的最外层,是对外界环境响应、调节自身生存策略的主要结果体现.
3.2 胶被参与蓝藻营养物质的传递、吸收和储存早期的学者发现,在相同的无机养分浓度下,蓝藻在天然水体中的生长比在实验室中培养生长的好;添加微量的无机营养盐可能会对天然水体中的蓝藻生长产生显著影响,而对在实验室培养中的蓝藻则没有影响[42]. 基于此,实验室培养的蓝藻由于形态上的变化(如从群体变为单细胞、从聚集体变为单链)而被视为衰弱和半生病的细胞. 因此,Lange[43]提出胶被除了在藻细胞与周围外界环境之间提供物理屏障外,同时也为细胞提供了必要营养元素和微量元素的微环境. Fang等[44]对太湖蓝藻的研究也发现群体和分散的单细胞之间的生理微环境有很大差异,解释了富含胶被的蓝藻在营养盐吸收和储存能力上的优势. 有学者认为,由于胶被中保留了部分胞外酶,因此形成了一种外部消化系统,可将水体中溶解的或颗粒状的营养物质分离富集出来作为营养源和能源[45]. Zhou等[46]在对集胞藻生长过程中磷的分布及转化的研究中发现,胶被是无机磷的重要储存库,且当外界无机磷耗尽时,胶被中无机磷的解吸成为胞内磷的主要来源. 在C/N营养不平衡时,念珠藻的胶被会充当固定的过量碳的汇[47],且同位素示踪实验亦表明蓝藻会重新利用其储存在胶被中的有机碳[48].
研究还发现,氮或磷营养元素饥饿的条件,反而促进了藻类胶被的合成[49-50],也可从侧面反映了在缺乏营养的条件下胶被对保证藻类生存起到一定作用. Yao等[51]提出在藻类吸附无机磷的过程中,胶被对磷的吸收是一个独立于胞内吸附的不同过程. 在不同藻类中,胶被对磷的吸收可占总细胞的60 % ~90 % [52]. 而蓝藻细胞的磷库和营养储藏转化-奢侈消费机制,使其对较低浓度的磷亲和力更高,原因可能是因为胶被粘液的特殊功能,在其营养的吸收和利用方面起重要作用[53-54].
除了对营养物质进行富集吸收,胶被还会影响其扩散传递速率. 有研究表明胶被EPS能改变物质的扩散系数使其低于水中的扩散系数[55],从而影响营养物质的传入以及细胞代谢产物的输出[56]. 近期,我们进一步采用非损伤微测技术(noninvasive microtest technology,NMT)研究了胶被在蓝藻NH4+和O2吸收及传输中的作用. 初步的研究工作发现,胶被可能是驱动蓝藻物质传输的重要特征结构,可促进其吸收与细胞相邻10 μm边界范围的必需营养素,但其作用效果和胶被类型有密切关系[57]. 这些结果均表明胶被的存在可有助于蓝藻调节物质的摄取和释放,在营养物质的传递、吸收和储存上具有重要的生物学功能.
3.3 胶被参与蓝藻运动迁移过程运动性是蓝藻在自然水体中存活的一项重要能力. 对于无鞭毛的丝状蓝藻来说,有科学家猜测粘液物质有可能在其运动上具有一定的功能. 直到1995年,Hoiczyk研究小组基于对巨颤藻(Oscillatoria princeps)、钩状席藻(Phormidium uncinatum)和铜绿鞘丝藻(Lyngbya aeruginosa)包膜的观察,最早提出了蓝藻滑动所需的动力由包膜上特殊排列的原纤维间的剪切力以及分泌到胞外的粘液的持续流动提供[22]. 进一步对丝状蓝藻的滑动模式进行更具体的表征时,发现了分泌粘液的原核"细胞器"孔结构,细胞通过"连接孔"分泌粘液推动细胞运动[58]. 该研究直接证明了蓝藻细胞分泌粘液的生物学功能. Dhahri等[59]对念珠藻活细胞滑动进行原子力显微成像(atomic force microscopy,AFM),研究了胶被粘液流变特性对细胞运动的影响,发现胶被粘液厚度随运动速度的增加而增加.
除了参与蓝藻细胞的滑行运动,胶被的存在还会影响蓝藻在水体中的迁移. Brookes和Ganf[60]研究发现,蓝藻群体的胶被可在细胞间形成空隙,与伪空泡共同提供浮力,利于蓝藻群体的垂直迁移. 同时,Reynolds[32]认为,在含有相同细胞数的蓝藻群体之间,有胶被的群体密度比无胶被的群体密度更低,更有利于群体的上浮. 而Dervaux等[61]提出了一种与细胞内伪空胞无关的蓝藻上浮机制——适当的营养和光照带来的高光合作用导致溶解氧过饱和并成为核气泡,这些气泡困在胶被中直至其浮力足以拉动群体上浮至水体表层,这种说法有待进一步研究.
3.4 胶被对蓝藻聚集和水华形成起到一定作用在前文中已提到,形态可塑性是蓝藻形成水华的一个重要策略. 而胶被对于蓝藻维持其群体形态至关重要,并参与细胞间相互作用、粘附和聚集等一系列过程,从而进一步影响水华的形成[6]. 蓝藻群体或聚集体的形成受表面性质的高度影响,包括zeta电位、亲水性/疏水性等,而胶被分子量大、官能团多,可通过静电结合、聚合物侨联等方式影响细胞表面性质. Yang等[62]提出群体比单细胞具有更强的疏水性,且胶被EPS可促进细胞之间的粘附进而形成大群体. Xu等[14]运用扩展的DLVO理论计算得出胶被对微囊藻细胞间吸引力的贡献排序为:成熟期微囊藻水华>早期微囊藻水华>微囊藻聚集体>实验室培养微囊藻悬浮液,认为TB-EPS在致密微囊藻聚集体的形成中起重要作用,而LB-EPS促进了后续向粘液性水华的发展;而进一步的研究表明,Ca2+和Mg2+与—OH、C=C和C—O基团形成的强复合物可以将每个单独的生物分子桥接在一起,解释了微囊藻胶群体的形成机制[63]. 与此同时,秦伯强等[64]在野外水体中的研究发现,适度的风浪扰动促使蓝藻细胞团碰撞而形成更大的聚集体,并强调了胶被在水华形成第一阶段中的重要性,即因环境胁迫分泌的胶被EPS在其中起到了粘合的作用. 另有学者认为,尽管胶被粘液是微囊藻群体形成的重要因素,但生长速率是蓝藻群体形成的主要驱动因素,通过单细胞分裂增殖产生的子细胞有效聚集形成群体,如较高的温度和磷的富集可提高微囊藻生长速率使其群体变大而增强水体表面微囊藻的漂浮聚集[65]. 在野外复杂水环境中,这两种聚集方式并存[66],而胶被可能更多地参与蓝藻群体的维持,以及藻细胞相互识别粘合的过程,从而保持其在水华期间的竞争优势.
4 胶被合成的分子机制的研究现状 4.1 胶被生物合成通路目前关于蓝藻胶被多糖合成的分子机制主要是基于细菌EPS合成通路——Wzy途径、ABC转运蛋白途径、合成酶途径(图 3~5)进行的研究,每种途径中的关键蛋白及其功能见表 2.
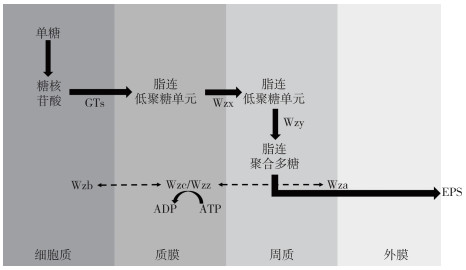
|
图 3 Wzy依赖途径[8]:以在细胞质和质膜的界面处寡糖脂质连接的重复单元的组装开始,随后重复单元被整合蛋白Wzx转移到质膜的周质侧,并被Wzy聚合,聚合反应受多糖共聚酶蛋白Wzc的活性影响,而其活性受磷酸酶Wzb控制,且行使功能时消耗ATP,该蛋白与多糖输出蛋白Wza形成复合物,从而允许聚合物的输出(实线表示直接转化过程,虚线表示间接参与过程) Fig.3 Wzy-dependent pathway[8]: begins with the assembly of oligosaccharide lipid-linked repeating units at the interface of the cytoplasm and the plasma membrane. Subsequently, the repeating units are translocated to the periplasmatic side of the plasma membrane by the integral protein Wzx, and polymerized by Wzy. The polymerization reaction is influenced by the activity of the polysaccharide copolymerase protein Wzc, which is controlled by Wzb and the process consumes ATP. Wzc forms a complex with the polysaccharide export protein Wza that allows the export of the polymer (The solid lines represent the direct transformation process, and the dotted lines represent the indirect process) |

|
图 4 ABC转运蛋白依赖途径[67]:在由包含2个跨膜结构域(KpsM)和两个核苷酸结合结构域(KpsT)的ABC转运蛋白转运通过质膜之前,多糖在质膜表面完全聚合,聚合物通过周质和外膜的输出是由多糖共聚酶蛋白KpsE和多糖输出蛋白KpsD进行(实线表示直接转化过程,虚线表示该蛋白具体参与形式未知) Fig.4 ABC transporter-dependent pathway[67]: the polysaccharide is fully polymerized in the surface of the plasma membrane before being translocated through the plasma membrane by an ABC transporter, which is comprised of two transmembrane domains (KpsM) and two nucleotide-binding domains (KpsT). The export of the polymer through the periplasm and outer membrane is performed by the polysaccharide copolymerase protein KpsE and the polysaccharide export protein KpsD (The solid lines represent the direct transformation process, and the dotted lines represent the unknown participation process of the protein) |
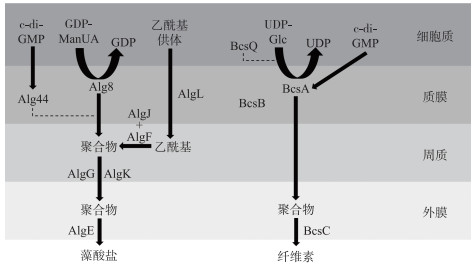
|
图 5 合成酶依赖途径[68]:多糖被内膜合成酶蛋白聚合并通过内膜输出,在一些情况下,多糖合成酶的活性由内膜c-di-GMP受体翻译后调节,然后多糖通过含TPR的周质蛋白和完整的外膜β桶状蛋白穿过外膜输出(缩写释义:c-di-GMP,双(3′-5′)-环二聚鸟苷单磷酸;GDP-ManUA,鸟苷二磷酸- 甘露糖醛酸;UDP-Glc,尿苷二磷酸葡萄糖.实线表示直接转化过程,虚线表示该蛋白具体参与形式未知) Fig.5 Synthase-dependent pathway: the polysaccharide is polymerized and exported across the inner membrane by an inner-membrane synthase protein. In some instances, the activity of the polysaccharide synthase is post-translationally regulated by an inner-membrane c-di-GMP receptor. The polysaccharide is then exported across the outer membrane by a periplasmic TPR-containing protein and an integral outer-membrane β-barrel (Abbreviations: c-di-GMP, bis-(3′-5′)-cyclic dimeric guanosine monophosphate; GDP-ManUA, GDP mannuronic acid; UDP-Glc, UDP glucose. The solid lines represent the direct transformation process, and the dotted lines represent the unknown participation process of the protein) |
| 表 2 胶被多糖合成3种途径中的关键蛋白及其作用[8, 67-68] Tab. 2 Key proteins and their functions in the three EPS synthetic pathways[8, 67-68] |
2009年,Pereira等研究小组提出了基于细菌Wzy途径的蓝藻胶被多糖合成模型,细胞质内单糖在糖活化和修饰酶的作用下形成糖核苷酸;在质膜上,通过糖基转移酶(glycosyltransferases,GTs)将糖核苷酸依次添加到脂质载体上来组装重复单元;寡糖脂连重复单元经Wzx蛋白转运至质膜的周质侧,并经Wzy蛋白聚合. 随后,聚合物分别由多糖共聚酶和外膜多糖输出蛋白家族成员Wzc和Wza形成的复合物通过外膜输出,其中Wzc磷酸化状态由磷酸酶Wzb控制,可通过其状态控制聚合物链长,并且与Wza相互作用潜在地调节复合物构象以打开或关闭通道[8].
在ABC转运蛋白途径中,多糖在质膜内小叶处完全聚合,后经ABC转运蛋白(KpsM和KpsT)转运,在还原末端通过聚-2-酮-3-脱氧辛二酸(Kdo)连接到终端脂质,其中KpsC、KpsS、KpsF和KpsU蛋白被认为参与了Kdo连接剂或其活性供体的合成,这是与Wzy途径的主要区别,最后在多糖共聚酶蛋白以及多糖输出蛋白的作用下输出胞外[67].
合成酶途径一般来说可分为2种,一种是合成藻酸盐,一种是合成纤维素. 首先通过合成酶Alg8或BcsA(分别存在于藻酸盐或纤维素产生中),多糖同时聚合和输出到质膜上,AlgI、AlgF、AlgG在质内参与聚合物修饰,AlgL降解积累的褐藻酸盐,BcsZ可能具有类似水解作用,BcsQ为极性定位提供条件. 含有四肽重复(tetratricopeptide repeat,TPR)的外膜脂蛋白AlgK可以将成熟聚合物导向完整的外膜蛋白AlgE,从而促进藻酸盐跨外膜的转运,对于纤维素其输出则是由BcsC蛋白完成[68].
基于以上在细菌中确立的胞外多糖合成通路,研究者在蓝藻中进行了探索. Pereira等[11]对已经完成测序的24种属于不同亚科、具有不同形态和生态位的蓝藻进行了分析,检测其是否具有Wzy及ABC转运蛋白途径所需蛋白的保守结构域Wz-或Kps-同源序列,结果显示蓝藻中Wz-同源序列丰度较高,表明其胶被合成可能主要依赖Wzy途径,但同时部分藻株中未发现Wzx同源序列,推测蓝藻胶被合成可能不完全符合现有模型. Chrismas等[69]对北极蓝藻Phormidesmis priestleyi基因组研究发现,有2个基因簇包含Wzy途径中wza、wzc、wzx和wzy保守序列,且含有生物合成(WcaA结构域)和组装(糖基转移酶,RfaB结构域)的结构域的基因;同时,另在2个基因簇发现有基因含有ABC途径中KpsD、KpsE、KpsM、KpsT的结构域. 该研究直接证明了蓝藻胶被胞外多糖的合成存在有多种途径共存的情况. 然而,在蓝藻基因组中暂未发现有完整的合成酶通路(合成藻酸盐或合成纤维素),但有研究表明在褐藻的胞外基质中存在藻酸盐成分,且部分合成步骤中的蛋白都可找到同源序列[70]. Pereira等[12]对124株蓝藻进行了全基因组分析,结果表明大多数藻株携带的基因编码的蛋白质与上述3种主要途径相关,但通常不是定义一条途径的完整序列,进一步说明了蓝藻胶被多糖的合成可能不严格遵循先前表征的途径之一.
除多糖外,胶被中的另一重要成分蛋白质,按照其结构功能可分为结构性蛋白和非结构性蛋白. 结构蛋白在蓝藻聚集体形成和结构稳定中起到重要作用. 已有研究发现,铜绿微囊藻胞外蛋白凝集素(microvirin,MVN)能与脂多糖结合并参与群体的形成中[71];胞外糖蛋白MrpC参与了微囊藻细胞间的相互作用[72]. 而非结构蛋白胞外酶等,在降解聚合物为蓝藻提供可利用的小分子物质方面发挥重要作用[45]. 关于胞外蛋白合成通路,在革兰氏阴性菌中已发, 6种途径,其中最简单的为Ⅰ型途径(T1SS),在此途径中外膜蛋白TolC与跨质膜的α螺旋桶蛋白以及被膜包裹的β桶蛋白形成通道,而TolC蛋白能与不同的内膜ABC转运蛋白相互作用从而分泌特异性蛋白[73]. 然而,目前关于蓝藻胞外蛋白合成通路研究较少. 有研究在部分蓝藻中鉴定出了Ⅰ型分泌途径的底物[74];Moslavac等[75]发现鱼腥藻具有TolC蛋白的同系物HgdD,且后续研究证明此同系物直接参与了胞外蛋白分泌,并对部分蛋白存在质量控制机制[76];另有研究发现集胞藻体内的另一同系物Slr1270也具有相似功能[77]. 因此,蓝藻胶被蛋白的合成机制仍需进一步探索研究.
4.2 胶被合成及其响应的分子调控机制许多研究表明, 蓝藻胶被的合成及其生物化学特性主要受盐度、pH、光照、温度和营养盐等环境因子的调节[8]. 目前关于蓝藻在变化环境下调控胶被的分子机制的研究并不多. Fisher等[78]发现可通过改变ABC转运蛋白和(或)糖基转移酶的不同组合来改变胶被EPS的组分,进而改变集胞藻的表面特性. 近期有研究发现,多糖共聚酶蛋白Wzc表现出自磷酸化活性,且可作为Wzb蛋白的底物受其去磷酸化作用,这一过程可调控胶被的合成[79]. 此外,在蓝藻胶被响应外界环境因子的分子调控方面,Chrismas等[69]从基因组层面发现北极蓝藻P. priestleyie中存在一条几乎完整的Wsp感应通路,通过调控胞内信使双(3′-5′)-环二聚鸟苷单磷酸(c-di-GMP)而参与调节胶被的生物合成,并证明了P. priestleyie主要通过利用糖类产生一种特殊的保护粘层使其细胞免受冻害,从而在北极的冬季环境中生存. Zhang等[80]对微重力条件下的集胞藻基因表达进行了研究,结果表明参与糖原降解的基因glgP在整个实验过程中其表达量都增加,为胶被多糖合成提供了前体物质,且在微重力不同阶段参与EPS合成(epsD)及输出(epsB)的基因的不同变化趋势,表明其增加的来源分别是胞外转运或是胶被的从头合成,一定程度解释了蓝藻在太空中的生存适应机制. Han等[81]研究了不同光照对胶被多糖的影响,提出光质量通过提高活性氧(ROS)水平以作为信号分子来刺激胶被多糖的合成;红光、蓝光以及混合光照首先改变碳的分配促进了胶被前体糖核苷酸的合成,其次GTs转录水平明显上调以促进寡糖重复单元的形成,以此增加了胶被多糖的积累. 此外,Gan等[82]发现,微囊藻毒素可通过激活产毒及非产毒微囊藻细胞中部分与胶被多糖合成相关基因(capD,csaB,tagH,epsL)的表达,诱导一系列胞外多糖产物的释放,进而促进微囊藻群体的聚集. 同时,有研究亦表明产毒铜绿微囊藻中微囊藻毒素会影响凝集素MVN的表达,在微囊藻毒素基因(mcyB或mcyH)缺失的菌株中MVN只能形成寡聚体而无法形成多聚体,从而影响微囊藻细胞间的相互作用[71].
胶被在蓝藻适应性策略中发挥了重要的生物学功能. 目前倾向于认为,胶被的产生起源于调节细胞中积累且不会释放到溶液中的光合产物[82],而藻细胞穿上这层"外衣"可通过减缓扩散使得不必要的代谢活动最小化,但目前已有研究仅揭示了环境压力会导致胶被分泌变化,胶被合成和降解通路的研究相对而言较为匮乏,其在变化环境下的分子调控机制仍还有待深入探讨.
5 研究展望在全球气候变化背景下,蓝藻将会在淡水水体生态系统中长期占据优势. 蓝藻如何优化胶被形成与功能以适应环境胁迫、如何调控相关基因和蛋白的表达,仍是未知问题. 在基础生物学研究中,针对蓝藻研究仍缺乏有效的遗传操纵系统,从而使得蓝藻胶被合成及其分子调控机制研究进展缓慢. 对于大多数蓝藻而言,可用的选择标记有限导致无法针对蓝藻细胞中的多个基因或途径进行全面的代谢调节;另外,常规的蓝藻基因删除方法可能导致致死表型,进而难以阐明特定的基因或代谢途径[83]. 因此,未来研究可着力开发新基因组编辑工具及mRNA增强子等适用于蓝藻的各类遗传工具,建立基因组尺度的建模分析系统,以促进蓝藻胶被生物合成分子机制等基础研究.
此外,在有限的资源条件下,蓝藻对胶被的高效"投资"策略很可能与其他生存策略的表达产生"代谢竞争",蓝藻如何权衡(trade-off)并选择最优策略,其科学的认识仍显不足,尚需深入探索. 未来,可考虑依靠基因组学与代谢组学方法,解析胶被对环境变化响应的机制,更全面的探究蓝藻胶被合成和分泌过程中具体的响应信号体系,解析不同类型蛋白在胶被生成和降解、碳循环和能量通量中的定量贡献. 碳源作为合成胶被的物质基础,在环境变化时,如何在各大生理过程之间周转以供应需求,也是未来值得关注的问题.
| [1] |
Huisman J, Codd GA, Paerl HW et al. Cyanobacterial blooms. Nature Reviews Microbiology, 2018, 16(8): 471-483. DOI:10.1038/s41579-018-0040-1 |
| [2] |
Litchman E, Pinto PDT, Klausmeier CA et al. Linking traits to species diversity and community structure in phytoplankton. Hydrobiologia, 2010, 653(1): 15-28. DOI:10.1007/s10750-010-0341-5 |
| [3] |
Otsuka S, Suda S, Li RH et al. Morphological variability of colonies of Microcystis morphospecies in culture. Journal of General and Applied Microbiology, 2000, 46(1): 39-50. DOI:10.2323/jgam.46.39 |
| [4] |
Pancic M, Kiorboe T. Phytoplankton defence mechanisms: traits and trade-offs. Biological Reviews, 2018, 93(2): 1269-1303. DOI:10.1111/brv.12395 |
| [5] |
Xiao M, Willis A, Burford MA et al. Review: a meta-analysis comparing cell-division and cell-adhesion in Microcystis colony formation. Harmful Algae, 2017, 67: 85-91. DOI:10.1016/j.hal.2017.06.007 |
| [6] |
Liu L, Huang Q, Qin B. Characteristics and roles of Microcystis extracellular polymeric substances (EPS) in cyanobacterial blooms: a short review. Journal of Freshwater Ecology, 2018, 33(1): 183-193. DOI:10.1080/02705060.2017.1391722 |
| [7] |
Chen MZ, Xie MJ, Wu W et al. Chemical characteristics of capsular polysaccharide and water-soluble released exopolysaccharide from Microcystis. J Lake Sci, 2016, 28(3): 609-615. [陈毛珍, 谢梅娟, 巫伟等. 微囊藻胶鞘多糖和水溶性胞外多糖的化学特性. 湖泊科学, 2016, 28(3): 609-615. DOI:10.18307/2016.0317] |
| [8] |
Pereira S, Zille A, Micheletti E et al. Complexity of cyanobacterial exopolysaccharides: composition, structures, inducing factors and putative genes involved in their biosynthesis and assembly. FEMS Microbiology Reviews, 2009, 33(5): 917-941. DOI:10.1111/j.1574-6976.2009.00183.x |
| [9] |
Kumar D, Kastanek P, Adhikary SP. Exopolysaccharides from cyanobacteria and microalgae and their commercial application. Current Science, 2018, 115(2): 234-241. DOI:10.18520/cs/v115/i2/234-241 |
| [10] |
De Philippis R, Vincenzini M. Exocellular polysaccharides from cyanobacteria and their possible applications. FEMS Microbiology Reviews, 1998, 22(3): 151-175. DOI:10.1111/j.1574-6976.1998.tb00365.x |
| [11] |
Pereira SB, Mota R, Santos CL et al. Chapter Seven-Assembly and export of extracellular polymeric substances (eps) in cyanobacteria: a phylogenomic approach//Chauvat F, Cassier-Chauvat C. Advances in botanical research. Academic Press, 2013, 235-279. |
| [12] |
Pereira SB, Mota R, Vieira CP et al. Phylum-wide analysis of genes/proteins related to the last steps of assembly and export of extracellular polymeric substances (EPS) in cyanobacteria. Scientific Reports, 2015, 5(14835). DOI:10.1038/srep14835 |
| [13] |
Oertel A, Aichinger N, Hochreiter R et al. Analysis of mucilage secretion and excretion in micrasterias (chlorophyta) by means of immunoelectron microscopy and digital time lapse video microscopy1. Journal of Phycology, 2004, 40(4): 711-720. DOI:10.1111/j.1529-8817.2004.03222.x |
| [14] |
Xu H, Jiang H, Yu G et al. Towards understanding the role of extracellular polymeric substances in cyanobacterial Microcystis aggregation and mucilaginous bloom formation. Chemosphere, 2014, 117: 815-822. DOI:10.1016/j.chemosphere.2014.10.061 |
| [15] |
Chang TP. Sheath formation in Oscillatoria agardhii Gomont. Schweizerische Zeitschrift für Hydrologie-Swiss Journal of Hydrology, 1978, 39(2): 178-181. |
| [16] |
Zhu J, Wang J, Hua ZJ et al. Ultrastructure of the vegetative cells of Nostoc flagelliforme prepared with high pressure freezing and freeze substitution technique. Acta Botanica Sinica, 1998, 40(10): 901. |
| [17] |
Adhikary SP, Weckesser J, Jurgens UJ et al. Isolation and chemical characterization of the sheath from the cyanobacterium Chroococcus minutus SAG-B.41.79. Journal of General Microbiology, 1986, 132(9): 2595-2599. |
| [18] |
Bittar TB, Henriques Vieira AA. Transparent exopolymer particles formation from capsules of Anabaena spiroides (cyanobacteria) in culture. Journal of Phycology, 2010, 46(2): 243-247. DOI:10.1111/j.1529-8817.2009.00802.x |
| [19] |
Weckesser J, Hofmann K, Jurgens UJ et al. Isolation and chemical-analysis of the sheaths of the filamentous cyanobacteria Calothrix parietina and C. scopulorum. Journal of General Microbiology, 1988, 134(3): 629-634. |
| [20] |
Nakagawa M, Takamura Y, Yagi O. Isolation and characterization of the slime from a cyanobacterium, Microcystis aeruginosa K-3A. Agricultural and Biological Chemistry, 1987, 51(2): 329-337. DOI:10.1080/00021369.1987.10868065 |
| [21] |
Camacho FA, Thacker RW. Amphipod herbivory on the freshwater cyanobacterium Lyngbya wollei: Chemical stimulants and morphological defenses. Limnology and Oceanography, 2006, 51(4): 1870-1875. DOI:10.4319/lo.2006.51.4.1870 |
| [22] |
Hoiczyk E, Baumeister W. Envelope structure of 4 gliding filamentous cyanobacteria. Journal of Bacteriology, 1995, 177(9): 2387-2395. DOI:10.1128/jb.177.9.2387-2395.1995 |
| [23] |
Gloaguen V, Morvan H, Hoffmann L et al. Capsular polysaccharide produced by the thermophilic cyanobacterium Mastigocladus laminosus—Structural study of an undecasaccharide obtained by lithium degradation. European Journal of Biochemistry, 1999, 266(3): 762-770. DOI:10.1046/j.1432-1327.1999.00879.x |
| [24] |
Marco S, Aboal M, Chaves E et al. Immunolocalisation of microcystins in colonies of the cyanobacterium Rivularia in calcareous streams. Marine and Freshwater Research, 2012, 63(2): 160-165. DOI:10.1071/MF11168 |
| [25] |
Rastogi RP, Sonani RR, Madamwar D. The high-energy radiation protectant extracellular sheath pigment scytonemin and its reduced counterpart in the cyanobacterium Scytonema sp. R77DM. Bioresource Technology, 2014, 171: 396-400. DOI:10.1016/j.biortech.2014.08.106 |
| [26] |
Prasad A, Sedlarova M, Pospisil P. Singlet oxygen imaging using fluorescent probe Singlet Oxygen Sensor Green in photosynthetic organisms. Scientific Reports, 2018, 8(13685). DOI:10.1038/s41598-018-31638-5 |
| [27] |
Sheng G, Yu H, Li X. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: A review. Biotechnology Advances, 2010, 28(6): 882-894. DOI:10.1016/j.biotechadv.2010.08.001 |
| [28] |
Xu H, Cai H, Yu G et al. Insights into extracellular polymeric substances of cyanobacterium Microcystis aeruginosa using fractionation procedure and parallel factor analysis. Water Research, 2013, 47(6): 2005-2014. DOI:10.1016/j.watres.2013.01.019 |
| [29] |
Liu L, Huang Q, Qin B et al. Characterizing cell surface of blooming Microcystis in Lake Taihu, China. Water Science and Technology, 2016, 73(11): 2731-2738. DOI:10.2166/wst.2016.069 |
| [30] |
Ahmed M, Moerdijk-Poortvliet TCW, Wijnholds A et al. Isolation, characterization and localization of extracellular polymeric substances from the cyanobacterium Arthrospira platensis strain MMG-9. European Journal of Phycology, 2014, 49(2): 143-150. DOI:10.1080/09670262.2014.895048 |
| [31] |
Jackson GA. A model of the formation of marine algal flocs by physical coagulation processes. Deep Sea Research Part A Oceanographic Research Papers, 1990, 37(8): 1197-1211. DOI:10.1016/0198-0149(90)90038-W |
| [32] |
Reynolds CS. Variability in the provision and function of mucilage in phytoplankton: facultative responses to the environment. Hydrobiologia, 2007, 578(1): 37-45. DOI:10.1007/s10750-006-0431-6 |
| [33] |
D'Agostino PM, Woodhouse JN, Liew HT et al. Bioinformatic, phylogenetic and chemical analysis of the UV-absorbing compounds scytonemin and mycosporine-like amino acids from the microbial mat communities of Shark Bay, Australia. Environmental Microbiology, 2019, 21(2): 702-715. DOI:10.1111/1462-2920.14517 |
| [34] |
Storme J, Golubic S, Wilmotte A et al. Raman characterization of the UV-protective pigment gloeocapsin and its role in the survival of cyanobacteria. Astrobiology, 2015, 15(10): 843-857. DOI:10.1089/ast.2015.1292 |
| [35] |
Ehling-Schulz M, Bilger W, Scherer S. UV-B-induced synthesis of photoprotective pigments and extracellular polysaccharides in the terrestrial cyanobacterium Nostoc commune. Journal of Bacteriology, 1997, 179(6): 1940-1945. DOI:10.1128/jb.179.6.1940-1945.1997 |
| [36] |
Foster JS, Havemann SA, Singh AK et al. Role of mrgA in peroxide and light stress in the cyanobacterium Synechocystis sp. PCC 6803. FEMS Microbiology Letters, 2009, 293(2): 298-304. DOI:10.1111/j.1574-6968.2009.01548.x |
| [37] |
Pereira S, Micheletti E, Zille A et al. Using extracellular polymeric substances (EPS)-producing cyanobacteria for the bioremediation of heavy metals: do cations compete for the EPS functional groups and also accumulate inside the cell?. Microbiology-Sgm, 2011, 157(2): 451-458. DOI:10.1099/mic.0.041038-0 |
| [38] |
Mohite BV, Koli SH, Narkhede CP et al. Prospective of microbial exopolysaccharide for heavy metal exclusion. Applied Biochemistry and Biotechnology, 2017, 183(2SI): 582-600. DOI:10.1007/s12010-017-2591-4 |
| [39] |
Hou J, Yang Y, Wang P et al. Effects of CeO2, CuO, and ZnO nanoparticles on physiological features of Microcystis aeruginosa and the production and composition of extracellular polymeric substances. Environmental Science and Pollution Research, 2017, 24(1): 226-235. DOI:10.1007/s11356-016-7387-5 |
| [40] |
Wejnerowski L, Cerbin S, Dziuba MK. Thicker filaments of Aphanizomenon gracile are more harmful to Daphnia than thinner Cylindrospermopsis raciborskii. Zoological Studies, 2015, 54(2). DOI:10.1186/s40555-014-0084-5 |
| [41] |
Blanco Y, Alfonso Rivas L, Gonzalez-Toril E et al. Environmental parameters, and not phylogeny, determine the composition of extracellular polymeric substances in microbial mats from extreme environments. Science of the Total Environment, 2019, 650(1): 384-393. DOI:10.1016/j.scitotenv.2018.08.440 |
| [42] |
Lund J. Ecology of freshwater phytoplankton. Biological Reviews of the Cambridge Philosophical Society, 1965, 40(2): 231. DOI:10.1111/j.1469-185X.1965.tb00803.x |
| [43] |
Lange W. Speculations on a possible essential function of gelatinous sheath of blue-green-algae. Canadian Journal of Microbiology, 1976, 22(8): 1181-1185. DOI:10.1139/m76-171 |
| [44] |
Fang F, Yang L, Gan L et al. DO, pH, and Eh microprofiles in cyanobacterial granules from Lake Taihu under different environmental conditions. Journal of Applied Phycology, 2014, 26(4): 1689-1699. DOI:10.1007/s10811-013-0211-4 |
| [45] |
Flemming H, Wingender J. The biofilm matrix. Nature Reviews Microbiology, 2010, 8(9): 623-633. DOI:10.1038/nrmicro2415 |
| [46] |
Zhou Y, Nguyen BT, Zhou C et al. The distribution of phosphorus and its transformations during batch growth of Synechocystis. Water Research, 2017, 122: 355-362. DOI:10.1016/j.watres.2017.06.017 |
| [47] |
Otero A, Vincenzini M. Nostoc (Cyanophyceae) goes nude: Extracellular polysaccharides serve as a sink for reducing power under unbalanced C/N metabolism. Journal of Phycology, 2004, 40(1): 74-81. DOI:10.1111/j.0022-3646.2003.03-067.x |
| [48] |
Stuart RK, Mayali X, Lee JZ et al. Cyanobacterial reuse of extracellular organic carbon in microbial mats. ISME Journal, 2016, 10(5): 1240-1251. DOI:10.1038/ismej.2015.180 |
| [49] |
Otero A, Vincenzini M. Extracellular polysaccharide synthesis by Nostoc strains as affected by N source and light intensity. Journal of Biotechnology, 2003, 102(2): 143-152. DOI:10.1016/S0168-1656(03)00022-1 |
| [50] |
Boonchai R, Kaewsuk J, Seo G. Effect of nutrient starvation on nutrient uptake and extracellular polymeric substance for microalgae cultivation and separation. Desalination and Water Treatment, 2015, 55(2): 360-367. DOI:10.1080/19443994.2014.939501 |
| [51] |
Yao B, Xi B, Hu C et al. A model and experimental study of phosphate uptake kinetics in algae: Considering surface adsorption and P-stress. Journal of Environmental Sciences, 2011, 23(2): 189-198. DOI:10.1016/S1001-0742(10)60392-0 |
| [52] |
Sanudo-Wilhelmy SA, Tovar-Sanchez A, Fu FX et al. The impact of surface-adsorbed phosphorus on phytoplankton Redfield stoichiometry. Nature, 2004, 432(7019): 897-901. DOI:10.1038/nature03125 |
| [53] |
Shen H, Song L. Comparative studies on physiological responses to phosphorus in two phenotypes of bloom-forming Microcystis. Hydrobiologia, 2007, 592: 475-486. DOI:10.1007/s10750-007-0794-3 |
| [54] |
Pannard A, Pedrono J, Bormans M et al. Production of exopolymers (EPS) by cyanobacteria: impact on the carbon-to-nutrient ratio of the particulate organic matter. Aquatic Ecology, 2016, 50(1): 29-44. DOI:10.1007/s10452-015-9550-3 |
| [55] |
Cao HB, Li XG, Jiang B et al. Evaluation of the influence of extracellular polymeric substances on the mass transport of substrate within multispecies biofilms. Chinese Journal of Chemical Engineering, 2004(4): 134-138. |
| [56] |
Marshall KC. Starved and nonculturable microorganisms in biofilms. Nonculturable Microorganisms in the Environment, 2000, 113-129. |
| [57] |
Xiao Y, Liu L, Li Z et al. The role of cyanobacterial external layers in mass transfer: Evidence from temperature shock experiments by noninvasive microtest technology. Microorganisms, 2020, 8(6). DOI:10.3390/microorganisms8060861 |
| [58] |
Hoiczyk E, Baumeister W. The junctional pore complex, a prokaryotic secretion organelle, is the molecular motor underlying gliding motility in cyanobacteria. Current Biology, 1998, 8(21): 1161-1168. DOI:10.1016/S0960-9822(07)00487-3 |
| [59] |
Dhahri S, Ramonda M, Marliere C. In-situ determination of the mechanical properties of gliding or non-motile bacteria by atomic force microscopy under physiological conditions without immobilization. PLoS One, 2013, 8(e616634). DOI:10.1371/journal.pone.0061663 |
| [60] |
Brookes JD, Ganf GG. Variations in the buoyancy response of Microcystis aeruginosa to nitrogen, phosphorus and light. Journal of Plankton Research, 2001, 23(12): 1399-1411. DOI:10.1093/plankt/23.12.1399 |
| [61] |
Dervaux J, Mejean A, Brunet P. Irreversible collective migration of cyanobacteria in Eutrophic conditions. PLoS One, 2015, 10(e01209063). DOI:10.1371/journal.pone.0120906 |
| [62] |
Yang H, Cai Y, Xia M et al. Role of cell hydrophobicity on colony formation in Microcystis (Cyanobacteria). International Review of Hydrobiology, 2011, 96(2): 141-148. DOI:10.1002/iroh.201011312 |
| [63] |
Xu H, Lv H, Liu X et al. Electrolyte cations binding with extracellular polymeric substances enhanced Microcystis aggregation: implication for Microcystis bloom formation in eutrophic freshwater lakes. Environmental Science & Technology, 2016, 50(17): 9034-9043. DOI:10.1021/acs.est.6b00129 |
| [64] |
Qin BQ, Yang GJ, Ma JR et al. Dynamics of variability and mechanism of harmful cyanobacteria bloom in Lake Taihu, China. Chin Sci Bull, 2016, 61(7): 759-770. [秦伯强, 杨桂军, 马健荣等. 太湖蓝藻水华"暴发"的动态特征及其机制. 科学通报, 2016, 61(7): 759-770. DOI:10.1360/N972015-00400] |
| [65] |
Duan Z, Tan X, Parajuli K et al. Colony formation in two Microcystis morphotypes: Effects of temperature and nutrient availability. Harmful Algae, 2018, 72: 14-24. DOI:10.1016/j.hal.2017.12.006 |
| [66] |
Xiao M, Li M, Reynolds CS. Colony formation in the cyanobacterium Microcystis. Biological Reviews, 2018, 93(3): 1399-1420. DOI:10.1111/brv.12401 |
| [67] |
Whitfield C. Biosynthesis and assembly of capsular polysaccharides in Escherichia coli. Annual Review of Biochemistry, 2006, 75(1): 39-68. DOI:10.1146/annurev.biochem.75.103004.142545 |
| [68] |
Whitney JC, Howell PL. Synthase-dependent exopolysaccharide secretion in Gram-negative bacteria. Trends in Microbiology, 2013, 21(2): 63-72. DOI:10.1016/j.tim.2012.10.001 |
| [69] |
Chrismas NAM, Barker G, Anesio AM et al. Genomic mechanisms for cold tolerance and production of exopolysaccharides in the Arctic cyanobacterium Phormidesmis priestleyi BC1401. BMC Genomics, 2016, 17(1): 533. DOI:10.1186/s12864-016-2846-4 |
| [70] |
Michel G, Tonon T, Scornet D et al. The cell wall polysaccharide metabolism of the brown alga Ectocarpus siliculosus. Insights into the evolution of extracellular matrix polysaccharides in Eukaryotes.. New Phytologist, 2010, 188(1): 82-97. DOI:10.1111/j.1469-8137.2010.03374.x |
| [71] |
Kehr J, Zilliges Y, Springer A et al. A mannan binding lectin is involved in cell-cell attachment in a toxic strain of Microcystis aeruginosa. Molecular Microbiology, 2006, 59(3): 893-906. DOI:10.1111/j.1365-2958.2005.05001.x |
| [72] |
Zilliges Y, Kehr J, Mikkat S et al. An extracellular glycoprotein is implicated in cell-cell contacts in the toxic cyanobacterium Microcystis aeruginosa PCC 7806. Journal of Bacteriology, 2008, 190(8): 2871-2879. DOI:10.1128/JB.01867-07 |
| [73] |
Koronakis V, Eswaran J, Hughes C. Structure and function of TolC: The bacterial exit duct for proteins and drugs. Annual Review of Biochemistry, 2004, 73: 467-489. DOI:10.1146/annurev.biochem.73.011303.074104 |
| [74] |
Delepelaire P. Type Ⅰ secretion in gram-negative bacteria. Biochimica et Biophysica Acta-Molecular Cell Research, 2004, 1694(1/2/3): 149-161. DOI:10.1016/j.bbamcr.2004.05.001 |
| [75] |
Moslavac S, Bredemeier R, Mirus O et al. Proteomic analysis of the outer membrane of Anabaena sp. strain PCC 7120. Journal of Proteome Research, 2005, 4(4): 1330-1338. DOI:10.1021/pr050044c |
| [76] |
Hahn A, Stevanovic M, Brouwer E et al. Secretome analysis of Anabaena sp. PCC 7120 and the involvement of the TolC-homologue HgdD in protein secretion. Environmental Microbiology, 2015, 17(3): 767-780. DOI:10.1111/1462-2920.12516 |
| [77] |
Oliveira P, Martins NM, Santos M et al. The versatile TolC-like Slr1270 in the cyanobacterium Synechocystis sp. PCC 6803. Environmental Microbiology, 2016, 18(2): 486-502. DOI:10.1111/1462-2920.13172 |
| [78] |
Fisher ML, Allen R, Luo Y et al. Export of extracellular polysaccharides modulates adherence of the Cyanobacterium Synechocystis. PLoS One, 2013, 8(9): e74514. DOI:10.1371/journal.pone.0074514 |
| [79] |
Pereira SB, Santos M, Leite JP et al. The role of the tyrosine kinase Wzc (Sll0923) and the phosphatase Wzb (Slr0328) in the production of extracellular polymeric substances (EPS) by Synechocystis PCC 6803. Microbiologyopen, 2019, 8(6): e753. DOI:10.1002/mbo3.753 |
| [80] |
Zhang Y, Hu C, Chen M. Induced exopolysaccharide synthesis and the molecular mechanism in Synechocystis sp. PCC 6803 Under Clinorotation. Microgravity Science and Technology, 2018, 30(6): 857-864. DOI:10.1007/s12217-018-9646-1 |
| [81] |
Han P, Shen S, Guo R et al. ROS is a factor regulating the increased polysaccharide production by light quality in the edible cyanobacterium Nostoc flagelliforme. Journal of Agricultural and Food Chemistry, 2019, 67(8): 2235-2244. DOI:10.1021/acs.jafc.8b06176 |
| [82] |
Gan N, Xiao Y, Zhu L et al. The role of microcystins in maintaining colonies of bloom-forming Microcystis spp. Environmental Microbiology, 2012, 14(3): 730-742. DOI:10.1111/j.1462-2920.2011.02624.x |
| [83] |
Sun T, Li S, Song X et al. Toolboxes for cyanobacteria: Recent advances and future direction. Biotechnology Advances, 2018, 36(4): 1293-1307. DOI:10.1016/j.biotechadv.2018.04.007 |
 2021, Vol. 33
2021, Vol. 33 

