太湖和巢湖是我国长江中下游地区重要的淡水、浅水湖泊,兼具供水、通航、渔业、防洪、灌溉、旅游等多种功能. 随着社会经济的发展,流域内人口不断增加,工农业生产迅速发展,城镇大量工业废水、生活污水排放入湖,导致湖泊水体的营养盐浓度增加,湖泊富营养化进程加快[1-2],蓝藻水华频发,严重威胁到水体的多项生态功能. 近年来,随着湖泊治理力度的逐步加大,太湖和巢湖水体污染势头得到明显的遏制,并且部分水质指标逐渐好转,但是蓝藻水华的面积、水华蓝藻的生物量等指标仍没有明显好转[3-4],蓝藻水华依然是这2个湖泊最重要的水环境问题之一[5-6].
常见的水华蓝藻包括微囊藻(Microcystis)、束丝藻(Aphanizomenon)、长孢藻(Dolichospermum)、拟柱胞藻(Cylindropemopsis)等,由于不同蓝藻分属于不同的生态类型,因此,水华蓝藻的组成及其优势类群具有明显的季节性演替特征和空间差异,如早春通常发生束丝藻水华、长孢藻水华,而夏季为微囊藻水华,至秋冬季节再转变为长孢藻或束丝藻水华. 不同湖泊中水华蓝藻这种季节性演替模式也并不一致,这种非同步性体现了湖泊环境演变的差异. 太湖和巢湖的优势水华蓝藻种类明显不同,通常太湖以微囊藻为主要的水华蓝藻,而巢湖以微囊藻和长孢藻为共同优势水华蓝藻种类. 近年来2个湖泊的营养盐水平,如总氮或氨氮浓度均呈现明显的下降趋势[3-4],但是水华蓝藻的总生物量并没有随之而下降,而是水华蓝藻的种类发生了明显的变化,其中太湖由微囊藻年内绝对优势变为春初和秋末开始出现长孢藻优势,长孢藻的比例在增加,而巢湖长孢藻与微囊藻的比例却在下降[3-4]. 为阐明2个湖泊中2种水华蓝藻生物量的长尺度变化过程,本研究利用中国科学院太湖湖泊生态系统研究站的长时序(1993-2015年)监测数据和本团队2012-2018年巢湖的监测数据,阐述了2种水华蓝藻生物量的历史变化特征,并结合同步水体氮磷等营养盐数据,分析了驱动这种变化的主要因素,该研究将有助于深化对水华蓝藻响应湖泊治理过程的认识.
1 研究方法 1.1 野外调查太湖的历史数据主要来源于中国科学院太湖湖泊生态系统研究站(TLLER),野外调查于1993-2015年逐月进行,每月中旬采样1次,本研究采用了梅梁湾至湖心的6个采样点数据进行分析. 巢湖的野外调查于2012和2018年进行,每月中旬采样1次,本研究采用敞水区的8个采样点位进行分析,具体位置见图 1. 水温等环境因子于现场利用Yellow Spring Instruments(YSI 6600, USA)在原位进行测定. 水质测定样品和浮游植物样品通过混合表、中和底层样品获取,其中水质样品5 L,带回实验室测定,浮游植物样品500 mL,现场用1 % 的鲁哥氏碘液固定保存.

|
图 1 太湖和巢湖采样点位 Fig.1 The locations of the sampling sites in Lake Taihu and Lake Chaohu |
水样带回实验室后,参照《湖泊富营养化调查规范》方法[7]测定总氮(TN)、总磷(TP)、氨氮(NH3-N)、硝态氮(NO3--N)、正磷酸盐(PO43--P)等浓度. 其中,采用钼酸铵分光光度法测定TP浓度;碱性过硫酸钾-紫外分光光度法测定TN浓度,纳氏试剂比色法测定NH3-N浓度;紫外分光光度法测定NO3--N浓度;钼锑抗分光光度法测定PO43--P浓度.
浮游植物样品静置24 h后吸去上清液,浓缩至约30 mL,分析时取均匀样品0.1 mL,在光学显微镜下鉴定计数,每个样品计数2片取其平均值. 生物量则根据藻类的平均体积与密度乘积计算,其中藻类平均体积根据目微尺实测藻体大小,根据藻类的形状,使用相应的体积公式计算,藻类密度按1计算. 本研究主要分析微囊藻、长孢藻和所有藻类的总生物量.
1.3 数据分析利用Microsoft Excel 2010进行数据整理,R软件平台[8]的ggplot2、mgcv和caret等程序包进行分析和制图[9-10]. 其中微囊藻和长孢藻生物量的变化趋势及其显著性通过mgcv程序包内的一般加性混合模型(GAMM)确定,TN和TP的时间变化趋势通过局部加权回归模型(LOESS)确定,影响2种藻类生物量变化的主要驱动因子通过caret程序包内的分类回归树确定,采用ggplot2程序包制图.
2 结果 2.1 太湖和巢湖营养盐浓度及微囊藻和长孢藻生物量的变化趋势1993-2015年间,太湖总磷浓度呈现波动的变化过程,于1998年和2007年出现2个峰值,而根据现有的监测结果,2016年后太湖磷浓度再次反弹升高,这与太湖的阶段性治理过程密切相关. 而正磷酸盐浓度自2005年以后呈现明显的升高趋势. 太湖的总氮浓度也出现1998年和2007年2个峰值,但是自2007年以后呈现明显的下降趋势,历史上硝态氮的浓度始终高于氨氮,但是近年来,随着氮浓度的下降,二者的浓度越来越趋近(图 2).
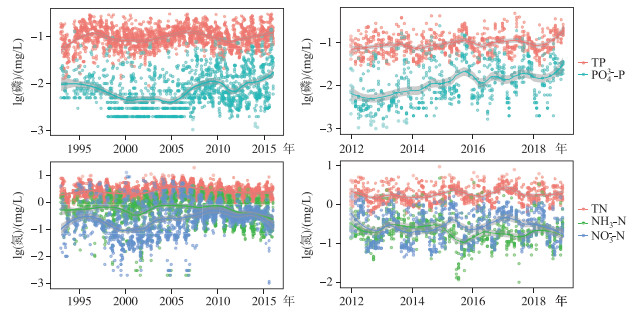
|
图 2 太湖(左)和巢湖(右)营养盐浓度的长期变化趋势 Fig.2 Long-term trends of nutrients in Lake Taihu (left) and Lake Chaohu (right) |
2012-2018年间,巢湖总磷浓度呈现升高趋势,但正磷酸盐浓度增加趋势明显. 巢湖的总氮浓度没有明显的变化趋势,但是硝态氮和氨氮浓度在2017年以后呈现明显的下降趋势,而且硝态氮和氨氮浓度相近(图 2).
随着营养盐浓度的变化,太湖和巢湖的微囊藻和长孢藻生物量发生了明显的变化,其中太湖的微囊藻生物量在2007年以后呈现缓慢的增加趋势,而长孢藻生物量响应总氮浓度的变化呈现相反的变化趋势,在1998年和2007年表现为低谷期,2007年以后长孢藻生物量明显增加. 巢湖的长孢藻生物量呈现明显的下降趋势,而微囊藻的生物量变化趋势不明显,但是就2种藻占总生物量的比例而言,巢湖呈现长孢藻比例下降,微囊藻比例升高的变化趋势(图 3).
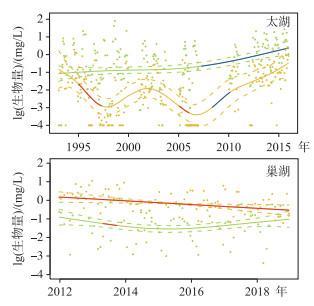
|
图 3 太湖和巢湖中微囊藻和长孢藻生物量的长期变化趋势(绿色点为微囊藻,金色点为长孢藻,绿色和金色实线为GAMM模型回归趋势线,虚线为对应的95 % 置信区间,红色表示该时间段内显著下降,蓝色表示该时间段内显著升高,显著水平为P<0.05) Fig.3 Long-term trends of Microcystis and Dolichospermum biomass in Lake Taihu and Lake Chaohu (The green and golden points indicate the log-transformed Microcystis and Dolichospermum biomass, respectively. The solid green and golden lines indicate the fit lines for the two algae with GAMM model, and the dot lines are the approximate 95 % confidence intervals on the fitted function. The red lines indicate significant decreasing trends with the linear regression (P < 0.05). The blue lines indicate significant increasing trends with the linear regression (P < 0.05)) |
通过每年的监测结果可以发现,微囊藻和长孢藻年内不同生物量的出现频率也呈现明显的变化趋势(图 4),其中太湖微囊藻在2006年以前,年内低生物量和高生物量均有较多分布,因此通常出现低生物量和高生物量两2个频率较高的峰值,而2010年以后,低生物量频率的峰值逐渐消失,以高生物量为主,而且这个峰值逐渐向更高的生物量方向偏移. 太湖长孢藻在1990s初有较多分布,1990s中后期到2010年以前,太湖长孢藻生物量降低,各年间波动较大,但整体上在年内以低生物量为主,2010年以后,较高生物量峰值频率逐渐增加,且向更高的生物量方向偏移. 2012-2018年间巢湖微囊藻年内分布频率逐渐向高生物量偏移,峰高逐渐增高,而长孢藻的变化趋势正好相反,年内分布频率的峰值逐渐降低,高频率峰值逐渐向低生物量偏移(图 5).
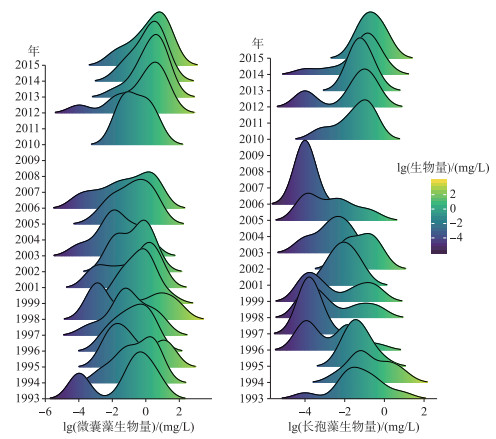
|
图 4 1993-2015年太湖微囊藻和长孢藻生物量的频度分布 Fig.4 The frequency distribution of Microcystis and Dolichospermum biomass in Lake Taihu from 1993 to 2015 |
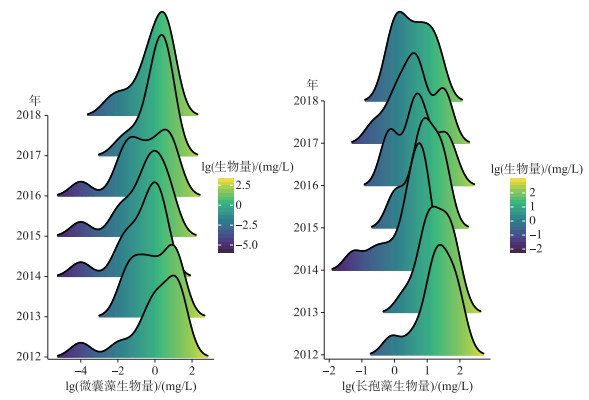
|
图 5 2012-2018年巢湖微囊藻和长孢藻生物量的频度分布 Fig.5 The frequency distribution of Microcystis and Dolichospermum biomass in Lake Chaohu from 2012 to 2018 |
根据分类回归树的结果可见(图 6):在太湖和巢湖的所有数据梯度范围内,温度是微囊藻占总生物量比例的最主要驱动因子(图 6,节点1),当温度低于20.4℃时,微囊藻占比通常较低,但是如果此时总磷浓度较高,微囊藻占比依然可以较高,如节点5中微囊藻占比的第三四分位数(Q3)可以达到70 %,节点8中Q3可以超过30 %,这一部分的微囊藻优势主要出现在夏季以后,温度逐渐降低的过程中. 当温度高于20.4℃时,微囊藻的占比通常较高,如果总磷浓度超过96 μg/L时,Q3均可以超过80 %,若氮磷比低于27,微囊藻占比的中位数(Q2)可以超过60 % (节点14);如果总磷浓度低于96 μg/L时,水体温度具有明显的调节作用,温度越高,微囊藻占比越高.
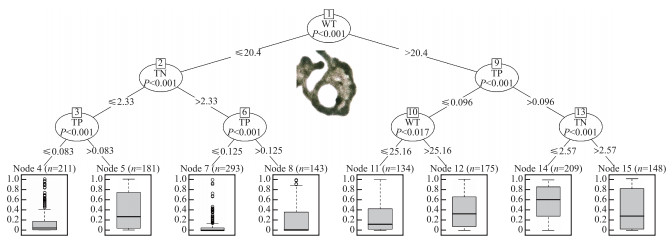
|
图 6 微囊藻占总生物量比值的分类回归树(TN:总氮(mg/L);TP:总磷(mg/L);WT:水温(℃)) Fig.6 Classification and regression trees for the ratio of Microcystis to total biomass (TN, total nitrogen (mg/L); TP, total phosphorus (mg/L); and WT, water temperature (℃)) |
长孢藻占总生物量比例的驱动因子相对于微囊藻较为简单,分类回归树的节点较少(图 7),总氮是长孢藻占比的最主要的驱动因子(节点1),当总氮浓度高于1.772 mg/L时,长孢藻的占比通常较低,其Q2均不到5 %,如果此时总氮浓度低于2.704 mg/L且温度低于22.3℃,Q3可以接近50 %. 当总氮浓度低于1.772 mg/L,温度越低、总磷浓度越低,长孢藻占比越高,其Q3可以超过90 %,Q2可以超过70 % (节点4),随着总磷浓度增加(> 79 μg/L)、温度增高(> 14.34℃),长孢藻占比逐渐下降.

|
图 7 长孢藻占总生物量比值的分类回归树(TN:总氮(mg/L);TP:总磷(mg/L);WT:水温(℃)) Fig.7 Classification and regression trees for the ratio of Dolichospermum to total biomass (TN, total nitrogen (mg/L); TP, total phosphorus (mg/L); and WT, water temperature (℃)) |
氮磷营养盐水平是影响微囊藻和长孢藻长尺度变化的重要驱动因素,同时它们同两种藻之间的关系又受对方以及温度的影响. 分析结果显示,微囊藻生物量与总磷的线性关系斜率均为正值,表明其具有显著的正相关关系,而这一斜率在总氮浓度低于约2 mg/L时,波动较大,而当总氮浓度超过约2 mg/L时,随着总氮浓度的增加而增加(图 8),同时这一斜率在温度15~20℃之间达到最大值,温度过低和过高,这一斜率均有所下降. 微囊藻生物量与总氮的线性关系显著性受总磷和温度的影响,当总磷浓度低于0.15 mg/L时,微囊藻生物量与总氮具有显著的负相关关系,其斜率不受总磷浓度的影响,当总磷浓度高于0.15 mg/L时,微囊藻生物量与总氮之间的关系不显著;当温度低于约21℃时,微囊藻生物量与总氮具有显著的负相关关系,其斜率随着温度的升高,呈现先降低后升高的趋势,17~18℃时斜率最低,当温度高于约21℃时微囊藻生物量与总氮之间的关系不显著.

|
图 8 微囊藻生物量与总磷、总氮线性关系的斜率随总氮、总磷和水温的变化过程 Fig.8 The variations of the slope of Microcystis biomass-TP (or TN) linear relationship along TN (or TP) and water temperature |
长孢藻生物量与总磷浓度之间的关系在大部分总氮和温度范围内均不具有显著性(图 9),表明长孢藻基本不受总磷浓度的影响. 但是长孢藻生物量与总氮浓度之间的关系明显受总磷和水体温度的影响. 当磷浓度低于0.09 mg/L时,长孢藻生物量与总氮浓度间具有显著的负相关关系,当磷浓度高于0.09 mg/L时,关系不显著. 当温度低于约21℃时,大部分测试样本中,长孢藻生物量与总氮浓度具有显著的负相关关系,当温度高于约21℃时长孢藻生物量与总氮浓度之间的关系不显著.

|
图 9 长孢藻生物量与总磷、总氮线性关系的斜率随总氮、总磷和水温的变化过程 Fig.9 The variations of the slope of Dolichospermum biomass-TP (or TN) linear relationship along TN (or TP) and water temperature |
太湖和巢湖中溶解态氮中,硝态氮与总氮的关系更为密切,其变化趋势相似,而氨氮与总氮的关系不显著. 因此,长孢藻生物量在随着总氮浓度升高而下降的同时,也随着硝酸盐浓度的升高而下降,与氨氮浓度的变化无显著相关性(图 10). 另外,微囊藻生物量除与总磷浓度呈现显著正相关关系外,与溶解态总磷和正磷酸盐浓度也呈现显著的正相关关系(图 10).

|
图 10 长孢藻和微囊藻生物量、溶解性氮(氨氮和硝态氮)和溶解态磷之间的关系(蓝色实线为线性回归线,灰色区域为95 % 置信区间,黑色实线为1 ∶1分割线) Fig.10 The relationships among dissolved nitrogen (ammonium, nitrate), dissolved phosphorus, total nitrogen, Microcysits and Dolichospermum biomass(The solid blue lines are the linear fit lines, and the gray area is the approximate 95 % confidence intervals on the fitted function, The solid black lines are the 1 ∶1 lines) |
影响水华蓝藻种间优势演替的因素主要可以归结为外部环境因素的变化和两个物种间的相互作用,其中外部环境包括温度、营养盐等. 微囊藻和长孢藻间的季节性演替在众多水体研究中均有报道[11-13],这些季节性演替的首要驱动因素为温度[14],但是在长尺度上,两种水华蓝藻的演替通常被认为是营养盐驱动,如水体中溶解态氮浓度的降低,导致具有固氮功能的长孢藻占据优势[15].
本研究发现总氮浓度与长孢藻生物量具有明显的负相关关系,随着总氮浓度的降低,长孢藻生物量显著增加,这与以往控制试验和湖泊观测的结果相一致[16-18],本研究分析结果进一步显示,尽管在低氮浓度时长孢藻占据优势,但是长孢藻占据优势可能存在不同的方式. 当氮浓度低于2.7 mg/L,温度低于22.3℃(图 7,节点7~9),微囊藻尚未形成优势时,长孢藻可以占据优势,此时由于氮浓度相对较高,长孢藻不需大量形成异形胞. 当氮更低、温度更高时(图 7,节点6),长孢藻仍能形成优势,此时长孢藻形成较多异形胞. 前者可能是利用了长孢藻温度生态位的优势,而后者可能是利用长孢藻异形胞的氮利用优势. 本研究给出了一些节点的温度和氮浓度,但是这些数值仍不能作为区分这两种优势形成方式的关键阈值,这部分阈值需进一步深入分析研究.
总磷浓度是影响微囊藻生物量的重要因素,从长尺度看,微囊藻生物量与总磷浓度的变化呈现明显的正相关关系,当然,藻类个体中的磷也会贡献于水体的总磷变化,这可能会影响这一关系,但是溶解态总磷和正磷酸盐浓度与微囊藻生物量也具有明显的正相关关系,因此,虽然有藻类个体中磷对这一关系的影响,磷仍然是决定微囊藻生物量长尺度变化的重要因素. 这可能与微囊藻的磷利用策略有关,微囊藻在低磷浓度时,可以快速吸收并储存磷于细胞内,当磷浓度升高时,其依然可以利用丰富的磷快速生长[11].
温度是影响微囊藻和长孢藻比例的最主要因素,这种影响主要表现为影响两种藻的季节性演替,当微囊藻和长孢藻处于它们的温度生态位重叠区域时,如果2种藻类均没有环境条件的限制,此时具有相对高生长速率的物种通常会占据优势. 比如微囊藻和长孢藻都在20℃以上具有较高的生长速率,并且在最优营养盐条件下在28~32℃达到各自的最快生长速率,但是长孢藻的最快生长速率明显低于微囊藻[14],导致在此条件下通常是微囊藻占据优势,而此时微囊藻与长孢藻的相对比例可能主要取决于磷的浓度,如果磷的浓度偏高,微囊藻可能会完全替代长孢藻成为单一优势水华蓝藻,如果磷的浓度偏低,则可能出现两种共存的现象,如果磷浓度偏低的同时出现氮限制,则将是以长孢藻为单一的优势水华蓝藻. 气候变暖导致的温度升高也被认为是影响水华蓝藻扩张的重要因素,但是2000年以来,太湖地区的温度升高幅度不明显,一般加性模型的结果也显示温度对于太湖蓝藻生物量、微囊藻生物量的变化影响不显著[4, 19],而巢湖的时间序列数据较短,温度升高的影响更加不显著,因此,气候变暖导致的温度升高对2个湖泊近年来微囊藻和长孢藻演变过程的影响可能有限.
3.2 太湖和巢湖水华蓝藻种间演替的分析近年来太湖和巢湖污染治理力度加大,总氮或者氨氮浓度出现了明显的下降,但是总磷浓度仍然在高位水平波动. 2个湖泊水华蓝藻的组成响应营养盐变化而发生演化,其中2个湖泊微囊藻的生物量始终维持在较高水平并缓慢增加,而太湖长孢藻的生物量2007年后快速增加,导致长孢藻在水华蓝藻中的占比明显提升;而巢湖微囊藻生物量稳定维持并略有升高的同时,长孢藻生物量却明显下降. 可见2个湖泊中同样的氮削减工作,却导致长孢藻生物量向2个不同的方向演化.
太湖的微囊藻生物量始终处于较高水平,这与太湖磷浓度的长期高位波动相关,而近几年磷浓度的明显增加,也导致了微囊藻生物量的显著升高. 太湖长孢藻生物量的波动趋势始终与总氮浓度的波动趋势相反,特别是2007年以后,太湖的总氮浓度明显降低,这可能导致长孢藻在太湖中成为优势种之一,但是其在夏季微囊藻为绝对优势的环境中,受微囊藻的竞争影响无法形成优势,而在春季和秋季温度较低的环境中开始在太湖各个湖区占据优势,形成蓝藻水华,此时形成长孢藻水华主要是利用了其温度生态位优势,因为在春季和秋冬季节太湖的氮水平相较于夏季更高,无需固氮作用,因此观测到的长孢藻异形胞较少.
巢湖的水华蓝藻呈现湖区间的分布差异,其中西部湖区与太湖当下的分布模式相似,即春季和秋冬季节以长孢藻为水华蓝藻,夏季以微囊藻为水华蓝藻[20]. 东部湖区在2012年前后,由于水体中的氮、磷营养水平较低,全年以长孢藻为水华蓝藻,夏季的长孢藻具有明显的异形胞,因此,其夏季可能以固氮的方式成为优势蓝藻;但是近年来该湖区由于磷浓度的升高,导致微囊藻的比例开始增加,长孢藻比例下降,因此春季和秋冬季节仍然以长孢藻为水华蓝藻,但是夏季开始出现2种藻共同占据优势的情况.
综上所述,巢湖可能是由于磷浓度的升高,微囊藻的竞争生长导致了夏季长孢藻生物量的下降,而太湖可能是由于氮浓度的降低,导致春、秋季长孢藻生物量的升高.
4 结论1) 太湖和巢湖的微囊藻生物量多年来始终保持高位波动,近年来均有升高的趋势;太湖的长孢藻生物量呈现较大波动变化,近10年来升高明显,巢湖的长孢藻生物量有明显的下降趋势.
2) 磷是决定微囊藻生物量长尺度变化的主要驱动因素,而氮是决定长孢藻生物量长尺度变化的驱动因素,因此针对2种蓝藻水华的治理需要针对性的氮磷控制策略.
3) 长孢藻可以通过温度生态位和固氮两种方式占据优势,一年四季均有可能并形成蓝藻水华,需注意预警与防控,但是关键的温度阈值和开始固氮的氮浓度阈值仍不清楚,有待深入研究.
致谢: 中国科学院南京地理与湖泊研究所太湖湖泊生态系统研究站提供太湖相关数据,在此表示感谢.
| [1] |
Xie P ed. Reading about the histories of cyanobacteria, eutrophication and geological evolution in Lake Chaohu. Beijing: Science Press, 2009. [谢平. 翻阅巢湖的历史: 蓝藻、富营养化及地质演化. 北京: 科学出版社, 2009.]
|
| [2] |
Qin BQ, Hu WP, Chen WM. The chaning process and mechanism of water environmentin Lake Taihu. Beijing: Science Press, 2004. [秦伯强, 胡维平, 陈伟民等. 太湖水环境演化过程与机理. 北京: 科学出版社, 2004.]
|
| [3] |
Zhang M, Shi XL, Yang Z et al. The variation of water quality from 2012 to 2018 in Lake Chaohu and the mitigating strategy on cyanobacterial blooms. J Lake Sci, 2020, 32(1): 11-20. [张民, 史小丽, 阳振等. 2012-2018年巢湖水质变化趋势分析和蓝藻防控建议. 湖泊科学, 2020, 32(1): 11-20. DOI:10.18307/2020.0102] |
| [4] |
Zhang M, Yang Z, Shi X. Expansion and drivers of cyanobacterial blooms in Lake Taihu. J Lake Sci, 2019, 31(2): 336-344. [张民, 阳振, 史小丽. 太湖蓝藻水华的扩张与驱动因素. 湖泊科学, 2019, 31(2): 336-344. DOI:10.18307/2019.0203] |
| [5] |
Yang L, Yang X, Ren L et al. Mechanism and control strategy of cyanobacterial bloom in Lake Taihu. J Lake Sci, 2019, 31(1): 18-27. [杨柳燕, 杨欣妍, 任丽曼等. 太湖蓝藻水华暴发机制与控制对策. 湖泊科学, 2019, 31(1): 18-27. DOI:10.18307/2019.0102] |
| [6] |
Zhu G, Qin B, Zhang Y et al. Variation and driving factors of nutrients and chlorophyll-a concentrations in northern region of Lake Taihu, China, 2005-2017. J Lake Sci, 2018, 30(2): 279-295. [朱广伟, 秦伯强, 张运林等. 2005-2017年北部太湖水体叶绿素a和营养盐变化及影响因素. 湖泊科学, 2018, 30(2): 279-295. DOI:10.18307/2018.0201] |
| [7] |
Jin XC, Tu QY. Standard for investigation of lake eutrophication. Beijing: China Environmental Science Press, 1990. [金相灿, 屠清瑛. 湖泊富营养化调查规范. 北京: 中国环境科学出版社, 1990.]
|
| [8] |
Team RC. R: a language and environment for statistical computing. Vienna, Austria: R Foundation for Statistical Computing, 2014.
|
| [9] |
Wickham H. ggplot2: elegant graphics for data analysis. Springer Science & Business Media, 2009. |
| [10] |
Wood S. The mgcv package. 2007. www.r-project.org.
|
| [11] |
Wan L, Chen X, Deng Q et al. Phosphorus strategy in bloom-forming cyanobacteria (Dolichospermum and Microcystis) and its role in their succession. Harmful Algae, 2019, 84: 46-55. DOI:10.1016/j.hal.2019.02.007 |
| [12] |
Zhang M, Zhang Y, Yang Z et al. Spatial and seasonal shifts in bloom-forming cyanobacteria in Lake Chaohu: Patterns and driving factors. Phycological Research, 2016, 64(1): 44-55. DOI:10.1111/pre.12112 |
| [13] |
Chia MA, Jankowiak JG, Kramer BJ et al. Succession and toxicity of Microcystis and Anabaena (Dolichospermum) blooms are controlled by nutrient-dependent allelopathic interactions. Harmful Algae, 2018, 74: 67-77. DOI:10.1016/j.hal.2018.03.002 |
| [14] |
Li R, Watanabe MM. Physiological properties of planktic species of Anabaena (Cyanobacteria) and their taxonomic value at species level. Archiv für Hydrobiologie Supplementband Algological Studies, 2001, 140: 31-45. |
| [15] |
Herrero A, Flores E. Genetic responses to carbon and nitrogen availability in Anabaena. Environmental Microbiology, 2019, 21(1): 1-17. DOI:10.1111/1462-2920.14370 |
| [16] |
Paerl HW, Xu H, Hall NS et al. Controlling cyanobacterial blooms in hypertrophic Lake Taihu, China: Will nitrogen reductions cause replacement of non-N2 fixing by N2 fixing taxa?. PLoS One, 2014, 9(11): e113123. DOI:10.1371/journal.pone.0113123 |
| [17] |
Moisander PH, Paerl HW, Zehr JP. Effects of inorganic nitrogen on taxa-specific cyanobacterial growth and nifH expression in a subtropical estuary. Limnology and Oceanography, 2008, 53(6): 2519-2532. DOI:10.4319/lo.2008.53.6.2519 |
| [18] |
Shan K, Song L, Chen W et al. Analysis of environmental drivers influencing interspecific variations and associations among bloom-forming cyanobacteria in large, shallow eutrophic lakes. Harmful Algae, 2019, 84: 84-94. DOI:10.1016/j.hal.2019.02.002 |
| [19] |
Zhang M, Shi X, Yang Z et al. Long-term dynamics and drivers of phytoplankton biomass in eutrophic Lake Taihu. Science of the Total Environment, 2018, 645: 876-886. DOI:10.1016/j.scitotenv.2018.07.220 |
| [20] |
Zhang M, Yang Z, Yu Y et al. Interannual and seasonal shift between Microcystis and Dolichospermum: A 7-year investigation in Lake Chaohu, China. Water, 2020, 12(7): 1978. DOI:10.3390/w12071978 |
 2021, Vol. 33
2021, Vol. 33 

