(2: 湘潭大学环境与资源学院, 湘潭 411105)
(3: 中南大学冶金与环境学院, 长沙 410083)
(2: College of Environment and Resources, Xiangtan University, Xiangtan 411105, P. R. China)
(3: School of Metallurgy and Environment, Central South University, Changsha 410083, P. R. China)
洞庭湖素有“长江之肾”美誉, 其径流量约为长江总径流量的1/3, 是长江中游水量最大的通江湖泊, 是长江中下游极重要的洪水调蓄库和国际重要湿地, 是长江流域重要的水生生物栖息地和种质资源库, 担负着长江流域中下游水安全和国家粮食安全的重大责任[1]. 水生植物是湖泊生态系统结构和功能的重要组成部分, 南荻(Triarrhena lutarioriparia)是我国特有的纤维型多年生草本植物, 主要分布于长江中下游的蓄洪湖区, 其在洞庭湖洲滩上的面积最大[2]. 南荻作为洞庭湖标志性植物群落, 具有增强蓄洪能力、净化水体、抑制藻类、防止水土流失等多重生态功能[3-5], 对洞庭湖湿地生态系统极其重要. 在洞庭湖区, 南荻与芦苇(Phragmites australis)混生, 但以南荻为主, 其占比约达到80 % [2]. 南荻与芦苇外形相似, 但两种植株在秆壁与叶鞘存在显著差异, 同时, 与芦苇及其他(松、杨等)造纸原料相比, 南荻单位面积生物量高、纤维品质优异、造纸纸浆得率高、浆板强度好, 是我国特有的适于造纸的原料[2, 6]. 自1960s初国家将洞庭湖区规划为我国造纸重要原料基地, 近年来洞庭湖南荻面积不断扩大, 至2017年, 湖区南荻面积约达8.67×108 m2, 年产量约90万t, 占全国总产量的30 % 以上, 是全国14个芦苇主产区之一. 制浆造纸是南荻主要资源利用途径[7], 每年90 % 以上的南荻被收割用于制浆造纸.
为深入贯彻十九大精神以及习近平总书记关于长江经济带发展战略思想, 坚持生态优先、人与自然和谐共生、绿色发展, 湖南省人民政府出台了《洞庭湖区造纸企业引导退出实施方案》(湘政办函﹝2018﹞36号), 要求“2018年环洞庭湖造纸企业全面退出制浆产能, 2019年全面退出造纸产能”, 南荻下游产业造纸业面临整体退出. 造纸业退出后, 湖区南荻短期内难以找到可替代的资源化利用途径, 南荻原有的“生长-刈割-生长”模式改变为“生长-凋落腐解-生长”, 一方面, 每年近90万t干重的南荻凋落物及残体凋落腐解可能会影响洞庭湖水环境, 特别是近年来洞庭湖湖体总磷(TP)污染问题突出[8], 掌握南荻腐解及其氮磷释放特征是制定南荻管控方案、避免南荻大规模腐解造成湖体营养盐污染的前提;另一方面, 南荻作为洞庭湖分布最广的挺水植物, 其生物量变化及残体腐解过程直接关系洞庭湖物质能量循环, 研究南荻腐解及其氮磷释放特征对认识洞庭湖生态系统物质循环过程具有重要意义.
目前, 针对芦苇的腐解相关研究较多, 且主要为芦苇腐解过程体内氮、磷变化特征, 近年来部分研究开始涉及腐解过程对水质影响. 相比于芦苇, 现有研究对南荻腐解关注较少[9-10], 且主要集中于环境条件对南荻生长与生理特性的影响[11-14]. 诸多研究表明植物参与腐解的生物量、自身碳氮比、纤维素及营养元素含量、水文水质特征、微生物群落等是影响挺水植物腐解速率及有机物、氮、磷等释放的关键因素[15-18]. 南荻地上部分生物量、碳氮比、有机碳和纤维素、半纤维素、木质素等含量均高于芦苇, 总氮含量低于芦苇[7, 19], 不能简单根据芦苇及其他挺水植物腐解特征推论南荻腐解特征, 特别是其腐解过程对洞庭湖湖体水质的影响.
南荻主要生长于洞庭湖滩涂区域, 水位波动幅度较小, 特别是在平水期和枯水期, 生长区域水流波动相对较缓, 水体交换相对较少, 南荻腐解对生长区域水体水质的影响则相对较大. 因此, 为评估在水流较缓条件下未刈割南荻残体腐解对洞庭湖水质的影响, 本研究利用批量分解袋实验[20]考察了不同生物量条件下南荻腐解对洞庭湖湖水-沉积物模拟系统水质的影响, 研究结果有利于深入认识南荻弃割后洞庭湖物质能量循环过程, 同时可为湖区造纸业退出后南荻管控及洞庭湖生态恢复与重建等相关方案的制定提供科学依据.
1 材料与方法于2018年11月在南洞庭湖南荻生长区域, 现场采集南荻植株及其生长区域沉积物与湖水等实验样品, 将南荻茎、叶、穗分开保存与标记, 南荻茎、叶、穗样品经超纯水清洗后晾干, 在105℃烘箱内杀青30 min, 而后80℃烘干至恒重, 测定南荻茎、叶、穗生物量干重, 计算各部分占比. 将南荻茎、叶、穗等剪成约1 cm的碎片, 按照各部分生物量干重占比, 称取一定量的茎、叶、穗南荻样品投入150 μm分解袋中. 将采集的南荻种植区表层沉积物风干, 研磨过15 μm筛, 去除杂物和植物残体;而后称取100 g表层沉积物铺放于8 L塑料桶底部, 并在桶中加入湖水6 L, 静置3 d. 将装有南荻样品的分解袋置于桶内上覆水中, 悬于水体中部位置, 最后放置于15℃恒温培养箱中无光照条件下静置. 各实验组分解袋内南荻样品在湖水中的生物量密度分别为0.5、1、2 g/L, 另设置无南荻残体的空白组. 分别在腐解时间为第0、5、10、20、30、45、60、75、90天时采集上覆水液面以下5 cm处水样进行相关水质分析, 测定pH、溶解氧(DO)、COD、氨氮(NH3-N)、总氮(TN)、总磷(TP)水质指标. 整个实验过程设空白对照和2个平行样.
分别采用《水质化学需氧量的测定重铬酸盐法》(GB11914-1989)、《纳氏试剂法》(HJ 535-2009)、《碱性过硫酸钾消解紫外分光光度法》(HJ636-2012)、《钼酸铵分光光度法》(GB11893-1989)测定上覆水中COD、NH3-N、TN和TP浓度. 本研究所有实验平行样的标准误差在5 % 以内, 图表中所显示的数据为平行样的平均值, 采用SPSS 20.0软件中单因素ANOVA检验法对数据间的差异进行分析.
2 结果与分析 2.1 南荻体内氮磷分布特征所采集的洞庭湖南荻叶、茎、穗各部位TN和TP含量如表 1所示, 氮磷含量在南荻地上部分不同器官分布趋势均表现为穗>叶>茎, 且不同器官氮磷含量差异较大, 其中, 穗内TN和TP含量均最高, 分别达到29.38和3.82 mg/g. 现有报道指出芦苇体内氮磷含量分布特征为穗>叶>茎[21], 与南洞庭湖南荻氮磷含量地上各器官的分布规律一致. 南洞庭湖南荻茎的氮磷含量较低, 但茎生物量干重占地上部分的80.17 %, 叶的生物量干重占比为14.13 %.
| 表 1 洞庭湖南荻叶、茎、穗氮、磷含量a Tab. 1 Nitrogen and phosphorus content of leaves, stem and spike of Triarrhena lutarioriparia in Lake Dongting |
洞庭湖南荻腐解对上覆水中DO浓度影响如图 1a所示, 总体上, 上覆水中DO浓度在初始腐解10 d内急剧下降, 而后缓慢回升, 且在腐解60 d后逐步持续下降, 除南荻投加量2 g/L实验组外, 当腐解时间达到60 d后上覆水中DO浓度在较小范围内波动. 南荻初始投加量对腐解过程中上覆水DO浓度变化影响较大, 随着南荻生物量的增加而显著降低(P < 0.001), 特别是当南荻残体初始投加量增加至2 g/L, 腐解时间为90 d时, 与初始DO浓度相比, 上覆水中DO浓度下降了83.4 %, 降至0.46 mg/L, 水体已呈缺氧状态.
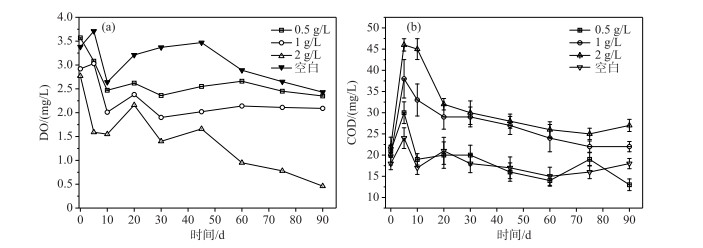
|
图 1 上覆水DO浓度(a)和COD(b)随腐解时间的变化 Fig.1 Changes of dissolved oxygen concentration (a) and COD(b) in overlying water with decomposition time |
洞庭湖南荻腐解期间上覆水中COD变化如图 1b所示, 随着分解时间的增加, 上覆水中所有COD均呈现急剧增加而后逐渐降低趋势. 具体而言, 在初始腐解的5 d内, 上覆水中COD浓度急剧增加至最高值(20~46 mg/L), 且最高值随着南荻投加量的增加而显著增加(P < 0.001), 南荻投加量为2 g/L实验组上覆水COD浓度是空白组的2.6倍;第5~20天内COD浓度快速降低, 而后缓慢降低并在一定范围内波动;腐解时间达到90 d时, 不同南荻投加量(0~2 g/L)实验组上覆水COD浓度均基本恢复至未腐解时水平.
2.2.3 NH3-N浓度图 2a为洞庭湖南荻腐解期间上覆水中NH3-N浓度的变化, 上覆水中NH3-N浓度在初始腐解10 d内呈现急速增长的趋势, 之后增长趋势变缓, 第20天达到最高值(2.60~4.11 mg/L)而后急剧下降. 腐解20 d时上覆水NH3-N浓度最高值随着南荻生物量的增加而增加;当腐解时间达到30 d后, 除南荻投加量2 g/L实验组外, 上覆水中NH3-N浓度在较小范围内波动. 南荻残体初始投加量为2 g/L条件下, 腐解时间为90 d时, 与初始NH3-N浓度相比, 上覆水中NH3-N浓度上升了58.5 %, 由0.41 mg/L升高至0.65 mg/L.

|
图 2 上覆水NH3-N(a)、TN(b)和TP(c)浓度随腐解时间的变化 Fig.2 Changes of ammonia nitrogen(a), total nitrogen(b) and total phosphorus(c) concentrations in overlying water with decomposition time |
洞庭湖南荻腐解期间上覆水中TN浓度变化如图 2b所示, 不同投加量条件下腐解系统上覆水中TN浓度变化均呈现“急剧增加-缓慢下降”的趋势. 具体而言, 当南荻投加量为0、0.5和1 g/L时, 上覆水中TN浓度均在初始腐解的20 d内迅速增加至最高值(4.83~5.76 mg/L);相比之下, 南荻投加量为2 g/L时, 上覆水中TN浓度在初始腐解的10 d即可迅速升高到最高值(6.84 mg/L). 不同南荻投加量条件下, 腐解系统上覆水TN浓度均在第10天或第20天达到最高值后持续缓慢降低, 至腐解时间为90 d时, 南荻投加量为0~1 g/L的腐解系统上覆水中TN浓度均恢复至未腐解(第0天)时水平, 而南荻投加量为2 g/L的腐解系统上覆水中TN浓度(3.42 mg/L)仍显著高于未腐解(第0天)时水平(2.54 mg/L).
2.2.5 TP浓度洞庭湖南荻腐解对上覆水中TP浓度影响如图 2c所示, 上覆水中TP浓度在初始腐解5 d内急速上升, 而后急剧下降, 在腐解第20~90 d内, 上覆水中TP浓度在小范围内波动. 在整个90 d的腐解过程中, 上覆水中TP浓度随南荻投加量的增加而显著增加(P < 0.01). 当南荻投加量由0.5 g/L增加到2 g/L, 腐解系统上覆水TP浓度在第5天时的最高值增加了1.65倍. 相比于实验组, 无南荻添加的空白组上覆水TP浓度则基本保持在0.08~0.13 mg/L之间, 处于相对较稳定状态. 当腐解时间为90 d时, 南荻投加量为0~1 g/L的腐解系统上覆水中TP浓度(0.08~0.10 mg/L)均略低于未腐解时水平(0.12~0.15 mg/L), 而南荻投加量为2 g/L的腐解系统上覆水中TP浓度(0.18 mg/L) 仍为未腐解(第0天)时的2倍(0.09 mg/L).
2.3 南荻腐解过程底泥变化不同投加量(0~2 g/L)下南荻腐解90 d后底泥氮、磷及有机质含量如表 2所示, 腐解后底泥中总氮、总磷和有机质含量均随着南荻投加量的增加而有所增加, 其中, 南荻投加量为2 g/L的实验组底泥有机质、总氮、总磷含量分别是空白组的1.13、1.18和1.56倍. 相比于有机质与氮, 南荻腐解可显著增加底泥中磷含量, 这可能与迁移转化机制有关, 磷只能在南荻残体、上覆水、底泥3种介质中迁移分配, 磷总量不变, 而有机质和氮可分别通过微生物降解与反硝化作用降低其在腐解系统内的总量.
| 表 2 南荻腐解后底泥氮、磷及有机质含量 Tab. 2 Nitrogen, phosphorus and organic matter content in sediment after decomposing Triarrhena lutarioriparia |
现有植物残体腐解研究报道指出植物腐解主要为营养盐和有机组分等快速浸出和微生物缓慢降解等2个过程[22-26], 本研究90 d的腐解实验中, COD、NH3-N、TN、TP等水质指标浓度基本呈现“急速上升-快速下降-缓慢恢复”的趋势. 在快速浸出阶段, 实验组上覆水COD、NH3-N和TP在初始腐解的5 d内急剧增加至最高值, TN浓度则在腐解时间20 d时达到最高值, 同时DO浓度总体呈现持续下降态势;空白组上覆水TN和COD浓度均快速上升, 这可能是由于底泥向上覆水释放了含氮有机物. 在微生物缓慢降解阶段, 腐解时间5~20 d内, NH3-N和TP在达到最高值后浓度均快速下降;腐解时间20~30 d内, NH3-N和TP浓度均小幅度上升, 而后在腐解30 d时浓度均开始逐步下降. 综合本研究各项水质指标变化特征, 南荻残体在快速浸出阶段水溶性有机物和磷元素等组分受淋溶作用快速释放至上覆水中[27], 且以上组分快速浸出是一个耗氧过程. 总体上, 南荻腐解系统上覆水中各项水质指标浓度在腐解30 d后变化幅度减缓并趋于稳定, 这表明南荻生物降解阶段营养成分在上覆水中的释放或矿化与沉积物-湖水系统对各组分的自净能力达到动态平衡.
相比之下, 南荻残体内磷的释放或矿化速率高于氮, 这可能由于南荻体内大部分磷主要以水溶态或可生物降解态存在, 芦苇腐解过程中也存在相似的氮、磷快速释放特征[27-29]. 在南荻残体内营养盐和有机组分等快速浸出后, 上覆水中COD、NH3-N和TP等浓度的快速下降可能与腐解系统内沉积物从上覆水中吸附营养盐和有机组分有关[28-29];经对比分析, 相比于空白组, 南荻腐解90 d后腐解系统内底泥中有机质及氮、磷含量显著升高;汤志凯等[30]研究也表明在水-植物残体-底泥系统内沉水植物狐尾藻(Myriophyllum verticillatum L.)、浮水植物菱角(Trapa bispinosa Roxb)、挺水植物荷花(Lotus flower)腐解释放的磷明显呈向底泥迁移的趋势, 且在快速浸出阶段总磷向底泥迁移得最多. 此外, 相关研究指出植物残体生物降解阶段, 吸附作用、微生物代谢和固定作用等共同存在, 残体可通过吸附作用吸附上覆水中的营养物质, 同时当植物残体内营养物不足时, 残体微生物需从上覆水中固定氮、磷等参与降解过程[28], 这可能是导致南荻腐解过程上覆水中氮磷等指标浓度下降的又一重要原因;NH3-N和TP浓度在微生物腐解阶段均呈现小幅度上升, 这可能是由于南荻残体微生物的分解作用高于氮磷吸附和微生物氮磷固定作用所致.
不同生物量南荻腐解对水质的影响趋势相似, 不同南荻投加量实验组上覆水水质在腐解前期差异显著、后期差异较小. 腐解过程中上覆水DO、COD、NH3-N、TN和TP水质指标浓度变化幅度均与南荻的添加量呈显著正相关(P < 0.01). 在快速浸出阶段, 随着腐解系统内南荻投加量增加, 上覆水中COD、NH3-N、TN和TP浓度越高、增加幅度越大, DO越低;在微生物降解阶段, 不同南荻投加量下腐解系统上覆水中各项指标浓度差异逐渐减小. 当腐解时间达到90 d后, 在南荻投加量为0~1 g/L条件下, 腐解系统上覆水各项水质指标基本能通过沉积物-湖水系统的自净能力恢复到初始未腐解时(第0天)水平;当南荻投加量增至2 g/L, 腐解时间达到90 d后, 腐解系统上覆水中DO浓度(0.47 mg/L)仍仅为初始水平的16.6 %, NH3-N、TN和TP浓度均高于初始未腐解时水平, 分别为未腐解时的0.59、0.35和2倍. 付贤钟等[31]和叶春等[32]对苦草与黑藻的腐解实验结果也表明,过量水生植物残体腐解会导致水体持续缺氧, 水质恶化. 本研究腐解系统条件下南荻的适量投加量为0~1 g/L, 而刘彪等[33]研究指出芦苇投加量为2~8 g/L条件下腐解60 d后上覆水水质可恢复至腐解前水平, 以上研究结果差异可能与南荻及芦苇腐解系统内底泥与水环境因子不同有关.
结合以上南荻腐解对水质的影响结果, 可初步推断:在洞庭湖湖区相对封闭缓流区域和高密度南荻种植区域, 未刈割南荻大规模凋落、水淹后, 其腐解初期营养盐和有机组分快速释放可能会引起洞庭湖局部水域水质短期内急速恶化, 主要表现为DO浓度降低, 以及COD、NH3-N、TN和TP浓度显著升高等;且随着南荻残体腐解生物量增加, 其腐解对水质的影响程度越高、时间越长, 过高生物量南荻的腐解可能导致湖体局部水域水质恶化, 特别是DO和TP浓度在较长时间内处于较差水平;以上研究结果有利于深入认识南荻弃割后洞庭湖物质能量循环过程, 可为洞庭湖相对封闭且缓流滩涂上南荻养护与管控(如刈割方案的制订)提供科学依据. 现有研究结果指出:腐解温度的升高可能会促进植物残体内有机质与氮的释放, 对磷释放影响较小[34];光照条件下适量的植物残体腐解有利于提高微生物丰度与活性, 增强水体中吸光性物质的降解能力[35]. 但本研究主要模拟了低温(15℃)、无光照条件下南荻腐解对静态水域水质的影响, 模拟条件与洞庭湖过水型湖泊水文、光照、季节交替引起的温度变化等具有一定差距, 尚需开展系统全面的室内模拟条件实验及现场跟踪监测, 以此研究确定不同温度和光照条件下南荻腐解对洞庭湖水质的综合影响与长期作用效应.
4 结论1) 南荻腐解对水质的影响主要表现在腐解初期, COD、NH3-N、TN、TP水质指标浓度基本呈现“急速上升-快速下降-缓慢恢复”的趋势, DO则呈现出“快速下降-缓慢回升-持续逐步下降”的趋势.
2) 随着南荻生物量增加, 南荻腐解对水质的影响程度越高、影响时间越长. 当南荻投加量增加至2 g/L时, 上覆水中COD、NH3-N、TN和TP水质指标浓度分别是未添加南荻残体空白组的2.60、1.58、1.42和8.14倍;腐解时间达到90 d时, 2 g/L南荻投加量实验组上覆水水质仍未恢复至初始水平.
3) 在洞庭湖湖区相对封闭缓流区域和高密度南荻种植区域, 未刈割南荻腐解初期营养盐和有机组分快速释放可能会引起洞庭湖局部水域水质短期内急速恶化, 且腐解释放的有机质与氮磷部分向底泥迁移.
| [1] |
Wang SM, Dou HS. China lakes. Beijing: Science Press, 1998. [王苏民, 窦鸿身. 中国湖泊志. 北京: 科学出版社, 1998.]
|
| [2] |
Chen SL, Renvoize SA. A new species and a new combination from China of Miscanthus (Poaceae). Kew Bulletin, 2011, 60(4): 605-607. |
| [3] |
Liu L. Unique parper-making raw materials in China: Triarrhena lutarioriparia. Plants, 1990, 17(5): 6-7. [刘亮. 中国特有造纸原料——南荻. 植物杂志, 1990, 17(5): 6-7.] |
| [4] |
Li X, Song BB, Li F et al. Population distribution patterns and growing status of Triarrhena lutarioriparia along a gentle elevation gradient of Lake Dongting wetlands. J Lake Sci, 2016, 28(5): 1039-1046. [李旭, 宋冰冰, 李峰等. 洞庭湖不同水位高程下南荻(Triarrhena lutarioriparia)种群分布格局及生长动态. 湖泊科学, 2016, 28(5): 1039-1046. DOI:10.18307/2016.0514] |
| [5] |
Yang C, Xiao L. Energy plant Dongting South Reed and its ecological benefits. Journal of Green Science and Technology, 2017, 15: 137-138. [杨闯, 肖亮. 能源植物洞庭南荻及其生态效益. 绿色科技, 2017, 15: 137-138.] |
| [6] |
Zhang YX, Chen JS, Ma LF. Discussion on the development strategy of reed production in Lake Dongting District. Hunan Papermaking, 2012, 41(4): 11-15. [张运雄, 陈金山, 马乐凡. 洞庭湖区芦苇生产发展战略探讨. 湖南造纸, 2012, 41(4): 11-15. DOI:10.3969/j.issn.1672-3066.2012.04.005] |
| [7] |
Liu X. New raw material for paper making—Triarrhena lutarioriparia. New Rural Technology, 1996(11): 18. [刘新. 造纸新原料——南荻. 农村新技术, 1996(11): 18.] |
| [8] |
Guo J, Wang CM, Huang DZ et al. Pollution characterization and water quality assessment of Dongting Lake. Environmental Chemistry, 2019, 38(1): 152-160. [郭晶, 王丑明, 黄代中等. 洞庭湖水污染特征及水质评价. 环境化学, 2019, 38(1): 152-160.] |
| [9] |
Wang XL, Xu LG, Xu JY et al. Effects of prescribed fire on plant traits and community characteristics of Triarrhena lutarioriparia in Poyang lake, China. Wetlands, 2019, 39(1): 161-172. DOI:10.1007/s13157-018-1065-y |
| [10] |
Xie YJ, Xie YH, Xiao HY et al. Controls on litter decomposition of emergent macrophyte in Dongting Lake wetlands. Ecosystems, 2017, 20(7): 1383-1389. DOI:10.1007/s10021-017-0119-y |
| [11] |
Wang B, Huang P, Lv DY et al. Effects of Pb and Cd on the seed germination and seedling growth of Triarrhena lutarioriparia. Ecology and Environmental Sciences, 2018, 27(9): 1768-1773. [王波, 黄攀, 吕德雅等. 铅、镉对南荻种子萌发和幼苗生长的影响. 生态环境学报, 2018, 27(9): 1768-1773.] |
| [12] |
Wu C, Chen XS, Zou Y et al. Effects of different water levels and cutting treatments on the growth and physiology of Miscanthus lutarioriparius. Journal of Hunan Agricultural University: Natural Sciences, 2018, 44(3): 290-294. [吴超, 陈心胜, 邹业爱等. 不同水位和刈割处理对南荻生长和生理的影响. 湖南农业大学学报: 自然科学版, 2018, 44(3): 290-294.] |
| [13] |
Ji XS, Cao Y, Tang SW et al. Indoor simulating study on growth and physiological characteristic of Triarrhena lularioriparia seedlings under different waterlogging depths. Wetland Science, 2019, 17(1): 112-118. [纪欣圣, 曹昀, 汤思文等. 不同深度淹水下南荻幼苗生长和生理特性室内模拟研究. 湿地科学, 2019, 17(1): 112-118.] |
| [14] |
Chen MZ, Jin Z, Lei GC et al. The response of soil seed bank diversity to soil moisture change in Lake Dongting. J Lake Sci, 2020, 32(3): 745-753. [陈明珠, 靳朝, 雷光春等. 洞庭湖洲滩土壤种子库对土壤水分变化的响应. 湖泊科学, 2020, 32(3): 745-753. DOI:10.18307/2020.0314] |
| [15] |
Zhao QQ, Bai JH, Liu PP et al. Decomposition and carbon and nitrogen dynamics of Phragmites australis Litter as affected by flooding periods in coastal wetlands. CLEAN-Soil, Air, Water, 2015, 43(3): 441-445. DOI:10.1002/clen.201300823 |
| [16] |
Chen XR, Zhu LL, Deng ZM et al. Effects of clipping on bud bank and population regeneration of Triarrhena lutarioriparia in Dongting Lake wetland, China. Wetlands, 2020, 40(6): 2635-2642. DOI:10.1007/s13157-020-01311-7 |
| [17] |
Ou X, Cui KP, Tang HY et al. Impacts of decomposition of Vallisneria natans on nutrient speciation concentration in two kinds of water environments. Research of Environmental Sciences, 2017, 30(10): 1553-1560. [藕翔, 崔康平, 汤海燕等. 不同水环境下苦草腐解对水质的影响. 环境科学研究, 2017, 30(10): 1553-1560.] |
| [18] |
Sun ZG, Mou XJ, Sun WL. Potential effects of tidal flat variations on decomposition and nutrient dynamics of Phragmites australis, Suaeda salsa and Suaeda glauca litter in newly created marshes of the Yellow River estuary, China. Ecological Engineering, 2016, 93: 175-186. DOI:10.1016/j.ecoleng.2016.05.024 |
| [19] |
Dang N, Huang ZG, Li HS. Advances in biology and applications of fiber plant Triarrhena lutarioriparia. Journal of Tropical and Subtropical Botany, 2012, 20(4): 418-424. [党宁, 黄志刚, 李合松. 纤维型植物南荻的生物学及其应用研究进展. 热带亚热带植物学报, 2012, 20(4): 418-424. DOI:10.3969/j.issn.1005-3395.2012.04.017] |
| [20] |
Bärlocher F. Leaf mass loss estimated by the litter bag technique. Methods to study litter decomposition. Cham: Springer International Publishing, 2020: 43-51. DOI:10.1007/978-3-030-30515-4_6
|
| [21] |
Song JY, Shan BQ. Nitrogen and phosphorus absorption capacity of Phragmites australis in constructed pond-wetland system for reclaimed water treatment. Environmental Science & Technology, 2012, 35(10): 16-19, 33. [宋佳宇, 单保庆. 塘-湿地系统中芦苇对再生水氮磷吸收能力研究. 环境科学与技术, 2012, 35(10): 16-19, 33.] |
| [22] |
Hietz P. Decomposition and nutrient dynamics of reed (Phragmites australis (Cav.) Trin. ex Steud.) litter in Lake Neusiedl, Austria. Aquatic Botany, 1992, 43(3): 211-230. DOI:10.1016/0304-3770(92)90068-T |
| [23] |
Lan Y, Cui BS, You ZY et al. Litter decomposition of six macrophytes in a eutrophic shallow lake (Baiyangdian lake, China). CLEAN-Soil, Air, Water, 2012, 40(10): 1159-1166. DOI:10.1002/clen.201200056 |
| [24] |
Eid EM, Shaltout KH, Al-Sodany YM. Decomposition dynamics of Phragmites australis litter in Lake Burullus, Egypt. Plant Species Biology, 2014, 29(1): 47-56. DOI:10.1111/j.1442-1984.2012.00389.x |
| [25] |
Deng HG, Zhang J, Chen SY et al. Metal release/accumulation during the decomposition of Potamogeton crispus in a shallow macrophytic lake. Journal of Environmental Sciences, 2016, 42: 71-78. DOI:10.1016/j.jes.2015.07.004 |
| [26] |
Hongwei Y. A primary study of the decomposition of reed (Phragmites australis cav.) leaves in the schelde under experimental conditions. Archive Vliz Archive A Thes3, 1996. |
| [27] |
van Dokkum HP, Slijkerman DME, Rossi L et al. Variation in the decomposition of Phragmites australis litter in a monomictic lake: The role of gammarids. Hydrobiologia, 2002, 482(1/2/3): 69-77. DOI:10.1023/A:1021295610780 |
| [28] |
Cai RF. The litter decomposition process of three dominant plants in Poyang Lake wetland and the dynamics of related bacterial community[Dissertation]. Nachang: Nachang University, 2010. [蔡润发. 鄱阳湖湿地三种植物凋落物的分解过程及细菌群落结构动态变化[学位论文]. 南昌: 南昌大学, 2010. ]
|
| [29] |
Dinka M, Ágoston-Szabó E, Tóth I. Changes in nutrient and fibre content of decomposing Phragmites australis litter. International Review of Hydrobiology, 2004, 89(5/6): 519-535. DOI:10.1002/iroh.200410772 |
| [30] |
Tang ZK, Zhang YM, Yang F et al. Migration and transformation of phosphorus nutrients in the decomposition process of three aquatic plants. Acta Scientiae Circumstantiae, 2019, 39(3): 716-721. [汤志凯, 张毅敏, 杨飞等. 3种水生植物腐解过程中磷营养物质迁移、转化过程研究. 环境科学学报, 2019, 39(3): 716-721. DOI:10.13671/j.hjkxxb.2018.0398] |
| [31] |
Fu XZ, Cui KP, Ou X et al. Effect of residues decomposition of Vallisneria natans on water quality under different biomass levels in water body. Water Purification Technology, 2018, 37(1): 123-128. [付贤钟, 崔康平, 藕翔等. 不同生物量苦草残体腐解对水体水质的影响. 净水技术, 2018, 37(1): 123-128.] |
| [32] |
Ye C, Wang B, Li CH et al. Nutrient release process during decomposition of submerged macrophytes(Hydrilla verticillata Royle). China Environmental Science, 2014, 34(10): 2653-2659. [叶春, 王博, 李春华等. 沉水植物黑藻腐解过程中营养盐释放过程. 中国环境科学, 2014, 34(10): 2653-2659.] |
| [33] |
Liu B, Yang XY, Sun HP. Decomposition of Phragmites australis and its influence on water quality of Baigui Lake wetland. Journal of Henan University of Urban Construction, 2016, 25(5): 61-67. [刘彪, 杨晓玉, 孙华鹏. 芦苇腐解对白龟湖湿地水质的影响研究. 河南城建学院学报, 2016, 25(5): 61-67.] |
| [34] |
Yang F, Yao J, Zhang YM et al. Research on the dissolved organic matter and microbial community diversity of submerged macrophytes decomposed under different temperature. China Environmental Science, 2018, 38(10): 3904-3913. [杨飞, 姚佳, 张毅敏等. 温度对沉水植物腐解释放DOM及微生物群落多样性的影响. 中国环境科学, 2018, 38(10): 3904-3913.] |
| [35] |
Zhang J, Li CH, Ye C et al. Effects of Hydrilla verticillata decomposition on recruitment of the dormant Microcystis spp. Research of Environmental Sciences, 2012, 25(1): 43-50. [张娟, 李春华, 叶春等. 沉水植物黑藻腐解对微囊藻休眠体复苏的影响. 环境科学研究, 2012, 25(1): 43-50. DOI:10.13198/j.res.2012.01.46.zhangj.002] |
 2021, Vol. 33
2021, Vol. 33 

