(2: 暨南大学生态学系水生生物研究所, 广州 510632)
(3: 中国科学院大学中丹科研教育中心, 北京 100049)
(2: Department of Ecology and Institute of Hydrobiology, Jinan University, Guangzhou 510632, P. R. China)
(3: Sino-Danish Center for Education and Research, University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
杂食性鱼类是指可同时摄食植物性饵料(如沉水植物等)和动物性饵料(如底栖动物等)的鱼类. 因此, 杂食性鱼类可从至少2个营养级中获取食物, 通过多种途径影响水生态系统. 底栖杂食性鱼类(例如鲤和鲫)在取食底栖动物的过程中, 可显著引起水体营养盐浓度和浊度升高[1-4], 从而促进浮游植物生长和生物量升高[1, 3]. 此外, 杂食性鱼类还可导致浮游动物和底栖动物生物量下降[3, 5]. 杂食性鱼类引起的浮游动物生物量下降, 将削弱浮游动物对浮游植物生物量的下行控制力, 间接地促进了浮游植物生物量增长. 目前有关杂食性鱼类的研究主要集中在个体较大的种类(鲤、鲫等)[4, 6-7], 而对小型杂食性鱼类对水生态系统的影响研究较少.
在五里湖生态修复区, 鳑鲏等小型杂食性鱼类是鱼类群落的优势鱼类[8]. 鳑鲏是鲤科鱊亚科鱼类的统称, 在我国分布广泛[9], 属于小型杂食性鱼类, 可摄食浮游动物、底栖动物、附着藻类、碎屑和沉水植物等[8, 10]. 鳑鲏可能与其他杂食性鱼类(例如鲤和鲫)类似, 主要通过扰动沉积物[3-4]、排泄[11]、捕食浮游动物[12]、底栖动物[3]和沉水植物[8]等途径, 影响水质和生物群落结构. 但鳑鲏对水生态系统影响的研究还相对较少[13-14].
鳑鲏繁殖时必需依赖河蚌(例如背角无齿蚌(Sinanodonta woodiana)和三角帆蚌(Hyriopsis cumingii)等[15]), 其受精卵在河蚌体内孵化, 幼鱼在河蚌外套膜生活一段时间后才独自生活[16-17]. 河蚌通过滤食可有效提高水体透明度[18-20], 促进沉水植物生长[5]. 因此, 在以构建沉水植物群落为主的富营养化湖泊生态修复中, 常将放养河蚌作为沉水植物群落恢复的辅助手段[21-23]. 而放养的河蚌可能通过排泄营养盐[24]和促进鳑鲏种群的发展(携带鳑鲏的卵或为已有鳑鲏种群提供产卵基质)等途径影响水生态系统.
鳑鲏可引起水体营养盐浓度、浮游植物生物量和悬浮质浓度升高[14], 而河蚌通过滤食可能会缓解(抵消)鳑鲏对水质造成的这些负面影响. 现有研究主要从鳑鲏—河蚌协同进化的角度研究两者间的相互作用[25-26], 而它们之间的交互作用对水生态系统的影响还尚不清楚. 本研究以大鳍鱊(Acheilognathus macropterus)(鳑鲏)和背角无齿蚌(河蚌)为研究对象, 通过受控实验探讨鳑鲏和河蚌及其交互作用对水质以及浮游植物、浮游动物和底栖动物群落结构的影响, 为我国浅水湖泊管理与生态修复提供参考.
1 材料与方法 1.1 实验设置本实验于2018年11—12月, 在中国科学院太湖湖泊生态系统研究站中设置12个高密度聚乙烯桶实验系统(底部直径: 43 cm; 开口直径51 cm; 桶高: 70 cm; 容积: 130 L). 实验开始前, 向每个实验系统中加入10 cm混匀的沉积物(经孔径为0.5 cm的筛网过滤)以及100 L经64 μm浮游生物网过滤的湖水. 沉积物和水均采自实验站的池塘.
本实验共设置4个处理组, 分别为对照组、河蚌组、鳑鲏组和河蚌+鳑鲏组, 每个处理组设置3个重复. 其中, 河蚌组中添加2只背角无齿蚌, 其生物量为(122.1±1.8) g/m2; 鱼类组中添加2尾大鳍鱊(平均全长(4.6±0.1) cm; 平均生物量(12.8±0.2) g/m2); 河蚌+鳑鲏组中添加2只河蚌(生物量(120.6±0.7) g/m2)和2尾大鳍鱊(平均全长(4.4±0.02) cm; 平均生物量(12.1±0.1) g/m2); 对照组中不添加河蚌和大鳍鱊. 本实验采用的鱼类密度(3.8 ind./m2)小于自然湖泊中的小型鱼类密度(8.7 ind./m2)[27], 河蚌的生物量低于2006—2007年太湖蚌类的总平均生物量(647 g/m2)[28]. 鳑鲏和河蚌均采自太湖, 并在实验开始时直接投放到相应的系统.
1.2 样品采集与分析实验开始后, 每7天测定一次水体的营养盐、悬浮质和叶绿素a(Chl.a)浓度. 实验结束时, 分析浮游植物、浮游动物和底栖动物的丰度和生物量. 每次水样采集时, 用2.5 L的有机玻璃采水器, 收集5 L不同水层的上覆水, 然后带2 L混合均匀的水样回实验室分析水体不同形态的氮、磷营养盐浓度、Chl.a浓度和不同形态的悬浮物浓度; 然后将剩余水样倒回实验系统. 浮游植物和浮游动物样品采集时, 用采水器收集7.5 L水样, 然后用8 % 的鲁哥试剂固定500 mL水样, 用于分析浮游植物的群落结构组成; 随后, 通过64 μm的浮游生物网过滤5 L混合水样获取浮游动物群落样品, 并保存于4 % 的甲醛溶液; 最后, 将剩余的水样和经浮游动物网过滤的水倒入实验系统. 每次采样结束或当系统水位变化明显时, 用提前准备好的湖水将水位恢复至实验初始水平. 在实验结束时, 用彼得森采泥器采集沉积物中的底栖动物. 浮游植物在100~400倍显微镜下, 鉴定到属[29-30]; 不同浮游植物体积的0.29倍作为各类植物的干重生物量[31]. 浮游动物样品分析时, 轮虫在100倍视野中鉴定, 枝角类和桡足类则在10~40倍视野中进行鉴定[32-33], 然后根据浮游动物体长与干重的经验公式计算浮游动物的干重生物量[34-35].
总氮(TN)、溶解性总氮(TDN)、总磷(TP)、溶解性总磷(TDP)浓度的分析方法参照《湖泊富营养化调查规范》[36]. 测定水体Chl.a浓度时, 用醋酸纤维膜过滤0.5~1 L水样, 将滤膜转入离心管, 加入10 mL 90 % 的丙酮溶液, 充分震荡后置于4℃暗处反应18~24 h; 随后, 经3500 r/min离心后, 取上清液, 用紫外分光光度计测定其在750、663、645和630 nm波长下的吸光值, 计算水样中的Chl.a浓度.
用已知重量的Whatman GF/C玻璃纤维摸抽滤0.5~1 L水样, 随后将膜置于60℃烘箱内烘至恒重(约48 h), 称量后获得总悬浮质(TSS)浓度. 随后, 将膜置于450℃的马弗炉中灼烧4 h, 取出称重, 获得有机悬浮质(OSS)浓度; TSS与OSS的差值即为无机悬浮质(ISS)浓度.
1.3 数据分析本研究的所有数据统计分析均在SPSS 22.0软件中进行. 通过双因素(鳑鲏和河蚌)重复测量方差分析方法(rmANOVA), 分析鳑鲏、河蚌以及鳑鲏与河蚌交互作用对TN、TDN、TP、TDP、Chl.a、TSS、OSS、ISS浓度的影响;通过双因素方差分析,比较了实验结束时不同处理组间浮游植物、浮游动物和底栖动物的影响. 所有实验数据经Kolmogorov-Smirnov正态性检验和Levene's方差齐性检验, 必要时对数据进行lg x转换. 其中组内比较参照一元方差分析中Greenhouse-Giesser校正后的结果; 组间比较参照Tukey post-hoc方法的分析结果.
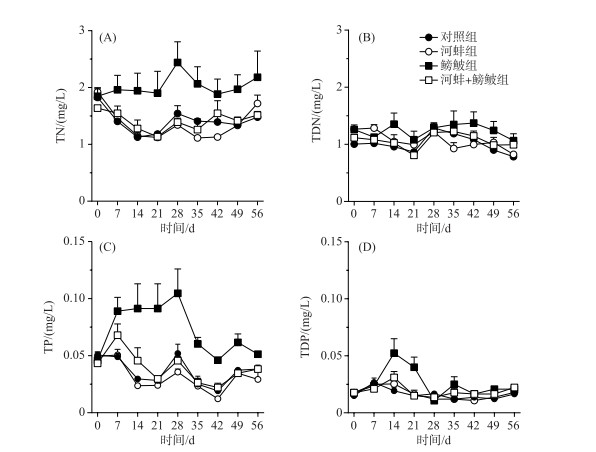
2 结果 2.1 上覆水营养盐实验期间, 鳑鲏与河蚌对水体TN浓度的影响显著, 而两者交互作用对TN浓度的影响不显著(表 1). 与对照组相比, 鳑鲏显著增加了水体TN浓度(F=8.7, P=0.019); 而河蚌组的TN浓度与对照组相近(F=0.1, P=0.7; 图 1A). 当河蚌与鳑鲏同时存在时, 河蚌的出现显著降低了鳑鲏对水体TN浓度的影响(鳑鲏+河蚌组vs鳑鲏组, F=8.6, P=0.019; 图 1A). 此外, 鳑鲏+河蚌组的水体TN浓度与河蚌组间无显著性差异(F=0.1, P=0.7). 水体TDN浓度并未受鳑鲏、河蚌以及两者交互作用的影响(表 1). 同时, 各实验处理组间的TDN浓度也均无显著差异(图 1B).
| 表 1 鳑鲏与河蚌对水体TN、TDN、TP、TDP、TSS、OSS、ISS和Chl.a浓度影响的双因子重复测量方差分析结果(rmANOVA) Tab. 1 Results of rmANOVA on the effects of mussel and bitterling treatments on total nitrogen (TN), total dissolved nitrogen (TDN), total phosphorus (TP), total dissolved phosphorus (TDP), total suspended solids (TSS), total organic suspended solids (OSS), total inorganic suspended solids (ISS), and chlorophyll-a (Chl.a, phytoplankton biomass) concentrations during the mesocosm experiment |
|
图 1 不同处理组的总氮、总溶解性氮以及总磷、总溶解性磷浓度随时间的变化趋势 Fig.1 Concentrations of total nitrogen, total dissolved nitrogen, total phosphorus and total dissolved phosphorus in different treatments during the experiment |
河蚌、鳑鲏以及两者的交互作用对水体TP浓度具有显著的影响(表 1). 鳑鲏组的TP浓度显著高于对照组(F=22.2, P=0. 002), 低于鳑鲏+河蚌组(F=18.8, P=0.002; 图 2). 河蚌组的TP浓度与对照组和河蚌+鳑鲏组间均无显著差异(图 1C). 此外, 仅鳑鲏对水体TDP浓度的影响显著, 河蚌以及鳑鲏与河蚌的交互作用对TDP浓度的影响均不显著(表 1). 鳑鲏组的TDP浓度显著高于对照组(F=11.9, P=0.009; 图 1D). 河蚌组的TDP与对照组和鳑鲏+河蚌组间均无显著差异(图 1D).
|
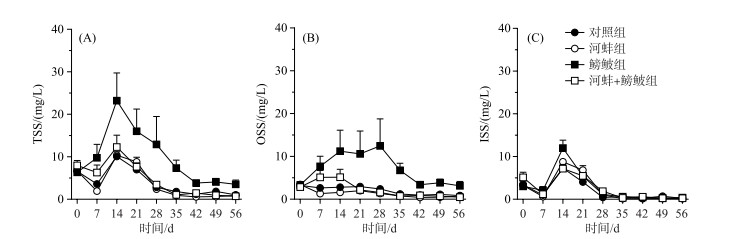
图 2 不同处理组的总悬浮质(TSS)、有机悬浮质(OSS)和无机悬浮质(ISS)浓度随时间的变化 Fig.2 Concentrations of total suspended solids (TSS), organic suspended solids (OSS) and inorganic suspended solids (ISS) in different treatments during the experiment |
实验期间, 河蚌和鳑鲏对TSS浓度的影响显著, 而两者的交互作用对TSS浓度的影响不显著(表 1). 鳑鲏组的TSS浓度显著高于对照组(F=20.9, P=0.002)和鳑鲏+河蚌组(F=23.2, P=0.001); 而河蚌组与对照组以及鳑鲏+河蚌组间的TSS浓度均无显著差异(图 2A). 鳑鲏显著引起OSS浓度升高, 其中鳑鲏组的OSS浓度显著高于对照组(F=17.95, P=0.003); 而河蚌的出现可显著降低鳑鲏引起的OSS浓度现象, 鳑鲏+河蚌组的OSS浓度显著低于鳑鲏组(F=25.03, P=0.001). 河蚌出现的处理组中, 无论是否有鳑鲏出现, 其各处理组间的OSS浓度均无显著差异(图 2B). 此外, 鳑鲏与河蚌的交互作用也并未显著影响OSS浓度(表 1). 鳑鲏、河蚌、鳑鲏与河蚌的交互作用对ISS浓度均无显著影响(表 1), 其中各实验处理组间的ISS浓度均无显著差异(P>0.05; 图 2C).
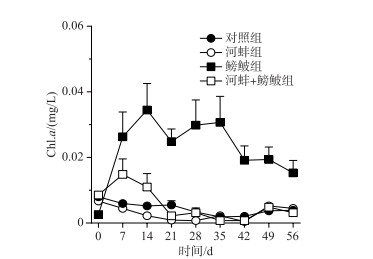
2.3 浮游植物鳑鲏、河蚌以及两者的交互作用均可显著影响水体Chl.a浓度(表 1). 实验期间, 鳑鲏组的Chl.a浓度显著高于对照组(F=31.8, P < 0.0001). 而当河蚌出现时, 鳑鲏+河蚌组的Chl.a浓度显著低于鳑鲏组(F=28.1, P=0.001). 河蚌组与对照组(F=0.2, P=0.7)和鳑鲏+河蚌组(F=0. 6, P=0.5)的Chl.a浓度均无显著差异(图 3).
|
图 3 不同处理组的水体Chl.a浓度 Fig.3 Concentrations of chlorophyll-a in different treatments during the experiment |
实验结束时, 与对照组相比, 鳑鲏显著增加了浮游植物的丰度(F=7.0, P=0.029)和生物量(F=7.0, P=0.03). 河蚌显著抑制了鳑鲏导致的浮游植物丰度和生物量增长, 表现为鳑鲏+河蚌组的浮游植物丰度(F=13.7, P=0.006)和生物量(F=24.7, P=0.001)均显著低于鳑鲏组(图 4). 此外, 河蚌组与对照组间的浮游植物也无显著差异(丰度F=2.6, P=0.14; 生物量F=3.5, P=0.1).

|
图 4 实验结束时不同处理组的浮游植物丰度和生物量 Fig.4 The abundance and biomass of phytoplankton in different treatments at the end of the experiment |
鳑鲏组的浮游植物以蓝藻门为主(优势种为束丝藻Aphanizomenon), 占总生物量的63 % ±28 %. 而河蚌的出现(鳑鲏+河蚌组), 降低了蓝藻门的比例(24 % ±41 %); 硅藻门(37 % ±21 %)和隐藻门(34 % ±31 %)的种类为该处理组的优势种, 其中硅藻门以针杆藻Synedra为主、隐藻门以蓝隐藻Chroomonas为主. 对照组和河蚌组的优势种均为隐藻门的隐藻, 分别占各组生物量的比例为48 % ±41 % 和56 % ±51 %.
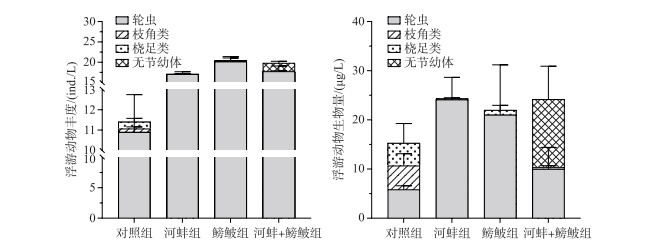
2.4 浮游动物鳑鲏显著增加了浮游动物的丰度(F=17.9, P=0.003), 而对浮游动物生物量无显著影响(F=0.06, P=0.80). 河蚌对浮游动物丰度(F=5.03, P=0.06)和生物量(F=1.2, P=0.31)的影响均不显著. 鳑鲏与河蚌的交互作用对浮游动物丰度的影响显著(F=6.7, P=0.032), 但对总生物量无显著影响(F=0.2, P=0.64).
实验结束时, 对照组中检出个体较大的枝角类(如长肢秀体溞Diaphanosoma leuchtenbergianum和透明薄皮溞Leptodora kindti), 但在鳑鲏出现的实验组中未检出枝角类. 而鳑鲏组的浮游动物丰度显著高于对照组(F=23.4, P=0.001), 生物量与对照组间无显著差异(F=0.3, P=0.62). 鳑鲏组以轮虫为主(优势种为螺形龟甲轮虫Keratella cochlearis和月型腔轮虫Lecane buna), 未检测到枝角类. 河蚌组与鳑鲏+河蚌组间的丰度(F=1.4, P=0.28)和生物量(F=0.03, P=0.87)均无显著差异(图 5). 河蚌组的浮游动物总丰度显著高于对照组(F=11.7, P=0.009), 而这2个处理组的生物量相近(F=1.2, P=0.3). 鳑鲏组与鳑鲏+河蚌组的浮游动物丰度(F=0.06, P=0.8)和生物量(F=0.2, P=0.7)均无显著差异(图 5).
|
图 5 实验结束时不同处理组的浮游动物丰度与生物量 Fig.5 The abundance and biomass of zooplankton in different treatments at the end of the experiment |
鳑鲏显著促进了底栖动物丰度上升(F=10.1, P=0.013), 而对生物量的影响不显著(图 6); 河蚌、鳑鲏与河蚌的交互作用对底栖动物的丰度和生物量均无显著影响(P>0.05).

|
图 6 实验结束时不同处理组底栖动物丰度和生物量 Fig.6 The abundance and biomass of benthic macroinvertebrates in different treatments at the end of the experiment |
实验结束时, 鳑鲏组的底栖动物总丰度显著高于对照组(F=8.04, P=0.022), 而两组间的生物量却无显著差异(F=4.9, P=0.058). 河蚌组与对照组(P>0.05)、河蚌组与鳑鲏+河蚌组(P>0.05)、鳑鲏组与鳑鲏+河蚌组(P>0.05)间的底栖动物丰度和生物量均无显著差异(图 6).
3 讨论在本研究中, 大鳍鱊(以下简称鳑鲏)引起水体营养盐浓度升高、浮游动物以小型种类轮虫为主、枝角类生物量下降. 鳑鲏驱动的营养盐供给增加与捕食压力下降, 最终导致浮游植物生物量显著升高, 增加了蓝藻的占比. 鳑鲏对ISS浓度无显著影响, 说明鳑鲏对沉积物的扰动作用较弱; 而鳑鲏可显著增加OSS和TSS浓度, 这说明鳑鲏主要通过影响OSS浓度的途径增加TSS浓度. 此外, 鳑鲏组的底栖动物总丰度显著高于对照组, 主要以水丝蚓为主.
背角无齿蚌抵消了部分鳑鲏对水生态系统造成的这些负面作用(如降低水体营养盐浓度、抑制浮游植物生物量上升等). 鳑鲏与河蚌的交互作用对水体TP、Chl.a、浮游植物生物量和浮游动物丰度的影响显著, 而对水体TN、TSS、浮游动物生物量以及底栖动物丰度和生物量均无显著影响.
3.1 大鳍鱊对水体理化因子的影响分析杂食性鱼类可通过排泄和扰动沉积物等方式影响水体营养盐浓度[6, 37-38], 其主要影响途径与鱼类的体型和摄食习性有关. 底栖杂食性鱼类体型较大, 主要以底栖动物为食(如摇蚊幼虫和水丝蚓), 其摄食活动可显著促进沉积物再悬浮, 增加水体无机悬浮质的浓度. 鱼类对沉积物的扰动越强, 其无机悬浮质的浓度也就越高. 因此, 无机悬浮质浓度常被用于评价鱼类对沉积物再悬浮的影响程度. 本研究中, 鳑鲏组的营养盐浓度显著高于对照组, 而无机悬浮质浓度却无显著差异, 这说明鳑鲏对沉积物的扰动作用较弱. 鳑鲏组中较高的氮、磷浓度则可能主要由鱼类排泄所致. 这与已有的鳑鲏鱼类(中华鳑鲏或大鳍鱊)对水体营养盐影响的结果一致[13-14]. 在本研究中, 鳑鲏可能主要通过摄食浮游动物、摇蚊幼虫和附着藻等途径加速营养盐循环. 因为, 相较于对照组, 鳑鲏组中未检出枝角类和摇蚊幼虫, 桡足类生物量低于对照组. 此外, 鳑鲏可摄食附着藻类[10], 这不但会减少附着藻类对水体营养盐的吸收, 通过摄食附着藻还会增加排泄营养盐, 最终导致水体营养盐浓度升高.
3.2 大鳍鱊对浮游生物的影响分析底栖杂食性鱼类(如鲫)可降低浮游动物生物量[6, 12]. 本研究中, 鳑鲏不但对浮游动物总生物量的影响不明显, 而且还显著增加了浮游动物的总丰度, 其中主要以小型浮游动物(轮虫)为主. 鱼类选择性摄食个体较大的浮游动物是引起浮游动物群落小型化的主要原因[39]. 在自然湖泊中, 鳑鲏可摄食大量的浮游动物[8]. 在本研究中, 鳑鲏组中未检出枝角类, 这与其他杂食性鱼类的研究结果一致[3].
鳑鲏引起的氮、磷浓度升高和捕食压力下降(小型浮游动物为主), 促进了浮游植物丰度和生物量的升高, 改变了浮游植物群落结构. 在其他杂食性鱼类研究中, 鱼类的出现也显著增加了浮游植物的丰度和生物量[6, 40-41]. 本研究中, 蓝藻门的束丝藻是鳑鲏组的绝对优势种, 而He等[6]发现, 底栖杂食性鱼类鲫降低了束丝藻的比例, 他们认为鱼类引起的沉积物再悬浮是引起束丝藻比例下降的主要原因, 因为浮游藻类的比例与水体ISS浓度呈显著负相关关系[42]. 而引起研究结果存在差异的主因可能主要与鳑鲏对ISS的浓度无显著影响有关.
3.3 大鳍鱊对底栖动物的影响分析底栖杂食性鱼类, 可降低底栖动物生物量[3, 43-44]. 然而, 鳑鲏并未显著影响底栖动物生物量, 反而鳑鲏组的底栖动物总丰度显著高于对照组. 水丝蚓是鳑鲏组底栖动物群落的优势种. 在前面的讨论中, 通过比较鳑鲏组与对照组间的ISS浓度差异认为鳑鲏对沉积物再悬浮的作用较弱, 这也反映了鳑鲏几乎不在沉积物表面摄食, 从而对水丝蚓的摄食压力较弱, 促进了水丝蚓的种群发展. 但这与底栖杂食性鱼类鲫对底栖动物生物量产生的影响不同, He等[3]发现鲫可显著降低底栖动物生物量. 此外, 鳑鲏组水丝蚓丰度升高可能还与鳑鲏引起的较高浮游植物生物量有关. 例如Cai等[45-46]的野外调查发现巢湖和太湖的水丝蚓生物量随浮游藻类生物量的增加而上升. 在原位受控实验中, 研究人员也发现浮游植物碎屑是水丝蚓的重要食物来源[47-48], 大量的浮游藻类碎屑可显著促进水丝蚓生物量增加[49]. 因此, 鳑鲏对水丝蚓较弱的捕食压力和鳑鲏驱动的较高初级生产力(浮游植物生物量上升)是引起底栖动物丰度显著高于对照组的主要原因.
3.4 河蚌对水质及生物群落的影响分析河蚌通过排泄可引起水体营养盐浓度升高[50-51], 而本研究中河蚌(河蚌组)未显著影响水体的氮、磷浓度, 说明在本实验中河蚌排泄对水体营养盐的影响较弱. 河蚌通过滤食可显著降低水体悬浮质浓度[18]和浮游植物的生物量[52]. 本研究中, 河蚌(河蚌+鳑鲏组)抑制了鳑鲏引起的水体营养盐浓度升高和浮游植物生物量上升的趋势, 降低了蓝藻在浮游植物群落中的占比. 但河蚌组的悬浮质和Chl.a浓度与对照组间无显著差异, 这可能与河蚌在清水态系统中对悬浮质和浮游植物生物量的影响较弱有关[18]. 底栖滤食性双壳类通过滤食浮游植物降低浮游动物的食物可得性和直接滤食浮游动物等途径, 可显著影响浮游动物的生物量[53], 而本研究中背角无齿蚌并未显著影响浮游动物的丰度和生物量; 而降低了枝角类和桡足类的生物量, 这与斑马贻贝等双壳类的研究结果一致[54].
3.5 对浅水湖泊生态修复的启示本研究对浅水湖泊生态修复具有一定的指导意义. 鳑鲏等小型杂食性鱼类种群在湖泊生态修复后恢复较快, 在肉食性鱼类捕食压力较弱时易发展为草型湖泊的优势鱼类[8]. 鳑鲏可引起水体营养盐浓度升高和浮游动物小型化, 从而促进浮游植物生长, 导致蓝藻发展成为优势种, 且这些负面影响随鳑鲏密度的升高而增强[49]. 因此, 鳑鲏对水生态系统产生的这些影响将直接或间接地影响沉水植物生长与繁殖. 此外, 鳑鲏还可直接摄食沉水植物[8]. 在本研究中, 虽然河蚌可削弱鳑鲏的这些负面影响, 但当鳑鲏密度逐渐升高时, 这种抵消作用可能会逐渐减弱. 因此, 在湖泊生态修复和管理中, 需监测鳑鲏等小型杂食性鱼类密度, 关注小型杂食性鱼类对水生态系统可能产生的负面影响. 为了达到生态修复效果长效与稳定运行的目标, 根据本文的研究结果, 建议通过物理(网簖等)和生物(如放养有效地肉食性鱼类)等方式将此类小型鱼类控制在较低的生物量水平.
4 结论1) 大鳍鱊(鳑鲏)引起TN、TP、悬浮质和Chl.a浓度升高, 而河蚌削弱了鳑鲏的这些负面影响. 鳑鲏与河蚌交互作用对TP和Chl.a浓度的影响显著.
2) 鳑鲏(鳑鲏组)促进了浮游植物丰度和生物量增加, 其中蓝藻门的束丝藻是浮游植物群落的优势种. 河蚌(鳑鲏+河蚌组)降低了浮游植物丰度、生物量和蓝藻的比例.
3) 鳑鲏显著增加了浮游动物总丰度, 而对浮游动物总生物量的影响不显著; 鳑鲏引起浮游动物群落以小型种类(轮虫)为主, 导致枝角类和桡足类生物量下降. 鳑鲏与河蚌交互作用对浮游动物丰度的影响显著, 而对生物量无显著影响.
4) 鳑鲏未显著影响底栖动物的生物量, 但促进了底栖动物丰度升高(以水丝蚓为主).
5) 背角无齿蚌抵消了鳑鲏对水质造成的部分负面影响. 主要表现为: 河蚌降低了水体营养盐和悬浮质浓度, 引起Chl.a和浮游植物生物量下降; 但河蚌对浮游动物和底栖动物生物量的影响不显著.
致谢: 感谢沈睿杰对受控实验的支持.
| [1] |
Gu J, Jin H, He H et al. Effects of small-sized crucian carp (Carassius carassius) on the growth of submerged macrophytes: Implications for shallow lake restoration. Ecological Engineering, 2016, 95: 567-573. DOI:10.1016/j.ecoleng.2016.06.118 |
| [2] |
Zhang XF, Mei XY, Gulati RD. Effects of omnivorous tilapia on water turbidity and primary production dynamics in shallow lakes: Implications for ecosystem management. Reviews in Fish Biology and Fisheries, 2017, 27(1): 245-254. DOI:10.1007/s11160-016-9458-6 |
| [3] |
He H, Han YQ, Li QS et al. Crucian carp (Carassius carassius) strongly affect C/N/P stoichiometry of suspended particulate matter in shallow warm water eutrophic lakes. Water, 2019, 11(3): 524. DOI:10.3390/w11030524 |
| [4] |
Qiu X, Mei XY, Vladimir R et al. Effects of common carp (Cyprinus carpio) on water quality in aquatic ecosystems dominated by submerged plants: a mesocosm study. Knowledge & Management of Aquatic Ecosystems, 2019, 420: 28. DOI:10.1051/kmae/2019017 |
| [5] |
He H, Liu XB, Liu XL et al. Effects of cyanobacterial blooms on submerged macrophytes alleviated by the native Chinese bivalve Hyriopsis cumingii: A mesocosm experiment study. Ecological Engineering, 2014, 71: 363-367. DOI:10.1016/j.ecoleng.2014.07.015 |
| [6] |
He H, Hu E, Yu JL et al. Does turbidity induced by Carassius carassius limit phytoplankton growth?A mesocosm study. Environmental Science and Pollution Research, 2017, 24(5): 5012-5018. DOI:10.1007/s11356-016-8247-z |
| [7] |
Zhang XF, Liu ZW, Jeppesen E et al. Effects of benthic-feeding common carp and filter-feeding silver carp on benthic-pelagic coupling: implications for shallow lake management. Ecological Engineering, 2016, 88: 256-264. DOI:10.1016/j.ecoleng.2015.12.039 |
| [8] |
Yu JL, Liu ZW, He H et al. Submerged macrophytes facilitate dominance of omnivorous fish in a subtropical shallow lake: implications for lake restoration. Hydrobiologia, 2016, 775: 97-107. DOI:10.1007/s10750-016-2717-7 |
| [9] |
Zhu YR, Liu HZ. Genetic diversity and the biogeographical process of Acheilognathus macropterus revealed by sequence variations of mitochondrial cytochrome b gene. Frontiers of Biology in China, 2007, 2: 450-455. DOI:10.1007/s11515-007-0069-4 |
| [10] |
Koutrakis ET, Kokkinakis AK, Tsikliras AC et al. Characteristics of the European bitterling Rhodeus amarus(Cyprinidae) in the Rihios river, Greece. Journal of Freshwater Ecology, 2003, 18: 615-624. DOI:10.1080/02705060.2003.9664003 |
| [11] |
Vanni MJ, Bowling AM, Dickman EM et al. Nutrient cycling by fish supports relatively more primary production as lake productivity increases. Ecology, 2006, 87: 1696-1709. DOI:10.1890/0012-9658(2006)87[1696:NCBFSR]2.0.CO;2 |
| [12] |
Gu J, He H, Jin H et al. Synergistic negative effects of small-sized benthivorous fish and nitrogen loading on the growth of submerged macrophytes-relevance for shallow lake restoration. Science of the Total Environment, 2018, 610: 1572-1580. DOI:10.1016/j.scitotenv.2017.06.119 |
| [13] |
Yu Q, Wang J, Liu Y. Effects of intensive Rhodeus sinensis culture on both nutritive salts and phytoplankton of water body. Acta Agriculturae Shanghai, 2014, 30(4): 52-56. [喻倩, 王金庆, 刘娅琴等. 高密度养殖鱼鳑鲏鱼对水体营养盐浓度和浮游植物群落的影响. 上海农业学报, 2014, 30(4): 52-56.] |
| [14] |
Yu JL, Xia ML, Kong M et al. A small omnivorous bitterling fish (Acheilognathus macropterus) facilitates dominance of cyanobacteria, rotifers and Limnodrilus in an outdoor mesocosm experiment. Environmental Science and Pollution Research, 2020, 27: 23862-23870. DOI:10.1007/s11356-020-08774-5 |
| [15] |
Shen JZ. Experimental investigations into some reproduction aspects of Chinese bitterling, Rhodeus sinensis. Journal of Huazhong Agricultural University, 2000, 19(5): 494-496. [沈建忠. 中华鳑鲏Rhodeus sinensis繁殖习性的初步观察. 华中农业大学学报, 2000, 19(5): 494-496. DOI:10.3321/j.issn:1000-2421.2000.05.022] |
| [16] |
Reynolds JD, Debuse VJ, Aldridge DC. Host specialisation in an unusual symbiosis: European bitterlings spawning in freshwater mussels. Oikos, 1997, 78(3): 539. DOI:10.2307/3545615 |
| [17] |
Smith C, Reynolds JD, Sutherland WJ et al. Adaptive host choice and avoidance of superparasitism in the spawning decisions of bitterling (Rhodeus sericeus). Behavioral Ecology and Sociobiology, 2000, 48(1): 29-35. DOI:10.1007/s002650000212 |
| [18] |
Wu ZK, Qiu XC, Zhang XF et al. Effects of Anodonta woodiana on water quality improvement in restoration of eutrophic shallow lakes. J Lake Sci, 2018, 30(6): 1610-1615. [吴中奎, 邱小常, 张修峰等. 富营养化浅水湖泊生态修复中背角无齿蚌(Anodonta woodiana)对水质改善的影响. 湖泊科学, 2018, 30(6): 1610-1615. DOI:10.18307/2018.0612] |
| [19] |
Johengen TH, Nalepa TF, Fahnenstiel GL et al. Nutrient changes in Saginaw bay, lake Huron, after the establishment of the zebra mussel (Dreissena polymorpha). Journal of Great Lakes Research, 1995, 21(4): 449-464. DOI:10.1016/S0380-1330(95)71058-9 |
| [20] |
Yang DM, Chen YW, Liu ZW et al. Top-down effects of Anodonta woodiana on nutrient concentration & phytoplankton community composition in a microcosm ecosystem. J Lake Sci, 2008, 20(2): 228-234. [杨东妹, 陈宇炜, 刘正文等. 背角无齿蚌滤食对营养盐和浮游藻类结构影响的模拟. 湖泊科学, 2008, 20(2): 228-234. DOI:10.18307/2008.0215] |
| [21] |
Gao HL, Qian X, Wu HF et al. Combined effects of submerged macrophytes and aquatic animals on the restoration of a eutrophic water body-A case study of Gonghu Bay, Lake Taihu. Ecological Engineering, 2017, 102: 15-23. DOI:10.1016/j.ecoleng.2017.01.013 |
| [22] |
Qin BQ. A large-scale biological control experiment to improve water quality in eutrophic Lake Taihu, China. Lake and Reservoir Management, 2013, 29(1): 33-46. DOI:10.1080/10402381.2013.767867 |
| [23] |
Liu ZW, Hu JR, Zhong P et al. Successful restoration of a tropical shallow eutrophic lake: Strong bottom-up but weak top-down effects recorded. Water Research, 2018, 146: 88-97. DOI:10.1016/j.watres.2018.09.007 |
| [24] |
Atkinson CL, Vaughn CC. Biogeochemical hotspots: Temporal and spatial scaling of the impact of freshwater mussels on ecosystem function. Freshwater Biology, 2015, 60(3): 563-574. DOI:10.1111/fwb.12498 |
| [25] |
Mills SC, Reynolds JD. The bitterling-mussel interaction as a test case for co-evolution. Journal of Fish Biology, 2003, 63: 84-104. DOI:10.1111/j.1095-8649.2003.00209.x |
| [26] |
Reichard M, Polac čik M, Tarkan AS et al. The bitterling-mussel coevolutionary relationship in areas of recent and ancient sympatry. Evolution, 2010, 64(10): 3047-3056. DOI:10.1111/j.1558-5646.2010.01032.x |
| [27] |
Ye SW, Li ZJ, Lek-Ang S et al. Community structure of small fishes in a shallow macrophytic lake (Niushan Lake) along the middle reach of the Yangtze River, China. Aquatic Living Resources, 2006, 19(4): 349-359. DOI:10.1051/alr:2007005 |
| [28] |
Cai YJ, Gong ZJ, Qin BQ. Standing crop and spatial distributional pattern of Mollusca in Lake Taihu, 2006-2007. J Lake Sci, 2009, 21(5): 713-719. [蔡永久, 龚志军, 秦伯强. 太湖软体动物现存量及空间分布格局(2006-2007年). 湖泊科学, 2009, 21(5): 713-719. DOI:10.18307/2009.0516] |
| [29] |
Hu HJ, Wei YX. The freshwater algae of China: Systematics, taxonomy and ecology. Beijing: Science Press, 2006. [胡鸿钧, 魏印心. 中国淡水藻类--系统、分类及生态. 北京: 科学出版社, 2006.]
|
| [30] |
Guiry MD, Guiry GM eds. AlgaeBase. Galway: World-wide electronic publication, National University of Ireland, 2017. URL: http://www.algaebase.org.
|
| [31] |
Reynolds RS. The ecology of freshwater phytoplankton. Cambridge: Cambridge University Press, 1984.
|
| [32] |
Jiang XZ, Du NS. Fauna sinica, crustacea, freshwater cladocera. Beijing: Science Press, 1979. [蒋燮治, 堵南山. 中国动物志.节肢动物门, 甲壳纲, 淡水枝角类. 北京: 科学出版社, 1979.]
|
| [33] |
Shen JR. Fauna sinica, crustacea, freshwater copepoda. Beijing: Science Press, 1979. [沈嘉瑞. 中国动物志.节肢动物门, 甲壳纲, 淡水桡足类. 北京: 科学出版社, 1979.]
|
| [34] |
Dumont HJ, Velde I, Dumont S. The dry weight estimate of biomass in a selection of Cladocera, Copepoda and Rotifera from the plankton, periphyton and benthos of continental waters. Oecologia, 1975, 19(1): 75-97. DOI:10.1007/BF00377592 |
| [35] |
Huang XF. Survey observation and analysis of lake ecology. Beijing: China Standard Press, 1999. [黄祥飞. 湖泊生态调查观测与分析. 北京: 中国标准出版社, 1999.]
|
| [36] |
Jin XC, Tu QY. The standard methods in lake eutrophication investigation. Beijing: China Environmental Science Press, 1990. [金相灿, 屠清瑛. 湖泊富营养化调查规范. 北京: 中国环境科学出版社, 1990.]
|
| [37] |
Attayde JL, Hansson LA. The relative importance of fish predation and excretion effects on planktonic communities. Limnology and Oceanography, 2001, 46(5): 1001-1012. DOI:10.4319/lo.2001.46.5.1001 |
| [38] |
Brabrand Å, Faafeng BA, Moritz NJP. Relative importance of phosphorus supply to phytoplankton production: Fish excretion versus external loading. Canadian Journal of Fisheries and Aquatic Sciences, 1990, 47(2): 364-372. DOI:10.1139/f90-038 |
| [39] |
Brooks JL, Dodson SI. Predation, body size, and composition of plankton. Science, 1965, 150(3692): 28-35. DOI:10.1126/science.150.3692.28 |
| [40] |
Havens KE. Fish-induced sediment resuspension: Effects on phytoplankton biomass and community structure in a shallow hypereutrophic lake. Journal of Plankton Research, 1991, 13(6): 1163-1176. DOI:10.1093/plankt/13.6.1163 |
| [41] |
Jeppesen E, S øndergaard M, Lauridsen TL et al. Biomanipulation as a restoration tool to combat eutrophication. Advances in ecological research. Amsterdam: Elsevier, 2012, 411-488. DOI:10.1016/b978-0-12-398315-2.00006-5 |
| [42] |
Roozen FCJM, L ürling M, Vlek H et al. Resuspension of algal cells by benthivorous fish boosts phytoplankton biomass and alters community structure in shallow lakes. Freshwater Biology, 2007, 52(6): 977-987. DOI:10.1111/j.1365-2427.2007.01729.x |
| [43] |
Miller SA, Crowl TA. Effects of common carp (Cyprinus carpio) on macrophytes and invertebrate communities in a shallow lake. Freshwater Biology, 2006, 51(1): 85-94. DOI:10.1111/j.1365-2427.2005.01477.x |
| [44] |
Weber MJ, Brown ML. Effects of common carp on aquatic ecosystems 80 years after "carp as a dominant": Ecological insights for fisheries management. Reviews in Fisheries Science, 2009, 17(4): 524-537. DOI:10.1080/10641260903189243 |
| [45] |
Cai YJ, Gong ZJ, Qin BQ. Benthic macroinvertebrate community structure in Lake Taihu, China: Effects of trophic status, wind-induced disturbance and habitat complexity. Journal of Great Lakes Research, 2012, 38(1): 39-48. DOI:10.1016/j.jglr.2011.12.009 |
| [46] |
Cai Y, Gong Z, Xie P. Community structure and spatiotemporal patterns of macrozoobenthos in Lake Chaohu (China). Aquatic Biology, 2012, 17(1): 35-46. DOI:10.3354/ab00455 |
| [47] |
Yu JL, Li YM, Liu XL et al. The fate of cyanobacterial detritus in the food web of Lake Taihu: A mesocosm study using 13C and 15N labeling. Hydrobiologia, 2013, 710(1): 39-46. DOI:10.1007/s10750-012-1205-y |
| [48] |
Yu JL, He H, Liu ZW et al. Carbon transfer from cyanobacteria to pelagic and benthic consumers in a subtropical lake: Evidence from a 13C labelling experiment. Water, 2019, 11(8): 1536. DOI:10.3390/w11081536 |
| [49] |
Xia ML, Yu JL, He H et al. Effects of cyanobacterial detritus on water quality and the biomass of periphyton and Limnodrilus spp. in Lake Taihu. J Lake Sci, 2020, 32(4): 1050-1059. [夏曼莉, 于谨磊, 何虎等. 太湖蓝藻碎屑对水质及附着藻和水丝蚓生物量的影响. 湖泊科学, 2020, 32(4): 1050-1059. DOI:10.18307/2020.0414] |
| [50] |
Coelho JP, Lilleb ø AI, Crespo D et al. Effect of the alien invasive bivalve Corbicula fluminea on the nutrient dynamics under climate change scenarios. Estuarine, Coastal and Shelf Science, 2018, 204: 273-282. DOI:10.1016/j.ecss.2018.03.001 |
| [51] |
Parr TB, Vaughn CC, Gido KB. Animal effects on dissolved organic carbon bioavailability in an algal controlled ecosystem. Freshwater Biology, 2020, 65(7): 1298-1310. DOI:10.1111/fwb.13438 |
| [52] |
Zhang XF, Liu ZW, Jeppesen E et al. Effects of deposit-feeding tubificid worms and filter-feeding bivalves on benthic-pelagic coupling: Implications for the restoration of eutrophic shallow lakes. Water Research, 2014, 50: 135-146. DOI:10.1016/j.watres.2013.12.003 |
| [53] |
Jack JD, Thorp JH. Effects of the benthic suspension feeder Dreissena polymorpha on zooplankton in a large river. Freshwater Biology, 2000, 44(4): 569-579. DOI:10.1046/j.1365-2427.2000.00609.x |
| [54] |
Thorp JH, Casper AF. Potential effects on zooplankton from species shifts in planktivorous mussels: A field experiment in the St Lawrence River. Freshwater Biology, 2002, 47(1): 107-119. DOI:10.1046/j.1365-2427.2002.00787.x |
 2021, Vol. 33
2021, Vol. 33 


