(2: 国家海洋环境监测中心, 大连 116023)
(3: 中国科学院大学, 北京 100049)
(2: National Marine Environmental Monitoring Center, Dalian 116023, P. R. China)
(3: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
植物是湿地生态系统重要组分和主要初级生产者,维持和承载着湿地生态系统各种各样的过程和功能[1]. 湿地中大量的挺水植物和湿生植物生产力非常旺盛,每年都会有大量的枯落物积累残留在湿地[2]. 这些枯落物分解是维持湿地生态系统能量流动、物质循环和养分平衡的关键生态过程[3-4],其分解速率的微弱变化都会直接影响到区域乃至全球的碳收支平衡[5]. 然而,影响湿地枯落物分解过程的因素非常多[6-7],调控机理也远比陆地生态系统的复杂[8-9].洪泛平原湿地枯水期地下水位、丰水期洪水淹没强度、频率和持续时间都是影响枯落物分解过程的重要因素[7, 10-12]. 然而,关于湿地水文条件年内剧烈转换对枯落物分解影响的研究还比较少,并且存在许多不一致的结论. Langhans等在意大利东北部湿地研究认为减少洪水淹没持续时间会降低黑杨(Populus nigra)叶枯落物分解速率[10],然而Tupacz等对大沼泽(Great Dismal Swamp)的研究表明增加淹水时长和淹水深度会降低植物枯落物及根系的分解速率[13]. 而我们在鄱阳湖湿地的研究结果却显示,短期出露和较浅积水频繁交替的区域枯落物分解及碳、氮、磷归还速率是最快的[7]. 上述研究虽然取得了许多重要成果,但是有关枯水期和丰水期水文条件季节性剧烈转换对湿地枯落物分解过程的影响尚有许多不清楚的问题需要研究.
鄱阳湖是我国最大的淡水湖,也是国际重要湿地,在维持长江洪泛平原生态系统独特生物群落方面发挥着重要作用[14]. 鄱阳湖受流域来水和长江水位双重影响,年内丰水期和枯水期时间界限非常明显、转换速度很快且水位落差非常大[15],这种独特的水文变化特征使得鄱阳湖具有大面积季节性出露和淹没交替的洲滩湿地. 在枯水期,这些洲滩全部露出水面,沿不同高程呈现出明显的地下水位梯度,在丰水期这些洲滩全部被洪水淹没,沿不同高程又呈现明显的淹水深度梯度. 灰化薹草(Carex cinerascens Kükenth)是鄱阳湖枯水期泥滩出露后最早发芽的植物之一,是鄱阳湖湿地分布面积最大的湿生草本植物,分布遍及湖岸到湖心水线之间全部洲滩[16],薹草每年都会在鄱阳湖湿地留下大量的枯落物.
许多在鄱阳湖湿地的研究只关注到了枯水期地下水位梯度[7]及土壤环境因素[17]对薹草枯落物分解的影响,而没有关注到枯水期和丰水期整个水文周期内薹草枯落物的分解过程,这不仅很难确定整个水文周期内薹草枯落物分解过程调控因子的转换,而且也往往会高估或者低估整个水文周期内的分解速率及养分释放速率. 因此,本文利用鄱阳湖洲滩湿地天然的地下水位梯度和淹水深度梯度,采取分解袋技术研究了鄱阳湖湿地枯水期和丰水期水文条件发生剧烈转换条件下薹草枯落物分解的动力学过程和碳、氮、磷释放动态特征的差异性,以期加深人们对洪泛湖泊湿地不同水文条件下生源要素生物地球化学循环过程的理解,为鄱阳湖湿地乃至长江中下游流域湖泊湿地基于水位调控下的生态系统管理提供新的认识和科学决策依据.
1 材料和方法 1.1 研究区域概况本研究在江西鄱阳湖南矶湿地国家级自然保护区典型的碟形湖泊白沙湖内开展(图 1). 该保护区位于鄱阳湖主湖区南部,地处赣江北支、中支和南支汇入鄱阳湖开放水域冲积形成的三角洲前缘,海拔在12~16 m(吴淞)之间[18]. 属亚热带暖湿型季风气候,夏季炎热多雨,冬季低温少雨. 受鄱阳湖季节性周期性水文变化的影响,保护区内有明显的丰水期和枯水期. 正常年份内,丰水期内保护区除总面积不足4 km2的南山岛和矶山岛两个人居岛屿外其他草洲均被洪水淹没,处于典型的湖相水文状态. 枯水期内湖水消退归入河道和一些碟形洼地,区内大小河流纵横,碟形湖泊星罗棋布,不同高程洲滩相继出露,整个三角洲地区呈现河、湖、洲交错的景观[18]. 这种特殊的水文节律使得保护区内形成了大量土壤肥沃、水热条件充裕的洲滩和浅滩,发育了丰富的湿生植物和水生植物,多样性极其丰富,其中以灰化薹草、南荻(Triarrhena lutarioriparia)、芦苇(Phragmites australis)等为优势种[16]. 白沙湖内每年9月水退后薹草“秋草”在大面积的洲滩上萌生,在11月中旬部分薹草就逐渐开始枯萎并分解;2月份过后在“秋草”尚未全部分解之前薹草“春草”会再次萌生,一直生长到5—6月才逐渐被湖水淹没,然后在水下休眠、死亡直至地上部分全部分解消失[16].
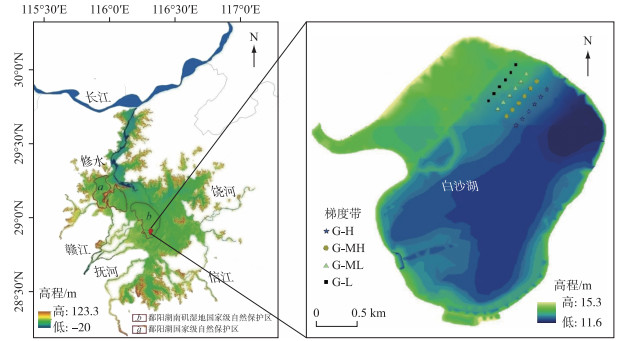
|
图 1 样点在鄱阳湖湿地中的位置 Fig.1 The location of sampling area in Lake Poyang wetland |
2018年2月上旬在白沙湖洲滩上,利用自然高程差选取4个水位梯度带,在枯水期4个梯度分别是G-L(低地下水位带,靠近湖岸,出露时间最长,枯水期出露的最早,地下水位约-50~-25 cm)、G-ML(中低地下水位带,枯水期地下水位约-25~-15 cm)、G-MH(中高地下水位带,枯水期地下水位约-15~-5 cm)、G-H(高地下水位带,靠近湖心水体,出露时间最短,枯水期出露的最晚,地下水位约-5~5 cm). 在丰水期这4个梯度又分别转变为G-L(浅淹水带,丰水期淹没的最晚,淹水深度约84~158 cm)、G-ML(中度浅淹水带,丰水期淹水深度约106~208 cm)、G-MH(中度深淹水带,丰水期淹水深度约122~258 cm)和G-H(深淹水带,丰水期淹没的最早,淹水深度约138~308 cm). 每个梯度带内选取6个样点埋上钢圈用于固定分解袋,样点之间相隔50 m左右(图 1). 受2018年鄱阳湖特大枯水年的影响,实验区域内丰水期持续时间比正常年份短且水位涨幅没有正常年份大,因此本研究的丰水期只持续40天左右,且最大淹水深度也只有300 cm左右.
将薹草枯落物用去离子水冲洗干净后剪成10 cm长小段混合均匀装入牛皮纸信封内,置于烘箱120℃杀青1 h后再调至60℃烘干72 h. 取一批薹草样品测量其初始养分含量,剩下的称量10 g分别装入孔径为0.15 mm、规格为15 cm×20 cm的白色网孔尼龙网袋中作为分解袋. 每个梯度随机取4个作为4个重复样点,将分解袋用绳子固定在预先设置的钢圈上,每个样点放置20个分解袋. 每个分解袋都充分地接触地表,绳子上的重物能保证当丰水期来临时分解袋仍能充分地贴近湖底. 分别于实验开始后的第10、20、40、60、90、120、150、180、240、270、330和420天从各样点回收1个分解袋,共回收12次(实验结束时每个样点剩8个分解袋留在原地).
每次将取回的分解袋除去泥土、苔藓等杂物并用去离子水冲洗干净后置于60℃烘箱中烘干至恒重,称量其残余干物质质量后再碾成粉末,分别密封于聚乙烯样品袋中待测. 全碳(TC)和全氮(TN)使用元素分析仪(Vario Max CN Analyzer,Elementar Analysensysteme GmbH,Germany)测定;全磷(TP)使用电感耦合等离子体发射光谱仪(Inductively Coupled Plasma Optical Emission Spectrometer(ICP-OES),Optima 5300DV,Perkin-Elmer,America)测定.
1.3 数据处理与统计分析薹草枯落物分解过程的评估参数用以下公式计算.
瞬时残留率(remaining rate, Rt)的计算公式为:
| $ {R_t} = \frac{{{M_t}}}{{{M_0}}} \times 100\% $ | (1) |
式中,Rt表示t时刻残留率,Mt表示t时刻重量,M0表示初始重量,t为枯落物分解进行的时间(下文中含义相同).
瞬时分解速率(instantaneous decomposition rate)用Olson负指数衰减模型计算[19]:
| $ {M_t} = {M_0} \cdot {{\rm{e}}^{ - k \cdot t}} $ | (2) |
式中,k表示t时枯落物的瞬时分解速率常数,k值越大枯落物的分解速度越快.
养分相对归还指数(relative return index,RRI)的计算公式为:
| $ RR{I_t} = \frac{{{M_0}\cdot{C_0} - {M_t}\cdot{C_t}}}{{{M_0}\cdot{C_0}}} \times 100\% $ | (3) |
式中,Ct为t时刻枯落物中某元素的浓度,C0为枯落物中某元素的初始浓度. CRRI表示碳相对归还指数(carbon relative return index),NRRI表示氮相对归还指数(nitrogen relative return index),PRRI表示磷相对归还指数(phosphorus relative return index). 当RRI为正数时表示枯落物分解过程中元素发生了净释放,当RRI为负数时则表示发生了净累积.
使用Excel 2016软件进行数据记录、计算和统计分析,使用SPSS 19.0软件在α=0.05的显著性水平上做单因素方差分析(ANOVA)和LSD多重比较,对薹草分解过程中各个参数在不同梯度下的差异性进行显著性检验. 使用Origin 9.0和Microsoft Visio软件制图.
2 结果与分析 2.1 干物质残留率及分解速率分异特征随着分解的进行,4个梯度的薹草枯落物干物质残留率逐渐减小(图 2A). 枯水期与丰水期之间的干物质残留率差异极其显著(G-L:F=6208.875,P < 0.0001;G-ML:F=7196.998,P < 0.0001;G-MH:F=2547.367,P < 0.0001;G-H:F=14040.608,P < 0.0001). 4个梯度带之间薹草枯落物干物质残留率都具有极显著的差异性(第10天:F=265.477,P < 0.0001;第20天:F=3746.400,P < 0.0001;第40天:F=1704.467,P < 0.0001;第60天:F=290.201,P < 0.0001;第90天:F=1108.988,P < 0.0001;第120天:F=166.906,P < 0.0001;第150天:F=10.376,P=0.001;第240天:F=147.879,P < 0.0001;第270天:F=538.599,P < 0.0001;第330天:F=81.947,P < 0.0001;第420天:F=27.161,P < 0.0001).
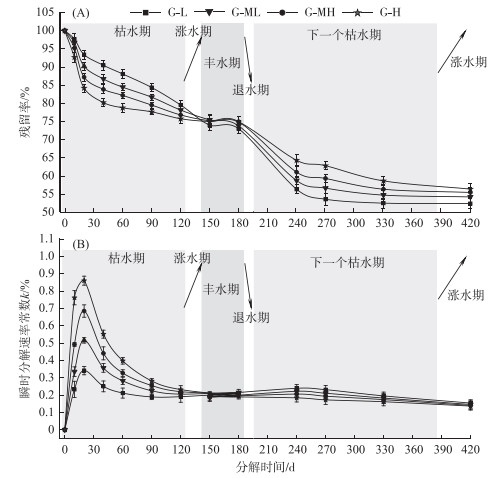
|
图 2 薹草枯落物干物质残留率及分解速率沿水位梯度的分异特征 Fig.2 Variations of dry mass remaining and decay rate during Carex decomposition along water gradients |
分解120天内(枯水期内),4个梯度的干物质残留率的大小关系为:G-L > G-ML > G-MH > G-H,第140天左右4个梯度的干物质残留率值基本都在73 % 左右,第150天以后(进入丰水期)其大小关系反转为:G-L < G-ML < G-MH < G-H. 分解到第420天时,G-L、G-ML、G-MH、G-H梯度干物质残留率分别约为52.37 %、54.20 %、55.43 % 和56.37 % (图 2A).
通过Olson负指数衰减模型计算出每个分解时间点的干物质瞬时分解速率常数k,结果表明:不同的分解时间点上,4个梯度薹草枯落物干物质的k值差异性都极其显著(G-L:F=59.732,P < 0.0001;G-ML:F=646.923,P < 0.0001;G-MH:F=1069.028,P < 0.0001;G-H:F=2414.463,P < 0.0001). 4个梯度的k值都表现出先快速增加后缓慢减小直至稳定的趋势,4个梯度带的最大k值出现在第20天,G-H、G-MH、G-ML、G-L的最大值依次约为0.34、0.52、0.68和0.86(图 2B).
分解0~420天内4个梯度带之间薹草枯落物干物质的k值都具有极显著的差异性(第10天:F=269.086,P < 0.0001;第20天:F=3976.155,P < 0.0001;第40天:F=1814.306,P < 0.0001;第60天:F=284.164,P < 0.0001;第90天:F=1092.007,P < 0.0001;第120天:F=169.375,P < 0.0001;第150天:F=10.414,P=0.001;第240天:F=144.186,P < 0.0001;第270天:F=481.186,P < 0.0001;第330天:F=80.293,P < 0.0001;第420天:F=27.429,P < 0.0001).
分解120天内(枯水期内)4个梯度的干物质k值大小关系为:G-L < G-ML < G-MH < G-H,第150天左右4个梯度的干物质k值均为0.19左右,第150天以后(进入丰水期)其大小关系反转为:G-L > G-ML > G-MH > G-H. 直到第420天时,G-L、G-ML、G-MH、G-H 4个梯度的干物质k值都约为0.15(图 2B).
2.2 碳、氮、磷相对归还指数分异特征在整个分解过程中4个梯度带碳元素都表现为净释放模式(CRRI > 0),随着分解的进行,4个梯度的CRRI都呈现出一直增大的趋势(图 3A). 分解120天内4个梯度带CRRI呈极显著性差异(第10天:F=248.630,P < 0.0001;第20天:F=1090.162,P < 0.0001;第40天:F=218.825,P < 0.0001;第60天:F=94.864,P < 0.0001;第90天:F=27.825,P < 0.0001;第120天:F=5.782,P=0.011). 在第150天时差异性不显著(F=0.073,P=0.973),第240~420天差异性显著(第240天:F=86.658,P < 0.0001;第270天:F=57.825,P < 0.0001;第330天:F=64.004,P < 0.0001;第420天:F=31.411,P < 0.0001). 分解第120天内4个梯度的CRRI大小关系为:G-L < G-ML < G-MH < G-H,第150天左右4个梯度的CRRI值均为27.5 % 左右,第150天以后其大小关系反转为:G-L > G-ML > G-MH > G-H. 分解第420天时,G-L、G-ML、G-MH和G-H梯度的CRRI值依次约为51.14 %、49.46 %、48.19 % 和46.86 % (图 3A).
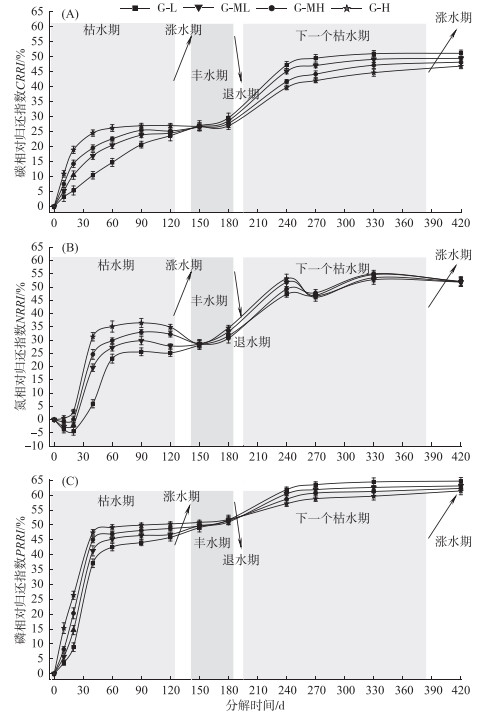
|
图 3 薹草枯落物碳、氮、磷相对归还指数沿水位梯度的分异特征 Fig.3 Variations of CRRI, NRRI and PRRI during Carex decomposition along water gradients |
G-L和G-ML两个梯度的氮元素在分解过程中表现出第0~20天净积累(NRRI < 0),第20~420天净释放(NRRI > 0)的模式;G-MH梯度表现为第0~10天净积累(NRRI < 0),第10~420天净释放(NRRI > 0)的模式;G-H梯度始终为氮的净释放模式. 随着分解的进行,4个梯度的NRRI都呈现出一直上下波动的曲线式上升趋势(图 3B). 分解120天以内,4个梯度带NRRI呈极显著性差异(第10天:F=12.035,P=0.001;第20天:F=18.683,P < 0.0001;第40天:F=161.429,P < 0.0001;第60天:F=50.936,P < 0.0001;第90天:F=44.717,P < 0.0001;第120天:F=14.971,P < 0.0001),在第150天时差异性不显著(F=0.205,P=0.891),第240~330天差异性显著(第240天:F=14.919,P < 0.0001;第270天:F=2.216,P=0.0139;第330天:F=3.819,P=0.039),第420天差异性不显著(F=0.025,P=0.994). 分解120天内4个梯度的NRRI大小关系为:G-L < G-ML < G-MH < G-H,第150天左右4个梯度的NRRI值均为28.5 % 左右,第150天以后其大小关系反转为:G-L > G-ML > G-MH > G-H. 但第150~420天4个梯度NRRI值都很接近,差值不大. 分解第420天时,G-L、G-ML、G-MH和G-H梯度NRRI值依次约为52.18 %、51.92 %、52.02 % 和51.99 % (图 3B).
4个梯度PRRI的变化趋势一致,在整个分解过程中磷元素都表现为净释放模式(PRRI > 0),并且PRRI在整个分解过程中都呈一直升高的趋势. 其中在40天内迅速升高,之后趋于稳定,直到第150天以后才再次缓慢上升(图 3C). 分解120天内4个梯度带PRRI呈极显著性差异(第10天:F=118.601,P < 0.0001;第20天:F=275.262,P < 0.0001;第40天:F=73.627,P < 0.0001;第60天:F=29.323,P < 0.0001;第90天:F=28.922,P < 0.0001;第120天:F=8.946,P=0.001),在第150天时差异性不显著(F=3.646,P=0.051),第240~420天差异性显著(第240天:F=25.468,P < 0.0001;第270天:F=32.460,P < 0.0001;第330天:F=72.953,P < 0.0001;第420天:F=8.166,P=0.003). 分解120天内4个梯度PRRI的大小关系为:G-L < G-ML < G-MH < G-H,第150天左右4个梯度的PRRI值均为50 % 左右,第150天以后其大小关系反转为:G-L > G-ML > G-MH > G-H. 分解第420天时,G-L、G-ML、G-MH、G-H梯度的PRRI值依次约为64.71 %、63.10 %、62.25 % 和61.41 % (图 3C).
2.3 碳、氮、磷化学计量比分异特征4个水位梯度带上的C/N比值随着分解时间呈波浪式变化的趋势,变化范围约为30.37~46.78,最大值和最小值都出现在G-H梯度上(图 4A). 分解40天内4个梯度带C/N比呈极显著性差异(第10天:F=9.695,P=0.002;第20天:F=23.643,P < 0.0001;第40天:F=21.383,P < 0.0001),第60天差异性不显著(F=3.109,P=0.067),第90~120天差异性显著(第90天:F=3.936,P=0.006;第120天:F=6.502,P=0.007),第150天差异性不显著(F=0.201,P=0.894),第240~420天差异性显著(第240天:F=79.278,P < 0.0001;第270天:F=46.832,P < 0.0001;第330天:F=3.819,P < 0.0001;第420天:F=5.056,P=0.017). 分解起始阶段4个梯度的C/N比相等,均为36.30,随着分解的进行C/N比发生波浪式变化. 分解20天内4个梯度C/N比的关系为:G-L > G-ML > G-MH > G-H,第40天时其关系反转为:G-L < G-ML < G-MH < G-H,在第60、90和150天时4个梯度C/N比的关系和梯度顺序没有关联,在第120天及第240~420天其关系均为G-L < G-ML < G-MH < G-H(图 4A).
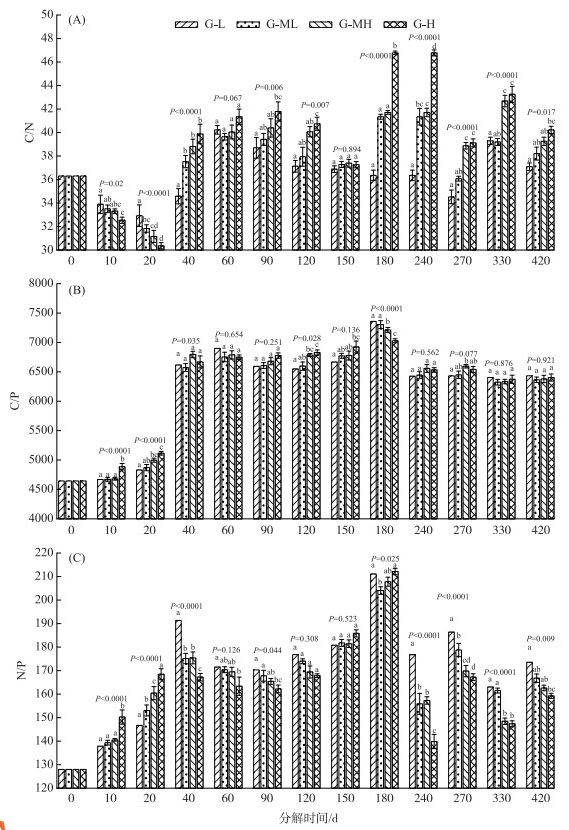
|
图 4 薹草枯落物分解过程中碳、氮、磷化学计量比沿水位梯度的分异特征 Fig.4 Variations of C, N and P stoichiometric ratio during Carex decomposition along water gradients |
4个水位梯度带上的C/P比值随着分解时间呈先上升再稳定的变化趋势,范围大约为4645.16~6922.57,没有明显的最大值,最小值即为初始值(图 4B). 分解40天内4个梯度带C/P比呈极显著性差异(第10天:F=24.007,P < 0.0001;第20天:F=20.471,P < 0.0001;第40天:F=3.965,P=0.035),第60~90天差异性不显著(第60天:F=0.555,P=0.654;第90天:F=1.558,P=0.251),第120天差异性显著(F=4.326,P=0.028),第150~420天差异性不显著(第150天:F=2.242,P=0.136;第240天:F=0.714,P=0.562;第270天:F=2.926,P=0.077;第330天:F=0.227,P=0.876;第420天:F=0.161,P=0.921). 分解起始阶段4个梯度的C/P比相等,均为4645.16,随着分解的进行C/P比开始上升并趋于稳定. 分解20天内4个梯度C/P比的大小关系为G-L < G-ML < G-MH < G-H,第40~60天其大小关系和梯度顺序没有关联,在第90~150天4个梯度C/P比的大小关系为G-L > G-ML > G-MH > G-H,在第240~420天其大小关系和梯度顺序没有关联(图 4B).
4个水位梯度带上的枯落物N/P比都表现出随着分解时间先增大再稍微变小后又稳定的变化趋势,变化范围在127.96~191.35之间,没有出现减少的情况(图 4C). 分解40天内4个梯度带N/P比呈极显著性差异(第10天:F=28.101,P=0.002;第20天:F=84.574,P < 0.0001;第40天:F=22.785,P < 0.0001),第60天差异性不显著(F=2.331,P=0.126),第90天差异性显著(第90天:F=3.650,P=0.044),第120~150天差异性不显著(第120天:F=1.337,P=0.308;第150天:F=0.790,P=0.523),第240~420天差异性极其显著(第240天:F=36.027,P < 0.0001;第270天:F=24.764,P < 0.0001;第330天:F=13.492,P < 0.0001;第420天:F=6.132,P=0.009). 分解起始阶段4个梯度的N/P比相等,均为127.96,随着分解的进行N/P比发生变化. 分解20天内4个梯度N/P比的大小关系为:G-L < G-ML < G-MH < G-H,第40~420天中除第150天外,其他时间点N/P比值的大小关系均反转为:G-L > G-ML > G-MH > G-H(图 4C).
3 讨论 3.1 枯水期和丰水期变换对薹草枯落物分解速率的影响分析无论在枯水期内(第0~120天)还是在丰水期内(第150~180天),4个梯度带之间薹草枯落物干物质残留率及k都具有极显著的差异性(P < 0.05). 在涨水期内(第120~150天),这种差异性不显著(P > 0.05),且其对应的值也都非常接近. 湿地枯落物分解过程一般会受到湿地的水分条件[7]、水流速度[20]、水温[21]和可获得溶解氧[22]、微生物[21]等环境因素的影响. 增加水分或者适合的水流速度可以增加枯落物中可溶解性物质的淋溶速度以及增加分解环境中的氧气,从而能够缩短养分淋溶和固持阶段的滞留时间,也能提升微生物对枯落物中养分的利用效率,从而促进分解. 我们前期的研究显示4个梯度带环境因素的差异性极显著[7, 17, 23],因此这4个梯度枯落物分解过程才有如此显著的差异性.
在枯水期内,4个梯度的干物质分解速率的大小关系为:G-H(高地下水位) > G-MH(中高地下水位) > G-ML(中低地下水位) > G-L(低地下水位),并且G-L梯度带分解速率明显比其他梯度带要小很多(在枯水期内G-H梯度带处于干湿频繁交替的状态,而G-MH、G-ML及G-L梯度带则长期处于出露状态). 这可能是地下水位、土壤pH值、容重、土壤全氮、土壤有机质、土壤砂粒含量及土壤微生物微等环境因子综合作用的结果[7]. 干湿频繁交替环境对枯落物分解产生的促进作用可能是由于这种条件能保持足够的土壤水分从而利于微生物/真菌定居和活动[24]. 这与前人的研究结论十分相似,认为淹水和出露频繁交替的湿地环境分解速度最快的原因是这种环境能促进微生物活性进而促进枯落物分解[25]. 还有另外一个重要的原因是干湿交替会显著增加枯落物的淋溶作用[26-27].
在丰水期内,干物质的分解速率大小关系与枯水期相比发生了反转,即为:G-L(浅淹水) > G-ML(中度浅淹水) > G-MH(中度深淹水) > G-H(深淹水)(在丰水期内G-L梯度带处于浅水淹没与偶尔出露交替的状态,而G-ML、G-MH及G-H梯度带则长期处于淹没状态). 这是因为在丰水期内4个梯度全部被不同深度的洪水淹没,影响枯落物分解过程的因素发生了巨大的变化. 这时影响枯落物分解的主要因素则变成了水体温度[21]、溶解氧可获得性[22]、微生物[21]及水流速度[20]等. 这些因素的差异基本上都是由淹水深度的不同造成的. 本研究中G-H、G-MH、G-ML及G-L 4个梯度带的水深依次减小,因此G-H梯度带上的分解袋在最深层的湖水中,而G-L梯度带在浅水区,分解袋也接近表层湖水.
鄱阳湖洪水期水温一般是随着深度的减小而升高的[28]. 一般在淹水条件下,湿地分解速率随水温的升高而增加[21, 29]. 这是因为增加水温可以通过促进可溶性化合物的淋溶浸出而直接提高分解率,或者通过增加微生物活性[21]和通过刺激无脊椎动物碎裂和消耗速度[30]而间接提高分解速率. 湖泊水体溶解氧一般是随着深度的减小而增加的. 氧气增加有利于好氧微生物呼吸,这是加速枯落物分解过程的重要因素[31]. 另外,受到风力以及湖泊水位涨落过程的影响,表层湖水流速较大且方向改变频繁,深层湖水流速较小,基本处于静水状态. 水流速度的增加会导致枯落物的物理碎裂程度增加,淋溶速度变快,也会使枯落物等承受的压力增加,从而将枯落物中难分解的部分转化为更不稳定/或可溶的物质,这种转化会导致分解速率的增加[20]. 而深层湖水中会静水条件或沉积物沉积造成的水流速度小和缺氧条件减缓了枯落物的分解过程[32]. 上述几个因素的综合作用下形成了本研究中呈现的现象,即浅淹水区枯落物分解速度最快,深淹水区分解速率最慢.
3.2 枯水期和丰水期变换对薹草枯落物分解过程中养分释放的影响因素分析枯落物的分解过程伴随着碳、氮、磷等养分元素的释放与迁移,一般情况下养分元素的归还与分解速率密切相关[33].所以本研究中碳、氮、磷相对归还指数也同样受到枯水期地下水位梯度和丰水期淹水深度的影响. 薹草枯落物碳、氮、磷相对归还指数表现出与干物质分解速率相似的差异规律,即:无论在枯水期内还是在丰水期内,4个梯度带之间薹草枯落物碳、氮、磷相对归还指数都具有极显著的差异性(P < 0.05). 在枯水期内,4个梯度的碳、氮、磷相对归还指数大小关系为:G-L < G-ML < G-MH < G-H,在丰水期内,这些参数的大小关系反转为:G-L > G-ML > G-MH > G-H;但是枯水期和丰水期过渡期内,4个梯度带之间这些参数的差异性均不显著(P > 0.05).
本研究中4个梯度带的CRRI都是在以先快后慢的模式持续地增加. 这是因为在分解初期的淋溶阶段溶解性有机碳快速发生淋溶,CRRI快速增加[34]. 随着淋溶作用的减弱,同时受外部环境因子的激发作用或者外源营养元素输入的影响[33],枯落物的分解速率会逐渐加快,土壤微生物数量变多、活力增强,这些微生物开始逐渐利用分解残留物中剩余木质素、纤维素和单宁等难分解物质中的碳. 此时CRRI的增加速度虽然开始减缓甚至开始减小,但是碳元素的释放却在持续进行[35].
本研究中虽然4个梯度带的NRRI高低波动起伏且有正有负,但整体表现为增加的趋势.这是由于在前期淋溶阶段NRRI会因含氮盐的快速流失而增大[36]. 但是在枯落物分解过程氮的释放和积累总是交替进行的. 因为氮元素更多的是以复杂且不易被淋溶的大分子蛋白质形式存在,微生物在分解这些大分子蛋白质时对氮元素需求的增加会固定大量的氮[37],NRRI增加速度会因此减缓,甚至会大幅下降成负数,从而发生氮元素的积累[38].
本研究中PRRI也都是以先快后慢的模式持续增加. 这是因为在薹草枯落物组织中的磷主要以磷酸根或化合物的形式存在,非常容易发生淋溶损失,因此分解残留物中磷归还速度在分解初期阶段就非常快,当易淋溶性的磷含量变少时磷归还速度就会趋于稳定[39]. 在分解后期枯落物中的难分解成分开始分解也会促进磷释放,但是释放速度明显地减缓,这可能是因为这些难分解成分中磷含量较少的原因.
4 结论无论在枯水期内还是在丰水期内,4个梯度带之间薹草枯落干物质残留率及分解速率都具有极显著的差异性. 在鄱阳湖枯水期内,湖盆高程差异引起的草洲出露时间及地下水位差异性是影响湿地植物枯落物分解过程的关键因子,靠近水体的草洲内枯落物的分解速率最快,靠近湖岸的分解速率最慢. 在鄱阳湖丰水期内,淹水深度和淹水时长是影响湿地植物枯落物分解过程的关键因子,较浅淹水区枯落物分解最快,较深淹水区域的枯落物分解最慢.
今后的研究应考虑分解袋中微生物群落动态变化以及不同深度水体理化性质对分解的影响,以揭示水文状况剧烈转换对湿地生物地球化学循环的影响机制.
| [1] |
Berg B, Mcclaugherty C eds. Plant litter-decomposition, humus formation, carbon sequestration. New Delhi: Springer-verlag Berlin Heidelberg, 2014.
|
| [2] |
Kuehn KA, Suberkropp K. Decomposition of standing litter of the freshwater emergent macrophyte Juncus effusus. Freshwater Biology, 1998, 40(4): 717-727. DOI:10.1046/j.1365-2427.1998.00374.x |
| [3] |
Mitsch WJ, Gosselink JG eds. Wetlands: 5th edition. New York: John Wiley & Sons, Inc, 2015.
|
| [4] |
Sun XL, Kong FL, Li Y et al. Effects of litter decomposition on contents and three-dimensional fluorescence spectroscopy characteristics of soil labile organic carbon in coastal wetlands of Jiaozhou Bay, China. Chinese Journal of Applied Ecology, 2019, 30(2): 563-572. [孙小琳, 孔范龙, 李悦等. 胶州湾滨海湿地枯落物分解对土壤活性有机碳含量及其三维荧光特性的影响. 应用生态学报, 2019, 30(2): 563-572. DOI:10.13287/j.1001-9332.201902.036] |
| [5] |
Roehm CL. Respiration in wetland ecosystems. Respirationin aquatic ecosystems. New York: Oxford University Press, 2005: 83-102. DOI:10.1093/acprof:oso/9780198527084.003.0006
|
| [6] |
Yue K, Peng CH, Yang WQ et al. Degradation of lignin and cellulose during foliar litter decomposition in an alpine forest river. Ecosphere, 2016, 7(10): 1-11. DOI:10.1002/ecs2.1523 |
| [7] |
Zhang QJ, Zhang GS, Yu XB et al. Effect of ground water level on the release of carbon, nitrogen and phosphorus during decomposition of Carex cinerascens Kükenth in the typical seasonal floodplain in dry season. Journal of Freshwater Ecology, 2019, 34(1): 305-322. DOI:10.1080/02705060.2019.1584128 |
| [8] |
Bradford MA, Berg B, Maynard DS et al. Understanding the dominant controls on litter decomposition. Journal of Ecology, 2016, 104(1): 229-238. DOI:10.1111/1365-2745.12507 |
| [9] |
Xie YJ, Xie YH, Xiao HY. Differential responses of litter decomposition to climate between wetland and upland ecosystems in China. Plant and Soil, 2019, 440(1/2): 1-9. DOI:10.1007/s11104-019-04022-z |
| [10] |
Langhans SD, Tockner K. The role of timing, duration, and frequency of inundation in controlling leaf litter decomposition in a river-floodplain ecosystem (Tagliamento, northeastern Italy). Oecologia, 2006, 147(3): 501-509. DOI:10.1007/s00442-005-0282-2 |
| [11] |
Zhang LH, Zeng CS, Zhang WJ et al. Litter decomposition and its main affecting factors in tidal marshes of Minjiang River estuary, East China. Chinese Journal of Applied Ecology, 2012, 23(9): 2404-2410. [张林海, 曾从盛, 张文娟等. 闽江河口湿地枯落物分解及主要影响因子. 应用生态学报, 2012, 23(9): 2404-2410. DOI:10.13287/j.1001-9332.2012.0333] |
| [12] |
Yuan QY, Xie ZQ, Yang LS et al. Decomposition of herbaceous species in reservoir riparian region of Three Gorges Reservoir under flooding condition. Chinese Journal of Applied Ecology, 2014, 25(8): 2229-2237. [袁庆叶, 谢宗强, 杨林森等. 水淹条件下三峡水库消落带常见草本植物的分解. 应用生态学报, 2014, 25(8): 2229-2237. DOI:10.13287/j.1001-9332.20140530.002] |
| [13] |
Tupacz EG, Day FP. Decomposition of roots in a seasonally flooded swamp ecosystem. Aquatic Botany, 1990, 37(3): 199-214. DOI:10.1016/0304-3770(90)90070-2 |
| [14] |
Wang YY, Molinos JG, Shi LL et al. Drivers and changes of the Poyang lake wetland ecosystem. Wetlands, 2019, 39(1): 35-44. DOI:10.1007/s13157-019-01180-9 |
| [15] |
Dai X, He Z, Wan RR et al. Variation of seasonal water-level fluctuations in river-connected lakes in the middle reaches of Yangtze River in the recent three decades. Resources and Environment in the Yangtze Basin, 2017, 26(1): 118-125. [戴雪, 何征, 万荣荣等. 近35a长江中游大型通江湖泊季节性水情变化规律研究. 长江流域资源与环境, 2017, 26(1): 118-125. DOI:10.11870/cjlyzyyhj201701014] |
| [16] |
Zhang QJ, Yu XB, Qian JX et al. Distribution characteristics of plant communities and soft organic matter and main nutrients in the Poyang Lake Nanji Wetland. Acta Ecologica Sinica, 2012, 32(12): 3656-3669. [张全军, 于秀波, 钱建鑫等. 鄱阳湖南矶湿地优势植物群落及土壤有机质和营养元素分布特征. 生态学报, 2012, 32(12): 3656-3669. DOI:10.5846/stxb201111201768] |
| [17] |
Zhang GS, Yu XB, Xu J et al. Effects of environmental variation on stable isotope abundances during typical seasonal floodplain dry season litter decomposition. Science of the Total Environment, 2018, 630: 1205-1215. DOI:10.1016/j.scitotenv.2018.02.298 |
| [18] |
Liu X, Hu B, Fan S. Comprehensive and scientific survey of Jiangxi Nanjishan Wetland Nature Reserve. Beijing: China Forestry Publishing House, 2005. [刘信中, 樊三宝, 胡斌华. 江西南矶湿地自然保护区综合科学考察. 北京: 中国林业出版社, 2005.]
|
| [19] |
Olson JS. Energy storage and the balance of producers and decomposers in ecological systems. Ecology, 1963, 44(2): 322-331. DOI:10.2307/1932179 |
| [20] |
Santos Fonseca AL, Bianchini I, Pimenta CMM et al. The flow velocity as driving force for decomposition of leaves and twigs. Hydrobiologia, 2013, 703(1): 59-67. DOI:10.1007/s10750-012-1342-3 |
| [21] |
Ferreira V, Chauvet E. Synergistic effects of water temperature and dissolved nutrients on litter decomposition and associated fungi. Global Change Biology, 2011, 17(1): 551-564. DOI:10.1111/j.1365-2486.2010.02185.x |
| [22] |
Passerini MD, Cunha-Santino MB, Bianchini I Jr. Oxygen availability and temperature as driving forces for decomposition of aquatic macrophytes. Aquatic Botany, 2016, 130: 1-10. DOI:10.1016/j.aquabot.2015.12.003 |
| [23] |
Zhang GS, Yu XB, Zhang QJ et al. Variation in the distribution of soil microbial community structure along ground water level gradients in the Poyang Lake Wetland. Acta Ecologica Sinica, 2018, 38(11): 3825-3837. [张广帅, 于秀波, 张全军等. 鄱阳湖湿地土壤微生物群落结构沿地下水位梯度分异特征. 生态学报, 2018, 38(11): 3825-3837. DOI:10.5846/stxb201705220946] |
| [24] |
Neckles HA, Neill C. Hydrologic control of litter decomposition in seasonally flooded prairie marshes. Hydrobiologia, 1994, 286(3): 155-165. DOI:10.1007/BF00006247 |
| [25] |
Battle JM, Golladay SW. Hydroperiod influence on breakdown of leaf litter in cypress-gum wetlands. The American Midland Naturalist, 2001, 146(1): 128-145. DOI:10.1674/0003-0031(2001)146[0128:hiobol]2.0.co;2 |
| [26] |
Glazebrook HS, Robertson AI. The effect of flooding and flood timing on leaf litter breakdown rates and nutrient dynamics in a river red gum (Eucalyptus camaldulensis) forest. Austral Ecology, 1999, 24(6): 625-635. DOI:10.1046/j.1442-9993.1999.00992.x |
| [27] |
Qin SJ, Liu JS, Zhou WM et al. Dynamics of initial decomposition of Calamagrostis angustifolia litter in Sanjiang Plain of China. Chinese Journal of Applied Ecology, 2008, 19(6): 1217-1222. [秦胜金, 刘景双, 周旺明等. 三江平原小叶章湿地枯落物初期分解动态. 应用生态学报, 2008, 19(6): 1217-1222.] |
| [28] |
Xu HS, Ouyang XF. Water temperature in Poyang Lake. Oceanologia et Limnologia Sinica, 1989, 20(4): 343-353. [徐火生, 欧阳幸福. 鄱阳湖的水温. 海洋与湖沼, 1989, 20(4): 343-353. DOI:10.3321/j.issn:0029-814X.1989.04.002] |
| [29] |
Sun ZG, Mou XJ, Liu JS. Effects of flooding regimes on the decomposition and nutrient dynamics of Calamagrostis angustifolia litter in the Sanjiang Plain of China. Environmental Earth Sciences, 2012, 66(8): 2235-2246. DOI:10.1007/s12665-011-1444-7 |
| [30] |
Azevedo-Pereira HVS, Graça MAS, González JM. Life history of Lepidostoma hirtum in an Iberian stream and its role in organic matter processing. Hydrobiologia, 2006, 559(1): 183-192. DOI:10.1007/s10750-005-1267-1 |
| [31] |
Robinson CT, Gessner MO. Nutrient addition accelerates leaf breakdown in an alpine springbrook. Oecologia, 2000, 122(2): 258-263. DOI:10.1007/PL00008854 |
| [32] |
Chauvet E. Influence of the environment on willow leaf litter decomposition in the alluvial corridor of the Garonne River. Arch Hydrobiol, 1988, 112(1): 371-386. |
| [33] |
Zhang GS, Yu XB, Gao Y et al. Effects of water table on cellulose and lignin degradation of Carex cinerascens in a large seasonal floodplain. Journal of Freshwater Ecology, 2018, 33(1): 311-325. DOI:10.1080/02705060.2018.1459324 |
| [34] |
Lan Y, Cui BS, You ZY et al. Litter decomposition of six macrophytes in a eutrophic shallow lake (Baiyangdian Lake, China). CLEAN - Soil, Air, Water, 2012, 40(10): 1159-1166. DOI:10.1002/clen.201200056 |
| [35] |
Davis SE, Corronado-molina, Carlos et al. Temporally dependent C, N, and P dynamics associated with the decay of rhizophora mangle l. leaf litter in oligotrophic mangrove wetlands of the southern everglades. Aquatic Botany, 2003, 75(3): 199-215. DOI:10.1016/S0304-3770(02)00176-6 |
| [36] |
Shilenkova OL, Tiunov AV. Soil-litter nitrogen transfer and changes in δ13C and δ15N values in decomposing leaf litter during laboratory incubation. Pedobiologia, 2013, 56(3): 147-152. DOI:10.1016/j.pedobi.2013.03.004 |
| [37] |
Aber JD, Melillo JM. Litter decomposition: Measuring relative contributions of organic matter and nitrogen to forest soils. Canadian Journal of Botany, 1980, 58(4): 416-421. DOI:10.1139/b80-046 |
| [38] |
Wu HT, Lu XG, Yang Q et al. Early-stage litter decomposition and its influencing factors in the wetland of the Sanjiang Plain, China. Acta Ecologica Sinica, 2007, 27(10): 4027-4035. DOI:10.1016/S1872-2032(07)60088-2 |
| [39] |
Wrubleski DA, Murkin HR, van der Valk AG et al. Decomposition of emergent macrophyte roots and rhizomes in a northern prairie marsh. Aquatic Botany, 1997, 58(2): 121-134. DOI:10.1016/S0304-3770(97)00016-8 |
 2021, Vol. 33
2021, Vol. 33 

