(2: 江苏省地理信息资源开发与利用协同创新中心, 江苏省水土环境生态修复工程实验室, 江苏省环境演变与生态建设重点实验室, 南京 210023)
(2: Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Jiangsu Key Laboratory of Environmental Change and Ecological Construction, Jiangsu Engineering Lab of Water and Soil Eco-remediation, Nanjing 210023, P. R. China)
甲烷(CH4)是第二大温室气体,其在大气中的含量增多是引起温室效应的主要元凶,单分子CH4的温室效应是单分子二氧化碳(CO2)的25倍,对目前温室效应的贡献率达20 %,在全球气候变暖中扮演了重要的角色[1-2]. 湖泊作为全球CH4的重要自然排放源之一,尽管湖泊面积占地球陆地表面积仅为3.7 %,但其释放量占全球的CH4自然排放比高达6 % ~16 % [3-4]. 因此湖泊CH4的产生和消耗过程对于大气中CH4的浓度以及热量收支具有重要意义[4-5]. 近年来,关于富营养化湖泊CH4的产生、排放等问题也逐渐成为研究热点.
受气候变暖和人为活动的双重影响,富营养化湖泊蓝藻水华频繁暴发,研究指出,温度的升高以及CO2等温室气体的浓度水平强烈影响蓝藻水华爆发的频率、强度和持续时间[6-7]. 另一方面,在过去的几个世纪里,大规模的土地利用以及人类活动改变营养盐循环,导致大量的氮(N)、磷(P)等营养盐排入湖泊水体,进而导致富营养化成为主要的淡水环境问题之一[8]. 蓝藻的衰亡、腐解过程对湖泊生态系统造成的影响,实则是藻源性有机物厌氧代谢驱动的C、N、P和S等元素的生物地球化学过程, 这是由于蓝藻的聚积直接影响了水体的氧化还原环境. 当蓝藻开始衰亡分解后,大量消耗溶解氧(DO),使水体快速转变为厌氧强还原状态[9-10],改变水体的微生物群落结构[11]. 蓝藻水华的暴发会促进CH4的产生与排放,主要是因为蓝藻水华的衰亡分解会提高有机碳含量和矿化率,同时释放的营养物质也会导致产甲烷菌(methanogenic bacteria, MPB)生物量的增长和活性的增强[12]. 环境中的DO或者氧化还原电位(ORP)是CH4产生与氧化过程中的关键影响因素,当蓝藻残体逐渐沉降至沉积物表层,其厌氧代谢伴随着沉积物中C、N、P、S的一系列氧化还原反应,直接影响了湖泊有机物的矿化过程[9]. 同时,释放的有机物质使得水解细菌、产氢产乙酸细菌以及产甲烷细菌等丰度增加, 进一步促进了CH4的排放[12].
近年来,全球范围内淡水水体硫酸盐(SO42-)浓度的不断提高,以富营养化湖泊太湖为例,湖泊上覆水中的SO42-浓度从1950s的30 mg/L逐年上升,到2010s达到了96 mg/L,并有持续上升的趋势[13-14]. 湖泊中的硫主要包括以下来源:流域含硫岩石的风化作用以及陆源有机硫的氧化作用[15];酸沉降将大气中的SO42-和SO2以酸雨的形式进入淡水湖泊中[16],东欧和亚洲酸沉降都有增加的趋势,东南亚和东亚的酸沉降在30~85 kg SO42--S/(hm2 ·a)之间,据IPCC的悲观估计,到2030年东南亚酸沉降将达到88 kg SO42--S/(hm2 ·a),东亚130 kg SO42--S/(hm2 ·a),南亚最高达150 kg SO42--S/(hm2 ·a)[17];据估计海洋沉积物中25 % ~50 % 的有机碳矿化是通过硫酸盐还原完成的,且硫酸盐还原途径还可以消耗已经产生的CH4[18-22]. 而湖泊中SO42-浓度比海洋生态系统中低2~3个数量级,一般小于800 μmol/L,在淡水湖泊中该过程对CH4排放的抑制作用容易被忽视[23-24]. 但随着湖泊富营养化加剧,同时湖泊水体中的SO42-浓度的逐年升高,导致湖泊沉积物中的SO42-浓度升高,硫酸盐还原过程对富营养化湖泊产甲烷以及对碳循环影响可能远远超过以往的认知.
为探究SO42-浓度对蓝藻衰亡过程中CH4产生的影响,本实验拟以太湖为研究背景,通过构建微宇宙系统,分析不同初始SO42-浓度下,蓝藻聚积衰亡过程中,水体理化指标以及SO42-与∑S2-浓度变化趋势,以期为精准评估富营养化湖泊CH4释放通量提供科学依据.
1 材料与方法 1.1 样品采集与处理蓝藻和沉积物于2019年11月,从太湖西北部符渎港附近(31°14′45.61″N, 120°0′45.01″E)采集,其中,蓝藻采用25号筛绢浮游生物网采集,沉积物使用彼得森采泥器,挑拣出大颗粒杂质以及植物残体后,混匀,待用;根据前期的调查结果,采集低硫酸盐浓度的上覆水体后,速运回实验室0~4℃保存,过孔径为0.15 mm的筛网后,混匀,待用. 初始蓝藻组成、上覆水体以及沉积物理化指标相关数据见表 1、2.
| 表 1 蓝藻的组成成分 Tab. 1 Composition of cyanobacteria |
| 表 2 上覆水体及沉积物初始理化指标 Tab. 2 Initial physical and chemical indexes of overlying water and sediment |
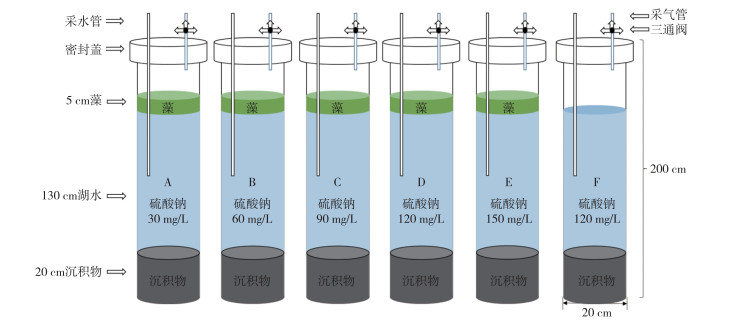
通过野外采集的样品构建A~E五组微宇宙系统,如图 1所示. 向每根直径20 cm,高200 cm的实验系统中先后加入过滤、混匀后含水率为38.17 % 的沉积物6.28 L,使得沉积物高度为20 cm. 同时加入体积为40.8 L的湖水,使得高度为130 cm. 在(30±2)℃条件下预培养,稳定化2周. 根据太湖水体的SO42-浓度历年变化趋势,将A~E五组实验系统中水体的SO42-浓度分别配置为A:30 mg/L,B:60 mg/L,C:90 mg/L,D:120 mg/L,E:150 mg/L,然后加入含水率为99 %,体积为1.57×10-3 m3的新鲜蓝藻,使得系统中的藻堆积密度达到5 g/cm2,高度为5 cm. 并设置初始SO42-浓度为90 mg/L的无蓝藻组F,系统稳定化两周后进行实验. 通过预埋采水管和采气管用以采集水样和气样. 实验开始后,分别于第0.5、1、2、3、4、5、6、7、8、9、11、13、17和21天采集水样以及气样.
|
图 1 模拟湖泊蓝藻水华衰亡的微宇宙系统示意图 Fig.1 Microcosm system simulating the decay of cyanobacteria bloom of a lake |
采样时,用注射器分上下中3层抽取顶空部分气体各10 mL,分别注入已抽真空的气袋中,待分析. 同样,采用虹吸法分上中下3层将实验系统中的水样抽取进已进行过氮吹的采水瓶中,避免水样复氧,每次每层取水量为200 mL,并在取样后添加相应体积等浓度硫酸盐的水进入系统. 取出的水样均经过0.45 μm滤膜过滤后,测定SO42-浓度、∑S2-浓度、总磷(TP)、总氮(TN)、溶解氧(DO)、氧化还原电位(ORP)和溶解性有机碳(DOC).
1.2 分析测试方法蓝藻取回后冷冻干燥,采用GB/T 6433-2006/ISO 6492:1999测定粗脂肪,凯式定氮法(GB/T 6432-2018)测定蛋白质,多糖的测定使用苯酚硫酸法(NY/T 1676-2008). DO、ORP使用水质测定仪(YSI, Professional plus, USA)测量,待读数稳定后,记录相应数值.
SO42-浓度参照Tabatabai的浊度比色法进行测定[25],称取0.15 g明胶溶解于50 mL的沸水中,再加入2 g BaCl2 ·2H2O搅拌溶解后,加入50 mL 0.5 mol/L的盐酸溶液,制备成稳定剂,吸取100 μL的稳定剂和过0.45 μm膜后100 μL的水样加入96孔酶标板中,将酶标板振荡60 min后,上酶标仪于450 nm处测定吸光值.
∑S2-浓度用亚甲基蓝比色法测定[26],称取50 g ZnAc2 ·2H2O和12.5 g NaAc ·3H2O溶于去离子水中,定容至1000 mL,配成乙酸锌-乙酸钠溶液;称取2 g N, N-二甲基对苯二胺盐酸盐溶于200 mL去离子水中,缓慢加入200 mL浓硫酸,冷却后用水稀释,定容至1000 mL,配置成N,N-二甲基对苯二胺溶液,装入密闭棕色容量瓶中;称取25 g Fe(NH4)(SO4)2 ·12H2O溶于含有5 mL浓硫酸的150 mL去离子水中,用去离子水稀释至250 mL,装入容量瓶中,配置成硫酸铁铵溶液(10 %). 测样时依次在96孔的酶标板中加入60 μL的乙酸锌-乙酸钠,120 μL过0.45 μm膜的水样,30 μL的N,N-二甲基对苯二胺以及20 μL的硫酸铁铵,将酶标板振荡30 min后,上酶标仪于665 nm处测定吸光值.
溶解性总磷(DTP)浓度的测定使用GB 11893-1989钼酸铵分光光度法,DTN浓度的测定使用GB 11894-1989碱性过硫酸钾消解紫外分光光度法. DOC浓度用C/N分析仪(analytik multi N/C 3100)测定,在炉温800℃下,每次进样量为300 μL,测得相应的数值.
CH4含量用气相色谱仪(Aglient, 7890B)测定[27],检测器为火焰离子检测器(FID)和电子捕获检测器(ECD). 炉温、FID、ECD检测器温度分别为55、200、300℃. 选用99.999 % 的高纯氮气作为载气,流速为2 mL/min;选用高纯氢和空气作为燃气,流速分别为40、400 mL/min,CH4的检出限为0.13 μg/L,误差范围1 % 以内.
数据作图及分析数据使用A~E五组实验系统中,整个培养周期里的相关数据,分别采用Origin 8.0和SPSS 18.0软件,相关性分析采用Pearson检验法.
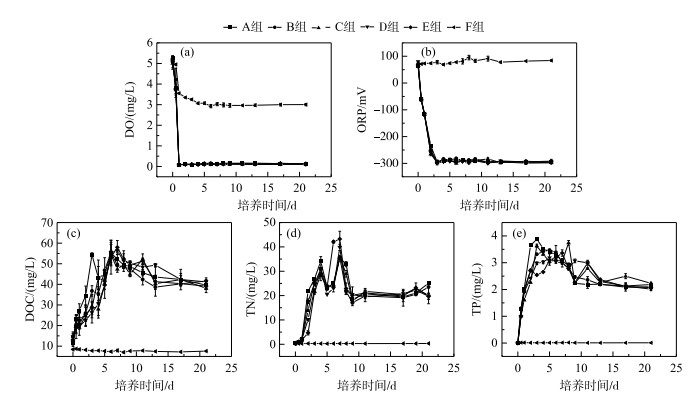
2 结果与分析 2.1 水体中DO、ORP以及溶解性有机碳、氮、磷浓度的动态变化随着蓝藻的聚集衰亡,A~E五组实验系统水体中TN、TP和DOC浓度显著升高(图 2a~c),同时水体中的DO浓度、ORP迅速降低(图 2d, 2e),且五组实验系统之间无明显差异. DO浓度在加藻后0~2 d急剧下降到最低值(< 0.9 mg/L),此后稳定维持在这一水平(图 2d),ORP在加藻后0.5 d内下降到-120~-110 mV,2 d后降至-270~-230 mV(图 2e). TN、TP浓度在0~4 d上升速率最快,A组中的TN浓度在第4天时最高为34.17 mg/L(图 2b),TP浓度在第3天时达到最高,为3.88 mg/L(图 2c). 水体中的DOC浓度在0~6 d上升的速率最快,在第6天时,B组中的DOC浓度最高,为55.46 mg/L(图 2a). 蓝藻聚积衰亡过程中,DOC、TP和TN浓度大幅度上升,而DO浓度、ORP大幅度下降,并使水体达到强厌氧还原状态. F组除了DO浓度在初期有小幅下降之外,ORP、DOC、TN以及TP浓度无明显变化.
|
图 2 水中DO、ORP以及溶解性有机碳、氮、磷浓度的动态变化 Fig.2 The dynamics of DO, ORP and dissolved organic carbon, nitrogen, phosphorus concentrations in the overlying water |
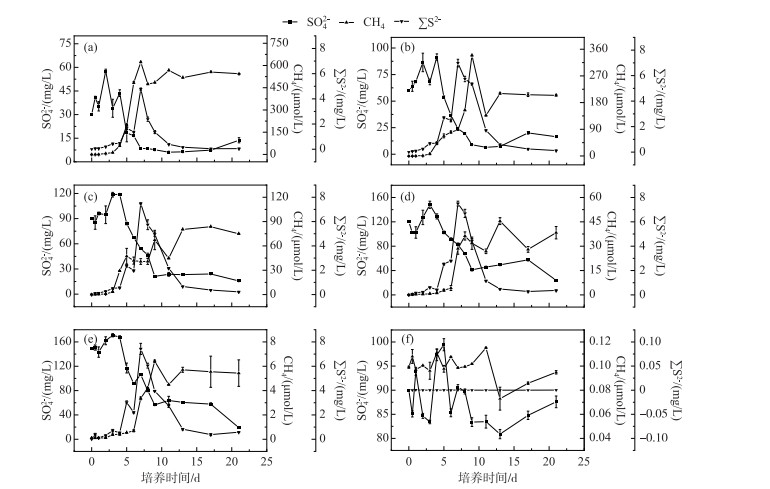
实验周期内,蓝藻的聚积衰亡过程会使水体处于厌氧强还原状态,从而导致水体中发生强烈的氧化还原反应. 随着硫酸盐还原的反应,水柱中SO42-的浓度逐渐下降,∑S2-、CH4浓度不断上升,实验过程中,CH4释放的累计浓度随着初始SO42-浓度的增高而降低,同时∑S2-的最高浓度随着初始SO42-浓度的增高而增高,当初始SO42-浓度大于90 mg/L后,∑S2-的最高浓度将不再升高. 在A~E五组实验系统中,水体中的SO42-浓度在第4天开始急剧降低,其中A组在第7天时,SO42-达到最低值(8.49 mg/L)(图 3a),B组在第9天时,SO42-浓度达到最低值(8.87 mg/L)(图 3b),C、D、E三组在第9天时,SO42-浓度依次为21.21、41.14、56.54 mg/L(图 3c, 3d, 3e). ∑S2-浓度在4 d后大幅上升,并在第7天时达到峰值,依次为4.77、6.98、7.49、7.50、7.43 mg/L,C、D、E三组的∑S2-浓度近似相等. CH4浓度均表现为初期值较低,而随着SO42-浓度的降低,CH4浓度则逐渐上升,其峰值出现在第7~13天内,并随着初始SO42-浓度的提高,峰值出现的时间点相应延后. 其中A组峰值出现在第7天,B组和C组峰值均出现在第9天,D组和E组峰值出现在第13天. 实验培养结束时,A~E五组实验系统中,CH4产生的累计浓度依次为546.39、207.24、79.61、37.25和5.56 μmol/L. 在培养的后期,五组实验组水体中的SO42-浓度在第11~17天,均表现为轻微回升的趋势,但随后都下降. F组水柱中SO42-浓度变化不明显,维持在(90±10) mg/L范围内,∑S2-浓度低于0.01 mg/L,CH4浓度低于0.12 μmol/L.
|
图 3 水体中SO42-、∑S2-和CH4浓度动态变化 Fig.3 Dynamic changes of SO42-, ∑S2- and CH4 concentrations in overlying water |
为进一步了解SO42-浓度的提高对CH4产生以及蓝藻聚积衰亡过程中各指标间的相互关系,本研究对各项指标进行相关性分析. CH4浓度与SO42-浓度呈显著负相关(R2=0.99,P < 0.01),表明SO42-浓度的提高对与产甲烷有明显的抑制作用(表 3). CH4浓度与DO、ORP均呈显著正相关(R2=0.58,P < 0.01),与DOC、TN、TP浓度之间相关性显著(R2=0.49,P < 0.01), 表明蓝藻分解过程造成的水体环境的改变,对产CH4过程也造成了影响.
| 表 3 CH4浓度与水体理化指标的相互关系 Tab. 3 The correlation between CH4 concentration and physicochemical parameters of overlying water |
湖泊虽然只占陆地表面的很小部分,却是大气中CH4的最大排放源之一,据估算每年的释放量范围为8~48 Tg,对全球气候变化影响巨大[3]. 随着富营养化湖泊问题的日益加剧,蓝藻水华的暴发对湖泊生态系统中各元素的生物地球化学循环的影响引起了广泛关注[28-30]. 蓝藻水华的暴发会造成区域性缺氧甚至是厌氧,蓝藻在水面大量堆积、衰亡,快速消耗水体中的DO,同时在其之后的分解过程中进一步消耗DO,造成水体的缺氧、厌氧[31-33],进而改变了湖泊水体的理化环境. 本研究中,无蓝藻F组实验系统中,DO在初期有小幅下降,而ORP则一直保持不变,实验周期内,水体一直处于好氧状态(图 3a, 3b). 而A~E添加蓝藻组的系统中,随着蓝藻的聚积衰亡,水体中的DO浓度以及ORP快速下降(图 3a, 3b),使得水体处于厌氧强还原状态[8-9],两者之间呈现显著的正相关关系(R2=0.58,P < 0.01)(表 1). 另一方面,蓝藻衰亡提供有机质,促进了CH4的排放,同时也向水体释放出大量的C、N、P等营养盐. 在A~E五组实验系统中,水体营养盐负荷升高,TN、TP和DOC浓度显著上升(图 2),同时,野外的研究也表明,在太湖梅梁湾的同一个营养区内,近岸区域的CH4排放量均值为0.173 mmol/(m2 ·d),明显高于梅梁湾湖区的排放量0.107 mmol/(m2 ·d),从河口区到湖心区,随着富营养化程度的降低,CH4扩散通量由0.173 mmol/(m2 ·d)递减到0.107 mmol/(m2 ·d)[36].
研究发现,富营养化湖泊中SO42-浓度普遍较高,这主要与湖泊营养状态密切相关,与TN浓度表现为正相关关系(R2=0.93, 表 4). 这是因为外源性营养盐的输入,引起了水体N、P的超负荷. 伴随外源输入的还有大量的含硫废水等,由此引起了淡水湖泊水体SO42-浓度的升高. 以太湖为例,水体中SO42-浓度由20世纪50年代的不到30 mg/L上升到2010年的近90 mg/L, 并有进一步上升的趋势,其SO42-浓度升高的原因本质上是近几十年硫排放增强以及硫的干湿沉降[13-14]. 贫营养条件下,湖泊中的硫酸盐还原作用不明显,这是因为有机质的可用性限制了硫酸盐还原的进行,富营养湖泊中的硫酸盐具有大幅度减少的潜力,因为其有机质的可利用性和硫酸盐的浓度通常都高于贫营养湖泊(表 4)[15]. 同时,硫酸盐还原菌(sulphate reducing bacteria,SRB)是专性厌氧菌,SRB主要利用SO42-作为电子受体完成厌氧呼吸,常用的电子供体包括短链脂肪酸(乙酸、甲酸和丙酸等)、其他小分子物质、H2等[15],痕量的氧气能够抑制硫酸盐还原过程[42-43],因此,蓝藻的聚积衰亡会改变水体的理化性质(图 2c, 2d, 2e),使得“沉积物-上覆水”交界处处于厌氧强还原状态,促使硫酸盐还原反应的发生[9]. 太湖水体SO42-浓度随着温度变化具有明显的变化(R2=0.53;P < 0.05),冬季水体SO42-浓度维持在较高水平,最高达到了97.77 mg/L,而夏季水体SO42-浓度则明显下降,仅为59.28 mg/L[14]. 夏季气温高,蓝藻水华易爆发,水体中有机质的可利用性高[14, 44-45],蓝藻聚积衰亡会向水体释放大量的营养盐,促进了硫酸盐还原的进行,SO42-浓度随着硫酸盐还原的进行而减少(图 2, 图 3). 夏季沉积物中有机质含量高,氧气供给不足会使得SO42-成为电子受体,进行硫酸盐还原反应;而冬季沉积物表层新鲜有机质少,氧气供给充足,硫酸盐还原反应较弱,对SO42-的消耗大幅下降. 同时,冬季随着气温的下降,微生物的活性降低,相应的硫酸盐还原速率下降[13],且无蓝藻水华的存在,水体实现复氧,部分∑S2-被再氧化为SO42-[46-47], 此外冬季蓝藻等浮游植物残体的衰亡也会向水体释放∑S2-,部分会被氧化成SO42-,因而导致了冬季太湖水体SO42-浓度显著上升[14].
| 表 4 不同湖泊水体营养状态与SO42-浓度分布情况 Tab. 4 Nutritional state and distribution of SO42- concentration in different lakes |
蓝藻水华的暴发不仅影响到了温室气体CO2和CH4的排放,同时还影响到湖泊沉积物中硫循环过程.蓝藻的腐解厌氧代谢释放出的大量营养物质,促进了水体中SRB等异养微生物的繁殖,使硫酸盐还原速率显著提高[5]. 本研究中,A~E组的SO42-浓度较初始值均大幅度下降,而F组SO42-浓度则保持在(90±10) mg/L(图 3),这表明硫酸盐还原的发生与蓝藻的聚积衰亡存在明显的相关性. 强烈的硫酸盐还原反应发生在第6~9天,此时水柱中的SO42-浓度快速下降,达到较低值,并伴随着∑S2-浓度的快速上升(图 3a~e). 硫酸盐还原反应速率涉及很多因素,例如含氧量、SO42-浓度、温度以及有机质有效性等. 本实验中,A、B、C三组∑S2-浓度表现为随着初始SO42-浓度的升高而升高,依次为4.77、6.98、7.49 mg/L, D、E两组与C组相比几乎相同(图 3c~e), ∑S2-和DOC、TP以及TN浓度存在显著的正相关关系(表 3), 这可能是有机质的可利用性限制了硫酸盐还原的进一步发生[48-49].
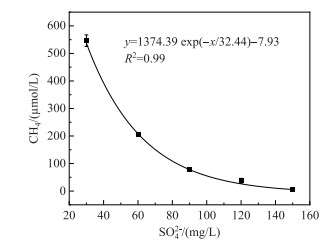
当前,微生物参与的硫循环和碳循环之间耦合的联动机制成为研究的主要热点,但关于富营养化湖泊条件下,SO42-浓度的升高对硫循环的促进作用以及其对碳循环产生的影响尚不明确[14, 50]. 富营养化湖泊中,CH4的生成很大一部分是来自蓝藻水华聚积衰亡后向水体释放的有机碳的厌氧分解,大部分CH4在排放到大气之前就会被好氧及厌氧甲烷氧化过程所消耗[16, 35]. 目前已知的硫酸盐还原过程对产CH4的影响主要包括了有机碳源的竞争[51]和厌氧甲烷氧化耦合硫酸盐还原两种方式. 据估计海洋沉积物中29 % ~50 % 的有机碳矿化是通过硫酸盐还原完成的[46-47, 52],由此可减少甲烷的产生,且硫酸盐还原途径还可以消耗已经产生的甲烷[18-19, 53]. 此外,含硫化合物会对厌氧细菌,尤其是MPB产生毒害作用[54]. 在以往的研究中,由于淡水湖泊中SO42-浓度较低,硫酸盐还原过程对于产CH4影响的研究较少,但随着全球淡水流域SO42-浓度的不断提高,其中太湖水柱中的SO42-浓度甚至达到1 mmol/L, 显著高于世界范围内其他典型淡水湖泊[55],其对产CH4过程的影响可能超过了以往的认知[21]. 本研究表明,在蓝藻水华暴发的情况下,随着初始SO42-浓度的提高,CH4的最终累计浓度逐渐降低,其对蓝藻聚积衰亡过程中的产CH4过程有明显的抑制作用,两者呈现显著的指数型负相关关系(表 3, 图 4).
|
图 4 初始SO42-浓度和最终CH4浓度的相关关系 Fig.4 Relationship between the initial SO42- concentration and the final CH4 concentration |
本研究中,每个实验组CH4的浓度在SO42-下降到低浓度之后,开始大幅度上升(图 3),两者呈现显著负相关(R2=0.99,P < 0.01)(表 3). 在淡水湖泊沉积物中,底栖动物的活动对硫酸盐还原过程的影响也是不可忽略的[56],且硫酸盐还原过程发生的SO42-临界浓度尚无定论[13],有研究报道其极限浓度为8~40 μmol/L[57-58],也有研究指出,SRB只有大于SO42-饱和浓度200~3000 μmol/L时,才会比较活跃,此时与MPB的基质竞争作用明显[59-60]. 同时在淡水湖泊沉积物中,SO42-的快速再生也使得硫酸盐还原过程得以在淡水湖泊中持续进行[22, 61]. 因此,随着富营养化湖泊水体的SO42-浓度持续上升,其在一定程度上抑制了蓝藻聚积衰亡过程中CH4的产生,但SO42-对产CH4过程抑制的内在驱动因素,尤其是其中的微生物过程仍需进一步研究.
4 结论1) 蓝藻水华聚积衰亡会造成水体的厌氧强还原环境,同时在腐解的过程中向水体释放了大量的C、N、P等物质,加剧水体的富营养化,形成了湖泊富营养化的恶性循环.
2) 蓝藻聚积衰亡提供了充足的有机质,使得水柱中发生了强烈的硫酸盐还原反应,SO42-浓度下降,并伴随着∑S2-浓度的显著上升,但当初始SO42-浓度达到一定水平后,∑S2-浓度的最高浓度保持不变,有机质的可用性是限制硫酸盐还原反应的重要因素之一.
3) 富营养化湖泊中的SO42-浓度提高对CH4的产生存在显著的抑制作用,CH4的累计浓度与初始SO42-浓度呈指数型负相关关系. 这对我们精准评估富营养湖泊CH4产生与释放具有重要的参考意义.
| [1] |
Kirschke S, Bousquet P, Ciais P et al. Three decades of global methane sources and sinks. Nature Geoscience, 2013, 6(10): 813-823. DOI:10.1038/ngeo1955 |
| [2] |
IPCC. Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change, 2013.
|
| [3] |
Bastviken D, Cole J, Pace M et al. Methane emissions from lakes: Dependence of lake characteristics, two regional assessments, and a global estimate. Global Biogeochemical Cycles, 2004, 18(4): GB4009. DOI:10.1029/2004GB002238 |
| [4] |
Bastviken D, Tranvik LJ, Downing JA et al. Freshwater methane emissions offset the continental carbon sink. Science, 2011, 331(6013): 50. DOI:10.1126/science.1196808 |
| [5] |
Li SY, Bush RT. Revision of methane and carbon dioxide emissions from inland waters in India. Global Change Biology, 2015, 21(1): 6-8. DOI:10.1111/gcb.12705 |
| [6] |
Mehnert G, Leunert F, Cirés S et al. Competitiveness of invasive and native cyanobacteria from temperate freshwaters under various light and temperature conditions. Journal of Plankton Research, 2010, 32(7): 1009-1021. DOI:10.1093/plankt/fbq033 |
| [7] |
O'Reilly CM, Sharma S, Gray DK et al. Rapid and highly variable warming of lake surface waters around the globe. Geophys Res Lett, 2015, 42(24): 10773-10781. |
| [8] |
Carey CC, Ibelings BW, Hoffmann EP et al. Eco-physiological adaptations that favour freshwater cyanobacteria in a changing climate. Water Research, 2012, 46(5): 1394-1407. DOI:10.1016/j.watres.2011.12.016 |
| [9] |
Fan CX. Progress and prospect in formation of black bloom in Lake Taihu: A review. J Lake Sci, 2015, 27(4): 553-566. [范成新. 太湖湖泛形成研究进展与展望. 湖泊科学, 2015, 27(4): 553-566. DOI:10.18307/2015.0401] |
| [10] |
Shen QS, Liu C, Zhou QL et al. Effects of physical and chemical characteristics of surface sediments in the formation of shallow lake algae-induced black bloom. Journal of Environmental Sciences, 2013, 25(12): 2353-2360. DOI:10.1016/S1001-0742(12)60325-8 |
| [11] |
Handley KM, VerBerkmoes NC, Steefel CI et al. Biostimulation induces syntrophic interactions that impact C, S and N cycling in a sediment microbial community. The ISME Journal, 2013, 7(4): 800-816. DOI:10.1038/ismej.2012.148 |
| [12] |
Yan XC, Zhang ZQ, Wang GX et al. Concentration of dissolved greenhouse gas and its influence factors in the summer surface water of eutrophic lake. J Lake Sci, 2018, 30(5): 1420-1428. [闫兴成, 张重乾, 王国祥等. 富营养化湖泊夏季表层水体温室气体浓度及其影响因素. 湖泊科学, 2018, 30(5): 1420-1428. DOI:10.18307/2018.0523] |
| [13] |
Zhao J, Dai D, Wang R et al. Long-term trends of acid anion in the rain water in Lake Taihu watershed and the lake water, and its environmental implications. J Lake Sci, 2019, 31(1): 88-98. [赵健, 代丹, 王瑞等. 太湖流域降雨和湖水酸根阴离子长期变化及其环境意义. 湖泊科学, 2019, 31(1): 88-98. DOI:10.18307/2019.0109] |
| [14] |
Yu T, Zhang Y, Wu FC et al. Six-decade change in water chemistry of large freshwater lake Taihu, China. Environmental Science & Technology, 2013, 47(16): 9093-9101. DOI:10.1021/es401517h |
| [15] |
Holmer M, Storkholm P. Sulphate reduction and sulphur cycling in lake sediments: A review. Freshwater Biology, 2001, 46(4): 431-451. DOI:10.1046/j.1365-2427.2001.00687.x |
| [16] |
Xu J, Wang H, Li SY et al. Microbial and biogeochemical cycles in lake sediments. Environmental Science and Technology, 2019, 32(1): 74-78. [徐洁, 王红, 李思言等. 湖泊沉积物中微生物与生物地球化学循环. 环境科技, 2019, 32(1): 74-78.] |
| [17] |
Dentener F, Drevet J, Lamarque JF et al. Nitrogen and sulfur deposition on regional and global scales: A multimodel evaluation. Global Biogeochemical Cycles, 2006, 20(4): GB4003. DOI:10.1029/2005GB002672 |
| [18] |
Hall KC, Baldwin DS, Rees GN et al. Distribution of inland wetlands with sulfidic sediments in the Murray-Darling Basin, Australia. Science of the Total Environment, 2006, 370(1): 235-244. DOI:10.1016/j.scitotenv.2006.07.019 |
| [19] |
Fike DA, Bradley AS, Rose CV. Rethinking the ancient sulfur cycle. Annual Review of Earth and Planetary Sciences, 2015, 43(1): 593-622. DOI:10.1146/annurev-earth-060313-054802 |
| [20] |
Zeng Q, Hao TW, MacKey HR et al. Recent advances in dissimilatory sulfate reduction: From metabolic study to application. Water Research, 2019, 150: 162-181. DOI:10.1016/j.watres.2018.11.018 |
| [21] |
Sela-Adler M, Ronen Z, Herut B et al. Co-existence of methanogenesis and sulfate reduction with common substrates in sulfate-rich estuarine sediments. Frontiers in Microbiology, 2017, 8: 766. DOI:10.3389/fmicb.2017.00766 |
| [22] |
Anantharaman K, Hausmann B, Jungbluth SP et al. Expanded diversity of microbial groups that shape the dissimilatory sulfur cycle. The ISME Journal, 2018, 12(7): 1715-1728. DOI:10.1038/s41396-018-0078-0 |
| [23] |
Pester M, Knorr KH, Friedrich MW et al. Sulfate-reducing microorganisms in wetlands-fameless actors in carbon cycling and climate change. Frontiers in Microbiology, 2012, 3: 72. DOI:10.3389/fmicb.2012.00072 |
| [24] |
Hausmann B, Knorr KH, Schreck K et al. Consortia of low-abundance bacteria drive sulfate reduction-dependent degradation of fermentation products in peat soil microcosms. The ISME Journal, 2016, 10(10): 2365-2375. DOI:10.1038/ismej.2016.42 |
| [25] |
Tabatabai MA. A rapid method for determination of sulfate in water samples. Environmental Letters, 1974, 7(3): 237-243. DOI:10.1080/00139307409437403 |
| [26] |
Florin THJ. Hydrogen sulphide and total acid-volatile sulphide in faeces, determined with a direct spectrophotometric method. Clinica Chimica Acta, 1991, 196(2/3): 127-134. DOI:10.1016/0009-8981(91)90065-K |
| [27] |
Bastviken D, Santoro AL, Marotta H et al. Methane emissions from pantanal, south America, during the low water season: Toward more comprehensive sampling. Environmental Science & Technology, 2010, 44(14): 5450-5455. DOI:10.1021/es1005048 |
| [28] |
Chen MS, Ding SM, Chen X et al. Mechanisms driving phosphorus release during algal blooms based on hourly changes in iron and phosphorus concentrations in sediments. Water Research, 2018, 133: 153-164. DOI:10.1016/j.watres.2018.01.040 |
| [29] |
Chen M, Li XH, He YH et al. Increasing sulfate concentrations result in higher sulfide production and phosphorous mobilization in a shallow eutrophic freshwater lake. Water Research, 2016, 96: 94-104. DOI:10.1016/j.watres.2016.03.030 |
| [30] |
Chen M, Ye TR, Krumholz LR et al. Temperature and cyanobacterial bloom biomass influence phosphorous cycling in eutrophic lake sediments. PLoS One, 2014, 9(3): e93130. DOI:10.1371/journal.pone.0093130 |
| [31] |
Xing P, Guo L, Tian W et al. Novel Clostridium populations involved in the anaerobic degradation of Microcystis blooms. The ISME Journal, 2011, 5(5): 792-800. DOI:10.1038/ismej.2010.176 |
| [32] |
Li HB, Xing P, Chen MJ et al. Short-term bacterial community composition dynamics in response to accumulation and breakdown of Microcystis blooms. Water Research, 2011, 45(4): 1702-1710. DOI:10.1016/j.watres.2010.11.011 |
| [33] |
Tranvik LJ, Downing JA, Cotner JB et al. Lakes and reservoirs as regulators of carbon cycling and climate. Limnology and Oceanography, 2009, 54(6part2): 2298-2314. DOI:10.4319/lo.2009.54.6_part_2.2298 |
| [34] |
Yan XC, Wang MY, Xu XG et al. Migration of carbon, nitrogen and phosphorus during organic matter mineralization in eutrophic lake sediments. J Lake Sci, 2018, 30(2): 306-313. [闫兴成, 王明玥, 许晓光等. 富营养化湖泊沉积物有机质矿化过程中碳、氮、磷的迁移特征. 湖泊科学, 2018, 30(2): 306-313. DOI:10.18307/2018.0203] |
| [35] |
Yan XC, Xu XG, Wang MY et al. Climate warming and cyanobacteria blooms: Looks at their relationships from a new perspective. Water Research, 2017, 125: 449-457. DOI:10.1016/j.watres.2017.09.008 |
| [36] |
Shang DY, Xiao QT, Hu ZH et al. CH4 emissions characteristics and its influencing factors in an eutrophic lake. Environmental Science, 2018, 39(11): 5227-5236. [商东耀, 肖启涛, 胡正华等. 富营养化湖区CH4排放特征及其影响因素. 环境科学, 2018, 39(11): 5227-5236. DOI:10.13227/j.hjkx.201803128] |
| [37] |
Yu FF. Effect of external sulfate on nutrients and heavy metals in the sediments of lake moshui in wuhan[Dissertation]. Wuhan: Huazhong Agrucyltural University, 2013. [余芬芳. 外源硫酸盐对武汉墨水湖沉积物营养盐和重金属的作用[学位论文]. 武汉: 华中农业大学, 2013. ]
|
| [38] |
Yuan T, Hua YM, Zhu DW et al. Response of phosphorus components in sediments from eutrophic lake to external sulfate. Environmental Science, 2012, 33(7): 2315-2321. [袁探, 华玉妹, 朱端卫等. 富营养湖泊沉积物中磷组分对硫酸盐的响应. 环境科学, 2012, 33(7): 2315-2321. DOI:10.13227/j.hjkx.2012.07.033] |
| [39] |
Ding M. Short-term effect of exotic sulfate on phosphorus in the sediment of Lake DongHu in Wuhan[Dissertation]. Wuhan: Huazhong Agrucyltural University, 2012. [丁敏. 外源硫酸盐对武汉东湖沉积物磷的短期效应[学位论文]. 武汉: 华中农业大学, 2012. ]
|
| [40] |
Zhang J, Zhou YP, Chen SY et al. Impact of decomposition of Potamogeton crispus of Dongping lake on the sulfur concentrations in overlying water. Yellow River, 2014, 36(11): 65-68. [张菊, 周韵平, 陈诗越等. 东平湖菹草腐烂对上覆水硫浓度的影响. 人民黄河, 2014, 36(11): 65-68.] |
| [41] |
Zhang LK, Qin XQ, Liu PY et al. Chemical denudation rate and atmospheric CO2 consumption by H2CO3 and H2SO4 in the Yangtze River catchment. Acta Geologica Sinica, 2016, 90(8): 1933-1944. [张连凯, 覃小群, 刘朋雨等. 硫酸参与的长江流域岩石化学风化与大气CO2消耗. 地质学报, 2016, 90(8): 1933-1944. DOI:10.3969/j.issn.0001-5717.2016.08.021] |
| [42] |
Brand TPH, Roest K, Chen GH et al. Potential for beneficial application of sulfate reducing bacteria in sulfate containing domestic wastewater treatment. World Journal of Microbiology and Biotechnology, 2015, 31(11): 1675-1681. DOI:10.1007/s11274-015-1935-x |
| [43] |
van den Brand TPH, Roest K, Chen GH et al. Effects of chemical oxygen demand, nutrients and salinity on sulfate-reducing bacteria. Environmental Engineering Science, 2015, 32(10): 858-864. DOI:10.1089/ees.2014.0307 |
| [44] |
Zhu GW, Shi K, Li W et al. Seasonal forecast method of cyanobacterial bloom intensity in eutrophic Lake Taihu, China. J Lake Sci, 2020, 32(5): 1421-1431. [朱广伟, 施坤, 李未等. 太湖蓝藻水华的年度情势预测方法探讨. 湖泊科学, 2020, 32(5): 1421-1431. DOI:10.18307/2020.0504] |
| [45] |
Zhu GW, Xu H, Zhu MY et al. Changing characteristics and driving factors of trophic state of lakes in the middle and lower reaches of Yangtze River in the past 30 years. J Lake Sci, 2019, 31(6): 1510-1524. [朱广伟, 许海, 朱梦圆等. 三十年来长江中下游湖泊富营养化状况变迁及其影响因素. 湖泊科学, 2019, 31(6): 1510-1524. DOI:10.18307/2019.0622] |
| [46] |
Jørgensen BB, Findlay AJ, Pellerin A. The biogeochemical sulfur cycle of marine sediments. Frontiers in Microbiology, 2019, 10: 849. DOI:10.3389/fmicb.2019.00849 |
| [47] |
Wasmund K, Mußmann M, Loy A. The life sulfuric: Microbial ecology of sulfur cycling in marine sediments. Environmental Microbiology Reports, 2017, 9(4): 323-344. DOI:10.1111/1758-2229.12538 |
| [48] |
King GM. Utilization of hydrogen, acetate, and "noncompetitive"; substrates by methanogenic bacteria in marine sediments. Geomicrobiology Journal, 1984, 3(4): 275-306. DOI:10.1080/01490458409377807 |
| [49] |
Vile MA, Bridgham SD, Wieder RK. Response of anaerobic carbon mineralization rates to sulfate amendments in a boreal peatland. Ecological Applications, 2003, 13(3): 720-734. DOI:10.1890/1051-0761(2003)013[0720:ROACMR]2.0.CO;2 |
| [50] |
Yu H, Li N. Carbon cycle of lake and estimate method of air-water carbon dioxide exchange quantifies. Environmental Science and Technology, 2008, 21(z2): 1-5. [于浩, 李宁. 湖泊碳循环及碳通量的估算方法. 环境科技, 2008, 21(z2): 1-5. DOI:10.3969/j.issn.1674-4829.2008.z2.001] |
| [51] |
Denier van der Gon HA, van Bodegom PM, Wassmann R et al. Sulfate-containing amendments to reduce methane emissions from rice fields: Mechanisms, effectiveness and costs. Mitigation and Adaptation Strategies for Global Change, 2001, 6(1): 71-89. DOI:10.1023/A:1011380916490 |
| [52] |
Canfield DE. Sulfate reduction in deep-sea sediments. American Journal of Science, 1991, 291(2): 177-188. DOI:10.2475/ajs.291.2.177 |
| [53] |
Wegener G, Krukenberg V, Riedel D et al. Intercellular wiring enables electron transfer between methanotrophic Archaea and bacteria. Nature, 2015, 526(7574): 587-590. DOI:10.1038/nature15733 |
| [54] |
Kushkevych I, Abdulina D, Kováč J et al. Adenosine-5'-phosphosulfate- and sulfite reductases activities of sulfate-reducing bacteria from various environments. Biomolecules, 2020, 10(6): 921. DOI:10.3390/biom10060921 |
| [55] |
Wu SJ, Wang X, Ji QY et al. Iron-sulfur distribution and its environmental significance in three typical areas of western Lake Taihu. J Lake Sci, 2019, 31(4): 950-960. [吴松峻, 汪旋, 季秋忆等. 太湖西岸典型区域沉积物的硫铁分布特征及环境意义. 湖泊科学, 2019, 31(4): 950-960. DOI:10.18307/2019.0408] |
| [56] |
Yang BH, Ma SQ, Wang M et al. Diversity and temporal-spatial dynamics of macroinvertebrate functional feeding group in north canal in Beijing. Journal of Henan Normal University: Nature Science Edition, 2019, 47(1): 105-111. [杨柏贺, 马思琦, 王汨等. 北运河水系大型底栖动物摄食功能群多样性及时空分布特征. 河南师范大学学报: 自然科学版, 2019, 47(1): 105-111.] |
| [57] |
Sinke AJC, Cornelese AA, Cappenberg TE et al. Seasonal variation in sulfate reduction and methanogenesis in peaty sediments of eutrophic Lake Loosdrecht, The Netherlands. Biogeochemistry, 1992, 16(1): 43-61. DOI:10.1007/BF02402262 |
| [58] |
Kuivila KM, Murray JW, Devol AH et al. Methane production, sulfate reduction and competition for substrates in the sediments of Lake Washington. Geochimica et Cosmochimica Acta, 1989, 53(2): 409-416. DOI:10.1016/0016-7037(89)90392-X |
| [59] |
Vile MA, Bridgham SD, Wieder RK et al. Atmospheric sulfur deposition alters pathways of gaseous carbon production in peatlands. Global Biogeochemical Cycles, 2003, 17(2): 1058. DOI:10.1029/2002GB001966 |
| [60] |
Jia XS, Li SY. Kinetic competition between methanogenic and sulfate-reducing bacteria in anaerobic mixed cultures Ⅱ. results and discussion. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2004, 43(1): 92-97. [贾晓珊, 李顺义. 厌气混合培养中产甲烷菌和硫酸盐还原菌的动力学竞争Ⅱ.动力学推定的结果及讨论. 中山大学学报: 自然科学版, 2004, 43(1): 92-97.] |
| [61] |
Hausmann B, Pelikan C, Herbold CW et al. Peatland Acidobacteria with a dissimilatory sulfur metabolism. The ISME Journal, 2018, 12(7): 1729-1742. DOI:10.1038/s41396-018-0077-1. |
 2021, Vol. 33
2021, Vol. 33 


