浮游生物包括真核浮游生物和原核浮游生物,它们与水体中的各类环境因子关系密切,其多样性和群落特征会随着水体生态环境的变化而变化,对浮游生物多样性和群落特征的研究能够间接反映水体生态环境质量的优劣[1]. 水体中的浮游植物是生态系统中重要的初级生产者(例如绿藻门、蓝藻门、硅藻门、甲藻门和隐藻门等),浮游动物不仅是重要的消费者也是食物链中的关键枢纽(例如原生动物、轮虫、枝角类和桡足类等),它们在水生态系统中的物质循环和能量流动中均起着重要作用[2]. 水生态系统中的原核浮游生物数量众多种类丰富,例如细菌、蓝藻和放线菌等. 细菌是原核浮游生物中的一大类群,它们是生态系统中的分解者,也参与了水体中各类物质的形态转化和地球化学循环,对其多样性和群落特征进行研究,能够为维护水体生态环境健康提供重要的参考资料[3].
丹江口水库作为南水北调中线工程的水源地,承担着向京津及华北地区多个城市供水,同时兼顾农业和生态用水的任务,其水质状况不仅直接影响中线工程的效率和效益,而且密切关系到广大人民群众的饮水安全. 保证丹江口水库水体生态系统健康至关重要,而这离不开对丹江口水库各类浮游生物的详尽调查. 目前对丹江口水库的调查大多是基于传统的调查方法[4-7]. 传统的水生态调查依靠人工在光学显微镜下对浮游生物进行鉴定,这类方法高度依赖鉴定人员的经验和能力,能够鉴定出的物种有限,鉴定方式主观鉴定结果难于重复,往往很难精确且详尽的监测到水体中水生生物群落的全貌[8]. 近年来的研究表明,环境DNA宏条形码技术能够更深入的调查水体群落多样性,而且有着比传统调查方法更高的监测效率[9-10].
本研究在丹江口水库采集水样,利用环境DNA宏条形码技术研究丹江口水库水体生物多样性及其群落特征. 之前的环境DNA宏条形码技术往往采用二代测序技术,这种测序方法获取的OTU序列长度约在几百bp左右,序列长度较短限制了物种注释的准确性. 单分子实时测序技术获取的序列长度要远高于二代测序结果,序列长度的增加保证了物种注释的准确性,提高了对物种的分辨率[11]. 本研究首次在丹江口水库区域采用单分子实时测序技术进行分子生态学的研究,以期准确且全面地掌握丹江口水库浮游生物多样性现状,为保障丹江口水库的水生态健康提供参考资料.
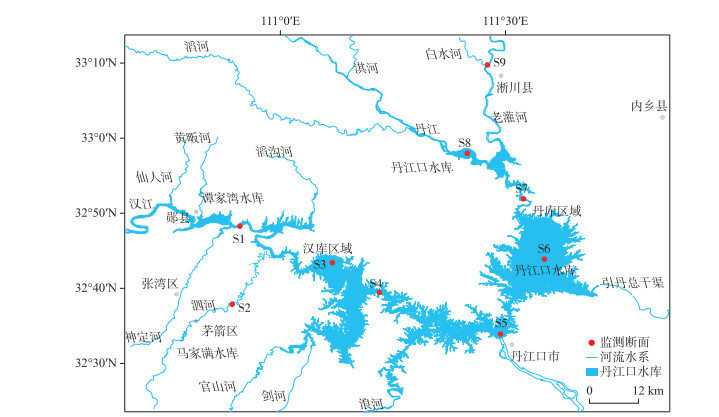
1 样本采集与研究方法于2020年7月在丹江口水库进行采样,为保证采样尽可能涵盖丹江口水库,在丹江口水库区域和支流区域共布设了9个采样点,其中S1、S3、S4、S5为丹江口的汉库区域,S2为汉库的入库支流之一;S6、S7、S8为丹江口水库的丹库区域,S9为丹库的入库支流之一,如图 1所示. 采样前对采水器进行了高压灭菌处理,采样人员在每个样点佩戴一次性手套采集1.5 L表层水样,使用0.2 μm聚碳酸酯滤膜(Whatman)真空抽滤,每次抽滤前使用次氯酸钠对抽滤装置进行浸泡消毒,洗净后进行抽滤. 抽滤后将滤膜装于液氮中运输至实验室,使用DNA提取试剂盒(Mobio)提取滤膜上的DNA,在液氮中保存DNA. 利用YSI多参数水质测量仪(Xylem)现场测量每个样点的水温、pH、溶解氧(DO)、电导率(TDS)等水质指标. 水体总磷(TP)、总氮(TN)、氨氮(NH3-N)、化学需氧量(COD)、硝酸盐(NOX)等环境因子的测定参照《地表水环境质量标准》(GB 3838-2002). 浊度(TUR)的测定参照《水质——浊度的测定》(ISO7027-1984).
|
图 1 丹江口库区样点分布 Fig.1 Location of the sampling sites in the Danjiangkou Reservoir |
分别使用18S和16S分子标记对DNA样品进行目的片段的扩增,18S采用引物Euk-A(AACCTGGTTGATCCTGCCAGT)和Euk-B(GATCCTTCTGCAGGTTCACCTAC)[12],16S采用引物pA(AGAGTTTGATCCTGGCTCAG)和B23S(CTTCGCCTCTGTGTGCCTAGGT)[13]. 20 μL的反应体系包括10 μL的2×PCR Buffer、4 μL的dNTP、正向和反向引物各1 μL,5 μL的DNA模板,然后使用ddH2O补足. 反应条件为95℃预变性5 min;95℃变性30 s、50℃退火30 s、72℃延伸3 min(25个循环);最后延伸7 min. 每个样品进行3次PCR技术重复,以无菌水作为阴性对照,阴性对照无可见扩增,将3份产物混合后使用AxyPrep DNA Gel Extraction Kit试剂盒(Axygen)进行纯化回收.
使用SMRT建库试剂盒(DNA Template Prep kit 1.0)进行文库的构建,通过Qubit荧光定量仪定量(ThermoFisher),FEMTO Pulse自动化脉冲场凝胶电泳系统(Bio-red)检测片段大小质量,库检合格后使用PacBio Sequel Ⅱ平台(Pacific Biosciences)进行上机测序.
使用lima v1.7.0(https://github.com/pacificbiosciences/barcoding)软件通过Barcode序列拆分出各样本数据. 使用SMRT link v8(https://www.pacb.com/products-and-services/analytical-software/smrt-analysis/)软件获取环状一致性序列(circular consensus sequencing,CCS). 使用cutadapt v1.9.1[14]进行引物序列的识别与去除并且进行长度过滤. 使用UCHIME v4.2[15]软件鉴定并去除嵌合体序列. 使用USEARCH v10[16]在97 % 的相似度水平下对质控后的CCS序列进行聚类,获取OTU序列及OTU表格,过滤丰度小于0.005 % 的OTU序列,使用QIIME1 v1.9.1对OTU表根据样本序列最低数量(16S序列数为4633,18S序列数为4158)抽平后进行多样性分析. 使用朴素贝叶斯分类器将OTU序列比对SILVA数据库(SILVA_132_SSURef)[17],对于注释无法获取物种信息的OTU序列,进一步比对到NCBI的NT数据库(下载于2020年9月),以获取分类学注释. 群落组成使用Krona[18]生成,分子生态网络使用Python中的networkx模块[19],RDA分析以及α多样性指数(Shannon-Wiener指数、Simpson指数、Pielou指数、物种数、Chao1指数和ACE指数)使用R语言中的vegan包[20]计算.
2 结果与讨论 2.1 测序结果在丹江口库区9个样点中,基于18S扩增测序一共获取了65713条CCS序列,经质控后,有效CCS序列数为61115条,序列平均长度为1749 bp;基于16S扩增测序一共获取了86702条CCS序列,经质控后,有效CCS序列数为73032条,序列平均长度为1445 bp. 测序深度足够保证测序正确率,序列长度足够保证注释准确率.
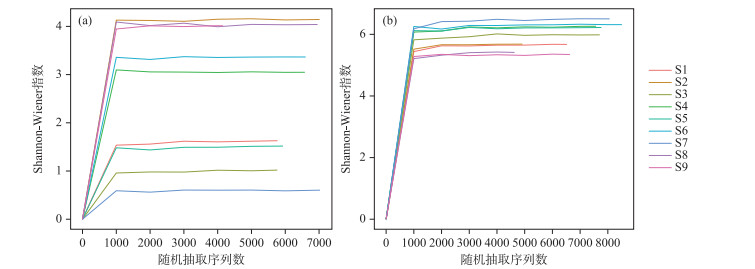
基于18S和16S数据计算其群落α多样性指数,通过Shannon-Wiener指数构建的稀释曲线结果如图 2所示. 随着随机抽取序列数的增加,18S和16S所有样点的Shannon-Wiener指数达到平台期,多样性不再增加,故本次调查的测序深度足够反映丹江口水库浮游生物群落的多样性.
|
图 2 各样点基于Shannon-Wiener指数的稀释曲线(a:真核-18S;b:原核-16S) Fig.2 The rarefaction curves based on Shannon-Wiener index of each sampling site (a: Eukaryotic-18S; b: Prokaryote-16S) |
在97 % 的相似度水平下,基于18S数据聚类得到240条OTU序列,通过分类学注释到25门48纲70目101科123属158种,其中有82条OTU序列无法注释到种的分类学水平,占比34 %;基于16S数据聚类得到566条OTU,通过分类学注释到20门42纲108目175科293属377种,其中有189条OTU序列无法注释到种的分类学水平,占比33 %. 综上所述,有近1/3的浮游生物无法得到有效的物种注释信息,说明公共数据库中缺乏丹江口水库区域生物的分子数据,需要进一步开展相关方面的研究,以扩充数据库完善物种的注释信息.
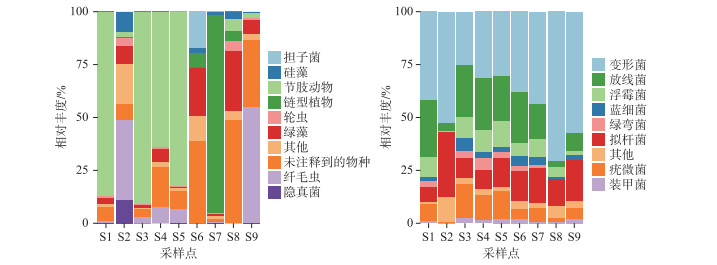
2.2 丹江口水库浮游生物的群落组成丹江口水库各样点的浮游生物群落组成如图 3所示. 丹江口水库真核浮游生物群落组成在门水平上显示出明显的空间变化,主要的真核浮游生物群落包括节肢动物、链型植物、绿藻门、硅藻门等,其中浮游植物的结果与之前的研究结果相类似[5]. 在空间尺度上,样点S1、S3、S4和S5主要由节肢动物组成,说明丹江口水库西北区域汉库的水生昆虫类较其他区域更为丰富;样点S7的优势物种主要是链型植物,链型植物即轮藻和有胚植物,说明该区域水生植物的相对丰度较大,是水生植物较茂盛的地带;样点S6和S8有大部分物种无法获取到门水平上的注释信息,S6为丹江口水库丹库区域,S8样点位于丹江入库处,这些区域的多样性有待进一步研究.
|
图 3 各样点在门分类学水平上基于相对丰度的浮游生物群落组成(a: 真核-18S;b: 原核-16S) Fig.3 The plankton community composition based on relative abundance of each sampling site at phylum level (a: Eukaryotic-18S; b: Prokaryote-16S) |
对于原核浮游生物群落,不同点位间的原核浮游生物群落具有空间异质性,群落组成不尽相同. 水体原核浮游生物群落中的蓝藻(蓝细菌)是被广泛关注的类群,这主要是因为蓝藻易在富营养化的水体中异常增殖形成蓝藻水华,本次调查结果显示,丹江口水库所有样点中的蓝藻相对丰度均较低.
原核浮游生物群落中,变形菌门(Proteobacteria)是丹江口水库所有样点中相对丰度最大的一个类群,由于变形菌门是细菌中最大的一门,故其较高的相对丰度可能在于类群涵盖范围较广,对丹江口水库该类群进行统计,结果如图 4所示. 本次调查发现了多种类型的细菌种类,其中无法培养的细菌占比最大. 在相对丰度较高的细菌中,Limnohabitans能通过共生关系调节水蚤类的繁殖能力,在维持浮游动物种群多样性中起关键作用[21];需要注意的是,不动杆菌Acinetobacter具有较高的相对丰度,而不动杆菌是污水细菌群落的核心类群,被作为水体污染的指示菌群[22].

|
图 4 丹江口水库变形菌门在属分类学水平上的群落组成 Fig.4 The Proteobacteria community composition of Danjiangkou Reservoir at genus level |
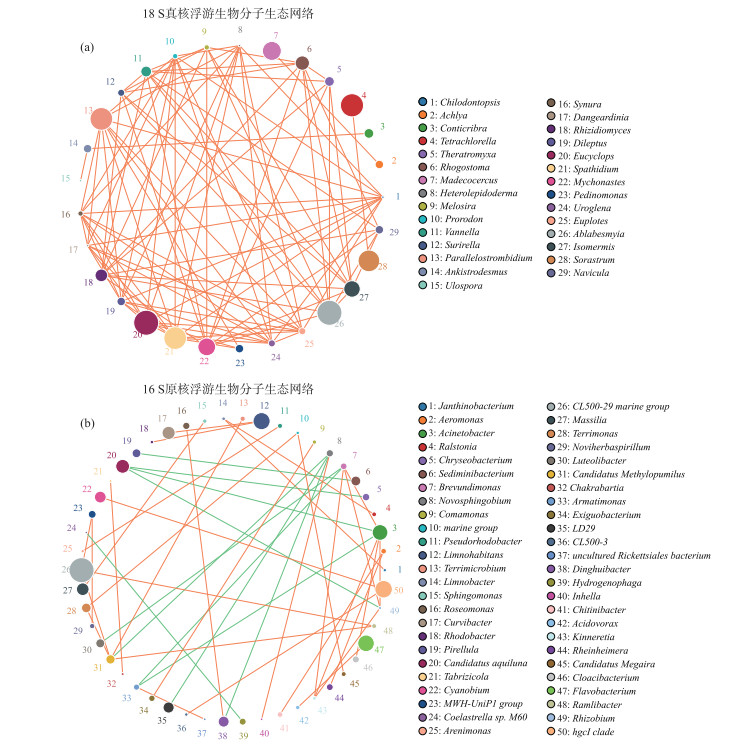
微生物群落中存在着复杂的相互作用机制,分子生态网络能够揭示浮游生物群落物种互作中占有重要地位的类群. 根据各个物种在各个样品中的丰度以及变化情况,进行斯皮尔曼秩相关分析并筛选相关性大于0.1且P值小于0.05的数据构建相关性网络. 通过各样点生物间的分子生态网络分析,从而确定丹江口水库中的重要物种.
从图 5中可以发现,丹江口水库真核浮游生物群落在属水平中起重要作用的类群有四球藻Tetrachlorella、群星藻Sorastrum、无突摇蚊Ablabesmyia、真剑水蚤Eucyclops等. 其中,四球藻、群星藻、真剑水蚤是静水水体中的常见种类;无突摇蚊为底栖动物,但我们采集到的表层水体中却能够测序出该类物种,由于摇蚊幼虫营浮游生活[23],说明无突摇蚊的幼虫在真核浮游生物群落中起重要作用.
|
图 5 真核浮游生物和原核浮游生物在属水平上的分子生态网络(a:真核-18S;b:原核-16S) Fig.5 Molecular ecological network of Eukaryotic and Prokaryotic plankton community at genus level (a: Eukaryotic-18S; b: Prokaryote-16S) |
在丹江口水库原核浮游生物群落在属分类学水平起重要作用的类群有CL500-29_marine_group、hgcI_clade、Limnohabitans、黄杆菌属Flavobacterium、不动杆菌属Acinetobacter等. 其中,CL500-29_marine_group和hgcI_clade与蓝藻关系密切[24],近年的研究显示蓝藻是丹江口水库全年的优势类群[25],蓝藻的物种数和密度在丹江口水库的浮游植物群落中占优势[26],也可能会在夏季水库中进行大量繁殖[5],故需要对丹江口水库加强监测,以预防蓝藻的异常增殖出现. Limnohabitans在水体的富营养化中起着重要作用[27];黄杆菌属是广泛存在于水生环境中的革兰氏阴性好氧菌[28];不动杆菌属则是上文提到的水体污染指示菌.
2.4 丹江口水库浮游生物群落的与环境因子的关系根据浮游生物的出现频率、相对丰度和分子生态网络分析的结果,挑选了分布最广泛、相对丰度最大以及在群落中起重要作用的物种进行tb-RDA分析,结果如图 6所示. 本研究共使用了8个环境因子进行tb-RDA分析,基于方差膨胀系数衡量环境因子中的多重共线性,筛选后使用的环境因子包括浊度(TUR)、溶解氧(DO)、总氮(TN)、化学需氧量(COD)和电导率(TDS).

|
图 6 各样点在种水平上与环境因子间的tb-RDA分析(a:真核-18S;b:原核-16S) Fig.6 The tb-RDA analysis of each sampling site and environmental factors at species level (a: Eukaryotic-18S; b: Prokaryote-16S) |
由图 6可见所有测定的环境因子之间存在一定程度的正相关关系,真核浮游生物在种水平上的群落格局均受到多个环境因子的影响,使用蒙特卡洛拟合方法对环境因子进行显著性检验,TN(R2=0.80,P=0.05)和化学需氧量COD(R2=0.60,P=0.08)是对真核浮游生物群落有较大解释性的变量. 之前的研究表明隐藻是丹江口库区四季的优势种[25],本研究在种水平上发现隐藻门的弯曲隐藻Cryptomonas curvata和对蛋白核隐藻Cryptomonas pyrenoidifera是丹江口分布广泛且相对丰度较大的物种,且二者与COD密切相关(图 6a),而COD能够表征水体有机污染程度,这与之前研究结果相一致,隐藻增加即表明水体受到有机污染[29];同时,空球藻Eudorina elegans也与COD具有较大的相关性(图 6a),而空球藻常分布于有机质丰富的水体中[30],故RDA分析显示了真核浮游生物群落与COD的关系较紧密. 原核浮游生物群落中(图 6b),病原菌-凡隆气单胞菌Aeromonas veronii、条件致病菌-泡囊短波单胞菌Brevundimonas vesicularis以及不动杆菌Acinetobacter junii等均与浊度有较大相关性,Limnohabitans与TN有较大的相关性,这与之前的研究结果相一致[31-32].
2.5 丹江口水库浮游生物群落的空间异质性对丹江口库区真核浮游生物群落和原核浮游生物群落进行PCA分析,结果如图 7所示. 真核浮游生物群落(ADONIS,R2=0.87,P=0.002)和原核浮游生物群落(ADONIS,R2=0.73,P=0.004)均能够划分为3个类型. 样点S1、S3、S4和S5具有更类似的群落组成;样点S6、S7和S8具有更为类似的群落组成;样点S2和S9的群落组成更为类似. 根据各样点的地理位置可知,样点S1、S3、S4和S5属于丹江口水库的汉库区域,样点S6、S7和S8属于丹江口水库的丹库区域,样点S2和S9则是丹江口水库的入库支流区域,故丹江口的浮游生物群落可以分为3个类型,其中丹库为一个类型、汉库为一个类型、入库支流为一个类型. 该结果与之前的研究结果类似[26].
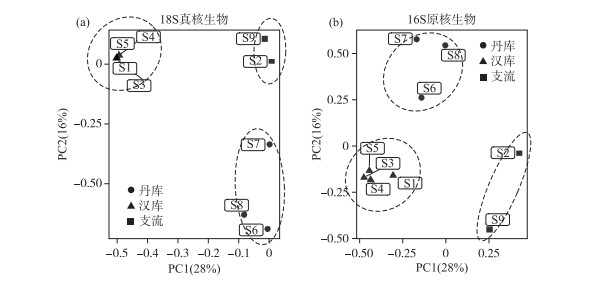
|
图 7 各样点浮游生物群落的PCA分析(a:真核-18S;b:原核-16S) Fig.7 The PCA analysis of the plankton community in each sampling site (a: Eukaryotic-18S; b: Prokaryote-16S) |
对上述3个区域的浮游生物群落计算α多样性指数,采用置换检验的方式进行方差分析,真核浮游生物群落和原核浮游生物群落显示了一致的结果,如表 1所示. Shannon-Wiener指数和Simpson指数能够反映群落整体的多样性,这两种指数能够兼顾群落的均匀度和丰富度,结果显示3个区域的群落差异不显著;Pielou指数能够反映群落内物种的均匀程度,3个区域的群落差异也不显著;物种数、Chao1指数和ACE指数均反映了群落的丰富度,3个区域差异显著. 综上所述,丹库、汉库和支流由于浮游生物群落含有的物种数目不一致,使得群落丰富度差异显著,进而能被划分为3类群落结构.
| 表 1 不同分组条件下浮游生物多样性指数的置换检验P值* Tab. 1 The P value of Permutation test based on plankton diversity indexes in different groups |
本研究表明,丹江口库区的浮游生物仍有较大比例无法注释到物种,说明目前使用的公共数据库中仍然缺乏中国物种的DNA条形码数据,需要在中国本土进一步构建水生生物DNA条形码数据库以丰富各物种的分子信息,提高后续研究中物种注释的比例.
丹江口库区的真核浮游生物群落的分子生态网络显示四球藻、群星藻、无突摇蚊幼虫和真剑水蚤在真核浮游生物群落中起着重要作用. 分布广泛且相对丰度较大的物种有弯曲隐藻、对蛋白核隐藻和空球藻等,它们的分布格局与水体中的化学需氧量密切相关. 因此,真核浮游生物群落格局反映了库区化学需氧量的变化,而化学需氧量与有机污染相关,需要对此持续关注.
原核浮游生物群落中,库区相对丰度较大的不动杆菌Acinetobacter是污水污染的指示菌群;群落中起重要作用的Limnohabitans与水体的富营养化密切相关;库区蓝藻的相对丰度较低,但是与蓝藻关系密切的CL500-29_marine_group和hgcI_clade两类细菌在原核浮游生物群落中也起着重要作用. 综上,丹江口的原核浮游生物群落与污水污染、水体富营养化、蓝藻等联系紧密,故需要加强丹江口水库的水生态监测,以预防水质恶化和蓝藻的异常增殖.
真核和原核浮游生物群落具有类似的空间异质性,能够被划分为丹库型、汉库型和入库支流型3种类型. 不同类型间的浮游生物群落(组间差异)差异较大,而同一类型下的浮游生物群落组成(组内差异)更为相似,不同区域的浮游生物群落在物种丰富度上差异较大.
| [1] |
Chu YF, Zhao SS, Li GG et al. Plankton community structure and evaluation of water quality in Chenqiao east lake wetland. Journal of Yangtze River Scientific Research Institute, 2019, 36(8): 23-29. [褚一凡, 赵闪闪, 李杲光等. 陈桥东湖浮游生物群落结构特征及水质评价. 长江科学院院报, 2019, 36(8): 23-29. DOI:10.11988/ckyyb.20171424] |
| [2] |
Cheng R, Chen HX, Qi C et al. Characteristics of plankton community structure in Shahe Reservoir of the North Canal. Acta Scientiae Circumstantiae, 2021, 41(1): 239-246. [程荣, 陈惠鑫, 亓畅等. 北运河流域沙河水库的浮游生物群落特征分析. 环境科学学报, 2021, 41(1): 239-246. DOI:10.13671/j.hjkxxb.2020.0563] |
| [3] |
Ren LJ, He D, Xing P et al. Bacterial diversity and ecological function in lake water bodies. Biodiversity Science, 2013, 21(4): 422-433. [任丽娟, 何聃, 邢鹏等. 湖泊水体细菌多样性及其生态功能研究进展. 生物多样性, 2013, 21(4): 422-433.] |
| [4] |
Kong LH, Cai QH, Xu YY et al. Seasonal change features of rotifer community and its correlation with environmental factors in Danjiangkou Reservoir. J Lake Sci, 2010, 22(6): 941-949. [孔令惠, 蔡庆华, 徐耀阳等. 丹江口水库浮游轮虫群落季节变动特征及其与环境因子的关系. 湖泊科学, 2010, 22(6): 941-949. DOI:10.18307/2010.0619] |
| [5] |
Wang YH, Chen L, Niu Y et al. Spatio-temporal variation in phytoplankton community and its influencing factors in Dan-Jiangkou Reservoir. J Lake Sci, 2016, 28(5): 1057-1065. [王英华, 陈雷, 牛远等. 丹江口水库浮游植物时空变化特征. 湖泊科学, 2016, 28(5): 1057-1065. DOI:10.18307/2016.0516] |
| [6] |
Zhou M, Tang T, Yang MZ et al. Investigations and studies on fishery resources of main canal of South-to-North Water Diversion Middle Route Project. China Water Resources, 2019(14): 33-36. [周梦, 唐涛, 杨明哲等. 南水北调中线干线鱼类资源调查研究. 中国水利, 2019(14): 33-36.] |
| [7] |
Chi SY, Zhao XF, Gao SB et al. The spatial distribution pattern of autumn macroinvertebrates in relation to environmental factors in Danjiangkou Reservoir. Acta Ecologica Sinica, 2021, 41(3): 1229-1241. [池仕运, 赵先富, 高少波等. 丹江口水库秋季底栖动物群落状态和空间分布及其与环境因子的关系. 生态学报, 2021, 41(3): 1229-1241.] |
| [8] |
Hu YX, Liu XD, Xing WY et al. Marker gene analysis reveals the spatial and seasonal variations in the eukaryotic phytoplankton community composition in the Yangtze River, Three Gorges Reservoir, China. Journal of Plankton Research, 2019, 41(6): 835-848. DOI:10.1093/plankt/fbz065 |
| [9] |
Xu N, Xiong MH, Shao K et al. Preliminary study on environmental DNA metabarcoding for detecting biodiversity in the middle and lower reaches of the Yangtze River. Research of Environmental Sciences, 2020, 33(5): 1187-1196. [徐念, 熊美华, 邵科等. 长江中下游环境DNA宏条形码生物多样性检测技术初步研究. 环境科学研究, 2020, 33(5): 1187-1196.] |
| [10] |
Xu YK, Ma Y, Hu A et al. Analysis of prospective microbiology research using third-generation sequencing technology. Biodiversity Science, 2019, 27(5): 534-542. [许亚昆, 马越, 胡小茜等. 基于三代测序技术的微生物组学研究进展. 生物多样性, 2019, 27(5): 534-542.] |
| [11] |
Callahan BJ, Wong J, Heiner C et al. High-throughput amplicon sequencing of the full-length 16S rRNA gene with single-nucleotide resolution. Nucleic Acids Research, 2019, 47(18): e103. DOI:10.1093/nar/gkz569 |
| [12] |
Lie AAY, Liu ZF, Hu SK et al. Investigating microbial eukaryotic diversity from a global census: Insights from a comparison of pyrotag and full-length sequences of 18S rRNA genes. Applied and Environmental Microbiology, 2014, 80(14): 4363-4373. DOI:10.1128/AEM.00057-14 |
| [13] |
Kurobe T, Baxa DV, Mioni CE et al. Identification of harmful cyanobacteria in the Sacramento-San Joaquin delta and clear lake, California by DNA barcoding. Springer Plus, 2013, 2(1): 491. DOI:10.1186/2193-1801-2-491 |
| [14] |
Martin M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet Journal, 2011, 17(1): 10. DOI:10.14806/ej.17.1.200 |
| [15] |
Edgar RC, Haas BJ, Clemente JC et al. UCHIME improves sensitivity and speed of chimera detection. Bioinformatics, 2011, 27(16): 2194-2200. DOI:10.1093/bioinformatics/btr381 |
| [16] |
Edgar RC. Search and clustering orders of magnitude faster than BLAST. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [17] |
Bolyen E, Rideout JR, Dillon MR et al. Reproducible, interactive, scalable and extensible microbiome data science using QⅡME 2. Nature Biotechnology, 2019, 37(8): 852-857. DOI:10.1038/s41587-019-0209-9 |
| [18] |
Ondov B, Bergman N, Phillippy A. Interactive metagenomic visualization in a Web browser. BMC Bioinformatics, 2011, 12(1): 385. DOI:10.1186/1471-2105-12-385 |
| [19] |
Zhang TH. Realization of complex network characteristics based on NetworkX and their application in biological networks[Dissertation]. Guangzhou: South China University of Technology, 2016. [张庭辉. 基于NetworkX的复杂网络特征实现及其在生物网络中的应用[学位论文]. 广州: 华南理工大学, 2016. ]
|
| [20] |
Oksanen J, Blanchet F, Kindt R et al. vegan: community ecology package 1.18-2. Time International, 2010, 1997(6): 15-17. DOI:10.1002/ltl.40619970607 |
| [21] |
Peerakietkhajorn S, Kato Y, Kasalický V et al. Betaproteobacteria Limnohabitans strains increase fecundity in the crustacean Daphnia magna: Symbiotic relationship between major bacterioplankton and zooplankton in freshwater ecosystem. Environmental Microbiology, 2016, 18(8): 2366-2374. DOI:10.1111/1462-2920.12919 |
| [22] |
Hu AY, Li JW, Yang XY et al. Analysis of prokaryotic community structure in river waters of the Ningbo Sanjiang mouth. Environmental Science, 2015, 36(7): 2487-2495. [胡安谊, 李姜维, 杨晓永等. 宁波三江口水域原核生物群落结构分析. 环境科学, 2015, 36(7): 2487-2495. DOI:10.13227/j.hjkx.2015.07.022] |
| [23] |
Wang S, Zhang KF, Li M et al. Contamination and prevention technology of chironomid larvae in drinking water treatment. Water Technology, 2013, 7(1): 22-26. [王珊, 张克峰, 李梅等. 饮用水处理系统中摇蚊幼虫的污染及防治技术研究. 供水技术, 2013, 7(1): 22-26.] |
| [24] |
Chen GZ, Jiang XY, Hu Y. Characteristics of bacterial communities and their Co-occurrence networks in lake ecosystem with different trophic states. Research of Environmental Sciences, 2020, 33(2): 375-384. [陈光哲, 姜星宇, 胡洋. 不同营养程度湖泊中细菌群落组成及其分子生态网络特征. 环境科学研究, 2020, 33(2): 375-384.] |
| [25] |
Jia HY, Xu JF, Lei JS. Relationship of community structure of phytoplankton and environmental factors in Danjiangkou Reservoir bay. Yangtze River, 2019, 50(5): 52-58. [贾海燕, 徐建锋, 雷俊山. 丹江口库湾浮游植物群落与环境因子关系研究. 人民长江, 2019, 50(5): 52-58.] |
| [26] |
Hui Y, Liu D, Wang Z et al eds. Evaluation on current status of aquatic ecology and fishery resources protection in Danjiangkou Reservoir. In: 2020 Chinese Society For Environmental Sciences proceeding (Volume One). Beijing: Chinese Society For Environmental Sciences, 2020: 9. [惠筠, 刘德中, 王兆平等. 丹江口水库库区水生态现状评价及渔业资源保护措施. 见: 2020中国环境科学学会科学技术年会论文集(第一卷). 北京: 中国环境科学学会, 2020: 9. ]
|
| [27] |
Zhao DD, Luo JF, Huang XY et al. Diversity of bacterial APase phoD gene in the Pearl River water. Acta Scientiae Circumstantiae, 2015, 35(3): 722-728. [赵丹丹, 罗剑飞, 黄晓燕等. 珠江水体中细菌碱性磷酸酶基因phoD的多样性. 环境科学学报, 2015, 35(3): 722-728. DOI:10.13671/j.hjkxxb.2014.0876] |
| [28] |
Yang Y, Qian L, Dai QY et al. The diversity of surface aquatic bacteria from lake dongting in Yueyang, Hunan. Life Science Research, 2008, 12(4): 333-339. [杨宇, 钱林, 代沁芸等. 湖南岳阳洞庭湖3个样点的表层水体细菌多样性研究. 生命科学研究, 2008, 12(4): 333-339.] |
| [29] |
Chai Y, Peng T, Guo K et al. Community characteristics of phytoplankton in Lake Changhu and relationships with environmental factors in the summer of 2012. Chinese Journal of Plant Ecology, 2014, 38(8): 857-867. [柴毅, 彭婷, 郭坤等. 2012年夏季长湖浮游植物群落特征及其与环境因子的关系. 植物生态学报, 2014, 38(8): 857-867. DOI:10.3724/SP.J.1258.2014.00080] |
| [30] |
Hu YX, Xing WY, Zhu H et al. The newly record of colonial algae in volvocales from China. Acta Hydrobiologica Sinica, 2016, 40(6): 1257-1265. DOI:10.7541/2016.164 |
| [31] |
Zhou L, Li YS, Huang XD et al. Spatial distribution of bacterioplankton community in Hongchaojiang Reservoir and its relationship with environmental factors. Acta Microbiologica Sinica, 2020, 60(10): 2253-2264. [周磊, 李育森, 黄仙德等. 洪潮江水库浮游细菌群落空间分布及其与环境因子的关系. 微生物学报, 2020, 60(10): 2253-2264.] |
| [32] |
Du YY, Lou ZY, Zhang YP et al. Effect of cage culture on community structure and influencing factors of bacterioplankton in Liujiaxia Reservoir. Freshwater Fisheries, 2018, 48(5): 11-16. [杜岩岩, 娄忠玉, 张艳萍等. 网箱养殖对刘家峡水库浮游细菌群落组成及影响因素分析. 淡水渔业, 2018, 48(5): 11-16.] |
 2021, Vol. 33
2021, Vol. 33 

