(2: 江苏省地质调查研究院, 自然资源部(国土)耕地生态监测与修复工程技术创新中心, 南京 210018)
(2: Technology Innovation Center of Ecological Monitoring & Restoration Project on Land(Arable), MNR Geological Survey of Jiangsu Province, Nanjing 210018, P. R. China)
全氟化合物(Perfluorinated compounds, PFCs)是一类人工合成的新型持久性有机污染物,具有一定的生物累积性、环境持久性和长距离迁徙性,其在化工、电子、纺织、制药、航空、电镀和合成洗涤剂等方面被大量使用[1-3]. PFCs能够通过多种途径进入环境,在地表水[4-5]、沉积物[6]、土壤[7]、野生动物[8]甚至人体[9]内广泛赋存,产生生殖毒性、神经毒性及致畸性,威胁生态安全及人类健康[10-12]. 作为两种主要的PFCs,全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)和全氟辛酸(perfluorooctanoic acid, PFOA)生产量和使用量最大,环境检出最为频繁,先后被列入斯德哥尔摩公约和美国环保署的限制生产排放协议[13]. 为了满足生产需要,包括中国在内的多个发展中国家仍在大量使用,导致PFCs成为危害我国生态环境的重要污染物,尤其是在长江三角洲地区、珠江三角洲地区、中北部工业区等. 我国长江流域氟化工业发达,该区域河流、湖泊以及水库中PFCs均有高频次的检出,检出浓度一般低于μg/L水平. 例如,长江重庆段16种PFCs的总浓度在1.54~61.93 ng/L(均值23.94 ng/L)[14],长江汉江段11种PFCs的总浓度为0.16~23.04 ng/L[15],长江中游的武汉段、洞庭湖、鄱阳湖、洪湖等区域,平均浓度达到了22.53 ng/L以上[16],到长江下游黄浦江水体中,14种PFCs浓度最高达到596.2 ng/L(平均浓度226.3 ng/L)[17]. 整个长江流域PFOS都是最主要的PFCs,下游水体污染程度明显高于上游. 流域对比来看,长江流域中PFCs污染水平高于太湖流域[18]、珠江流域[19]和乌梁素海流域[20],与韩国[21]、西班牙[22]部分河湖水域中PFCs浓度相当. 现有的研究大多集中在大江大河水体,平原地区不同受纳水体中PFCs的污染特征尚不明确.
目前PFCs在水环境介质中的调查主要集中在传统水相和沉积相,对于胶体介质的吸附影响研究还相当匮乏. 胶体介质具有体积小、比表面积大、吸附位点多等特点,能够有效吸附水中的有机化合物,并对其迁移、转化、生物有效性等环境行为产生重要影响[23-24]. 长江滨岸水体中胶体对新兴有机污染物的吸附贡献率可达42.3 %,吸附作用与胶体的粒径、电位、类腐殖质等因素直接相关[24]. 泰州市姜堰区地跨长江三角洲和里下河平原,区域内河流湖泊众多,水产丰富,水资源利用类型多变,经济社会与环境保护协调发展,是我国建设的首批国家级生态示范区. 基于以上背景,本研究以姜堰区为完整研究区域,在农业区、工业区、养殖区、湿地区、城市区、农村居民聚集区等不同受纳类型河湖水体中开展4种典型的PFCs的定性定量分析工作,探讨其污染水平、成分组成、空间分布和胶体吸附潜能,并评价其生态风险,以期为生态示范区的水环境保护和有机污染物综合治理提供理论基础和参考依据.
1 材料和方法 1.1 标准品和试剂4种PFCs标准品全氟辛酸(PFOA)、全氟壬酸(PFNA)、全氟正癸酸(PFDA)和全氟辛烷磺酸(PFOS)购买于Sigma-Aldrich试剂公司;正己烷、二氯甲烷、乙腈、甲醇、丙酮均为色谱纯试剂,购于美国Merck公司;Waters Oasis WAX固相萃取小柱(200 mg, 6 mL),购于美国Waters公司;实验用水为Milli-Q纯净水.
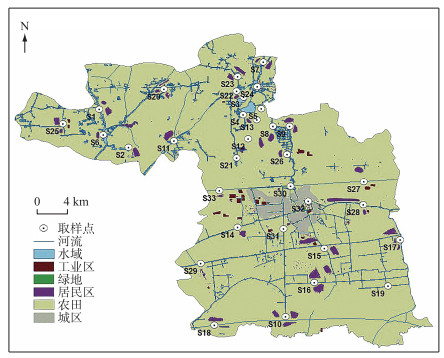
1.2 采样点布设在泰州市姜堰区共设置了33个采样点位,采样时间为2018年8月,采样时节为丰水期,天气情况良好,水温在25.0~28.6℃之间,每个点位采集水样2 L,平行样品2个. 采样点主要分布在7类区域,分别为水产养殖区(S1和S2)、溱湖湿地公园(S3~S5)、农业区(S6~S10)、农业/居民混合区(S11~S19)、居民聚集区(S20~S24)、工业区(S25~S29)和城市区(S30~S33),具体见图 1.
|
图 1 江苏省泰州市姜堰区采样点布设示意 Fig.1 Distribution of sampling sites in Jiangyan District, Taizhou City, Jiangsu Province |
在水面以下0.3~0.5 m范围内用准备好的聚丙烯采样瓶采集水样2 L,现场测定水质参数,采集后的水样过1.0 μm的醋酸纤维滤膜. 将过滤后的水样利用切向超滤装置和孔径为1000 Da聚醚砜过滤膜进行分离,以获得胶体相(1000 Da~1 μm)和超滤水相(<1000 Da). 胶体相和超滤水相加甲酸调至pH=2.5,用固相萃取装置萃取. 用5 mL甲醇、5 mL 0.1 % (V/V)氨-甲醇溶液和5 mL超纯水活化WAX小柱,以2~2.5 mL/min的速率过样,经10 mL超纯水进行淋洗. 最后用5 mL甲醇和5 mL 0.1 % (V/V)氨-甲醇溶液进行洗脱,洗脱液被收集到聚丙烯管中,氮吹至近干,用甲醇定容至1 mL,然后过0.22 μm滤膜,置于聚丙烯材质进样瓶中,低温冷藏待测.
1.4 仪器分析与质量控制超高效液相色谱-三重四级杆串联质谱仪(配有电喷雾离子源),Waters ACQUITY UPLC Xevo TQ,美国Waters公司;ACQUITY BEH C18色谱柱(2.1 mm×100 mm, 1.7 μm,美国Waters公司). 流动相A为5 mmol/L的醋酸铵溶液,流动相B为100 % 乙腈;流动相梯度变化如表 1所示.
| 表 1 流动相梯度变化 Tab. 1 Gradient change of mobile phase |
采用正负离子模式的电喷雾(ESI)离子源以及多反应监测模式(MRM)定量分析目标污染物. 质谱仪条件:毛细管电压3.0 kV,碰撞气体流速0.16 L/min,离子源温度150℃;锥孔反吹气流量50 L/h;脱溶剂气温度400℃;脱溶剂气流量900 L/h目标微污染物的电离模式、母离子、子离子、碰撞能等质谱条件见表 2.
| 表 2 目标化合物质谱参数 Tab. 2 Mass spectrum parameters of the target compounds |
样品采集、样品前处理及样品分析整个过程遵循严格的质量控制程序. 采样过程设置野外现场空白. 每批样品添加一个方法空白、溶剂空白和空白加标样进行实时校正. 空白组的基质为去离子水,在现场空白、方法空白和溶剂空白中4种PFCs目标物均未检出或低于定量限. 标准曲线的浓度范围为0.1~200 μg/L,线性相关系数R2>0.99,以3倍信噪比(S/N)确定方法检出限(LOD),4种PFCs的LODs在8.3~30.0 ng/L之间,在100 ng/L浓度水平下的加标回收率范围为68.9 % ~108.5 %,满足分析要求.
1.5 数据分析方法为评估水体中PFCs对水生生物的影响,采用风险熵值法(RQ)对PFOA、PFNA、PFOS和PFDA进行生态风险评价,RQ的计算方法为:
| $RQ=MEC/PNEC$ | (1) |
式中,MEC和PNEC分别为环境介质中实测浓度和预测无效应浓度. 根据所选毒性数据和模式生物营养级的不同,PNEC需用不同的评估因子(AF)计算得到. 采用急性毒性数据EC50或LC50前提下,AF取值为1000;当选用长期或慢性无可观察效应浓度(NOEC)时,根据生物的营养级水平分别选取AF值为100、50和10. 由于慢性毒性数据缺失和有限的急性毒理数据,综合考虑毒性试验的标准程度和毒性终点的敏感性,PNEC采用评价因子法和基于物种敏感性分布的统计外推法获得,PFOA、PFNA、PFOS、PFDA对于藻类、溞类、鱼类的部分毒理数据见表 3[25]. 通常按RQ的大小将污染物的生态风险水平分为4个级别,>1为高风险,0.1~1之间为中等风险,0.01~0.1之间为低风险,<0.01为无风险.
| 表 3 4种PFCs对水生生物的毒理数据 Tab. 3 Toxicological data of four PFCs for aquatic organisms |
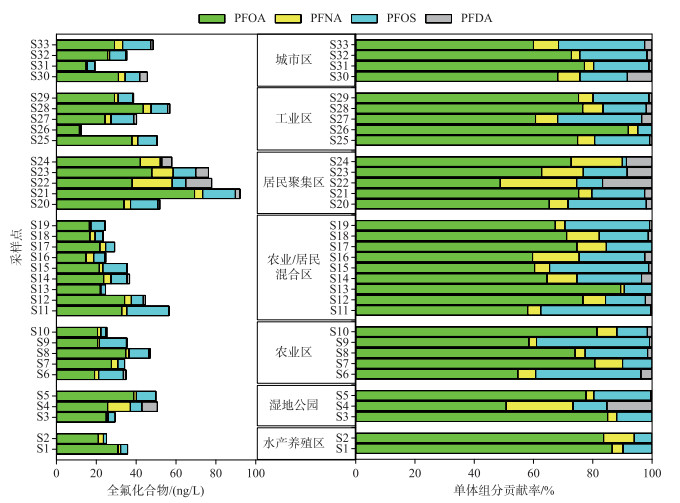
传统溶解相中4种PFCs的污染水平及空间分布特征见图 2和表 4. 从结果可知,4种PFCs中,PFOA、PFNA和PFOS的检测率最高,为100 %,而PFDA则为78.8 %. 4种PFCs的总浓度在12.5~92.1 ng/L之间,平均浓度为41.6 ng/L. PFOA作为最主要的污染物,其浓度范围为11.5~69.3 ng/L,平均浓度为28.7 ng/L. PFOS和PFNA浓度相当,最高浓度分别达到21.0和20.1 ng/L,平均浓度分别为7.7和3.6 ng/L. PFDA浓度最低,平均浓度为1.6 ng/L,最高达到13.0 ng/L. 从单体贡献率上来看,PFOA浓度占所有PFCs检出总浓度的70 % 以上,其次是PFOS(平均贡献率为18.5 %)、PFNA(7.8 %)和PFDA(2.8 %). 相似的结果在我国千岛湖表层水和胶州湾表层海水中被发现,在这两个区域中PFOA是众多PFCs中检测频率和检出浓度最高的污染物,接近100 %,在胶州湾海水中PFCs的总浓度在1.71~48.27 ng/L之间,PFOA平均浓度为16.41 ng/L,单体贡献率在29.2 % ~95.6 % 之间[26-27]. 这与PFCs的市场使用量和使用途径直接相关,PFOA和PFOS被广泛应用于石化行业、五金电镀、纺织品生产、橡胶乳化等工业制造和食品包装、纸类表面处理等生活用品生产,而PFNA和PFDA主要源于全氟羧酸生产过程的排放,使用量和使用途径相对偏低.
|
图 2 PFCs在姜堰区地表水传统溶解相中的浓度及组分贡献率 Fig.2 Concentrations and compositions of PFCs in traditionally dissolved phase of surface water from Jiangyan District |
| 表 4 姜堰区地表水中PFCs的浓度范围和平均值(中值) Tab. 4 Concentration ranges and mean (median) values of PFCs in surface water from Jiangyan Districty |
从空间分布来看,居民聚集区(S20~S24)污染水平最高,5个采样点的PFCs总浓度范围为51.9~92.1 ng/L,平均浓度为71.2 ng/L. 其中泰东河(S21)在所有采样点中检出浓度最高(92.1 ng/L),PFOA浓度达到69.3 ng/L,单体贡献率为75.2 %. 泰东河是姜堰区最主要的主干河道,东接溱湖湿地,西连新通扬运河,沿岸居民聚集,支流汇入口众多,是该流域农业面源径流和居民生活污水的主要受纳水体,这可能是引起PFCs浓度偏高的主要原因. 溱湖湿地公园平均浓度为43.3 ng/L,显著低于居民聚集区,略高于其他几个研究区域. 溱湖湿地公园与泰东河水体连通,在水体交换过程中泰东河水体中的PFCs进入到湿地公园,可能是该区域PFCs相对偏高的原因. 其他研究区域(包括城市区、工业区、农业区、水产养殖区等)浓度相近,PFCs平均浓度在30~40 ng/L之间,其中PFCs浓度最高的为工业区(39.8 ng/L),污染浓度最低的是水产养殖区(30.4 ng/L). PFNA、PFOS和PFDA 3种单体的最高浓度均出现在居民聚集区或居民/农业混合区. 分析7个研究区域中4种PFCs贡献率,发现姜堰区所有采样点中4种PFCs贡献占比具有较高的相关性(0.999>R2>0.942, P<0.01),这说明姜堰区河湖水系中PFCs的污染来源具有相似性. 根据比值法对PFCs来源定性分析[28],在整个采样区域PFOS/PFOA值均小于1,这表明该区域降雨输入是最主要的污染途径,42 % 的点位PFOA/PFNA值在7~15之间,36 % 的点位PFOA/PFNA值大于15,这表明研究区域PFCs污染受工业排放和前驱体降解的双重作用,在水产养殖区、溱湖湿地、城市区PFCs的来源由前驱体发生降解主导,其他区域主要受工业点源排放的影响. 农村或乡镇居民聚集区相对于城市居民聚集区来说,PFCs污染更为严重,主要由于农村或乡镇区域的污水收集、处理能力偏弱,小型工厂零星分布. 另外,农村或乡镇居民聚集区水系中PFOA/PFNA均值为7.6,表明该区点源排放是PFCs污染的主导因素,而湿地公园PFCs污染应考量汇入河流的水质情况.
溱湖湿地是我国著名的国家级生态湿地公园,4种PFCs检出率接近100 %,检出总浓度在29.4~50.6 ng/L之间,其中PFOA和PFOS是最主要的污染物,浓度范围分别为25.0~38.8 ng/L(平均浓度29.8 ng/L)和3.5~9.6 ng/L(平均浓度6.3 ng/L). 以PFOA和PFOS为目标,表 5总结了溱湖湿地公园与其他淡水湖泊中两种污染物的污染水平. 从表 5可以看出,PFOA在溱湖湿地中的污染水平显著低于白洋淀(2010)、武汉的东湖(2009)和汤逊湖(2011),与巢湖(2015)、太湖流域(2009)污染水平相当,显著高于千岛湖(2017)、深圳水库(2012)、官厅水库(2008)、鄱阳湖(2011)、意大利Maggiore Lake(2006)等水域. PFOS污染水平显著低于白洋淀(2010)、武汉东湖(2009)和汤逊湖(2011)、太湖(2009)、东莞同沙水库(2017)和韩国Shihwa Lake(2004),与巢湖(2015)、意大利Maggiore Lake(2006)和美国的Great Lake(2019)污染水平相当,显著高于鄱阳湖(2011)、官厅水库(2008)等水域. 总体上溱湖湿地公园中PFOA和PFOS的污染程度处于中等偏下水平.
| 表 5 溱湖湿地公园与全球部分地区淡水湖泊PFOA和PFOS浓度比较* Tab. 5 Comparison of the concentration of PFOA and PFOS between Qinhu Wetland Park and freshwater lakes around the world |
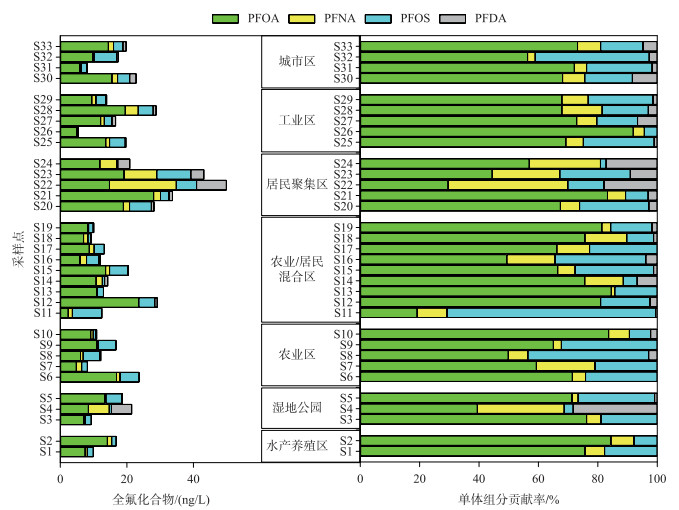
胶体广泛存在于地表水环境中,是多种新型有机污染物的重要“汇”[41],能改变污染物在水环境中的迁移、转化、生物累积等多种环境行为,并对水生生物的生长产生重要影响[42-43]. 4种PFCs在胶体介质中的赋存状况见图 3和表 4. 在胶体相中,4种PFCs中均被检出,检出率为78.8 % ~100 %,其中PFOA和PFOS检出率100 %,PFNA次之(97 %). 胶体相中PFCs的总浓度范围为5.4~49.9 ng/L. 与PFCs在传统溶解相中的单体分布相似,PFOA仍然是最主要的污染物,浓度范围为2.4~28.0 ng/L,其次是PFOS (0.2~10.2 ng/L)、PFNA (0~20.1 ng/L)、PFDA (0~8.9 ng/L),平均浓度分别为11.7、3.5、2.2和1.0 ng/L. 就单体组成而言,在胶体相中,PFOA的平均占比为66.6 %,其次是PFOS(19.6 %)、PFNA(9.9 %)和PFDA(4.0 %). 在太湖流域常熟地区平原河网中,PFOA、PFOS、PFNA和PFDA的平均浓度分别达到113.07、47.41、15.72和40.25 ng/L,高于姜堰区PFCs在胶体中的赋存水平,但成分组成占比与本文相似[44].
|
图 3 姜堰区33个点位胶体相的PFCs浓度与组成 Fig.3 Concentrations and composition of 33 PFCs in colloidal phase of Jiangyan District |
从空间分布来看,居民聚集区地表水体中PFCs的赋存水平最高,总浓度达到35.1 ng/L,其他区域水体中PFCs总浓度相差不大,浓度范围为13.3~17.0 ng/L,最高浓度依然出现在姜堰区的主干河流泰东河(S22),位于传统溶解相PFCs污染水平最高点(S21)的上游,毗邻溱湖湿地公园. 与溶解相相比,该点位(S22)胶体相中的主要PFCs组分是PFNA和PFOA,浓度分别达到20.1和14.8 ng/L,单体贡献率分别为40.3 % 和29.6 %,其次为PFDA(17.9 %)和PFOS(12.2 %),说明胶体中污染物的组成与溶解相略有区别,这可能与污染物物化性质等相关. 从7个区域河湖水系中PFCs的组成来看,4种PFCs的贡献占比具有相似性,除了居民聚集区和城市区中PFCs组分占比相关性稍低外(R2<0.88),其他区域组分贡献相关性均大于0.9,这说明在研究区域胶体相中4种PFCs与传统溶解相具有相似的赋存特性,而PFCs单体贡献率在城市和农村居民聚集区水系胶体中相关性偏弱的影响机制有待进一步研究.
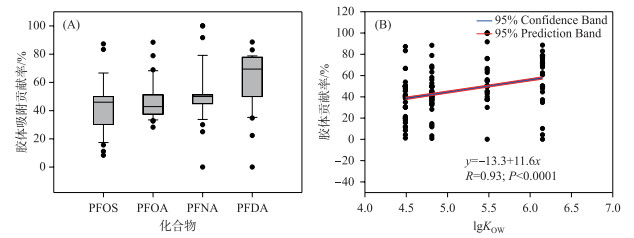
2.3 PFCs在水体中的胶体吸附特征为了评估胶体对PFCs的潜在影响,图 4显示了胶体在传统溶解相中对PFCs的吸附潜能. 传统溶解相中,胶体对4种PFCs的平均吸附贡献率在42.6 % ~66.1 % 之间(图 4A),其中胶体对PFDA的吸附潜能最大,吸附贡献率在35 % ~89 % 之间,平均值为66.1 %,其次是PFNA(均值53.5 %)、PFOA(47.0 %)和PFOS(42.6 %). 从空间分布来看,居民聚集区和水产养殖区水体中胶体对PFCs的吸附贡献率最大,分别达到57.4 % 和56.5 %,其次是城市区(52.8 %)、工业区(52.3 %)、农业/居民混合区(50.3 %)、农业区(49.5 %)和湿地区(47.9 %),这说明农村居民聚集区和水产养殖区水体中胶体对PFCs具有更高的吸附潜能,这可能与该区域的污废水直排和胶体性能有关. 研究发现污水和养殖废水能够改变水体中胶体的粒径分配,进而影响胶体对污染物的吸附潜能[24]. 在太湖流域常熟地区河网系统中,发现胶体对PFCs的吸附贡献率在45.46 % ~62.59 % 之间[44],胶体有机碳含量、颗粒粒径、电荷条件等因素是影响PFCs在水-胶体两相分配的主要原因,而与胶体浓度无明显相关. 与悬浮颗粒物相比,胶体对PFCs具有更高的吸附潜能[44],其吸附潜能比悬浮颗粒物高1~2个数量级[45]. 相似的结果在其他新型污染物中也被发现,传统溶解相中4 % ~45 % 的药物活性化合物和9.5 % ~50.4 % 的双酚类化合物被胶体介质吸附,胶体吸附潜能与物质的疏水特性和胶体有机质含量显著相关[45-46]. 胶体不仅具有较小的粒径、较大的比表面积,其较高的溶解性有机碳(DOC)含量,更有利于胶体对有机污染物的吸附作用[47]. 此外,胶体颗粒还存在Ca、Mg、Na和K等多种元素,可以通过静电作用和阳离子交换作用与PFCs等有机化合物稳定结合[28, 47]. 本研究中胶体对PFCs吸附含量占传统溶解相PFCs总含量的50 % 左右,胶体对4种PFCs的吸附贡献率与其正辛醇-水分配系数(lgKOW)呈现显著的正相关(图 4B). 这些研究结果表明在传统溶解相中胶体对多种有机污染物具有极强的吸附作用,化合物的疏水性能是影响水体中PFCs赋存和分配的主要因素之一. 胶体粒径较小、结合位点多,极易与有机污染物结合被水生生物摄取,且胶体具有较高的生物利用度,能够改变有机污染物的生物有效性[48-49],但胶体及其结合物生物效应改变的原因尚不明确,胶体对污染物的吸附机制研究仍需进一步加强.
|
图 4 地表水传统溶解相中胶体对PFCs吸附贡献率(A)及其与lgKOW的关系(B) Fig.4 Contribution rates of colloids to the PFCs (A) and the relationships between lgKOW and contribution rates (B) in traditionally dissolved phase of surface water |
PFCs对生物具有毒性作用,长期暴露能够影响幼鱼的性腺发育,引起雌雄数量失调,对胚胎生长、生殖和后代发育产生不利影响,甚至个体死亡[50-52]. 根据国内外生态风险评价进展,本研究主要基于熵值法和水质量基准进行量化表征. 根据本研究区域中4种PFCs在传统相的检出浓度(<70 ng/L)和评价因子法得到的PNEC(3640 ng/L<PNEC)计算,发现PFCs对藻类、溞类和鱼类的风险水平均低于0.01,这表明该区域内检出的PFCs未对水生生物产生生态风险. 根据物种敏感度分布方法得到的PNEC(0.61 μg/L)进行计算[53],发现PFOS的生态风险值(RQPFOS)在0.001~0.034之间,58 % 的点位大于0.01,处于低风险状态(图 5). 评估结果表明检出的PFCs对于水环境中95 % 的生物物种不存在生态风险,只有少部分生物物种处于低风险状态. 物种敏感度分布方法使用的毒理数据主要来源于急性和慢性生态毒性试验的生长率、死亡率等测试终点,忽略了PFCs长期暴露对生态系统丰度、生产量等方面的影响. 熵值法计算过程中毒理数据单一,未考虑物种之间的相互关系及污染物的生物富集和放大效应,但PFCs难降解,持久性强,且具有较高的生物富集性,容易在生物体和食物网中累积放大. 由于胶体对PFCs生物有效性的影响机制和贡献量尚不清楚,生态风险评价过程未考虑胶体存在对PFCs毒理效应的影响. 因此,在有机污染物的生态风险评估过程中,综合考虑胶体存在对有机污染物毒理效应的影响权重和评价方法有效性,对准确评估水环境中PFCs等有机污染物的生态风险具有重要意义.
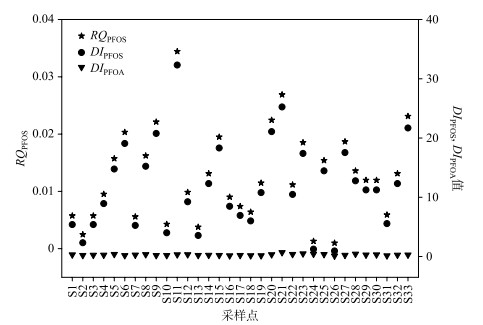
|
图 5 研究区域传统溶解相中PFOS的生态风险值(RQPFOS)和PFOA、PFOS环境检出浓度与环境质量标准比值(DIPFOA和DIPFOS) Fig.5 RQPFOS, DIPFOA and DIPFOS of PFOA/PFOS in traditionally dissolved phase of surface water from study area |
根据欧盟委员会设定的PFOS在淡水环境中的年均环境质量标准AA-EQSfw(0.65 ng/L),所有采样点中PFOS的污染水平均高于0.65 ng/L,环境检出浓度与AA-EQSfw的比值(DIPFOS)在0.9~32.3之间,接近60 % 的点位高出此标准10倍以上,最高达到32倍左右,但仍远低于最大允许浓度36 μg/L,这表明姜堰区水环境中PFOS对水生生物产生急性风险的概率较低,但长期慢性风险不容忽视. 这与我国天津滨海新区湿地公园PFOS生态风险水平相似,湿地公园中PFOS的浓度大于0.65 ng/L,低于最大允许浓度36 μg/L[22, 54]. 根据Valsecchi等[55]计算的年均环境质量标准AA-EQSfw(0.1 μg/L),PFOA在所有采样点中的污染水平均低于0.1 μg/L,环境检出浓度与AA-EQSfw的比值(DIPFOA)在0.12~0.69之间,在姜堰区主要纳污河流泰东河流域PFOA污染水平接近年均环境质量标准值,存在一定的慢性生态风险,但均低于2220 μg/L的最大可接受浓度和EPA规定的饮用水中的限值(0.4 μg/L). 利用Valsecchi等提出的海水水生生物的浓度限值[55],王世亮等对山东省20个滨海旅游度假区水体中PFOA和PFOS污染水平进行风险评估,发现该区域水体中PFOA和PFOS污染水平均高于欧盟规定的保护海洋生物的浓度限值,PFOS和PFOA造成的生态毒理风险不容忽视,建议加强立法与污染管控[56].
3 结论在传统溶解相和胶体相中,PFOA、PFNA、PFOS和PFDA均被检出,检出率在78.8 % ~100 % 之间,总浓度范围分别为12.5~92.1和5.4~49.9 ng/L. PFOA是溶解相和胶体相最主要的PFCs,贡献率在65 % 以上. 从空间分布来看,居民聚集区水域中PFCs污染水平最高,其次是溱湖湿地公园、工业区、农业区及城市区,水产养殖区污染水平最低. 在传统溶解相中,胶体对PFCs的平均吸附贡献率在42.6 % ~66.1 % 之间,农村居民聚集区和水产养殖区水体中胶体呈现出较高的吸附潜能. 胶体对PFCs的吸附贡献率与其疏水特性呈显著正相关,传统溶解相中平均66.1 % 的PFDA吸附在胶体介质中. 从风险评价结果可知,PFOS对大部分水域中的水生生物产生低风险毒理影响. 此外,PFOS的污染水平均高于欧盟委员会设定的PFOS在淡水环境中的年均环境质量标准(0.65 ng/L),且PFCs具有累积特性和长距离传输能力,其长期的累积效应依然不容忽视.
| [1] |
Zhang M, Lou QT, Shao QW et al. Research progress of perfluorinated compounds pollution status and risk assessment. Asian Journal of Ecotoxicology, 2019, 14(3): 30-53. [张美, 楼巧婷, 邵倩文等. 全氟化合物污染现状及风险评估的研究进展. 生态毒理学报, 2019, 14(3): 30-53. DOI:10.7524/AJE.1673-5897.20180821001] |
| [2] |
Elmonznino JA. Occurrence, fate and distribution behaviors of organic contaminants, perfluorinated alkyl acids and phthalic acid esters, in wastewater effluent and the Housatonic River Estuary. Storrs, CT: University of Connecticut, 2016.
|
| [3] |
Clara M, Gans O, Weiss S et al. Perfluorinated alkylated substances in the aquatic environment: An Austrian case study. Water Research, 2009, 43(18): 4760-4768. DOI:10.1016/j.watres.2009.08.004 |
| [4] |
Yang YL, Lu GH, Yang WX et al. Levels and distribution of perfluorinated compounds in water and biological samples from the Shenyang area, China. Acta Scientiae Circumstantiae, 2010, 30(10): 2097-2107. [杨永亮, 路国慧, 杨伟贤等. 沈阳地区水环境和生物样品中全氟化合物的污染分布特征. 环境科学学报, 2010, 30(10): 2097-2107. DOI:10.13671/j.hjkxxb.2010.10.022] |
| [5] |
Yamashita N, Taniyasu S, Petrick G et al. Perfluorinated acids as novel chemical tracers of global circulation of ocean waters. Chemosphere, 2008, 70(7): 1247-1255. DOI:10.1016/j.chemosphere.2007.07.079 |
| [6] |
Cao YX, Cao XZ, Wang H et al. Assessment on the distribution and partitioning of perfluorinated compounds in the water and sediment of Nansi Lake, China. Environmental Monitoring and Assessment, 2015, 187(10): 1-9. DOI:10.1007/s10661-015-4831-9 |
| [7] |
Liu BL, Zhang H, Yu Y et al. Perfluorinated compounds (PFCs) in soil of the Pearl River Delta, China: Spatial distribution, sources, and ecological risk assessment. Archives of Environmental Contamination and Toxicology, 2020, 78(2): 182-189. DOI:10.1007/s00244-019-00674-1 |
| [8] |
Senthilkumar K, Ohi E, Sajwan K et al. Perfluorinated compounds in river water, river sediment, market fish, and wildlife samples from Japan. Bulletin of Environmental Contamination and Toxicology, 2007, 79(4): 427-431. DOI:10.1007/s00128-007-9243-2 |
| [9] |
Zhang T, Wu Q, Sun HW et al. Perfluorinated compounds in whole blood samples from infants, children, and adults in China. Environmental Science & Technology, 2010, 44(11): 4341-4347. DOI:10.1021/es1002132 |
| [10] |
Wang TY, Wang P, Meng J et al. A review of sources, multimedia distribution and health risks of perfluoroalkyl acids (PFAAs) in China. Chemosphere, 2015, 129: 87-99. DOI:10.1016/j.chemosphere.2014.09.021 |
| [11] |
Johansson N, Fredriksson A, Eriksson P. Neonatal exposure to perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) causes neurobehavioural defects in adult mice. Neuro Toxicology, 2008, 29(1): 160-169. DOI:10.1016/j.neuro.2007.10.008 |
| [12] |
Fang XM, Feng YX, Shi ZM et al. Alterations of cytokines and MAPK signaling pathways are related to the immunotoxic effect of perfluorononanoic acid. Toxicological Sciences, 2009, 108(2): 367-376. DOI:10.1093/toxsci/kfp019 |
| [13] |
Chen CL, Lu YL, Zhang X et al. A review of spatial and temporal assessment of PFOS and PFOA contamination in China. Chemistry and Ecology, 2009, 25(3): 163-177. DOI:10.1080/02757540902918321 |
| [14] |
Du GY, Jiang XP, Zhuo L et al. Distribution characteristics and risk assessment of perfluorinated compounds in surface water from Chongqing section of the Yangtze River. Ecology and Environmental Sciences, 2019, 28(11): 2266-2272. [杜国勇, 蒋小萍, 卓丽等. 长江流域重庆段水体中全氟化合物的污染特征及风险评价. 生态环境学报, 2019, 28(11): 2266-2272.] |
| [15] |
Li J, Gao Y, Wang ZF et al. Risk assessment of perfluoroalkyl compounds(PFCs) in water and sediment samples of Hanjiang river. Acta Scientiarum Naturalium Universitatis Pekinensis, 2017, 53(5): 913-920. [李杰, 高月, 王之芬等. 汉江水体和沉积物中全氟化合物的风险评估. 北京大学学报: 自然科学版, 2017, 53(5): 913-920. DOI:10.13209/j.0479-8023.2017.096] |
| [16] |
Li Z. Distribution and risk assessment of perfluoroalkyl substances in lakes from the middle reach of Yangtze River, China[Dissertation]. Beijing: University of Chinese Academy of Sciences, 2019. [李珍. 长江中游地区湖泊全氟化合物的污染特征及生态风险评估[学位论文]. 北京: 中国科学院大学, 2019. ]
|
| [17] |
Sun ZY, Zhang CJ, Yan H et al. Spatiotemporal distribution and potential sources of perfluoroalkyl acids in Huangpu River, Shanghai, China. Chemosphere, 2017, 174: 127-135. DOI:10.1016/j.chemosphere.2017.01.122 |
| [18] |
Zhang DW, Wang DG, Zhang L et al. A study on the perfluorinated compounds pollution in Meiliang Bay, Taihu Lake. Acta Scientiae Circumstantiae, 2012, 32(12): 2978-2985. [张大文, 王冬根, 张莉等. 太湖梅梁湾全氟化合物污染现状研究. 环境科学学报, 2012, 32(12): 2978-2985. DOI:10.13671/j.hjkxxb.2012.12.016] |
| [19] |
Liu BL, Zhang H, Xie LW et al. Spatial distribution and partition of perfluoroalkyl acids (PFAAs) in rivers of the Pearl River Delta, Southern China. Science of the Total Environment, 2015, 524/525: 1-7. DOI:10.1016/j.scitotenv.2015.04.004 |
| [20] |
Shi R, Mao RY, Zhang M et al. Distribution, sources, and ecological risks of polyfluoroalkyl substances in the surface water of the wuliangsuhai watershed. Environmental Science, 2021, 42(2): 663-672. [史锐, 毛若愚, 张梦等. 乌梁素海流域地表水中全氟化合物分布、来源及其生态风险. 环境科学, 2021, 42(2): 663-672. DOI:10.13227/j.hjkx.202005216] |
| [21] |
Lee YM, Lee JY, Kim MK et al. Concentration and distribution of per- and polyfluoroalkyl substances (PFAS) in the Asan Lake area of South Korea. Journal of Hazardous Materials, 2020, 381: 120909. DOI:10.1016/j.jhazmat.2019.120909 |
| [22] |
Navarro I, de la Torre A, Sanz P et al. Perfluoroalkyl acids (PFAAs): Distribution, trends and aquatic ecological risk assessment in surface water from Tagus River basin (Spain). Environmental Pollution, 2020, 256: 113511. DOI:10.1016/j.envpol.2019.113511 |
| [23] |
Li YN, Xu HC, Jiang HL. Molecular weight distribution, fluorescence characteristics of dissolved organic matter and their effect on the distribution of heavy metals of Lake Poyang. J Lake Sci, 2020, 32(4): 1029-1040. [李雅妮, 徐华成, 江和龙. 鄱阳湖水体溶解有机质分子量分布、荧光特征及对重金属分布的影响. 湖泊科学, 2020, 32(4): 1029-1040. DOI:10.18307/2020.0412] |
| [24] |
Yan CX. Effect of aquatic colloids on thebehavior of selected emerging organic contaminants in the Yangtze Estuary[Dissertation]. Shanghai: East China Normal University, 2014. [晏彩霞. 长江口滨岸水中胶体对新兴有机污染物环境行为的影响研究[学位论文]. 上海: 华东师范大学, 2014. ]
|
| [25] |
Durjava MK, Kolar B, Peijnenburg W. Case studies on the development and application of in-silico techniques for environmental hazard and risk assessment. National Institute of Public Health and the Environment (RIVM), Laboratory for Ecological Risk Assessment, 2012.
|
| [26] |
Han TZ. Distribution and potential sources of perfluoroalkyl substances (PFASs) in Jiaozhou bay[Dissertation]. Qingdao: First Institute of Cceanography, SOA, 2018. [韩同竹. 胶州湾海水和生物体中全氟化合物的分布特征及来源解析[学位论文]. 青岛: 国家海洋局第一海洋研究所, 2018. ]
|
| [27] |
Zhang M, Tang FL, Cheng XL et al. Occurrence and distribution of perfluorinated compounds in surface water of Lake Qiandao(Xin'anjiang Reservoir). J Lake Sci, 2020, 32(2): 337-345. [张明, 唐访良, 程新良等. 千岛湖(新安江水库)表层水中全氟化合物的残留水平及分布特征. 湖泊科学, 2020, 32(2): 337-345. DOI:10.18307/2020.0204] |
| [28] |
Wang TY, Khim JS, Chen CL et al. Perfluorinated compounds in surface waters from Northern China: Comparison to level of industrialization. Environment International, 2012, 42: 37-46. DOI:10.1016/j.envint.2011.03.023 |
| [29] |
Yang LP, Zhu LY, Liu ZT. Occurrence and partition of perfluorinated compounds in water and sediment from Liao River and Taihu Lake, China. Chemosphere, 2011, 83(6): 806-814. DOI:10.1016/j.chemosphere.2011.02.075 |
| [30] |
Wang TY, Chen CL, Naile JE et al. Perfluorinated compounds in water, sediment and soil from Guanting reservoir, China. Bulletin of Environmental Contamination and Toxicology, 2011, 87(1): 74-79. DOI:10.1007/s00128-011-0307-y |
| [31] |
Zhang DW, Zhang L, Wei YH et al. Investigation of perfluorooctanoic acid(pfoa) and perfluorooctane sulfonate(pfos) pollution in surface water of Poyang lake. Resources and Environment in the Yangtze Basin, 2012, 21(7): 885-890. [张大文, 张莉, 魏益华等. 鄱阳湖表层水中全氟辛酸和全氟辛烷磺酸污染现状调查. 长江流域资源与环境, 2012, 21(7): 885-890.] |
| [32] |
Zhou Z, Shi YL, Li WH et al. Perfluorinated compounds in surface water and organisms from Baiyangdian lake in North China: Source profiles, bioaccumulation and potential risk. Bulletin of Environmental Contamination and Toxicology, 2012, 89(3): 519-524. DOI:10.1007/s00128-012-0745-1 |
| [33] |
Chen J, Wang LL, Zhu HD et al. Spatial distribution of perfluorooctanoic acids and perfluorinate sulphonates in surface water of east lake. Environmental Science, 2012, 33(8): 2586-2591. [陈静, 王琳玲, 朱湖地等. 东湖表层水体中全氟辛酸和全氟辛磺酸空间分布特征. 环境科学, 2012, 33(8): 2586-2591. DOI:10.13227/j.hjkx.2012.08.035] |
| [34] |
Zhou Z, Liang Y, Shi YL et al. Occurrence and transport of perfluoroalkyl acids (PFAAs), including short-chain PFAAs in Tangxun lake, China. Environmental Science & Technology, 2013, 47(16): 9249-9257. DOI:10.1021/es402120y |
| [35] |
Wang XX, Zhang H, He L et al. Distribution of perfluorinated compounds in surface water of Shenzhen reservoir groups. Environmental Science, 2014, 35(6): 2085-2090. [王鑫璇, 张鸿, 何龙等. 深圳水库群表层水中全氟化合物的分布特征. 环境科学, 2014, 35(6): 2085-2090. DOI:10.13227/j.hjkx.2014.06.007] |
| [36] |
Zhang JJ, Xue XY, Huang CS et al. Survey of perfluorooctanoic acid and perfluorooctane sulfonate in surface water from Tongsha Reservoir of Pearl River Delta, South China. Environmental Chemistry, 2017, 36(12): 2600-2608. [张佳骥, 薛晓燕, 黄楚珊等. 珠江三角洲同沙水库全氟辛酸和全氟辛烷磺酸污染现状调查. 环境化学, 2017, 36(12): 2600-2608. DOI:10.7524/j.issn.0254-6108.2017031702] |
| [37] |
Pan X, Ye J, Zhang H et al. Occurrence, removal and bioaccumulation of perfluoroalkyl substances in lake Chaohu, China. International Journal of Environmental Research and Public Health, 2019, 16(10): E1692. DOI:10.3390/ijerph16101692 |
| [38] |
Rostkowski P, Yamashita N, So IMK et al. Perfluorinated compounds in streams of the Shihwa industrial zone and Lake Shihwa, South Korea. Environmental Toxicology and Chemistry, 2006, 25(9): 2374-2380. DOI:10.1897/05-627R.1 |
| [39] |
Loos R, Wollgast J, Huber T et al. Polar herbicides, pharmaceutical products, perfluorooctanesulfonate (PFOS), perfluorooctanoate (PFOA), and nonylphenol and its carboxylates and ethoxylates in surface and tap waters around Lake Maggiore in Northern Italy. Analytical and Bioanalytical Chemistry, 2007, 387(4): 1469-1478. DOI:10.1007/s00216-006-1036-7 |
| [40] |
Remucal CK. Spatial and temporal variability of perfluoroalkyl substances in the Laurentian Great Lakes. Environmental Science Processes & Impacts, 2019, 21(11): 1816-1834. DOI:10.1039/c9em00265k |
| [41] |
Yan CX, Nie MH, Yang Y et al. Effect of colloids on the occurrence, distribution and photolysis of emerging organic contaminants in wastewaters. Journal of Hazardous Materials, 2015, 299: 241-248. DOI:10.1016/j.jhazmat.2015.06.022 |
| [42] |
Bai YY, Zheng MF, Zheng AR et al. Effects of nature colloids on the growth of nature bacteria community. Journal of Xiamen University: Natural Science, 2007, 46(4): 550-554. [白艳艳, 郑敏芳, 郑爱榕等. 天然胶体对天然菌群生长的影响. 厦门大学学报: 自然科学版, 2007, 46(4): 550-554. DOI:10.3321/j.issn:0438-0479.2007.04.025] |
| [43] |
Wang F, Zhu G, Xu H et al. The bioeffect of natural colloids on the growth of Microcystis aeruginosa in Lake Taihn, China. China Environmental Science, 2009, 29(5): 538-542. [王芳, 朱广伟, 许海等. 太湖梅梁湾水体中胶体对铜绿微囊藻生长的促进效应. 中国环境科学, 2009, 29(5): 538-542. DOI:10.3321/j.issn:1000-6923.2009.05.016] |
| [44] |
Li XQ, Hua ZL. Multiphase distribution and spatial patterns of perfluoroalkyl acids (PFAAs) associated with catchment characteristics in a plain river network. Chemosphere, 2021, 263: 128284. DOI:10.1016/j.chemosphere.2020.128284 |
| [45] |
Duan YP, Meng XZ, Wen ZH et al. Multi-phase partitioning, ecological risk and fate of acidic pharmaceuticals in a wastewater receiving river: The role of colloids. Science of the Total Environment, 2013, 447: 267-273. DOI:10.1016/j.scitotenv.2013.01.017 |
| [46] |
Si W, Cai YF, Liu JC et al. Investigating the role of colloids on the distribution of bisphenol analogues in surface water from an ecological demonstration area, China. Science of the Total Environment, 2019, 673: 699-707. DOI:10.1016/j.scitotenv.2019.04.142 |
| [47] |
Pan B, Qiu MY, Wu M et al. The opposite impacts of Cu and Mg cations on dissolved organic matter-ofloxacin interaction. Environmental Pollution, 2012, 161: 76-82. DOI:10.1016/j.envpol.2011.09.040 |
| [48] |
Sun Y, Liu JC, Lu GH. Influence of aquatic colloids on the bioaccumulation and biological effects of diclofenac in zebrafish (Danio rerio). Ecotoxicology and Environmental Safety, 2020, 195: 110470. DOI:10.1016/j.ecoenv.2020.110470 |
| [49] |
Liu WX, He W, Wu JY et al. Effects of fluorescent dissolved organic matters (FDOMs) on perfluoroalkyl acids (PFAAs) in lake and river water. Science of the Total Environment, 2019, 666: 598-607. DOI:10.1016/j.scitotenv.2019.02.219 |
| [50] |
Olsen GW, Mair DC, Lange CC et al. Per- and polyfluoroalkyl substances (PFAS) in American Red Cross adult blood donors, 2000-2015. Environmental Research, 2017, 157: 87-95. DOI:10.1016/j.envres.2017.05.013 |
| [51] |
Stein CR, McGovern KJ, Pajak AM et al. Perfluoroalkyl and polyfluoroalkyl substances and indicators of immune function in children aged 12-19 y: National Health and Nutrition Examination Survey. Pediatric Research, 2016, 79(2): 348-357. DOI:10.1038/pr.2015.213 |
| [52] |
Joensen UN, Bossi R, Leffers H et al. Do perfluoroalkyl compounds impair human semen quality?. Environmental Health Perspectives, 2009, 117(6): 923-927. DOI:10.1289/ehp.0800517 |
| [53] |
Qi P, Wang Y, Mu JL et al. Aquatic predicted no-effect-concentration derivation for perfluorooctane sulfonic acid. Environmental Toxicology and Chemistry, 2011, 30(4): 836-842. DOI:10.1002/etc.460 |
| [54] |
Chen ZA, Ren GB, Ma XD et al. Perfluoroalkyl substances in the Lingang hybrid constructed wetland, Tianjin, China: Occurrence, distribution characteristics, and ecological risks. Environmental Science and Pollution Research, 2020, 27(31): 38580-38590. DOI:10.1007/s11356-020-09921-8 |
| [55] |
Valsecchi S, Conti D, Crebelli R et al. Deriving environmental quality standards for perfluorooctanoic acid (PFOA) and related short chain perfluorinated alkyl acids. Journal of Hazardous Materials, 2017, 323: 84-98. DOI:10.1016/j.jhazmat.2016.04.055 |
| [56] |
Wang SL, Cao XZ. Contamination characteristics and potential ecological risks of typical perfluoroalkyl substances in the water and sediment of coastal tourism resorts in Shandong Province. Environmental Science, 2020, 41(12): 5428-5437. [王世亮, 曹雪稚. 山东省滨海旅游度假区水体环境典型全氟化合物污染特征及潜在生态风险. 环境科学, 2020, 41(12): 5428-5437. DOI:10.13227/j.hjkx.202003286] |
 2021, Vol. 33
2021, Vol. 33 


