(2: 湖南洞庭湖湿地生态系统国家野外科学观测研究站, 常德 415923)
(3: 西洞庭湖国家级自然保护区管理局, 常德 415923)
(2: National Field Scientific Observation and Research Station of Dongting Lake Wetland Ecosystem in Hunan Province, Changde 415923, P. R. China)
(3: National Nature Reserve of West Dongting Lake, Changde 415923, P. R. China)
淡水生态系统是世界上最受威胁的生态系统,由于栖息地退化、水文节律变化、全球气候变暖、过度捕捞、水污染和生物入侵,淡水生物多样性的丧失速率远超陆地和海洋生态系统[1-2]. 生物入侵作为全球变化的重要组成部分,对环境及社会经济产生了严重的负面影响[3]. 通过量化不同人类活动干扰强度下外来入侵物种和本土物种的食性组成差异,有助于明确入侵种的入侵机制以及环境效应,对于制定科学的管理对策具有重要的意义.
克氏原螯虾(Procambarus clarkii)原产于美国中南部和墨西哥东北部[4],属节肢动物门(Arthropoda)甲壳纲(Crustacea)十足目(Decapoda)螯虾科(Cambaridae),俗名小龙虾,是淡水生态系统中极具破坏力和广泛分布的入侵物种. 克氏原螯虾1920s初作为牛蛙饵料由美国引进到日本的本州[5],后于1929年从日本引入中国南京,并迅速传播到中国大部分省份,并于1980s初开始成为我国水产养殖品种[6]. 目前已在全国13个省份调查到克氏原螯虾野外种群,其高度适宜栖息地集中在长江中下游[7],而该区域原先并无十足目螯虾科的动物生存. 尽管在全球范围内克氏原螯虾已入侵到除大洋洲外四大洲的40个国家,但早期的发表论文主要是关注克氏原螯虾的人工养殖方法,在2000年左右才开始将其作为入侵物种来研究,目前约25 %已发表研究论文关注的是其入侵引起的生态问题[6].
日本沼虾(Macrobrachium nipponensis)同隶属于甲壳纲十足目,分属于长臂虾科(Palaemonidae),为本土种,广泛分布于我国淡水湖泊及河流中,是长江中下游地区许多湖泊和河流中虾类资源的优势种类[8-10]. 克氏原螯虾与日本沼虾同为甲壳纲十足目动物[11-12],食性分析结果表明克氏原螯虾的食物来源包括浮游动物、大型水生植物、底栖动物、有机碎屑等[13]. 日本沼虾主要摄食固着藻类、植物碎片、有机碎屑、底栖动物、浮游动物和鱼虾[14]. 根据食性分析结果可知日本沼虾与克氏原螯虾的食性有所重叠. 此外还发现在人工养殖环境下,当克氏原螯虾出现时,日本沼虾不仅降低其活动水平,还会通过改变其空间利用从而远离克氏原鳌虾[15]. 例如,张燕萍等调查发现在2009- 2013年,鄱阳湖克氏原螯虾捕捞产量已经占到虾类捕捞总产量的50 %以上[16]. 与此同时,对比2013和1998年鄱阳湖日本沼虾种群调查结果发现日本沼虾种群数量出现减退趋势,其产量和个体大小呈明显下降趋势[17-18]. 但目前对于野外环境下二者共存时食性组成的研究较少,对于长江中下游淡水湖泊中入侵种克氏原螯虾与本土种日本沼虾之间的营养关系尚不清楚. 该区域入侵种与本土种的食性偏好在不同人类活动强度的栖息地中是否存在差异,这一差异是否会影响该区域中本土种的生存有待探讨. 在长江流域“十年禁渔”期间,如何避免克氏原螯虾因其适应能力强、数量多和分布范围广从而成为影响该区域生态系统营养相互作用的关键种,亟需科学指导.
稳定同位素分析技术已成为评估水生生态系统中资源利用、食物组成、营养相互作用、营养级和估算食物网功能的重要方法[19]. 这种方法与传统的食性分析相比可以反映动物在较长时间内同化的食物来源,可以用以推断种间竞争强度[20-21]. 目前主要根据碳、氮稳定同位素比值建立混合模型来研究消费者食性[22]. 其中贝叶斯混合模型由于集合了各潜在食物来源稳定同位素组成的变异性,允许纳入先验信息,因而可以更加准确地估算各来源对消费者的贡献比例[23]. 此外,利用稳定同位素混合模型量化食物来源对消费者贡献过程中的常见问题是来源过多,使得模型量化可信度下降[24-25]. 根据消费者摄食偏好和生态系统中食物资源丰富度等先验信息对多种食物来源分类组合,可以简化科学问题,控制源的数量,提高模型可信度,降低不确定性,已成为常用手段[25-26].
长江中下游地区人口密集,湿地利用强度大,由于围垦、水产养殖、水利工程设施建设等人类活动引起区域景观格局破碎化,湿地退化明显[27-28]. 在该区域第二大淡水湖洞庭湖中,地势最高的西洞庭湖区,曾通过挖沟抬垄种植了大量杨树[29]. 杨树种植区域本土湿生植物比例显著降低[30],水鸟和鱼类数量大幅减少[31-32]. 虽然当前核心区域杨树已经被砍伐,但是造林时抬垄留下的沟渠人为地打破了洲滩与低洼地、浅水湖面等湿地景观的水文连通,切断了湖水的自然流动,现已成为克氏原螯虾藏身的重要区域. 本研究将通过碳、氮同位素分析技术,运用贝叶斯混合模型,比较克氏原螯虾与日本沼虾在西洞庭湖改造湿地与天然湿地间的食性差异,为西洞庭湖湿地恢复工作提供科学依据.
1 材料与方法 1.1 研究区域概况西洞庭湖(28°47′~29°7′N,111°57′~112°17′E)位于湖南省常德市汉寿县境内,承接松滋、虎渡、藕池三口和沅、澧两水五支入流,是洞庭湖水文过程最复杂的区域,也是地势最高的区域[29],属于国家级自然保护区,并于2002年被列入国际重要湿地. 区域内主要生境类型有:水域、泥滩、芦苇滩地、草滩、人工改造沟渠[31]. 其中人工改造沟渠区域受到人为干扰影响较大,其与湖区横向水文连通性降低,枯水期水位稳定[33-34]. 本研究区域为西洞庭湖的天然湿地(水域)和人类活动强度最大的改造湿地(人工改造沟渠区域).
1.2 样品采集与处理2017年8月8- 18日,在西洞庭湖湖区用地笼(长度:30 m,宽度:20 cm,高:20 cm,网目尺寸:10 mm)进行克氏原螯虾和日本沼虾样品采集. 在24个采样点采集到了克氏原螯虾,其中分布在人工改造湿地中的样点为17个,分布在天然湿地中的样点为7个(图 1). 每个采样点的地笼放置时间为24 h,均在第2天上午9:00- 10:00段收集. 样品采集后将带回实验室进行鉴定、计数和称重,记录克氏原螯虾和日本沼虾每网捕捞数量. 由于克氏原螯虾和日本沼虾个体发育过程中幼体和成体食性会发生转变[11, 35-36],为避免这一因素的影响,因而从渔获物中随机选择个体大小相近的克氏原螯虾和个体大小相近的日本沼虾样品的体长和体重并冷冻留作稳定同位素分析,分别为66和25个.

|
图 1 西洞庭湿地样品采样点示意 Fig.1 Sampling sites in West Dongting Lake |
在使用贝叶斯混合模型分析消费者的食物来源前,根据对克氏原螯虾胃含物中食物组成[37-38]和西洞庭湖湿地生态系统现有食物资源情况采集了来自湖泊浮游层和底栖层的潜在食物来源并归为5类,分别为:浮游动物、浮叶植物、底栖动物、沉水植物以及由湿地挺水植物碎片组成的凋落物. 由于调查区域底质多为泥质底,因而未采集到底栖附着藻类. 使用孔径为0.15 mm的浮游动物网现场过滤水样10 L收集到聚乙烯采样瓶中,带回实验室镜检后通过Whatman GF/C滤膜(孔径1.2 μm)过滤,取滤膜做为浮游动物样品[39]. 浮游动物主要包括桡足类哲水蚤目(Calanoida)和剑水蚤目(Cyclopoidea). 在天然和人工改造湿地中采集的浮叶植物均为凤眼莲(Eichhornia crassipes). 使用采草夹定量采集湖区常见大型维管束植物,带回实验室分类鉴定称重后,留取金鱼藻(Ceratophyllum demersum)样品用于稳定同位素分析[40]. 使用彼得逊采泥器采集表层0~15 cm底泥,带回实验室进一步清洗分类鉴定称重后,留取大型底栖无脊椎动物铜锈环棱螺(Bellamya aeruginosa). 使用孔径为0.425 mm的抄网采集地笼周边凋落物.
在各样点使用手持式声纳测深仪SM-5A(美国Weatherhawk)测量水深,使用赛氏盘测量水透明度,使用YSI水质仪测量电导率、pH、水温和氧化还原电位. 采集5 L水样带回实验室中分别使用碱性过硫酸钾消解紫外分光光度法(GB11894- 1989)、过硫酸钾消解钼酸铵分光光度法(GB11893- 1989)和热乙醇法测定水体总氮、总磷和叶绿素a浓度[41].使用0.45 μm滤膜过滤500 mL水样后105℃烘干至恒重,测定滤膜质量差获得各样点悬浮固体浓度.
1.3 稳定同位素分析用解剖刀切取克氏原螯虾和日本沼虾的尾部肌肉以及铜锈环棱螺的腹足. 上述样品和凋落物、凤眼莲、金鱼藻、浮游动物样品均在烘箱中保持60℃干燥至恒重后,用研钵和研杵研磨成均匀的粉末,称重后包入锡胶囊中以进行稳定同位素分析. 稳定同位素分析在中国科学院水生生物研究所进行,所用仪器为美国Thermo公司的Carlo Erba EA-1110元素分析仪与Delta Plus Finnigan同位素质谱仪. 同位素比值δ13C和δ15N(‰)计算公式为:
| {\rm{ \mathit{ δ} }}X = [({R_{{\rm{sample}}}}/{R_{{\rm{standard}}}}) - 1] \times 1000 | (1) |
式中,X为13C或15N,R为对应的13C /12C或15N /14N. δ13C的测定参考标准是Pee Dee Belemnite石灰石,δ15N的测定参考标准是大气氮. 根据实验室标准品(尿素)的重复数据,观察到δ13C和δ15N的分析精度分别为±0.1 %和±0.3 %. 由于样品脂质含量低(所有样品的C∶N < 3.5),肌肉组织的脂质含量未校正[42]. 测定克氏原螯虾、日本沼虾、铜锈环棱螺、凋落物、凤眼莲、金鱼藻和浮游动物样品分别为66、25、28、5、10、4和6个.
1.4 数据处理与统计分析使用R语言的SIAR软件包siarmcmcdirichletv4指令,选择默认迭代次数200000,应用贝叶斯混合模型来估算5种潜在食源对克氏原螯虾及本土种日本沼虾食性组成的贡献比例[24, 43]. 针对本研究的十足纲甲壳动物设定碳稳定同位素的营养富集因子为1.3 % ±0.3 %,氮稳定同位素的营养富集因子为3.4 % ±1 % [44]. 对于不同类型湿地中采集的相似生态位动物,其δ13C区间(最大值与最小值的差值)反映了消费者利用食物资源的多样性,而δ15N区间反映了消费者营养级的多样性[45],可以用来说明群落的营养生态特征.
使用IBM SPSS Statistics 23进行t检验分析天然湿地和人工改造湿地中克氏原螯虾和日本沼虾体长、体重以及两种消费者和5种潜在食物来源的δ13C和δ15N比值差异.
2 结果 2.1 不同类型栖息地中环境因子差异2017年8月所调查的人工改造湿地与天然湿地相比水深较浅,透明度较大,电导率较大,pH值较低,悬浮固体、总氮、水体叶绿素a浓度较高,总磷浓度较低,克氏原螯虾每网捕捞数量较多,日本沼虾每网捕捞数量较少,沉水植物生物量较低,其中pH值和沉水植物生物量具有显著差异(表 1).
| 表 1 天然湿地和改造湿地的环境因子差异* Tab. 1 The difference in water environment between natural and modified wetlands |
两种栖息地中,两种消费者和5种潜在食物来源的碳、氮稳定同位素比值如图 2所示,其中仅浮游动物δ15N比值(P=0.004),金鱼藻δ13C和δ15N比值(均为P < 0.001)存在显著差异. 克氏原螯虾在改造湿地中的稳定同位素比值与日本沼虾重叠更多. 与天然湿地相比,克氏原螯虾体长在两种栖息地中无显著差异,但是其平均体重在改造湿地中显著小于天然湿地(表 2). 日本沼虾体长和体重在改造湿地中均显著小于天然湿地中(表 2). 克氏原螯虾和日本沼虾δ13C比值在两种栖息地中差异显著,克氏原螯虾δ15N比值在两种栖息地中无差异显著,而日本沼虾δ15N比值在改造湿地中显著低于天然湿地(表 3).
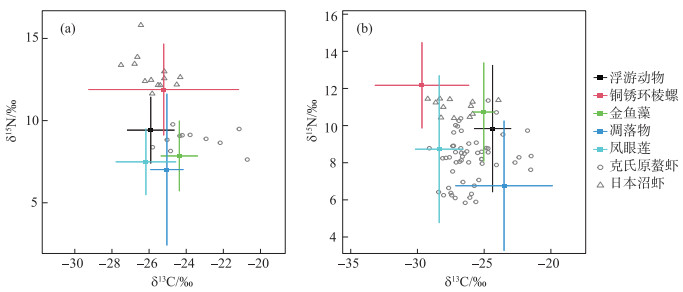
|
图 2 天然湿地(a)和改造湿地(b)中克氏原螯虾和日本沼虾及食物来源碳、氮稳定同位素比值 Fig.2 Stable isotope signatures of P. clarkii, M. nipponense and 5 food sources in natural wetland (a) and modified wetland (b) |
| 表 2 不同湿地类型中克氏原螯虾与日本沼虾的体长、体重差异 Tab. 2 Variations in body length and weight of P. clarkii and M. nipponense in different wetland types |
| 表 3 克氏原螯虾与日本沼虾的稳定同位素比值差异 Tab. 3 Variations of stable isotope signatures between P. clarkii and M. nipponense |
克氏原螯虾在天然湿地中对于5种潜在食物来源没有明显的选择倾向,但是在改造湿地中对于凋落物和凤眼莲的取食比例提高(图 3a). 日本沼虾在改造湿地中对沉水植物金鱼藻的取食比例提高(图 3b). 总体而言,克氏原螯虾与日本沼虾的食物选择均发生了改变,克氏原螯虾的主要食物来自凋落物和凤眼莲,而日本沼虾提高了对金鱼藻的取食比例(图 3).

|
图 3 克氏原螯虾(a)和日本沼虾(b)在天然湿地和改造湿地中的食性组成 Fig.3 Diet composition of P. clarkii (a) and M. nipponense (b) in natural and modified wetlands |
已有研究表明克氏原螯虾入侵会对沉水植物产生负面影响,显著减少沉水植物的密度[5, 46-47],影响光合作用强度导致对水体中溶解二氧化碳的消耗减少,从而降低水体的pH值. 此外,改造湿地中周边杨树落叶导致水体腐殖质过多,周边农业活动中化肥随地表径流进入沟渠也是导致水体pH降低的潜在原因[48]. 克氏原螯虾的爬行和掘洞行为会扰动表层沉积物,从而导致表层沉积物再悬浮,使得更多离子释放到水中,水体电导率升高,浊度增加,总悬浮固体浓度增大,叶绿素a浓度升高[47, 49-50],加速水体由“清水”向“浊水”转变. 克氏原螯虾通过对栖息环境和沉水植物的破坏改变水体氮、磷营养盐浓度[51],从而增加了浮游植物的生物量导致叶绿素a浓度提高. 在本研究中,改造湿地沉水植物生物量显著低于天然湿地,光合作用强度低,对溶解二氧化碳利用减少少,导从而致水体pH值在两类湿地中存在显著差异. 改造湿地中水体与外界交换频率低,水位变动小,受水体pH值、溶解无机碳浓度和外源输入的影响金鱼藻δ13C比值在天然湿地中显著偏低[52],由于含氮化肥的输入改造湿地中浮游动物和金鱼藻δ15N比值在天然湿地中显著偏低[53].
3.2 不同类型栖息地中克氏原螯虾和日本沼虾的食性差异在两种栖息地中克氏原螯虾与日本沼虾食性均有重叠,与克氏原螯虾相比,日本沼虾消费更多的动物性食物,与Mao等基于稳定同位素的分析结果一致[54]. 在改造湿地中由于食物资源可获得性的变化,日本沼虾和克氏原螯虾转向更多取食植物性食物. Zhang等对日本沼虾的研究发现,在水流较缓的水库中要比在南水北调干渠流动水体中更依靠来自底栖层的碳源[55]. 入侵生物通常具有高度适应能力,可以通过改变食性偏好来适应栖息地变化,从而成功入侵和对本土生物产生影响[35]. 在改造湿地中日本沼虾的δ15N显著下降与其食性中动物性食物来源减少引起营养级下降有关. 而虽然食物组成发生了变化,克氏原螯虾在两种栖息地中的δ15N值无显著变化.
在天然湿地中克氏原螯虾和日本沼虾群落的δ13C区间小于改造湿地,说明在天然湿地中二者的食物来源范围较小. 在改造湿地中,由于克氏原螯虾和日本沼虾扩大了食性范围,更多依赖植物性食物导致营养级位置降低.这与这两种十足目动物均为杂食性动物有关[56-58]. 对非洲河流的研究发现,本土蟹(Potamonautes loveni)在克氏原螯虾入侵后营养生态位空间被挤压,生长速率减缓,最终出现灭绝[59]. 在天然湿地中克氏原螯虾和日本沼虾群落的δ15N区间大于改造湿地,说明在天然湿地中二者取食更多营养级的食物来源.对西洞庭湖人工改造湿地鱼类和底栖动物的研究发现,改造后的湿地水深较浅,水体流速缓慢,电导率高,水生生物多样性显著低于天然湿地[60-61]. 对湿地的人为干扰加剧了本土种利用资源的限制,消费者扩大了其食性范围,从而影响消费者之间营养关系的变化.
4 小结受到人类活动的影响,由于和湖区横向的水文连通被切断,导致改造湿地栖息地中水生生物生存空间狭小,克氏原螯虾密度较大,使得同时生活在其中的日本沼虾的取食空间受到挤压,种间竞争增强. 在改造湿地中克氏原螯虾和日本沼虾δ13C都显著升高,食物中植物性食物来源比重增加,但仅表征日本沼虾营养级位置的δ15N值出现了显著降低. 本研究说明湿地退化克氏原螯虾数量增多会对本土十足目动物日本沼虾的食性组成产生影响.
| [1] |
Reid AJ, Carlson AK, Creed IF et al. Emerging threats and persistent conservation challenges for freshwater biodiversity. Biological Reviews, 2019, 94(3): 849-873. DOI:10.1111/brv.12480 |
| [2] |
Tickner D, Opperman JJ, Abell R et al. Bending the curve of global freshwater biodiversity loss: An emergency recovery plan. BioScience, 2020, 70(4): 330-342. DOI:10.1093/biosci/biaa002 |
| [3] |
Oficialdegui FJ, Clavero M, Sánchez MI et al. Unravelling the global invasion routes of a worldwide invader, the red swamp crayfish (Procambarus clarkii). Freshwater Biology, 2019, 64(8): 1382-1400. DOI:10.1111/fwb.13312 |
| [4] |
Huner JV. Procambarus in North America and elsewhere. Freshwater crayfish: Biology, management and exploitation. Portland: Timber Press, 1988: 239-261.
|
| [5] |
Matsuzaki SIS, Usio N, Takamura N et al. Contrasting impacts of invasive engineers on freshwater ecosystems: An experiment and meta-analysis. Oecologia, 2009, 158(4): 673-686. DOI:10.1007/s00442-008-1180-1 |
| [6] |
Oficialdegui FJ, Sánchez MI, Clavero M. One century away from home: How the red swamp crayfish took over the world. Reviews in Fish Biology and Fisheries, 2020, 30(1): 121-135. DOI:10.1007/s11160-020-09594-z |
| [7] |
Yue GH, Feng JB, Xia JH et al. Inferring the invasion mechanisms of the red swamp crayfish in China using mitochondrial DNA sequences. Aquaculture and Fisheries, 2021, 6(1): 35-41. DOI:10.1016/j.aaf.2020.04.003 |
| [8] |
Li CC, Li Y, Xie QM et al. A study on the maximum sustained yield of the macrura's shrimp in the Poyang Lake and its development, utilization. Jiangxi Science, 1990, 8(4): 28-33. [李长春, 李云, 谢钦铭等. 鄱阳湖虾类资源最大持续产量及其开发利用的研究. 江西科学, 1990, 8(4): 28-33.] |
| [9] |
Jiang H, Xiao KY, He YL et al. Preliminary investigation of shrimp and crab resources in the South Dongting Lake of Yuanjiang, Hunan. Water Conservancy Fishery, 2006, 27(5): 72-73. [江辉, 肖克宇, 何燕林等. 湖南沅江南洞庭湖虾蟹资源的初步调查. 水利渔业, 2006, 27(5): 72-73. DOI:10.15928/j.1674-3075.2006.05.029] |
| [10] |
Zhang H, Xie P, Wu GG et al. Studies on trophic niches of Macrobrachium nipponensis and Exopalaemon modestus. Research of Environmental Sciences, 2013, 26(1): 22-26. [张欢, 谢平, 吴功果等. 日本沼虾与秀丽白虾的营养生态位. 环境科学研究, 2013, 26(1): 22-26. DOI:10.13198/j.res.2013.01.26.zhangh.001] |
| [11] |
Momot WT. Redefining the role of crayfish in aquatic ecosystems. Reviews in Fisheries Science, 1995, 3(1): 33-63. DOI:10.1080/10641269509388566 |
| [12] |
Wen ZR, Xie P. Studies on the feeding Habits and sources of dietary carbon of Macrobrachium nipponense and Exopalaemon modestus in Taihu Lake. Journal of Yangtze University: Nat Sci Edit, 2013, 10(29): 36-42. [温周瑞, 谢平. 太湖日本沼虾与秀丽白虾的食性与食物碳源分析. 长江大学学报: 自然科学版, 2013, 10(29): 36-42.] |
| [13] |
Xu ZH, Zhou X, Shui Y. Food preference and feeding rhythm in red swamp crayfish Procambarus clarkii. Journal of Dalian Ocean University, 2012, 27(2): 166-170. [徐增洪, 周鑫, 水燕. 克氏原螯虾的食物选择性及其摄食节律. 大连海洋大学学报, 2012, 27(2): 166-170. DOI:10.3969/j.issn.1000-9957.2012.02.014] |
| [14] |
Liu J, Gong SY, He XG et al. Study on the feeding habits of Macrobrachium nipponense in Wuhu Lake. Freshwater Fisheries, 2005, 35(1): 25-28. [刘军, 龚世园, 何绪刚等. 武湖日本沼虾食性的研究. 淡水渔业, 2005, 35(1): 25-28. DOI:10.3969/j.issn.1000-6907.2005.01.008] |
| [15] |
Cai FJ. Predation of Procambarus clarkii on several aquatic animal and recognition mechanism aquatic animal to Procambarus clarkii[Dissertation]. Guangxi: Guangxi Normal University, 2011. [蔡凤金. 克氏原螯虾对几种水生动物的捕食及其对克氏原螯虾的识别机制研究[学位论文]. 桂林: 广西师范大学, 2011. ]
|
| [16] |
Zhang YP, Chen WJ, Fang CL et al. Analysis on the fishing population structure of Procambarus clarkii in Poyang Lake. Jiangxi Fisheries Science and Technology, 2014(2): 6-9, 19. [张燕萍, 陈文静, 方春林等. 鄱阳湖区克氏原螯虾捕捞种群结构分析. 江西水产科技, 2014(2): 6-9, 19. DOI:10.3969/j.issn.1006-3188.2014.02.004] |
| [17] |
Fu HY, Zhang YP, Fang CL et al. Population growth and structure analysis of Macrobrachium nipponense in Poyang Lake. Jiangxi Fisheries Science and Technology, 2015(3): 17-20. [付辉云, 张燕萍, 方春林等. 鄱阳湖日本沼虾捕捞种群生长与结构分析. 江西水产科技, 2015(3): 17-20.] |
| [18] |
Hong YJ, Hu CY, Guan SF. Preliminary investigation of Macrobrachium resources in Poyang Lake. Reservoir Fisheries, 2003, 24(3): 38-39. [洪一江, 胡成钰, 官少飞. 鄱阳湖沼虾资源的初步调查. 水利渔业, 2003, 24(3): 38-39.] |
| [19] |
Fry B. Stable isotope ecology. New York: Springer-Verlag New York, 2006.
|
| [20] |
Haubrock PJ, Azzini M, Balzani P et al. When alien catfish meet-Resource overlap between the North American Ictalurus punctatus and immature European Silurus glanis in the Arno River (Italy). Ecology of Freshwater Fish, 2020, 29(1): 4-17. DOI:10.1111/eff.12481 |
| [21] |
Balzani P, Vizzini S, Santini G et al. Stable isotope analysis of trophic niche in two co-occurring native and invasive terrapins, Emys orbicularis and Trachemys scripta elegans. Biological Invasions, 2016, 18(12): 3611-3621. DOI:10.1007/s10530-016-1251-x |
| [22] |
Phillips DL. Mixing models in analyses of diet using multiple stable isotopes: A critique. Oecologia, 2001, 127(2): 166-170. DOI:10.1007/s004420000571 |
| [23] |
Parnell AC, Phillips DL, Bearhop S et al. Bayesian stable isotope mixing models. Environmetrics, 2013, 24(6): 387-399. DOI:10.1002/env.2221 |
| [24] |
Parnell AC, Inger R, Bearhop S et al. Source partitioning using stable isotopes: Coping with too much variation. PLoS One, 2010, 5(3): e9672. DOI:10.1371/journal.pone.0009672 |
| [25] |
Phillips DL, Inger R, Bearhop S et al. Best practices for use of stable isotope mixing models in food-web studies. Canadian Journal of Zoology, 2014, 92(10): 823-835. DOI:10.1139/cjz-2014-0127 |
| [26] |
Moore JW, Semmens BX. Incorporating uncertainty and prior information into stable isotope mixing models. Ecology Letters, 2008, 11(5): 470-480. DOI:10.1111/j.1461-0248.2008.01163.x |
| [27] |
Hou XJ, Feng L, Tang J et al. Anthropogenic transformation of Yangtze Plain freshwater lakes: Patterns, drivers and impacts. Remote Sensing of Environment, 2020, 248: 111998. DOI:10.1016/j.rse.2020.111998 |
| [28] |
Qin BQ. Approaches to mechanisms and control of eutrophication of shallow lakes in the middle and lower reaches of the Yangze River. J Lake Sci, 2002, 14(3): 193-202. [秦伯强. 长江中下游浅水湖泊富营养化发生机制与控制途径初探. 湖泊科学, 2002, 14(3): 193-202. DOI:10.18307/2002.0301] |
| [29] |
Jing L, Lyu C, Zhou Y et al. Spatio-temporal characteristics of the expansion of poplar plantation in West Dongting Lake wetland, China. Chinese Journal of Applied Ecology, 2016, 27(7): 2039-2047. [靖磊, 吕偲, 周延等. 西洞庭湖湿地杨树人工林扩张的时空特征. 应用生态学报, 2016, 27(7): 2039-2047. DOI:10.13287/j.1001-9332.201607.025] |
| [30] |
Li YZ, Li XQ, Zhang CM et al. Change trend of Salix ligneous plants in the Dongting Lake Wetlands and its reasons. Wetland Science, 2014, 12(5): 646-649. [李有志, 李锡泉, 张灿明等. 洞庭湖湿地柳属木本植物变化趋势及成因. 湿地科学, 2014, 12(5): 646-649.] |
| [31] |
Liu YZ, Shi LL, Duo HR et al. Disturbance-driven changes to landscape patterns and responses of waterbirds at West Dongting Lake, China. Biodiversity Science, 2013, 21(6): 666-676. [刘云珠, 史林鹭, 朵海瑞等. 人为干扰下西洞庭湖湿地景观格局变化及冬季水鸟的响应. 生物多样性, 2013, 21(6): 666-676. DOI:10.3724/SP.J.1003.2013.11090] |
| [32] |
Zhu Y, Lu C, Hu HJ et al. Changes in fish community structure in West Dongting Lake after the operation of the Three Gorges Dam. J Lake Sci, 2014, 26(6): 844-852. [朱轶, 吕偲, 胡慧建等. 三峡大坝运行前后西洞庭湖鱼类群落结构特征变化. 湖泊科学, 2014, 26(6): 844-852. DOI:10.18307/2014.0605] |
| [33] |
Dong R, Wang YY, Lv C et al. Effects of hydrological connectivity on the community structure of macrobenthos in West Dongting Lake. Acta Ecologica Sinica, 2020, 40(22): 8336-8346. [董芮, 王玉玉, 吕偲等. 水文连通性对西洞庭湖大型底栖动物群落结构的影响. 生态学报, 2020, 40(22): 8336-8346. DOI:10.5846/stxb201911262565] |
| [34] |
Zhang JK, Zhou JX, Zhang HQ et al. Analysis on the driving force of the returning farmland to lake project and its impacts on wetland resources of West Dongting Lake. Forest Resources Management, 2010(4): 68-73, 78. [张健康, 周金星, 张怀清等. 退田还湖工程对西洞庭湖湿地资源的影响及驱动力分析. 林业资源管理, 2010(4): 68-73, 78.] |
| [35] |
Cai FJ, Wu ZJ, He N et al. Research progress in invasion ecology of Procambarus clarkia. Chinese Journal of Ecology, 2010, 29(1): 124-132. [蔡凤金, 武正军, 何南等. 克氏原螯虾的入侵生态学研究进展. 生态学杂志, 2010, 29(1): 124-132. DOI:10.13292/j.1000-4890.2010.0038] |
| [36] |
Loureiro TG, Anastácio PMSG, Araujo PB et al. Red swamp crayfish: Biology, ecology and invasion-an overview. Nauplius, 2015, 23(1): 1-19. DOI:10.1590/s0104-64972014002214 |
| [37] |
Xie WX, Dong FY, Xie S et al. The feeding habits, reproduction and habitat habits of Procambarus clarkii. Water Conservancy Fishery, 2008, 28(4): 63-65. [谢文星, 董方勇, 谢山等. 克氏原螯虾的食性、繁殖和栖息习性研究. 水利渔业, 2008, 28(4): 63-65. DOI:10.15928/j.1674-3075.2008.04.032] |
| [38] |
Rudnick D, Resh V. Stable isotopes, mesocosms and gut content analysis demonstrate trophic differences in two invasive decapod Crustacea. Freshwater Biology, 2005, 50(8): 1323-1336. DOI:10.1111/j.1365-2427.2005.01398.x |
| [39] |
Zhao W. Aquatic biology: Second edition. Beijing: China Agriculture Press, 2016. [赵文. 水生生物学: 第二版. 北京: 中国农业出版社, 2016.]
|
| [40] |
Guo KD, Zhang XB, Liu PZ et al. The response of submerged plants to different environmental factors and hydrologic regime in West Lake Dongting. J Lake Sci, 2020, 32(6): 1736-1748. [郭凯迪, 张晓波, 刘培中等. 西洞庭湖沉水植物分布格局对环境因子及水文情势差异的响应. 湖泊科学, 2020, 32(6): 1736-1748. DOI:10.18307/2020.0614] |
| [41] |
APHA ed. Standard methods for the examination of water and wastewater: 20th edition. Washington DC: American Public Health Association, American Water Works Association and Water Environmental Federation, 1998.
|
| [42] |
Post DM, Layman CA, Arrington DA et al. Getting to the fat of the matter: Models, methods and assumptions for dealing with lipids in stable isotope analyses. Oecologia, 2007, 152(1): 179-189. DOI:10.1007/s00442-006-0630-x |
| [43] |
Jackson AL, Inger R, Parnell AC et al. Comparing isotopic niche widths among and within communities: SIBER-Stable Isotope Bayesian Ellipses in R. Journal of Animal Ecology, 2011, 80(3): 595-602. DOI:10.1111/j.1365-2656.2011.01806.x |
| [44] |
Post DM. The long and short of food-chain length. Trends in Ecology & Evolution, 2002, 17(6): 269-277. DOI:10.1016/S0169-5347(02)02455-2 |
| [45] |
Layman CA, Arrington DA, Montaña CG et al. Can stable isotope ratios provide for community-wide measures of trophic structure?. Ecology, 2007, 88(1): 42-48. DOI:10.3390/d5030479 |
| [46] |
Rodríguez CF, Bécares E, Fernández-Aláez M. Shift from clear to turbid phase in Lake Chozas (NW Spain) due to the introduction of American red swamp crayfish (Procambarus clarkii). Hydrobiologia, 2003, 506/507/508/509(1/2/3): 421-426. DOI:10.1023/B:HYDR.0000008626.07042.87 |
| [47] |
Roessink I, Gylstra R, Heuts P et al. Impact of invasive crayfish on water quality and aquatic macrophytes in the Netherlands. Aquatic Invasions, 2017, 12(3): 397-404. DOI:10.3391/ai.2017.12.3.12 |
| [48] |
Hu CH, Liu SJ, Yang D et al. Time-series characteristics and influencing factors of pH value in the Qingfeng Gorge section of the Jialing River from 2007 to 2017. Journal of Sichuan Forestry Science and Technology, 2021, 42(1): 47-51. [胡翠华, 刘守江, 杨丹等. 嘉陵江清风峡断面水体pH值时间序列特征及其影响因素分析. 四川林业科技, 2021, 42(1): 47-51. DOI:10.12172/202007150001] |
| [49] |
Rodríguez-Pérez H, Hilaire S, Mesléard F. Temporary pond ecosystem functioning shifts mediated by the exotic red swamp crayfish (Procambarus clarkii): A mesocosm study. Hydrobiologia, 2016, 767(1): 333-345. DOI:10.1007/s10750-015-2523-7 |
| [50] |
Souty-Grosset C, Anastácio PM, Aquiloni L et al. The red swamp crayfish Procambarus clarkii in Europe: Impacts on aquatic ecosystems and human well-being. Limnologica, 2016, 58: 78-93. DOI:10.1016/j.limno.2016.03.003 |
| [51] |
Gallardo B, Clavero M, Sánchez MI et al. Global ecological impacts of invasive species in aquatic ecosystems. Global Change Biology, 2016, 22(1): 151-163. DOI:10.1111/gcb.13004 |
| [52] |
Liu JL, Cheng LJ, Yao SC et al. Variations in stable carbon isotopes in different components of aquatic macrophytes from Taihu Lake, China. Ecological Indicators, 2020, 118: 106721. DOI:10.1016/j.ecolind.2020.106721 |
| [53] |
Diebel MW, Zanden MJV. Nitrogen stable isotopes in streams: Effects of agricultural sources and transformations. Ecological Applications, 2009, 19(5): 1127-1134. DOI:10.1890/08-0327.1 |
| [54] |
Mao ZG, Gu XH, Zeng QF. Food sources and trophic relationships of three decapod crustaceans: Insights from gut contents and stable isotope analyses. Aquaculture Research, 2016, 47(9): 2888-2898. DOI:10.1111/are.12739 |
| [55] |
Zhang M, Li N, Gu BH et al. Trophic ecology and ecological function for oriental river prawn (Macrobrachium nipponense) in the south-to-north canal system. Wetlands, 2020, 40(5): 1207-1216. DOI:10.1007/s13157-020-01272-x |
| [56] |
Jackson MC, Evangelista C, Zhao T et al. Between-lake variation in the trophic ecology of an invasive crayfish. Freshwater Biology, 2017, 62(9): 1501-1510. DOI:10.1111/fwb.12957 |
| [57] |
Tillberg CV, Holway DA, Lebrun EG et al. Trophic ecology of invasive Argentine ants in their native and introduced ranges. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(52): 20856-20861. DOI:10.1073/pnas.0706903105 |
| [58] |
Grey J, Jackson MC. 'Leaves and eats shoots': Direct terrestrial feeding can supplement invasive red swamp crayfish in times of need. PLoS One, 2012, 7(8): e42575. DOI:10.1371/journal.pone.0042575 |
| [59] |
Jackson MC, Grey J, Miller K et al. Dietary niche constriction when invaders meet natives: Evidence from freshwater decapods. Journal of Animal Ecology, 2016, 85(4): 1098-1107. DOI:10.1111/1365-2656.12533 |
| [60] |
Dong R, Wang YY, Lu C et al. The seasonality of macroinvertebrate β diversity along the gradient of hydrological connectivity in a dynamic river-floodplain system. Ecological Indicators, 2021, 121: 107112. DOI:10.1016/j.ecolind.2020.107112 |
| [61] |
Li B, Tan WZ, Wen L et al. Anthropogenic habitat alternation significantly decreases α- and β-diversity of benthopelagic metacommunity in a large floodplain lake. Hydrobiologia, 2020, 847(1): 293-307. DOI:10.1007/s10750-019-04091-2 |
 2022, Vol. 34
2022, Vol. 34 


