(2: 上海海洋大学, 水产与生命学院, 上海 201306)
(3: 江西省武宁县农业农村局, 九江 332300)
(2: Shanghai Ocean University, College of Fisheries and Life Science, Shanghai 201306, P. R. China)
(3: Agriculture and Rural Affairs Bureau of Wuning County, Jiangxi Province, Jiujiang 332300, P. R. China)
解释自然界物种分布模式和生物多样性格局形成的过程一直面临巨大的挑战,也是目前亟需解决的难题[1-2]. 随着研究的深入,研究学者认识到生物群落并非封闭或稳定的实体,应用集合群落(Metacommunity)模型能够更准确地回答环境过滤和扩散限制作用是如何影响生物群落结构变异的问题[3],该理论方法在生态学研究中得到了广泛的应用[4-5],对了解生物多样性及其变化机制,形成生物多样性保护方案和制定管理措施具有极其重要的意义[6].
淡水湖库浮游植物长期以来一直被认为是研究物种群落构建机制的理想对象,浮游植物是水生态系统中重要的初级生产者及水生食物网的基础,与水生态系统能量流动、物质循环、信息传递等密切相关[7-8];同时,浮游植物的群落结构特征和动态变化规律可以反映出环境因子对生态系统的影响,对水生态系统的健康及稳定具有重要指示意义. 研究发现,浮游植物群落结构主要受环境过滤作用和空间扩散限制作用两方面的影响,两者在浮游植物群落结构变化过程中的驱动力往往在不同研究区域中结果不同[9]. 由于浮游植物扩散能力相对较弱,环境因子在浮游植物群落结构变异中扮演主要角色,然而,越来越多的研究发现,空间过程(即扩散限制作用)在构建浮游植物群落中的贡献度大于环境筛选作用[10]. 由于研究区域空间格局以及研究对象生物学特征差异的存在,使得已有研究中所得到的浮游植物群落构建机制并不能在其他区域进行完美的呈现[11],因此,探讨淡水湖库浮游植物群落构建机制,需要根据具体研究区域系统表征浮游植物群落的构建过程.
江西柘林水库是长江中游鄱阳湖流域的大型峡谷型水库,自上游下坊水电站到下游柘林大坝,水库东西长度跨度达到了80 km,不同库区水环境、水文及水生生物群落组成差异性显著[12],是研究浮游植物群落构建机制的理想区域. 目前,对柘林水库浮游植物的研究相对较少,已有的研究主要探讨了浮游植物种类组成结构及其与环境理化因子之间的关系[12-14],空间变量作为驱动浮游植物群落构建过程的关键因素一直是被忽略的对象. 本研究通过对柘林水库浮游植物群落及水体环境因子进行调查,从浮游植物群落种类组成、优势种分析、细胞丰度、物种多样性指数等方面探明柘林水库浮游植物群落组成特征;解析浮游植物群落结构与环境因子和空间扩散限制性因子之间的关系,旨在为解释湖库浮游植物群落构建过程机制提供理论依据,为柘林水库水生生物资源保护与管理提供参照资料.
1 材料和方法 1.1 研究区域概况柘林水库(29°3′~29°27′N,115°4′~115°40′E)位于修河流域中上游,处于幕阜山脉和九岭山脉之间,西接修水、地跨永修和武宁两县(图 1). 柘林水库全境水域面积308 km2,平均水深16.3 m,最大水深45 m,总容量79.2亿m3,换水周期平均为430 d[12, 15]. 柘林水库属于亚热带季风气候,全年平均气温为16.7℃,以1月份气温最低,平均气温为4.4℃,7、8月份气温最高,平均气温分别为28.2、27.9℃. 年平均降水量为1624.1 mm,最大年降雨量为2224.7 mm,最低年降雨量971.9 mm. 四季雨量分布不均,4-9月雨量最大,占全年总降水量的67 %;1-3月占20 %;10-12月雨量最低,仅占全年降水量的13 % [16].
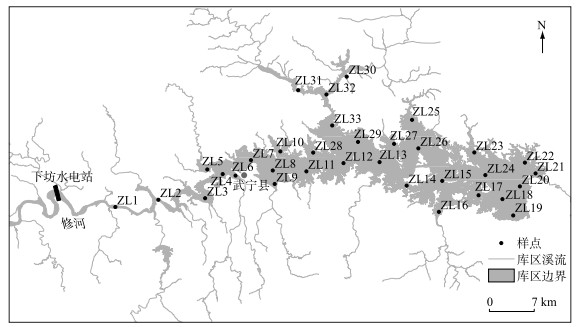
|
图 1 柘林水库采样点分布 Fig.1 Distribution of sampling sites in Zhelin Reservoir |
采样点的设置参考《水域生态系统观测规范》[17]进行并根据柘林水库实际水域形态、进出水口以及水文特征进行调整. 全库共设置33个采样点,根据样点的分布位置和环境差异将样点划分为3个分组,分别为修河区域样点(ZL1~ZL3),代表了流水环境;库心区域样点(ZL4、ZL6~ZL9、ZL11~ZL15、ZL17~ZL20、ZL24~ZL26、ZL29),代表了深水缓流环境;库湾区域样点(ZL05、ZL10、ZL16、ZL21~ZL23、ZL27、ZL28、ZL30~ZL33),代表了库汊静水环境(图 1),于2020年的10月对柘林水库进行调查采样,收集浮游植物样本和对应样点的环境因子.
1.3 样品采集与分析 1.3.1 浮游植物浮游植物定性样本使用25#浮游生物网(网目65 μm)进行采集,加4 % 甲醛固定后带回实验室用于种类鉴定. 定量样本使用有机玻璃采水器(1 L)在表层至0.5 m深处和0.5~1.0 m深处分别采样,样本充分混合后取1 L加入15 mL鲁哥氏液固定,带回实验室后沉淀、浓缩至30~50 mL用以定量计数. 对浮游植物样本进行种类鉴定和计数,浮游植物鉴定准则参考《中国淡水藻类——系统、分类及生态》[18].
1.3.2 环境因子使用多参数水质分析仪(HQ40D, Hach Love- land, USA)现场测定溶解氧(DO)、水温(WT)、电导率(Cond)和pH,利用塞氏盘测定透明度(SD),便携式水深探测器(SM-5)测定水深. 总磷(TP)、总氮(TN)、磷酸盐(PO43--P)、硝态氮(NO3--N)、亚硝态氮(NO2--N)和氨氮(NH3-N)等水化学指标参照《水和废水监测分析方法(第四版)》[19]进行测定.
1.3.3 空间变量使用主轴邻距法(principal coordinate of neighbor matrice, PCNM)基于样点坐标计算空间变量用于典范排序分析. 相比于趋势面分析,PCNM方法可以获得比取样间隔更多更宽尺度的正交空间变量,同时,此方法不仅不局限于模拟规则的取样空间结构,而且可以用来模拟不规则取样空间的结构,目前已被广泛运用到生物群落结构的研究中[20-22]. PCNM计算步骤:转换样点坐标为笛卡尔坐标系,根据样点坐标构建样点之间的距离矩阵(欧式距离),削减距离矩阵规模保留一定规模的邻体之间的距离,计算削减距离矩阵的主坐标分析(PCoA),保留具有正空间相关的特征向量. 本研究中的PCNM分析使用“vegan”包中的pcnm函数进行计算.
1.4 生物多样性指数计算使用Shannon-Wiener多样性指数(H′)[23]、Simpson多样性指数(D)[24]、Margalef丰富度指数(d)[25]、Pielou均匀度指数(J)[26]表示浮游植物群落多样性的变化规律,公式分别为:
| $ H' = - \sum\limits_{i = 1}^S {{P_i}} \cdot {\rm{ln}}\;{P_i} $ | (1) |
| $ D=1-\sum\limits_{i=1}^{S} P_{i}^{2} $ | (2) |
| $ d=\frac{S-1}{\ln N} $ | (3) |
| $ J=H^{\prime} / \ln S $ | (4) |
式中, Pi为第i种藻类个体数(Ni)占总个体数(N)的比例, S为样点物种数.
浮游植物的优势种根据各个种的优势度(Y)值来确定,公式为:
| $ Y = {N_i}/N \cdot {f_i} $ | (5) |
式中,fi为第i种类出现的频率. Y>0.02的种类为优势种[27].
1.5 数据分析柘林水库采样点分为3组,分别是上游修河水域、库心水域以及库湾水域用来研究浮游植物群落结构在3个不同分组的差异性. 检验结果显示生物多样性指数呈非正态分布(P < 0.05, Shapiro-Wilk),因此选择使用Kruskal-Wallis方法检验不同样点分组之间生物多样性指数的差异性,使用dunnTest多重比较方法计算两两分组之间矫正后的P值(Padj). 为更好地展示不同样点在物种组成结构上的差异性,使用非度量多维尺度排序(NMDS)分析方法,基于Bray-Curtis差异指数对调查地点进行空间排序,物种组成数据进行Hellinger转换以降低极值的影响. 不同分组之间物种组成差异的显著性使用置换方差分析(PERMANOVA)在9999次迭代次数下进行检验.
使用约束性排序方法(constrained ordination)分析群落组成与环境以及空间限制因子之间的相关关系. 首先,环境因子进行平方根转化以消除极值的影响. 然后,对数据矩阵进行除趋势对应分析(detrended correspondence analysis, DCA),根据分析结果中的第一轴梯度距离确定使用冗余分析(redundancy analysis, RDA)(gradient length < 3)还是典范对应分析(canonical correspondence analysis, CCA)(gradient length≥3). 其次,为降低解释变量之间的共线性效应,对转化后的解释因子变量计算方差膨胀因子(variance inflation factors, VIF),较高的VIF值预示着较高的共线性效应,后续分析剔除VIF大于10的变量[28]. 剩余因子变量与转化后的物种组成数据进行冗余排序,使用前向选择方法(forward selection)和Monte Carlo转置检验筛选对生物群落结构最重要的解释变量. 观察筛选出的重要环境因子在排序空间中的分布规律,使用一般可加模型(generalized additive model, GAM)分析环境影响因子与排序轴之间的非线性关系,并将拟合结果以趋势面的方式展示在排序空间中. 最后,检验不同层面解释变量(环境因子与空间变量)对群落结构的贡献性,使用变差分解函数varpart[29],在9999次置换(permutations)次数下检验差异的显著性[30].
以上数据分析均在R(4.0.4)语言中实现;其中,生物多样性指数、空间变量、NMDS、RDA使用“vegan”包进行;Kruskal-Wallis及dunnTest使用“FSA”包进行;GAM使用“metR”及“ggplot2”进行分析和可视化.
2 结果 2.1 物种组成本次调查共采集浮游植物122种,隶属于7门9纲24目35科68属. 其中,绿藻门(Chlorophyta)和硅藻门(Bacillariophyta)种类数最多,绿藻门有2纲6目14科34属62种,占总数的50.81 %,硅藻门有2纲9目11科11属27种,占总物种数的22.13 %;蓝藻门(Cyanophyta))有1纲4目5科10属16种,占总物种数的13.11 %;甲藻门(Pyrrophyta)有1纲1目2科4属7种,占总物种数的5.7 %;裸藻门(Euglenophyta)有1纲1目1科3属4种,占总物种数的3.2 %;金藻门(Chrysophyta)有1纲3目3科3属3种,占总物种数的2.4 %;隐藻门(Cryptophyta)有1纲2目2科3属3种,占总物种数的2.4 %.
2.2 优势物种柘林水库浮游植物不同科物种数不同;其中,栅藻科(Scenedesmaceae)(17种)、小球藻科(Chlorellaceae)(11种)和鼓藻科(Desmidiaceae)(11种)物种数相对较高;栅藻科中栅藻属(Scenedesmus)物种数最高为7种,小球藻科中四角藻属(Tetraedron)物种数最高为5种. 根据优势度(Y)计算结果,柘林水库浮游植物优势种类主要是蓝藻门中的伪鱼腥藻属(Pseudoanabaena)、浮鞘丝藻属(Planktolyngbya)、小尖头藻属(Raphidiopsis)以及硅藻门中的针杆藻属(Synedra)种类,Y值分别为0.071、0.119、0.657和0.024. 总体来看,柘林水库浮游植物优势物种相对较少,不同样点物种组成结构相对分散.
2.3 浮游植物细胞丰度与生物量图 2所示,柘林水库浮游植物细胞丰度在不同采样点间的变化范围为0.93×106~172.12×106 cells/L,平均值为95.42×106 cells/L,不同样点间细胞丰度差异性较大. 蓝藻门细胞丰度占比相对最高,变化范围达到了23.55 % ~99.30 %,其次是硅藻门和绿藻门,细胞丰度变化范围分别为0.19×106~9.62×106和0.18×106~8.57×106 cells/L,占比变化范围为0.14 % ~26.45 % 和0.15 % ~42.26 %;空间上,上游修河水域硅藻门与绿藻门细胞丰度相对较高,细胞丰度占比平均值分别为14.68 % 和27.53 %,其余样点蓝藻门细胞丰度占比相对较大,平均值达到92.93 %.
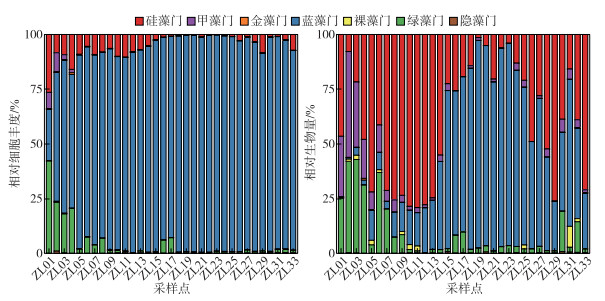
|
图 2 柘林水库不同采样点浮游植物各类群相对细胞丰度与相对生物量 Fig.2 Relative cell abundance and biomass of different phytoplankton taxa among different sites in Zhelin Reservoir |
在生物量方面,浮游植物生物量在不同采样点的变化范围为0.95~22.35 mg/L,平均值为9.35 mg/L. 硅藻门和蓝藻门生物量相对最高,变化范围分别为0.13~15.96和0.0045~9.39 mg/L,平均值分别为4.36和4.26 mg/L,生物量占比平均值分别为40.77 % 和42.89 %. 空间上,硅藻门生物量在水库上游样点(ZL07~ZL014)值较高,蓝藻门生物量在下游样点(ZL15~ZL25)值相对较高.
2.4 浮游植物多样性指数变化对柘林水库浮游植物生物多样性指数在不同采样水域间差异性分析结果显示(表 1),Shannon-Wiener、Simpson、Peilou和Margalef指数整体上呈现显著性差异(Kruskal-Wallis, P < 0.05);多重比较结果显示,上游修河水域浮游植物生物多样性指数显著高于库心和库湾水域(Padj < 0.05),而库心与库湾水域之间生物多样性指数差异性不明显(Padj>0.05)(图 3).
| 表 1 柘林水库浮游植物生物多样性指数在不同库区分布及差异性检验 Tab. 1 Distribution and significance test of phytoplankton diversity indexes among different areas in Zhelin Reservoir |
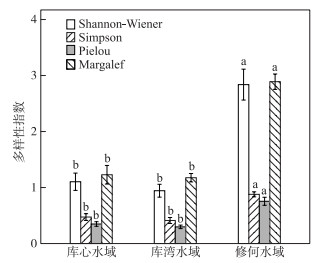
|
图 3 柘林水库不同区域浮游植物生物多样性指数 (同一指标的不同小写字母表示差异显著(Padj < 0.05),相同小写字母表示差异不显著(Padj>0.05)) Fig.3 Biodiversity of phytoplankton in different areas in Zhelin Reservoir (Different lowercase letters represented significant differences (Padj < 0.05), the same letter indicates no significant difference (Padj>0.05)) |
PERMANOVA结果显示柘林水库浮游植物群落结构在不同研究区域之间差异性极显著(F=5.65, P < 0.001),主要为修河水域与库心(F=7.42, P < 0.01)及库湾水域(F=13.27, P < 0.01)之间差异性显著,库心水域与库湾水域浮游植物物种组成结构差异性不明显(F=0.94, P>0.05). NMDS结果显示,修河水域采样点与其他样点之间呈现分离状态(图 4). 不同样点与主要环境因子之间具有显著的相关关系(P < 0.05)(表 2),其中,修河水域浮游植物群落主要分布在较大透明度和氨氮浓度等值线附近;库心水域与库湾水域浮游植物群落主要分布在较小透明度、氨氮浓度等值线以及较大硝态氮浓度附近.
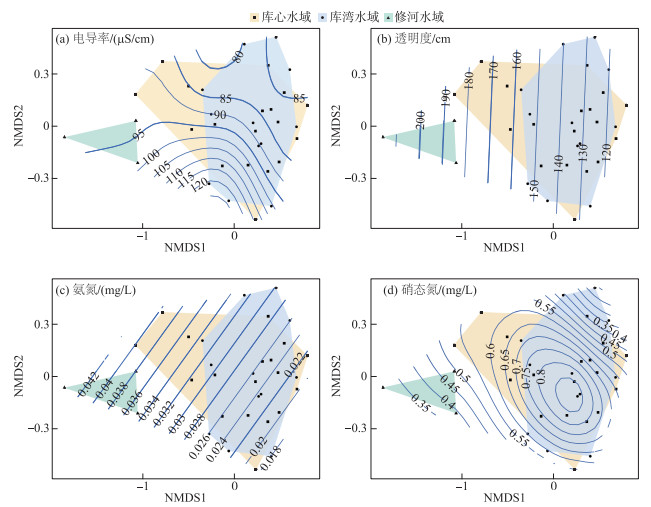
|
图 4 浮游植物群落结构的非度量多维标尺排序(NMDS),以及环境因子在空间中的可加模型曲线 Fig.4 Non-metric multidimensional scaling(NMDS) plots of the phytoplankton community structure, with smooth response curves of the environmental variables overlain |
| 表 2 环境变量对NMDS排序轴的广义可加模型(GAM)结果 Tab. 2 summary of the generalized additive models(GAMs) performed on the environmental variables and axis of NMDS |
基于浮游植物细胞丰度与环境因子的除趋势对应分析(DCA)结果显示,第一轴的长度为2.85,表明使用冗余分析(RDA)能够更加准确地研究限制性因子对柘林水库浮游植物群落结构的影响机制. 根据解释变量的VIF值以及前向选择方法,共筛选出11个因子用来解释浮游植物群落结构变异,包括4个环境因子和7个空间因子(图 5),共解释了浮游植物群落结构76.19 % 的变异率,其中第一轴解释率为51.19 % (F=45.17, P < 0.01);第二轴解释率为14.52 % (F=12.82, P < 0.01). 环境因子中,透明度、氨氮浓度对浮游植物群落结构的影响达到显著水平(P < 0.05),空间因子中较大尺度空间因子PCNM1、PCNM3、PCNM7和PCNM13对浮游植物群落结构的影响达到显著水平(P < 0.05)(表 3). 伪鱼腥藻(Pseudoanabaena sp.)、细浮鞘丝藻(Planktolyngbya subtilis)、尖针杆藻(Synedra acus)与硝态氮浓度之间存在正相关关系,裸甲藻(Gymnodinium sp.)、细小平裂藻(Merismopedia minima)与氨氮浓度之间存在正相关关系.
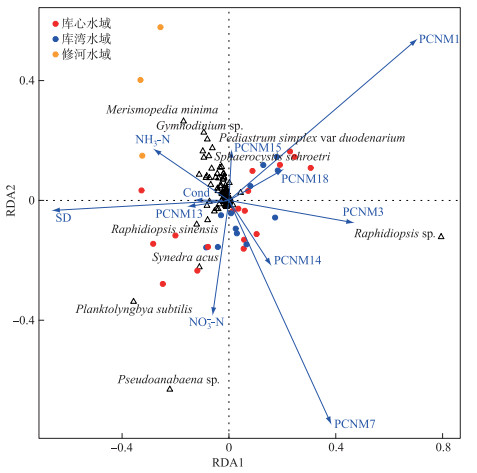
|
图 5 基于浮游植物丰度与环境因子的RDA排序图 Fig.5 RDA plot of phytoplankton abundance and environmental factors |
| 表 3 柘林水库浮游植物群落与解释变量之间的RDA分析 Tab. 3 Result of RDA of phytoplankton and explanatory variables in Zhelin Reservoir |
变差分解结果显示,水体理化与空间变量对浮游植物群落结构的解释度分别为13.33 % 和30.43 %,共同解释度为10.22 %,未解释度为46.02 %,表明空间扩散限制作用在解释浮游植物群落结构变异中贡献度相对较大(图 6). 尽管如此,两者的共同解释度达到10.2 %,说明在柘林水库中,浮游植物群落结构的变异主要是自然环境因素与空间扩散限制性作用共同决定的,占主导地位的为空间扩散限制性作用.

|
图 6 环境因子与空间扩散限制性作用对浮游植物群落变差分解结果 Fig.6 Result of variation partitioning with environment factors and spatial dispersal limitation |
本次藻类优势物种调查结果与2012年秋季和2015年春季对柘林水库的调查结果一致,硅藻门和蓝藻门是柘林水库优势藻类类群[12-13],不同的是浮游植物细胞丰度与生物量呈现上升趋势,远高于同季节的调查结果. 浮游植物群落结构、种类组成等能有效地反映水质现状及变化[31-32],硅藻门和绿藻门作为敏感类群,其物种数和生物量与水质之间具有显著的相关关系,被认为是反映水质等级的理想类群[33]. 柘林水库硅藻门和绿藻门物种数相对最高,分别占总物种数的22.13 % 和50.81 %,主要是水库中上水域样点(ZL01~ZL14)生物量占比较高,这一结果说明修河及入库口水质良好. 然而,下游(ZL16~ZL27)蓝藻门物种生物量占比明显增高,预示着该水域富营养化程度较高,水质状况相对较差. 产生这一现象的主要原因是,上游修河入库口由于受到外源营养物质的补充,导致了浮游植物丰富度的增加,而库心区及库湾水域水体滞留时间较长,营养物质大量积累,导致浮游植物群落主要以蓝藻门物种为主,浮游植物生物多样性与均匀度相对较低[34]. 对柘林水库浮游植物群落结构变化的研究同样发现,库湾及库区内水体滞留时间较长,水体交换速度慢,营养盐浓度超标,导致蓝藻水华现象,这也是库湾及库区浮游植物群落结构区别与上游修河水域的主要原因之一[12].
3.2 柘林水库浮游植物群落结构与环境因子的关系浮游植物群落结构与环境因子的关系一直是研究的重点之一,不同湖库和河流生态系统中,环境因子对浮游植物群落结构的影响也不尽相同[32, 35-36]. 通过分析柘林水库浮游植物群落与环境因子的关系发现,透明度、电导率、氨氮和硝态氮浓度对浮游植物群落结构的影响较大,这一结果与长江中下游及其他流域湖库浮游植物的研究结果相似[32, 34, 37].
水体透明度是反映水体理化环境的综合性指数,水体悬浮颗粒、浮游生物密度等与水体透明度之间存在显著的相关关系. 浮游植物的生长与繁殖通常受到光照强度的影响,而水体透明度的差异直接导致不同水层光照强度的变化,进而引起浮游植物群落结构的变异[38]. 根据对柘林水库的调查研究,不同水域样点水体透明度分布范围为7~220 cm,其中,水库上游包括修河水域透明度((191±24)cm)明显高于水库中游((137±33)cm)和下游透明度((139±31)cm),导致浮游植物群落结构在透明度梯度变化曲线上呈现分离的现象,这与熊莲等对湖泊浮游植物群落结构的研究结果一致[37, 39].
电导率是反映水体营养盐浓度的重要指标,研究发现,电导率的不同反映了水体内无机盐浓度的差异,其数值范围与氮磷无机盐浓度具有显著的相关关系[36],不同的浮游植物类群对电导率具有不同的适应范围,绿藻门与蓝藻门与电导率之间呈现显著的正相关关系[32]. 本研究中,柘林水库修河水域电导率处于相对中等水平,说明无机盐浓度相对适宜,从而导致该区域浮游植物群落结构与其他区域之间的分离.
研究发现,无机盐浓度在浮游植物生长过程中扮演重要角色,营养盐浓度不足或过量都会影响浮游植物的生长和繁殖活动[40]. 氨氮和硝态氮作为溶解性氮盐的两种存在方式,对柘林水库浮游植物群落结构具有显著的影响作用,与其他研究具有相似的结果[35, 41]. 柘林水库上游监测样点(ZL01~ZL09)硅藻门和绿藻门浮游植物细胞密度相对较高,浮游植物群落结构排序结果显示,该区域样点主要分布在较高浓度氨氮和较低浓度硝态氮等值线上,表明水体中氨氮浓度的增高促进了直链藻、尖针杆藻、栅藻(Scenedesmus sp.)等硅藻门和绿藻门优势物种的生长,硝态氮浓度的增高预示着水体中氨氮转化利用率较低,造成水体的富营养化,从而导致蓝藻门的大量生长.
3.3 柘林水库浮游植物群落结构的驱动机制分析环境因子过滤作用和空间扩散限制作用被认为是物种群落构建过程中的主要决定机制,在解析物种组成结构变化,群落构建过程驱动机制中占据主导地位[11]. 近年来,随着集合群落概念的提出,研究者发现使用单一的生态位理论或中性理论很难解释清楚生物群落构建过程的驱动机制,对生物群落构建机制的研究也逐渐由单一理论转移到探讨环境因子和空间因子在决定群落结构中的贡献度大小的问题中[1]. 研究发现,不同生物类群在不同的空间格局尺度下,其决定机制存在差异性[11]. 浮游植物作为水生生物重要的组成部分,群落结构的变异主要受到环境和空间因子两方面的影响[42],两者在解释群落结构变异中的贡献度在不同水域中结果不同. 本研究结果显示,空间扩散限制性作用对柘林水库浮游植物群落结构变异达到了30.43 % 的解释率,大于环境因子(13.33 %)的解释率,这与其他湖库浮游植物群落结构驱动机制的研究结果一致[6, 9]. 相反Guo等[37]和Algarte等[43]的研究发现,环境因子在湖泊水库浮游植物群落结构中占据主导地位,产生不同结果的原因可能是研究空间尺度以及人类干扰强度等级不同导致的[44]. 柘林水库在空间格局尺度上与其他研究湖泊或水库存在差异性,柘林水库水域呈现狭长分布结构,水域连通性较高,网络空间位置变异较大,较高的联通性弱化了环境因子对浮游植物群落结构的解释度,从而导致了空间扩散限制性因子在解释浮游植物群落结构中占据主导地位[6, 11];与此同时,柘林水库受到不同程度的人类干扰活动的影响,武宁县污水排污口与巾口码头排污口生活污水的排放造成了中部库区水体营养物浓度的上升;库区旅游景点的运行影响了附近水体健康状况,这些因素均会造成环境因子空间分布不均等,导致环境因子过滤作用在解释浮游植物群落构建机制中的作用被弱化.
尽管环境因子与空间因子在解释柘林水库浮游植物群落结构中占到了相对较高的解释率,达到了53.98 %,但是,仍然有46.02 % 群落结构变异率未被解释. 原因可能是一些关键的限制性因子在本研究中未被选择,例如,柘林水库每年进行的鲢鳙鱼类增殖放流活动对浮游植物的牧食作用会影响其群落结构的变化;浮游动物的牧食活动也会导致浮游植物群落构建过程机制产生不同的结果[45];水文特征的差异同样是影响浮游植物群落结构变异的重要因素;此外,本研究基于秋季单次调查数据分析了浮游植物群落构建机制,由于湖库水文理化及浮游植物群落组成季节性差异的存在,后续研究还需比较不同季节浮游植物群落构建机制的差异性,更加全面深入地解释浮游植物群落结构的驱动机制[6, 43].
4 结论1) 柘林水库上游修河区域浮游植物生物多样性指数显著高于库心和库湾区,库心区与库湾区之间生物多样性指数差异性不明显.
2) 柘林水库上游修河水域浮游植物群落结构与库心和库湾区存在明显分离,结构的差异性主要受水体透明度、电导率、氨氮和硝态氮浓度的影响.
3) 空间扩散限制性作用在驱动柘林水库浮游植物群落构建中占据主导地位.
| [1] |
Leibold MA, Holyoak M, Mouquet N et al. The metacommunity concept: A framework for multi-scale community ecology. Ecology Letters, 2004, 7(7): 601-613. DOI:10.1111/j.1461-0248.2004.00608.x |
| [2] |
Datry T, Bonada N, Heino J. Towards understanding the organisation of metacommunities in highly dynamic ecological systems. Oikos, 2016, 125(2): 149-159. DOI:10.1111/oik.02922 |
| [3] |
Soininen J, Heino J, Wang JJ. A meta-analysis of nestedness and turnover components of beta diversity across organisms and ecosystems. Global Ecology and Biogeography, 2018, 27(1): 96-109. DOI:10.1111/geb.12660 |
| [4] |
Meier S, Luoto M, Soininen J. The effects of local, buffer zone and geographical variables on lake plankton metacommunities. Hydrobiologia, 2015, 743(1): 175-188. DOI:10.1007/s10750-014-2034-y |
| [5] |
Tolonen KT, Cai YJ, Vilmi A et al. Environmental filtering and spatial effects on metacommunity organisation differ among littoral macroinvertebrate groups deconstructed by biological traits. Aquatic Ecology, 2018, 52(1): 119-131. DOI:10.1007/s10452-018-9649-4 |
| [6] |
Bortolini JC, Silva PRL, Baumgartner G et al. Response to environmental, spatial, and temporal mechanisms of the phytoplankton metacommunity: Comparing ecological approaches in subtropical reservoirs. Hydrobiologia, 2019, 830(1): 45-61. DOI:10.1007/s10750-018-3849-8 |
| [7] |
Hayes NM, Vanni MJ, Horgan MJ et al. Climate and land use interactively affect lake phytoplankton nutrient limitation status. Ecology, 2015, 96(2): 392-402. DOI:10.1890/13-1840.1 |
| [8] |
Pomati F, Matthews B, Seehausen O et al. Eutrophication and climate warming alter spatial (depth) co-occurrence patterns of lake phytoplankton assemblages. Hydrobiologia, 2017, 787(1): 375-385. DOI:10.1007/s10750-016-2981-6 |
| [9] |
Vilmi A, Tolonen KT, Karjalainen SM et al. Metacommunity structuring in a highly-connected aquatic system: Effects of dispersal, abiotic environment and grazing pressure on microalgal guilds. Hydrobiologia, 2017, 790(1): 125-140. DOI:10.1007/s10750-016-3024-z |
| [10] |
Martiny JBH, Bohannan BJM, Brown JH et al. Microbial biogeography: Putting microorganisms on the map. Nature Reviews Microbiology, 2006, 4(2): 102-112. DOI:10.1038/nrmicro1341 |
| [11] |
Heino J, Melo AS, Siqueira T et al. Metacommunity organisation, spatial extent and dispersal in aquatic systems: Patterns, processes and prospects. Freshwater Biology, 2015, 60(5): 845-869. DOI:10.1111/fwb.12533 |
| [12] |
Dai GF, Liu HL, Zhang W et al. Spatio-temporal variation of algae and eutrophic status of Lake Zhelin, Jiangxi Province. J Lake Sci, 2015, 27(2): 275-281. [戴国飞, 刘慧丽, 张伟等. 江西柘林湖富营养化现状与藻类时空分布特征. 湖泊科学, 2015, 27(2): 275-281. DOI:10.18307/2015.0211] |
| [13] |
Li YM, Li MT, Ai W et al. Distribution, relationship and significance of phytoplankton, chlorophyll-a and environment variables in spring season of the Zhelin Reservoir, Jiangxi Province. J Lake Sci, 2017, 29(3): 625-636. [李懿淼, 李茂田, 艾威等. 江西柘林水库春季浮游藻类、叶绿素a与环境因子的分布、关系及意义. 湖泊科学, 2017, 29(3): 625-636. DOI:10.18307/2017.0311] |
| [14] |
Zhang YG. Phytoplankton community composition and dynamics in Lake Zhelin and their effect on cyanobacterial blooms of Lake Poyang[Dissertation]. Nanchang: Jiangxi Normal University, 2020. [张毅鸽. 柘林湖浮游植物的群落结构、动态变化及其对鄱阳湖蓝藻水华影响[学位论文]. 南昌: 江西师范大学, 2020. ]
|
| [15] |
Liu HL, Feng ML, Xiong P. Non-point source into lake load estimation and countermeasure research on Zhelin Lake. Journal of Anhui Agricultural Sciences, 2013, 41(4): 1670-1673. [刘慧丽, 冯明雷, 熊鹏. 柘林湖非点源入湖负荷估算及对策研究. 安徽农业科学, 2013, 41(4): 1670-1673. DOI:10.3969/j.issn.0517-6611.2013.04.103] |
| [16] |
Ling CH. Research on flood and climate change of the Xiuhe River for the last 230 years[Dissertation]. Nanchang: Jiangxi Normal University, 2016. [凌超豪. 230年来修河流域气候变化与洪水研究[学位论文]. 南昌: 江西师范大学, 2016. ]
|
| [17] |
Cai QH. Water ecosystem observation norms. Beijing: China Environmental Science Press, 2007. [蔡庆华. 水域生态系统观测规范. 北京: 中国环境科学出版社, 2007.]
|
| [18] |
Hu HJ, Wei YX. The freshwater algae of China-Systematics, taxonomy and ecology. Beijing: Science Press, 2006. [胡鸿钧, 魏印心. 中国淡水藻类——系统、分类与生态. 北京: 科学出版社, 2006.]
|
| [19] |
Ministry of Environmental Protection of the People's Republic of China, Editorial Board of Water and Wastewater Monitoring and Analysis Methods. Water and Wastewater Monitoring and Analysis Methods: 4th edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002.]
|
| [20] |
Borcard D, Legendre P, Avois-Jacquet C et al. Dissecting the spatial structure of ecological data at multiple scales. Ecology, 2004, 85(7): 1826-1832. DOI:10.1890/03-3111 |
| [21] |
Brind'Amour A, Boisclair D, Legendre P et al. Multiscale spatial distribution of a littoral fish community in relation to environmental variables. Limnology and Oceanography, 2005, 50(2): 465-479. DOI:10.4319/lo.2005.50.2.0465 |
| [22] |
Brind'Amour A, Boisclair D, Dray S et al. Relationships between species feeding traits and environmental conditions in fish communities: A three-matrix approach. Ecological Applications, 2011, 21(2): 363-377. DOI:10.1890/09-2178.1 |
| [23] |
Shannon CE, Weaver W, Wiener N. The mathematical theory of communication. Urbana: The University of Illinois Press, 1949.
|
| [24] |
Simpson EH. Measurement of diversity. Nature, 1949, 163: 688. DOI:10.1038/163688a0 |
| [25] |
Pielou EC. Species-diversity and pattern-diversity in the study of ecological succession. Journal of theoretical biology, 1966, 10(2): 370-383. DOI:10.1016/0022-5193(66)90133-0 |
| [26] |
Margalef R. Information theory in ecology. General Systems, 1958(3): 36-71. |
| [27] |
Hao YY, Sun GJ, Zhang LX et al. Relationship between community characteristics of the phytoplankton and environmental factors in Heihu River basin. J Lake Sci, 2014, 26(1): 121-130. [郝媛媛, 孙国钧, 张立勋等. 黑河流域浮游植物群落特征与环境因子的关系. 湖泊科学, 2014, 26(1): 121-130. DOI:10.18307/2014.0115] |
| [28] |
Wu NC, Qu YM, Guse B et al. Hydrological and environmental variables outperform spatial factors in structuring species, trait composition, and beta diversity of pelagic algae. Ecology and Evolution, 2018, 8(5): 2947-2961. DOI:10.1002/ece3.3903 |
| [29] |
Oksanen J, Blanchet FG, Friendly M et al. Package "vegan". R package version 2.3-4, 2016.
|
| [30] |
Legendre P. Studying beta diversity: Ecological variation partitioning by multiple regression and canonical analysis. Journal of Plant Ecology, 2008, 1(1): 3-8. DOI:10.1093/jpe/rtm001 |
| [31] |
Li RR, Zhang GX, Zhang L. Multivariate analysis of the relations between phytoplankton assemblages and environmental factors in Chagan Lake Wetland. Acta Ecologica Sinica, 2014, 34(10): 2663-2673. [李然然, 章光新, 张蕾. 查干湖湿地浮游植物与环境因子关系的多元分析. 生态学报, 2014, 34(10): 2663-2673. DOI:10.5846/stxb201306091545] |
| [32] |
Jia HY, Xu JF, Lei JS. Relationship of community structure of phytoplankton and environmental factors in Danjiangkou Reservoir bay. Yangtze River, 2019, 50(5): 52-58. [贾海燕, 徐建锋, 雷俊山. 丹江口库湾浮游植物群落与环境因子关系研究. 人民长江, 2019, 50(5): 52-58.] |
| [33] |
Pan H, Tang YH. Pollution indicator species and evaluation of water quality in Caohai Lake, Weining. Wetland Science, 2016, 14(2): 230-234. [潘鸿, 唐宇宏. 威宁草海浮游植物污染指示种及水质评价. 湿地科学, 2016, 14(2): 230-234.] |
| [34] |
Zhao XX, Lu WX, Li J et al. Community structure of phytoplankton and bio-assessment of water quality in Chengdong Lake in Anhui, China. Ecological Science, 2020, 39(5): 187-196. [赵秀侠, 卢文轩, 李静等. 安徽城东湖浮游植物群落结构与水质评价. 生态科学, 2020, 39(5): 187-196.] |
| [35] |
Wang H, Yang SP, Fang SZ et al. Canonical correspondence analysis of relationship between characteristics of phytoplankton community and environmental factors in Dianchi Lake. China Environmental Science, 2016, 36(2): 544-552. [王华, 杨树平, 房晟忠等. 滇池浮游植物群落特征及与环境因子的典范对应分析. 中国环境科学, 2016, 36(2): 544-552. DOI:10.3969/j.issn.1000-6923.2016.02.034] |
| [36] |
Zhao XX, Fang T, Yang K et al. Community structure characteristics of phytoplankton and related environmental factors in summer in Tuohu Lake, Anhui, China. Plant Science Journal, 2018, 36(5): 687-695. [赵秀侠, 方婷, 杨坤等. 安徽沱湖夏季浮游植物群落结构特征与环境因子关系. 植物科学学报, 2018, 36(5): 687-695. DOI:10.11913/PSJ.2095-0837.2018.50687] |
| [37] |
Xiong L, Liu DY, Wang JL et al. Phytoplankton community structure in Lake Taiping of Anhui Province. J Lake Sci, 2016, 28(5): 1066-1077. [熊莲, 刘冬燕, 王俊莉等. 安徽太平湖浮游植物群落结构. 湖泊科学, 2016, 28(5): 1066-1077. DOI:10.18307/2016.0517] |
| [38] |
Pan JZ, Xiong F, Li WC et al. Structure, distribution and its impact factors of phytoplankton community in Fuxian Lake. Acta Ecologica Sinica, 2009, 29(10): 5376-5385. [潘继征, 熊飞, 李文朝等. 抚仙湖浮游植物群落结构、分布及其影响因子. 生态学报, 2009, 29(10): 5376-5385. DOI:10.3321/j.issn:1000-0933.2009.10.024] |
| [39] |
Pan JZ, Xiong F, Li WC et al. Spatial-temporal dynamic changes of the water transparency and their influencing factors in Lake Fuxian, Yunnan Province. J Lake Sci, 2008, 20(5): 681-686. [潘继征, 熊飞, 李文朝等. 云南抚仙湖透明度的时空变化及影响因子分析. 湖泊科学, 2008, 20(5): 681-686. DOI:10.18307/2008.0519] |
| [40] |
Xu H, Paerl HW, Qin BQ et al. Nitrogen and phosphorus inputs control phytoplankton growth in eutrophic Lake Taihu, China. Limnology and Oceanography, 2010, 55(1): 420-432. DOI:10.4319/lo.2010.55.1.0420 |
| [41] |
Li LQ, Huang DZ, Xiong J et al. Nutrient limiting phytoplankton growth in Dongting Lake. Ecology and Environmental Sciences, 2014, 23(2): 283-288. [李利强, 黄代中, 熊剑等. 洞庭湖浮游植物增长的限制性营养元素研究. 生态环境学报, 2014, 23(2): 283-288. DOI:10.3969/j.issn.1674-5906.2014.02.016] |
| [42] |
Pujoni DGF, Barros CFDA, dos Santos JBO et al. Dispersal ability and niche breadth act synergistically to determine zooplankton but not phytoplankton metacommunity structure. Journal of Plankton Research, 2019, 41(4): 479-490. DOI:10.1093/plankt/fbz029 |
| [43] |
Algarte VM, Rodrigues L, Landeiro VL et al. Variance partitioning of deconstructed periphyton communities: Does the use of biological traits matter?. Hydrobiologia, 2014, 722(1): 279-290. DOI:10.1007/s10750-013-1711-6 |
| [44] |
Bortolini JC, Pineda A, Rodrigues LC et al. Environmental and spatial processes influencing phytoplankton biomass along a reservoirs-river-floodplain lakes gradient: A metacommunity approach. Freshwater Biology, 2017, 62(10): 1756-1767. DOI:10.1111/fwb.12986 |
| [45] |
Guo K, Wu NC, Wang C et al. Trait dependent roles of environmental factors, spatial processes and grazing pressure on lake phytoplankton metacommunity. Ecological Indicators, 2019, 103: 312-320. DOI:10.1016/j.ecolind.2019.04.028 |
 2022, Vol. 34
2022, Vol. 34 

