湖泊作为重要的淡水水体,其水体水质优劣和生态健康与否直接关系着该地区居民的生活和经济发展[1]. 白洋淀作为华北地区最大的淡水湖泊,为周边的经济发展提供了重要的生态保障,然而由于白洋淀水体环境受到旅游、历史养殖等多方面的综合影响,大量的氮素进入水体,造成了严重的水体富营养化[2]. 传统的生物脱氮在天然水体中进行原位氮素削减效果较差,好氧反硝化菌的发现为原位削减好氧环境下的天然水体氮素提供了新思路. 特别是在春季,白洋淀冰封解冻,水体温度、溶解氧等环境变化剧烈,引起微生物种群结构也发生相应变化. 因此,研究春季白洋淀好氧反硝化菌群落对控制其水体富营养化程度、削减氮素具有重要意义.
目前关于好氧反硝化菌的研究大多是基于实验室的菌种分离鉴定和脱氮特性分析[3],牟东阳等从活性污泥中分离出一株假单胞菌并研究了其可同时进行硝化反硝化的特征,表明其在处理含氮废水方面有一定的潜力[4],周石磊等采用改良的富集驯化方法来分离贫营养好氧反硝化菌并进行脱氮实验,结果显示筛选的好氧反硝化菌具有良好的短程反硝化、硝化和源水脱氮能力[5]. 由于用于富集驯化好氧反硝化菌的碳源与实际环境差异太大,筛选出来的高效菌在现实环境中并不高效,以至于发挥不出应有的脱氮优势,因此很少有好氧反硝化菌实际应用于修复天然水体. 碳源在反硝化过程中作为电子供体,为好氧反硝化菌的增殖提供能量[6]. 目前,许多学者以乙酸钠、丁二酸钠、葡萄糖等作为碳源对好氧反硝化菌的脱氮特性进行研究[7-8],仅有文刚等[9]和周石磊等[10]研究了湖库中天然有机物对好氧反硝化菌的影响. 沉积物是微生物重要的栖息场所[11],并且表层沉积物大多时期处于缺氧-好氧环境,研究表明缺氧-好氧的交替环境有利于好氧反硝化菌的富集[12]. 与此同时,表层沉积物中大量的有机质可以作为异养微生物的碳源,因此,基于天然环境开展好氧反硝化菌群与溶解性有机物的相关关系研究十分必要,不仅有助于进一步认识天然环境中的氮循环微生物的特征,可以为将来适于实际环境的高效菌筛选的碳源选择提供参考.
本研究基于课题组前期研究[13]与白洋淀整体淀区的历史承载功能[14]将白洋淀划分为原始区、入淀区、旅游区、生活区和养殖区五大功能区,对5个功能区的25个点位进行采样,利用三维荧光-荧光区域积分法分析沉积物的溶解性有机物的组成,并利用高通量测序分析白洋淀春季好氧反硝化菌群落结构,进而研究好氧反硝化菌群落对溶解性有机物的响应,以期为天然水体高效好氧反硝化菌筛选的碳源选择提供依据.
1 材料与方法 1.1 研究区概况白洋淀(38°44′~38°59′N, 115°45′~116°07′E)位于河北省雄安新区,总面积336万m2,蓄水量1.024亿m3,是华北地区最大的淡水湖泊和最大的湿地生态系统,为周边的经济发展提供了重要的生态保障. 与此同时,白洋淀的水体环境受到上游外源输入和淀区生活、历史养殖以及旅游的综合影响,有水质恶化的风险.
1.2 样品采集与处理本研究将白洋淀分为原始区(AN)、入淀区(EA)、旅游区(TA)、生活区(LA)、养殖区(BA)五大功能区,原始区人烟稀少,人类干预较少,入淀区是白洋淀与6条河流相连接的区域,旅游区内设置旅游景点,夏季接纳大量游客,生活区内居住大量居民,村庄依水而建,养殖区历史水产养殖业发达[13],选取藻苲淀1#(S1)、藻苲淀2#(S2)、藻苲淀3#(S3)代表原始区,烧车淀(S4)、鸳鸯岛(S5)、文化苑西门(S6)代表旅游区,枣林庄(S7)、平阳淀(S8)、小麦淀(S9)、北田庄西淀(S10)、涝王淀(S11)、采蒲台(S12)、范峪淀(S13)代表生活区,前塘(S14)、后塘(S15)、端村1#(S16)、端村2#(S17)、泛鱼淀(S18)、鲥鮜淀(S19)代表养殖区,白沟引河(S20)、瀑河藻苲淀入淀口(S21)、萍河藻苲淀入淀口(S22)、唐河端村入淀口(S23)、南刘庄府河入淀口(S24)、潴笼河入淀口(S25)代表入淀区,每个区域的采样点位置见图 1. 于2019年春季(4月)采用抓泥斗采集白洋淀各个采样点的0~2 cm表层沉积物[2].
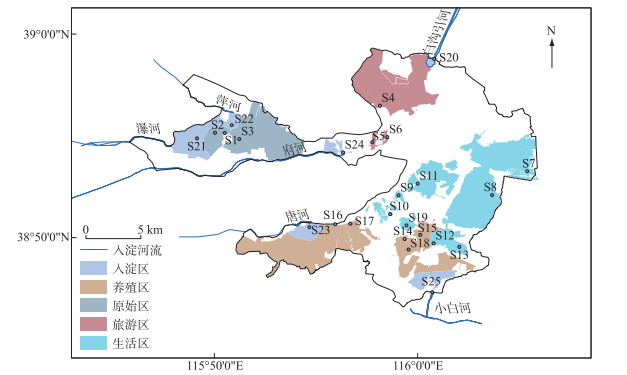
|
图 1 白洋淀沉积物采样点分布 Fig.1 Distribution of sediment sampling sites in Lake Baiyangdian |
本研究采用荧光区域积分法对沉积物中的有机质进行解析. 沉积物采用超纯水与沉积物重量比20 ∶1提取浸提液进行分析. 荧光光谱采用日立F700荧光分析仪进行分析,激发波长(Ex)扫描范围为200~450 nm,发射波长(Em)扫描范围为250~600 nm,扫描速率为2400 nm/min,激发波长和发射波长的增量分别为5和1 nm,将三维荧光光谱按激发/发射波长划分为5个区域,P1的Ex/Em为(200~250)/(250~330)nm;P2的Ex/Em为(200~250)/(330~350)nm;P3的Ex/Em为(200~250)/(350~500)nm;P4的Ex/Em为(250~280)/(250~380)nm;P5的Ex/Em为(280~400)/(380~500)nm. 采用Matlab 2016b进行前处理后将区域划块,并在Matlab2016b中进行区域积分计算,算出特定的荧光区域积分体积(Φ),Φi表示具有相似性质有机物的累积荧光强度;对Φi进行标准化分析,得到某一荧光区域积分标准体积(Φi, n);最后计算出某一荧光区域特定结构有机物的积分占总积分的比例(Pi, n)[15].
1.4 沉积物好氧反硝化细菌群落结构测定 1.4.1 样品总DNA提取与PCR扩增分别取各个采样点的沉积物寄送到上海派森诺生物公司进行DNA提取;采用引物F: TGGACVATGGGYTTYAAYC, R: ACYTCRCGHGCVGTRCCRCA[16]对沉积物的napA基因进行PCR扩增, 进而分析好氧反硝化菌微生物群落分布特征. PCR反应条件由测序公司进行优化调整. PCR反应条件如下: 95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸45 s,30个循环;72℃保温10 min,于4℃保存. 反应结束后配制2 % 琼脂糖凝胶电泳检测PCR产物. 扩增产物采用Illumina Miseq高通量测序技术进行分析,首先使用cutadapt切除序列的引物片段,设置-O为10,弃去未匹配引物的序列;使用Vsearch的fastq_mergepairs模块拼接序列;使用fastq_filter模块对拼接序列进行质控;使用derep_fulllength模块去除重复序列;使用cluster_size模块,在98 % 相似度水平对去重后的序列聚类,并使用uchime_denovo模块去除嵌合体;再使用perl脚本,过滤质控后序列集中的嵌合体,从而获得高质量序列;使用cluster_size模块,在97 % 相似度水平对高质量序列聚类,并分别输出代表序列和OTU表. 最后,去除OTU表格中的singletons OTUs (即,在所有样本中丰度为1的OTU,默认操作)及其代表序列.
1.4.2 生物信息处理α多样性分析中,采用Chao1指数表征丰富度[17],采用Shannon-Wiener和Simpson指数表征多样性,采用Good's coverage指数表征覆盖度[18]. β多样性分析中,采用R语言基于Bray-Curtis距离矩阵进行PCoA(Principal co-ordinates analysis)分析,来研究样本群落组成的相似性和差异性[19]. 采用随机森林分析来筛选不同功能区的好氧反硝化群落的指示物种[20],采用冗余分析(RDA)和Spearman相关指数方法来研究不同功能区好氧反硝化群落与碳源有机质的关系[21]. 利用R中的Vegan包对好氧反硝化菌丰度指标做降趋势对应分析(detrended correspondence analysis, DCA),分析结果显示梯度长度(gradients length)的第一轴小于3.0[22],因此选用RDA研究溶解性有机物对好氧反硝化菌群落的影响. 利用R对物种因子进行hellinger转化处理,对环境因子进行对数处理,通过VIF检验筛选高膨胀环境因子并舍去. 利用ANOVA分析来比较不同分组之间好氧反硝化菌群落丰富度和多样性差异在统计学意义上的显著性. 利用Adonis分析比较不同分组之间好氧反硝化菌群落组成差异在统计学意义上的显著性[23].
1.5 数据分析与处理本文中绘图和数据统计分析采用SPSS、R和Origin软件完成. P < 0.05表示存在显著差异,0.001 < P < 0.01表示存在极显著差异,在图表中分别以“*”“**”表示.
2 结果与讨论 2.1 沉积物有机质分析三维荧光区域的分区如图 2a所示,三维荧光区域的积分标准体积可间接表征不同荧光组分的相对浓度. 图为不同采样点各荧光区域所占的比例,白洋淀沉积物类酪氨酸物质占比范围为6.18 % ~17.42 %,其中旅游区最高,原始区最低. DOM中类色氨酸物质占比范围为15.11 % ~49.84 %,其中入淀区的采样点中类色氨酸物质所占比例分布范围最大,类色氨酸物质在白洋淀DOM中比例最大. DOM中的类富里酸物质占比范围为4.69 % ~21.80 %,原始区比例最大,养殖区最小. DOM中微生物代谢产物占比范围为17.00 % ~46.44 %,其分布规律与类富里酸物质正好相反,养殖区所占比例最大,原始区最小. DOM中类腐殖质物质占比范围为5.26 % ~29.13 %,其分布规律与类富里酸物质类似,原始区最大,养殖区最小. 白洋淀不同功能区采样点中DOM不同组分平均所占比例表现为:类色氨酸物质>微生物代谢产物>类腐殖酸物质>类富里酸物质>类酪氨酸物质,类色氨酸物质主要来源于生物活动,并且微生物代谢产物所占比例也较大,表明春季白洋淀沉积物中微生物的活动较为丰富[24].
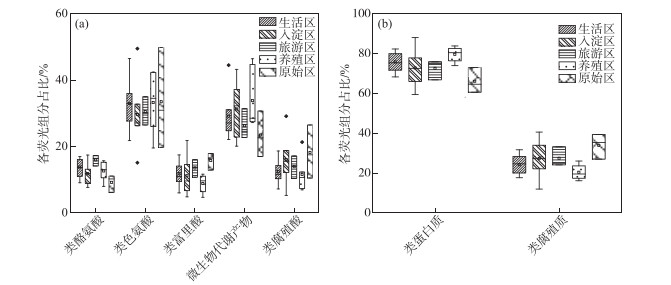
|
图 2 不同功能区各荧光组分(a)和类蛋白质和类腐殖质组分(b)所占比例 Fig.2 The proportion of fluorescence components (a) and protein-like components and humic-like components (b) in different functional areas |
在此基础上,将荧光组分类酪氨酸物质、类色氨酸物质和微生物代谢产物归为类蛋白质物质,类富里酸物质和类腐殖酸物质归为类腐殖质物质(图 2b). 类腐殖质一般是由地表径流携带的部分腐殖质以及浮游动植物释放的有机物经过细菌降解后产生,而类蛋白质主要由水生生物或微生物的新陈代谢作用产生[25]. 各个功能区的类蛋白质组分均显著高于类腐殖质组分,表明类蛋白质组分是白洋淀沉积物中溶解性有机质的主要成分,其中养殖区的类蛋白质组分所占比例最大为79.63 % ±3.79 %,这可能是因为养殖区过去饵料沉积所产生的,其次是生活区,所占比例为75.82 % ±4.91 %,可能是生活污水中含有大量类色氨酸类物质多环芳烃,增加了生活区类蛋白质物质的含量[26],原始区所占比例最小,为66.09 % ±6.32 %. 类腐殖质组分的含量与之相反,原始区中类腐殖质的比例最大,为33.91 % ±6.32 %,水生植物的腐烂分解会导致原始区类腐殖质含量的增多,其次是入淀区,所占比例为27.23 % ±9.83 %.
2.2 好氧反硝化细菌群落α多样性分析通过Chao1指数反映了不同功能区微生物群落的丰富度,其中,旅游区沉积物中好氧反硝化菌群落Chao1指数最大,为1216.44±109.43,生活区、入淀区和原始区次之,分别为1094.13±276.34、1066.70±384.33和1042.54±117.81(图 3),这与包头南海湖旅游开发区采样点Chao1指数高于进水口区相一致[27],养殖区最小,为732.37±98.81,并且呈显著差异(P < 0.05). 通过Shannon-Wiener指数可知,旅游区的Shannon-Wiener指数(5.96±0.38)高于原始区(5.70±0.34),这可能是春季白洋淀上覆水体变化剧烈,而白沟引河周边分布较多居民,水体中汇集的生活垃圾等污染物随水体流动进入旅游区,导致旅游区营养物质含量增加,促进了旅游区好氧反硝化菌的多样性的增加. 生活区和入淀区的Shannon-Wiener指数较小,分别为5.43±1.04和5.24±0.73,养殖区的Shannon-Wiener指数最小,为4.75±0.32,Simpson指数同Shannon-Wiener指数的结果相一致,表现为旅游区(0.95±0.004)>原始区(0.94±0.02)>生活区(0.91±0.07)>入淀区(0.91±0.05)>养殖区(0.89±0.04). 以上结果表征旅游区的好氧反硝化菌群多样性最高,养殖区的多样性最低. 由覆盖度指数可知,5个功能区的菌群覆盖度指数均大于99 %,满足测序深度的要求. 另外,利用ANOVA分析对5个功能区好氧反硝化菌群落α多样性进行分析,结果表明各个功能区之间菌群丰富度和多样性均不存在显著差异(P>0.05). 综上,白洋淀春季不同功能区沉积物好氧反硝化菌群丰富度存在显著差异,菌群多样性没有表现出显著差异.
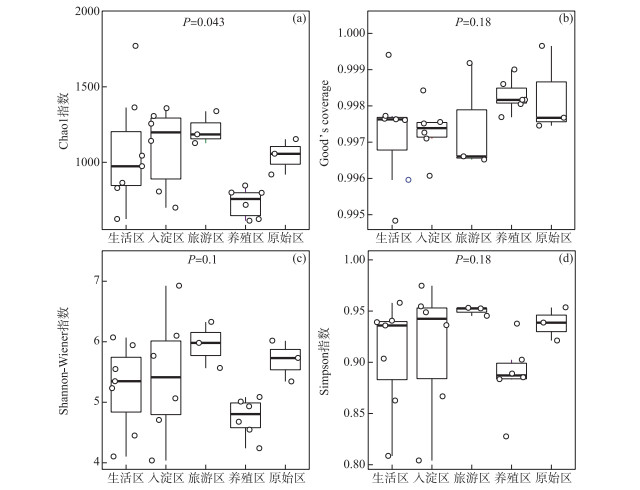
|
图 3 白洋淀沉积物好氧反硝化菌不同功能区的Chao1指数(a)、Good's coverage指数(b)、Shannon-Wiener指数(c)和Simpson指数(d) Fig.3 Chao1 index (a), Good's coverage index (b), Shannon-Wiener index (c) and Simpson index (d) in different functional areas of aerobic denitrifying bacteria in the sediments in Lake Baiyangdian |
通过物种注释,白洋淀春季沉积物napA型好氧反硝化菌群落共得到3653个OTUs,分为9个主要的门类,分别是变形菌门(Proteobacteria)、栖热菌门(Deinococcus-thermus)、硝化螺旋菌门(Nitrospirae)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、索脊动物门(Chordata)和疣微杆菌门(Verrucomicrobia),其余为未知细菌. 其中,变形菌门是所有样品中的优势门,所占比例均大于99 %,这与于妍等对白洋淀表层沉积物进行研究时所得出的结果相一致[28]. 变形菌门在诸多脱氮过程中占据着主导地位[29]. 在纲水平上,不同采样点丰度不同,图 4为丰度前4的主要纲,包括Betaproteobacteria、Gammaproteobacteria、Alphaproteobacteria、Epsilonproteobacteria. Betaproteobacteria是丰度最高的纲,其中养殖区丰度最大,占比为33.31 %,研究显示Betaproteobacteria大多具有脱氮特性,广泛存在于各种天然水体与沉积物中[30];Gammaproteobacteria是第二大纲,入淀区的丰度最大,占比为32.97 %,在前人的研究中发现Gammaproteobacteria在含盐废水反硝化过程中发挥关键作用[31];Alphaproteobacteria为第三大纲,旅游区的丰度最大,占比为7.81 %,Alphaproteobacteria在促进氨氧化和固氮过程中起着重要的作用[32].
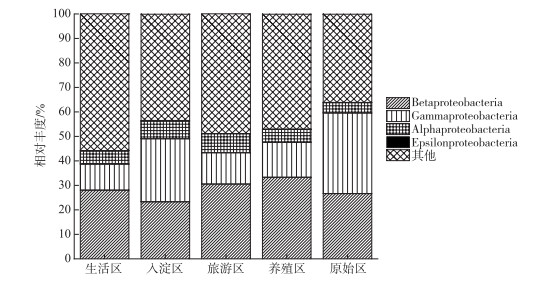
|
图 4 白洋淀春季沉积物不同分组napA型好氧反硝化细菌纲水平上的相对丰度 Fig.4 The relative abundance of napA-type aerobic denitrifying bacterial community in the sediments of different groups at class level in Lake Baiyangdian |
在属水平上,图 5为丰度前10的主要属,包括Aeromonas、Sulfuritortus、Cupriavidus、Pseudomonas、Thauera、Magnetospirllum、Azospirillum、Bradyrhizobium、Azospira和Agrobacterium. Aeromonas在白洋淀春季整体好氧反硝化菌群落中占比最大,为第一大属,占比范围为4.95 % ~28.87 %,其中原始区丰度最大,占比为28.87 %,入淀区次之,丰度占比为22.34 %. 研究表明,Aeromonas是水库中主要的好氧反硝化菌,在脱氮过程中能够利用各种碳水化合物作为碳源[29]. Sulfuritortus作为第二大属,养殖区丰度最大,占比为11.85 %,其次是旅游区,占比为8.56 %. Cupriavidus作为第三大属,占比范围为2.11 % ~5.15 %,在原始区丰度最大,养殖区次之,占比为4.66 %,其次是原始区和生活区,旅游区丰度最小,研究者发现Cupriavidus sp. S1可以利用不同形式的氮源同时进行硝化反硝化,并且对含重金属工业废水的脱氮效果较好[33]. Pseudomonas和Thauera在旅游区中占比最大,分别为3.61 % 和7.93 %,有研究表明Pseudomonas能够适应较宽的氨氮负荷,在高氨氮浓度条件下仍具有较高的异养硝化能力[34],并且从太湖[35]和山东周村饮用水水库[36]中均分离出具有异养硝化-好氧反硝化能力的假单胞菌属,Thauera可以利用甲苯作为唯一碳源和能量来进行反硝化[37].
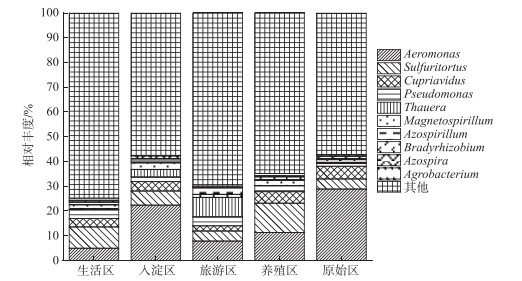
|
图 5 白洋淀春季沉积物不同分组napA型好氧反硝化细菌属水平上的相对丰度 Fig.5 The relative abundance of napA-type aerobic denitrifying bacterial community in the sediments of different groups at genus level in Lake Baiyangdian |
与此同时,本研究通过韦恩图和PCoA分析来研究春季不同功能区采样点沉积物好氧反硝化菌群的差异. 通过图 6a韦恩图可以直观地反映物种的差异及重叠情况,其中,入淀区独有1033个OTUs;生活区独有913个OTUs;养殖区独有262个OTUs;旅游区独有503个OTUs;原始区独有440个OTUs. 5个功能区都存在的OTUs有502个. 5个功能区所含OTUs数目关系为入淀区>生活区>旅游区>原始区>养殖区. 这与Chao1指数所得的结果基本相一致,验证了前人OTUs的个数与细菌群落的相对丰度之间的相关性,相对丰度高的细菌有更多的OTUs[38].

|
图 6 白洋淀沉积物napA型好氧反硝化菌韦恩图(a)、主成分分析(b)和随机森林分析(c) Fig.6 Venn plot(a), Principal coordinates analysis(b) and Random Forests analysis(c) of napA-type aerobic denitrifying bacteria in the sediments in Lake Baiyangdian |
图 6b为白洋淀春季不同功能区沉积物好氧反硝化群落组成情况. PCo1和PCo2分别解释了总体变化的29.3 % 和20.6 %,总共解释了整体变化的49.9 %. 原始区分布在第二象限,入淀区分布在第二、三象限,旅游区主要分布在第三、四象限,生活区和养殖区主要分布在第一、四象限且分布位置相似,其差异可能是由于不同功能区环境因素不同引起的,其中生活区和养殖区由于人类活动较为频繁,存在差异较小. 通过将5个功能区采样点的好氧反硝化菌群落进行Adonis分析,结果显示P < 0.01,表明了白洋淀春季5个功能区的好氧反硝化菌群落结构存在极显著差异.
2.5 好氧反硝化菌标志物种分析通过对春季沉积物好氧反硝化群落进行分析,得到丰度排名前20的标志物种,分别是Ferrimonas、Achromobacter、Rhodobacter、Oceanimonas、Brandyrhizobium、Aeromonas、Bordetella、Azoarcus、Pseudomonas、Thauera等,其中,Aeromonas、Sulfuritortus、Pseudomonas、Thauera、Magnetospirllum、Bradyrhizobium和Azospira是好氧反硝化微生物群落中丰度前10的物种,由此可以推断出指示物种和丰度较大的物种有重合(图 6c). 从图中可以看出,Ferrimonas在不同采样点好氧反硝化微生物群落中差异贡献最大,其在养殖区的采样点中占据较大的丰度,在原始区和入淀区的丰度均较小. Achromobacter、Azospira和Rhodobacter在入淀区的采样点的丰度较大,在旅游区次之,其余采样点均较小,有研究发现从垃圾渗滤液分离出的Achromobacter sp. L16可将氮素大部分转化为气体和菌体胞内氮[39]. Oceanimonas在原始区采样点的丰度与其他功能区相比较大,在前人的研究中发现,Oceanimonas的反硝化过程在处理高盐废水中发挥着关键作用[40]. Aeromonas在入淀区和原始区占据较大的丰度,其他功能区均较小,有研究发现Aeromonas sp. HN-2是一株耐盐高效异养硝化-好氧反硝化菌[41]. Thauera在旅游区的丰度最大,Sulfuritalea在生活区的丰度比其他功能区均较大. 综上Oceanimonas、Azoarcus、Comamonas和Pectobacterium可以作为原始区好氧反硝化菌群落的标志物种,Ferrimonas在养殖区的标志作用最明显,Achromobacter、Rhodobacter、Azospira、Magnetospirillum和Bosea在入淀区占据着最大的丰度,指示作用最强,Sulfutitalea和Bordetella可以作为生活区的指示物种,旅游区的指示物种为Thauera.
2.6 好氧反硝化菌群与碳源的关联分析 2.6.1 RDA分析好氧反硝化菌在脱氮的过程中以碳源作为电子供体来发挥反硝化作用,并且碳源是影响好氧反硝化过程最重要的限制因素之一[9]. 湖泊中的溶解性有机质作为天然碳源,其不同组分和含量对好氧反硝化菌的影响均是不同的. 本文通过RDA分析来研究春季白洋淀好氧反硝化菌群落与溶解性有机物的关系,使用膨胀因子(VIF)检验筛选出P2(VIF>15)属于高膨胀因子,将其去除后,基于VIF分析得到组分P1(VIF=2.15)、P3(VIF=13.71)、P4(VIF=12.46)和P5(VIF=2.31)是影响好氧反硝化菌群落分布的重要环境因子. 基于纲水平上的好氧反硝化菌群落与溶解性有机物的RDA分析结果显示RDA1和RDA2共同解释了总体变化的27.46 %,图 7a中显示养殖区的采样点主要与P1类酪氨酸组分呈正相关,并且与P5类腐殖酸组分呈负相关,表明养殖区的好氧反硝化菌群落可以较好地利用类酪氨酸物质而对类腐殖酸类物质难以利用. 从图 7b中可以看出Alphaproteobacteria与P4、P5组分均呈正相关,与P3组分呈负相关,表明Alphaproteobacteria与微生物代谢产物和类腐殖酸物质呈正相关,与类富里酸物质呈负相关,与类蛋白质物质相比,类腐殖质物质对被微生物利用更具有抗性,但是高分子量的溶解性有机物一般具有高疏水性能和众多官能团[42],这可能是Alphaproteobacteria能更好利用类腐殖质物质而对类富里酸物质具有抗性的原因. Betaproteobacteria与P1、P4组分均呈正相关,表明Betaproteobacteria与类蛋白质物质呈正相关. 有研究表明Alphaproteobacteria和Betaproteobacteria是响应溶解性有机物的优势门[43]. Gammaproteobacteria与P4呈负相关,表明在微生物代谢产物浓度高的区域Gammaproteobacteria的丰度较小. P4(R2=0.2754,P < 0.05)能解释最多的好氧反硝化菌群落纲水平上的差异性,因此,微生物代谢产物是影响春季白洋淀好氧反硝化菌群落纲水平差异的关键环境因子.
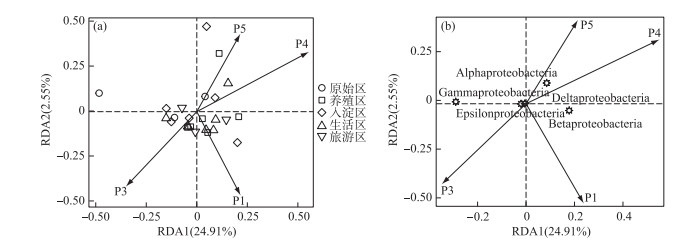
|
图 7 基于纲水平的不同功能区好氧反硝化菌(a)和整体好氧反硝化菌(b)与溶解性有机物的冗余分析 (P1代表类酪氨酸,P3代表类富里酸,P4代表微生物代谢产物,P5代表类腐殖酸) Fig.7 RDA analysis of aerobic denitrifying bacteria in different functional areas(a), the whole aerobic denitrifying bacteria(b) and dissolved organic matter at class level |
基于属水平上的好氧反硝化菌群落与溶解性有机物的RDA分析结果显示,RDA1和RDA2共同解释了总体变化的22.87 %,从图 8a中可以看出养殖区的采样点主要与P5呈负相关,这与纲水平上的好氧反硝化菌群落与溶解性有机物的冗余分析结果一致. 生活区的采样点主要与P4组分呈正相关,表明生活区的好氧反硝化菌群落可以较好地利用微生物代谢产物. 图 8b显示Pseudomonas与P4、P1均呈正相关,Thauera、Agrobacterium、Azospirillum与P5均呈正相关,Bradyrhizobium与P1呈负相关,Azospira与P5呈负相关. P5(R2=0.2408,P < 0.05)能解释最多的好氧反硝化菌群落属水平上的差异性,因此,类腐殖酸类物质是影响春季白洋淀好氧反硝化菌群落属水平差异的关键环境因子. 在未来对白洋淀不同功能区的高效好氧反硝化菌的定向筛选过程中,以养殖区沉积物进行驯化时可以适当添加类酪氨酸类物质作为碳源. 综上,类酪氨酸物质、类富里酸物质、微生物代谢产物和类腐殖酸物质是白洋淀春季不同功能区好氧反硝化菌群落纲水平和属水平上存在差异的主要原因,其中微生物代谢产物和类腐殖酸物质分别是影响纲水平和属水平上好氧反硝化菌差异的关键环境因子.
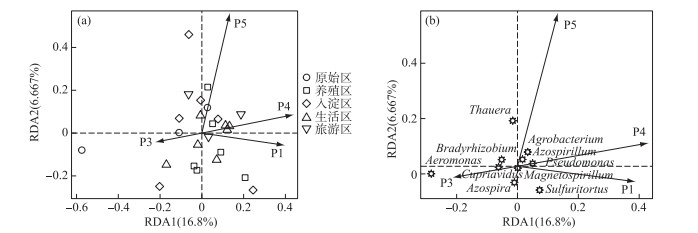
|
图 8 基于属水平的不同功能区好氧反硝化菌(a)和整体好氧反硝化菌(b)与溶解性有机物的冗余分析 (P1代表类酪氨酸,P3代表类富里酸,P4代表微生物代谢产物,P5代表类腐殖酸) Fig.8 RDA analysis of aerobic denitrifying bacteria in different functional areas(a), the whole aerobic denitrifying bacteria (b) and dissolved organic matter at genus level |
为了研究溶解性有机质对好氧反硝化菌群落的影响,本研究通过Spearman相关系数分析了溶解性有机质与好氧反硝化菌群落的相关性. 纲水平上养殖区、入淀区和生活区以及白洋淀整体区域沉积物好氧反硝化微生物群落组成与荧光组分的相关性如表 1所示,Alphaproteobacteria、Betaproteobacteria、Gammaproteobacteria、Deltaproteobacteria和Epsilonproteobacteria是纲水平的主要优势菌群并且均属于变形菌门,已有研究表明变形菌门与溶解性有机物有显著的关联性[44]. 养殖区中Epsilonproteobacteria与P5组分呈显著正相关(P < 0.05),相关性系数为0.8799,表明Epsilonproteobacteria与类腐殖酸物质呈显著正相关,并且养殖区中Epsilonproteobacteria与类蛋白质组分呈极显著负相关(P < 0.01),与类腐殖质组分呈极显著正相关(P < 0.01),相关性系数分别为-0.9830和0.9832. 入淀区中Alphaproteobacteria与P4呈显著正相关(P < 0.05),相关性系数为0.8703,Deltaproteobacteria和Epsilonproteobacteria均与P3呈显著正相关(P < 0.05),相关性系数分别为0.8370和0.8545. 生活区中Gammaproteobacteria与P2组分呈显著正相关,相关性系数为0.7971,表明Gammaproteobacteria主要消耗类色氨酸类物质,Deltaproteobacteria均与P4、P5均呈显著正相关(P < 0.05),相关性系数分别为0.7559和0.7851. 从白洋淀整体来说,Alphaproteobacteria与P5组分呈显著正相关(P < 0.05),相关性系数为0.4098,表明Alphaproteobacteria可以较容易地利用类腐殖酸类物质,这与冗余分析所得出的结论一致,并且前人研究中也表明了Alphaproteobacteria在水生环境中表现出对类腐殖质物质的偏好[45]. Gammaproteobacteria与P4呈显著负相关(P < 0.05),相关性系数为-0.4519,在对西藏冰川生态系统的研究中Alphaproteobacteria和Gammaproteobacteria与微生物代谢产物和腐殖质成分同样具有相关性[45]. Deltaproteobacteria和Epsilonproteobacteria均与P3呈显著正相关(P < 0.05),相关性系数分别为0.4463和0.4893,并且Deltaproteobacteria和Epsilonproteobacteria与类蛋白质组分呈显著负相关(P < 0.05),相关性系数分别为-0.4357和-0.4220,与类腐殖质组分呈显著正相关(P < 0.05),相关性系数分别为0.4360和0.4223,表明Deltaproteobacteria和Epsilonproteobacteria难以利用类蛋白质物质而对类腐殖质物质有较好的利用性. 在纲水平上的优势菌均属于Proteobacteria,Proteobacteria属于富营养菌群,对有机物具有很强的代谢能力,在碳充足时可快速生长[46].
| 表 1 养殖区、入淀区、生活区和白洋淀整体区域沉积物中纲水平上napA型好氧反硝化菌与溶解性有机物的Spearman相关系数* Tab. 1 Spearman correlation coefficient of dissolved organic matter and napA-type aerobic denitrifying bacteria at class level in the sediments of the breeding area, the entry area, the living area and the whole area of Lake Baiyangdian |
为明确好氧反硝化微生物群落对溶解性有机物的响应,在属水平上分析沉积物中好氧反硝化群落组成与荧光组分的相关性,图 9为白洋淀养殖区、入淀区、生活区和白洋淀整体区域好氧反硝化菌群落与溶解性有机质的相关性分析.在养殖区中,Bradyrhizobium与P5组分呈显著正相关(P < 0.05),相关性系数为0.8514,Agrobacterium与类蛋白质组分呈显著负相关(P < 0.05),与类腐殖质组分呈显著正相关(P < 0.05),相关性系数分别为-0.8776和0.8780. 在入淀区中,Thauera和Azoarcus均与P5组分呈显著正相关(P < 0.05),相关性系数分别为0.8183和0.8654. 生活区中Aeromonas与P2组分的相关性系数为0.7787,呈显著正相关(P < 0.05). 从白洋淀整体来说,Bradyrhizobium与P1组分呈极显著负相关(P < 0.01),相关性系数为-0.5223,Magnetospirillum与P3组分呈显著负相关(P < 0.05),相关性系数为-0.4148,Aeromonas与P4组分呈显著负相关(P < 0.05),相关性系数为-0.3995,Thauera与P5组分呈显著正相关(P < 0.05),相关性系数为0.4122. 有研究从Thauera检测出nirS基因,同时可以耐高碳氮负荷[47],在驯化耐高碳氮的好氧反硝化菌时可以适当控制类腐殖酸类物质,Aeromonas对盐度波动有较高的适应性,在高盐环境下也能有效去除氨氮和总氮[48],在驯化适应高盐环境下的好氧反硝化菌时可以适当添加类色氨酸类物质,同时避免微生物代谢产物对Aeromonas的抑制作用,这表明不同微生物群落对碳源的响应不同,在未来的好氧反硝化菌驯化过程中,筛选不同适应性菌株时可以相应添加碳源来提升菌群的丰度.
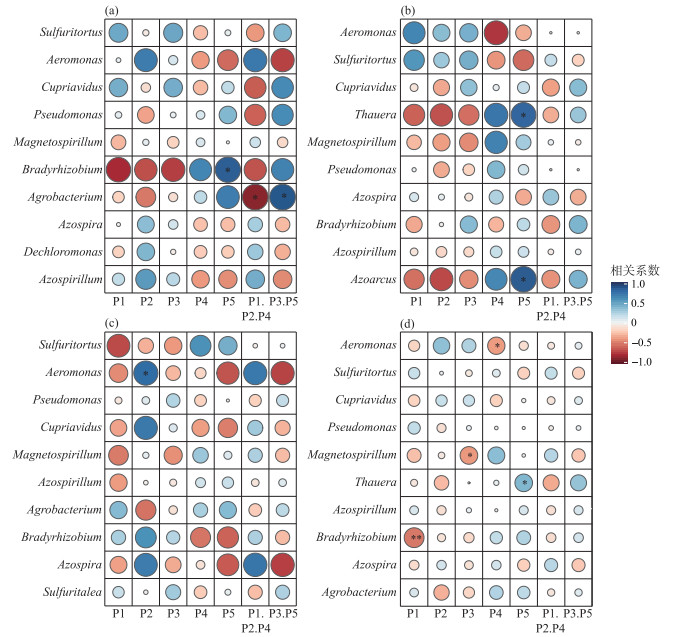
|
图 9 养殖区(a)、入淀区(b)、生活区(c)和白洋淀整体区域(d)沉积物中属水平上napA型好氧反硝化菌与溶解性有机物的Spearman相关性分析 (P1代表类酪氨酸,P2代表类色氨酸,P3代表类富里酸,P4代表微生物代谢产物,P5代表类腐殖酸,P1.P2.P4代表类蛋白质,P3.P5代表类腐殖质) Fig.9 Spearman correlation analysis of dissolved organic matter and napA-type aerobic denitrifying bacteria at genus level in the sediments of the breeding area(a), the entry area(b), the living area(c) and the whole area of Lake Baiyangdian (d) |
1) 通过荧光区域积分法分析,白洋淀春季沉积物有机质中类蛋白质组分含量要高于类腐殖质组分,其中养殖区的类蛋白质组分最高,原始区的类腐殖质组分最高.
2) 春季白洋淀沉积物中好氧反硝化菌共分为9个门类,其中变形菌为第一大门类. 旅游区的好氧反硝化菌群丰度最大,5个不同功能区的好氧反硝化菌群丰富度呈显著差异(P < 0.05),多样性不存在显著差异(P>0.05). 各个采样点的菌种组成存在差异. Ferrimonas作为指示物种,在不同采样点好氧反硝化微生物群落中差异贡献最大.
3) 好氧反硝化菌与溶解性有机物的RDA分析结果表明,类酪氨酸物质、类富里酸物质、微生物代谢产物和类腐殖酸物质是白洋淀春季不同功能区好氧反硝化菌群落纲水平和属水平上存在差异的主要原因,其中微生物代谢产物和类腐殖酸物质分别是影响纲水平和属水平上好氧反硝化菌差异的关键环境因子. 通过RDA和Spearman相关性分析可知,Alphaproteobacteria与类腐殖酸类物质呈显著正相关(P < 0.05),Gammaproteobacteria与微生物代谢产物呈显著负相关(P < 0.05),在不同功能区以及白洋淀整体中Aeromonas与微生物代谢产物呈负相关,Thauera与类腐殖酸物质呈正相关.
| [1] |
Cui QQ, Pan YT, Zhang HX et al. Elevated concentrations of perfluorohexanesulfonate and other per- and polyfluoroalkyl substances in Lake Baiyangdian (China): Source characterization and exposure assessment. Environmental Pollution, 2018, 241: 684-691. DOI:10.1016/j.envpol.2018.05.099 |
| [2] |
Zhou SL, Sun Y, Yue GC et al. Vertical distribution characteristics and driving factors of microbial community of spring culture area sediments in Lake Baiyangdian. Acta Scientiae Circumstantiae, 2020, 40(5): 1722-1733. [周石磊, 孙悦, 岳哿丞等. 白洋淀养殖区春季沉积物垂向微生物群落特征及驱动因素. 环境科学学报, 2020, 40(5): 1722-1733. DOI:10.13671/j.hjkxxb.2019.0460] |
| [3] |
Ji B, Yang K, Zhu L et al. Aerobic denitrification: A review of important advances of the last 30 years. Biotechnology and Bioprocess Engineering, 2015, 20(4): 643-651. DOI:10.1007/s12257-015-0009-0 |
| [4] |
Mu DY, Jin PF, Peng YZ et al. Identification and nitrogen removal characteristics of the heterotrophic nitrification and aerobic denitrification bacterial strain DK1. Environmental Science, 2017, 38(11): 4763-4773. [牟东阳, 靳鹏飞, 彭永臻等. 1株异养硝化-好氧反硝化细菌DK1的分离鉴定及其脱氮特性. 环境科学, 2017, 38(11): 4763-4773. DOI:10.13227/j.hjkx.201704131] |
| [5] |
Zhou SL, Huang TL, Bai SY et al. Isolation, Identification, and nitrogen removal characteristics of oligotrophic aerobic denitrifiers. China Environmental Science, 2016, 36(1): 238-248. [周石磊, 黄廷林, 白士远等. 贫营养好氧反硝化菌的分离鉴定及其脱氮特性, 2016, 36(1): 238-248.] |
| [6] |
Jia YT, Zhou MM, Chen YC et al. Carbon selection for nitrogen degradation pathway by Stenotrophomonas maltophilia: Based on the balances of nitrogen, carbon and electron. Bioresource Technology, 2019, 294: 122114. DOI:10.1016/j.biortech.2019.122114 |
| [7] |
Bai J, Chen L, Huang X et al. Isolation and nitrogen removal characteristics of salt-tolerant heterotrophic nitrification and aerobic denitrification bacteria Zobellella sp. B307. Environmental Science, 2018, 39(10): 4793-4801. [白洁, 陈琳, 黄潇等. 1株耐盐异养硝化-好氧反硝化菌Zobellella sp. B307的分离及脱氮特性. 环境科学, 2018, 39(10): 4793-4801. DOI:10.13227/j.hjkx.201802022] |
| [8] |
Wang HY, Ma F, Su JF et al. Influence of carbon source and C/N ratio on nitrogen removal of aerobic denitrifier. Acta Scientiae Circumstantiae, 2007, 27(6): 968-972. [王弘宇, 马放, 苏俊峰等. 不同碳源和碳氮比对一株好氧反硝化细菌脱氮性能的影响. 环境科学学报, 2007, 27(6): 968-972. DOI:10.13671/j.hjkxxb.2007.06.011] |
| [9] |
Wen G, Wang T, Li K et al. Aerobic denitrification performance of strain Acinetobacter johnsonii WGX-9 using different natural organic matter as carbon source: Effect of molecular weight. Water Research, 2019, 164: 114956. DOI:10.1016/j.watres.2019.114956 |
| [10] |
Zhou SL, Zhang TN, Chen ZY et al. Response of aerobic denitrification bacterial community structure to dissolved organic matter in Lake Baiyangdian during the water delivery period. Environmental Science, 2021. [周石磊, 张甜娜, 陈召莹等. 输水情景下白洋淀好氧反硝化菌群落对溶解性有机物的响应. 环境科学, 2021. DOI:10.13227/j.hjkx.202101290] |
| [11] |
Fan CX. Advances and prospect in sediment-water interface of lakes: A review. J Lake Sci, 2019, 31(5): 1191-1218. [范成新. 湖泊沉积物——水界面研究进展与展望. 湖泊科学, 2019, 31(5): 1191-1218. DOI:10.18307/2019.0514] |
| [12] |
Dong Y, Wang DJ, Yu B. Application of multi-stage AO process in the upgrading and reforming project in underground BeijingBishui wastewater treatment plant. China Water & Wastewater, 2018, 34(2): 59-62. [董洋, 汪德金, 余波. 多级AO工艺用于全地下式北京碧水污水处理厂升级改造. 中国给水排水, 2018, 34(2): 59-62. DOI:10.19853/j.zgjsps.1000-4602.2018.02.012] |
| [13] |
Sun Y, Li ZX, Zhang YR et al. Water pollution characteristics and water quality evaluation during the freezing period in Lake Baiyangdian of Xiongan New Area. J Lake Sci, 2020, 32(4): 952-963. [孙悦, 李再兴, 张艺冉等. 雄安新区——白洋淀冰封期水体污染特征及水质评价. 湖泊科学, 2020, 32(4): 952-963. DOI:10.18307/2020.0405] |
| [14] |
Du YH, Liu C, Chen KN et al. Occurrence and internal loadings of nitrogen and phosphorus in the sediment of Lake Baiyangdian. J Lake Sci, 2018, 30(6): 1537-1551. [杜奕衡, 刘成, 陈开宁等. 白洋淀沉积物氮磷赋存特征及其内源负荷. 湖泊科学, 2018, 30(6): 1537-1551. DOI:10.18307/2018.0606] |
| [15] |
Yu GH, Wu MJ, Luo YH et al. Fluorescence excitation-emission spectroscopy with regional integration analysis for assessment of compost maturity. Waste Management, 2011, 31(8): 1729-1736. DOI:10.1016/j.wasman.2010.10.031 |
| [16] |
Abed RMM, Lam P, de Beer D et al. High rates of denitrification and nitrous oxide emission in arid biological soil crusts from the Sultanate of Oman. The ISME Journal, 2013, 7(9): 1862-1875. DOI:10.1038/ismej.2013.55 |
| [17] |
Rogers MB, Firek B, Shi M et al. Disruption of the microbiota across multiple body sites in critically ill children. Microbiome, 2016, 4(1): 66. DOI:10.1186/s40168-016-0211-0 |
| [18] |
Chen BS, Teh BS, Sun C et al. Biodiversity and activity of the gut microbiota across the life history of the insect herbivore Spodoptera littoralis. Scientific Reports, 2016, 6(1): 1-13. DOI:10.1038/srep29505 |
| [19] |
Calderón K, Spor A, Breuil MC et al. Effectiveness of ecological rescue for altered soil microbial communities and functions. The ISME Journal, 2017, 11(1): 272-283. DOI:10.1038/ismej.2016.86 |
| [20] |
Hu he, Chen X, Hou F et al. Bacterial and fungal community structures in loess plateau grasslands with different grazing intensities. Frontiers in Microbiology, 2017, 8: 606. DOI:10.3389/fmicb.2017.00606 |
| [21] |
Kernan MR, Helliwell RC. Partitioning the variation within the acid neutralizing capacity of surface waters in Scotland in relation to land cover, soil and atmospheric depositional factors. Science of the Total Environment, 2001, 265(1/2/3): 39-49. DOI:10.1016/s0048-9697(00)00648-3 |
| [22] |
Zhou JJ, Xiang J, Wang LY et al. Relationship between landscape pattern and hydrochemical characteristics of Binggou River Basin in eastern Qilian Mountains. Chinese Journal of Ecology, 2019, 38(12): 3779-3788. [周俊菊, 向鹃, 王兰英等. 祁连山东部冰沟河流域景观格局与河流水化学特征关系. 生态学杂志, 2019, 38(12): 3779-3788. DOI:10.13292/j.1000-4890.201912.032] |
| [23] |
Anderson MJ, Ellingsen KE, McArdle BH. Multivariate dispersion as a measure of beta diversity. Ecology Letters, 2006, 9(6): 683-693. DOI:10.1111/j.1461-0248.2006.00926.x |
| [24] |
Wang T, Wen G, Huang TL et al. Characteristics of organic matter in sediments during the thermal stratification of a reservoir and effects on an aerobic denitrifier. Environmental Science, 2020, 41(11): 5027-5036. [王彤, 文刚, 黄廷林等. 水库热分层期沉积物中有机物特性及对好氧反硝化细菌脱氮的影响. 环境科学, 2020, 41(11): 5027-5036. DOI:10.13227/j.hjkx.202004250] |
| [25] |
Rochelle-Newall EJ, Fisher TR. Production of chromophoric dissolved organic matter fluorescence in marine and estuarine environments: An investigation into the role of phytoplankton. Marine Chemistry, 2002, 77(1): 7-21. DOI:10.1016/S0304-4203(01)00072-X |
| [26] |
Dong YR, Li Y, Kong FL et al. Source, structural characteristics and ecological indication of dissolved organic matter extracted from sediments in the primary tributaries of the Dagu River. Ecological Indicators, 2020, 109: 105776. DOI:10.1016/j.ecolind.2019.105776 |
| [27] |
Yang WH, Shi DJ, Zhang Y et al. Community characteristics of denitrifying microorganisms in plateau lake sediments-taking Nanhaihu Lake as example. China Environmental Science, 2020, 40(1): 431-438. [杨文焕, 石大钧, 张元等. 高原湖泊沉积物中反硝化微生物的群落特征——以包头南海湖为例. 中国环境科学, 2020, 40(1): 431-438. DOI:10.3969/j.issn.1000-6923.2020.01.048] |
| [28] |
Yu Y, Wang YY, Fang DX et al. Bacterial diversity in surface sediments of Lake Baiyangdian and its influencing factors. Chinese Journal of Environmental Engineering, 2021, 15(3): 1121-1130. [于妍, 王悦悦, 方杜贤等. 白洋淀表层沉积物细菌多样性及影响因素. 环境工程学报, 2021, 15(3): 1121-1130. DOI:10.12030/j.cjee.202004089] |
| [29] |
Zhang PF, Peng YK, Lu JL et al. Microbial communities and functional genes of nitrogen cycling in an electrolysis augmented constructed wetland treating wastewater treatment plant effluent. Chemosphere, 2018, 211: 25-33. DOI:10.1016/j.chemosphere.2018.07.067 |
| [30] |
Chen Q, Chen F, Gonsior M et al. Correspondence between DOM molecules and microbial community in a subtropical coastal estuary on a spatiotemporal scale. Environment International, 2021, 154: 106558. DOI:10.1016/j.envint.2021.106558 |
| [31] |
Miao Y, Liao R, Zhang XX et al. Metagenomic insights into salinity effect on diversity and abundance of denitrifying bacteria and genes in an expanded granular sludge bed reactor treating high-nitrate wastewater. Chemical Engineering Journal, 2015, 277: 116-123. DOI:10.1016/j.cej.2015.04.125 |
| [32] |
Zhu LJ, Zhou HX, Xie XY et al. Effects of floodgates operation on nitrogen transformation in a lake based on structural equation modeling analysis. Science of the Total Environment, 2018, 631/632: 1311-1320. DOI:10.1016/j.scitotenv.2018.03.134 |
| [33] |
Yang L, Wang XH, Cui S et al. Simultaneous removal of nitrogen and phosphorous by heterotrophic nitrification-aerobic denitrification of a metal resistant bacterium Pseudomonas putida strain NP5. Bioresource Technology, 2019, 285: 142-150. DOI:10.1016/j.biortech.2019.121360 |
| [34] |
Wang XH, Yang L, Ren YX et al. Nitrogen removal by heterotrophic nitrifying bacterium Pseudomonas putida YH and its kinetic characteristics. Environmental Science, 2019, 40(4): 1892-1899. [汪旭晖, 杨垒, 任勇翔等. 异养硝化细菌Pseudomonas putida YH的脱氮特性及降解动力学. 环境科学, 2019, 40(4): 1892-1899. DOI:10.13227/j.hjkx.201809044] |
| [35] |
Guo LY, Chen QK, Fang F et al. Application potential of a newly isolated indigenous aerobic denitrifier for nitrate and ammonium removal of eutrophic lake water. Bioresource Technology, 2013, 142: 45-51. DOI:10.1016/j.biortech.2013.05.021 |
| [36] |
Huang TL, Guo L, Zhang HH et al. Nitrogen-removal efficiency of a novel aerobic denitrifying bacterium, Pseudomonas stutzeri strain ZF31, isolated from a drinking-water reservoir. Bioresource Technology, 2015, 196: 209-216. DOI:10.1016/j.biortech.2015.07.059 |
| [37] |
Shinoda Y, Sakai Y, Uenishi H et al. Aerobic and anaerobic toluene degradation by a newly isolated denitrifying bacterium, Thauera sp. strain DNT-1. Applied and Environmental Microbiology, 2004, 70(3): 1385-1392. DOI:10.1128/aem.70.3.1385-1392.2004 |
| [38] |
Kou WB, Huang ZY, Zhang J et al. Bacterial community structure and composition in Lake Poyang: A case study in the Songmenshan Region, China. Acta Ecologica Sinica, 2015, 35(23): 7608-7614. [寇文伯, 黄正云, 张杰等. 鄱阳湖湖泊细菌群落组成及结构——以松门山为例. 生态学报, 2015, 35(23): 7608-7614. DOI:10.5846/stxb201405030873] |
| [39] |
Li SQ, Yang JD, Liu L et al. Denitrification characteristics of aerobic denitrifying bacteria Achromobacter sp. L16. Biotechnology Bulletin, 2020, 36(6): 93-101. [李思琦, 杨静丹, 刘琳等. 好氧反硝化菌Achromobacter sp. L16的脱氮特性. 生物技术通报, 2020, 36(6): 93-101.] |
| [40] |
Mohd Yasin NH, Sanchez-Torres V, Maeda T. Enhanced reduction of waste activated sludge at a low temperature by locally isolated strains Pseudomonas sp. VNT and Aeromonas sp. VNT. Bioresource Technology, 2014, 174: 134-141. DOI:10.1016/j.biortech.2014.10.005 |
| [41] |
Ju Q, Zhang Q, Cao CC et al. Response of microbial community to natural organic matter input in lake sediments. Environmental Science, 2021, 42(7): 3263-3271. [居琪, 章奇, 曹驰程等. 湖泊沉积物中微生物群落对天然有机质输入的响应. 环境科学, 2021, 42(7): 3263-3271. DOI:10.13227/j.hjkx.202011205] |
| [42] |
Xu HC, Ji L, Kong M et al. Molecular weight-dependent adsorption fractionation of natural organic matter on ferrihydrite colloids in aquatic environment. Chemical Engineering Journal, 2019, 363: 356-364. DOI:10.1016/j.cej.2019.01.154 |
| [43] |
Traving SJ, Rowe O, Jakobsen NM et al. The effect of increased loads of dissolved organic matter on estuarine microbial community composition and function. Front Microbiology, 2017, 8: 351. DOI:10.3389/fmicb.2017.00351 |
| [44] |
Amaral V, Graeber D, Calliari D et al. Strong linkages between DOM optical properties and main clades of aquatic bacteria. Limnology and Oceanography, 2016, 61(3): 906-918. DOI:10.1002/lno.10258 |
| [45] |
Zhou L, Zhou YQ, Hu Y et al. Microbial production and consumption of dissolved organic matter in glacial ecosystems on the Tibetan Plateau. Water Research, 2019, 160: 18-28. DOI:10.1016/j.watres.2019.05.048 |
| [46] |
Yang H, Huang J, Zhao YG et al. Identif ication and characterization of Thauera sp. strain TN9. Chinese Journal of Applied and Environmental Biology, 2013, 19(2): 318-323. [杨华, 黄钧, 赵永贵等. 陶厄氏菌Thauera sp. strain TN9的鉴定及特性. 应用与环境生物学报, 2013, 19(2): 318-323.] |
| [47] |
Fu GP, Han JY, Yu T et al. The structure of denitrifying microbial communities in constructed mangrove wetlands in response to fluctuating salinities. Journal of Environmental Management, 2019, 238: 1-9. DOI:10.1016/j.jenvman.2019.02.029 |
| [48] |
Herlemann DPR, Manecki M, Dittmar T et al. Differential responses of marine, mesohaline, and oligohaline bacterial communities to the addition of terrigenous carbon. Environmental Microbiology, 2017, 19(8): 3098-3117. DOI:10.1111/1462-2920.13784 |
 2022, Vol. 34
2022, Vol. 34 


