(2: 中国科学院南京地理与湖泊研究所, 南京 210008)
(2: Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
湖泊是地球表层系统中各个圈层相互作用的联结点,是陆地水圈的重要组成部分[1]. 作为与人类联系最为密切的淡水生态系统之一,在气候变化和人类活动的双重影响下,世界范围内已有75 % 以上的湖泊发生了富营养化或正处于富营养化过程中[2]. 随着氮、磷等营养物质持续不断进入湖泊,营养水平上升到一定程度或者阈值时,生态系统就可能发生剧变,藻类大量增殖,高等水生植物逐渐或迅速消失[3-4],进而影响湖泊食物网的结构和功能. 浮游动物既是主要的初级消费者,是衔接浮游食物网与更高营养级之间的纽带,从而成为影响湖泊生态系统结构和功能的一个关键类群[5]. 浮游动物(尤其是浮游甲壳动物)不仅牧食浮游植物,也可以摄食水体中的有机颗粒物和细菌,其碳源包括内源有机碳(浮游植物、水生植物等初级生产者),也包括陆源输入的有机碳[6]. 湖泊营养状态不同,浮游动物的碳源组成也会产生相应的差异[7]. 以往研究表明,在寡营养和含腐殖质丰富的小型水体中,由于初级生产力过低,外源有机碳有助于维持生态系统中食物网的物质循环和能量流动[7-8];但在富营养化水体中,水生生物对外源性碳的依赖性降低,可能会更多地利用内源有机碳[7-8]. 然而,随着富营养化程度加剧,水体中的浮游植物多为营养价值较低的种类占优,浮游动物的碳源会如何变化尚不明确.
食性分析法常被用来研究浮游动物的食物来源组成[8]. 此方法主要采用肠道解剖法和观察方法,但结果难以反映动物长期的摄食习性,存在一定的偶然性,并且对一些小型动物的食性分析难度较大[9]. 脂肪酸作为细菌、藻类、水生动物体内含量最高的脂类物质,主要以三羧酸甘油酯和磷脂的形式存在,生物体内的脂肪酸主要来自于食物,在生物新陈代谢过程中比较稳定,故常被作为生物标志物来反映生物间的摄食关系[10]. 相比食性分析法,生物体脂肪酸的组成和累积能够反映其长期摄食活动经历,减少了判断的偶然性,因而采用脂肪酸作为生物标志物来追溯消费者的食物来源被广泛认可[11].
研究表明, 亚油酸(C18:2n6)、亚麻酸(C18:3n3)、花生四烯酸(C20:4n6)、二十碳五烯酸(C20:5n3)、二十二碳六烯酸(C22:6n3)等多不饱和脂肪酸,属于必需脂肪酸(EFA),主要源自藻类颗粒有机物(POM)[12];奇链饱和脂肪酸和支链脂肪酸(如C15:0、C17:0及其支链)主要来源于细菌脂肪酸(BAFA)[13-14],故∑C15+∑C17脂肪酸常被用作细菌标志物[15];C24:0等偶数高碳直链脂肪酸则主要源自陆生高等植物[16]. 二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)等多不饱和脂肪酸对水生生物的生长发育和免疫系统起着支配作用,因此浮游植物中EPA的相对含量可作为预测浮游动物对其碳转化效果的有效指标[17]. 湖泊中消费者脂肪酸的组成主要与食物来源相关,而食物组成又受到湖泊营养水平的影响[18]. 富营养化湖泊中,浮游植物是湖泊的主要初级生产者,其对应的脂肪酸标志物在浮游动物体内可能会相应较高;而在水生植物占优势或陆源输入较多的湖泊,浮游动物体内则可能含有一定的长链脂肪酸[8, 19]. 目前利用脂肪酸标志物技术研究湖库营养水平和浮游动物碳源之间关系的报道较少. 因此,了解不同营养水平梯度下湖库浮游动物的碳源特征及其与水环境因子的关系,有助于加强对湖库水生态系统结构和功能的认识.
为了解湖泊营养状态与浮游动物碳源的关系以及影响浮游动物碳源的主要影响因子,采集了南京及周边不同营养水平湖库中的水样、POM与浮游动物样品,通过对比分析POM、浮游动物的脂肪酸特征及水环境因子,比较了浮游动物的碳源组成,为研究不同营养水平对湖泊浮游动物碳源的影响提供借鉴.
1 材料与方法 1.1 样品采集与处理于2020年8月分别采集了南京市六合区、浦口区、玄武区、溧水区、高淳区和溧阳市共21个浅水湖库的水样与浮游动物样品(图 1). 现场用塞氏盘测定水体透明度(SD),用YSI测定水体pH、电导率(Cond)、氧化还原电位(ORP)及溶解氧(DO). 用采水器采集水面表层、水下1 m处、底层以上0.5 m处混合水样2 L,低温保存. 水样带回实验室测定高锰酸盐指数(CODMn);采用SKALAR San ++流动分析仪测定总氮(TN)、总磷(TP)浓度;水样经醋酸纤维滤膜(0.45 μm)过滤后用SKALAR San ++流动分析仪测定氨氮(NH3-N)、硝酸盐氮(NO3--N)、亚硝酸盐氮(NO2--N)、正磷酸盐磷(PO43--P);将过滤水样的醋酸纤维滤膜(0.45 μm)于-20℃保存用于测定叶绿素a(Chl.a)浓度. Chl.a浓度分析方法参照《水质叶绿素a的测定分光光度法》(HJ 897--2017)法;水样经GFF玻璃纤维滤膜(0.7 μm)过滤后测定溶解性有机碳(DOC),而GFF膜用于提取过滤截留的颗粒有机物(POM)的脂肪酸[20].

|
图 1 南京及周边湖库采样点及营养状态分布 Fig.1 Distribution of sampling sites and eutrophication status in sampling lakes and reservoirs in Nanjing and surrounding areas |
浮游动物采集:采用64 μm浮游动物网在水中拖曳若干次,将浓缩液置于500 mL聚乙烯瓶中,带回实验室置于清水中4 h清空肠道,用解剖镜挑选优势种并于-20℃保存. 南京及其周边地区21个湖库浮游动物数量分布虽不均匀,但优势种均以中-富营养指示种为主,例如中山水库以象鼻溞(Bosmina spp.)、汤匙华哲水蚤(Sinocalanus dorrii)、螺形龟甲轮虫(Keratella cochlearis)等为优势种[21],玄武湖以模糊秀体溞(Diaphanosoma dubium)、微型裸腹溞(Moina micrura)、尖额溞(Alona sp.)及壳纹船卵溞(Scapholeberis kingi)等枝角类优势种为主[22]. 本研究挑选枝角类浮游动物优势种测其脂肪酸.
过滤浮游动物后将滤有POM样品的GFF膜冷冻干燥,称取10 mg冻干物提取脂肪酸,提取方法如下[23]:在冻干物中加入甲醇、二氯甲烷和甲酸(20:10:1,V:V:V)混合液,在液氮中研磨3遍,用旋涡振荡器剧烈摇动10 min后,添入3 mL水溶液(19.6 mg/mL磷酸,74.55 mg/mL氯化钾). 振摇2 min后在1000×g转速下离心10 min,然后在氮气下蒸发以除去溶剂. 将脂质溶解在10 μL的二氯甲烷∶甲醇(1:1,V:V)混合液中,然后与200 μL的二氯甲烷∶甲醇(2:1,V:V)、300 μL的HCl:甲醇(5 % HCl)和25 μL的C19:0(200 μg/mL)混合. 将混合物置于水浴锅中85℃加热1 h. 冷却至室温后,加入1 mL己烷,然后短暂离心,将200 μL正己烷顶层转移至GC小瓶中,与5 μL十九烷标准液(最终浓度为200 μg/mL)混合上机测定. 上机条件: 毛细管柱是HP-88(60 m×0.25 mm×0.2 μm,安捷伦);进样器、检测器的温度:250℃;温度程序: 初始温度为50℃,保持2 min,后以25℃/min的速度升至175℃,并以7℃/min的速度保持5 min,直至达到210℃,持续2 min,最终以2℃/min升至275℃.
1.2 计算方法 1.2.1 脂肪酸含量计算脂肪酸测定值转换为单位干重的脂肪酸含量(mg/g),并根据单位干重的脂肪酸含量计算不同脂肪酸组分占总脂肪酸的百分比.
1.2.2 营养水平评价方法本研究采用综合营养状态指数法评价水体营养状况[24-25]. 选择营养状态参数Chl.a、SD、TP、TN、CODMn. 综合营养状态指数公式如下:
| TLI(∑)=m∑j=1Wj⋅TLIj | (1) |
| Wj=r2ijm∑j=1r2ij | (2) |
式中, TLI(∑)为综合营养状态指数;TLIj为第j种参数的营养状态指数;Wj为第j种参数的营养状态指数的相关权重,rij为第j种参数与基准参数Chl.a的相关系数;m为评价参数的个数. 根据中国湖泊中Chl.a与其他参数之间的关系[24],综合营养状态指数法对湖泊的营养状态分为贫营养、中营养、轻富营养、中度富营养、重度富营养.
1.3 统计方法所有数据处理采用Excel 2013,图表绘制使用ArcGIS 10.2与Origin 2018. 浮游动物脂肪酸与环境因子的相关性采用Canoco5进行RDA分析. 统计分析通过SPSS 22.0软件实现.
2 结果 2.1 水体营养等级根据综合营养状态指数法选取Chl.a、SD、TP、TN、CODMn 5个参数对采样点水体营养等级进行计算. 从(图 1)可以看出,综合营养状态指数TLI(∑)为中营养的湖库包括中山水库、姚家水库、方便书库、方庄水库、黄山水库、紫霞湖、老鸭坝水库(编号分别为1~7),其余湖库则均为富营养状态. 其中,轻富营养湖库为山曹水库、大泉水库、龙墩河水库(编号分别为8~10),中富营养湖库为平山水库、泥桥水库、大河桥水库、三岔水库、固城湖、河王坝水库(编号分别为11~16),重富营养湖库有海平庄水库、山湖水库、傅湾水库、赵桥水库、玄武湖(编号分别为17~21).
2.2 POM脂肪酸组成不同营养水平湖库POM中脂肪酸组成来源不同(图 2). 本研究所采集的21个湖库中,POM脂肪酸组成主要以源自藻类的必需脂肪酸(EFA)占优;且随着湖库富营养化程度的增加,EFA浓度随之增加,其中泥桥水库浓度最高(117.96 mg/L),中营养湖库EFA平均浓度为25.83 mg/L,富营养湖库则为42.16 mg/L. 来源于细菌的脂肪酸∑C15:0+∑C17:0浓度范围在2.6~5.12 mg/L,浓度略高的有中营养的方便水库(9.3 mg/L)、中富营养的泥桥水库(13.89 mg/L)以及重富营养的山湖水库(7.98 mg/L). 陆源高等植物的脂肪酸标志物∑C24在不同湖库中浓度差别较小,呈均匀分布. 不同湖库中多不饱和脂肪酸(PUFA)与单不饱和脂肪酸(MUFA)浓度有明显差异,轻富营养状态的山曹水库、大泉水库、龙墩河水库中MUFA浓度均大于PUFA,中富营养湖库中则相反. 从中营养湖库到富营养湖库POM脂肪酸整体变化趋势来看,PUFA平均百分含量增大,MUFA则逐渐减少. 中营养湖库MUFA平均百分含量为31.3 %,轻富营养湖库则为17.9 %,中富营养湖库为7.7 %,重富营养湖库为9.6 %. PUFA在中营养湖库的平均百分含量为13.7 %,富营养湖库均比中营养湖库浓度高,由轻富营养湖库至重富营养湖库分别为23.2 %、19.5 %、17.4 %.
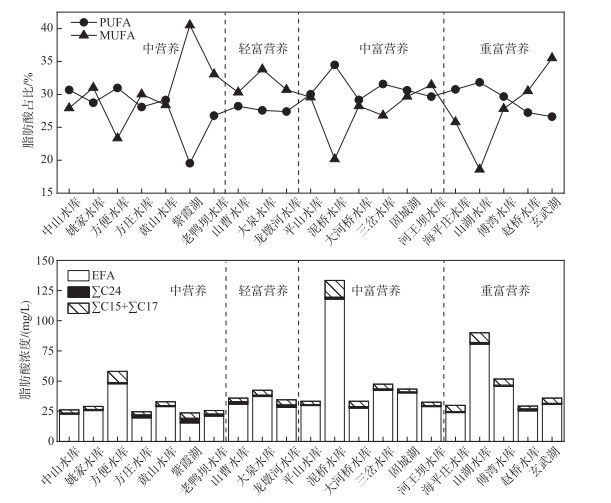
|
图 2 南京及周边21个湖库POM脂肪酸组成及占比 Fig.2 Composition and proportion of POM fatty acids in 21 lakes and reservoirs in Nanjing and surrounding areas |
脂肪酸包括饱和脂肪酸(SFA)与不饱和脂肪酸(MUFA与PUFA). 12种饱和脂肪酸(C12:0、C13:0、C14:0、C15:0、C16:0、C17:0、C18:0、C20:0、C21:0、C22:0、C23:0和C24:0)、9种单不饱和脂肪酸(C14:1、C15:1、C16:1、C17:1、C18:1n9t、C18:1n9c、C20:1、C22:1和C24:1)和10种多不饱和脂肪酸(C18:2n6t、C18:2n6c、C18:3n6、C18:3n3、C20:3n6、C20:3n3、C20:4、C22:2、C20:5和C22:6).
分别比较中营养、轻富营养、中富营养、重富营养湖库浮游动物的主要脂肪酸,包括EPA、DHA、∑C15:0+ ∑C17:0、EFA、∑C24含量和总PUFA、总MUFA的百分含量. 图 3表明,21个湖库的PUFA占各自总脂肪酸(TFA)含量的19 % ~40 %,其中山湖水库的PUFA占比最高;而MUFA在中营养水平的方便书库、方庄水库、黄山水库、紫霞湖、老鸭坝水库中百分含量达到了60 % 以上. 紫霞湖的MUFA最高,达到7.38 mg/g,中山水库的MUFA最低为0.06 mg/g,中营养湖库的MUFA含量高于富营养湖库.
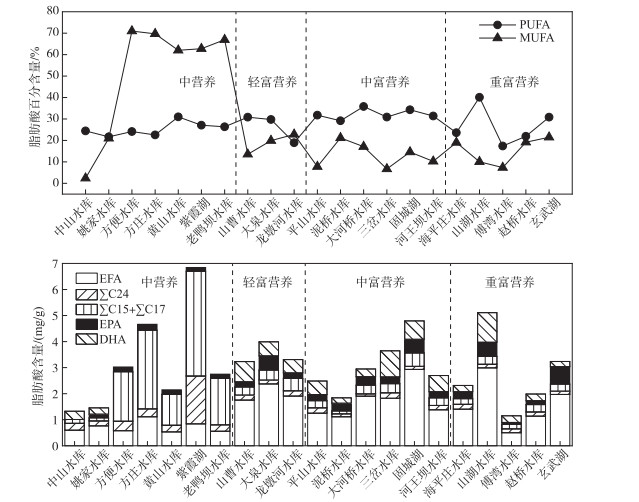
|
图 3 南京及周边21个湖库浮游动物脂肪酸含量 Fig.3 The fatty acid contents of zooplankton in 21 lakes and reservoirs in Nanjing and surrounding areas |
浮游动物的必需脂肪酸,包括亚油酸、亚麻酸、花生四烯酸、EPA、DHA在内,在中营养水平湖库中含量低于富营养湖库,含量最高的为山湖水库(2.99 mg/g). 就对于生物生长有重要影响的EPA和DHA而言,中营养状态的湖库中EPA含量较富营养湖库少,玄武湖浮游动物中的EPA为0.67 mg/g,在21个湖库中最高,而中山水库不含EPA;DHA除了方便书库、方庄水库、黄山水库、紫霞湖、老鸭坝水库之外,其余湖库中均有分布. 总体而言,随着水体富营养化程度增加,湖库浮游动物体内EFA含量逐渐增多,∑C24含量逐渐减少. 脂肪酸∑C24在紫霞湖中含量达到1.84 mg/g,是大河桥水库的20倍. 在轻富营养状态下的山曹水库、大泉水库、龙墩河水库中∑C24平均含量为0.18 mg/g. 中营养湖库中除了中山水库和姚家水库,其余湖库浮游动物体内细菌脂肪酸∑C15:0+∑C17:0的含量远高于富营养状态的湖库,以固城湖浮游动物体内∑C15:0+∑C17:0含量最高,达到0.43 mg/g,而方便水库、方庄水库、黄山水库、老鸭坝水库中浮游动物体内均未检测到细菌脂肪酸.
2.4 浮游动物碳源脂肪酸比值已知16:0脂肪酸广泛分布于浮游植物群落[12, 26-28],为避免因含量较少的脂肪酸的影响而导致主要脂肪酸百分比的相对降低(实际含量未变),本研究采用浮游动物各脂肪酸与其体内棕榈酸(C16:0)的比值(相对指数)作为浮游动物碳源转化指征(图 4). 具体如下,以EFA/C16:0指示浮游植物碳源;∑C24/C16:0指示陆源碳;(∑C15+∑C17)/C16:0指示细菌碳源. 结果表明,中营养湖库浮游动物EFA/C16:0、∑C24/C16:0、(∑C15+∑C17)/C16:0的比值均显著高于富营养水平的湖库(P < 0.001). 中营养湖库浮游动物EFA/C16:0、∑C24/C16:0、(∑C15+∑C17)/C16:0的平均比值分别为2.81、2.00、8.06,轻富营养湖库浮游动物的平均比值分别为0.86、0.08、0.16,中富营养湖库浮游动物的平均比值分别为1.07、0.1、0.19,重富营养湖库浮游动物的平均比值分别为1.03、0.11、0.17. 富营养湖库中指示浮游植物碳源的EFA/C16:0比值均显著高于外源碳(∑C24/C16:0)与细菌碳((∑C15+∑C17)/C16:0)(P < 0.001).
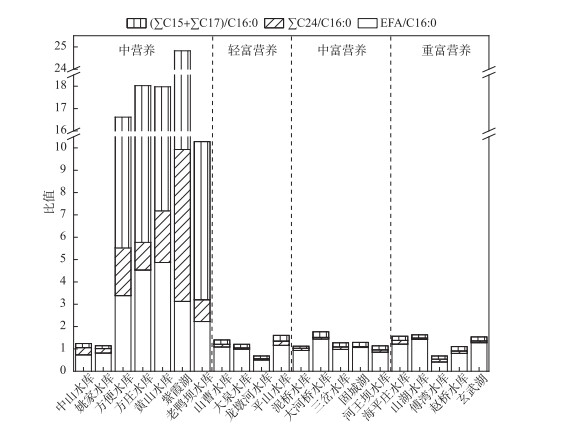
|
图 4 湖库浮游动物碳源脂肪酸指征图 Fig.4 Indication map of carbon source fatty acid of zooplankton in lakes and reservoirs |
对南京及其周边地区21个湖库浮游动物碳源脂肪酸和环境因子进行冗余分析(RDA). 环境因子包括TN、TP、SD、pH、Cond、ORP、DO、NH3-N、NO3--N、NO2--N、PO43--P、Chl.a及溶解性有机碳(DOC)共13个. RDA分析结果(图 5)轴1与轴2特征值分别为0.585和0.018,共解释了60.31 % 的浮游动物碳源脂肪酸信息. 轴1与轴2浮游动物碳源脂肪酸与环境因子的相关系数分别为0.78和0.73,表明两轴能较好地反映浮游动物碳源脂肪酸与环境因子之间的关系. 从图 5可以看出,浮游植物碳源EFA/C16:0与Chl.a、TP、PO43--P高度负相关,与SD呈正相关;细菌碳源(∑C15+∑C17)/C16:0与SD呈高度正相关,与Chl.a、TP、PO43--P呈高度负相关;陆源碳∑C24/C16:0与TN、NO3--N、SD呈正相关性.

|
图 5 南京及其周边地区湖库浮游动物碳源转化指征与环境因子的冗余分析(1~21代表湖库) Fig.5 Redundancy analysis diagram of carbon sources utilization indicators of zooplankton and environment factors in lakes and reservoirs in Nanjing and surrounding areas |
淡水生态系统有机碳由内源有机碳和流域输入的外源有机碳组成[29]. 水体的营养状态是决定外源有机碳对食物网碳源的重要因素[30-31]. 在营养水平较低的水体中,初级生产力不足,外源性有机碳可被浮游细菌利用,细菌是鞭毛虫、纤毛虫和枝角类浮游动物的适口食物,桡足类浮游动物也可以选择性摄食纤毛虫和鞭毛虫[32-33]. 通过以上路径,外源有机碳可以补贴湖泊食物网碳源. 在富营养水体中,内源性初级生产力较高,消费者对外源碳的依赖性则相对较低[34-35].
研究区湖库POM与细菌的脂肪酸组成特征表明,浮游动物碳源组成与选取的湖库营养状况有关. 21个湖库中,不同营养水平湖库的POM样品中脂肪酸组成有明显区别. Chl.a与浮游植物的种类、丰度以及生物量密切相关,是反映水质的综合评价指标;浮游植物丰度越高,Chl.a浓度越高[33],来源于POM的特征脂肪酸EFA浓度也会相应越高. 本研究中,中营养湖库Chl.a浓度低于富营养湖库,脂肪酸EFA平均浓度(25.83 mg/L)低于富营养湖库(42.16 mg/L). 通过对比发现,中营养湖库中POM的细菌特征脂肪酸(∑C15+∑C17)含量多于富营养湖库,且中营养湖库的SD相对较高、Chl.a浓度相对低. 轻富营养湖库EFA浓度高于陆源碳特征脂肪酸∑C24和细菌特征脂肪酸∑C15+∑C17浓度,POM的PUFA浓度较低. 与轻富营养湖库相比,中富营养湖库水体中Chl.a浓度较高,SD较低,PUFA浓度均大于MUFA. 有研究表明,随着水体富营养化水平增加,PUFA浓度随之升高[34]. 重富营养湖库Chl.a浓度最高,POM的EFA浓度略高于中营养湖库,PUFA浓度逐渐增大,MUFA浓度则逐渐减少. 有研究表明处于中度富营养-富营养化状态的水库,SD是影响浮游植物功能群分布的主要因子之一,而浮游植物生产力高又会反过来导致SD下降[33].
中营养湖库与POM相似,浮游动物脂肪酸组成特征与湖库营养状态密切相关. 中营养湖库浮游动物PUFA浓度总体低于富营养湖库,∑C15+∑C17浓度则相反. 这与POM中PUFA与∑C15+∑C17浓度变化趋势一致. 其中,中山水库浮游动物的SFA占其总脂肪酸的73 %,而主要来源于藻类的EFA和PUFA含量较低. 这可能与中山水库作为饮用水水源地,对营养盐输入管控严格,藻类生物量低导致EFA或PUFA含量低有一定关系. 轻富营养湖库浮游动物PUFA浓度大于MUFA,与POM相反. 重富营养湖库浮游动物∑C24浓度较其他营养水平湖库逐渐减少,而POM中∑C24在不同湖库中浓度无明显差异.
中营养湖库的细菌碳源转化指征(∑C15+∑C17)/C16:0比值高,表明中营养湖库浮游动物的主要碳源为细菌来源的有机碳,尤其是外源碳. 值得注意的是,中营养湖库中陆源碳转化指征∑C24/C16:0显著高于其他类型湖库(P < 0.001),进一步证明了外源输入的有机碳对该类型水体中异养生物的物质与能量需求有重要的支撑作用. 同时,尽管中营养湖库POM中EFA绝对浓度较低,但浮游动物体内浮游植物转化指征EFA/C16:0比值仍然相对较高,说明藻类碳仍是浮游动物的重要碳源,而细菌来源的碳是对藻类碳的重要补充,二者共同成为浮游动物的主要碳源,以维持浮游动物的生产. 另外,轻富营养水平的山曹水库、大泉水库、龙墩河水库POM中EFA浓度高于∑C24和∑C15+∑C17,且浮游动物体内EFA浓度最高,说明轻富营养湖库藻类生物量开始增多,藻类对浮游动物的碳源贡献可能较细菌的贡献高. 中富营养湖库浮游动物PUFA占总脂肪酸百分含量增加,EFA含量最高. 可见随着湖库富营养化,水体中浮游植物增多,会产生高浓度的PUFA[36]. 值得关注的是,中富营养湖库浮游动物DHA浓度较轻富营养湖库高. DHA是多不饱和脂肪酸中极为重要的生物必需脂肪酸之一,DHA含量对于浮游动物的生长和繁殖具有不可缺少的作用. 通常,DHA在甲藻中含量丰富[37],夏季时,中富营养湖泊桡足类产卵率和孵化率都相对较高,Evjemo等认为这是由于甲藻DHA含量显著较高所致[38]. Jónasdóttir与Kirboe[39]的研究也表明DHA含量会影响浮游动物的产卵率. 由于中富营养湖库藻类以DHA含量较高的藻类为主,食物质量较高[40],因此浮游动物碳源以藻类为主,导致浮游动物体内EFA/C16:0比值较高. 重富营养山湖水库POM脂肪酸中EFA含量最多,浮游动物体内PUFA含量也最多,说明EFA沿食物链进入浮游动物体内,浮游植物是浮游动物的主要食物来源,食物质量较低的外源碳的作用并不显著. 蓝藻占优的富营养湖库中尽管其POM中EFA的含量略高于中营养湖库,然而浮游动物对EFA的转化指征却显著低于中营养湖库. 这可能与蓝藻或部分绿藻中PUFA含量低,食物质量较差有关[41].
RDA研究结果显示,浮游动物碳源转化指征EFA/C16:0、(∑C15+∑C17)/C16:0与SD呈正相关,与Chl.a、TP、PO43--P浓度呈负相关. 这一结果表明,水体富营养化程度过高时,浮游植物快速增长,SD降低,浮游植物群落结构变得单一,饱和脂肪酸增多,脂肪酸种类减少,浮游动物对浮游植物的摄食可能会有所降低[42]. 此外,浮游植物的过度生长会影响细菌对营养盐的吸收,从而影响浮游动物对细菌生物碳的利用效率. 此外,陆源碳转化指标∑C24/C16:0与TN、NO3--N呈正相关性,表明随着营养水平升高,陆源碳对浮游动物碳源贡献呈增加趋势. 总体而言,浮游动物更倾向于利用高质量的内源碳,但在初级生产力相对较低的贫营养和中营养水体中,内源碳不足以供给水生生物生长需求,此时外源碳在生态系统的物质循环和能量流动中会产生重要作用.
4 结语脂肪酸生物标记物在消费者脂质组成中大量存在,从而成为追溯消费者食物来源的重要证据,还能为水体生物之间的营养关系提供丰富的信息. 本研究对南京及其周边地区21个湖库POM和浮游动物脂肪酸组成特征进行了分析,湖库营养水平是影响生物体内脂肪酸组成的重要因素,脂肪酸生物标志物技术较好地指示了浮游动物碳源组成及食性差异,为今后研究水生生物碳源对水体富营养化进程的响应提供借鉴和参考. 今后的研究可借助例如单分子脂肪酸稳定同位素方法,更精确地追溯食物网碳源流动与转化.
| [1] |
Wu QL, Xing P, Li HB et al. Impacts of regime shift between phytoplankton and macrophyte on the microbial community structure and its carbon cycling in lakes. Microbiology China, 2013, 40(1): 87-97. [吴庆龙, 邢鹏, 李化炳等. 草藻型稳态转换对湖泊微生物结构及其碳循环功能的影响. 微生物学通报, 2013, 40(1): 87-97. DOI:10.13344/j.microbiol.china.2013.01.003] |
| [2] |
Qin BQ, Gao G, Hu WP et al. Reflections on the theory and practice of shallow lake ecosystem restoration. J Lake Sci, 2005, 17(1): 9-16. [秦伯强, 高光, 胡维平等. 浅水湖泊生态系统恢复的理论与实践思考. 湖泊科学, 2005, 17(1): 9-16. DOI:10.18307/2005.0102] |
| [3] |
Scheffer M, Carpenter S, Foley JA et al. Catastrophic shifts in ecosystems. Nature, 2001, 413(6856): 591-596. DOI:10.1038/35098000 |
| [4] |
Shi RJ, Ma J, Lv CX et al. Accumulation and decomposition of cyanobacteria and reed debris in eutrophic lakes and its potential co-metabolism effects. J Lake Sci, 2021, 33(4): 1062-1071. [石瑞洁, 马杰, 吕成旭等. 富营养化湖泊蓝藻-芦苇碎屑堆积分解过程及其潜在的共代谢效应. 湖泊科学, 2021, 33(4): 1062-1071. DOI:10.18307/2021.0409] |
| [5] |
Hou W, Sun SH, Gu BH et al. Stable isotopes of zooplankton and their applications in the research of aquatic ecosystems. Chinese Journal of Applied Ecology, 2019, 30(6): 1807-1814. [侯伟, 孙韶华, 古滨河等. 浮游动物稳定碳、氮同位素特征及其在水生态系统研究中的应用. 应用生态学报, 2019, 30(6): 1807-1814. DOI:10.13287/j.1001-9332.201906.016] |
| [6] |
Su L, Jin Z, Xie LC et al. Carbon transfer from the submerged macrophyte Hydrilla verticillata to zooplankton: A 13C-labeled mesocosm study. Hydrobiologia, 2021, 848(18): 4179-4188. DOI:10.1007/s10750-021-04645-3 |
| [7] |
Fry B. 13C/12C fractionation by marine diatoms. Marine Ecology Progress Series, 1996, 134: 283-294. DOI:10.3354/meps134283 |
| [8] |
Xu Q, Yang HS. Fatty acid biomarker and its application in marine trophic relation studies. Acta Oceanologica Sinica, 2011, 33(1): 1-6. [许强, 杨红生. 脂肪酸标志物在海洋生态系统营养关系研究中的应用. 海洋学报: 中文版, 2011, 33(1): 1-6. DOI:10.3969/j.issn.1009-5470.2011.01.001] |
| [9] |
Li YM, Huang XH, Liu CW. Application of carbon nitrogen stability isotope technology in animal survival analysis. Journal of Ocean University, 2007, 27(4): 99-103. [李由明, 黄翔鹄, 刘楚吾. 碳氮稳定同位素技术在动物食性分析中的应用. 广东海洋大学学报, 2007, 27(4): 99-103.] |
| [10] |
Wang N. The application of biomarkers such as fatty acids in the study of marine food networks[Dissertation]. Shanghai: East China Normal University, 2008. [王娜. 脂肪酸等生物标志物在海洋食物网研究中的应用[学位论文]. 上海: 华东师范大学, 2008. ]
|
| [11] |
Xu Q, Yang HS. Food sources of three bivalves living in two habitats of Jiaozhou bay (Qingdao, China): Indicated by lipid biomarkers and stable isotope analysis. Journal of Shellfish Research, 2007, 26(2): 561-567. DOI:10.2983/0730-8000(2007)26[561:fsotbl]2.0.co;2 |
| [12] |
You JT, Dong LH, Han BP. Composition and distribution of fatty acids for phytoplankton in a typical tropical lake. J Lake Sci, 2005, 17(1): 69-74. [游江涛, 董丽华, 韩博平. 热带富营养化湖泊中浮游植物的脂肪酸组成与分布. 湖泊科学, 2005, 17(1): 69-74. DOI:10.18307/2005.0111] |
| [13] |
Liang Y, Mai KS, Sun SC. Total lipid and fatty acid composition of eight strains of marine diatoms. Chinese Journal of Oceanology and Limnology, 2000, 18(4): 345-349. DOI:10.1007/BF02876083 |
| [14] |
Kainz M, Mazumder A. Effect of algal and bacterial diet on methyl mercury concentrations in zooplankton. Environmental Science & Technology, 2005, 39(6): 1666-1672. DOI:10.1021/es049119o |
| [15] |
Budge SM, Parrish CC, McKenzie CH. Fatty acid composition of phytoplankton, settling particulate matter and sediments at a sheltered bivalve aquaculture site. Marine Chemistry, 2001, 76(4): 285-303. DOI:10.1016/S0304-4203(01)00068-8 |
| [16] |
Perga ME, Bec A, Anneville O. Origins of carbon sustaining the growth of whitefish Coregonus lavaretus early larval stages in Lake Annecy: Insights from fatty-acid biomarkers. Journal of Fish Biology, 2009, 74(1): 2-17. DOI:10.1111/j.1095-8649.2008.02105.x |
| [17] |
Müller-Navarra DC, Brett MT, Liston AM et al. A highly unsaturated fatty acid predicts carbon transfer between primary producers and consumers. Nature, 2000, 403(6765): 74-77. DOI:10.1038/47469 |
| [18] |
Fisher JL, Menkel J, Copeman L et al. Comparison of condition metrics and lipid content between Euphausia pacifica and Thysanoessa spinifera in the northern California Current, USA. Progress in Oceanography, 2020, 188: 102417. DOI:10.1016/j.pocean.2020.102417 |
| [19] |
Volkman JK, Johns RB, Gillan FT et al. Microbial lipids of an intertidal sediment-I. Fatty acids and hydrocarbons. Geochimica et Cosmochimica Acta, 1980, 44(8): 1133-1143. DOI:10.1016/0016-7037(80)90067-8 |
| [20] |
Editorial Board of Water and Wastewater Monitoring and Analysis Methods, Ministry of Environmental Protection of the People's Republic of China eds. Water and wastewater monitoring and analysis methods. 4th edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002.]
|
| [21] |
Wang WX, Chen FZ, Gu XH. Community structures of zooplankton and its relation to environmental factors in five medium reservoirs in Nanjing City. J Lake Sci, 2017, 29(1): 216-223. [王文侠, 陈非洲, 谷孝鸿. 南京市5座中型水库浮游动物群落结构及其与环境因子的关系. 湖泊科学, 2017, 29(1): 216-223. DOI:10.18307/2017.0123] |
| [22] |
Sun Y, Shu TT, Li J et al. Horizontal distribution characteristics of crustacean planktons and its relationship with environmental factors in Lake Xuanwu, Nanjing City. J Lake Sci, 2012, 24(3): 422-428. [孙颖, 舒婷婷, 李静等. 南京玄武湖浮游甲壳动物的水平分布及其与环境的关系. 湖泊科学, 2012, 24(3): 422-428. DOI:10.18307/2012.0314] |
| [23] |
Wu MC, Zhang H, Sun WC et al. Metabolic plasticity of the starchless mutant of Chlorella sorokiniana and mechanisms underlying its enhanced lipid production revealed by comparative metabolomics analysis. Algal Research, 2019, 42: 101587. DOI:10.1016/j.algal.2019.101587 |
| [24] |
Wang MC, Liu XQ, Zhang JH. Evaluate method and classification standard on lake eutrophication. Environmental Monitoring in China, 2002, 18(5): 47-49. [王明翠, 刘雪芹, 张建辉. 湖泊富营养化评价方法及分级标准. 中国环境监测, 2002, 18(5): 47-49.] |
| [25] |
Cai QH. On the comprehensive evaluation methods for lake eutrophication. J Lake Sci, 1997, 9(1): 89-94. [蔡庆华. 湖泊富营养化综合评价方法. 湖泊科学, 1997, 9(1): 89-94. DOI:10.18307/1997.0114] |
| [26] |
Viso AC, de Marty JC. Fatty acids from 28 marine microalgae. Phytochemistry, 1993, 34(6): 1521-1533. DOI:10.1016/S0031-9422(00)90839-2 |
| [27] |
Zhukova NV, Kharlamenko VI. Sources of essential fatty acids in the marine microbial loop. Aquatic Microbial Ecology, 1999, 17: 153-157. DOI:10.3354/ame017153 |
| [28] |
Napolitano GE, Ackman RG, Ratnayake WMN. Fatty acid composition of three cultured algal species (Isochvysis galbana, Chaetoceros gracilis and Chaetoceros calcitrans) used as food for bivalve larvae. Journal of the World Aquaculture Society, 1990, 21(2): 122-130. DOI:10.1111/j.1749-7345.1990.tb00532.x |
| [29] |
Richardson JS, Zhang YX, Marczak LB. Resource subsidies across the land-freshwater interface and responses in recipient communities. River Research and Applications, 2010, 26(1): 55-66. DOI:10.1002/rra.1283 |
| [30] |
Hu ZJ, Yang XD, Anderson NJ et al. The landscape-atmosphere continuum determines ecological change in alpine lakes of SE Tibet. Ecosystems, 2018, 21(5): 839-851. DOI:10.1007/s10021-017-0187-z |
| [31] |
Chen X, McGowan S, Peng J et al. Local and regional drivers of environmental changes in two subtropical montane ponds (central China) over the last two centuries. Ecosystems, 2021, 24(3): 565-582. DOI:10.1007/s10021-020-00535-2 |
| [32] |
Carpenter SR, Cole JJ, Pace ML et al. Ecosystem subsidies: Terrestrial support of aquatic food webs from 13C addition to contrasting lakes. Ecology, 2005, 86(10): 2737-2750. DOI:10.1890/04-1282 |
| [33] |
Cole JJ, Carpenter SR, Pace ML et al. Differential support of lake food webs by three types of terrestrial organic carbon. Ecology Letters, 2006, 9(5): 558-568. DOI:10.1111/j.1461-0248.2006.00898.x |
| [34] |
Sun H, Zhang YD, Yu JL et al. Contribution of allochthonous dissolved organic carbon to the carbon source of planktonic crustaceans in Lake Fuxian. J Lake Sci, 2017, 29(4): 887-895. [孙欢, 张永东, 于谨磊等. 外源溶解性有机碳对抚仙湖甲壳类浮游动物碳源的贡献. 湖泊科学, 2017, 29(4): 887-895. DOI:10.18307/2017.0412] |
| [35] |
van den Meersche K, Rijswijk PV, Soetaert K et al. Autochthonous and allochthonous contributions to mesozooplankton diet in a tidal river and estuary: Integrating carbon isotope and fatty acid constraints. Limnology and Oceanography, 2009, 54(1): 62-74. DOI:10.4319/lo.2009.54.1.0062 |
| [36] |
Kelly PB, Reiser R, Hood DW. The origin of the marine polyunsaturated fatty acids. Composition of some marine plankton. Journal of the American Oil Chemists' Society, 1959, 36(3): 104-106. DOI:10.1007/bf02639979 |
| [37] |
Wong WH, Gao QF, Cheung SG et al. Field observations on correlation of fatty acid profiles between suspended particulate matter and green-lipped mussels in subtropical waters of Hong Kong. Marine Pollution Bulletin, 2008, 57(6/7/8/9/10/11/12): 662-671. DOI:10.1016/j.marpolbul.2007.12.019 |
| [38] |
Evjemo JO, Tokle N, Vadstein O et al. Effect of essential dietary fatty acids on egg production and hatching success of the marine copepod Temora longicornis. Journal of Experimental Marine Biology and Ecology, 2008, 365(1): 31-37. DOI:10.1016/j.jembe.2008.07.032 |
| [39] |
Jónasdóttir SH, Kiørboe T. Copepod recruitment and food composition: Do diatoms affect hatching success?. Marine Biology, 1996, 125(4): 743-750. DOI:10.1007/BF00349257 |
| [40] |
Trommer G, Lorenz P, Lentz A et al. Nitrogen enrichment leads to changing fatty acid composition of phytoplankton and negatively affects zooplankton in a natural lake community. Scientific Reports, 2019, 9: 16805. DOI:10.1038/s41598-019-53250-x |
| [41] |
Li YH, Li YC, Wang N et al. Formation and control of the harmful ingredients during the decaying process of cyanobacteria from Lake Chaohu. J Lake Sci, 2012, 24(4): 513-518. [李永慧, 李玉成, 王宁等. 巢湖蓝藻死亡衰败过程中典型有害成分形成及控制对策. 湖泊科学, 2012, 24(4): 513-518. DOI:10.18307/2012.0402] |
| [42] |
You JT, Dong LH, Han BP. The fatty acid composition of two bloom-causing algal species: Phaeocystis globosa and Microcystis aeruginosa. Chinese Journal of Plant Ecology, 2005, 29(4): 623-629. [游江涛, 董丽华, 韩博平. 两种水华藻——球形棕囊藻和铜绿微囊藻的脂肪酸组成特征与水华形成机制. 植物生态学报, 2005, 29(4): 623-629. DOI:10.3321/j.issn:1005-264X.2005.04.014] |
 2022, Vol. 34
2022, Vol. 34 


