(2: 江苏省环境监测中心,南京 210008)
(3: 上海市青浦区环境监测站,上海 201799)
(2: Jiangsu Environmental Monitoring Center, Nanjing 210008, P.R.China)
(3: Qingpu District Environmental Monitoring Station, Shanghai 201799, P.R.China)
蓝藻水华(cyanobacterial blooms)通常被定义为,富含N、P等营养盐的水体,在适宜的温度、光照和风速等环境条件下,水体中的蓝藻大量繁殖,往往形成肉眼可见的蓝藻群体颗粒,使水柱的透明度发生明显改变,从而对水体生态环境造成危害或潜在危害的一种现象[1]. 藻类细胞所呈现的颜色,是其所含光合色素的综合表现,与其细胞所含光合色素的组成和含量直接相关. 藻类光合色素是指在光合作用过程中捕获光能,并将光能转化为化学能的一类化学物质. 根据其分子结构可以分成叶绿素(chlorophylls)、类胡萝卜素(carotenoids)和藻胆蛋白三大类(phycobiliprotein). 蓝藻细胞内色素主要包括叶绿素、藻蓝素和藻红素,故较少吸收蓝绿光,因而主要呈现蓝绿色[2]. 为此,蓝藻也常被称为蓝绿藻(blue green algae),蓝藻水华也以蓝绿色的水色为主.
随着蓝藻水华关注度的不断提升,尤其是监测和研究的不断深入,经常在水体中发现黄绿色和黄色的蓝藻水华. Cai等于2014年10月发现,以微囊藻为优势种的太湖蓝藻水华从7月的蓝绿色变为黄色[3]. 国外,关于黄色蓝藻水华的文献也较少. 2000年,新西兰一个富营养湖泊Rotoehu湖,大量微囊藻变成了芥末黄色. 有些人认为这可能是另一种藻种导致的颜色变化,但调查发现微囊藻活体样本呈黄色且占绝对主导地位. 实际上,这种现象存在很长时间,在西班牙也出现了这种现象,主要是由蓝藻门的赖格乌龙藻(Woronichinia naegliana)水华导致. 此外,2002年Krienitz等观察到了以鱼腥藻(长孢藻)为主的Victoria湖黄色蓝藻水华[4],以及2005年Santos等报道在葡萄牙亚速尔群岛Sete-Cidades湖发现以微囊藻属为优势种的黄色蓝藻水华[5]. 目前,对于黄色蓝藻水华的成因尚未有统一的结论. 本文拟重点分析太湖黄色蓝藻水华案例,并通过综述国内外其他湖泊水体黄色蓝藻水华案例,探究黄色蓝藻水华的成因.
1 案例分析 1.1 中国太湖限于以往的观测手段、范围和频次等,以及对于蓝藻水华黄化这一现象的认识还不足,目前记录和开展相关研究的资料不多. 实际上,太湖的黄色蓝藻水华是一种非常常见的水华现象. 近年来,尤其是随着无人机技术在蓝藻水华监测预警中的不断发展和运用,近地飞行后获取大量的水华照片,逐步引起了科学家和政府管理部门的重视.
2022年2月26日,无锡市生态环境局在太湖梅梁湾沿岸及其周边河道发现较大面积的黄色蓝藻水华. 随后,2022年3月2日至4日江苏省无锡环境监测中心开展深入调查和研究,发现引起本次水华的物种是太湖冬春季常见物种长孢藻(Dolichospermum),优势度大于99.9 %. 针对图 1在黄色蓝藻水华出现的区域设置了5个点位,现场和理化数据详见表 1.

|
图 1 长孢藻引起的黄色蓝藻水华(A, 2022年2月26日无人机监测图;B, 2022年3月2日现场人工监测;C, 2022年3月2日无人机监测图;D, 2022年3月2日黄色蓝藻水华优势种,水华长孢藻) Fig.1 Yellow cyanobacterial blooms caused by Dolichospermum (A, aerial view of the drone for monitoring yellow cyanobacterial blooms on February 26, 2022; B, manual inspection and sampling on March 2, 2022; C, aerial view of the drone for monitoring yellow cyanobacterial blooms on March 2, 2022; D, dominant species of yellow cyanobacterial blooms, Dolichospermum flos-aquae, March 2, 2022) |
| 表 1 2022年3月2日调查的现场和理化参数 Tab. 1 Field and physicochemical parameters in the survey on March 2, 2022 |
由表 1可知,调查期间黄色蓝藻水华的聚集区域主要分布在太湖沿岸,且湖体中也有少量分布. 因此岸边聚集不是其分布特征,这主要与气象条件有关. 同时,由于样本采自太湖沿岸蓝藻水华聚集区的表层,因此叶绿素a最低值也超过了100 μg/L,均值更是高达369 μg/L,可见水体中的生物量较大. 同时,由于水体中较大的生物量,藻源性的N和P贡献也较大,总氮和总磷的均值分别高达3.87和0.15 mg/L. 水体温度均值为14.6℃,藻类已经逐步开始繁殖,生物量达到一定程度后,加之适宜的气象条件,极易形成蓝藻水华.
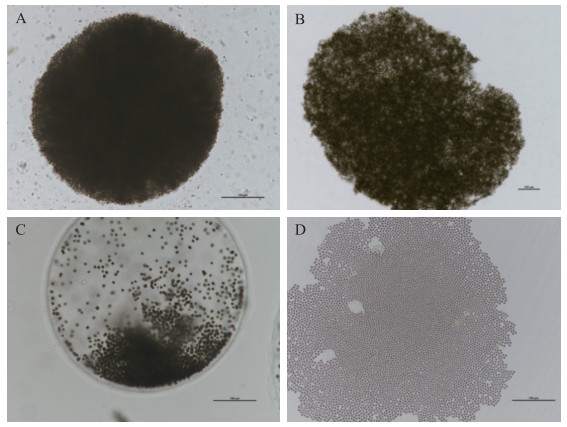
2018年9月14日11时16分EOS/MODIS卫星遥感影像显示,全太湖藻类聚集面积约为475 km2. 如图 2所示,在梅梁湖附近水域,发现同时出现蓝绿色、橙黄色和暗黄色的蓝藻水华聚集. 现场水温26.7℃,pH值9.30,溶解氧浓度为10.93 mg/L(饱和度136.3 %),可见藻类处于大量增殖阶段. 样本采集后,经显微镜镜检分析蓝藻水华优势种主要为微囊藻(Microcystis spp.),优势种类为水华微囊藻(M. flos-aquae)、鱼害微囊藻(M. ichthyobabe)、片状微囊藻(M. panniformis)和惠氏微囊藻(M. wesenbergii),合计80.0 % 以上, 详见图 3.

|
图 2 微囊藻引起的黄色蓝藻水华(A, 蓝绿色的蓝藻水华;B, 橙黄色的蓝藻水华;C, 暗黄色的蓝藻水华;D, 太湖蓝藻水华卫星遥感监测图) Fig.2 Yellow cyanobacterial blooms caused by Microcystis (A, blue-green cyanobacterial blooms; B, orange-yellow cyanobacterial blooms; C, dark-yellow cyanobacterial blooms; D, Satellite remote sensing monitoring map of cyanobacterial blooms in Lake Taihu) |
|
图 3 水华蓝藻优势种显微图(A, 水华微囊藻;B, 鱼害微囊藻;C, 惠氏微囊藻;D片状微囊藻) Fig.3 Microphotography of water bloom-forming cyanobacterial species(A, M. flos-aquae; B, M. ichthyobabe; C, M. wesenbergii; D, M. panniformis) |
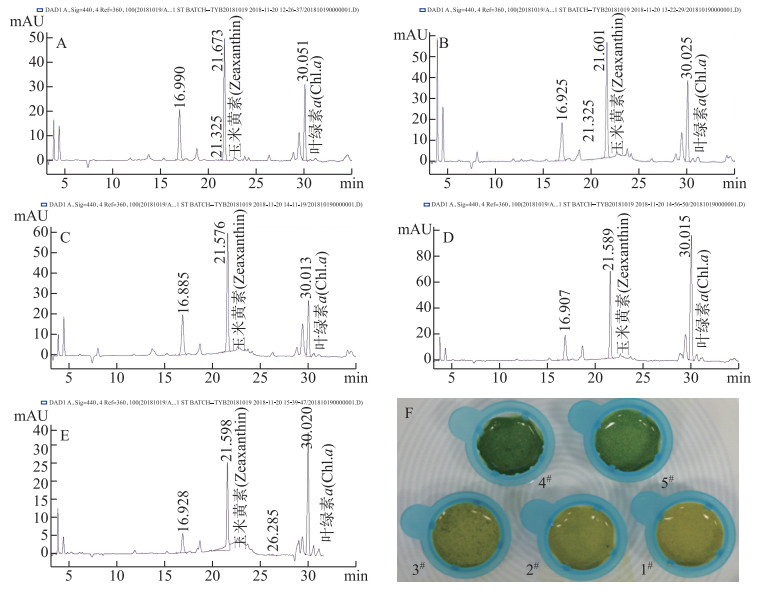
在2018年9月14日太湖黄色微囊藻水华调查中,分别取5个点位的藻类样品进行了色素组成分析实验. 其中,1#、2#和3#为黄色水华样本,4#和5#为蓝绿色水华样本. 由图 4可知,5个点位的藻类在主要色素组成方面并无明显的差异;但通过测定样品中色素的相对含量可知,1#、2#和3#点位中蓝藻的特征色素玉米黄素(Zeaxanthin)浓度明显大于叶绿素a浓度(chlorophyll-a),而4#和5#点位中蓝藻的叶绿素a浓度明显大于玉米黄素,这表明细胞中不同色素的含量有所差异. 从样品的外观来看,1#、2#和3#点位样品的颜色显得偏黄,而4#和5#点位样品显得深绿.
|
图 4 反相高效液相色谱对混合标准光合色素的色谱分析(A~E, 色谱分析图;F, 样本) Fig.4 RP-HPLC chromatograms of mixed photosynthetic pigment standards(A-E, chromatograms; F, samples) |
综上所述,在中国太湖经常可以监测到冬末春初的长孢藻水华,以及夏秋季的微囊藻水华,这些蓝藻水华均可以呈现黄色. 实际上,太湖黄色的蓝藻水华可在四季出现,只是限制于观测手段、范围和频次等原因,不能及时观测而已. 值得注意的是,即使在相同时间相同水域,蓝藻水华的颜色也会有很大的变化. 对于形成蓝藻水华的群体颗粒而言,不同的藻类群体颗粒颜色也有一定的差异,这些群体颗粒的色素组成是藻类对外界环境条件的响应.
1.2 国际水库和湖泊国际上关于黄色蓝藻水华报道较少. 2018年8月3日,Maria Verdugo Althöfer在ResearchGate上提问,关于西班牙某水库黄色蓝藻水华的问题. 她发现该水库出现明显黄色水华,采集水体中的混合样本镜检后发现,赖格乌龙藻优势度为87.9 %,细胞密度1.4×109 cells/L,为第一优势种(图 5). 而在上述Maria Verdugo Althöfere的提问中提到也存在黄色蓝藻水华的Rotoehu湖,是新西兰罗托鲁阿群湖(Lakes Rotorua)之一,这些湖泊大多是火山型湖泊,相对集中,不同程度上均面临湖泊富营养化问题. 而其中的Rotoehu湖水质也在不断恶化中,蓝藻水华也时常暴发. 2020年,Thomson-Laing等针对Rotoehu湖开展了为期12周的蓝藻监测,发现12月份至1月中旬以长孢藻为优势种,1月下旬以后以微囊藻为优势种,存在长孢藻和微囊藻交替的演替规律[6]. 2001年,Krienitz等在Victoria湖的调查中发现了以鱼腥藻(长孢藻)为主的黄色蓝藻水华,其优势种主要是Anabaena flos-aquae和Anabaena discoidea[4]. 2005年,Santos等在葡萄牙亚速尔群岛的Sete-Cidades湖研究发现,蓝藻水华暴发往往从4—5月份至10月份,期间以铜绿微囊藻为优势种常在水面形成黄绿色蓝藻水华[5]. 因此,从上述Rotoehu湖、Victoria湖和Sete-Cidades来看,鱼腥藻(长孢藻)和微囊藻可形成黄色蓝藻水华.

|
图 5 赖格乌龙藻水华(A~B, 呈现黄色的水华;C, 赖格乌龙藻×100倍;D, 赖格乌龙藻×400倍)(https://www.researchgate.net/post/Why-this-year-are-my-cyanobacteria-blooms-yellow) Fig.5 Cyanobacterial blooms dominated by Woronichinia naegeliana (A-B, cyanobacterial blooms in yellow; C, microphotography of W. naegeliana ×100;D, microphotography of W. naegeliana ×400) (https://www.researchgate.net/post/Why-this-year-are-my-cyanobacteria-blooms-yellow) |
目前,对于黄色蓝藻水华的成因尚未有统一的结论. 主要争论点在于蓝藻藻体是否变黄. 一部分观点认为蓝藻水华是由大量的藻类群体颗粒组成[7],实际上每一个群体颗粒的色素组成存在差异,因此每一个群体颗粒的颜色都不一样. 黄色蓝藻水华所呈现的黄色主要原因是光的折射以及红色伴生硅藻的存在,使得尽管水体中蓝绿色的蓝藻为优势种群,在观测湖水时水色仍以黄色为主. 另一部分认为蓝藻在周围环境出现变化时,自身叶绿素、藻蓝素合成减少,胡萝卜素以及叶黄素占比增加,使得藻体呈现黄色,故而发生黄色蓝藻水华. 其中,主要的环境影响因子包括光照和营养元素(特别是氮元素)[8-9].
2.1 光照光照强度能够显著影响蓝藻细胞的色素合成[10]. 当光照较强时,比如在夏季强烈的阳光下,尤其是阴雨天放晴后,蓝藻暴露于较强的光合有效辐射很可能导致水分分解速度过快,并产生过多的活性氧,因此会通过合成光保护色素类胡萝卜素以防止氧化损伤光系统. 类胡萝素在色素组成中比例上升,导致蓝藻在感官上呈现偏黄的状态. 当光照较弱时,缺乏阳光或营养可能会影响蓝藻生长甚至衰亡,孟泽婧等的模拟实验推断,在自然条件下绿色的新鲜蓝藻会逐步降解为黄绿色、浅黄色和白色,其中在衰亡3天后会释放大量的藻蓝色素[11],这也解释了蓝藻衰亡过程中发黄的原因.
此外,Sidler研究表明,不同光质下细胞藻胆体组分也会发生变化[12],借此可将蓝藻分为3大类:1) 当蓝藻含有藻红蓝蛋白时,在不同光质下,蓝藻藻胆体的组分不变化[13];2) 在不同光质下,藻胆体中色素蛋白种类发生变化. 例如丝状蓝藻Calothrix sp. PCC 7601细胞在红光培养下,其编码红色、吸收蓝绿光的蓝藻藻红蛋白基因的表达被另一种编码蓝色、吸收红光的藻蓝蛋白的基因所替代[14]. 3)在不同光质下,藻胆体的中色素蛋白相对丰度发生变化[15]. 例如席藻属Phormidium sp. C86细胞在绿光培养下藻胆体中藻红蛋白、藻蓝蛋白以及别藻蓝蛋白的比例为7.3∶1∶1,而在红光培养下,三者比例则变化为1.2∶3.3∶1[16].
2.2 水温水温对蓝藻水华颜色的影响,往往通过影响光合作用和色素类型来实现. Takamura等,1981—1982年在霞浦湖原位研究了光照和水温对铜绿微囊藻光合作用的影响. 研究发现,最大光合有效速率在水温较高的8月至9月初反而较低. 同时,值得关注的是微囊藻增殖在不同湖库的水温也有较大差异,总体来说是水温和其他环境条件综合影响野外条件下微囊藻的光合作用和增殖[17]. 1999年,Tang等以席藻属(Phormidium)为对象,研究了细胞中叶绿素a、类胡萝卜素、藻蓝蛋白和别藻蓝蛋白等含量随温度变化的规律,发现属内种间存在一定的差异. 例如Phormidium tenue的叶绿素a含量随水温升高至30℃达到峰值,随后快速下降. 但是类胡萝卜素含量随水温变化不明显,尤其是水温在15℃以上. 但对于Phormidium subfuscum,类胡萝卜素和叶绿素a含量随水温变化均不明显,但是两者的相关性较高,且超过5~20℃范围后,类胡萝卜素和叶绿素a的比值有一定的变化[18].
2.3 营养盐非固氮蓝藻的营养限制会使生长诱发一系列的反应,包括细胞停止分裂和形态生理改变,如光合膜的丧失、糖原的增加以及色素的流失. 氮限制会导致叶绿素和藻胆蛋白含量降低,致使细胞颜色从正常的蓝绿色急剧变化为黄绿色,这种现象可称之为“漂白”. 其中藻胆蛋白会几乎被完全降解,叶绿素含量也会有所下降,藻胆蛋白降解所释放的物质可能为适应缺氮状态下所需的多肽合成提供材料. 在一些蓝藻物种中,该现象也会出现在对硫元素、磷元素、碳元素和铁元素的营养限制反应中,这种情况下的降解是蓝藻在压力条件下最大限度地减少对多余激发能量的吸收. Collier和Grossman证明“漂白”在氮或硫与磷限制的情况下是不同的[19],在氮限制或者硫限制的培养基上,藻胆蛋白的减少比在磷限制的培养基上要更快、更彻底,这表明在不同的营养盐限制条件下“漂白”是有所区别的. 此外,Noel等通过测定Rotoehu湖水体营养元素浓度发现,该湖因靠近泉水而含有浓度相当高的溶解活性磷,因此水中浮游生物生长主要受氮可用性的制约[20],这也是黄色蓝藻水华在Rotoehu湖出现的可能原因之一.
2.4 生命周期水华呈现黄色可能与水华藻类所处的生命周期不同有关. 首先,类似于植物叶片,蓝藻有季节性的生命周期,随着秋冬季节太阳辐射的减少进入衰亡期. 细胞内的主要叶绿素的分解速度逐步加快,其它色素的比例随之上升,就表现为包括黄色在内的其它颜色. 其次,受营养盐、气象等外部条件影响,蓝藻在较短时间周期、局部水域也会从指数生长期进入到衰亡期,这可能是在水华发生过程中,伴随大量的营养物质被消耗,导致水体受到营养盐限制,水华趋向于消亡. 该阶段,一方面氮限制影响了叶绿素a和藻蓝蛋白的合成;另一方面叶绿素a相对光敏容易分解,而类胡萝卜素分子相对稳定,从而导致细胞色素的叶绿素a占比下降,类胡萝卜素占比增加,使水华呈现黄色.
2.5 小结总的来说,溶解性氮、磷、硫等营养物质的缺乏,光周期、光胁迫导致的光保护色素的产生,都可能使蓝藻对生理和代谢反应发生变化,从而引起色素组成的改变导致感官颜色变化. 实际上,鉴于上述原因,经常在水体中会发现蓝色、亮绿色、黄绿色、黄色、棕色、灰色、白色或红色等多种颜色类型的蓝藻水华.
3 黄色蓝藻水华对水生态管理的思考对于黄色蓝藻水华的及时发现与监测,是否可以使用遥感或者视频监控的手段进行?比如长时间序列卫星影像的CIE主波长判断,以及对实时视频的深度学习快速自动识别. 蓝藻水华的颜色变化是对环境条件的一种响应,那么到底是什么环境条件导致了颜色的变化?是光照强度还是营养盐限制?具体是哪种营养盐?是否可以较为方便地确定一定时间和地点蓝藻水华黄化的主导环境因子?例如,如果是氮,那么是否可以通过控氮来更好地控制蓝藻水华的暴发规模?同时,这种颜色的变化随之带来的是藻类生长活性的促进还是抑制?藻毒素的释放是否受到影响?这些问题都需要找到引起蓝藻水华黄化的原因及揭示其黄化的机理研究. 值得注意的是,蓝藻水华的黄色仅是其外在颜色的一种表现,还有其他绿色、蓝色、棕色、白色和红色等颜色,研究这些颜色的变化机理对于揭示蓝藻水华暴发机理及防控具有重大意义.
| [1] |
Zhang JY. Metagenomic studies on cyanobacterial blooms in Lake Taihu[Dissertation]. Nanjing: Southeast University, 2018. [张军毅, 太湖蓝藻水华的宏基因组学研究[学位论文]. 南京: 东南大学, 2018. ]
|
| [2] |
Bi YH, Hu ZY. Relationship between watercolor and phytoplankton. Ecological Science, 2005, 24(1): 66-68. [毕永红, 胡征宇. 水色及其与藻类的关系. 生态科学, 2005, 24(1): 66-68.] |
| [3] |
Cai HY, Jiang HL, Krumholz LR et al. Bacterial community composition of size-fractioned aggregates within the phycosphere of cyanobacterial blooms in a eutrophic freshwater lake. PLoS One, 2014, 9(8): e102879. DOI:10.1371/journal.pone.0102879 |
| [4] |
Krienitz L, Ballot A, Wiegand C et al. Cyanotoxin-producing bloom of Anabaena flos-aquae, Anabaena discoidea and Microcystis aeruginosa (cyanobacteria) in Nyanza gulf of Lake Victoria, Kenya. Journal of Applied Botany, 2002, 76(5/6): 179-183. |
| [5] |
Santos M, Pacheco D, Santana F et al. Cyanobacteria blooms in Sete-Cidades lake (S. Miguel Island-Azores). Algological Studies, 2005, 117(6): 393-406. |
| [6] |
Thomson-Laing G, Puddick J, Wood SA. Predicting cyanobacterial biovolumes from phycocyanin fluorescence using a handheld fluorometer in the field. Harmful Algae, 2020, 97: 101869. DOI:10.1016/j.hal.2020.101869 |
| [7] |
Deng J, Chen XC, Huang YY et al. Biogeochemical cycling processes associated with cyanobacterial aggregates. Acta Microbiologica Sinica, 2020, 60(9): 1922-1940. [邓杰, 陈雪初, 黄莹莹等. 蓝藻群体颗粒驱动元素地球化学循环研究进展. 微生物学报, 2020, 60(9): 1922-1940.] |
| [8] |
Allen MM, Hutchison F. Nitrogen limitation and recovery in the cyanobacterium Aphanocapsa 6308. Archives of Microbiology, 1980, 128(1): 1-7. DOI:10.1007/BF00422297 |
| [9] |
Richaud C, Zabulon G, Joder A et al. Nitrogen or sulfur starvation differentially affects phycobilisome degradation and expression of the nblA gene in Synechocystis strain PCC 6803. Journal of Bacteriology, 2001, 183(10): 2989-2994. DOI:10.1128/JB.183.10.2989-2994.2001 |
| [10] |
Reuter W, Nickel-Reuter C. Molecular assembly of thephycobilisomes from the cyanobacterium Mastigocladus laminosus. Journal of Photochemistry and Photobiology B: Biology, 1993, 18(1): 51-66. DOI:10.1016/1011-1344(93)80040-G |
| [11] |
Meng ZJ, Li YC, Wu J et al. Laboratory simulation study of color and morphological changes in the decay process of cyanobacteria in Chaohu lake. Journal of Anhui Agricultural Sciences, 2011, 39(17): 10348-10352. [孟泽婧, 李玉成, 吴涓等. 巢湖蓝藻衰亡过程中颜色及形态变化的室内模拟研究. 安徽农业科学, 2011, 39(17): 10348-10352.] |
| [12] |
Sidler WA. Phycobilisome and phycobiliprotein structures, in the molecular biology of cyanobacteria. Berlin: Springer, 1994: 139-216. DOI:10.1007/978-94-011-0227-8_7
|
| [13] |
Bryant DA. Phycoerythrocyanin and phycoerythrin: Properties and occurrence in cyanobacteria. Microbiology, 1982, 128(4): 835-844. DOI:10.1099/00221287-128-4-835 |
| [14] |
Mazel D, Marlière P. Adaptive eradication of methionine and cysteine from cyanobacterial light-harvesting proteins. Nature, 1989, 341(6239): 245-248. DOI:10.1038/341245a0 |
| [15] |
Westermann M, Reuter W, Schimek C et al. Presence of both hemidiscoidal and hemiellipsoidal phycobilisomes in a Phormidium species (cyanobacteria). Zeitschrift für Naturforschung C, 1993, 48(1/2): 28-34. DOI:10.1515/znc-1993-1-206 |
| [16] |
Wehrmeyer W. Phycobilisomes: Structure and function, in cell walls and surfaces, reproduction, photosynthesis. Berlin: Springer, 1990: 158-172.
|
| [17] |
Takamura N, Iwakuma T, Yasuno M. Photosynthesis and primary production of Microcystis aeruginosa Kütz. in Lake Kasumigaura. Journal of Plankton Research, 1985, 7(3): 303-312. DOI:10.1093/plankt/7.3.303 |
| [18] |
Tang EPY, Vincent WF. Strategies of thermal adaptation by high-latitude cyanobacteria. New Phytologist, 1999, 142(2): 315-323. DOI:10.1046/j.1469-8137.1999.00385.x |
| [19] |
Collier JL, Grossman AR. Chlorosis induced by nutrient deprivation in Synechococcus sp. strain PCC 7942: Not all bleaching is the same. Journal of Bacteriology, 1992, 174(14): 4718-1726. DOI:10.1128/jb.174.14.4718-4726.1992 |
| [20] |
Burns N, McIntosh J, Scholes P. Strategies for managing the lakes of the Rotorua district, New Zealand. Lake and Reservoir Management, 2005, 21(1): 61-72. DOI:10.1080/07438140509354413 |
 2022, Vol. 34
2022, Vol. 34 

