(2: 中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,南京 210008)
(3: 中国科学院大学南京分院,南京 211135)
(4: 江苏省水文水资源勘测局南京分局,南京 210008)
(5: 南京市水资源管理中心,南京 210008)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P.R.China)
(3: Nanjing School, University of Chinese Academy of Sciences, Nanjing 211135, P.R.China)
(4: Nanjing Branch of Jiangsu Province Hydrology and Water Resources Investigation Bureau, Nanjing 210008, P.R.China)
(5: Nanjing Water Resources Management Center, Nanjing 210008, P.R.China)
寡—中营养型水体,如抚仙湖、千岛湖等,在局部水域偶发水华,这些水华虽然范围小,持续时间短,但是由于此类水体供水功能的敏感性,水华的影响和危害仍不容忽视[1]. 富营养化水体中藻类生长、水华发生与营养盐水平直接相关,同时气象因素调节其在水体中的垂向和水平分布,形成肉眼可见的水华现象,这一过程和机制已经被较为清楚的认识[2-3]. 然而寡—中营养型水体中营养盐水平偏低,在这种低营养盐水平下藻类如何完成大量生长并形成水华的机制仍有待深入探索研究.
目前国际上关于寡—中营养型水体中蓝藻水华的研究文章和报道非常有限,甚至部分此类水体发生的蓝藻水华案例仅被记录于水资源管理部门[4]. 此类水体中发生水华的蓝藻种类目前约有12属,且这些种类多与富营养化水体中的种类相同. 关于在如此低营养的水体中发生水华的解释也仍多沿用富营养化水体中蓝藻水华发生机制的框架,从水华蓝藻物种的特性和外部环境两个层面进行分析,支持这些物种形成水华的生理特性包括产生厚壁孢子[5]、上浮特性、营养盐利用特性、光利用策略和碳浓缩机制[3]等,外部环境如温度升高[6]、水体混合过程变化[7]等. 与富营养化水体中蓝藻水华成因分析不同的是,此类水体的分析更注重水华蓝藻种类环境适应的广谱性[4].
方便水库作为溧水区主要供水水源地,也是南京市主城区的应急备用水源地之一,其水质对供水保障极为重要. 然而在2016年夏季,方便水库发生了较为严重的蓝藻水华现象,出现水体变色、异味等水质异常问题,取水口附近水域尤为明显,严重影响了供水安全; 2017年夏季方便水库又出现了局部蓝藻水华现象. 根据地方监测结果显示,优势水华藻类为丝状蓝藻. 丝状水华蓝藻由于其种类繁多、生理特性差异明显,因此其形成水华的机制也各不相同[8],甚至同一种丝状水华蓝藻在不同的环境条件下也会呈现出不同的优势形成策略,如长孢藻可以利用低温条件的生长优势和低氮条件的固氮优势在春季和夏季均形成蓝藻水华[9].
为揭示寡—中营养型水体偶发性水华的驱动因素,本研究以南京方便水库为例,通过长期历史数据分析和水华期的藻类演变过程监测,分析了偶发性蓝藻水华形成过程中的环境变化过程,阐明了优势水华蓝藻生长的主要驱动因子,该研究对于寡—中营养型水库水质管理与蓝藻水华的防治具有重要意义.
1 研究方法 1.1 方便水库概况方便水库(31°40′~31°43′N,119°05′07″~119°07′02″E)是一座以防洪、灌溉为主,兼有供水功能的中型水利工程,位于南京市溧水区. 方便水库流域总面积为77.1 km2,其中水面面积6.68 km2,兴利水位26.20 m,兴利库容2084万m3,该水位条件下平均水深约4.7 m,最大水深10.7 m. 入库河流包括青龙桥河、四古凹河、西南村河、方棚撇洪沟、谢家棚河、王家山河、后吕河7条河流. 方便水库外源污染负荷以农田径流为主,其中东部及南部是入库污染的主要来源.
1.2 长序列数据获取方便水库2006—2020年的长序列数据主要来源于江苏省水文水资源勘测局南京分局的长期监测记录,主要指标包括总氮(TN)、总磷(TP)、氨氮(NH3-N)、高锰酸盐指数(CODMn)和叶绿素a(Chl.a)等. 这些指标中,总氮浓度采用过硫酸钾氧化、紫外分光光度法(GB 11894—1989)测定,总磷浓度采用过硫酸钾氧化、钼锑抗显色分光光度法(GB 11893—1989)测定,氨氮浓度采用纳氏试剂光度法(GB 7479—1987)测定,高锰酸盐指数采用高锰酸钾氧化法测定,叶绿素a浓度采用热丙酮提取,分光光度法测定.
1.3 野外样品采集观测于2021年3月-2021年10月的常见水华发生期进行,于每月中旬进行采样(7月份受疫情影响未采样),在方便水库设置5个观测点,以代表不同库区(图 1). 每个观测点在现场利用多参数水质仪(Horiba,U-50)原位测定水温(Tem)、溶解氧(DO)、pH、电导率(EC)、氧化还原电位(ORP)等环境因子. 通过赛氏盘(Secchi Disk)对透明度(SD)进行测定. 一部分水样直接分装于200 mL塑料瓶中,用于测定总氮、总磷、高锰酸盐指数等指标. 浮游植物样品的采集使用采水器采集表层(水下30 cm)、中层(50 % 水深)和底层(底泥上30 cm)混合样品500 mL,用5 % 的鲁哥溶液固定保存.
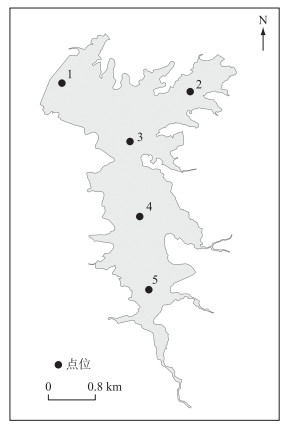
|
图 1 方便水库调查采样点位分布 Fig.1 Distribution of sampling sites in Fangbian Reservoir |
水样的高锰酸盐指数、总氮、总磷的测定方法同上. 浮游植物样品静置24 h后吸去上清液,最后根据藻细胞数浓缩至10~30 mL,分析时取均匀样品0.1 mL,在光学显微镜下鉴定计数,每个样品计数两片取其平均值. 生物量则根据藻类的平均体积与密度乘积计算,其中藻类平均体积根据目微尺实测藻体大小,根据藻类的形状,使用相应的体积公式计算,藻类密度按1 g/cm3计算.
1.5 数据分析与统计为阐明方便水库水体环境的长尺度变化过程以及影响浮游植物群落变化的主要驱动因子,本研究利用趋势分析和排序分析两种方法对数据进行了分析,为保证分析数据的分布正态性和方差齐性,分析前对数据进行了对数转换,其中在排序分析过程中,由于存在部分零值数据,因此对数转换过程中进行了加值处理,这一处理对分析结果的影响有限[10].
变化趋势分析:长尺度变化趋势采用广义加性混合模型(GAMM)进行分析,GAMM模型由于整合了非线性拟合和随机变量,因此其解释能力和预测能力较一般模型更有优势,另外,该模型方法通过对模拟拟合曲线进行求导,利用各时间点导数与零的显著性差异来确认显著性,因此该方法的显著性具有时间的分段性,可以确定显著变化发生的时段,该分析在R语言平台上利用mgcv和ggplot2程序包完成[11-12].
排序分析:排序分析是进行物种组成与环境变量关系分析的重要方法,本研究分析过程中,采用Canoco for Windows 5软件对物种数据进行DCA分析,由于第一排序轴的梯度长度小于3,因此对浮游植物群落组成数据和环境数据进行冗余分析(RDA). 浮游植物生物量数据矩阵经过lg(x+0.0001) 转换,环境因子数据除pH外全部进行lg(x+1)转换. 利用前向选择法对环境因子进行筛选,最终结果仅显示有显著贡献的环境因子. RDA分析结果用浮游植物组成-环境因子关系的双序图表示,图中环境因子用带有箭头的线段表示,向量长短表示其在主轴中的作用,线段所处象限代表环境因子与排序轴间的正负关系[13].
2 结果 2.1 水质长期变化根据2006—2020年总磷的监测结果分析发现,方便水库总磷浓度总体呈现下降的趋势,整体总磷浓度在0.05 mg/L以下,但是年际间波动显著,部分时段总磷浓度明显增高. 根据GAMM模型分析发现,2016年以前总磷浓度并无显著变化趋势,但是2016年8月异常增高后,2016—2019年总磷浓度呈现显著的下降趋势. 2006—2020年方便水库总氮浓度呈现显著的下降趋势,2018年以前部分月份总氮浓度高于1 mg/L,2018年以后,总氮浓度整体低于1 mg/L. 2006—2020年方便水库氨氮浓度整体呈现显著下降的趋势. 近几年中,2016—2017年氨氮浓度较高,约为0.3 mg/L,但是进入2019—2020年时段,氨氮浓度水平降至0.1 mg/L以下. 2006—2020年方便水库高锰酸盐指数水平整体呈现显著下降的趋势,其中2020年以前高锰酸盐指数平稳下降,但2020年略有升高. 2009—2020年方便水库叶绿素a浓度整体呈现显著上升的趋势,叶绿素a浓度多年均值约为5.58 μg/L,仅在2014—2016年夏季叶绿素a浓度水平明显偏高于多年平均值(图 2).
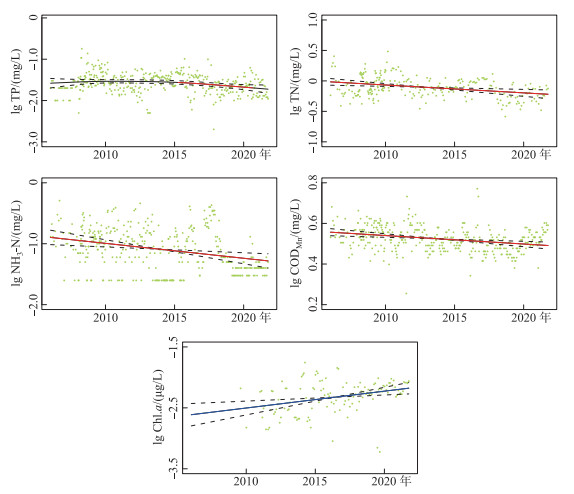
|
图 2 方便水库2006—2020年总磷、总氮、氨氮、高锰酸盐指数和叶绿素a的变化趋势(黑色实线为GAMM模型回归线,红色实线表示显著降低,蓝色实线表示显著升高,黑色虚线为95 % 置信区间) Fig.2 The trend of total phosphorus, total nitrogen, ammonia nitrogen, CODMn and chlorophyll-a in Fangbian Reservoir from 2006 to 2020 (The black solid line represents regression fitted with GAMM method, the red solid lines indicate the significant decreases, the blue solid line indicates the significant increases, and the black dotted lines are the approximate 95% confidence intervals on the fitted function) |
根据方便水库3—10月的逐月调查结果,方便水库各水质指标见表 1. 其中总磷平均浓度为0.031 mg/L,总氮平均浓度为0.62 mg/L,高锰酸盐指数平均值为3.94 mg/L. 在时间尺度上,3—10月除温度外,其余指标均呈现波动变化,无明显的趋势. 在空间尺度上,5号点的总氮、总磷和高锰酸盐指数均高于其他点位.
| 表 1 方便水库2021年3—10月水质 Tab. 1 Environmental variables summarised as the mean values, minimum values and maximum values in Fangbian Reservoir from March to October of 2021 |
2021年3—10月的逐月调查共鉴定出浮游植物7门50属,其中绿藻种类最多,21属,占总数的42 %; 其次为硅藻,11属,占总数的22 %; 再次为蓝藻,9属,占总数的18 %; 裸藻为6属,占比为12 %; 甲藻和隐藻各1属,占比为2 %. 根据藻类相对生物量,3月以硅藻为主要优势类群,4和5月隐藻的比例逐渐增加,6月以后蓝藻逐渐呈现优势,9月达到蓝藻的最大相对生物量,10月份浮游植物组成又渐趋向于多样化(图 3).

|
图 3 方便水库2021年3—10月各点位不同藻类的生物量及相对生物量 Fig.3 The biomass and proportion of phytoplankton in Fangbian Reservoir from March to October of 2021 |
2021年3—10月方便水库浮游植物生物量平均值为1.86 mg/L,处于相对较低的水平,其中3—5月浮游植物生物量仅为0.79 mg/L,9月生物量最高,平均值为4.79 mg/L. 在时间趋势上,3—5月为浮游植物生物量较低的时期,6月开始升高,在9月达到生物量峰值,而后10月再次降低. 而就不同门类而言,蓝藻门浮游植物生物量的增加与降低是整体浮游植物生物量变化的主要贡献量. 其中蓝藻门的优势类群为水华长孢藻(Dolichospermum flos-aquae)和阿氏浮丝藻(Planktothrix agardhii),长孢藻在4月的4号点位就开始生长,5月的1号点位也有较高占比,6月在多个点位中均较多,8—9月方便水库中出现长孢藻和浮丝藻共同为蓝藻优势的状况,但是其整体生物量仍较低,未观测到蓝藻水华的出现. 铜绿微囊藻(Microcystis aeruginosa)作为常见的水华蓝藻在方便水库中的生物量较低.
2.3 浮游植物组成变化的驱动因子根据浮游植物组成与环境因素的排序分析可以发现,第1~4个排序轴可以解释物种分布和变化的83.00 %,其中第1轴解释率为43.11 %,温度、氧化还原电位、高锰酸盐指数和透明度是第1轴的主要解释变量(图 4). 根据排序结果,优势浮游植物生物量与第1轴的主要环境变量间均具有较好的正相关关系.
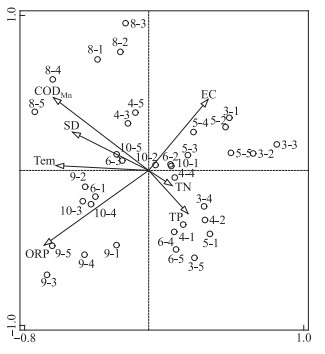
|
图 4 方便水库浮游植物与环境变量的RDA排序图(标号表示月份-点位. EC:电导率; CODMn:高锰酸盐指数; SD:透明度; Tem:水温; ORP:氧化还原电位; TP:总磷; TN:总氮. 下同) Fig.4 The RDA ordination plot of phytoplankton in Fangbian Reservoir (The labels indicate month and site. EC, conductivity; CODMn, permanganate index; SD, transparency; Tem, water temperature; ORP, oxidation-reduction potential; TP, total phosphorus; TN, total nitrogen. The same below) |
浮游植物的优势蓝藻类群中,长孢藻与氧化还原电位(R2=0.40,P=0.02)、水体温度(R2=0.34,P=0.05)、透明度(R2=0.24,P=0.04)具有明显的正相关关系,其中与氧化还原电位的相关性最高. 浮丝藻与水体温度(R2=0.46,P=0.03)、高锰酸盐指数(R2=0.36,P=0.01)、氧化还原电位(R2=0.32,P=0.01)呈现明显的正相关关系,其中与水体温度的相关性最高. 两种优势蓝藻生物量均与总磷和电导率呈负相关,但是相关性较弱(R2 < 0.20,图 5).
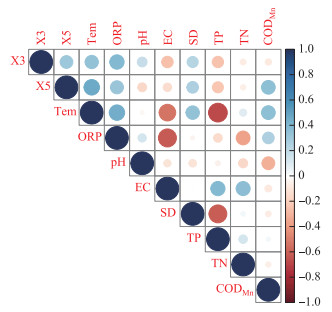
|
图 5 方便水库长孢藻(X3)和浮丝藻(X5)与环境变量的相关关系 Fig.5 The relationship between dominant cyanobacteria (Dolichospermum (X3) and Planktonthrix (X5)) and environmental variables in Fanbian Reservoir |
本研究发现方便水库中优势的水华蓝藻为长孢藻和浮丝藻,这是两种常见的丝状水华蓝藻[14],其中长孢藻生物量在春末夏初出现峰值,浮丝藻在夏季达到生物量峰值,因此两个属的藻在时间上呈现先长孢藻后浮丝藻的演替过程. 水华蓝藻微囊藻在方便水库中的生物量较低,且该水库中磷浓度较低,由于微囊藻对于磷有较高需求[15],因此其在方便水库形成水华的风险较低. 2016和2017年方便水库偶发性水华主要出现在8月,且前期鉴定为丝状蓝藻,因此可以推定两次偶发性蓝藻水华优势类群应为对高温具有更好适应性的浮丝藻.
浮丝藻是一类常见的无异形胞丝状水华蓝藻,在全球多地的湖泊和水库中均有发现,由于其可以产生微囊藻毒素、海兔毒素、鱼腥藻毒素-a以及贝类麻痹性毒素等,所以被供水部门广泛关注[16-17]. 我国对水华蓝藻的研究多集中于微囊藻,其他水华蓝藻的研究相对较少,目前我国已报道记录的浮丝藻有3种,其中两种为西藏早期采样发现种类(隐鞘浮丝藻(Planktothrix cryptovaginata)和多育浮丝藻(Planktothrix prolifica))[18],仅阿氏浮丝藻(Planktothrix agardhii)一种为常见的水华蓝藻,但是关于其生理特性的研究相对较少. 在我国已报道的浮丝藻水华中,已发现其可以混合于微囊藻水华中,亦可单独占据优势形成蓝藻水华[19]. 根据RDA排序结果,在浮丝藻占据优势的8和9月,温度、高锰酸盐指数、氧化还原电位和透明度与浮游植物的组成具有明显的正相关关系,表明浮丝藻对高温、高可利用光条件的偏好,这与已有的研究结果相一致. 不同研究测定的浮丝藻最优生长温度不尽相同,有的研究认为约为25℃[20],也有的研究认为在30℃以上[21],本研究观察到浮丝藻优势的月份,水温均在30℃以上,2016和2017年的水华发生期间水温超过33℃,可见方便水库中浮丝藻的偏好温度更高. 而且随着温度升高,浮丝藻生长速率对光照强度增加的响应更为强烈,生长速率增加的幅度更大,表明浮丝藻对高温和高光环境具有更好的适应性. 另外,浮丝藻也偏好于较高的高锰酸盐指数和氧化还原电位. 我们前期研究发现,氧化还原电位的变化会改变细胞形态、酯酶活性以及叶绿素荧光强度,从而影响栅藻和微囊藻的生长竞争[22]; 国外的研究表明,氧化还原电位的变化会改变水体中的有效电子供体数量,从而影响藻细胞体内的电子传递以及二氧化碳对RUBISCO酶活性的竞争,进而影响藻类的生长; 高锰酸盐指数反映了水体中有机和无机可氧化物质的量,其与氧化还原电位以及水体有机碳含量均具有一定的相关性[23-24]. 因此,浮丝藻对这两个因子的响应可能与该种藻类对于碳源利用或转化的机制有关,但是具体机制仍不清楚,有待深入研究.
长孢藻亦是一类常见的固氮水华蓝藻,分布较广,在太湖和巢湖等大型水体中均有分布,甚至占据绝对优势地位,如巢湖[25]. 长孢藻可以通过温度生态位和固氮两种方式占据优势,在低温条件下,长孢藻可以依靠温度生态位的优势形成水华. 长孢藻在室内理想条件下的最优生长温度范围为28~32℃[26],但是其温度适应范围较宽,且部分种类在低温条件下仍有较高的生长速率,因此,长孢藻常常在与高温适应类群(如微囊藻)的竞争中,通过低温的生态位优势占据优势地位,形成长孢藻水华. 而在氮限制的条件下,即使在夏季高温时,长孢藻依然可以利用固氮作用形成水华[9],但是长孢藻的固氮过程需要更多的能量支撑,因此在氮缺乏的环境中,长孢藻的优势维持需要较好的水下可利用光条件,以提供足够的能量[27]. 微囊藻在方便水库中的生物量较低,温度和磷是微囊藻生物量变化的主要驱动因素,微囊藻对磷浓度变化的正向快速响应和高效利用是其能够维持生物量优势的主要策略[15],由于目前方便水库中磷浓度较低,因此微囊藻在该水库中属于低风险物种.
通过长序列数据分析,未发现叶绿素a浓度与总氮和总磷浓度具有显著的相关性,这与一般认为的二者具有正相关的结果不一致. 产生这一结果的原因可能有3方面:首先,野外环境中藻类的生长通常是多种因素共同作用的结果,这不同于室内的理想状况; 其次,在方便水库这个营养盐偏低的水体中,藻类组成多样化,水华藻类生物量通常呈现有限的增长状态,如2021年浮游植物生物量平均值为1.86 mg/L,最高为4.79 mg/L,水体中的营养盐梯度和藻类生物量梯度均较小,在有限的梯度范围内,测量误差或系统误差造成的测量值波动将被放大,导致相关性分析过程的不确定性增加; 最后,对于丝状蓝藻自身生理特性而言,其本身生长速率对营养盐的响应明显低于群体性的水华蓝藻,如微囊藻[9, 28-29]. 因此,该调查结果不能否认营养盐对于方便水库蓝藻水华的贡献,仅体现了寡—中营养水体偶发性水华蓝藻规律上的不确定性. 相反,根据2016和2017年蓝藻水华的案例分析,多点位的监测结果显示,库区的总磷浓度达到0.068 mg/L,高出平均总磷浓度的2.2倍,这个总磷浓度已经满足水华形成的营养盐浓度需求,而总氮浓度仅为0.86 mg/L,尚处于氮限制的浓度范围,表明高总磷浓度可能是浮丝藻水华发生的必要条件,而氮则是非必要条件[30]. 已有的研究表明,浮丝藻水华的发生通常发生在磷相对充足,而氮相对受限的水体环境中[31],这与方便水库的情况相一致. 另外,也有研究表明,浮丝藻的生物量与磷酸根离子具有很好的相关性,只有磷酸根离子浓度低于0.019~0.029 mg/L时,浮丝藻的生物量才会出现显著的下降,且这个下降过程通常会持续1~3个月,具体时间视浮丝藻细胞浓度而呈现差异[4]. 方便水库的总磷浓度处于这个阈值上下浮动,因此夏季温度合适的时候通常会发现浮丝藻为优势类群,但是近年来方便水库的总磷浓度没有继续升高,反而呈现下降的趋势,因此这有利于浮丝藻水华的控制. 氨氮水平是影响浮丝藻生物量变化的另一个因素,浮丝藻的快速生长会导致水体中氨氮水平的显著下降,使得浮丝藻生物量与氨氮浓度通常呈现负相关,但是水体中氨氮的脉冲式补充会明显的提升浮丝藻的生物量维持时间.
已有的研究报道显示,国际上众多湖泊中均出现过浮丝藻水华,如法国的布尔热湖(Lake Bourget)[32],瑞士的苏黎世湖(Lake Zürich)[33]、德国的施特希林(Lake Stechlin)[34]等,这些湖泊中浮丝藻水华的出现均是在寡营养化过程中,由于水体透明度提升,水下可利用光增加,而导致浮丝藻形成蓝藻水华[32]. 这与方便水库不同,这些湖泊是营养水平下降过程中出现浮丝藻水华,期间营养盐的供应相对充足,而方便水库的营养盐水平始终处于较低水平,因此方便水库浮丝藻水华首要的触发条件是营养盐水平的升高. 方便水库营养盐水平的升高与流域内降水具有直接关系,溧水地区2015和2016年连续两年降雨量远超该地区平均降雨量1080 mm(1957—2020年均值,数据来源于国家气象中心),较大的降雨量导致入库污染负荷增加,短期内提升了库区水体的营养盐浓度,尤其是总磷浓度,为蓝藻水华的发生提供了物质基础. 已有的研究表明,寡营养水体中蓝藻更易受营养补充的影响,而中营养水体中蓝藻主要受温度影响,富营养水体中蓝藻受营养和温度的联合作用[35]. 因此对于偏寡营养水体的方便水库,其更易受流域入库污染的脉冲式补充影响,而当营养提升后,又受温度驱动. 2016和2017年夏季高温天气,水华期间平均水温超过33℃,为适应高温的浮丝藻提供更好的温度环境,多种有利环境条件的叠加,导致了方便水库偶发性的蓝藻水华.
| [1] |
Pomati F, Matthews B, Jokela J et al. Effects of re-oligotrophication and climate warming on plankton richness and community stability in a deep mesotrophic lake. Oikos, 2012, 121(8): 1317-1327. DOI:10.1111/j.1600-0706.2011.20055.x |
| [2] |
Reynolds CS. Cyanobacterial water-blooms. Advances in Botanical Research, 1987, 13: 67-143. DOI:10.1016/S0065-2296(08)60341-9 |
| [3] |
Dokulil M, Teubner K. Cyanobacterial dominance in lakes. Hydrobiologia, 2000, 438: 1-12. DOI:10.1023/A%3A1004155810302 |
| [4] |
Reinl KL, Brookes JD, Carey CC et al. Cyanobacterial blooms in oligotrophic lakes: Shifting the high-nutrient paradigm. Freshwater Biology, 2021, 66(9): 1846-1859. DOI:10.1111/fwb.13791 |
| [5] |
Cottingham KL, Weathers KC, Ewing HA et al. Predicting the effects of climate change on freshwater cyanobacterial blooms requires consideration of the complete cyanobacterial life cycle. Journal of Plankton Research, 2020, 43(1): 10-19. DOI:10.1093/plankt/fbaa059 |
| [6] |
Senerpont Domis LN, Mooij WM, Huisman J. Climate-induced shifts in an experimental phytoplankton community: A mechanistic approach. Hydrobiologia, 2007, 584(1): 403-413. DOI:10.1007/s10750-007-0609-6 |
| [7] |
Cottingham KL, Ewing HA, Greer ML et al. Cyanobacteria as biological drivers of lake nitrogen and phosphorus cycling. Ecosphere, 2015, 6(1): 1-19. DOI:10.1890/es14-00174.1 |
| [8] |
Scheffer M, Rinaldi S, Gragnani A et al. On the dominance of filamentous cyanobacteria in shallow, turbid lakes. Ecology, 1997, 78(1): 272-282. DOI:10.1890/0012-9658(1997)078[0272:otdofc]2.0.co;2 |
| [9] |
Zhang M, Shi XL, Yang Z et al. Characteristics and driving factors of the long-term shifts between Microcystis and Dolichospermum in Lake Taihu and Lake Chaohu. J Lake Sci, 2021, 33(4): 1051-1061. [张民, 史小丽, 阳振等. 太湖和巢湖中微囊藻(Microcystis)与长孢藻(Dolichospermum)的长时序变化及其驱动因子. 湖泊科学, 2021, 33(4): 1051-1061. DOI:10.18307/2021.0408] |
| [10] |
Leps J, Smilauer P. Multivariate analysis of ecological data using CANOCO. Cambridge: Cambridge University Press, 2003.
|
| [11] |
Wickham H. ggplot2: elegant graphics for data analysis. Springer Science & Business Media, 2009. |
| [12] |
Wood S. Themgcv package. www. r-project. org, 2007.
|
| [13] |
TerBraak CJF, Smilauer P. Canoco for windows version 4.5. Wageningen: Centre for Biometry Wageningen, 2002. |
| [14] |
Paerl HW, Fulton RS. Ecology of harmful cyanobacteria. In: Granéli E, Turner JT eds. Ecology of Harmful Algae. Heidelberg: Springer Berlin, 2006: 95-109.
|
| [15] |
Wan LL, Chen XY, Deng QH et al. Phosphorus strategy in bloom-forming cyanobacteria (Dolichospermum and Microcystis) and its role in their succession. Harmful Algae, 2019, 84: 46-55. DOI:10.1016/j.hal.2019.02.007 |
| [16] |
Gong XM, Hu HJ, Li YG et al. Studies on the life cycle and ultrastructure characteristics of Planktonema. Journal of Wuhan Botanical Research, 1996, 14(3): 193-198. [龚小敏, 胡鸿钧, 李夜光等. 浮丝藻生活史及其亚显微结构特征的研究. 武汉植物学研究, 1996, 14(3): 193-198.] |
| [17] |
Lin S, Wu ZX, Yu GL et al. Genetic diversity and molecular phylogeny of Planktothrix (Oscillatoriales, cyanobacteria) strains from China. Harmful Algae, 2010, 9(1): 87-97. DOI:10.1016/j.hal.2009.08.004 |
| [18] |
Li R, Wei Y, Shi Z. The algae of the Xizang Plateau. Beijing: Science Press, 1992. [李尧英, 魏印心, 施之新等. 西藏藻类. 北京: 科学出版社, 1992.]
|
| [19] |
Lin S, Peng X, Wu ZX et al. Physiological characteristics of Planktothrix agardhii—A new taxa of bloom cyanophyta in China. J Lake Sci, 2008, 20(4): 437-442. [林燊, 彭欣, 吴忠兴等. 我国水华蓝藻的新类群——阿氏浮丝藻(Planktothrix agardhii)生理特性. 湖泊科学, 2008, 20(4): 437-442. DOI:10.18307/2008.0405] |
| [20] |
Oberhaus L, Briand JF, Leboulanger C et al. Comparative effects of the quality and quantity of light and temperature on the growth of Planktothrix agardhii and P. rubescens. Journal of Phycology, 2007, 43(6): 1191-1199. DOI:10.1111/j.1529-8817.2007.00414.x |
| [21] |
Foy RH, Gibson CE, Smith RV. The influence of daylength, light intensity and temperature on the growth rates of planktonic blue-green algae. British Phycological Journal, 1976, 11(2): 151-163. DOI:10.1080/00071617600650181 |
| [22] |
Zhang M, Kong FX, Shi XL et al. Responses of Microcystis aeruginosa to reducing oxidation reduction potential under competition growth condition. J Lake Sci, 2007, 19(2): 118-124. [张民, 孔繁翔, 史小丽等. 铜绿微囊藻在竞争生长条件下对氧化还原电位降低的响应. 湖泊科学, 2007, 19(2): 118-124. DOI:10.18307/2007.0202] |
| [23] |
Sen CK, Packer L. Antioxidant and redox regulation of gene transcription. FASEB Journal, 1996, 10(7): 709-720. DOI:10.1096/fasebj.10.7.8635688 |
| [24] |
Koblížek M, Komenda J, Masojídek J et al. Cell aggregation of the cyanobacterium Synechococcus elongatus: Role of the electron transport chain. Journal of Phycology, 2000, 36(4): 662-668. DOI:10.1046/j.1529-8817.2000.99030.x |
| [25] |
Zhang M, Zhang YC, Yang Z et al. Spatial and seasonal shifts in bloom-forming cyanobacteria in Lake Chaohu: Patterns and driving factors. Phycological Research, 2016, 64(1): 44-55. DOI:10.1111/pre.12112 |
| [26] |
Nalewajko C, Murphy TP. Effects of temperature, and availability of nitrogen and phosphorus on the abundance of Anabaena and Microcystis in Lake Biwa, Japan: An experimental approach. Limnology, 2001, 2(1): 45-48. DOI:10.1007/s102010170015 |
| [27] |
Paerl HW, Xu H, Hall NS et al. Controlling cyanobacterial blooms in hypertrophic Lake Taihu, China: Will nitrogen reductions cause replacement of non-N2 fixing by N2 fixing taxa?. PLoS One, 2014, 9(11): e113123. DOI:10.1371/journal.pone.0113123 |
| [28] |
Rücker J, Wiedner C, Zippel P. Factors controlling the dominance of Planktothrix agardhii and Limnothrix redekei in eutrophic shallow lakes. Hydrobiologia, 1997, 342/343: 107-115. DOI:10.1023/A:1017013208039 |
| [29] |
Wang XL. The spatial and temporal turnover between Microcystis and Dolichospermum in Lake Chaohu[Dissertation]. Yangzhou: Yangzhou University, 2017. [王徐林, 巢湖微囊藻和鱼腥藻时空转换机制研究[学位论文]. 扬州: 扬州大学, 2017. ]
|
| [30] |
Guildford SJ, Hecky RE. Total nitrogen, total phosphorus, and nutrient limitation in lakes and oceans: Is there a common relationship?. Limnology and Oceanography, 2000, 45(6): 1213-1223. DOI:10.4319/lo.2000.45.6.1213 |
| [31] |
Davis TW, Bullerjahn GS, Tuttle T et al. Effects of increasing nitrogen and phosphorus concentrations on phytoplankton community growth and toxicity during Planktothrix blooms in Sandusky Bay, Lake Erie. Environmental Science & Technology, 2015, 49(12): 7197-7207. DOI:10.1021/acs.est.5b00799 |
| [32] |
Jacquet S, Briand JF, Leboulanger C et al. The proliferation of the toxic cyanobacterium Planktothrix rubescens following restoration of the largest natural French Lake (Lac du Bourget). Harmful Algae, 2005, 4(4): 651-672. DOI:10.1016/j.hal.2003.12.006 |
| [33] |
Walsby AE, Schanz F. Light-dependent growth rate determines changes in the population of Planktothrix rubescens over the annual cycle in Lake Zürich, Switzerland. New Phytologist, 2002, 154(3): 671-687. DOI:10.1046/j.1469-8137.2002.00401.x |
| [34] |
Selmeczy GB, Tapolczai K, Casper P et al. Spatial-and niche segregation of DCM-forming cyanobacteria in Lake Stechlin (Germany). Hydrobiologia, 2016, 764(1): 229-240. DOI:10.1007/s10750-015-2282-5 |
| [35] |
Rigosi A, Carey CC, Ibelings BW et al. The interaction between climate warming and eutrophication to promote cyanobacteria is dependent on trophic state and varies among taxa. Limnology and Oceanography, 2014, 59(1): 99-114. DOI:10.4319/lo.2014.59.1.0099 |
 2022, Vol. 34
2022, Vol. 34 

