(2: 河海大学水文水资源学院,南京 210024)
(3: 中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,南京 210008)
(4: 水利部南京水利水文自动化研究所,南京 210012)
(5: 常州市武进区水利局,常州 213115)
(2: College of Hydrology and Water Resources, Hohai University, Nanjing 210024, P.R.China)
(3: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P.R.China)
(4: Nanjing Institute of Water Conservancy and Hydrology Automation, Ministry of Water Resources, Nanjing 210012, P.R.China)
(5: Water Resources Bureau of Wujin District in Changzhou City, Changzhou 213115, P.R.China)
近年来,随着污染控制力度与管理措施的加强,我国一些湖泊的氮磷浓度及比例已悄然发生变化[1]. 以太湖为例,Qin等[1]研究发现全湖水体总氮浓度在2007—2019年之间下降了约27%,而水体总磷浓度自2015年以来出现明显波动上升态势,导致水体氮磷比下降了约35%. 水体颗粒态磷(PP)约占水体总磷的69%,是影响水体总磷季节变化和年际变化的主要成分之一[2]. 夏季藻华期间,升温和溶解氧下降等因素加快了水体微生物反硝化脱氮速率,导致藻细胞处于低氮磷比环境[3]. 已有研究表明,氮磷比变化能显著影响藻类的营养摄取与分配[4-5]. 因此,氮磷比下降可能会对藻体颗粒态磷产生潜在影响.
一般认为,藻细胞对磷的吸收和利用过程包括胞外聚合物(EPS)吸附、富集和跨膜运输后被藻细胞利用[6-7]. 一些藻类不仅能在胞内储存磷,还能在胞外富集大量磷元素,且藻体胞外磷(EPS-P)的富集与EPS分泌密切相关[7]. 研究发现,氮浓度变化显著影响了藻细胞EPS分泌[8-9]. 例如,Duan等[10]发现,随着氮浓度降低,微囊藻EPS含量增加一倍,从3.9 pg/cell提高到7.9 pg/cell. De Philippis等[11]也发现,在氮限制条件下,蓝藻细胞EPS含量增加了2.2倍. 因此,氮浓度变化可能改变藻细胞EPS分泌,影响藻细胞磷的赋存及分配模式. 此外,氮浓度变化还影响藻细胞核酸、蛋白质等生物大分子的合成,影响藻细胞对磷元素的需求[12-13]. 然而,已有较多研究关注不同氮浓度对藻类生长和EPS产量的响应[10-13],对于氮浓度变化如何影响藻类磷元素赋存及分配的探究较少,特别是缺少EPS分泌与细胞磷赋存及分配定量关系的研究.
水体颗粒态磷包含可交换态活性磷、弱结合态磷、铁铝结合态磷、钙结合态磷和有机磷等形态. 藻细胞能够快速吸收水中的可交换态活性磷,还具有“过量”储存磷的能力[14-15]. 铁铝结合态磷具有潜在生物可利用性[16]. 在一定条件下,铁铝结合态磷是藻细胞磷元素的主要来源[17]. 相比而言,钙结合态磷较稳定,不易被藻类吸收利用[18]. 已有研究主要关注不同形态磷的释放风险和生物可利用性,但缺乏藻体磷形态、含量及分配模式的深入研究.
本研究选取太湖常见的微囊藻和栅藻,在不同氮磷比条件下培养,分析藻体磷赋存及分配模式的变化,探究EPS对磷赋存与分配的影响. 由于在野外微囊藻多以群体形态存在[10],本研究也选取了一株从太湖分离的群体微囊藻(Microcystis sp.)进行实验. 同时,参考并改进不同形态磷的连续分级提取法[15],分析在低氮磷比和高氮磷比条件下,群体微囊藻不同形态磷的含量及分布,揭示氮磷比对藻体磷赋存及分配的影响,为探究太湖水体总磷波动原因提供依据与借鉴.
1 材料与方法 1.1 实验藻种本研究采用的群体微囊藻(Microcystis sp.),藻株由Duan等[10]在2016年从太湖梅梁湾分离纯化获得.自分离以来,该藻株在5年多时间内一直维持群体形态,且附生菌含量低[10]. 斜生栅藻(S. obliquus,FACHB-416)和单细胞微囊藻(铜绿微囊藻M. aeruginosa,FACHB-469)购自中国科学院淡水藻种库.
1.2 培养条件采用BG-11培养基活化上述3种藻. 培养温度为25℃,光强为45 μmol/(m2·s),光暗周期为12 h ∶12 h. 活化培养至对数期,再分别将其转接到不同氮磷比的BG-11培养基中,初始接种时的细胞浓度均为1×105 cells/mL. 参考Redfield定律,设置改良BG-11培养基中的氮磷浓度和比例. Redfield定律指出藻细胞的碳氮磷摩尔比为106 ∶16 ∶1,这也是藻类生长的最佳营养比例. 蓝藻生长适宜的氮磷比为10 ∶1~16 ∶1[19],当氮磷比低于10 ∶1且其它条件适宜时,氮元素会成为限制因子[20-21]. 因此,本研究设置N ∶P=20作为高氮磷比组(初始氮浓度为84 mg/L),设置N ∶P=2作为低氮磷比组(初始氮浓度为8.4 mg/L),两组的初始磷浓度均为9.3 mg/L. 在批次培养中,监测藻细胞浓度变化,当3种藻的生长曲线均进入稳定期初期时,收获藻细胞,分析生理生化指标,包括测定光合活性、色素含量、EPS含量和各组分磷含量. 以上每个处理设置3个平行.
1.3 细胞浓度、比生长速率和群体形态分析采用分光光度计(岛津UV-2450,日本)测定藻细胞浓度,监测藻细胞生长. 首先分别在687、683、750 nm建立斜生栅藻、单细胞微囊藻和群体微囊藻的藻悬液吸光度与细胞浓度之间的标准曲线[22],两者呈现良好的线性关系,R2值分别为0.999(斜生栅藻)、0.998(单细胞微囊藻)和0.999(群体微囊藻). 群体微囊藻的细胞浓度测定时需首先将群体分散为单细胞. 具体操作方法为[23]:取2 mL群体微囊藻悬液,超声处理30 s(35 kHz,0.013 W/cm3),然后采用去离子水稀释10倍,摇匀制备藻悬液,在750 nm测定吸光度,绘制标准曲线. 当比生长速率接近零时,被认定达到稳定期初期. 通过计算比生长速率,可以准确判断藻类生长曲线是否到达稳定期初期. 具体参考以下公式[24]:
| μ=(lnNt−lnN0)/Δt | (1) |
式中,N0为藻细胞初始浓度(cells/mL),Nt为培养t天后的藻细胞浓度(cells/mL),Δt为样品采集时间间隔(d).
通过显微拍照法(AxioCam ICc3,德国卡尔·蔡司)记录群体微囊藻的形态变化.
1.4 EPS的提取与形态结构观察 1.4.1 EPS的提取与测定参考文献[25],采用热硼酸法高效无损地提取藻细胞EPS. 具体方法为:取35 mL藻悬液5000转/min离心10 min,去除上清液,收集藻细胞; 加入35 mL硼酸缓冲液(0.49 mmol/L H3BO3、0.2 mmol/L Na2B4O7 ·10H2O和85.6 mmol/L NaCl的混合溶液,pH=8.5),摇匀后,65℃水浴加热30 min. 其间,每隔10 min摇匀一次. 水浴结束后,取出冷却至室温,11000转/min低温(4℃)离心15 min,吸取清液,用玻璃纤维滤膜过滤(0.45 μm,上海新亚),测定滤液中的总有机碳(TOC)含量(TOC-VCPN,日本岛津),用来表征EPS含量[23]. 同时采用预先酸洗(1% HCl溶液)并干燥后的0.45 μm玻璃纤维滤膜,过滤收集藻细胞沉淀,用于测定细胞内的磷含量(INT-P).
1.4.2 EPS形态结构观察取群体微囊藻样品冻干24 h(LGJ-12冻干机,北京松源),采用扫描电镜(ZEISS EVO18,德国卡尔·蔡司),通过SE1检测器记录群体微囊藻的EPS形态(电压20 kV,工作距离8.5 mm,放大1000~5000倍).
1.5 藻细胞磷含量与分布的测定采用预先酸洗(1% HCl溶液)并干燥后的0.45 μm玻璃纤维滤膜,过滤35 mL藻液收集藻细胞用于藻体磷含量(CTP)测定,通过钼蓝比色法[26]测定CTP和INT-P含量. 将CTP含量减去INT-P含量得到藻体胞外磷(EPS-P)含量.
1.6 叶绿素a含量及荧光参数测定 1.6.1 叶绿素a的提取与测定参照《水和废水监测分析方法》[27]测定和计算叶绿素a含量. 具体方法为:取5 mL藻液,用0.45 μm玻璃纤维滤膜过滤,将滤膜放入10 mL离心管,加入5 mL的90% 丙酮溶液,完全浸入并在4℃黑暗静置24 h后,3000转/min离心10 min,吸取上清液,通过比色法测定叶绿素a含量.
1.6.2 叶绿素a荧光与JIP-test分析取2 mL藻液,经15 min暗适应后,采用叶绿素荧光仪(AquaPen-C100,捷克)记录叶绿素a荧光动力学曲线并进行JIP-test分析[28-29].
1.7 群体微囊藻细胞磷的分级提取与测定参考并改进Wu等[15]不同形态磷的连续分级提取法,提取群体微囊藻的各形态磷. 具体步骤为:(1)可交换态活性磷(NH4Cl-P)的提取:采用0.45 μm玻璃纤维滤膜过滤35 mL藻液,收集群体微囊藻,按1.4.1节的方法提取EPS后,将所获样品置入离心管,加入35 mL 1.0 mol/L NH4Cl溶液,调节pH=7,在25℃孵育2 h后离心(5000转/min,10 min),取上清液用比色法测定磷含量[26]. (2)铁铝结合态磷(Fe/Al-P)的提取:用0.05% NaCl溶液对步骤(1)中藻体沉淀冲洗2次后加入35 mL 0.1 mol/L NaOH溶液,25℃孵育16 h后离心(5000转/min,10 min),取上清液用比色法测定磷含量[26]. (3)钙结合态磷(Ca-P)的提取:用0.05% NaCl溶液对步骤(2)中藻细胞沉淀冲洗2次后加入35 mL 0.5 mol/L HCl溶液,25℃孵育16 h后离心(5000转/min,10 min),取上清液用比色法测定磷含量[26]. (4)残余磷(Residual-P)的提取:用0.05% NaCl溶液对步骤(3)中藻细胞沉淀冲洗2次后加入35 mL 1 mol/L H2SO4溶液,25℃孵育24 h后离心(5000转/min,10 min),取上清液用比色法测定磷含量[26].
1.8 数据分析采用Origin 2018整理数据并绘图; 采用SPSS 26.0进行单因素方差分析(One-way ANOVA),Tukey post-hoc检验进行多重比较分析,设定显著性水平为P < 0.05(*)和P < 0.01(* *).
2 结果 2.1 氮磷比对藻类生长的影响藻类比生长速率(μ)趋于零时,到达稳定期初期. 低氮磷比组的斜生栅藻和单细胞微囊藻在第14天到达稳定期初期,此时比生长速率分别为0.03和0.12 d-1(图 1A,B). 群体微囊藻在第12天到达稳定期初期,此时比生长速率为0.02 d-1(图 1C). 高氮磷比组的3种藻到达稳定期均较晚. 斜生栅藻在第24天到达稳定期初期,此时比生长速率为0.05 d-1(图 1A). 单细胞微囊藻在第24天到达稳定期初期,此时比生长速率为0.04 d-1(图 1B). 群体微囊藻在第28天到达稳定期初期,此时比生长速率为-0.01 d-1(图 1C). 此外,高氮磷比组的单细胞微囊藻和群体微囊藻的叶绿素a含量为4.0和5.8 pg/cell,分别是低氮磷比组的1.6和3.7倍(图 1D),而氮磷比对斜生栅藻的叶绿素a含量没有显著影响(P>0.05).
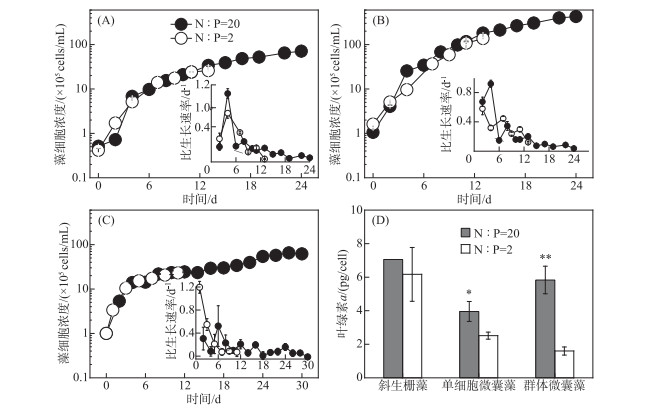
|
图 1 氮磷比对斜生栅藻(A)、单细胞微囊藻(B)和群体微囊藻(C)细胞浓度、比生长速率及叶绿素a含量(D)的影响(数据为平均值±标准方差(SD); *表示P < 0.05,* *表示P < 0.01) Fig.1 Effects of N ∶P ratio on cell concentrations and growth rate of S. obliquus (A), unicellular Microcystis (B) and colonial Microcystis (C) and changes in their chlorophyll-a contents (D) (* indicates P < 0.05, * * indicates P < 0.01) |
高氮磷比和低氮磷比组的斜生栅藻和微囊藻叶绿素a荧光均表现出典型的快速荧光动力学曲线(OJIP曲线). 相比而言,低氮磷比组藻类的荧光强度较弱,且氮磷比对最大荧光强度值(P点)的影响不显著(P>0.05)(图 2A,C,E).

|
图 2 氮磷比对斜生栅藻(A、B)、单细胞微囊藻(C、D)和群体微囊藻(E、F)叶绿素a快速荧光动力学曲线与JIP-test参数的影响(*表示P < 0.05,* *表示P < 0.01) Fig.2 Effects of N ∶P ratio on chlorophyll-a fast fluorescence kinetic curve and JIP-test parameters of S. obliquus (A, B), unicellular Microcystis (C, D) and colonial Microcystis (E, F) (* indicates P < 0.05, * * indicates P < 0.01) |
JIP-test参数中,低氮磷比组的斜生栅藻电子传递效率(ETo/TRo)比高氮磷比组高,而OJIP曲线初始斜率(Mo)和最大光量子产量(Fv/Fm)较低. 低氮磷比组的单细胞微囊藻和群体微囊藻ETo/TRo(单细胞微囊藻P < 0.05,群体微囊藻P < 0.01)和Fv/Fm值均较高(P < 0.05)(图 2B,D,F).
2.3 氮磷比对藻体胞内磷和胞外磷含量及分配模式的影响低氮磷比组斜生栅藻和群体微囊藻的EPS-P含量分别为0.82和0.31 pg/cell,均显著高于高氮磷比组(P < 0.05). 然而,氮磷比对单细胞微囊藻EPS-P含量无显著影响(P>0.05). 本研究中,3种藻细胞的INT-P含量占比均较低,且在低氮磷比和高氮磷比组间无显著差异(P>0.05)(图 3).
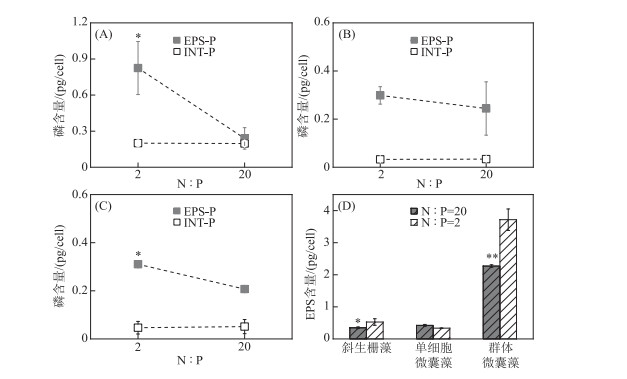
|
图 3 氮磷比对斜生栅藻(A)、单细胞微囊藻(B)和群体微囊藻(C) EPS-P、INT-P以及EPS含量(D)的影响(*表示P < 0.05,* *表示P < 0.01) Fig.3 Effects of N ∶P ratio on EPS-P and INT-P contents of S. obliquus(A), unicellular Microcystis(B), colonial Microcystis(C) and EPS contents(D) (* indicates P < 0.05, * * indicates P <0.01) |
EPS与EPS-P含量呈现类似规律,低氮磷比组的斜生栅藻和群体微囊藻EPS含量明显高于高氮磷比组(斜生栅藻P < 0.05,群体微囊藻P < 0.01). 然而,单细胞微囊藻EPS含量在高氮磷比和低氮磷比组间无显著差异(P>0.05).
2.4 氮磷比对群体微囊藻磷形态分布的影响群体微囊藻细胞磷以可交换态活性磷(NH4Cl-P)和铁铝结合态磷(Fe/Al-P)为主. 其中,低氮磷比组NH4Cl-P含量为0.265 pg/cell,约占藻体磷的75%,Fe/Al-P含量为0.085 pg/cell,约占藻体磷的24%. 然而,高氮磷比组的NH4Cl-P与Fe/Al-P含量分别为0.068和0.081 pg/cell,共占藻体磷的50% 左右(表 1).
| 表 1 氮磷比对藻体磷(CTP)、藻体胞内磷(INT-P)和藻体胞外磷(EPS-P)含量及形态分布占比的影响 Tab. 1 Effects of N ∶P ratio on CTP, INT-P and EPS-P contents and the distribution of phosphorus forms in colonial Microcystis |
此外,NH4Cl-P含量分别是低氮磷比组和高氮磷比组群体微囊藻EPS-P的87% 和55%,且低氮磷比组NH4Cl-P占比高. 而Fe/Al-P仅占EPS-P含量的13% ~43%. 相反,两组氮磷比条件下的群体微囊藻INT-P主要以Fe/Al-P形态存在,约占INT-P的80%,而NH4Cl-P仅占INT-P的17% ~20%.
2.5 氮磷比对微囊藻群体形态及其EPS结构的影响光学显微镜照片显示,高氮磷比组的群体微囊藻密实且硕大(图 4A),而低氮磷比组的群体微囊藻较松散(图 4D). 电子显微镜照片显示,高氮磷比组群体微囊藻的EPS呈膜状片层,包裹着藻细胞(图 4B,C),而低氮磷比组的群体微囊藻EPS呈疏松网状(图 4E,F).

|
图 4 高氮磷比组(A、B、C)与低氮磷比组(D、E、F)群体微囊藻及EPS的显微照片 Fig.4 Micrographs of colonial Microcystis and its EPS structures in the high (A, B, C) and low (D, E, F) N ∶P groups |
本研究发现,斜生栅藻和群体微囊藻磷含量(CTP,包括INT-P和EPS-P)在低氮磷比条件下显著增加(P < 0.05). 此时,斜生栅藻和群体微囊藻磷含量分别为1.06和0.36 pg/cell,是高氮磷比条件下藻体磷含量的2.7和1.4倍. 有研究表明,在氮浓度较低时,微囊藻细胞具有快速吸收无机磷的能力[30],藻体磷赋存量显著增加. 通过围隔实验得到进一步证实,当氮浓度较低时,蓝藻细胞大量吸收磷,藻体磷含量从初始的0.21 pg/cell增加到0.33 pg/cell[31]. Oliver和Ganf[12]认为,缺氮使藻细胞生长受限,磷元素消耗量随之减少,增加了藻体磷元素的积累. 本研究发现,低氮磷比改变了藻体磷的分配模式. 在低氮磷比条件下,藻体胞外磷(EPS-P)占藻体磷的80% ~90%,而藻体胞内磷仅占藻体磷的10% ~20%. 同时发现藻体胞内磷含量对氮磷比无显著响应(P>0.05),而斜生栅藻和群体微囊藻低氮磷比时的胞外磷含量显著升高(图 3A,C). 这表明,不同氮磷比对胞外磷含量的影响是藻体磷含量变化的主要原因. 本研究中,虽然低氮磷比时斜生栅藻与群体微囊藻磷含量变化趋势一致,但相关研究表明,夏季太湖暴发蓝藻水华主要为微囊藻群体,绿藻等其他藻类生物量相对较少[24]. 因此,斜生栅藻等绿藻对夏季太湖总磷波动影响较小.
不同形态磷的比例会影响藻类代谢与增殖,也会影响磷循环过程. 陈俊等[32]研究发现,藻体通过理化吸附和生物富集作用获得不同形态磷(主要是溶解性总磷和溶解性磷酸盐,分别占藻体磷含量的40% 和25%). 本研究发现,高氮磷比组和低氮磷比组的群体微囊藻含有大量可交换态活性磷和铁铝结合态磷,占藻体磷含量的90% 以上. 在藻体磷中,低氮磷比时的可交换态活性磷含量为0.264 pg/cell,占藻体磷含量的75% 以上,且显著高于高氮磷比时的可交换态活性磷含量(P < 0.05). 然而,在高氮磷比组和低氮磷比组的铁铝结合态磷无显著性差异(P>0.05),含量分别为0.071和0.085 pg/cell. 同时,氮磷比显著影响了各形态磷在藻体胞内和胞外的分布模式(表 1).
本研究还发现,可交换态活性磷为藻体胞外磷的主要组成部分,在低氮磷比时,其占比显著升高,这与EPS含量的变化规律一致(图 3D). 这表明,低氮磷比提升EPS含量,促进了藻体对可交换态活性磷的吸附和赋存. 然而,藻体胞内磷以铁铝结合态磷为主(表 1). 通常,铁铝结合态磷对氧化还原电位和pH较敏感[33]. 在氧化还原电位降低(或缺氧)时,底泥和无机颗粒中的铁铝结合态磷极易释放[34]. 相比而言,胞内铁铝结合态磷的释放规律有所不同,需藻细胞破裂后才能完全释放. 此外,藻体钙结合态磷通常处于稳定状态,在藻类生理代谢或环境变化时仅有少部分钙结合态磷转化或释放[32],对藻体磷贡献较小.
3.2 氮磷比对藻类光合活性的影响光合作用是藻类重要的同化过程,与碳、氮、磷代谢紧密关联. 氮浓度直接影响藻细胞叶绿素a含量[35]. 本研究发现,微囊藻在低氮磷比时的叶绿素a含量显著降低(图 1D). 前人研究表明,尽管反应中心叶绿素a含量降低,影响了组装完整PS II系统的能力和数量,但并不影响完整光系统的电子传输状态[36]. Walker等[35]也发现,叶绿素a含量减少并不会降低藻类光合效率. 本研究还发现,氮磷比对微囊藻Fv/Fm的影响较大(P < 0.05),Fv/Fm在低氮磷比组反而较高. 表明在低氮磷比组,藻细胞光系统II(PS II)的ETo/TRo并未受阻,反而加快了电子传递速率,提高了光合效率和糖类合成效率,促使EPS分泌. 这也是低氮磷比组群体微囊藻和斜生栅藻EPS含量增加的原因之一[8, 23].
3.3 氮磷比对EPS含量及形态结构的影响低氮磷比对斜生栅藻和群体微囊藻EPS含量具有显著促进作用(图 3D),更多的EPS分泌增加了藻体胞外磷的吸附和储存,导致其含量增加[37]. 这也可能是低氮磷比抑制了藻细胞生长,阻碍了糖类物质向其它生物大分子的转化,造成藻细胞碳元素相对过剩[38],胞内过量的糖类物质被分泌至胞外,增加了EPS含量[39]. Huang等[8]发现,氮限制使微囊藻生长速率快速下降,糖类向蛋白质的转化过程受阻,造成胞内糖类累积. 然而,由于自身合成和分泌EPS能力较弱,单细胞微囊藻EPS含量在高氮磷比和低氮磷比组间无显著差异(P>0.05),这或许是氮磷比对单细胞微囊藻胞外磷含量无显著影响的原因(图 3B). 相比而言,群体微囊藻的EPS含量均显著高于单细胞微囊藻[40],对氮磷比的响应也更加明显. 此外,胞外的糖类物质在微生物作用下极易腐殖化(humification)[41],进而与金属阳离子和磷酸根离子形成复合体,提高了EPS对磷的吸附与赋存能力. 微囊藻分泌的EPS也是附生菌的重要碳源[42]. 虽然自然水体中的藻类与细菌会相互粘附[43],附生菌因此也对藻体胞外磷总含量有贡献,但由于本研究中的群体微囊藻胞外磷主要为可交换态活性磷(表 1),并且本研究采用了分离纯化的群体微囊藻藻株,附生菌数量相对较少[10]. 所以,附生菌对本研究中胞外磷的贡献比较小.
氮磷比还会影响群体微囊藻形态和EPS结构. 电子显微镜照片显示,高氮磷比组的群体微囊藻EPS呈膜状片层,而在低氮磷比组中EPS呈疏松网状(图 4). 网状EPS具有更大的比表面积,显著增加了磷元素的结合位点和储存容量. 此外,EPS的主要成分为多糖类和腐殖酸类物质,含有较多羧基、羟基等基团,与金属离子结合后[44],提升了EPS对磷的吸附和赋存能力. 例如,金属阳离子能与EPS中的腐殖酸络合,进而与磷酸根结合形成“腐殖酸-金属离子-磷酸根”复合体[45].
4 结论1) 低氮磷比显著促进了群体微囊藻和斜生栅藻EPS分泌,提升了藻体胞外磷含量; 2) 氮磷比对微囊藻和斜生栅藻的胞内磷含量无显著影响; 3) 微囊藻胞内磷主要为铁铝结合态磷,胞外磷主要为可交换态活性磷,且胞外磷对藻体磷元素的赋存量与分配模式起关键作用.
| [1] |
Qin BQ, Zhang YL, Zhu GW et al. Are nitrogen-to-phosphorus ratios of Chinese lakes actually increasing?. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(35): 21000-21002. DOI:10.1073/pnas.2013445117 |
| [2] |
Zhu GW, Zou W, Guo CX et al. Long-term variations of phosphorus concentration and capacity in Lake Taihu, 2005-2018: Implications for future phosphorus reduction target management. J Lake Sci, 2020, 32(1): 21-35. [朱广伟, 邹伟, 国超旋等. 太湖水体磷浓度与赋存量长期变化(2005—2018年)及其对未来磷控制目标管理的启示. 湖泊科学, 2020, 32(1): 21-35. DOI:10.18307/2020.0103] |
| [3] |
Wu YL, Xu H, Yang GJ et al. Progress in nitrogen pollution research in Lake Taihu. J Lake Sci, 2014, 26(1): 19-28. [吴雅丽, 许海, 杨桂军等. 太湖水体氮素污染状况研究进展. 湖泊科学, 2014, 26(1): 19-28. DOI:10.18307/2014.0103] |
| [4] |
Song YZ, Qin BQ, Gao G. Effect of nutrient on periphytic algae and phytoplankton. J Lake Sci, 2007, 19(2): 125-130. [宋玉芝, 秦伯强, 高光. 氮及氮磷比对附着藻类及浮游藻类的影响. 湖泊科学, 2007, 19(2): 125-130. DOI:10.18307/2007.0203] |
| [5] |
Stockner JG, Shortreed KS. Response of Anabaena and Synechococcus to manipulation of nitrogen: Phosphorus ratios in a lake fertilization experiment. Limnology and Oceanography, 1988, 33(6): 1348-1361. DOI:10.4319/lo.1988.33.6.1348 |
| [6] |
Sañudo-Wilhelmy SA, Tovar-Sanchez A, Fu FX et al. The impact of surface-adsorbed phosphorus on phytoplankton Redfield stoichiometry. Nature, 2004, 432(7019): 897-901. DOI:10.1038/nature03125 |
| [7] |
Yao B, Xi BD, Hu CM et al. A model and experimental study of phosphate uptake kinetics in algae: Considering surface adsorption and P-stress. Journal of Environmental Sciences, 2011, 23(2): 189-198. DOI:10.1016/S1001-0742(10)60392-0 |
| [8] |
Huang YY, Li PP, Chen GQ et al. The production of cyanobacterial carbon under nitrogen-limited cultivation and its potential for nitrate removal. Chemosphere, 2018, 190: 1-8. DOI:10.1016/j.chemosphere.2017.09.125 |
| [9] |
Philippis R, Sili C, Vincenzini M. Response of an exopolysaccharide-producing heterocystous cyanobacterium to changes in metabolic carbon flux. Journal of Applied Phycology, 1996, 8(4/5): 275-281. DOI:10.1007/BF02178570 |
| [10] |
Duan ZP, Tan X, Parajuli K et al. Colony formation in two Microcystis morphotypes: Effects of temperature and nutrient availability. Harmful Algae, 2018, 72: 14-24. DOI:10.1016/j.hal.2017.12.006 |
| [11] |
De Philippis R, Margheri MC, Pelosi E et al. Exopolysaccharide production by a unicellular cyanobacterium isolated from a hypersaline habitat. Journal of Applied Phycology, 1993, 5(4): 387-394. DOI:10.1007/BF02182731 |
| [12] |
Oliver RL, Ganf GG. Freshwater blooms. In: Whitton BA, Potts M eds. The ecology of cyanobacteria. Their diversity in time and space. Dordrecht: Springer, 2000: 149-194. DOI: 10.1007/0-306-46855-7_6.
|
| [13] |
Perini V, Bracken MES. Nitrogen availability limits phosphorus uptake in an intertidal macroalga. Oecologia, 2014, 175(2): 667-676. DOI:10.1007/s00442-014-2914-x |
| [14] |
Rhee GY. A continuous culture study of phosphate uptake, growth rate and polyphosphate in Scenedesmus sp. Journal of Phycology, 1973, 9(4): 495-506. DOI:10.1111/j.1529-8817.1973.tb04126.x |
| [15] |
Wu Y. Periphyton functions in adjusting P sinks in sediments. Environmental Science, 2017, 155-170. DOI:10.1016/B978-0-12-801077-8.00006-5 |
| [16] |
Sonzogni WC, Chapra SC, Armstrong DE et al. Bioavailability of phosphorus inputs to lakes. Journal of Environmental Quality, 1982, 11(4): 555-563. DOI:10.2134/jeq1982.00472425001100040001x |
| [17] |
Boström B, Persson G, Broberg B. Bioavailability of different phosphorus forms in freshwater systems. Hydrobiologia, 1988, 170(1): 133-155. DOI:10.1007/BF00024902 |
| [18] |
Rydin E. Potentially mobile phosphorus in LakeErken sediment. Water Research, 2000, 34(7): 2037-2042. DOI:10.1016/S0043-1354(99)00375-9 |
| [19] |
Figler A, Márton K, B-Béres V et al. Effects of nutrient content and nitrogen to phosphorous ratio on the growth, nutrient removal and desalination properties of the green alga Coelastrum morus on a laboratory scale. Energies, 2021, 14(8): 2112. DOI:10.3390/en14082112 |
| [20] |
Redfield AC. The biological control of chemical factors in the environment. Science Progress, 1960, 11: 150-170. |
| [21] |
Wei Q, Chen YF, Li XW et al. Effect of N/P and hunger on the capacity of nitrogen and phosphorus removal from wastewater by algal biofilm. Journal of Guangxi University: Natural Science Edition, 2016, 41(3): 890-895. [魏群, 陈延飞, 李晓伟等. 氮磷比及饥饿度对藻类膜脱氮除磷能力的影响. 广西大学学报: 自然科学版, 2016, 41(3): 890-895.] |
| [22] |
Griffiths MJ, Garcin C, van Hille RP et al. Interference by pigment in the estimation of microalgal biomass concentration by optical density. Journal of Microbiological Methods, 2011, 85(2): 119-123. DOI:10.1016/j.mimet.2011.02.005 |
| [23] |
Duan ZP, Tan X, Paerl HW et al. Ecological stoichiometry of functional traits in a colonial harmful cyanobacterium. Limnology and Oceanography, 2021, 66(5): 2051-2062. DOI:10.1002/lno.11744 |
| [24] |
Xu H, Paerl HW, Qin BQ et al. Nitrogen and phosphorus inputs control phytoplankton growth in eutrophic Lake Taihu, China. Limnology and Oceanography, 2010, 55(1): 420-432. DOI:10.4319/lo.2010.55.1.0420 |
| [25] |
Duan ZP, Tan X, Zhang DF et al. Development of thermal treatment for the extraction of extracellular polymeric substances from Microcystis: Evaluating extraction efficiency and cell integrity. Algal Research, 2020, 48: 101879. DOI:10.1016/j.algal.2020.101879 |
| [26] |
Ebina J, Tsutsui T, Shirai T. Simultaneous determination of total nitrogen and total phosphorus in water using peroxodisulfate oxidation. Water Research, 1983, 17(12): 1721-1726. DOI:10.1016/0043-1354(83)90192-6 |
| [27] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第4版. 北京: 中国环境科学出版社, 2002.
|
| [28] |
Stirbet A, Govindjee. On the relation between the Kautsky effect (chlorophyll a fluorescence induction) and photosystem Ⅱ: Basics and applications of the OJIP fluorescence transient. Journal of Photochemistry and Photobiology B: Biology, 2011, 104(1/2): 236-257. DOI:10.1016/j.jphotobiol.2010.12.010 |
| [29] |
Duan ZP, Tan X, Li NG. Ultrasonic selectivity on depressing photosynthesis of cyanobacteria and green algae probed by chlorophyll-a fluorescence transient. Water Science and Technology, 2017, 76(7/8): 2085-2094. DOI:10.2166/wst.2017.376 |
| [30] |
Marinho MM, de Oliveira e Azevedo SMF. Influence of N/P ratio on competitive abilities for nitrogen and phosphorus by Microcystis aeruginosa and Aulacoseira distans. Aquatic Ecology, 2007, 41(4): 525-533. DOI:10.1007/s10452-007-9118-y |
| [31] |
Burford MA, Davis TW, Orr PT et al. Nutrient-related changes in the toxicity of field blooms of the cyanobacterium, Cylindrospermopsis raciborskii. FEMS Microbiology Ecology, 2014, 89(1): 135-148. DOI:10.1111/1574-6941.12341 |
| [32] |
Chen J, Li Y, Li DP et al. Distribution of phosphorus forms in the overlying water under disturbance with the addition of algae. Environmental Science, 2016, 37(4): 1413-1421. [陈俊, 李勇, 李大鹏等. 藻类与扰动共存下水体中不同形态磷的数量分布规律. 环境科学, 2016, 37(4): 1413-1421. DOI:10.13227/j.hjkx.2016.04.028] |
| [33] |
Johnston CA. Sediment and nutrient retention by freshwater wetlands: Effects on surface water quality. Critical Reviews in Environmental Control, 1991, 21(5/6): 491-565. DOI:10.1080/10643389109388425 |
| [34] |
Wang SH, Zhang B, Jiang X et al. Analysis of phosphorus fractions in sediments by sequential extraction. Research of Environmental Sciences, 2015, 28(9): 1382-1388. [王书航, 张博, 姜霞等. 采用连续分级提取法研究沉积物中磷的化学形态. 环境科学研究, 2015, 28(9): 1382-1388.] |
| [35] |
Walker BJ, Drewry DT, Slattery RA et al. Chlorophyll can be reduced in crop canopies with little penalty to photosynthesis. Plant Physiology, 2017, 176(2): 1215-1232. DOI:10.1104/pp.17.01401 |
| [36] |
Melis A. Photosystem-Ⅱ damage and repair cycle in chloroplasts: What modulates the rate of photodamage in vivo?. Trends in Plant Science, 1999, 4(4): 130-135. DOI:10.1016/S1360-1385(99)01387-4 |
| [37] |
Zhou Y, Nguyen BT, Zhou C et al. The distribution of phosphorus and its transformations during batch growth of Synechocystis. Water Research, 2017, 122: 355-362. DOI:10.1016/j.watres.2017.06.017 |
| [38] |
Willis A, Posselt AJ, Burford MA. Variations in carbon-to-phosphorus ratios of two Australian strains of Cylindrospermopsis raciborskii. European Journal of Phycology, 2017, 52(3): 303-310. DOI:10.1080/09670262.2017.1286524 |
| [39] |
Dragone G, Fernandes BD, Abreu AP et al. Nutrient limitation as a strategy for increasing starch accumulation in microalgae. Applied Energy, 2011, 88(10): 3331-3335. DOI:10.1016/j.apenergy.2011.03.012 |
| [40] |
Zhang M, Kong FX, Tan X et al. Biochemical, morphological, and genetic variations in Microcystis aeruginosa due to colony disaggregation. World Journal of Microbiology and Biotechnology, 2007, 23(5): 663-670. DOI:10.1007/s11274-006-9280-8 |
| [41] |
Duan ZP, Tan X, Parajuli K et al. Characterization of Microcystis morphotypes: Implications for colony formation and intraspecific variation. Harmful Algae, 2019, 90: 101701. DOI:10.1016/j.hal.2019.101701 |
| [42] |
Seymour JR, Amin SA, Raina JB et al. Zooming in on the phycosphere: The ecological interface for phytoplankton-bacteria relationships. Nature Microbiology, 2017, 30(2): 17065. DOI:10.1038/nmicrobiol.2017.65 |
| [43] |
Nielsen PH, Jahn A. Extraction of EPS. In: Microbial Extracellular Polymeric Substances, Springer-Verlag, 1999, 49-72. DOI:10.1007/978-3-642-60147-7_3 |
| [44] |
Casillo A, Lanzetta R, Parrilli M et al. Exopolysaccharides from marine and marine extremophilic bacteria: Structures, properties, ecological roles and applications. Marine Drugs, 2018, 16(2): 69. DOI:10.3390/md16020069 |
| [45] |
Gerke J, Hermann R. Adsorption of orthophosphate to humic-Fe-complexes and to amorphous Fe-oxide. Zeitschrift für Pflanzenernährung und Bodenkunde, 1992, 155(3): 233-236. DOI:10.1002/jpln.19921550313 |
 2022, Vol. 34
2022, Vol. 34 


