(2: 英国伯明翰大学,地理、地球和环境科学学院,伯明翰 B15 2TT)
(2: School of Geography, Earth and Environmental Sciences, University of Birmingham, Birmingham B15 2TT, UK)
有色可溶性有机物(chromophoric dissolved organic matter, CDOM)是广泛分布于自然水体中的一类成分和结构复杂、含有多种高活性化学官能团的大分子聚合物,是水体溶解有机物(dissolved organic matter, DOM)的重要组分,对水生生态系统健康、能量流动及生物地球化学循环有重要影响[1-2]. CDOM含有光特性基团因而具有光吸收特性,能有效吸收紫外辐射,从而保护水生生物; CDOM与生物地球化学循环密切相关,为水生生态系统中细菌和浮游植物生长供应营养; CDOM作为全球碳库的关键组成部分,由于复杂的来源、组成和分子结构,其迁移转化过程也是全球碳循环中的重要环节[3-5]. 因此,CDOM迁移转化机理及影响因素受到了越来越多的关注[6-7]. 光化学反应和微生物代谢过程被认为是控制水体CDOM转化和降解的主要因素. 研究表明,光化学转化过程通过改变CDOM的生物利用度来促进或抑制微生物代谢,影响CDOM的转化与降解[8]. 例如,光化学降解将大分子CDOM转化为易于被微生物利用的小分子有机物,提高CDOM的微生物代谢[9-10]. 生物代谢通过释放CDOM增加DOM光化学活性[11-12]. 同时,光照会降低光敏性微生物的丰度,从而抑制CDOM的微生物代谢[13-14].
CDOM的光反应性和生物活性都与其组成、来源和化学特性有关[15]. 研究表明,微生物代谢和光化学降解都可能在水体中竞争CDOM转化和分解[16]. 然而,由于不同的结构特征,一些CDOM(如内源CDOM)更容易被微生物消耗,但难以被光化学降解,而另一些(如芳香族腐殖质)则呈现相反的可利用模式[15]. 此外,微生物趋向优先消耗非有色DOM[17]. 快速发展的城市化改变了CDOM的输入途径,城市排污管道溢流、非透水地面形成的径流及城市中大面积的景观草地向水体提供大量独特的有机物,如生物可利用度高的CDOM[18]. 城市水体中高度动态化的CDOM反映了不同来源CDOM在不同时空尺度下的相互作用和非线性混合及其转化的范围与程度[19]. 这些独特的CDOM在转化过程中消耗氧气,对生态系统功能,如氮的循环分解,产生显著影响[20]. 而城市非点源输入对水体CDOM的迁移转化的影响,以及城市水体不同来源CDOM转化与降解过程在微生物和光化学作用之间关系的重叠程度研究较少. 为了满足水质监管要求,厘清城市水体复杂的CDOM迁移转化过程是至关重要的,不仅有利于评估城市流域碳循环过程,也有助于对城市流域的可持续开发与管理.
伯明翰是英国除伦敦外最大的城市,人口密集,也是典型的工业城市[21]. 作为全国运河网的交汇点,伯明翰拥有多种不同类型的水体. 由于多样的流域环境以及人类活动,其城市水体中的CDOM来源与组成更为复杂且更容易受到影响[20]. 因此,为解析城市化水体非点源输入对CDOM浓度及组成的影响,阐明光化学过程和微生物代谢对不同城市水体CDOM降解与转化的贡献,本研究在英国伯明翰选择了3种不同的城市水体. 通过实验室光化学和微生物控温培养,揭示光化学及微生物影响下CDOM特性的变化,比较分析光化学或/和微生物优先利用的CDOM组分. 以期为不同城市水体CDOM来源及活性差异特征研究提供了新的思路,针对光化学和微生物处理过程中CDOM特性的改变方式形成了新的认识,结果对研究全球城市化快速发展背景下城市流域碳循环及水陆界面碳交换也具有重要的理论意义.
1 材料和方法 1.1 研究区域概况本研究选取英国伯明翰市内3类具有代表性的典型DOM来源水体,分别是布恩河(B,城市河流)、韦尔湖(V,城市湖泊)以及埃德巴斯顿湖(E,非城市湖泊)(图 1). 布恩河位于伯明翰市区(52°26′51"N, 1°55′49"W),流经伯明翰大学,上游没有直接的污染源,但是接受城市雨水和合流污水系统溢流. 韦尔湖位于布恩河支流查德河下游,属于人工湖,西侧毗邻学生公寓,东侧为城市公园. 埃德巴斯顿湖四周环境以森林草地为主. 该湖泊及其周边地区因其多样的林地和湿地栖息地而被授予具有特殊科学价值的地点(SSSI)地区. 于2016年6—7月在点位B、V及E分别采集表层(0~10 cm)水样,每个点位多点水样采集并混合后置于2 L聚乙烯采样瓶中4℃避光冷藏运回实验室,用0.22 μm聚碳酸酯滤膜(Millipore)过滤[13, 22],并保存于-20℃的黑暗环境中直至分析. 现场用Hanna便携式水质测试仪与YSI ODO测试仪测定水温(T)、pH、电导率(EC)以及溶解氧(DO)等参数(表 1).
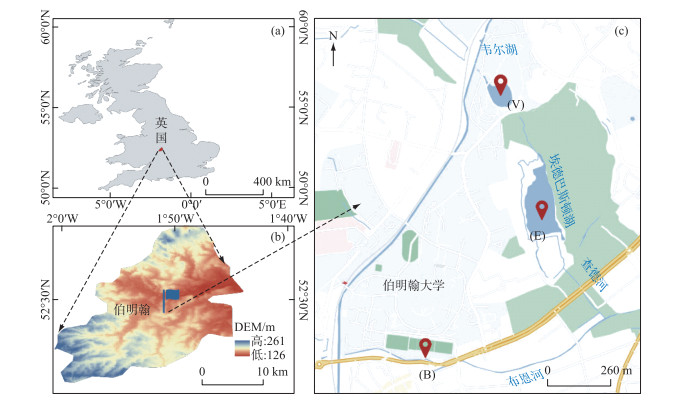
|
图 1 采样点分布示意图 Fig.1 Map of the study area showing the location and station name of the sampling sites |
| 表 1 各点位基本水质指标 Tab. 1 Environmental parameters measured of the sampling sites |
培养实验分为4组(表 2), 分别考察不同类型水体的CDOM的光降解、微生物降解,以及光-微生物联合降解作用. 简而言之,将各样点经过0.22 μm滤膜过滤后的水样等量(100 mL)置于事先经过10% HCl润洗的玻璃培养瓶中,在需要微生物的处理的水样中加入2 mL取自布恩河并经过2.7 μm孔径滤膜过滤后的接种水[22]. 不需要光照的样品瓶用铝箔包裹,以避免光辐照. 各降解培养体系均为三样平行培养(n=36),在实验室培养箱光照恒温条件下((25000±2500) lx, 25℃)进行为期9天的培养.
| 表 2 光/微生物降解室内培养实验设置 Tab. 2 The set-up of incubation experiment for photo-/biological degradation |
水体叶绿素采用D3731-87(2004)标准和Dos Santos等[23]所述的丙酮萃取法提取和测定,取样点背景值见表 1. 通常使用350 nm处的吸收系数(A350)来表示CDOM的相对浓度. CDOM吸收光谱使用FENAC UV-vis紫外-可见分光光度计进行测定,以Milli-Q水为空白,扫描波长范围为200~500 nm. A350可根据公式(1)计算:
| aλ=2.303Aλ/L | (1) |
式中,λ为波长,nm; aλ波长λ处的吸收系数,m-1; L为光程路径,cm; Aλ为波长为λ处的吸光度,m-1. 根据Helms等[24],光谱斜率S可由公式(2)计算:
| aλ=aλrefe−s(λ−λref) | (2) |
式中,aλ和aλref分别为水样在波长 λ和λref处的吸收系数,在本研究中计算波长范围为275~295 nm(S275~295)和350~400 nm(S350~400),两者比值为光谱斜率比值SR,与CDOM相对分子量呈负相关.
三维荧光光谱(EEM)采用Cary Eclipse荧光分光光度计(安捷伦技术公司)进行测定,使用1 cm石英比色皿,以Milli-Q水为空白,激发波长(Ex)为200~400 nm,间隔5 nm,发射波长为280~500 nm,间隔2 nm; 扫描速度为9600 nm/min,狭缝宽度为5 nm. 所有的样品需要去除拉曼及瑞利散射,并减去Milli-Q水的EEM. 荧光指数(FI)、腐殖化指数(HIX)以及自生源指数(BIX)分别用来指示CDOM来源,腐殖化程度以及内源物质对CDOM的相对贡献[25]. 采用MATLAB2016软件中的DOMFluor工具箱通过平行因子分析法(PARAFAC)进行CDOM组分分析. PARAFAC分析的原理是将EEMs数据集分解为一系列的三线性项和残差数矩阵,并使残差平方和最小化,通过对半检验、残差和负荷分析确定种荧光组分模型并进行验证.
1.4 统计分析三维荧光光谱、平行因子分析和各荧光参数指标的分析由MATLAB2016完成. 利用R4.0.5进行统计分析,包括平均值和标准差的计算、正态分布检验、相关性分析、主成分分析(PCA)、方差分析等,P < 0.05表示差异显著. 采样点分布图采用ArcGIS 10.1绘制.
2 结果与分析 2.1 初始水体性质分析 2.1.1 平行因子分析结果利用PARAFAC模型对三维荧光光谱进行解析,所得4组分模型C1~C4能很好地通过对半检验(图 2). 在Openfluor数据库(https://openfluor.lablicate.com/)[26]中进行匹配,选择Tucker收敛系数(TCC)高于0.95判定荧光组分的具体物质(表 3). 其中,组分C1(Ex/Em= < 250,345/458 nm)为外源输入的类腐殖酸,分子中含有很大比例的芳香族碳; 组分C2(Ex/Em= < 250,295/386 nm)归为微生物代谢产物的类腐殖酸,由有机物经过微生物降解后产生,与M峰类似,具有一定的自生源特征,在污水、农业等环境中较为常见; 组分C3(Ex/Em= < 250,285/400 nm)为类腐殖酸和类色氨酸混合物,可代表光/微生物降解的产物; 组分C4(Ex/Em= < 250,280/322 nm)代表类蛋白质中的酪氨酸组分,主要由水生生物或微生物的新陈代谢作用产生,代表内源CDOM.
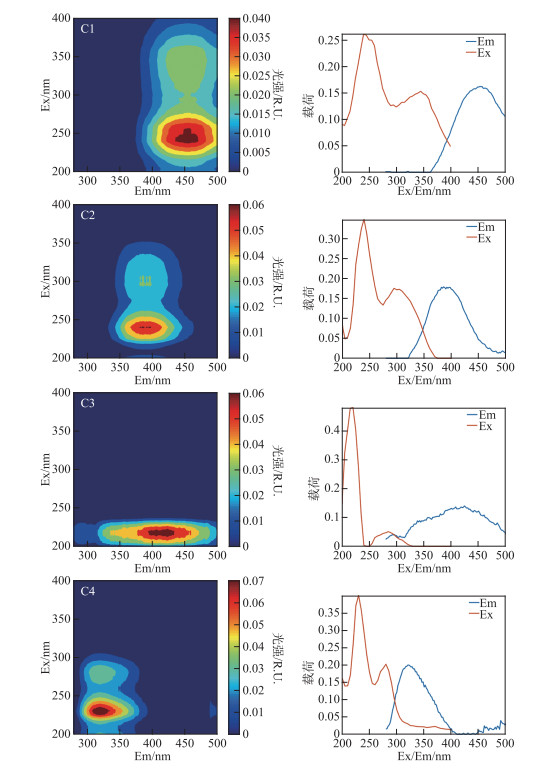
|
图 2 平行因子分析得到的4个组分EEMs及载荷 Fig.2 Fluorescent spectra and loadings of the four PARAFAC models |
| 表 3 OpenFluor数据库中PARAFAC组分及最大TCC值 Tab. 3 PARAFAC components and maximum TCC values in the OpenFluor database |
不同水体之间CDOM特征光学参数初始值(t0)见表 4. 采用A350表征CDOM相对浓度,各水体间CDOM浓度具有显著差异,其中湖泊中的A350高于河流,非城市湖泊E点位的A350高于城市湖泊. 非城市湖泊E点位的CDOM相对浓度显著高于典型城市河流B点位(ANOVA, P < 0.001). 这是由于非城市湖泊接受周围土壤输入大量有机物,且藻类活动明显,导致CDOM在湖泊水体累积[25]. 研究认为254 nm处的紫外吸收值(SUVA254)与芳香烃含量呈正比[31]. 本研究中,城市河流B点位的SUVA254明显高于湖泊(ANOVA: P < 0.05),芳香族化合物浓度较高,说明城市河流受城市化影响显著,接受污水管道溢流,导致更多芳香族化合物在此区域积累[25]. 荧光光谱特征参数(FI、BIX和HIX)被用来表征CDOM组分的来源,但其统计学差异并不显著. 基于CDOM各荧光组分占比,非城市湖泊E点位的陆源腐殖类荧光组分(即C1)贡献较高,类蛋白质组分占比较低,其CDOM主要源于土壤渗流及地表径流输入,受人类活动影响小,代表陆源主导的非城市水体. 而城市湖泊有较强的自生源特征,自生源特征腐殖质(C2)及类蛋白质组分(C4)占比高,为典型城市水体. 最新研究发现,受人类活动影响的水体中存在类似的生物荧光成分富集现象[7, 32]. 与非城市湖泊相比,城市湖泊由于受到人类活动的影响,CDOM来源及组成都相对复杂,这与Lv等[20]的研究结果一致. 而城市河流中陆源腐殖质及自生源腐殖质占比相当,具有混合源的特征,受人类活动影响强烈. 虽然城市河流CDOM浓度较低,但是含有丰富的芳香烃,且由于较短的水力滞留时间,CDOM活性也较高[33].
| 表 4 不同水体的CDOM浓度和光学特征1) Tab. 4 CDOM concentration, optical characteristics and their differences between sampling sites |
不同培养实验体系中,不同水体CDOM特征光学参数变化如表 5所示. 培养前后不同点位各处理组间的A350及光谱斜率比SR的差异均具有统计学意义(表 6). 虽然在培养过程中未发现FI有明显变化趋势,但HIX以及BIX均在9 d的培养实验中出现明显的变化. 结果说明在培养过程中,光/微生物对CDOM浓度及组成具有显著影响,且与CDOM的组成及来源有关. 有趣的是,虽然在初始阶段,各水体中的叶绿素含量差异并不显著,但是反应结束时,不同处理的培养体系中叶绿素浓度(Chl.a)出现明显的差异(P<0.001)(表 5),意味着光合细菌活动明显且与培养方式有关.
| 表 5 不同培养体系中水体CDOM光学参数特征* Tab. 5 Variation characteristics of CDOM optical parameters in different incubation systems |
| 表 6 重复方差分析的结果* Tab. 6 Summary of repeated ANOVA results |
对于光降解培养体系,各水体中A350均显著降低,表明CDOM发生显著降解. 其中,城市河流CDOM的降解率最高,为16.60%;非城市湖泊CDOM的降解率为15.31%,而自生源主导城市湖泊中CDOM降解率最低为12.03%. 随着CDOM浓度下降,不同水体的SR相较于未透光的对照组均呈现增加,表明光化学作用可将大分子量的CDOM分解为小分子的有机物[34-35]. 不同水体的HIX值在光照过程中都发生了显著的降低,说明CDOM腐殖化程度不断下降. 结合BIX的变化,光照前后,河流水体中CDOM从较强腐殖化特征向自生源特征转变. 一方面,相较于静态的湖泊水体,河流由于较短的水力滞留时间,其CDOM活性较高. 另一方面,相较于城市湖泊,陆源主导的非城市湖泊CDOM含有丰富的芳香性碳,具有更强的光化学活性[16].
与光降解培养体系不同,在微生物培养体系中,除了自生源主导的城市湖泊中CDOM的A350显著增加62.16%,其余水体中都未观察到明显变化. 这与先前的研究结果一致,自生源CDOM对微生物代谢更为敏感[11-12]. 相较于光和微生物培养,CDOM在光-微生物联合降解培养体系中发生了更为显著的变化. 非城市湖泊及城市河流中CDOM含量显著增加且分子量降低,表明光照会促进水体中存在的自养微生物利用光和CO2合成CDOM. 这与之前的研究结果基本一致,CDOM的光化学反应过程中,生物可利用性显著提高[16, 36]. 而城市湖泊中CDOM由于受人类活动影响,类蛋白质组分占比高,在光-微生物联合培养体系中未发现显著的变化. 表明光照与微生物的协同作用取决于CDOM的浓度、组成以及来源[31-32].
2.2.2 不同水体CDOM荧光组分变化特征不同培养体系中CDOM荧光组分变化如图 3所示. 与CDOM相对浓度相似,所有荧光组分均在9 d的培养实验中出现明显的变化(P<0.001). 结果进一步说明光/微生物降解作用依赖于CDOM初始的浓度及组成的不同水平[36].
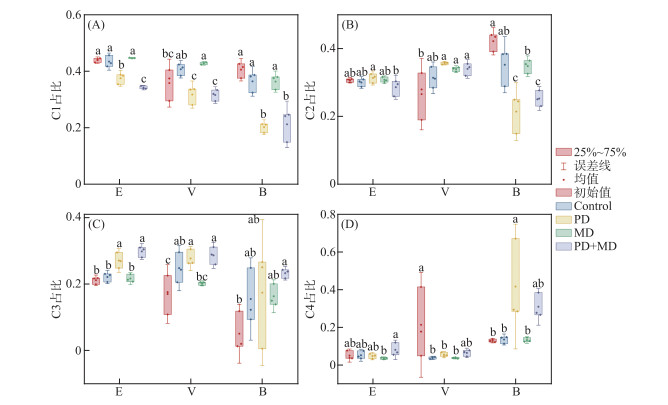
|
图 3 不同培养实验体系CDOM荧光组分变化特征(不同字母(a、b、c)表示差异显著(P < 0.05)) Fig.3 Variation characteristics of four CDOM fluorescence components in difference incubation systems (Different letters (a, b, c) represent differences are significant at P < 0.05) |
在本研究中,荧光强度以百分比(%Ci)表示,以减少CDOM浓度的影响[7]. 在光降解培养体系中,非城市湖泊、城市湖泊及城市河流CDOM中陆源腐殖质荧光组分C1的相对丰度都显著降低(P < 0.05),分别降低了6.33%、4.02%和20.16%. 陆源腐殖质类CDOM比微生物来源的有机物相对更具光反应性,这是由于大分子富里酸和腐殖酸中存在多种苯环及共轭体系等光敏结构,易吸收紫外光而发生光化学反应[16, 22]. 对于微生物培养体系,各水体CDOM中C1占比变化并不显著. 陆源腐殖质组分一般以芳香族化合物为主,常被认为是生物难降解的[37]. 而对于光-微生物联合培养体系,非城市湖泊中C1组分相对丰度的减少显著高于光降解培养体系,为9.63%. 表明光降解和微生物代谢这两个过程通过协同作用提高了CDOM的降解速率,即光化学过程促进了生物代谢,反之亦然[38]. 而城市水体中这样的差别并不显著,进一步说明了城市化会影响光降解和微生物代谢对CDOM的协同作用. 对于与人为活动相关的微生物源腐殖质C2,湖泊水体在各培养体系中变化并不显著. 但是城市河流中的C2占比发生了显著的变化,在光降解培养体系,微生物培养体系以及光-微生物联合培养体系中分别减少了20.71%、7.35%和16.89%. 进一步表明河流CDOM活性较高,这与之前的研究结果一致[37-38]. 微生物培养对不同水体CDOM中C3及C4组分相对丰度的影响并不显著. 而在光降解培养体系中,城市湖泊与非城市湖泊水体CDOM中光/微生物降解产物C3分别增加了10.68%和5.92%. 且C3相对丰度在光-微生物联合培养体系中的增加更为显著,分别为11.62%和8.66%. 这是由于生物和光对CDOM的降解存在互利的作用,光照将腐殖质类CDOM分解成为易被生物利用的小分子有机物,促进了微生物的代谢[38]. 相较于静态的湖泊水体,城市河流中类蛋白质组分C4的相对丰度在光降解培养体系中显著增加了28.55%. 这可能是由于河流水体中原有的活性较高的类蛋白组分在光照过程中被加速“老化”转化为难降解的状态,出现类蛋白质类CDOM的累积现象[39-40]. 结果表明,CDOM光降解对微生物代谢有促进作用还是抑制作用取决于CDOM的浓度、组成以及来源.
2.3 光/微生物降解过程中不同水体CDOM组成及光学特征参数的主成分分析(PCA)对不同培养实验体系中各水体CDOM组成、光学特征参数以及叶绿素浓度进行主成分分析. 主成分1和2共同解释了这些参数变化的73.7%(图 4). 主成分1(PC1)解释了44.8%的变化,与类蛋白质物质C4、SR、BIX以及叶绿素浓度呈正相关; 与类腐殖质物质C1及HIX呈负相关(图 4B). 主成分2(PC2)解释了总方差的28.9%,与A350及类蛋白质组分C3呈正相关,与SUVA254呈负相关. 其中,类蛋白质组分C4与叶绿素浓度呈显著正相关,说明生物代谢活动会生成小分子量的类蛋白质.
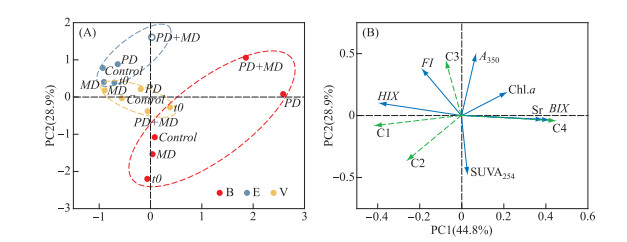
|
图 4 不同来源CDOM在各培养实验中主成分分析得分图(a)以及荷载图(b) Fig.4 Principal component analysis scores plot (a) and loadings plot (b) for incubation systems |
主成分分析得分图可表示不同水体CDOM在各培养实验体系之间的变化(图 4A). 城市河流B点位的CDOM与PC2显示出强正负相关,高分子量的芳香族有机物含量高,表明该来源与城市生活污水有关. 经过9 d的培养,微生物活动及未透光的对照组中城市河流CDOM的变化并不明显,与初始值存在强相似性,组成仍以强芳香性自生源特征腐殖质为主. 这是由于主导城市河流的自生源特征腐殖质由有机物经过微生物降解后产生,几乎不含新鲜/不稳定的组分[41]. 而经过光降解及光-微生物联合培养,城市河流B点位的CDOM与PC1展现出了明显的正相关,更趋向于小分子量的类蛋白质CDOM,表明城市河流CDOM的光化学活性高. 且城市河流中类蛋白质CDOM与叶绿素浓度呈显著正相关(图 5A). 表明光照促进了城市河流中CDOM大分子陆源腐殖质降解成为小分子化合物促进微生物代谢生成类蛋白质类有机物[8, 42]. 初始的城市湖泊CDOM与PC1呈正相关,表明新鲜的、低分子量的、低芳香烃的、不稳定的CDOM占优势. 经过9 d的微生物培养,这些物质与PC1呈现出负相关,表明这一部分有机物的损失以及进一步降解增加的有机物腐殖质部分. 这与Hansen等[31]的研究结果一致,随着CDOM的生物降解,低分子量的类蛋白质CDOM被优先降解,从新鲜物质转变为腐殖质. 而经过光照培养,城市湖泊CDOM特征变化较小,与PC2仍表现出微弱的负相关. 这表明光照后的CDOM组成与初始值类似,也进一步说明相较于类蛋白质CDOM,类腐殖质组分更具有光化学活性. 城市湖泊V点位的CDOM在光-微生物联合培养中的变化与光照培养类似,并不明显,组成仍以类蛋白质组分为主,且类蛋白质CDOM的变化与叶绿素浓度无显著相关性(图 5B). 因此,城市湖泊CDOM中类蛋白质物质的累积是由于光照改变了类蛋白质组分结构,使其更难被微生物利用[38]. 表明光照会抑制类蛋白质组分主导的CDOM的微生物代谢过程[13-14]. 陆源主导的非城市水体CDOM(E)在微生物培养过程中,与PC1的负相关性增强,说明少量的类蛋白质组分被分解生成腐殖质[31]. 与对照组相比,经过光照的陆源主导CDOM由较高的负PC1荷载转移到较高的负PC2荷载,表明腐殖质占比的减少. 这是由于腐殖质更具光化学活性[16]. 在光-微生物联合培养中,由负PC1荷载转移到负的PC2荷载,陆源主导的非城市水体CDOM逐步展现出具有高蛋白质组分的自生源特征但与叶绿素浓度无明显相关性(图 5C). 这进一步说明了在经历光照和生物同时影响时,CDOM组成的变化是非常复杂的.
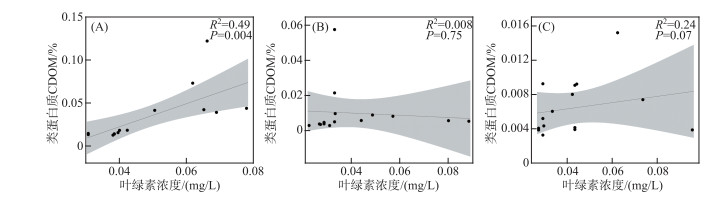
|
图 5 不同水体类蛋白质CDOM占比与叶绿素浓度的关系:(A)城市河流B、(B)城市湖泊V和(C)非城市湖泊 Fig.5 Relationships between the average percentage of protein-like components CDOM and chlorophyll concentration in different water bodies: (A) urban stream B, (B) urban lake V and (C) non-urban lake E |
上述分析表明,由于CDOM成分复杂,对于来源与组成不同的CDOM,其光/微生物降解过程不同,产物也不尽相同. 与非城市水体相比,城市水体中CDOM呈现出自生源贡献相对大于陆源输入,并且蛋白质类和/或微生物类CDOM的比例相对较大,具有较强的生物活性. 而非城市水体CDOM的光反应性更强. 本研究是基于短期室内模拟实验,初步分析光化学过程和微生物代谢对不同城市水体CDOM降解与转化的贡献,仍然缺乏对城市水体CDOM的光/微生物降解机理及其环境效应的深刻理解和定量估计,未来需要更多的受控实验、长期现场监测以及构建CDOM光/微生物反应过程模型,探究无机氮磷以及离子对CDOM组分生物降解的影响,提高我们对驱动CDOM转化的基本机制及其在全球变暖中作用的理解.
3 结论1) 城市河流由于接受上游污水排放及较短的水力滞留时间,含有丰富的芳香性碳,其CDOM光化学活性明显高于湖泊CDOM.
2) 城市湖泊受人类活动影响,微生物荧光成分富集,自生源CDOM主导,由于富含氨基酸、碳水化合物以及糖类物质等,较非城市水湖泊CDOM更具生物活性. 而相较于城市湖泊,非城市湖泊由于接受周围景观土壤输入的大量腐殖质类CDOM,光照对其降解转化作用较为明显.
3) 光化学过程和微生物过程对CDOM的转化降解具有协同/抑制作用. 光照促进了陆源CDOM中大分子类腐殖质物质降解成为生物活性高的小分子化合物,刺激微生物代谢生成蛋白质类有机物; 以类蛋白质物质为主导的自生源CDOM在光照过程中被转化为难降解的状态,生物活性降低,CDOM微生物代谢过程被抑制.
| [1] |
Liang WJ, Qin LP, Liu ZB et al. Spatial distribution of colored dissolved organic matter (CDOM) in the Bohai, Yellow and East China Seas in November and December. Marine Environmental Science, 2019, 38(6): 905-910. [梁文健, 秦礼萍, 刘兆冰等. 东黄渤海11—12月有色溶解有机质的分布特征. 海洋环境科学, 2019, 38(6): 905-910.] |
| [2] |
Liu YY, Sun H, Liu C et al. Characteristics of chromophoric dissolved organic matter (CDOM) in natural rivers of western Sichuan plateau. Environmental Science, 2019, 40(12): 5318-5329. [刘堰杨, 孙辉, 刘琛等. 川西高原河流水体CDOM的光化学降解特性. 环境科学, 2019, 40(12): 5318-5329. DOI:10.13227/j.hjkx.201905123] |
| [3] |
Zhang YL, Yin Y, Zhang EL et al. Spectral attenuation of ultraviolet and visible radiation in lakes in the Yunnan Plateau, and the middle and lower reaches of the Yangtze River, China. Photochemical & Photobiological Sciences: Official Journal of the European Photochemistry Association and the European Society for Photobiology, 2011, 10(4): 469-482. DOI:10.1039/c0pp00270d |
| [4] |
Williamson CE, Zepp RG, Lucas RM et al. Solar ultraviolet radiation in a changing climate. Nature Climate Change, 2014, 4(6): 434-441. DOI:10.1038/nclimate2225 |
| [5] |
Zhang YL, Yin Y, Feng LQ et al. Characterizing chromophoric dissolved organic matter in Lake Tianmuhu and its catchment basin using excitation-emission matrix fluorescence and parallel factor analysis. Water Research, 2011, 45(16): 5110-5122. DOI:10.1016/j.watres.2011.07.014 |
| [6] |
Zhang YL, Zhou L, Zhou YQ et al. Chromophoric dissolved organic matter in inland waters: Present knowledge and future challenges. Science of the Total Environment, 2021, 759: 143550. DOI:10.1016/j.scitotenv.2020.143550 |
| [7] |
Williams CJ, Yamashita Y, Wilson HF et al. Unraveling the role of land use and microbial activity in shaping dissolved organic matter characteristics in stream ecosystems. Limnology and Oceanography, 2010, 55(3): 1159-1171. DOI:10.4319/lo.2010.55.3.1159 |
| [8] |
Tranvik LJ, Bertilsson S. Contrasting effects of solar UV radiation on dissolved organic sources for bacterial growth. Ecology Letters, 2001, 4(5): 458-463. DOI:10.1046/j.1461-0248.2001.00245.x |
| [9] |
Amado AM, Farjalla VF, de A Esteves F et al. Complementary pathways of dissolved organic carbon removal pathways in clear-water Amazonian ecosystems: Photochemical degradation and bacterial uptake. FEMS Microbiology Ecology, 2006, 56(1): 8-17. DOI:10.1111/j.1574-6941.2006.00028.x |
| [10] |
Sun YX, Wang JX, Song KX et al. Research on photodegradation of chromophoric dissolved organic matter released by Ulva prolufera. Journal of Jiangsu Ocean University: Natural Sciences Edition, 2020, 29(2): 27-32. [孙一鑫, 王嘉旋, 宋可心等. 浒苔释放有色溶解有机物的光降解研究. 江苏海洋大学学报: 自然科学版, 2020, 29(2): 27-32.] |
| [11] |
Kramer GD, Herndl GJ. Photo- and bioreactivity of chromophoric dissolved organic matter produced by marine bacterioplankton. Aquatic Microbial Ecology, 2004, 36: 239-246. DOI:10.3354/ame036239 |
| [12] |
Nieto-Cid M, Álvarez-Salgado XA, PÉrez FF. Microbial and photochemical reactivity of fluorescent dissolved organic matter in a coastal upwelling system. Limnology and Oceanography, 2006, 51(3): 1391-1400. DOI:10.4319/lo.2006.51.3.1391 |
| [13] |
Niu C, Zhang YL, Zhu GW et al. Comparison of optical properties of DOM and CDOM in Lake Tianmuhu catchment. Research of Environmental Sciences, 2014, 27(9): 998-1007. [牛城, 张运林, 朱广伟等. 天目湖流域DOM和CDOM光学特性的对比. 环境科学研究, 2014, 27(9): 998-1007.] |
| [14] |
Herndl GJ, Müller-Niklas G, Frick J. Major role of ultraviolet-B in controlling bacterioplankton growth in the surface layer of the ocean. Nature, 1993, 361(6414): 717-719. DOI:10.1038/361717a0 |
| [15] |
Moran MA, Covert JS. Photochemically mediated linkages between dissolved organic matter and bacterioplankton. Aquatic Ecosystems. Amsterdam: Elsevier, 2003: 243-262. DOI: 10.1016/b978-012256371-3/50011-1.
|
| [16] |
Obernosterer I, Benner R. Competition between biological and photochemical processes in the mineralization of dissolved organic carbon. Limnology and Oceanography, 2004, 49(1): 117-124. DOI:10.4319/lo.2004.49.1.0117 |
| [17] |
Saadi I, Borisover M, Armon R et al. Monitoring of effluent DOM biodegradation using fluorescence, UV and DOC measurements. Chemosphere, 2006, 63(3): 530-539. DOI:10.1016/j.chemosphere.2005.07.075 |
| [18] |
Benner R. Chemical composition and reactivity. In: Hansell DA, Carlson CA eds. Biogeochemistry of marine dissolved organic matter. Academic Press 2002: 59-90.
|
| [19] |
Hosen JD, McDonough OT, Febria CM et al. Dissolved organic matter quality and bioavailability changes across an urbanization gradient in headwater streams. Environmental Science & Technology, 2014, 48(14): 7817-7824. DOI:10.1021/es501422z |
| [20] |
Lv LL, Liu G, Shang YX et al. Characterization of dissolved organic matter (DOM) in an urbanized watershed using spectroscopic analysis. Chemosphere, 2021, 277: 130210. DOI:10.1016/j.chemosphere.2021.130210 |
| [21] |
Carstea EM, Baker A, Pavelescu G et al. Continuous fluorescence assessment of organic matter variability on the Bournbrook River, Birmingham, UK. Hydrological Processes, 2009, 23(13): 1937-1946. DOI:10.1002/hyp.7335 |
| [22] |
Wang XK, Jin H, Liang SK et al. Photochemical/microbial degradation of dissolved organic matter from different sources in Changjiang Estuary. Periodical of Ocean University of China, 2020, 50(12): 88-97. [王新科, 金红, 梁生康等. 长江口不同来源溶解有机质光化学/微生物降解作用及机制研究. 中国海洋大学学报: 自然科学版, 2020, 50(12): 88-97.] |
| [23] |
dos Santos ACA, Calijuri MC, Moraes EM et al. Comparison of three methods for Chlorophyll determination: Spectrophotometry and Fluorimetry in samples containing pigment mixtures and spectrophotometry in samples with separate pigments through High Performance Liquid. Acta Limnologica Brasiliensia, 2003, 15(3): 7-18. |
| [24] |
Helms JR, Stubbins A, Ritchie JD et al. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter. Limnology and Oceanography, 2008, 53(3): 955-969. DOI:10.4319/lo.2008.53.3.0955 |
| [25] |
Zhu JJ, Zou N, Zhong H et al. Spatiotemporal characteristics and its environmental application of dissolved organic matter (DOM) in sediments from Chaohu Lake, a eutrophic lake. Acta Scientiae Circumstantiae, 2020, 40(7): 2528-2538. [朱金杰, 邹楠, 钟寰等. 富营养化巢湖沉积物溶解性有机质光谱时空分布特征及其环境意义. 环境科学学报, 2020, 40(7): 2528-2538. DOI:10.13671/j.hjkxxb.2020.0051] |
| [26] |
Murphy KR, Bro R, Stedmon CA. Aquatic Organic Matter Fluorescence: Chemometric analysis of organic matter fluorescence. 2014, 261(1), 339-375. DOI: 10.1017/CBO9781139045452.016.
|
| [27] |
Lin H, Guo LD. Variations in colloidal DOM composition with molecular weight within individual water samples as characterized by flow field-flow fractionation and EEM-PARAFAC analysis. Environmental Science & Technology, 2020, 54(3): 1657-1667. DOI:10.1021/acs.est.9b07123 |
| [28] |
Wauthy M, Rautio M, Christoffersen KS et al. Increasing dominance of terrigenous organic matter in circumpolar freshwaters due to permafrost thaw. Limnology and Oceanography Letters, 2018, 3(3): 186-198. DOI:10.1002/lol2.10063 |
| [29] |
Yang LY, Guo WD, Chen NW et al. Influence of a summer storm event on the flux and composition of dissolved organic matter in a subtropical river, China. Applied Geochemistry, 2013, 28: 164-171. DOI:10.1016/j.apgeochem.2012.10.004 |
| [30] |
Zhou YL, Martin P, Müller M. Composition and cycling of dissolved organic matter from tropical peatlands of coastal Sarawak, Borneo, revealed by fluorescence spectroscopy and parallel factor analysis. Biogeosciences, 2019, 16(13): 2733-2749. DOI:10.5194/bg-16-2733-2019 |
| [31] |
Hansen AM, Kraus TEC, Pellerin BA et al. Optical properties of dissolved organic matter (DOM): Effects of biological and photolytic degradation. Limnology and Oceanography, 2016, 61(3): 1015-1032. DOI:10.1002/lno.10270 |
| [32] |
Miller MP, McKnight DM. Comparison of seasonal changes in fluorescent dissolved organic matter among aquatic lake and stream sites in the Green Lakes Valley. Journal of Geophysical Research Atmospheres, 2010, 115: G00F12. DOI:10.1029/2009jg000985 |
| [33] |
Du YX, Lu YH, Roebuck JA Jr et al. Direct versus indirect effects of human activities on dissolved organic matter in highly impacted lakes. Science of the Total Environment, 2021, 752: 141839. DOI:10.1016/j.scitotenv.2020.141839 |
| [34] |
Zhou WH, Liao JZ, Guo YJ et al. Photodegradation of dissolved organic matter and its effect on bacterioplankton and phytoplankton. Marine Sciences, 2017, 41(2): 136-144. [周伟华, 廖健祖, 郭亚娟等. 溶解有机物的光降解及其对浮游细菌和浮游植物的影响. 海洋科学, 2017, 41(2): 136-144. DOI:10.11759/hykx20151214003] |
| [35] |
Ma QL, Li PH, Huang QH. Effect of UV-C irradiation on dissolved organic matter and its bioavailability. Research of Environmental Sciences, 2014, 27(3): 259-265. [马琼琳, 李朋辉, 黄清辉. UV-C辐照对河水溶解有机质降解及微生物可利用性的影响. 环境科学研究, 2014, 27(3): 259-265. DOI:10.13198/j.issn.1001-6929.2014.03.06] |
| [36] |
Lu YH, Bauer JE, Canuel EA et al. Photochemical and microbial alteration of dissolved organic matter in temperate headwater streams associated with different land use. Journal of Geophysical Research: Biogeosciences, 2013, 118(2): 566-580. DOI:10.1002/jgrg.20048 |
| [37] |
Meunier L, Laubscher H, Hug SJ et al. Effects of size and origin of natural dissolved organic matter compounds on the redox cycling of iron in sunlit surface waters. Aquatic Sciences, 2005, 67(3): 292-307. DOI:10.1007/s00027-005-0779-0 |
| [38] |
Megali Amado A, Cotner JB, Suhett AL et al. Contrasting interactions mediate dissolved organic matter decomposition in tropical aquatic ecosystems. Aquatic Microbial Ecology, 2007, 49: 25-34. DOI:10.3354/ame01131 |
| [39] |
Ouyang EM, Zhang XH, Wang W. Three-dimensional fluorescence spectroscopy in the analysis of organic pollution type of urban waters. Water Resources Protection, 2007, 23(3): 56-59. [欧阳二明, 张锡辉, 王伟. 城市水体有机污染类型的三维荧光光谱分析法. 水资源保护, 2007, 23(3): 56-59.] |
| [40] |
Sulzberger B, Durisch-Kaiser E. Chemical characterization of dissolved organic matter (DOM): A prerequisite for understanding UV-induced changes of DOM absorption properties and bioavailability. Aquatic Sciences, 2009, 71(2): 104-126. DOI:10.1007/s00027-008-8082-5 |
| [41] |
Tranvik L, Kokalj S. Decreased biodegradability of algal DOC due to interactive effects of UV radiation and humic matter. Aquatic Microbial Ecology, 1998, 14(3): 301-307. |
| [42] |
Spencer R, Stubbins A, Hernes PJ et al. Photochemical degradation of dissolved organic matter and dissolved lignin phenols from the Congo River. Journal of Geophysical Research: Biogeoences, 2015, 114(G3). DOI:10.1029/2009JG000968 |
| [43] |
Rasilo T, Prairie YT, del Giorgio PA. Large-scale patterns in summer diffusive CH4 fluxes across boreal lakes, and contribution to diffusive C emissions. Global Change Biology, 2015, 21(3): 1124-1139. DOI:10.1111/gcb.12741 |
 2022, Vol. 34
2022, Vol. 34 


