(2: 合肥师范学院生命科学学院,合肥 230061)
(3: 陕西省环境科学研究院,西安 710061)
(2: School of Life Sciences, Hefei Normal University, Hefei 230061, P.R.China)
(3: Shaanxi Provincial Academy of Environmental Science, Xi'an 710061, P.R.China)
渭河是黄河的第一大支流,发源于甘肃省定西市渭源县鸟鼠山,主要流经甘肃、宁夏、陕西三省(自治区),至陕西渭南市潼关县汇入黄河,地形特点为西高东低,从西至东横贯富饶的关中平原,为典型的季节性多泥沙河流[1]. 渭河流域总面积13.5万km2,占据陕西省64 % 的人口、52 % 的耕地、72 % 的灌溉面积和60 % 以上的生产总值,是“一带一路”中线和中心线两条路线上的必经之地,在维持地区可持续发展与生态平衡中具有重要意义[2]. 渭河流域在黄河治理开发中占有重要地位,牵动着我国西北地区的社会经济发展. 近些年来由于气候变化和人类活动的加剧,渭河流域的水文和水生态环境发生了重大变化. 第一,水土流失. 渭河流经黄土高原地区,水土流失较为严重,导致渭河含沙量高,其多年平均输沙量为9041.7×104 t/a[3]. 第二,水资源开发利用强度大. 渭河流域人类活动剧烈,生活和工农业用水量巨大,流域水资源较为短缺、生态流量偏少[4]. 第三,水工构筑物增多. 渭河流域干支流橡胶坝的建设与运行,改变了自然水文形势,干扰了河流廊道时间尺度上的自然动态[5]. 第四,某些河段存在水体污染. 自2011年实施渭河综合治理工程以来,渭河水质明显好转,然而由于排污强度大,个别支流依然污染严重[6-8].
作为典型的季节性多沙河流,渭河径流、泥沙的空间分布特征为水沙异源,径流大部分来自于秦岭北麓,但泥沙大部分来源于左岸黄土高原,大量泥沙淤积,河床抬升,造成“小洪水、高水位”的后果[3, 9-10]. 秦岭北麓是重要的水源涵养区及生态交错带,生态环境脆弱易受到破坏,渭河右岸支流多源于此,河流含沙量低[10]. 多沙河流浊度高,泥沙颗粒易携带污染物,对水生生物类群产生不利影响;低含沙河流中水体悬浮泥沙颗粒少,透明度高,营养物质分布均匀,河流生态系统稳定[11]. 鉴于渭河干流水环境问题的突出性和秦岭水系生态环境的脆弱性,为深入了解环境因素对不同含沙河流中水生生物的影响,有必要对渭河干流(多沙)和右岸支流(少沙)水生生物类群群落结构特征进行对比研究,利用指示生物评价该区域的水体环境状况.
浮游动物是水域生态系统中重要的初级消费者,有着个体小、数量多等特点,以藻类、细菌、碎屑等为食,同时它们是鱼类和其他水生动物的食物,是水生态系统食物网中物质转化、能量流动和信息传递的主要纽带[12-13],浮游动物对水环境因子变化响应敏感,其群落结构对于水生态系统健康具有重要的指示作用[14]. 渭河干流及其秦岭北麓支流浮游动物的相关报道甚少,仅王硕等[15]、白海锋等[16]开展过零星研究,且大多数样点布设在渭河北岸支流,鲜有对秦岭北麓支流的研究. 以往研究的薄弱限制了对渭河干流及秦岭北麓支流浮游动物现状的了解,鉴于此,本研究于2017年秋季和2018年春季对渭河干流及其秦岭北麓典型支流浮游动物群落结构和环境因子开展调查研究,研究结果有助于认识渭河流域水生态现状及其主要环境驱动因子,从而为渭河流域生态环境保护和开发利用提供科学依据.
1 材料与方法 1.1 采样点位设置2017年10—11月(秋季)及2018年4—5月(春季)以渭河干流和秦岭北麓支流石头河、黑河、灞河、石堤河、罗敷河为研究对象,开展了系统的生态调查. 在具有不同生境、流速、水深等环境因子的地方,避开了人类活动比较大的河段,设置具有代表性的采样断面,渭河干流设置15个断面(其中渭河上游为第1~6断面,渭河中游为第7~11断面,渭河下游为第12~15断面),为了同级支流更好地比较,每条支流设5个断面,每个断面均设3个样点. 研究区域及样点设置见图 1.

|
图 1 渭河干流与其秦岭北麓支流采样断面分布 (采样断面自上游至下游顺序排列;W:渭河干流;ST:石头河;H:黑河;B:灞河;SD:石堤河;LF:罗敷河) Fig.1 Distribution of sampling sections in the Weihe River mainstem and its tributaries from the northern foot of Qinling Mountains (sequential arrangement of sampling sections from upstream to downstream; W: Weihe River mainstem; ST: Shitou River; H: Heihe River; B: Bahe River; SD: Shidi River; LF: Luofu River) |
原生动物和轮虫定量样品在各断面取水样3 L,并当场用15 mL鲁哥试剂固定. 样品带回实验室后,放在稳定的实验台上,静置沉淀24 h,用细小的虹吸管吸取上清液至样品剩余500 mL,再次静置24 h,用虹吸管吸取上清液,直至浮游动物样品沉淀体积至50 mL后加入4 % 的甲醛溶液固定.
枝角类和桡足类定量样品用5 L采水器采集混合水样20 L. 水样经25#浮游生物网(孔径64 μm)过滤后收集样品装入100 mL样品瓶,用4 % 的甲醛溶液固定.
1.2.2 浮游动物定量样品鉴定浮游动物样品鉴定前进行预处理. 将样品静置沉淀24 h,用移液枪吸取上清液至样品体积为30~40 mL,参照文献[17-20],用Zeiss Axio Imager 4.2显微镜在100~1000倍下对浮游动物进行种类鉴定与计数. 鉴定前充分混匀浓缩样品,其中原生动物和轮虫用1 mL计数框进行全片计数,每瓶样品计数两片取其平均值,每片结果与平均数之差不大于±15 %,若超过±15 % 则必须进行第3片计数,最后将两个相近值的平均数作为最后的计算结果,而枝角类和桡足类用5 mL计数框将样品分若干次全部计数.
1.2.3 浮游动物定性样品采集与鉴定定性样品用25#浮游生物网在上层水体呈“∞”字形捞取3~5 min,并将滤取的样品放入100 mL样品瓶中,现场加入4 % ~5 % 的甲醛溶液固定,参照文献[17-20],用Zeiss Axio Imager 4.2显微镜在100~1000倍下进行浮游动物种类鉴定.
1.2.4 水体理化指标的测定水温(WT)、电导率(Cond)、溶解氧(DO)、pH和浊度(Turb)由哈希HQ40D便携式多参数分析仪和哈希2100Q便携式浊度仪在野外采样现场测定;在离水面1/3处用Global Water FP211直读式流速仪测定采样点平均流速(V)[21]. 根据《水和废水监测分析方法》(第四版)测定总磷(TP)、总氮(TN)、氨氮(NH3-N)、硝酸盐氮(NO3--N)和亚硝酸盐氮(NO2--N)浓度[22];水中叶绿素a(Chl.a)浓度采用热乙醇-分光光度计法测定[23].
1.3 数据处理与分析 1.3.1 生物量的计算常见的浮游动物个体湿重见《淡水浮游生物研究方法》[17]、《湖泊富营养调查规范》(第二版)[24]和《湖泊生态调查观测与分析》[25],其他浮游动物用与其形态相似的几何体积公式求体积,再乘以水的密度估算其个体湿重.
1.3.2 浮游动物物种多样性指数物种多样性的计算采用Shannon-Wiener指数(H′)[26]、物种丰富度指数(D)[27]和物种均匀度指数(J)[28],计算公式为:
| H′=−s∑i=1(Pi)(lnPi) | (1) |
| D=(S−1)/lnN | (2) |
| J=H′/lnS | (3) |
式中,Pi为第i种浮游动物的个体数与样品中浮游动物总个体数的比值(Ni/N),Ni表示第i种浮游动物的个体数,N表示群落中浮游动物的总个体数;S表示浮游动物种类总数.
1.3.3 数据分析数据统计采用Excel 2010软件. 多样性指数计算使用Primer 6.0软件. 采用ArcGIS和Origin 2018软件绘制文中图件. 理化数据(除pH外)进行数据转换使其呈正态分布后,用CANOCO 4.5软件对浮游动物优势种和环境因子进行DCA除趋势对应分析,得出物种的单峰响应值SD(梯度),SD < 3时采用RDA冗余度分析,3<SD<4时两种分析方法均可,SD>4时采用CCA典范对应分析,为了优化分析,P值大于0.05和膨胀因子(inflation factor)大于20的环境因子均被剔除,最后对数据进行499次蒙特卡洛置换检验,判定显著影响浮游动物优势种的环境因子. 利用SPSS 25进行单因素方差分析(one-way ANOVA),确定不同采样时期渭河干流及其秦岭北麓支流之间水环境、浮游动物密度和生物量、物种多样性之间差异的显著性.
2 结果与分析 2.1 水体理化指标时间尺度上,2017年秋季渭河干流与秦岭北麓支流的水温、电导率和Chl.a浓度低于2018年春季,而浊度、TP和NO2--N浓度高于2018年春季. 空间尺度上,对于渭河干流,2017年秋季下游浊度和NO2--N浓度显著高于中游(P < 0.05),Cond随着上、中、下游依次降低,上游显著高于下游(P < 0.05),其余水环境参数差异不明显. 2018年春季水温随着上、中、下游依次升高,下游显著高于上游(P < 0.05),NH3-N浓度随着上、中、下游显著降低,而Chl.a浓度显著升高(P < 0.05),下游的流速要显著低于上游和中游(P < 0.05),其余水环境参数差异不明显. 对于秦岭北麓支流,石堤河和罗敷河Chl.a浓度高于其余支流;2018年春季罗敷河Chl.a浓度显著低于其余支流(P < 0.05). 两次调查均发现灞河和石堤河N、P营养盐高于其余支流,其余水环境参数差异不明显. 渭河干流及秦岭北麓典型支流间淤泥、沙、卵石等底质具有显著差异(P < 0.05),渭河干流样点的底质类型多以淤泥和沙为主,而支流样点则具有较多的卵石及大石.
2.2 浮游动物的种类组成两次调查共鉴定出浮游动物136种,其中原生动物65种,占浮游动物总数的47.8 %;轮虫44种,占32.4 %;枝角类15种,占11.0 %;桡足类12种,占8.8 %.
2017年秋季共鉴定出浮游动物48种,其中原生动物29种,占浮游动物总数的60.4 %;轮虫4种,占8.3 %;枝角类8种,占16.7 %;桡足类7种,占14.6 %. 渭河干流浮游动物种类数为14种,在空间分布上表现为中游高于上游和下游;秦岭北麓典型支流浮游动物种类数为37种,其中石堤河浮游动物种类数最多,为15种;黑河最少,为4种;罗敷河、石头河和灞河分别为9、7和6种.
2018年春季共鉴定出浮游动物109种,其中原生动物44种,占浮游动物总数的40.4 %;轮虫42种,占38.5 %;枝角类13种,占11.9 %;桡足类12种,占9.2 %. 渭河干流浮游动物种类数为52种,种类数随上、中、下游依次增大,下游最多;秦岭北麓典型支流浮游动物种类数为68种,其中石堤河浮游动物种类数最多,为23种;罗敷河最少,为9种;黑河、灞河和石头河分别为20、20和15种.
2.3 浮游动物密度和生物量2017年秋季浮游动物密度的变化范围为0~96.82 ind./L,以原生动物和轮虫为主,分别占59.5 % 和40.1 %. 浮游动物生物量介于0~0.1055 mg/L之间,其中轮虫的相对生物量达89.3 %. 渭河干流浮游动物密度和生物量分别为9.02 ind./L和0.0051 mg/L,秦岭北麓典型支流为42.78 ind./L和0.0229 mg/L. 罗敷河密度和生物量显著高于渭河干流和其他支流(P < 0.05). 渭河干流上、中、下游之间密度和生物量没有显著性差异,浮游动物密度(17.05 ind./L)要高于上游和下游,而上游浮游动物生物量较高(0.0120 mg/L);秦岭北麓支流中罗敷河浮游动物密度和生物量最高(图 2).
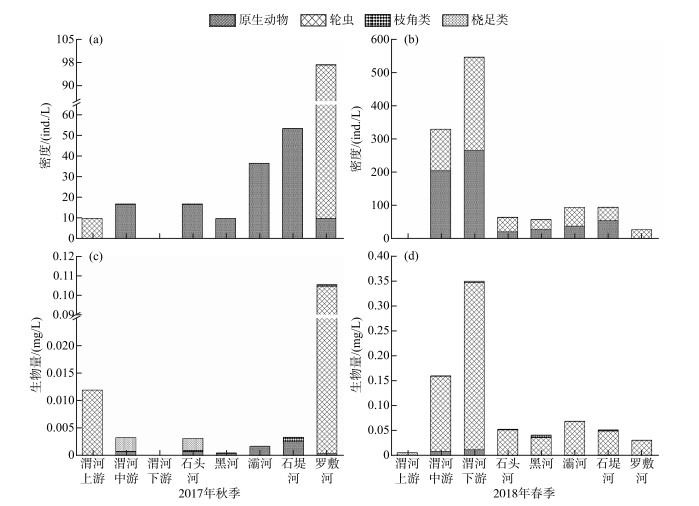
|
图 2 2017年秋季(a、c)和2018年春季(b、d)渭河干流及其秦岭北麓典型支流浮游动物密度及生物量 Fig.2 Zooplankton density and biomass in the Weihe River mainstem and its tributaries from the northern foot of Qinling Mountains in autumn 2017 (a, c) and spring 2018 (b, d) |
2018年春季浮游动物密度的变化范围为1.65~546.29 ind./L,以原生动物和轮虫为主,分别占50.9 % 和48.9 %. 浮游动物生物量介于0.0078~0.3510 mg/L之间,其中轮虫的相对生物量占比达93.2 %. 渭河干流浮游动物密度和生物量分别为292.89 ind./L和0.1734 mg/L,秦岭北麓典型支流为70.15 ind./L和0.0508 mg/L. 渭河干流密度和生物量显著高于秦岭北麓支流(P < 0.05). 渭河干流上、中、下游之间密度和生物量具有显著性差异(P < 0.05),随着上、中、下游浮游动物密度和生物量依次增大,下游密度和生物量最高,为546.29 ind./L和0.3510 mg/L;秦岭北麓支流密度和生物量没有显著性差异,浮游动物密度最高的是石堤河,生物量最高的是灞河,而罗敷河浮游动物密度和生物量均最低(图 2).
2.4 浮游动物优势种和多样性指数以优势度>0.02为标准,渭河干流及秦岭北麓支流浮游动物优势种共38种,其中原生动物21种,占优势种类的55.3 %;轮虫17种,占优势种类的44.7 %,且恩茨筒壳虫(Tintinnidium entzii)为两次调查共有优势种. 2017年秋季浮游动物优势种17种,以似铃壳虫(Tintinnopsis sp.)、草履虫(Paramecium sp.)和砂壳虫(Difflugia sp.)为主;而2018年春季优势种22种,以单趾轮虫(Monostyla sp.)、腔轮虫(Lecane sp.)和鞍甲轮虫(Lepadella sp.)为主.
2017年秋季浮游动物的Shannon-Wiener指数(H′)为0~0.95;丰富度指数(D)为0~0.82;均匀度指数(J)值为0~0.70. 渭河干流多样性指数均为中游>上游>下游,而秦岭北麓支流中石堤河多样性指数最大. 2018年春季Shannon-Wiener指数(H′)为0.24~1.97;丰富度指数(D)为0.29~2.39;均匀度指数(J)为0.12~0.79. 渭河干流多样性指数从上至下依次增大,而秦岭北麓支流中灞河和石堤河多样性指数较高,罗敷河最低(图 3).

|
图 3 2017年秋季(a、c、e)和2018年春季(b、d、f)渭河干流及秦岭北麓典型支流浮游动物多样性指数(平均值+标准误) (不同的字母表示河段或河流之间的差异显著(P < 0.05)) Fig.3 Zooplankton diversity indices(mean + standard error) in the Weihe River mainstem and its tributaries from the northern foot of Qinling Mountains in autumn 2017 (a, c, e) and spring 2018 (b, d, f) (Different letters denote significant differences between sections or rivers (P < 0.05)) |
CCA分析结果表明,2017年秋季影响干流浮游动物群落的环境因子主要是水温、电导率和Chl.a,第1、2轴特征值分别为0.991和0.639,物种环境相关系数分别为0.996和0.961,分别解释了37.9 % 和24.4 % 的物种-环境变异累积比. 影响支流浮游动物群落变化的环境因子为水温和Chl.a,第1、第2轴特征值分别为0.927和0.735,物种环境相关系数分别为0.993和0.933,分别解释了13.9 % 和11.1 % 的物种-环境变异累积比. 2018年春季影响渭河干流浮游动物的环境因子为pH、TN和电导率,第1、第2轴特征值分别为0.693和0.473,物种环境相关系数分别为0.962和0.990,分别解释了46.3 % 和31.6 % 的物种-环境变异累积比. 对支流浮游动物群落变化影响较大的环境因子为浊度、Chl.a、DO和pH. 第1、2轴特征值分别为0.961和0.845,物种环境相关系数分别为0.995和0.996,分别解释了11.9 % 和10.4 % 的物种-环境变异累积比(图 4).
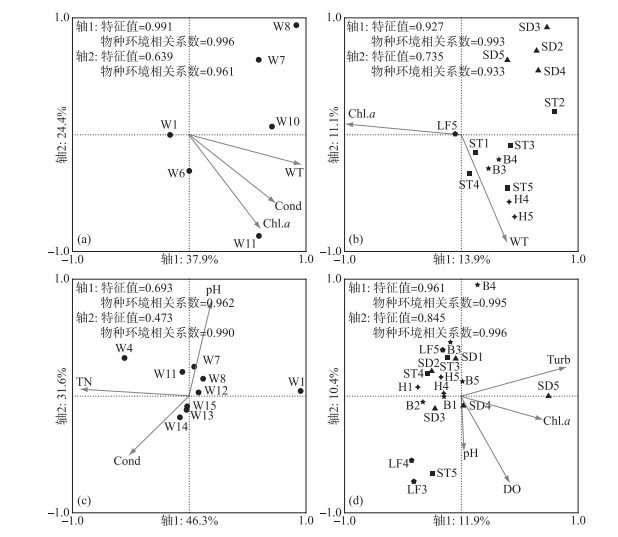
|
图 4 2017年秋季和2018年春季浮游动物采样断面与环境因子的CCA图 (a. 2017年秋季渭河干流;b. 2017年秋季秦岭北麓典型支流;c. 2018年春季渭河干流;d. 2018年春季秦岭北麓典型支流;W:渭河干流;ST:石头河;H:黑河;B:灞河;SD:石堤河;LF:罗敷河) Fig.4 CCA biplots of zooplankton sampling cross-sections and environmental factors in autumn 2017 and spring 2018 (a. the Weihe River mainstem during autumn 2017; b. tributaries from the northern foot of Qinling Mountains in autumn 2017; c. the Weihe River mainstem in spring 2018; d. tributaries from the northern foot of Qinling Mountains in spring 2018;W: Weihe River mainstem; ST: Shitou River; H: Heihe River; B: Bahe River; SD: Shidi River; LF: Luofu River) |
本研究发现渭河干流及其秦岭北麓支流浮游动物以普生性的小型浮游动物为主,占总种数的80.2 %. 两次调查均表明浮游动物总密度高低主要取决于原生动物(占比分别为59.5 % 和50.9 %)和轮虫(占比分别为40.1 % 和48.9 %),且轮虫的相对生物量最高(分别为89.3 % 和93.2 %),大型浮游动物种类数较少,这与许多已知河流浮游动物群落组成类似[29-32]. 将本研究中浮游动物群落结构与其同一流域不同调查时期的研究结果进行对比(表 1),由于采样频率、采样断面和平行样设置以及鉴定水平等原因,同一研究区域研究结果会有差异,但整体上看,渭河流域浮游动物种类数增加且趋于小型化,春、秋两季浮游动物密度显著增加. 这可能是由于轮虫类为孤雌生殖,该生殖方式使得轮虫类有着高繁殖率和短繁殖时间,使其在较短时间内达到很高的密度,从而快速适应河流水文条件的波动和理化条件的改变,因此在河流生态系统中浮游动物通常以轮虫为主[33-34].
| 表 1 渭河流域段不同时间段浮游动物群落结构的变化 Tab. 1 Changes in the community structure of zooplankton in different time periods in the Weihe River Basin |
河流浮游动物群落结构特征主要受水体理化指标、浮游植物等因子影响. 水体理化指标如流速过大会影响游泳能力弱的浮游动物生存;如水温、溶解氧、pH值、营养盐浓度会通过影响浮游动物新陈代谢、生长发育等进而影响其群落结构[37-39]. 研究发现渭河干流及秦岭北麓支流2018年春季浮游动物现存量显著高于2017年秋季. 浮游动物对水温的适应范围不同,使其出现季节性演替现象[36]. 溶解氧则直接影响浮游动物呼吸作用和生殖速率[40]. 不同类群浮游动物有其特定的适宜pH值范围,此外pH还可以和营养盐一样通过影响浮游植物现存量间接影响浮游动物生长繁殖[41-42]. 浮游植物作为藻食性浮游动物食物,其现存量的变化会影响浮游动物的生长繁殖. 有研究表明,浮游动物现存量与浮游植物细胞密度呈显著正相关关系[43].
多样的环境导致渭河浮游动物群落分布上、下游存在空间差异. 2017年秋季,渭河干流浮游动物密度在中游大于上游,但生物量却正好相反,这是由于中游浮游动物密度以原生动物为主,上游以轮虫为主,而轮虫个体湿重大于原生动物. 秋季渭河干流浮游动物现存量从上游至下游依次减小. 渭河干流上游河段窄,落差较大,上游落差约为1400 m,而中、下游河段落差减小,河段变宽,水流平缓,水体环境相对稳定,理论上更适宜浮游动物生长繁殖. 但在本研究中却表现出相反的结果,推测可能是由于渭河中下游发生较大的秋淋洪水造成的[44]. 强降雨导致河流流量快速增加,同时加强了对黄土高原两岸土壤的冲刷力度,水中的泥沙含量增加,下游水体浊度(1283.08 NTU)远高于中游(202.83 NTU),研究表明,浊度高制约着浮游动物的分布与丰度[45]. 与此同时,强降雨导致下游流速(1.03 m/s)增大,不适宜游泳能力弱的浮游动物生存. 2018年春季渭河干流浮游动物现存量从上游至下游依次增大. 2018年春季渭河干流水温从上至下逐渐升高,浊度随之降低,水温和浊度的改变有利于水中浮游动物的生长发育和繁殖,同时下游流速(0.06 m/s)降低,也为浮游动物提供了更加适宜的生存环境[45-46].
渭河秦岭北麓支流浮游动物现存量时空差异明显. 2017年秋季罗敷河浮游动物密度和生物量高于其它支流,这与罗敷河水中叶绿素a浓度较高、浮游动物的藻类食物来源充足有关[47-48],而2018年春季由于罗敷河水中叶绿素a浓度最低,其浮游动物的现存量在北麓支流中也相应最少. 与罗敷河相比,灞河和石堤河浮游动物密度和生物量在2018年春季各支流中较大,其叶绿素a和营养盐浓度较高. 秦岭北麓支流浮游动物的季节变化表明浮游动物对环境因子变化的响应十分敏感[31, 49],而藻类等食物来源是影响秦岭北麓支流浮游动物群落结构的重要因素之一.
渭河秦岭北麓支流地理气候特点和生态环境因子差异显著,人类活动干扰程度不一,影响干支流浮游动物分布的主要环境因子有所不同. 渭河干流流经黄土高原,地表径流携带大量泥沙和有机质汇入河流,尤其是在丰水期,高含沙量显然会影响渭河干流水生生物的生境质量. 有研究指出,电导率与水中叶绿素a浓度具有显著相关性[50],电导率通过影响浮游植物群落结构间接影响浮游动物的分布[11]. 此外,多沙水体中颗粒物质会导致进入水体的光照发生衰减,从而抑制浮游植物生长[11],间接影响浮游动物的生长. 将本文调查结果与多沙河流黄河干流兰州段[31](含沙量为2.43 kg/m3)、恒河[45](3.92 kg/m3),低含沙量的淮河干流[30](0.23~0.88 kg/m3)和长江干流中游[32](0.077 kg/m3)相比较[51],浊度、电导率均为影响多沙河流浮游动物群落结构最重要的环境因子. 渭河秦岭北麓支流为山间溪流,浊度仅为渭河干流的1 % ~10 %,浮游植物虽可以充分地进行光合作用,但湍急的水流和山溪低冷的水温抑制浮游植物的生长,影响浮游动物的食物供给.
渭河干流及秦岭北麓典型支流水生态环境差异明显,本研究以浮游动物为指示生物,发现臂尾轮虫(Brachionus sp.)、龟甲轮虫(Keratella sp.)等水体富营养化的指示生物[36]主要出现在2018年春季渭河中下游,说明春季渭河中下游富营养化程度较高. 根据Shannon-Wiener多样性指数水质生物评价分级标准,2017年秋季渭河干流与秦岭北麓支流属于重污染;2018年春季渭河干流上中游属于重污染,下游属于中污染,而秦岭北麓支流属于重污染,接近中污染. 相较于本团队对该区域浮游植物多样性指数水质生物评价分析可知,2017年秋季渭河干流属于重污染,秦岭北麓支流属于中污染;2018年春季渭河干流与秦岭北麓支流属于中污染,接近轻污染[52]. 因此,河流的水质生物评价应该在多样性指数生物评价的基础上充分结合多种水生生物类群,并参考水环境参数检测结果,为所研究区域的环境监测和生态保护提供全面可靠的数据. 此外,为了更全面了解渭河干流及秦岭北麓典型支流浮游动物群落结构以及环境因素对不同含沙河流中浮游动物的影响机制,还需要长期坚持对该研究区域水环境和水生生物的调查.
4 结论1) 渭河干流及秦岭北麓支流共检出浮游动物136种,秦岭北麓支流浮游动物物种数高于渭河干流. 浮游动物总密度高低主要取决于原生动物和轮虫,轮虫类高繁殖率和短繁殖时间的孤雌生殖使其在浮游动物现存量中占比最高. 春季浮游动物现存量显著高于秋季.
2) 浊度、电导率是影响渭河干流(多沙)浮游动物群落结构最重要的环境因子,而藻类等食物来源是影响秦岭北麓支流浮游动物群落结构的重要因素之一. 秋季渭河干流与秦岭北麓支流浮游动物现存量差异不大. 春季水体流速较快和水温较低的秦岭北麓支流不适宜浮游动物生存,其浮游动物现存量低于渭河干流.
3) 秋季渭河干流浮游动物现存量从上至下逐渐减小,而春季逐渐增大. 相较于秋季干流中下游的强降雨使下游浊度和流速增高,春季干流适宜的水温和下游浊度与流速的降低更适宜游泳能力弱的浮游动物生存. 秋季秦岭北麓支流中叶绿素a浓度较高,食物来源充足的罗敷河浮游动物现存量最高. 春季罗敷河叶绿素a浓度最低,浮游动物现存量也最低;而灞河和石堤河叶绿素a和营养盐浓度较高,浮游动物现存量较高.
| [1] |
Wang SJ, Lu AG, Dang SH et al. Ammonium nitrogen concentration in the Weihe River, central China during 2005-2015. Environmental Earth Sciences, 2016, 75(6): 1-10. DOI:10.1007/s12665-015-5224-7 |
| [2] |
Song JX, Cheng DD, Li Q et al. An evaluation of river health for the Weihe River in Shaanxi Province, China. Advances in Meteorology, 2015, 2015: 476020. DOI:10.1155/2015/476020 |
| [3] |
Bai YP, Zhao GJ, Zhang LM et al. Spatiotemporal variation of sediment load in the Weihe River Basin in recent 55 years and the driving factors. Journal of Soil and Water Conservation, 2020, 34(4): 91-97. [白云鹏, 赵广举, 张丽梅等. 近55年来渭河流域输沙变化及驱动因子分析. 水土保持学报, 2020, 34(4): 91-97.] |
| [4] |
Luo WG, Guo ZZ, Kou XM. Status assessment and improvement measures study on ecological water volume in Wei River. Northwest Water Power, 2018(6): 99-103, 108. [罗文刚, 郭正组, 寇晓梅. 渭河生态水量现状评价及改善措施探讨. 西北水电, 2018(6): 99-103, 108.] |
| [5] |
Dong ZR. Ecological compensations for damed rivers. Engineering Science, 2006, 8(1): 5-10. [董哲仁. 筑坝河流的生态补偿. 中国工程科学, 2006, 8(1): 5-10.] |
| [6] |
Cai M, Bai D, Li HE et al. Water-body pollution status of the Weihe River and research of the counter-measures for the pollution prevention and control. Journal of Shaanxi Water Power, 2001, 17(1): 38-40. [蔡明, 白丹, 李怀恩等. 渭河水体污染状况及污染防治对策研究. 陕西水力发电, 2001, 17(1): 38-40.] |
| [7] |
Wang XQ, Zhou XD, Li HE. Trend analysis on water environmental quality and industrial development in Weihe River Basin. Water Resources Protection, 2001, 17(1): 18-20. [王西琴, 周孝德, 李怀恩. 渭河流域工业发展与水环境质量趋势分析. 水资源保护, 2001, 17(1): 18-20.] |
| [8] |
Zhang QY, Xu PP, Qian H et al. Comprehensive evaluation of water quality of water river and its change trend analysis. Environmental Engineering, 2017, 35: 247-252. [张奇莹, 徐盼盼, 钱会等. 渭河入黄水质的综合评价及变化趋势分析. 环境工程, 2017, 35: 247-252.] |
| [9] |
Zhang GG, Zhao KY, Yang HM et al. Riverbed evolution and deposit extension headwater in lower reaches of Weihe River. Northwest Water Resources & Water Engineering, 2003, 14(3): 35-38, 46. [张根广, 赵克玉, 杨红梅等. 渭河下游河床演变特征及其淤积上延分析. 西北水资源与水工程, 2003, 14(3): 35-38, 46.] |
| [10] |
Fan YN, Liu K, Chen SS et al. Spatial pattern analysis on water conservative functionality of land ecosystem in northern slope of Qinling mountains. Bulletin of Soil and Water Conservation, 2017, 37(2): 50-56. [范亚宁, 刘康, 陈姗姗等. 秦岭北麓陆地生态系统水源涵养功能的空间格局. 水土保持通报, 2017, 37(2): 50-56.] |
| [11] |
Zhao GN, Pan BZ, Li YP et al. Phytoplankton in the heavy sediment-laden Weihe River and its tributaries from the northern foot of the Qinling Mountains: Community structure and environmental drivers. Environmental Science and Pollution Research International, 2020, 27(8): 8359-8370. DOI:10.1007/s11356-019-07346-6 |
| [12] |
Guo PY, Shen HT, Liu AC et al. The species composition, community structure and diversity of zooplankton in Changjiang Estuary. Chinese Journal of Plant Ecology, 2003, 23(5): 892-900. [郭沛涌, 沈焕庭, 刘阿成等. 长江河口浮游动物的种类组成、群落结构及多样性. 生态学报, 2003, 23(5): 892-900. DOI:10.3321/j.issn:1000-0933.2003.05.008] |
| [13] |
Yan QY, Yu YH, Feng WS. Corresponding relations between DNA fingerprinting topological structure and species composition of plankton community inDongting Lake. Chinese Journal of Plant Ecology, 2005, 25(9): 2221-2226. [颜庆云, 余育和, 冯伟松. 洞庭湖浮游生物群落DNA指纹拓扑结构与物种组成对应关系. 生态学报, 2005, 25(9): 2221-2226. DOI:10.3321/j.issn:1000-0933.2005.09.013] |
| [14] |
Wu L, Feng WS, Chen XJ et al. Community structure characteristics of zooplankton in Yili region of Xinjiang in summer. Chinese Journal of Applied Ecology, 2008, 19(1): 163-172. [吴利, 冯伟松, 陈小娟等. 新疆伊犁地区夏季浮游动物群落结构特征. 应用生态学报, 2008, 19(1): 163-172.] |
| [15] |
Wang S, Yang T, Li XP et al. Zooplankton community structure and the water quality in the Wei River basin. Acta Hydrobiologica Sinica, 2019, 43(6): 1333-1345. [王硕, 杨涛, 李小平等. 渭河流域浮游动物群落结构及其水质评价. 水生生物学报, 2019, 43(6): 1333-1345. DOI:10.7541/2019.157] |
| [16] |
Bai HF, Zhao NX, Yin XW et al. Community structure and relationship with environmental factors in zooplankton in Weihe River Basin, Northwest China. Journal of Dalian Fisheries University, 2014, 29(3): 260-266. [白海锋, 赵乃锡, 殷旭旺等. 渭河流域浮游动物的群落结构及其与环境因子的关系. 大连海洋大学学报, 2014, 29(3): 260-266.] |
| [17] |
Zhang ZS, Huang XF. Research methods in limnoplankton. Beijing: Science Press, 1991. [章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.]
|
| [18] |
Wang JJ. Freshwaterrotifera sinica. Beijing: Science Press, 1961. [王家楫. 中国淡水轮虫志. 北京: 科学出版社, 1961.]
|
| [19] |
Jiang XZ, Du NS. Fauna sinica·arthropoda·crustacea·freshwater cladocera. Beijing: Science Press, 1979. [蒋燮治, 堵南山. 中国动物志·节肢动物门·甲壳纲·淡水枝角类. 北京: 科学出版社, 1979.]
|
| [20] |
Shen JR. Fauna sinica·arthropoda·crustacea·freshwater copepoda. Beijing: Science Press, 1979. [沈嘉瑞. 中国动物志·节肢动物门·甲壳纲·淡水桡足类. 北京: 科学出版社, 1979.]
|
| [21] |
Xie YB. Water information technology. Beijing: China Water Conservancy and Hydropower Press, 2009. [谢悦波. 水信息技术. 北京: 中国水利水电出版社, 2009.]
|
| [22] |
Editorial board of "Water and wastewater monitoring and analysis method", Ministry of Environmental Protection of the People's Republic of China. Monitoring and analysis methods of water and wastewater: fourth edition. Beijing: China Environmental Science Press, 2002. [国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法: 第四版. 北京: 中国环境科学出版社, 2002.]
|
| [23] |
Chen YW, Chen KN, Hu YH. Discussion on possible error for phytoplankton chlorophyll-a concentration analysis using hot-ethanol extraction method. J Lake Sci, 2006, 18(5): 550-552. [陈宇炜, 陈开宁, 胡耀辉. 浮游植物叶绿素a测定的"热乙醇法" 及其测定误差的探讨. 湖泊科学, 2006, 18(5): 550-552. DOI:10.18307/2006.0519] |
| [24] |
Jin XC, Tu QY. Standard for investigation of lake eutrophication: Second edition. Beijing: China Environment Publishing Group, 1990: 245-251. [金相灿, 屠清瑛. 湖泊富营养化调查规范: 第二版. 北京: 中国环境科学出版社, 1990: 245-251.]
|
| [25] |
Huang XF. Observation and analysis of lake ecological investigation. Beijing: Standards Press of China, 1999: 85-91. [黄祥飞. 湖泊生态调查观测与分析. 北京: 中国标准出版社, 1999: 85-91.]
|
| [26] |
Shannon CE, Weaver W, Wiener N. The mathematical theory of communication. Physics Today, 1950, 3(9): 31-32. DOI:10.1063/1.3067010 |
| [27] |
Margalef R. Information theory in ecology. International Journal of General Systems, 1958, 3: 36-71. |
| [28] |
Pielou EC. Species-diversity and pattern-diversity in the study of ecological succession. Journal of Theoretical Biology, 1966, 10(2): 370-383. DOI:10.1016/0022-5193(66)90133-0 |
| [29] |
Chen H, Liu Q, Pan JX et al. Spatial and temporal variation of the plankton community and its relationship with environmental factors in the city section of the Ba River. Acta Ecologica Sinica, 2019, 39(1): 173-184. [陈红, 刘清, 潘建雄等. 灞河城市段浮游生物群落结构时空变化及其与环境因子的关系. 生态学报, 2019, 39(1): 173-184. DOI:10.5846/stxb201711282130] |
| [30] |
Wu L, Li YL, Chen YS. Characteristics of community structures of zooplankton in the mainstream of Huaihe River. J Lake Sci, 2015, 27(5): 932-940. [吴利, 李源玲, 陈延松. 淮河干流浮游动物群落结构特征. 湖泊科学, 2015, 27(5): 932-940. DOI:10.18307/2015.0521] |
| [31] |
Bai HF, Wang F, Zhang XL et al. Characteristics of zooplankton community structure for the Yellow River in Lanzhou City. Journal of Hydroecology, 2015, 36(5): 51-57. [白海锋, 王丰, 张星朗等. 黄河兰州市区段秋季浮游动物群落结构特征. 水生态学杂志, 2015, 36(5): 51-57. DOI:10.15928/j.1674-3075.2015.05.008] |
| [32] |
Luo D, Li XH, Yu YH et al. Spatial distribution of zooplankton in the main stem of the middle Yangtze River. Acta Hydrobiologica Sinica, 2019, 43(S1): 3-8. [罗丹, 李星浩, 余育和等. 长江中游干流浮游动物空间分布. 水生生物学报, 2019, 43(S1): 3-8.] |
| [33] |
Holst H, Zimmermann H, Kausch H et al. Temporal and spatial dynamics of planktonic rotifers in the Elbe Estuary during spring. Estuarine, Coastal and Shelf Science, 1998, 47(3): 261-273. DOI:10.1006/ecss.1998.0364 |
| [34] |
Pandey A, Upadhyay HC. Studies on zooplankton diversity of western Ramganga River in Almora (Uttarakhand) India. Int J Sci Res, 2013, 5(5): 1192-1194. DOI:10.21474/IJAR01/2177 |
| [35] |
Gao HW, Li WX, Hou SM et al. Water quality evaluation of the Weihe River in Shaanxi based on zooplankton diversity index. Modern Agricultural Science and Technology, 2015(23): 210-211, 213. [高宏伟, 李文香, 侯淑敏等. 基于浮游动物多样性指数的渭河陕西段水质评价研究. 现代农业科技, 2015(23): 210-211, 213.] |
| [36] |
Jia QH, Li WX, Wang BH et al. Study on community structure and diversity of zooplankton in Shaanxi section of the main stream of Wei River. Journal of Anhui Agricultural Sciences, 2015, 43(33): 92-93, 97. [贾秋红, 李文香, 王博涵等. 渭河干流陕西段枯水期浮游动物群落结构及多样性研究. 安徽农业科学, 2015, 43(33): 92-93, 97.] |
| [37] |
Devreker D, Souissi S, Seuront L. Effects of chlorophyll concentration and temperature variation on the reproduction and survival of Temora longicornis (Copepoda, Calanoida) in the Eastern English Channel. Journal of Experimental Marine Biology and Ecology, 2005, 318(2): 145-162. DOI:10.1016/j.jembe.2004.12.011 |
| [38] |
Sarma SSS, Nandini S, Gulati RD. Life history strategies of cladocerans: Comparisons of tropical and temperate taxa. Hydrobiologia, 2005, 542(1): 315-333. DOI:10.1007/s10750-004-3247-2 |
| [39] |
Lin Q, You WH, Xu FJ et al. Zooplankton community structure and its relationship with environmental factors in Dishui Lake. Acta Ecologica Sinica, 2014, 34(23): 6918-6929. [林青, 由文辉, 徐凤洁等. 滴水湖浮游动物群落结构及其与环境因子的关系. 生态学报, 2014, 34(23): 6918-6929. DOI:10.5846/stxb201303060360] |
| [40] |
Ekau W, Auel H, Pörtner HO et al. Impacts of hypoxia on the structure and processes in pelagic communities (zooplankton, macro-invertebrates and fish). Biogeosciences, 2010, 7(5): 1669-1699. DOI:10.5194/bg-7-1669-2010 |
| [41] |
Duggan A, Garcia-Anoveros J, Corey DP. The PDZ domain protein PICK1 and the sodium channel BNaC1 interact and localize at mechanosensory terminals of dorsal root ganglion neurons and dendrites of central neurons. The Journal of Biological Chemistry, 2002, 277(7): 5203-5208. DOI:10.1074/jbc.M104748200 |
| [42] |
Pinto-Coelho R, Pinel-Alloul B, Méthot G et al. Crustacean zooplankton in lakes and reservoirs of temperate and tropical regions: Variation with trophic status. Canadian Journal of Fisheries and Aquatic Sciences, 2005, 62(2): 348-361. DOI:10.1139/f04-178 |
| [43] |
Zhang XH, Zhou Y, Long H et al. Investigation on Zooplankton in Nanji Marine Protected Area (MPA). Chinese Journal of Zoology, 2006, 41(4): 83-86. [张晓辉, 周燕, 龙华等. 南麂列岛海洋保护区浮游动物调查. 动物学杂志, 2006, 41(4): 83-86. DOI:10.13859/j.cjz.2006.04.016] |
| [44] |
Zhang GL, Sun YR. Analysis on the characteristics and impact of Weihe River 2017·10 flood. Shaanxi Water Resources, 2018(2): 45-46, 53. [张广林, 孙亚茹. 渭河2017·10洪水特性及影响分析. 陕西水利, 2018(2): 45-46, 53.] |
| [45] |
Kamboj V, Kamboj N. Spatial and temporal variation of zooplankton assemblage in the mining-impacted stretch of Ganga River, Uttarakhand, India. Environmental Science and Pollution Research International, 2020, 27(21): 27135-27146. DOI:10.1007/s11356-020-09089-1 |
| [46] |
Marques SC, Azeiteiro UM, Marques JC et al. Zooplankton and ichthyoplankton communities in a temperate estuary: Spatial and temporal patterns. Journal of Plankton Research, 2006, 28(3): 297-312. DOI:10.1093/plankt/fbi126 |
| [47] |
Froneman PW. Seasonal changes in zooplankton biomass and grazing in a temperate estuary, South Africa. Estuarine, Coastal and Shelf Science, 2001, 52(5): 543-553. DOI:10.1006/ecss.2001.0776 |
| [48] |
Agasild H, Zingel P, Tõnno I et al. Contribution of different zooplankton groups in grazing on phytoplankton in shallow eutrophic Lake Võrtsjärv (Estonia). Hydrobiologia, 2007, 584(1): 167-177. DOI:10.1007/s10750-007-0575-z |
| [49] |
Wu L, Feng WS, Zhang TL et al. Characteristics of zooplankton community and its relation to environmental factors in lake Wuhu in spring and autumn. Journal of Hydroecology, 2011, 32(2): 31-37. [吴利, 冯伟松, 张堂林等. 春、秋季武湖浮游动物群落特征及其与环境因子的关系. 水生态学杂志, 2011, 32(2): 31-37. DOI:10.15928/j.1674-3075.2011.02.005] |
| [50] |
Jiang W, Zhou C, Ji DB et al. Comparison of relationship between conduction and algal bloom in Pengxi River and Modao River in Three Gorges Reservoir. Environmental Science, 2017, 38(6): 2326-2335. DOI:10.13227/j.hjkx.201610183 |
| [51] |
Ministry of Water Resources of the People's Republic of China. 2018 Chinese river sediment bulletin, 2019. [中华人民共和国水利部. 2018年中国河流泥沙公报, 2019. ]
|
| [52] |
Zhao GN, Pan BZ, Ding YT et al. Characteristics and water quality evaluation of phytoplankton functional groups in the Weihe River mainstem and its tributaries in the northern foot of the Qinling Mountains. Acta Ecologica Sinica, 2021, 41(8): 3226-3237. [赵耿楠, 潘保柱, 丁一桐等. 渭河干流和秦岭北麓典型支流浮游植物功能群特征及水质评价. 生态学报, 2021, 41(8): 3226-3237. DOI:10.5846/stxb201906131257] |
 2022, Vol. 34
2022, Vol. 34 


