(2: 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008)
(3: 中国科学院抚仙湖高原深水湖泊研究站,玉溪 652500)
(4: 安徽师范大学生态与环境学院,芜湖 241002)
(5: 河北大学生命科学学院,保定 071002)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P.R.China)
(3: The Fuxianhu Station of Plateau Deep Lake Research, Chinese Academy of Sciences, Yuxi 652500, P.R.China)
(4: School of Ecology and Environment, Anhui Normal University, Wuhu 241002, P.R.China)
(5: School of Life Sciences, Hebei University, Baoding 071002, P.R.China)
水体因水温季节性变化引起的垂向分层是深水湖泊的重要特征之一,这种现象的形成对湖泊营养物质以及水生生物的分布具有重要影响. 由于水具有不良导热性以及4℃时密度最高的物理学特性,深水湖泊水体在温度较高的季节往往形成温度均匀混合的表层变温层、温度变化较快的中层温跃层和温度较稳定的底层均温层“三层式”温度垂直结构[1-2]. 湖泊水体的分层将严重影响水体溶解氧(DO)、溶解性有机碳(DOC)、营养盐的垂向运移与分布[3-6],进而导致浮游藻类群落结构组成及其多样性在垂向上的差异性[7-10]. 稳定的湖泊水体分层使得湖泊上层变温层营养盐含量较低、光线充足、DO浓度较高,而底层均温层营养盐浓度较高、光线匮乏、DO较低. 显然,揭示水体垂向分层对深水湖泊生态系统的影响是了解深水湖泊生态系统结构和功能的关键.
水体细菌既是消费者,又是生产者,在水生生态系统生物地球化学循环中发挥着不可替代的作用[11],是深入了解湖泊等生态系统结构与功能的关键. 作为消费者,水体细菌可以分解和利用水生生态系统中的有机物进行异养生长;作为生产者,它们能够利用真核藻类所无法吸收的可溶性无机物,将之转化为颗粒有机物进行“二次生产”. 细菌合成的物质和能量可被微型原生动物(主要是异养鞭毛虫和纤毛虫)所摄取而完成微食物环循环;而微型食植动物的生物量又可通过桡足类等浮游动物进入传统食物链[12-14]. 可见,了解湖泊水体垂向分层对水体细菌群落结构和功能的影响是了解深水湖泊生态系统物质循环和能量流动的关键.
目前有关深水湖泊水体分层对水体细菌群落结构组成和多样性的研究相对较少,有关机制仍不清楚. Paganin等[15]运用变性梯度凝胶电泳(denaturing gradient gel electrophoresis, DGGE)技术,发现不同水层水体细菌群落结构组成因水体环境因子的不同而异,而细菌物种多样性(DGGE条带数)在各水层无明显差异. 与之相反,Yang等[16]利用高通量测序技术在水库中研究发现,均温层水体细菌物种多样性和丰富度均高于变温层,这与Liu等[17]在高原深水湖泊中的研究结果一致. Yu等[4]的研究进一步发现,水库中均温层水体细菌RNA ∶DNA的比值显著高于变温层水体,指示变温层和均温层水体中水体细菌的群落功能可能存在差异. 然而,上述零星的报道只是对水体一个采样点进行的调查,未考虑水体细菌及水体环境的空间异质性,深水湖泊水体垂向分层与对流引起的水体环境中可影响浮游细菌群落的上行因素、下行因素以及理化环境因素的空间分布差异势必对细菌群落结构组成和多样性产生不同影响,但有关研究较少,相关机制仍不清楚,有待进一步研究.
抚仙湖位于云南省玉溪市,南北长31.5 km,东西向平均宽度6.7 km,水域面积212 km2,平均水深89.7 m,最大水深155 m,每年1、2月水体垂向混合,3—12月,温跃层经历了一个形成、发展和消失的过程,垂向混合期只有一个,水体分层时间较长[18],是研究水体细菌群落结构和功能对水体垂向分层响应的理想场所. 已有研究结果表明,即使在水体垂向混合期,深水抚仙湖水体细菌的群落结构和功能也存在垂向差异[19]. 但是,水体垂向分层期间,抚仙湖水体细菌的群落结构组成和多样性的空间分布特征目前仍不得而知. 本研究运用Illumina Miseq高通量测序技术,结合多元统计分析研究抚仙湖水体垂向分层期间水体细菌群落结构组成和多样性的水平、垂向分布特征及其与环境因子的相关性,以期了解深水湖泊水体垂向分层期间影响水体细菌群落结构组成和多样性变化的机制.
1 材料和方法 1.1 样品的采集和预处理本研究以北部湖区S1为起点,在抚仙湖纵截面上每隔5 km设置1个采样点、共设置5个采样点(S1~S5,图 1). 2013年8月25日在这5个采样点采集水样:在S1采样点分9层采样,分别在水面以下0.5、10、20、30、40、50、60、100、130 m各设置1个采样层;其余4个采样点只在水面以下0.5 m处采样. 现场使用YSI6600多参数水质监测仪(YSI Inc., USA)原位测定各采样点、不同水层水体的温度(Temp)、pH、氧化还原电位(ORP)、电导率(Cond)、DO和浊度(Turb). 在各水层分别用采水器采集水样3次放于水桶内等体积混匀,然后用混合水样将10 L白色塑料桶润洗后装至9.8 L作为1个水样,每层水样采集3个平行样,将水样置于放有冰袋的保温箱内,在1 h内带回中国科学院抚仙湖高原深水湖泊研究站进行测定.
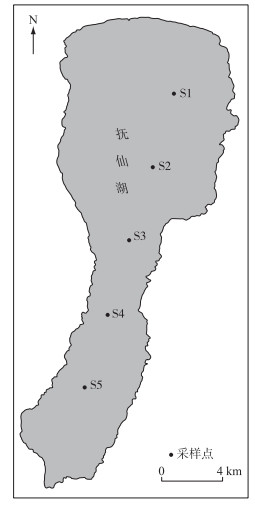
|
图 1 抚仙湖采样点分布 Fig.1 Distribution of sampling sites in Lake Fuxian |
水样送至实验室后部分用于化学分析,DOC、总氮(TN)、溶解性总氮(TDN)、氨氮(NH3-N)、硝态氮(NO3--N)、亚硝态氮(NO2--N)、总磷(TP)、溶解性总磷(TDP)、正磷酸盐(PO43-P)和叶绿素a(Chl.a)浓度的测定参见标准方法[20].
水体细菌样本收集:约1 L水样负压(< 20 m bar)过滤在孔径为0.2 μm的聚碳酸酯膜(DuraporeTM Millipore,USA)上[21]以收集水体细菌. 在提取基因组DNA前,滤膜保存在-80℃超低温冰箱中.
1.3 水体细菌DNA提取用改进的酚-氯仿提取、乙醇沉淀的方法从富集水体细菌的0.2 μm孔径的聚碳酸酯膜上提取细菌基因组DNA[22].
1.4 细菌16S rRNA基因高通量测序利用前端引物515F(5'-GTGCCAGCMGCCGCGG-3')和末端引物806R (5'-GGACTACHVGGGTWTCTAAT-3')对所有样品基因组DNA进行聚合酶链式反应(PCR)扩增,并使用Illumina Miseq平台进行高通量测序[23]. PCR扩增反应使用的是Gene Amp PCR-SystemⓇ 9700 (Applied Biosystems,Foster City,CA,USA)仪器,每个PCR反应体系中共有25 μL,其中包括:0.4 μmol/L的前端引物和0.4 μmol/L的末端引物,10 ng的DNA模板,2.5 μL的10X AccuPrimeTM PCR缓冲液Ⅱ,0.5单位的AccuPrimeTM Taq高保真DNA聚合酶(Invitrogen,Carlsbad,CA,USA). PCR扩增条件为:初始温度94℃保持1 min,后在94℃温度下保持20 s(变性);在53℃下保持25 s(退火);在68℃下保持45 s(延伸),该过程重复30次后,再在68℃下保持10 min,PCR反应完成. 所有的样品均进行3次PCR扩增,以减少PCR过程中生成产物的随机误差. 将3次的PCR产物聚集在一起,用琼脂糖凝胶电泳法分析其纯度,用QIAquick凝胶提取试剂盒(Qiagen,Germantown,MD,USA)纯化PCR产物,并使用PicoGreen(BMG Labtech,Jena,Germany)进行进一步的纯化. 在每个样品的DNA克隆文库纯化后的PCR扩增产物(扩增子)中添加PhiX(Illumina,San Diego,CA,USA)后,使用Illumina MiSeq平台进行测序.
1.5 温跃层相关特征描述依据王银珠和濮培民[24]对温跃层相关特征的定义,本研究关注的温跃层特征为:(1)温跃层:温度垂向梯度≥0.2℃/m的水层;(2)温跃层顶界(HT)及顶界温度(TT):自湖面向下温度垂向梯度开始≥0.2℃/m的深度及该深度上的水温,℃;(3)温跃层底界(HB)及底界温度(TB):自湖面向下温度垂向梯度开始≤0.2℃/m的深度及该深度上的水温,℃;(4)温跃层厚度(D):温跃层底界与顶界之差,即顶界与底界之间的距离,m,D=HT-HB;(5)温跃层强度(θ): 温跃层整层的平均温度梯度,℃/m;θ =(TT-TB)/D;(6)最大温度垂向梯度(θmax)及其所在深度(Hmax):温跃层内最大的温度垂向梯度,一般位于温跃层中部温度廓线的拐点处;(7)上温跃层(ST):温跃层顶界到最大温度垂向梯度所在深度内的水层;(8)下温跃层(SB):最大温度垂向梯度所在深度到温跃层底界的水层.
1.6 数据分析 1.6.1 细菌16S rRNA基因序列处理及分析在Galaxy Pipeline (http://zhoulab5.rccc.ou.edu:8080)上对Illumina MiSeq高通量测序获得的16S rRNA基因原始序列(raw sequences)进行质量控制,将高质量的序列进行聚类,在97 % 的相似度下生成样品的OTU(operational taxonomic unit)文件,并获得OTU代表序列,使用SILVA138数据库对每个OTU进行细菌物种注释;剔除在所有样品中仅出现1次的OTU,计算每个样品中的序列总数,以最少序列数对所有样品进行抽平,然后进行后续数据分析[23]. 使用OTU数目[25]和Faith's系统发育多样性[26](Faith's phylogenetic diversity,Faith's PD)表征各样品水体细菌的α多样性.
1.6.2 统计分析应用SPSS 16.0统计软件,以单因子方差分析法(One-way ANOVA)分别对不同位点及S1采样点不同水层环境因子、水体细菌群落及alpha多样性的差异显著性进行统计学分析,用SNK-q检验法对有显著性差异的样本均数间进行多重比较.
用R软件(http://www.r-project.org)的Vegan 2.5-7包[27]对水体细菌群落结构组成进行非线性多维标度(nonmetric multidimensional scaling,NMDS)分析,对于不同位点及S1采样点不同水层水体的细菌群落结构组成差异性进行ANOSIM分析;降趋对应分析(detrended correspondence analysis,DCA)结果显示,样品矩阵第一、二轴的长度均大于2,因此本研究假定物种与环境间具有非线性的相关关系,选择典范对应分析(canonical correspondence analysis, CCA)来分析环境因子与细菌群落组成变化的相关性.
2 结果 2.1 抚仙湖水体分层期间水体理化因子的空间分布特征本研究中,采样点S1现场测定结果显示该点水体存在明显的分层现象:温跃层在水深15~40 m处,温度由22.64℃骤降至14.67℃;温跃层强度为0.32℃/m;最大垂向梯度为1.27℃,发生在22 m水深处;上、下温跃层分别在水深15~22、22~40 m处(图 2a). 该采样点的pH、电导率的垂向变化趋势与温度相同,均在温跃层随着水深的增加逐渐降低,分别从8.7、0.298 mS/cm降低到8.2、0.258 mS/cm,此后在均温层分别维持在8.10、0.256 mS/cm(图 2b,d);DO浓度的垂向变化趋势与此类似,但其从表层的8.70 mg/L降低到上温跃层底部的20 m处的4.5 mg/L后逐渐升高到56 m处的6.69 mg/L,之后有所降低,但维持在4.7 mg/L的水平(图 2c). 而ORP的变化趋势与温度相反,在温跃层从-160 mV逐渐升高到-114 mV后趋于稳定(图 2e).
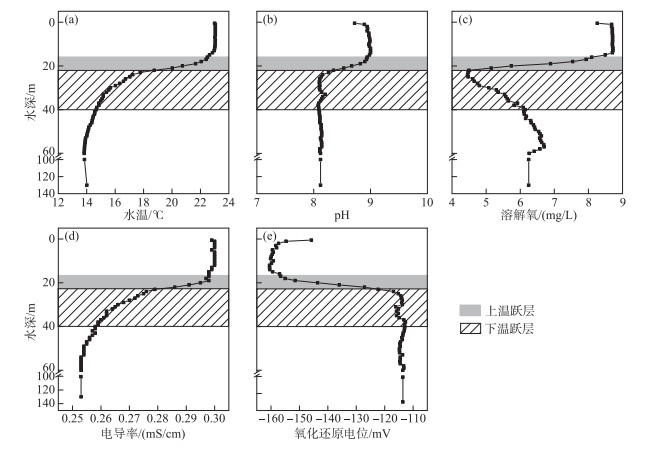
|
图 2 抚仙湖S1采样点水体现场测定的环境因子的垂向差异 (灰色、斜线阴影分别表示上、下温跃层所在位置) Fig.2 The vertical difference of environmental factors measured in situ at the S1 site in Lake Fuxian (The gray and slant lines shades indicate the location of the upper and lower thermocline, respectively) |
S1点水体其它环境因子随着水深的增加也发生了显著变化(图 3). 单因子方差分析结果表明,除TN/TP外,随着水体深度的增加,S1点的理化因子均发生了显著性变化. 随着水体深度的增加,Chl.a浓度从表层的1.0 μg/L升高到20 m处的1.6 μg/L后逐渐降低,最终在温跃层以下维持在0.5 μg/L左右(图 3a). NO3--N浓度在130 m最高,在20、60和100 m次之,在50 m处最低;NH3-N浓度在100 m处最高,其余各水层间无显著性差异(P > 0.05,图 3b). DOC浓度的变化趋势是先降低后升高,从表层的4.0 mg/L降低到20 m处的2.3 mg/L后逐渐升高到60 m处的6.7 mg/L,之后有所降低,但维持在4.7 mg/L的水平(图 3a). TN、TDN以及PO43--P浓度的变化趋势基本与Chl.a的变化趋势一致(图 3c,e). TP和TDP浓度的变化趋势相同,均在100 m最高(图 3d).

|
图 3 抚仙湖各采样点水体理化环境因子的差异 (同一环境因子柱状图顶端不同字母表示多重比较(SNK-q)检验具有显著性差异;灰色、斜线阴影分别表示上、下温跃层所在位置) Fig.3 Differences in physical and chemical environmental factors among the sites in Lake Fuxian (Different letters at the top of the histogram of the same environmental factor indicate that the multiple comparison (SNK-q) test is significantly different. The gray and slant lines shades indicate the location of the upper and lower thermocline, respectively) |
与S1点不同水层间的差异相比,本研究所调查的各采样点表层水体的各种理化因子差异相对较小(图 3). 单因子方差分析法(One-way ANOVA)表明,除TN/TP外,各位点表层的理化因子均存在显著性差异,但变化趋势不尽相同. 采样期间,各采样点表层水体的温度和TN/TP无显著性差异,分别约为23℃和35(图 3f). S3点Chl.a浓度最高,S2、S1点次之,S4和S5点最低且二者间无明显差异(P > 0.05,图 3a). 各采样点DOC浓度从高到低依次为:S2、S1、S4、S3、S5(图 2b). S4和S5点的pH最高,S1和S3点次之,S2点最低(图 3a). S1点的TN和TP浓度均高于其余各采样点近1倍,而其余各点间的差异相对较小;类似地,S1点的TDN和TDP浓度也较高,但各点间差异相对较小(图 3c,d). NO3--N浓度在S3点最高,S2点次之,而S1、S4、S5点间最低且三者间无明显差异(P > 0.05,图 3b). NH3-N浓度在S5点最低,在其余各采样点间无显著性差异(P > 0.05,图 3b);而各采样点的NO2--N浓度均低于0.001 mg/L的最低检测限. PO43-P浓度在各采样点从高到低依次为:S4、S1、S2、S3、S5(P < 0.05,图 3e).
2.2 抚仙湖水体分层期间水体细菌多样性及群落结构组成的空间分布特征 2.2.1 抚仙湖水体细菌alpha多样性的水平、垂向分布特征本研究结果表明,抚仙湖水体细菌alpha多样性(OTU数、PD值)在水平、垂向上均存在显著性差异,且在水平方向上alpha多样性显著低于垂向上的多样性(图 4). 单因素方差分析表明,在水平方向上,S5点水样中水体细菌的OTU数、PD值(分别为1960、83.66)均高于其余4采样点的表层水样,而S3点水体细菌alpha多样性最低(P < 0.01;图 4a,b). 在垂向上,S1点alpha多样性随着采样水深的增加呈现先增加后降低的趋势:水体细菌alpha多样性在表层(0.5 m水层)最低(分别为1653、61.42;图 4a,b),10、20 m水层次之,在30和40 m水层最高(OTU数分别为2411、2409,PD值分别为101.74、97.81;图 4a,b). T检验结果表明,水体细菌在水平方向(S1~S5表层水样)的OTU数、PD值均显著低于垂向(S1点各水层水样)(P < 0.01;图 4c,d).
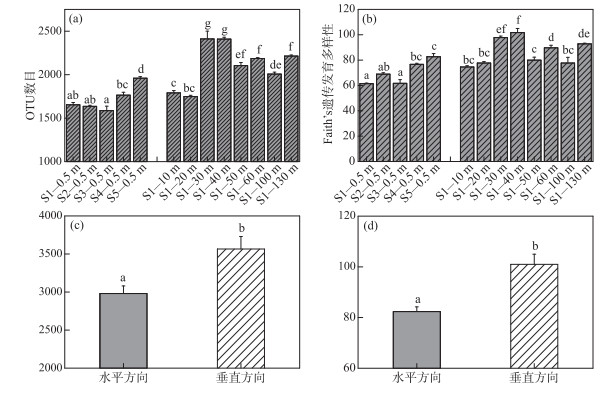
|
图 4 抚仙湖水体细菌alpha多样性的水平、垂向分布特征 (同一alpha多样性指数柱状图顶端不同字母表示多重比较(SNK-q)(a和b)或T检验(c和d)具有显著性差异) Fig.4 Horizontal and vertical distribution differences of bacterioplankton alpha diversity in Lake Fuxian (Different letters at the top of the histogram of the same alpha diversity index indicate that the multiple comparison (SNK-q) (a and b) test or T-test (c and d) are significantly different) |
水体细菌16S rRNA基因组成在不同采样点、同一采样点的不同水层间均存在差异,且后者差异较大(图 5). 基于OTU水平和系统发育树的水体细菌群落结构组成的NMDS分析均表明:同一样品的不同重复间的差异均小于不同样品间的差异;相对于垂向水样,表层水样间的组成更相似;S1点20 m水层水体细菌群落结构组成显著有别于其它样品(图 5a,b). T检验表明,基于OTU水平和系统发育树的水体细菌群落结构组成在水平方向的差异(分别为24.07 % ±0.57 % 和46.93 % ±0.23 %)均显著低于垂向(分别为51.33 % ±0.28 % 和52.19 % ±0.26 %;P < 0.01;图 5c,d).
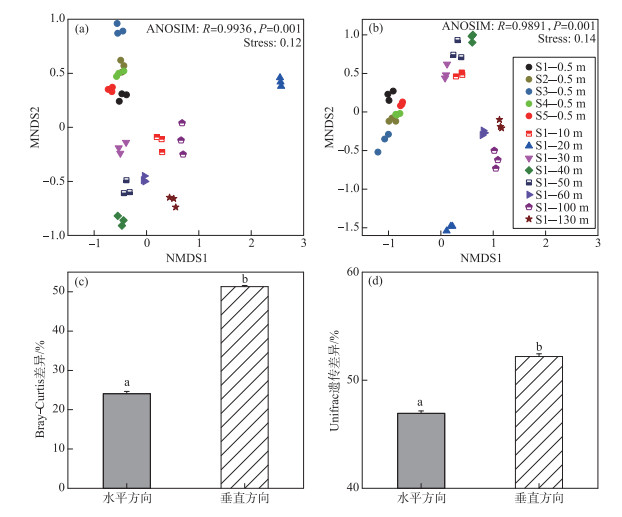
|
图 5 抚仙湖水体细菌群落结构组成的非度量多维尺度(NMDS;a和b)图及其在水平、垂向上差异性的比较(c和d) (a和c:基于OTU;b和d:基于系统发育树. 同一群落结构组成差异柱状图顶端不同字母表示T检验具有显著性差异) Fig.5 Non-metric multi-dimensional scale (NMDS; a and b) diagrams of the bacterioplankton community composition in Lake Fuxian and their differences in the horizontal and vertical directions (c and d) (a and c: based on OTU; b and d: Based on phylogenetic tree. Different letters at the top of the histogram of the same bacterioplankton community dissimilarity index indicate that the T-test are significantly different) |
通过对39个水体细菌样品16S rRNA基因高通量测序原始数据的拼接、过滤、去嵌合体、剔除仅出现1次OTU等处理后,共获得1535377条高质量序列且平均长度为250 bp. 测序条数最少的样品含有20808条,最多的样品含有58217条. 将所有样品resample至一个相同测序深度(每个样品20808条序列),共获得10165个有97 % 相似度的OTUs. 经比对分析,所有的高质量序列经resample之后,765579(94.34 %)条序列可分类至门水平. 在门水平上,细菌群落结构在水平、垂直水样间均存在较高的相似性,优势菌群主要包括:放线菌门(Actinobacteria)(所有序列的36.59 %)、变形菌门(Proteobacteria)(32.67 %)、蓝藻门(Cyanobacteria)(11.10 %)、拟杆菌门(Bacteroidetes)(7.55 %)、浮霉菌门Planctomycetes)(2.48 %)、疣微菌门(Verrucomicrobia)(1.24 %)、绿弯菌门(Chloroflexi)(1.19 %)、厚壁菌门(Firmicutes)(0.63 %)、装甲菌门(Armatimonadetes)(0.27 %)、衣原体门(Chlamydiae)(0.22 %)等18大类群(图 6a). 各样品细菌群落结构组成最大差异表现在绿弯菌门在S1点60、100和130 m水层中的相对丰度较高,分别为6.64 %、4.36 % 和4.26 %,而其在其余各样品中的相对丰度均低于0.1 % (图 6a).
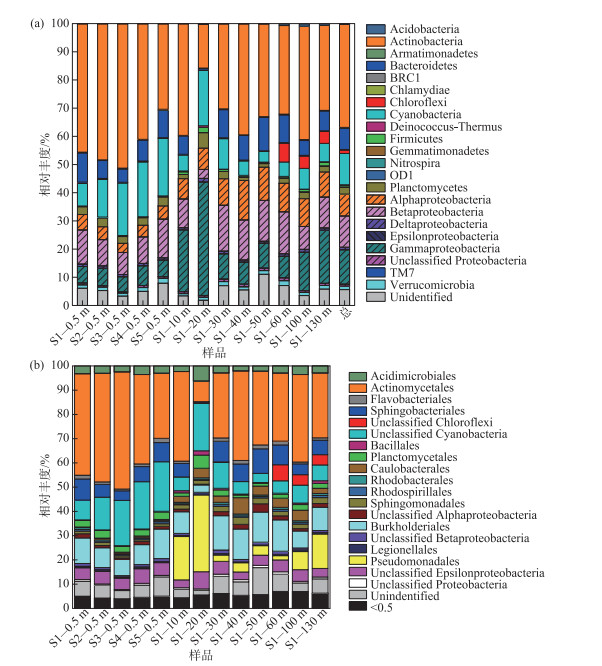
|
图 6 抚仙湖不同采样点水体细菌群落在门(a)和目(b)水平上的组成 Fig.6 The composition of bacterioplankton communities at phylum level (a) and order level (b) at the different sites in Lake Fuxian |
相对于门水平,各水样水体细菌群落结构在目(order)水平的组成差异较大,其相对丰度在水平、垂向水样间均存在差异,且在垂向上的差异相对较大. 本研究结果表明,各水样的水体细菌主要由相对丰度大于0.5 % 的菌群的组成,其相对丰度之和平均为89.62 % (83.82 % ~93.22 %;图 6b). 这些细菌主要包括:放线菌目(Actinomycetales)、鞘脂杆菌目(Sphingobacteriales)、未确定分类的绿弯菌纲(unidentified Chloroflexi)、未确定分类的蓝细菌(unidentified Cyanobacteria)、芽孢杆菌目(Bacillales)、浮霉菌目(Planctomycetales)、柄杆菌目(Caulobacterales)、红杆菌目(Rhodobacterales)、红螺菌目(Rhodospirillales)、伯克氏菌目(Burkholderiales)、未确定分类的beta变形菌(unidentified Betaproteobacteria)、未确定分类的gamma变形菌(unidentified Gammaproteobacteria)、假单胞菌目(Pseudomonadales)等18个目(图 6b).
在本研究中的5个采样点表层水样中,水体细菌的优势菌群类似,只是具体的菌群的相对丰度存在差异:Actinomycetales的相对丰度最高,其平均占39.75 %,在点S3中最高(48.34 %),在S5中最低(26.87 %);其次为unidentified Cyanobacteria,其相对丰度平均为16.04 %,其相对丰度最大值出现在S5点(20.42 %),其最低值出现在S1点(8.15 %);再次为Burkholderiales,其相对丰度平均为9.17 %,其相对丰度最大值出现在S5点(12.17 %),其最低值出现在S3点(6.77 %);Sphingobacteriales在表层水样中的相对丰度平均为6.41 %,其最大值出现在S1点(8.72 %),其最低值出现在S3点(3.94 %).
与表层水样相比,S1点垂向水样中水体细菌群落结构组成在优势菌群的相对丰度及其类别上均存在较大变化. 10和20 m处的水体细菌群落结构组成变化最大:S1点10 m水层水体细菌相对丰度增加最大的是隶属于gamma变形菌的Pseudomonadales(从0.08 % 增加到17.89 %),其次是隶属于alpha变形菌的Caulobacterales(从0.48 % 增加到2.46 %);而unidentified Cyanobacteria、Actinomycetales、Sphingobacteriales、Burkholderiales的相对丰度却有所降低,分别降低了10.36 %、2.78 %、0.87 %、0.24 % (图 6b). S1点20 m水层Pseudomonadales的相对丰度高达31.66 %,成为该样品相对丰度最大的菌群;Caulobacterales的相对丰度增加了近9倍(从0.48 % 增加到3.93 %),酸微菌目(Acidimicrobiales)的相对丰度增加了近1倍(从3.04 % 增加到6.22 %)(图 6b). 与此相反,Actinomycetales的相对丰度(8.49 %)减小了31.26 %,Burkholderiales和Sphingobacteriales的相对丰度(分别为3.01 %、0.49 %)分别降低了6.16 %、5.93 % (图 6b). 在40 m及以下的水层中,变化最大的是60、100和130 m水层样品中的unidentified Chloroflexi的相对丰度(4.24 % ~6.23 %)明显高于其它水层样品(最高为0.04 %)(图 6b). 在其它的优势菌群中,Actinomycetales再次成为相对丰度最高的水体细菌(均大于26.77 %);其次为Burkholderiales,其相对丰度为6.97 % ~14.14 %;再次为Sphingobacteriales,其相对丰度为4.48 % ~8.53 %;Caulobacterales的相对丰度也显著大于表层水样(2.15 % ~6.74 %)(图 6b).
2.2.4 影响水体细菌群落结构组成水平、垂向分布差异的环境因子根据DCA分析的结果显示,样品矩阵第1、2轴的长度均大于2,因此本研究假定物种与环境间具有非线性的相关关系,选择CCA分析来统计环境因子与细菌群落组成变化的相关性. 通过方差膨胀因子(variance inflation factors)分析对环境因子的预筛选及Monte Carlo permutation test表明,所测环境因子中DOC、DO、NO3--N、NH3-N和TP的膨胀因子均小于20,且它们与水体细菌群落结构变化显著相关(P < 0.01),因此,进行只包括DOC、DO、NO3--N、NH3-N和TP的CCA分析. CCA结果显示,前两轴共解释了30.40 % 的水体细菌OTU水平群落结构组成变化(图 7),所有6个轴共解释44.26 %,前两个排序轴足以反映细菌所测环境因子变化的相关趋势. NO3--N、TP与第1轴的相关性较高,R2分别为0.11、0.04;DOC、DO以及NH3-N浓度与第2轴的相关性较高,R2分别为0.12、0.09、0.05. 本研究结果表明,5个采样点表层水体及S1点30 m处水体细菌的群落结构组成与DO浓度呈正相关,S1点40、50和60 m处水体细菌的群落结构组成与DOC浓度呈负相关,S1点10、20、100和130 m处水体细菌的群落结构组成与NO3--N、NH3-N以及TP浓度呈正相关.
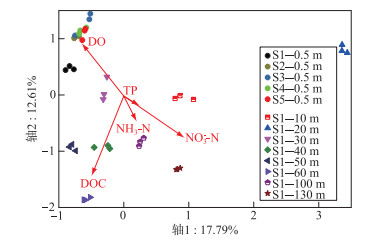
|
图 7 抚仙湖环境因子与水体细菌群落结构变化的典范对应分析 Fig.7 Canonical correspondence analysis of environmental factors and changes in the bacterioplankton community compositions in Lake Fuxian |
水体由于水温季节性变化引起的垂向分层是导致深水湖泊水体理化环境垂向差异的重要因素[4-6, 28]. 首先是DO浓度. 深水湖泊与水库水体在温度较高的季节“三层式”温度垂向结构的形成与维持限制了水体的垂直交换,使得上层水体中浮游植物光合作用产生的氧气不易穿透到均温层,进而使得均温层DO浓度相对较低[2]. 本研究中湖上层与均温层水体DO浓度的显著变化也验证了这一现象. 此外,本研究发现DO浓度在温跃层内存在截然不同的变化,即DO浓度在上温跃层内降低到最低(4.5 mg/L)后在下温跃层内逐渐升高(图 2c). 可见,本研究所观测的水体中无缺氧水层. 这不仅与先前关于抚仙湖的研究一致[19, 29-30],也与千岛湖[31]、天山天池[32]、日本的琵琶湖[33]的监测结果类似,但与红枫湖[3]、东圳水库[34]的研究结果不同,这种差异可能是由于水体营养盐水平差异介导的水体微生物代谢活动强度不同[33]. 其次,Chl.a浓度自湖上层至上温跃层升高到最大值后逐渐降低,这与以往的研究结果[30-31]类似. 再次,温跃层形成以后,湖底沉积物释放营养盐到均温层而上层水体很难获得这些营养盐,并且上层水体有机物碎屑以及浮游生物残体不断沉降到均温层[35-36],因此,本研究S1采样点均温层的TP、TDP、PO43--P以及DOC浓度相对较高.
本研究发现,抚仙湖在水体分层期间,水体理化因子的垂向差异大于水平方向的差异. 例如,垂向上最大的温度、pH以及DO浓度的差别分别为9.23℃、0.92、4.26 mg/L,而在距离跨度近20 km的不同采样点表层水体间相应环境因子的最大差别分别为1.22℃、0.36、0.66 mg/L(图 2,3). 这与苏黎世湖(最大水深136 m)在水体分层期间的观测结果一致[35].
3.2 抚仙湖水体分层期间水体细菌群落结构组成在垂向上的变化已有的结果表明,大型深水湖泊水体分层期间水体理化环境因子空间上的差异导致水体细菌群落结构组成在变温层、温跃层和均温层中的多样性分布[33, 37-38]. 本研究也发现类似的变化趋势,但是抚仙湖各水层的优势菌群与这些湖泊不尽相同. 在抚仙湖水体分层期间,变温层水体细菌主要由Actinomycetales、unidentified Cyanobacteria、Burkholderiales和Sphingobacteriales组成. Actinobacteria在深水湖泊不同水层均被发现且在变温层和温跃层中的相对丰度较高[33, 37-38],本研究进一步发现该细菌门中的Actinobacteria在抚仙湖各水层中均被发现且在变温层中的相对丰度较高(图 6b),这与利用宏基因测序技术在水体完全混合期对抚仙湖水体细菌的研究结果一致[19]. Actinobacteria在抚仙湖中存在这种分布特征的原因可能是一些Actinobacteria种群具有可以吸收阳光的放线菌视紫红质[39]且体积小(体表面积与体积的比率大),可以有效利用水体较低的营养盐等优势得以迅速繁殖的缘故[37, 40]. Cyanobacteria不仅可以进行光合作用,而且具有固氮的能力,其在不同营养水平的深水湖泊和水库的变温层中被大量发现[4, 33, 35, 41-42]. 已有的研究表明,Burkholderiales不仅在表层水体是优势菌群[41],而且其在DO浓度差别不大的不同水体中也大量存在[43]. 类似地,Burkholderiales在抚仙湖在不同水体的相对丰度均较高,这可能与其生态位较宽有关[43]. Sphingobacteriales可以适应低营养盐、低DOC浓度的水体环境[44],因此其成为深水湖泊——抚仙湖和Grand湖表层水体中的优势菌群[45].
随着水体深度的增加,抚仙湖温跃层中水体细菌的群落结构组成也发生了变化. 其中变化最明显的是Pseudomonadales迅速成为优势种群(在10和20 m水层处的平均相对丰度为24.77 %,图 6b). 一些Pseudomonadales菌群具有多种代谢能力,可以生活在多种水生真核生物的体表或体内,如鱼类[46]、淡水海绵[47]、淡水浮游甲壳动物[48],而且不同的Pseudomonadales菌群在浮游甲壳动物从生长到死亡、分解过程中表现出不同的种群增长趋势[49]. 有趣的是,本研究发现,Pseudomonadales相对丰度较高的水层(10、20 m)中浮游甲壳动物丰度也很高(未发表数据). 然而,本研究中的Pseudomonadales菌群是否与浮游甲壳动物有关,需要利用宏基因组、原位荧光探针(fluorescence in situ hybridization followed by catalyzed reporter deposition, CARD-FISH)等分子生物学技术进一步研究.
与表层和温跃层水体相比,抚仙湖有氧均温层水体的细菌群落结构组成发生了显著变化,其中既有均温层特有细菌种群的出现,也有在上层水体中存在的细菌种群的相对丰度的较大改变. 这与在不同温度、不同营养水平的有氧均温层中的研究结果一致[38]. Okazaki等[38]研究发现,Chloroflexi是普遍存在于深水湖泊有氧均温层水体中的优势种群. 与此类似,本研究也发现unidentified Chloroflexi在抚仙湖60 m及以下的水层中大量存在. 更多的研究表明,一些在表层和温跃层水体中出现的细菌是均温层水体中的优势菌群[38, 50-51]. 这一方面可能是因为这些细菌种群功能多样、世代时间短,例如本研究中的Actinomycetales[40, 52]和Burkholderiales[43];另一方面可能是因为一些附着细菌随着上层水体有机物碎屑以及浮游生物残体在均温层的累积[35-36]而富集. 例如,与浮游甲壳动物死亡分解相关的Pseudomonadales菌的相对丰度在本研究的100和130 m水层样品显著升高(图 6b). 然而,必须注意的是,这些在目水平上相同的细菌不一定完全相同,最新的研究发现,即使隶属于同一OTU的细菌间也存在功能及基因水平的差异,即同一OTU内部存在微多样性[38, 50, 53].
3.3 抚仙湖水体分层期间水体细菌多样性在垂向与水平方向上的差异比较尽管本研究中表层采样点间的水平距离(至少5 km)远远大于分层采样点不同水层间的距离(10~130 m),但是水体细菌多样性(alpha和beta多样性)在垂向上的差异明显大于水平方向上的差异(图 5,6). 深水湖泊水体分层期间,水体细菌多样性的变化主要受水体分层导致的上行因素如DOC浓度和组成,下行因素如捕食作用,以及环境因素如水体温度、光照、DO等的影响[4, 16, 18]. 而且已有的研究发现,不同湖泊中细菌多样性的差异与水体环境因子的差异呈正比[23]. 本研究发现,在抚仙湖水体分层期间水体理化因子在垂向上的差异显著大于在水平方向上的差异(图 2,3),这可能是导致水体细菌在垂向上多样性大于水平方向上多样性的主要原因(图 5). 此外,在冬季对抚仙湖北部一个采样点调查发现,即使在水体完全混合期,水体理化因子及细菌群落结构组成也存在垂向上的差异[19]. 由此看来,抚仙湖水体常年无法完全混合,这不仅会阻碍水体细菌的垂向混合,而且始终不混合的下层水体中严苛的环境条件将对细菌产生持续选择作用,进一步维持细菌多样性的垂向差异. 然而,影响不同水层细菌间多样性差异的主要环境因子却有所差异. 例如,DO浓度是导致表层水体与S1点30 m处水层细菌间的差异的主要环境因素,而DOC、营养盐浓度是导致S1点其余水层细菌间差异的主要环境因子(图 7). 在海洋生态系统中的研究发现,随着水深的增加溶解性有机物的可利用性较低,进而导致同一属内细菌在垂向的生态位分化[54]. 然而,抚仙湖水体DOC组成的垂向差异及其与细菌群落多样性的关系有待进一步研究.
| [1] |
Read JS, Hamilton DP, Jones ID et al. Derivation of lake mixing and stratification indices from high-resolution lake buoy data. Environmental Modelling & Software, 2011, 26(11): 1325-1336. DOI:10.1016/j.envsoft.2011.05.006 |
| [2] |
Zhang YL, Wu ZX, Liu ML et al. Thermal structure and response to long-term climatic changes in Lake Qiandaohu, a deep subtropical reservoir in China. Limnology and Oceanography, 2014, 59(4): 1193-1202. DOI:10.4319/lo.2014.59.4.1193 |
| [3] |
Wang JF, Chen JG, Yang YQ et al. Physical and chemical characteristics of water in Lake Hongfeng during the disappearance of seasonal stratification. Research of Environmental Sciences, 2012, 25(8): 845-851. [王敬富, 陈敬安, 杨永琼等. 红枫湖季节性热分层消亡期水体的理化特征. 环境科学研究, 2012, 25(8): 845-851. DOI:10.13198/j.res.2012.08.4.wangjf.009] |
| [4] |
Yu Z, Yang J, Amalfitano S et al. Effects of water stratification and mixing on microbial community structure in a subtropical deep reservoir. Scientific Reports, 2014, 4: 5821. DOI:10.1038/srep05821 |
| [5] |
Zhang YL, Wu ZX, Liu ML et al. Dissolved oxygen stratification and response to thermal structure and long-term climate change in a large and deep subtropical reservoir (Lake Qiandaohu, China). Water Research, 2015, 75: 249-258. DOI:10.1016/j.watres.2015.02.052 |
| [6] |
Wen XY, Zhang HC, Chang FQ et al. Seasonal stratification characteristics of vertical profiles of water body in Lake Lugu. Advances in Earth Science, 2016, 31(8): 858-869. [文新宇, 张虎才, 常凤琴等. 泸沽湖水体垂直断面季节性分层. 地球科学进展, 2016, 31(8): 858-869.] |
| [7] |
Chen XC, Wang XD, Wu DY et al. Seasonal variation of mixing depth and its influence on phytoplankton dynamics in the Zeya Reservoir, China. Limnology, 2009, 10(3): 159-165. DOI:10.1007/s10201-009-0292-6 |
| [8] |
Becker V, Caputo L, Ordóñez J et al. Driving factors of the phytoplankton functional groups in a deep Mediterranean Reservoir. Water Research, 2010, 44(11): 3345-3354. DOI:10.1016/j.watres.2010.03.018 |
| [9] |
Cantin A, Beisner BE, Gunn JM et al. Effects of thermocline deepening on lake plankton communities. Canadian Journal of Fisheries and Aquatic Sciences, 2011, 68(2): 260-276. DOI:10.1139/f10-138 |
| [10] |
Sastri AR, Gauthier J, Juneau P et al. Biomass and productivity responses of zooplankton communities to experimental thermocline deepening. Limnology and Oceanography, 2014, 59(1): 1-16. DOI:10.4319/lo.2014.59.1.0001 |
| [11] |
Cotner JB, Biddanda BA. Small players, large role: Microbial influence on biogeochemical processes in pelagic aquatic ecosystems. Ecosystems, 2002, 5(2): 105-121. DOI:10.1007/s10021-001-0059-3 |
| [12] |
Azam F, Fenchel T, Field JG et al. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series, 1983, 10: 257-263. DOI:10.3354/meps010257 |
| [13] |
Cole JJ, Findlay S, Pace ML. Bacterial production in fresh and saltwater ecosystems: A cross-system overview. Marine Ecology Progress Series, 1988, 43: 1-10. DOI:10.3354/meps043001 |
| [14] |
Toolan T, Wehr JD, Findlay S. Inorganic phosphorus stimulation of bacterioplankton production in a meso-eutrophic lake. Applied and Environmental Microbiology, 1991, 57(7): 2074-2078. DOI:10.1128/aem.57.7.2074-2078.1991 |
| [15] |
Paganin P, Chiarini L, Bevivino A et al. Vertical distribution of bacterioplankton in Lake Averno in relation to water chemistry. FEMS Microbiology Ecology, 2013, 84(1): 176-188. DOI:10.1111/1574-6941.12048 |
| [16] |
Yang X, Huang TL, Zhang HH. Effects of seasonal thermal stratification on the functional diversity and composition of the microbial community in a drinking water reservoir. Water, 2015, 7(10): 5525-5546. DOI:10.3390/w7105525 |
| [17] |
Liu KS, Liu YQ, Jiao NZ et al. Vertical variation of bacterial community in Nam Co, a large stratified lake in central Tibetan Plateau. Antonie Van Leeuwenhoek, 2016, 109(10): 1323-1335. DOI:10.1007/s10482-016-0731-4 |
| [18] |
Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences. Fuxian Lake. Beijing: Ocean Press, 1990. [中国科学院南京地理与湖泊研究所. 抚仙湖. 北京: 海洋出版社, 1990.]
|
| [19] |
Xing P, Tao Y, Luo JH et al. Stratification of microbiomes during the holomictic period of Lake Fuxian, an alpine monomictic lake. Limnology and Oceanography, 2019, 65: S134-S148. DOI:10.1002/lno.11346 |
| [20] |
Jin XC, Tu QY. Code for lake eutrophication investigation. Beijing: China Environmental Science Press, 1990. [金相灿, 屠清瑛. 湖泊富营养化调查规范. 北京: 中国环境科学出版社, 1990.]
|
| [21] |
Zwart G, Crump BC, Kamst-van Agterveld MP et al. Typical freshwater bacteria: An analysis of available 16S rRNA gene sequences from plankton of lakes and rivers. Aquatic Microbial Ecology, 2002, 28: 141-155. DOI:10.3354/ame028141 |
| [22] |
Li HB, Xing P, Chen MJ et al. Short-term bacterial community composition dynamics in response to accumulation and breakdown of Microcystis blooms. Water Research, 2011, 45(4): 1702-1710. DOI:10.1016/j.watres.2010.11.011 |
| [23] |
Li HB, Zeng J, Ren LJ et al. Contrasting patterns of diversity of abundant and rare bacterioplankton in freshwater lakes along an elevation gradient. Limnology and Oceanography, 2017, 62(4): 1570-1585. DOI:10.1002/lno.10518 |
| [24] |
Wang YZ, Pu PM. A preliminary study on the thermocline of Fuxian Lake. Transactions of Oceanology and Limnology, 1982, 4: 1-9. [王银珠, 濮培民. 抚仙湖水温跃层的初步研究. 海洋湖沼通报, 1982, 4: 1-9.] |
| [25] |
Edgar RC. UPARSE: Highly accurate OTU sequences from microbial amplicon reads. Nature Methods, 2013, 10(10): 996-998. DOI:10.1038/nmeth.2604 |
| [26] |
Faith DP. Conservation evaluation and phylogenetic diversity. Biological Conservation, 1992, 61(1): 1-10. DOI:10.1016/0006-3207(92)91201-3 |
| [27] |
Oksanen J, Blanchet FG, Frienfly M et al. Vegan community ecology package version 2.5-7 November 2020, 2020. https://cran.r-project.org,https://github.com/vegandevs/vegan.
|
| [28] |
Wang S, Qian X, Han BP et al. Effects of local climate and hydrological conditions on the thermal regime of a reservoir at Tropic of Cancer, in Southern China. Water Research, 2012, 46(8): 2591-2604. DOI:10.1016/j.watres.2012.02.014 |
| [29] |
Zhou QC, Zhang YL, Zhou YQ et al. Spectral attenuation of ultraviolet and visible radiation and its relationship with chromophoric dissolved organic matter in autumn/winter in Lake Fuxian, China. J Lake Sci, 2016, 28(6): 1316-1327. [周起超, 张运林, 周永强等. 抚仙湖秋、冬季光衰减特征及其与有色可溶性有机物的关系. 湖泊科学, 2016, 28(6): 1316-1327. DOI:10.18307/2016.0617] |
| [30] |
Wang LJ, Yu H, Niu Y et al. Distribution characteristics of water temperature and water quality of Fuxian Lake during thermal stratification period in summer. Environmental Science, 2017, 38(4): 1384-1392. [王琳杰, 余辉, 牛勇等. 抚仙湖夏季热分层时期水温及水质分布特征. 环境科学, 2017, 38(4): 1384-1392. DOI:10.13227/j.hjkx.201607165] |
| [31] |
Dong CY, Yu ZM, Wu ZX et al. Study on seasonal characteristics of thermal stratification in lacustrine zone of Lake Qiandao. Environmental Science, 2013, 34(7): 2574-2581. [董春颖, 虞左明, 吴志旭等. 千岛湖湖泊区水体季节性分层特征研究. 环境科学, 2013, 34(7): 2574-2581. DOI:10.13227/j.hjkx.2013.07.028] |
| [32] |
Wang B, Ma J, Wang YY et al. Seasonal characteristics of thermal stratification in Lake Tianchi of Tianshan Mountains. J Lake Sci, 2015, 27(6): 1197-1204. [王斌, 马健, 王银亚等. 天山天池水体季节性分层特征. 湖泊科学, 2015, 27(6): 1197-1204. DOI:10.18307/2015.0626] |
| [33] |
Okazaki Y, Nakano SI. Vertical partitioning of freshwater bacterioplankton community in a deep mesotrophic lake with a fully oxygenated hypolimnion (Lake Biwa, Japan). Environmental Microbiology Reports, 2016, 8(5): 780-788. DOI:10.1111/1758-2229.12439 |
| [34] |
Zhou J, Yu Z, Liu KG et al. Bacterial community and its relation to environmental variables in a subtropical stratified reservoir for drinking water supply in autumn. Chinese Journal of Plant Ecology, 2014, 34(21): 6205-6213. [周菁, 余正, 刘开国等. 典型亚热带热分层水库秋季细菌群落垂直分布. 生态学报, 2014, 34(21): 6205-6213. DOI:10.5846/stxb201302030226] |
| [35] |
Kim C, Nishimura Y, Nagata T. Role of dissolved organic matter in hypolimnetic mineralization of carbon and nitrogen in a large, monomictic lake. Limnology and Oceanography, 2006, 51(1): 70-78. DOI:10.4319/lo.2006.51.1.0070 |
| [36] |
Jiao N, Tang K, Cai H et al. Increasing the microbial carbon sink in the sea by reducing chemical fertilization on the land. Nature Reviews Microbiology, 2011, 9(1): 75. DOI:10.1038/nrmicro2386-c2 |
| [37] |
Salcher MM, Pernthaler J, Frater N et al. Vertical and longitudinal distribution patterns of different bacterioplankton populations in a canyon-shaped, deep prealpine lake. Limnology and Oceanography, 2011, 56(6): 2027-2039. DOI:10.4319/lo.2011.56.6.2027 |
| [38] |
Okazaki Y, Fujinaga S, Tanaka A et al. Ubiquity and quantitative significance of bacterioplankton lineages inhabiting the oxygenated hypolimnion of deep freshwater lakes. The ISME Journal, 2017, 11(10): 2279-2293. DOI:10.1038/ismej.2017.89 |
| [39] |
Sharma AK, Sommerfeld K, Bullerjahn GS et al. Actinorhodopsin genes discovered in diverse freshwater habitats and among cultivated freshwater Actinobacteria. The ISME Journal, 2009, 3(6): 726-737. DOI:10.1038/ismej.2009.13 |
| [40] |
Giovannoni SJ, Tripp HJ, Givan S et al. Genome streamlining in a cosmopolitan oceanic bacterium. Science, 2005, 309(5738): 1242-1245. DOI:10.1126/science.1114057 |
| [41] |
Comeau AM, Harding T, Galand PE et al. Vertical distribution of microbial communities in a perennially stratified Arctic Lake with saline, anoxic bottom waters. Scientific Reports, 2012, 2(35): 604. DOI:10.1038/srep00604 |
| [42] |
Obertegger U, Bertilsson S, Pindo M et al. Temporal variability of bacterioplankton is habitat driven. Molecular Ecology, 2018, 27(21): 4322-4335. DOI:10.1111/mec.14855 |
| [43] |
İnceoǧlu Ö, Llirós M, Crowe SA et al. Vertical distribution of functional potential and active microbial communities in meromictic Lake Kivu. Microbial Ecology, 2015, 70(3): 596-611. DOI:10.1007/s00248-015-0612-9 |
| [44] |
Newton RJ, McLellan SL. A unique assemblage of cosmopolitan freshwater bacteria and higher community diversity differentiate an urbanized estuary from oligotrophic Lake Michigan. Frontiers in Microbiology, 2015, 6: 1028. DOI:10.3389/fmicb.2015.01028 |
| [45] |
Morrison JM, Baker KD, Zamor RM et al. Spatiotemporal analysis of microbial community dynamics during seasonal stratification events in a freshwater lake (Grand Lake, OK, USA). PLoS One, 2017, 12(5): e0177488. DOI:10.1371/journal.pone.0177488 |
| [46] |
Ferguson HW, Collins RO, Moore M et al. Pseudomonas anguilliseptica infection in farmed cod, Gadus morhua L. Journal of Fish Diseases, 2004, 27(4): 249-253. DOI:10.1111/j.1365-2761.2004.00537.x |
| [47] |
Keller-Costa T, Jousset A, van Overbeek L et al. The freshwater sponge Ephydatia fluviatilis harbours diverse Pseudomonas species (Gammaproteobacteria, Pseudomonadales) with broad-spectrum antimicrobial activity. PLoS One, 2014, 9(2): e88429. DOI:10.1371/journal.pone.0088429 |
| [48] |
de Corte D, Srivastava A, Koski M et al. Metagenomic insights into zooplankton-associated bacterial communities. Environmental Microbiology, 2018, 20(2): 492-505. DOI:10.1111/1462-2920.13944 |
| [49] |
Preiswerk D, Walser J, Ebert D. Temporal dynamics of microbiota before and after host death. The ISME Journal, 2018, 12(8): 2076-2085. DOI:10.1038/s41396-018-0157-2 |
| [50] |
Salcher MM, Posch T, Pernthaler J. In situ substrate preferences of abundant bacterioplankton populations in a prealpine freshwater lake. The ISME Journal, 2013, 7(11): 896-907. DOI:10.1038/ismej.2012.162 |
| [51] |
Keshri J, Pradeep Ram AS, Nana PA et al. Taxonomical resolution and distribution of bacterioplankton along the vertical gradient reveals pronounced spatiotemporal patterns in contrasted temperate freshwater lakes. Microbial Ecology, 2018, 76(2): 372-386. DOI:10.1007/s00248-018-1143-y |
| [52] |
Salcher MM, Pernthaler J, Posch T. Spatiotemporal distribution and activity patterns of bacteria from three phylogenetic groups in an oligomesotrophic lake. Limnology and Oceanography, 2010, 55(2): 846-856. DOI:10.4319/lo.2010.55.2.0846 |
| [53] |
Callahan BJ, McMurdie PJ, Rosen MJ et al. DADA2:High-resolution sample inference from Illumina amplicon data. Nature Methods, 2016, 13(7): 581-583. DOI:10.1038/nmeth.3869 |
| [54] |
Rodríguez-Ramos T, Nieto-Cid M, Auladell A et al. Vertical niche partitioning of Archaea and bacteria linked to shifts in dissolved organic matter quality and hydrography in north Atlantic waters. Frontiers in Marine Science, 2021, 8: 673171. DOI:10.3389/fmars.2021.673171 |
 2022, Vol. 34
2022, Vol. 34 


