(2: 中国科学院大学, 北京 100049)
(3: 中国科学院大学中丹学院, 北京 100049)
(4: 中国-丹麦科研教育中心, 北京 100049)
(5: 华南师范大学环境研究院, 广东省化学品污染与环境安全重点实验室, 广州 510006)
(2: University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(3: Sino-Danish College, University of Chinese Academy of Sciences, Beijing 100049, P. R. China)
(4: Sino-Danish Center of Education and Research, Beijing 100049, P. R. China)
(5: Guangdong Provincial Key Laboratory of Chemical Pollution and Environmental Safety, Environmental Research Institute, South China Normal University, Guangzhou 510006, P. R. China)
杀生剂是指依靠化学或生物手段抑制或杀灭有害生物体,并且对人体没有直接危害的化学物质[1]。杀生剂广泛应用于水产养殖、水净化、食品、医药、农业、纺织、塑料、家具、化妆品、油漆和建筑等领域,用于控制部分有害生物,比如细菌、藻类、真菌、昆虫和啮齿动物[2-4]。按照用途,杀生剂一般分为5大类,分别是杀菌剂、驱虫剂、防污剂、防腐剂和消毒剂。杀生剂的使用广泛,用量巨大,比如尼泊金酯类防腐剂广泛应用于化妆品、食品和药物中,近年来我国尼泊金酯类的月产量超过了10000 t[5]。三氯生和三氯卡班是目前应用最广泛的消毒剂,被添加到香皂、肥皂、牙膏、洗手液、沐浴露和医用消毒剂等多种护理品中[6-7]。受到新冠肺炎疫情的影响,全球各地对于消毒剂的使用更加频繁,这可能导致其排放量增大,对环境的污染和破坏加重。大量杀生剂会随着污水处理厂出水或者废水直接排放进入水环境[8-9]。
多种杀生剂在河流、湖泊等地表水环境中广泛被检出。常见杀菌剂如克霉唑、氟康唑、咪康唑和多菌灵在我国东江流域[10]、长江中下游[11]和泰国曼谷河流[9]均有检出,在水相和沉积相的最高检出浓度的范围分别为10.7~154 ng/L和0.32~371 ng/g。防污剂1, 2-苯并异噻唑啉酮(BIT)在德国莱茵河[12]和泰国曼谷河流[9]等地检出,在水相和沉积相的最高检出浓度的范围分别为37.0~71.2 ng/L和2.64~179 ng/g。尼泊金酯类防腐剂在我国东江流域[10]、长江中下游流域[11]和山东德州[13],日本东京湾[14],美国底特律河[14],泰国曼谷[9],加拿大魁北克[15]和西班牙Turia River[16]均有检出;其中尼泊金甲酯的检出率最高,在水相和沉积相的最高检出浓度的范围分别为28.8~2270 ng/L和15.1~476 ng/g。典型消毒剂三氯生和三氯卡班在全世界多个地区的水体中广泛存在,如我国流溪河、石井河[17]、东江流域[10]、长江中下游及流域大型湖泊(洞庭湖、鄱阳湖、巢湖、太湖)[18]、辽河、海河和黄河[19],美国格林威治湾[20],巴西桑托斯湾[21]和泰国曼谷河流[9]。其中三氯生在水相和沉积相的最高检出浓度范围分别为23.1~478 ng/L和3.67~1329 ng/g,三氯卡班在水相和沉积相的最高检出浓度范围分别为10.3~551 ng/L和17.5~5649 ng/g。
大量杀生剂进入地表水后会进一步影响水生生物的生长和繁殖,对水生态系统健康和安全产生潜在的危害[11, 22]。例如,多菌灵对于藻类、无脊椎动物和鱼类均具有慢性毒性,其最大无效应浓度(NOEC)的范围为1.5~8000 μg/L[23]。BIT对于斑马鱼具有抑制作用,其半致死浓度(LC50)为6.8 mg/L[24]。尼泊金酯类防腐剂在低浓度能促进藻类的生长,但在较高浓度下会抑制藻类的生长[25]。目前关于杀生剂在沉积物中的生态毒性效应较少。Tamura等利用摇蚊Chironomus yoshimatsui进行慢性毒性实验(28天),得出三氯生和三氯卡班的NOEC值分别为5.0和2.5 μg/g[26]。
湖泊是杀生剂的重要受纳水体。杀生剂直接或者随河流或污水处理厂出水进入湖泊后,会因吸附作用进入沉积相。沉积物不仅是污染物的汇,也会通过解吸释放污染物,成为湖泊污染物的源。然而,目前关于典型杀生剂在湖泊水体尤其是沉积物中分布特征的研究较少。因此,有必要关注典型杀生剂在湖泊沉积物中的污染特征及可能的生态风险。
长江中下游平原是我国的三大平原之一,包括上海市、江苏省、浙江省、安徽省、江西省、湖北省和湖南省7省1市,是我国经济发达、人口密集的区域;该区域人口占全国总人口的28.6 %,GDP约占全国GDP的35 % [27-28]。长江中下游平原淡水湖泊众多,约占我国淡水湖泊总面积的60 %,许多湖泊是重要的饮水水源地[29]。此外,湖泊还提供重要的航运、旅游、水产养殖等服务。长江中下游地区湖泊环境安全至关重要,然而目前关于长江中下游地区湖泊水体中杀生剂的污染特征的研究相对较少。因此,有必要关注长江中下游湖泊沉积物中典型杀生剂的生态风险。本研究选取长江中下游地区为研究区域,选取13种常见杀生剂为研究对象,考察长江中下游地区湖泊沉积物中典型杀生剂的污染特征和生态风险。
1 材料与方法 1.1 研究区域概况和样品采集2016年7月(夏季)对我国长江中下游地区61个湖泊进行采样,共采集到104个沉积物样品,采样点如图 1所示,各采样点编号及所对应的基本信息详见附表Ⅰ。对于湖泊面积偏小的湖泊仅在湖心点采集样品,对面积较大的湖泊从近岸到湖心点采集2~3个样点;对于太湖、巢湖和洞庭湖等大型湖泊,将对其代表性区域按照从沿岸到湖心点的方法进行分别采集。根据湖泊位置和水系[30],将61个湖泊划分为7个湖群,分别为太湖湖群(Y1~Y16)、淮河湖群(Y17~Y32)、华阳湖群(Y33~Y49)、江汉湖群(Y50~Y72)、鄱阳湖湖群(Y73~Y87)、洞庭湖湖群(Y88~Y93)和其他湖泊(Y94~Y104)。
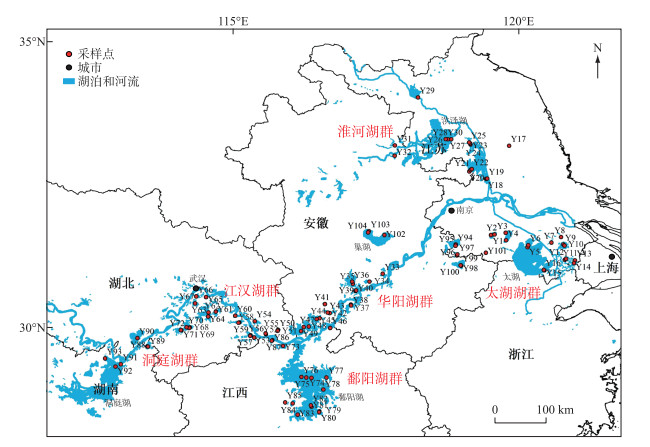
|
图 1 采样点分布 Fig.1 Distribution of sampling sites |
采样过程,使用不锈钢抓斗采泥器采集表层沉积物样品,放置于低温保温箱中,并在8 h内运回实验室冷冻保存。将沉积物样品在实验室中冷冻干燥、研磨、过筛(0.5 mm)后,避光保存于-18℃冰柜,待用。
1.2 材料与设备本研究选择4大类共13种杀生剂作为研究目标。克霉唑、氟康唑、涕必灵、多菌灵、OIT、三氯生、三氯卡班、氟康唑-D4和涕必灵-D6产自德国Dr. Ehrenstorfer公司;咪康唑购自美国Pharmacopeia公司;尼泊金甲酯、尼泊金乙酯、尼泊金丙酯和尼泊金丁酯均产自美国AccuStandard公司;BIT购于日本TCI公司。克霉唑-D5、咪康唑-D5、尼泊金丙酯-D4和OIT-D17产自加拿大TRC公司;尼泊金甲酯-D4产自加拿大CDN Isotopes公司;13C12-triclosan和triclocarban-D7均产自美国Cambridge Isotope Laboratories公司。甲醇、乙酸乙酯、甲酸等色谱级试剂分别产自德国Merck公司、上海安谱公司(CNW)和美国Tedia公司。
实验材料中,HLB固相萃取柱(200 mg,6 mL)购于美国Waters公司,0.22 μm有机相滤膜购于上海安谱公司,50 mL的TeflonTM FEP离心管来自美国Thermo Fisher公司,1200系列超高效液相色谱串联G6460A三重四级杆质谱(UHPLC-MS/MS)购于美国的Agilent公司。
1.3 杀生剂前处理及仪器分析 1.3.1 沉积物前处理沉积物中杀生剂的提取采用有机溶剂超声萃取结合固相萃取净化的方法[13]。
1.3.2 杀生剂UPLC-MS/MS分析杀生剂采用Agilent 1200超高效液相色谱串联Agilent 6460三重四级杆质谱(UHPLC-MS/MS)在电喷雾离子化检测器(ESI)的正离子模式和负离子模式下进行测定[13]。
1.3.3 质量控制为了抵消潜在的实验误差和基质效应,目标化合物采用内标法定量。加标回收率实验是向沉积物样品中加入混合标准样品和内标,然后按照上述前处理和仪器方法进行分析,回收率计算方法为实测的杀生剂浓度扣除背景值后除以添加的杀生剂浓度,再乘以100 %。目标化合物回收率的范围为78.4 %~165 %,检出限为0.01~0.08 ng/g,定量限为0.01~0.27 ng/g(表 1)。每20个样品穿插分析实验空白、溶剂空白和加标控制样品。实验空白用来检查提取过程中是否有污染,溶剂空白用来检查仪器背景和测试过程中是否引入了污染,加标控制样品用来考察提取过程是否正常。
| 表 1 目标杀生剂的回收率、检出限和定量限 Tab. 1 Recoveries, limits of detection (LODs) and limits of quantitation (LOQs) for the target biocides |
环境中杀生剂的生态风险评价采用欧盟技术指导文件(European Commission Technical Guidance Document,TGD)推荐的风险商(risk quotient,RQ)方法[31],计算公式为:
| $ R Q=M E C / P N E C $ | (1) |
式中,MEC为测定的环境浓度,PNEC为预测无效应浓度。根据RQ值的大小可以将风险等级划分为3个等级:RQ < 0.1代表低风险;0.1≤RQ < 1代表中风险;RQ≥1代表高风险[32]。
在对地表水水相中杀生剂进行生态风险评价时,实测的杀生剂浓度即为MEC值;在沉积物中,由于缺乏相关的毒性数据,需要将实测的沉积物杀生剂浓度转换为孔隙水浓度作为MEC值。转换公式如下:
| $ C_{\mathrm{P}}=\frac{k \cdot C_{\mathrm{S}}}{K_{\mathrm{oc}} \cdot f_{\mathrm{TOC}}} $ | (2) |
式中,CP(ng/L)为孔隙水浓度;CS(ng/g)为沉积物浓度;k为统一单位的转换因子,值为1000;KOC为有机碳标准化分配系数;fTOC为沉积物样品中总有机碳(TOC)的质量分数,测定方法见1.5。
杀生剂的PNEC值通过评估因子法或物种敏感度分布法计算获得,详见表 2。其中,评估因子法是使用对物种最敏感且最低的EC50、LC50值或最高的NOEC值除以合适的评价因子(assessment factor,AF)得到PNEC值,评价因子分别为1000(含至少1个营养级的EC50或LC50值)、100(含1个营养级的NOEC值)、50(含2个营养级的NOEC值)或10(含3个营养级的NOEC值)[31]。而且与EC50或LC50值对比,NOEC值优先用于计算PNEC值,无NOEC值可用时可选用EC10值代替。
| 表 2 杀生剂有机碳标准化分配系数(KOC)、毒性数据、评价因子(AF)和预测无效应浓度(PNEC) Tab. 2 KOC, toxicity data, AF and PNEC values for the target biocides |
在测量沉积物TOC时,需要先对沉积物样品进行预处理去除碳酸盐。具体步骤为:先选取50 mL离心管,称重记为M0。加入0.5~1.0 g冻干及研磨后的沉积物样品,样品的质量记为M1。再加入30 mL稀盐酸(37 % 盐酸∶纯水=1 ∶3),充分震荡后,静置12 h。在3214 g的转速下离心10 min,倒掉上清液。加入30 mL去离子水,离心,并倒掉上清液,重复3次,使样品pH为中性。经冷冻干燥机冻干后,称量离心管和样品的总质量为M2。用研钵将冻干后的样品磨成粉末,称取10~20 mg样品到锡杯中待测。使用CHNS元素分析仪(Vario EL Ⅲ)测定样品的C含量,记为fC。由此可计算出沉积物样品的TOC值:
| $ f_{\mathrm{TOC}}=\frac{(M 2-M 0) f_{\mathrm{C}}}{M 1} $ | (3) |
湖泊沉积物中杀生剂浓度和TOC采用Kolmogorov-Smirnov检验分析是否为正态分布。若数据为正态分布,采用Pearson相关分析来判断杀生剂浓度和TOC是否具有相关性(P < 0.05),否则就采用Spearman秩相关方法。数据分析过程在SPSS 21软件中进行。
2 结果 2.1 湖泊沉积物杀生剂含量水平和分布情况在61个湖泊共104个沉积物样品中,共有11种杀生剂被检出,分别是克霉唑、氟康唑、咪康唑、涕必灵、多菌灵、BIT、尼泊金甲酯、尼泊金乙酯、尼泊金丁酯、三氯生和三氯卡班(图 2)。各采样点的总杀生剂浓度范围为0.55~103 ng/g,平均值和中位值分别为(16.7±14.5)ng/g(n=104)和13.1 ng/g。其中有78个样品的总浓度小于20 ng/g,占75 %;总浓度在20~50 ng/g之间的采样点有23个,占22.1 %;总浓度在50~100 ng/g之间的采样点有2个,占1.9 %;总浓度高于100 ng/g采样点有1个,占1.0 % (图 3)。
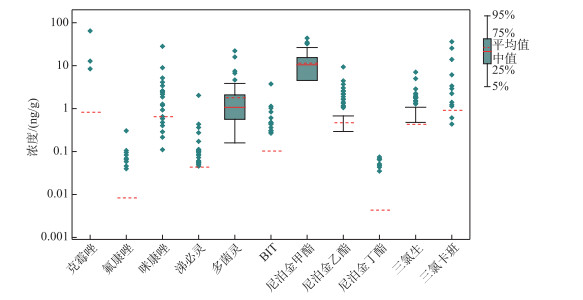
|
图 2 长江中下游地区湖泊沉积物中杀生剂的检出浓度 Fig.2 Concentrations of biocides in the lake sediments in the middle and lower reaches of the Yangtze River |
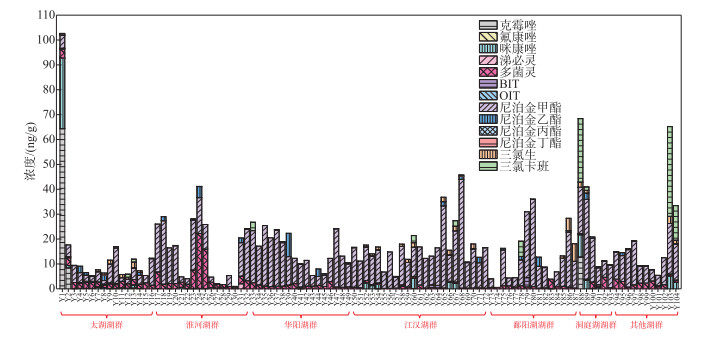
|
图 3 长江中下游地区湖泊沉积物各采样点的杀生剂含量水平 Fig.3 The biocide concentrations of each sampling site in lake sediments in the middle and lower reaches of the Yangtze River |
本次研究中共有5种杀菌剂被检出,其中检出率由高到低依次为多菌灵(100 %)、涕必灵(20.2 %)、咪康唑(19.2 %)、氟康唑(8.65 %)和克霉唑(2.88 %)(图 2)。多菌灵分布最为广泛,在104个采样点中均有检出,检出浓度范围为0.16 ng/g(猪婆湖Y55)~22.1 ng/g(白马湖Y24),平均浓度和中值浓度分别为(1.79±2.76)ng/g和1.07 ng/g。涕必灵在21个采样点被检出,检出浓度整体偏低,最高浓度和平均浓度分别为2.03 ng/g(陀湖Y31)和(0.04±0.21)ng/g。咪康唑在20个沉积物样品中被检出,最高浓度达到28.2 ng/g(长荡湖Y1),平均浓度为(0.65±3.00)ng/g。氟康唑检出率和检出浓度均偏低,最高浓度为0.30 ng/g(淀山湖Y13)。克霉唑仅在3个采样点被检出,浓度分别为64.4 ng/g(长荡湖Y1)、12.7 ng/g(黄盖湖Y88)和8.43 ng/g(长荡湖Y2)。
防污剂BIT的检出率为13.5 %,最高浓度为3.76 ng/g(杨坊湖Y79),平均浓度为(0.10±0.41)ng/g(图 2)。防腐剂尼泊金甲酯、尼泊金乙酯和尼泊金丁酯均在长江中下游湖泊沉积物中被检出,检出率分别为96.2 %、45.2 % 和7.69 % (图 2)。尼泊金甲酯在100个采样点中被检出,最高浓度为43.7 ng/g(斧头湖Y68),平均浓度和中值浓度分别为(11.4±8.19)和10.5 ng/g。尼泊金乙酯的最高浓度达到9.35 ng/g(鄱阳湖Y39),平均浓度为(0.47±1.20)ng/g。尼泊金丁酯的检出浓度相对较低,在8个采样点被检出,最高浓度仅为0.07 ng/g(白马湖Y23)。
消毒剂三氯生和三氯卡班在长江中下游地区的湖泊沉积物中均被检出,检出率分别为31.7 % 和11.5 %。三氯生和三氯卡班的最高浓度分别为7.05 ng/g(赤湖Y87)和36.1 ng/g(巢湖Y103),平均浓度分别为(0.43±1.01)和(0.91±4.55)ng/g(图 3)。
2.2 杀生剂生态风险本研究通过利用风险商值法对杀生剂的生态风险进行评估。在检出的11种杀生剂中,有4种杀生剂(多菌灵、尼泊金甲酯和三氯卡班)的RQ值在部分采样点大于1,表现为高风险(图 4)。多菌灵在50个采样点的RQ值>1,存在高风险;49个采样点的RQ值在0.1~1之间,表现为中风险;5个采样点的RQ值< 0.1,表现为低风险。尼泊金甲酯在6个采样点的RQ值>1,存在高风险;90个采样点的RQ值在0.1~1之间,存在中风险;8个采样点的RQ值< 1,为低风险。三氯卡班在1个采样点的RQ值>1,存在高风险;3个采样点的RQ值在0.1~1之间,占2.88 %;100个采样点的RQ值< 1,占96.2 %。其余的8种杀生剂中,BIT和三氯生分别在9和12个采样点的RQ值在0.1~1之间,表现为中风险,其余采样点均 < 0.1,为低风险。克霉唑、氟康唑、咪康唑、涕必灵、尼泊金乙酯和尼泊金丁酯在所有采样点的RQ值均 < 0.1,表现为低风险。
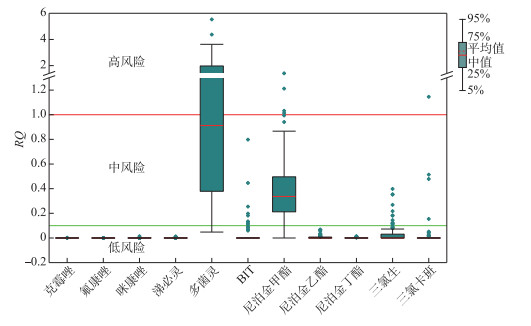
|
图 4 长江中下游地区湖泊沉积物中不同杀生剂的RQ值 Fig.4 The RQ values of different biocides in lake sediments in the middle and lower reaches of the Yangtze River |
本研究在长江中下游地区的湖泊沉积物共检出11种杀生剂,总杀生剂浓度最高可达103 ng/g,平均浓度为(16.7±14.5)ng/g(n=104)。太湖湖群、淮河湖群、华阳湖群、江汉湖群、鄱阳湖湖群、洞庭湖湖群和其他湖泊,杀生剂的平均浓度分别为(15.1±23.7)ng/g(n=16)、(15.7±12.6)ng/g(n=16)、(15.7±7.1) ng/g(n=17)、(17.2±9.0) ng/g(n=23)、(13.8±10.9) ng/g(n=15)、(26.7±23.8) ng/g(n=6)和(18.9±17.1) ng/g(n=11)。可以看出,不同湖群沉积物杀生剂含量水平大致相当。
3.1.1 杀菌剂和防污剂污染水平多菌灵在太湖湖群、淮河湖群和其他组湖泊(巢湖等)的平均浓度分别为(2.18±0.65)、(4.67±6.01)和(1.90±1.09)ng/g,与我国东江流域在同一水平(3.16 ng/g)[10];多菌灵在华阳湖群和洞庭湖群的平均浓度分别为(1.27±0.63)和(1.48±1.79) ng/g,与我国广州流溪河(1.40 ng/g)[13]和泰国曼谷河流沉积物(1.62 ng/g)[9]水平相当;多菌灵在江汉湖群和鄱阳湖湖群的平均浓度分别为(0.48±0.31)和(0.94±0.86)ng/g,与长江中下游段(0.90 ng/g)[11]和多瑙河I号铁门水库(0.55 ng/g)[41]相当,高于Turia和Júcar Rivers(0.02 ng/g)[42]。多菌灵的检出率在本研究中达到100 %,这与我国长江中下游段和泰国曼谷河流一致,均高于我国东江流域(74 %)、西班牙Turia和Júcar Rivers(3 %)和多瑙河I号铁门水库(38 %)。多菌灵在水体环境中广泛被检出,可能是由于多菌灵在农业生产中应用广泛[43],并且在自然水体环境中相对稳定,不易发生生物降解、水解或光解[23]。本研究中克霉唑的平均浓度为(0.82±6.47) ng/g,与我国长江中下游段在同一水平(0.59 ng/g)[11],低于我国东江流域(35.7 ng/g)[10]和泰国曼谷河流(42.5 ng/g)[9]。本研究中克霉唑的检出率为2.88 %,低于我国长江中下游段(96 %)、东江流域(74 %)和泰国曼谷河流(100 %)。咪康唑的平均浓度为(0.65±3.00) ng/g,与长江中下游段类似(0.70 ng/g)[11],同时也低于东江流域(11.2 ng/g)[10]和曼谷河流(23.3 ng/g)[9]。咪康唑的检出率在本研究中为20.2 %,低于我国长江中下游段(98 %)、东江流域(98 %)和泰国曼谷河流(100 %)。涕必灵的平均浓度为(0.04±0.21)ng/g,低于曼谷河流(2.14 ng/g)[9]和西班牙Turia和Júcar Rivers(0.63 ng/g)[42],高于我国长江中下游段(0.005 ng/g)[11]。本研究中涕必灵的检出率为21.2 %,高于我国长江中下游段(4 %)和西班牙Turia和Júcar Rivers(5 %),低于泰国曼谷河流(100 %)。氟康唑的平均浓度为(0.01±0.04)ng/g,与我国长江中下游段(0.01 ng/g)[11]和曼谷河流(0.43 ng/g)[9]类似。本研究中BIT的平均浓度为0.10 ng/g,检出率为13.5 %,均低于泰国曼谷河流沉积物(2.05 ng/g)[9],而BIT在我国长江中下流段河流沉积物中未检出[11]。
3.1.2 尼泊金酯类防腐剂污染水平除太湖湖群(平均值(4.86±3.52)ng/g)外,长江中下游地区其他湖群沉积物中尼泊金甲酯平均值范围为10.2~15.1 ng/g,高于我国长江中下游段河流沉积物(4.95 ng/g)[11]、山东德州沉积物(2.20 ng/g)[13],韩国西瓦湖(4.66 ng/g),日本东京湾(5.04 ng/g)和美国底特律河(4.04 ng/g)[14];与我国东江流域的沉积物(14.2 ng/g)相当[10],但低于泰国曼谷河流沉积物(44.7 ng/g)[9]、加拿大魁北克河流沉积物(28.0 ng/g)[15]以及西班牙Turia River沉积物(152 ng/g)[16]。尼泊金甲酯的检出率普遍较高,在其他研究区域达到了100 %,在本研究中也达到了96.2 %。尼泊金乙酯的平均浓度为(0.49±1.20)ng/g,与我国长江中下游段(0.20 ng/g)[11]和韩国西瓦湖(0.54 ng/g)处于同一水平,高于日本东京湾(0.07 ng/g)和美国底特律河(0.09 ng/g)[14],低于西班牙Turia River(23.0 ng/g)[16]和加拿大魁北克河流(6.00 ng/g)[15]。本研究中尼泊金乙酯的检出率为46.2 %,高于日本东京湾(18 %)和美国底特律河(23 %),低于其他研究区域。尼泊金丁酯的平均浓度为(0.004±0.02)ng/g,低于西班牙Turia River(3.00 ng/g)[16]、加拿大魁北克河流(9.50 ng/g)[15]、韩国西瓦湖(0.14 ng/g)[14]、日本东京湾(0.07 ng/g)[14]和美国底特律河(0.08 ng/g)[14],且本研究中尼泊金丁酯的检出率也低于以上各地。虽然尼泊金酯类在好氧环境下容易发生生物降解[44],但由于其在食品、化妆品、医药、饲料等领域广泛应用,污染源不断排放造成尼泊金酯类特别是尼泊金甲酯在环境中普遍存在。
3.1.3 消毒剂污染水平除淮河湖群(仅在Y30检出)和华阳湖群(未检出)外,三氯生在我国长江中下游地区其他湖群中的平均浓度范围为(0.39±0.93)~(0.86±2.1)ng/g,与我国多个地区沉积物中的三氯生污染水平类似,比如山东德州(0.70 ng/g)[13]和长江中下游河流(0.60 ng/g)[11],低于辽河(5.46 ng/g)、海河(2.31 ng/g)和黄河(1.37 ng/g)[19]。在其他国家和地区检测到的三氯生浓度更高,比如美国格林威治湾(10.8 ng/g)[20]、巴西桑托斯湾(15.1 ng/g)[21]和泰国曼谷河流(46.5 ng/g)[9]。三氯生在本研究中的检出率也低于以上各地,为31.7 %。三氯卡班在本研究中的平均浓度为(0.91±4.55)ng/g,与黄河类似(0.93 ng/g)[19],低于我国东江(495 ng/g)[10]、长江中下游段(7.83 ng/g)[11]、辽河(122 ng/g)、海河(22.3 ng/g)[19]和曼谷河流(604 ng/g)[9]。而本研究中三氯卡班的检出率仅为11.5 %,低于上述各研究区域。综上所述,与国内外其他地区相比,我国长江中下游地区湖泊沉积物的杀生剂污染总体处于中等偏低的水平。
3.2 杀生剂分布特征及来源各湖群沉积物杀生剂总量水平整体相当,但杀生剂检出率和检出浓度稍有差异。太湖湖群检出杀生剂种类最多,其中多菌灵和尼泊金甲酯检出率和检出浓度最高;三氯生、尼泊金乙酯、BIT和涕必灵检出率较高,但检出浓度整体偏低;克霉唑和咪康唑在长荡湖浓度偏高,其他湖泊浓度偏低或未检出。淮河湖群检出率较高的杀生剂为多菌灵和尼泊金甲酯,其次是尼泊金乙酯和涕必灵,但尼泊金乙酯和涕必灵的检出浓度偏低。华阳湖群仅检出5种杀生剂,主要污染物为尼泊金甲酯和多菌灵。江汉平原湖群主要污染物为尼泊金甲酯,多菌灵检出率高但检出浓度偏低。洞庭湖湖群的主要污染物为尼泊金甲酯,黄盖湖也检出较高浓度的克霉唑和三氯卡班。不同杀生剂在各湖群的检出情况可能与流域杀生剂使用情况、人口数量等有关。太湖湖群位于人口密集、经济发达的苏锡常地区,江汉湖群位于我国中部武汉城市圈,这两个区域的杀生剂检出率整体偏高,且与人口数量密切相关[10]的三氯生检出率较高。但三氯生在淮河湖群未检出,在华阳湖群检出率仅为5.9 %,可能是由于这两个区域分别位于苏北地区和安徽中南部,人口密度整体低于苏锡常地区。多菌灵在白马湖中检出浓度偏高,可能与农业面源污染有关。除了农业使用外,多菌灵也常用于城市绿化等;多菌灵应用广泛且不易降解[44],造成其在湖泊环境中普遍存在。
相关性分析(表 3)发现,氟康唑、咪康唑、三氯生和三氯卡班存在显著正相关性(P < 0.05,Spearman),说明这4种杀生剂的来源可能一致。而三氯生和三氯卡班是生活污水的指示性化合物[10],因此,氟康唑、咪康唑、三氯生和三氯卡班可能主要来自生活污水。涕必灵和多菌灵存在显著正相关性(P < .05,Spearman),而与尼泊金甲酯和三氯生存在显著负相关(P < 0.05,Spearman),说明涕必灵和多菌灵来源相似,但与尼泊金甲酯和三氯生的来源或者在湖泊中的环境行为不一致。涕必灵和多菌灵主要用作农药,其主要来源为面源污染。尼泊金甲酯和三氯生没有显著相关性,尼泊金酯类和三氯生的来源或者环境行为也存在较大差异。此外,尼泊金酯类防腐剂尼泊金甲酯(r=0.6606)、尼泊金乙酯(r=0.2811)和尼泊金丁酯(r=0.3134)与沉积物TOC均具有显著相关性(P < 0.05,Spearman),说明尼泊金酯类防腐剂在沉积物的分布特征也与沉积物TOC有一定关系。尼泊金酯类杀生剂容易生物降解[44],但与沉积物有机质结合后可能会降低其生物可利用性。
| 表 3 长江中下游地区湖泊沉积物杀生剂浓度与TOC的Spearman相关系数 Tab. 3 Spearman correlation coefficients between biocides and TOC in lake sediments in the middle and lower reaches of the Yangtze River |
杀生剂在湖泊内部的分布也存在一定的空间异质性。在采集2个及以上采样点的36个湖泊中,湖泊内部不同采样点的杀生剂浓度相对标准偏差小于20 % 的湖泊有16个,相对标准偏差在20 %~50 % 之间的湖泊有11个,相对标准偏差超过50 % 的湖泊有9个。杀生剂进入湖泊后可能会在风力扰动下发生迁移;在新污染源较少时,杀生剂分布相对均匀。然而,在浓度超过50 ng/g的5个湖泊中,西巢湖、黄盖湖和长荡湖较高浓度的采样点均为相对靠近岸边的采样点。这说明杀生剂进入湖泊后短期内与污染源存在较大关系。
3.3 杀生剂的环境影响及管控由于缺乏沉积物中杀生剂的毒性数据,本研究将沉积物杀生剂浓度转化为孔隙水中杀生剂的浓度,然后利用风险商值法进行杀生剂生态风险评价。结果显示,3种杀生剂多菌灵、尼泊金甲酯和三氯卡班在长江中下游湖泊部分沉积物中存在高风险。多菌灵在太湖湖群均为高风险,淮河湖群和其他组多为高风险,华阳湖群、江汉湖群、鄱阳湖湖群和洞庭湖湖群多为中风险,而整个长江中下游平原湖泊仅在猪婆湖(Y55)、严东湖(Y65)、斧头湖(Y68和Y69)和西凉湖(Y72)为低风险。尼泊金甲酯高风险采样点位于菜子湖(Y35和Y36)、杨坊湖(Y79和Y80)和西巢湖(Y103和Y104)。三氯卡班的高风险采样点位于巢湖(Y103)。多菌灵和尼泊金甲酯对浮游生物D. magna可能会造成风险。三氯生对藻类更为敏感,三氯卡班对甲壳类动物更为敏感[10]。
目前仅有少量关于三氯生和三氯卡班在沉积物中的慢性毒性数据。Tamura等研究发现,三氯生和三氯卡班对摇蚊Chironomus yoshimatsui的NOEC值分别为5.0和2.5 μg/g[26]。仅有一个营养级的NOEC值,评估因子为100,最终得到三氯生和三氯卡班的PNEC值为50和25 ng/g。利用沉积物毒性数据得到的PNEC值计算三氯生和三氯卡班RQ值,结果显示,三氯生在2个采样点的RQ介于0.1~1之间,对底栖动物有中等风险;三氯卡班在2个采样点(RQ分别为1.02和1.44)有高风险,在4个采样点有中等风险。对比孔隙水方法和沉积物毒性数据方法评估沉积物中三氯生和三氯卡班生态风险的结果来看,两种方法所获得的三氯生RQ值基本处于同一个数量级,沉积物毒性数据获得的三氯卡班RQ值相对偏高。目前关于沉积物中多菌灵、尼泊金甲酯、三氯生和三氯卡班的毒性数据极少,建议加强相关研究,为准确评估杀生剂在水体环境中的生态风险提供更多的基础数据。
同时,为了减少杀生剂可能造成的生态风险,有必要加大对杀生剂污染的管控。首先,提高污水收集率和处理效率,减少生活源和工业源的杀生剂排放。其次,合理使用农药,加强面源污染的管控。另外,加大饮水水源地安全管理,控制生活污水直接排放、污水处理厂出水排放以及可能的大规模面源污染;同时,研发自来水处理新技术,提高微污染物去除效率,并减少消毒副产物的产生及可能的人体健康风险。最后,呼吁企业和民众合理使用杀生剂,比如农药类杀菌剂多菌灵、消毒剂三氯生和三氯卡班等。
4 结论通过对我国长江中下游地区61个湖泊沉积物中杀生剂的污染特征和风险评价进行研究,得出以下结论:
1) 11种杀生剂在长江中下游地区湖泊沉积物中被检出,总杀生剂浓度范围为0.55~103 ng/g,平均浓度和中值分别为(16.7±14.5)和13.1 ng/g。与其他国家和地区相比,我国长江中下游地区湖泊沉积物杀生剂污染水平处于中等偏低的水平。
2) 多菌灵和尼泊金甲酯检出率超过50 %,且检出浓度整体高于其他杀生剂。氟康唑、咪康唑、三氯生和三氯卡班可能主要来自生活污水,多菌灵和涕必灵主要来自面源污染。尼泊金酯类防腐剂在沉积物中的分布特征与沉积物TOC含量密切相关。
3) 通过计算RQ发现,多菌灵、尼泊金甲酯和三氯卡班在部分采样点中RQ值高于1,表现出高风险。这些杀生剂在湖泊环境中的生态风险值得进一步关注。
5 附录附表Ⅰ见电子版(DOI: 10.18307/2023.0114)。
| 附表Ⅰ 采样点基本信息和沉积物总有机碳(TOC)含量 Appendix Ⅰ Basic information and total organic carbon for each sampling site |
致谢: 感谢中国科学院南京地理与湖泊研究所羊向东、云南师范大学孔令阳、华南师范大学张永东和中国药科大学李洁在采样过程中提供的帮助。
| [1] |
EC. Directive 98/8/EC of the European Parliament and of the Council of 16 February 1998 concerning the placing of biocidal products on the market. Official Journal of the European Communities, 1998, 41: 123. |
| [2] |
Ma XQ, Wan YJ, Wu MY et al. Occurrence of benzophenones, parabens and triclosan in the Yangtze River of China, and the implications for human exposure. Chemosphere, 2018, 213: 517-525. DOI:10.1016/j.chemosphere.2018.09.084 |
| [3] |
Gao YP, Niu XL, Qin YX et al. Unexpected culprit of increased estrogenic effects: Oligomers in the photodegradation of preservative ethylparaben in water. Water Research, 2020, 176: 115745. DOI:10.1016/j.watres.2020.115745 |
| [4] |
Deniz F, Bural H. Sustainable environmental remediation approach for biocide removal from water medium: A model biosorption study using activated biological waste. International Journal of Phytoremediation, 2021, 23(2): 111-118. DOI:10.1080/15226514.2020.1798872 |
| [5] |
Catao ECP, Gallois N, Fay F et al. Metal resistance genes enrichment in marine biofilm communities selected by biocide-containing surfaces in temperate and tropical coastal environments. Environmental Pollution, 2021, 268: 115835. DOI:10.1016/j.envpol.2020.115835 |
| [6] |
Weatherly LM, Gosse JA. Triclosan exposure, transformation, and human health effects. Journal of Toxicology and Environmental Health Part B, Critical Reviews, 2017, 20(8): 447-469. DOI:10.1080/10937404.2017.1399306 |
| [7] |
Fan B, Li J, Wang XN et al. Study of aquatic life criteria and ecological risk assessment for triclocarban (TCC). Environmental Pollution, 2019, 254: 112956. DOI:10.1016/j.envpol.2019.112956 |
| [8] |
Liu WR, Yang YY, Liu YS et al. Biocides in wastewater treatment plants: Mass balance analysis and pollution load estimation. Journal of Hazardous Materials, 2017, 329: 310-320. DOI:10.1016/j.jhazmat.2017.01.057 |
| [9] |
Juksu K, Zhao JL, Liu YS et al. Occurrence, fate and risk assessment of biocides in wastewater treatment plants and aquatic environments in Thailand. Science of the Total Environment, 2019, 690: 1110-1119. DOI:10.1016/j.scitotenv.2019.07.097 |
| [10] |
Chen ZF, Ying GG, Liu YS et al. Triclosan as a surrogate for household biocides: An investigation into biocides in aquatic environments of a highly urbanized region. Water Research, 2014, 58: 269-279. DOI:10.1016/j.watres.2014.03.072 |
| [11] |
Liu WR, Zhao JL, Liu YS et al. Biocides in the Yangtze River of China: Spatiotemporal distribution, mass load and risk assessment. Environmental Pollution, 2015, 200: 53-63. DOI:10.1016/j.envpol.2015.02.013 |
| [12] |
Wick A, Fink G, Ternes TA. Comparison of electrospray ionization and atmospheric pressure chemical ionization for multi-residue analysis of biocides, UV-filters and benzothiazoles in aqueous matrices and activated sludge by liquid chromatography-tandem mass spectrometry. Journal of Chromatography A, 2010, 1217(14): 2088-2103. DOI:10.1016/j.chroma.2010.01.079 |
| [13] |
Chen ZF, Ying GG, Lai HJ et al. Determination of biocides in different environmental matrices by use of ultra-high-performance liquid chromatography-tandem mass spectrometry. Analytical and Bioanalytical Chemistry, 2012, 404(10): 3175-3188. DOI:10.1007/s00216-012-6444-2 |
| [14] |
Liao CY, Lee S, Moon HB et al. Parabens in sediment and sewage sludge from the United States, Japan, and Korea: Spatial distribution and temporal trends. Environmental Science & Technology, 2013, 47(19): 10895-10902. DOI:10.1021/es402574k |
| [15] |
Viglino L, Prévost M, Sauvé S. High throughput analysis of solid-bound endocrine disruptors by LDTD-APCI-MS/MS. Journal of Environmental Monitoring, 2011, 13(3): 583-590. DOI:10.1039/C0EM00550A |
| [16] |
Carmona E, Andreu V, Picó Y. Occurrence of acidic pharmaceuticals and personal care products in Turia River Basin: From waste to drinking water. Science of the Total Environment, 2014, 484: 53-63. DOI:10.1016/j.scitotenv.2014.02.085 |
| [17] |
Zhao JL, Ying GG, Liu YS et al. Occurrence and risks of triclosan and triclocarban in the Pearl River system, South China: From source to the receiving environment. Journal of Hazardous Materials, 2010, 179(1/2/3): 215-222. DOI:10.1016/j.jhazmat.2010.02.082 |
| [18] |
Wu CX, Huang XL, Witter JD et al. Occurrence of pharmaceuticals and personal care products and associated environmental risks in the central and lower Yangtze River, China. Ecotoxicology and Environmental Safety, 2014, 106: 19-26. DOI:10.1016/j.ecoenv.2014.04.029 |
| [19] |
Zhao JL, Zhang QQ, Chen F et al. Evaluation of triclosan and triclocarban at river basin scale using monitoring and modeling tools: Implications for controlling of urban domestic sewage discharge. Water Research, 2013, 47(1): 395-405. DOI:10.1016/j.watres.2012.10.022 |
| [20] |
Katz DR, Cantwell MG, Sullivan JC et al. Factors regulating the accumulation and spatial distribution of the emerging contaminant triclosan in the sediments of an urbanized estuary: Greenwich Bay, Rhode Island, USA. Science of the Total Environment, 2013, 443: 123-133. DOI:10.1016/j.scitotenv.2012.10.052 |
| [21] |
Pusceddu FH, Choueri RB, Pereira CDS et al. Environmental risk assessment of triclosan and ibuprofen in marine sediments using individual and sub-individual endpoints. Environmental Pollution, 2018, 232: 274-283. DOI:10.1016/j.envpol.2017.09.046 |
| [22] |
Chen ZF, Ying GG. Occurrence, fate and ecological risk of five typical azole fungicides as therapeutic and personal care products in the environment: A review. Environment International, 2015, 84: 142-153. DOI:10.1016/j.envint.2015.07.022 |
| [23] |
ECHA. Evaluation of active substances-Assessment Report-Carbendazim. European Chemicals Agency, 2019.
|
| [24] |
Li A, Chen Z, Wu QY et al. Study on the removal of benzisothiazolinone biocide and its toxicity: The effectiveness of ozonation. Chemical Engineering Journal, 2016, 300: 376-383. DOI:10.1016/j.cej.2016.04.021 |
| [25] |
Dobbins LL, Usenko S, Brain RA et al. Probabilistic ecological hazard assessment of parabens using Daphnia magna and Pimephales promelas. Environmental Toxicology and Chemistry, 2009, 28(12): 2744-2753. DOI:10.1897/08-523.1 |
| [26] |
Tamura I, Kimura K, Kameda Y et al. Ecological risk assessment of urban creek sediments contaminated by untreated domestic wastewater: Potential contribution of antimicrobials and a musk fragrance. Environmental Technology, 2013, 34(12): 1567-1575. DOI:10.1080/09593330.2012.758667 |
| [27] |
Xu XB, Yang GS, Tan Y et al. Ecosystem services trade-offs and determinants in China's Yangtze River Economic Belt from 2000 to 2015. Science of the Total Environment, 2018, 634: 1601-1614. DOI:10.1016/j.scitotenv.2018.04.046 |
| [28] |
Zhou LJ, Li J, Zhang YD et al. Trends in the occurrence and risk assessment of antibiotics in shallow lakes in the lower-middle reaches of the Yangtze River Basin, China. Ecotoxicology and Environmental Safety, 2019, 183: 109511. DOI:10.1016/j.ecoenv.2019.109511 |
| [29] |
王苏民, 窦鸿身. 中国湖泊志. 北京: 科学出版社, 1998.
|
| [30] |
Zhao ZH, Zhang L, Wu JL. Polycyclic aromatic hydrocarbons (PAHs) and organochlorine pesticides (OCPs) in sediments from lakes along the middle-lower reaches of the Yangtze River and the Huaihe River of China. Limnology and Oceanography, 2016, 61(1): 47-60. DOI:10.1002/lno.10197 |
| [31] |
EC. Technical Guidance Document on Risk Assessment in support of Commission Directive 93/67/EEC on risk assessment for new notified substances. Commission Regulation (EC) No. 1488/94 on risk assessment for existing substances, and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market, 2003. http://enfo.agt.bme.hu/drupal/sites/default/files/tgdpart2_2ed.pdf.
|
| [32] |
Hernando MD, Mezcua M, Fernández-Alba AR et al. Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters and sediments. Talanta, 2006, 69(2): 334-342. DOI:10.1016/j.talanta.2005.09.037 |
| [33] |
OSPAR. Background document on clotrimazole. 2013. https://www.ospar.org/documents?v=7317.
|
| [34] |
Gustafson AL, Stedman DB, Ball J et al. Inter-laboratory assessment of a harmonized zebrafish developmental toxicology assay—Progress report on phase I. Reproductive Toxicology, 2012, 33(2): 155-164. DOI:10.1016/j.reprotox.2011.12.004 |
| [35] |
Chen ZF, Ying GG, Jiang YX et al. Photodegradation of the azole fungicide fluconazole in aqueous solution under UV-254: Kinetics, mechanistic investigations and toxicity evaluation. Water Research, 2014, 52: 83-91. DOI:10.1016/j.watres.2013.12.039 |
| [36] |
Assress HA, Nyoni H, Mamba BB et al. Occurrence and risk assessment of azole antifungal drugs in water and wastewater. Ecotoxicology and Environmental Safety, 2020, 187: 109868. DOI:10.1016/j.ecoenv.2019.109868 |
| [37] |
Vestel J, Caldwell DJ, Constantine L et al. Use of acute and chronic ecotoxicity data in environmental risk assessment of pharmaceuticals. Environmental Toxicology and Chemistry, 2016, 35(5): 1201-1212. DOI:10.1002/etc.3260 |
| [38] |
ECHA. Evaluation of active substances-Assessment Report-Thiabendazole. European Chemicals Agency, 2008. https://echa.europa.eu/documents/10162/1588e21b-caa4-d212-9df4-c7ea94c168a0.
|
| [39] |
Alslev B, Korsgaard B, Bjerregaard P. Estrogenicity of butylparaben in rainbow trout Oncorhynchus mykiss exposed via food and water. Aquatic Toxicology, 2005, 72(4): 295-304. DOI:10.1016/j.aquatox.2005.01.005 |
| [40] |
ECHA. Inclusion of active substances-Assessment Report-DEET. European Chemicals Agency, 2010.
|
| [41] |
Matić Bujagić I, Grujić S, Laušević M et al. Emerging contaminants in sediment core from the Iron Gate I Reservoir on the Danube River. Science of the Total Environment, 2019, 662: 77-87. DOI:10.1016/j.scitotenv.2019.01.205 |
| [42] |
Ccanccapa A, Masiá AN, Andreu V et al. Spatio-temporal patterns of pesticide residues in the Turia and Júcar Rivers (Spain). The Science of the Total Environment, 2016, 540: 200-210. DOI:10.1016/j.scitotenv.2015.06.063 |
| [43] |
Merel S, Benzing S, Gleiser C et al. Occurrence and overlooked sources of the biocide carbendazim in wastewater and surface water. Environmental Pollution, 2018, 239: 512-521. DOI:10.1016/j.envpol.2018.04.040 |
| [44] |
Haman C, Dauchy X, Rosin C et al. Occurrence, fate and behavior of parabens in aquatic environments: A review. Water Research, 2015, 68: 1-11. DOI:10.1016/j.watres.2014.09.030 |
 2023, Vol. 35
2023, Vol. 35 

