(2: 暨南大学生态学系, 广州 510632)
(2: Department of Ecology, Jinan University, Guangzhou 510632, P. R. China)
轮虫是后生淡水浮游动物中多样性最高的类群,广泛分布于湖泊、水库、河流以及池塘等水体中[1-2]。轮虫在食物网及生态系统中具有重要的功能,它以浮游植物和细菌为主要食物,又作为桡足类和水体中其它小型无脊椎动物和鱼类的食物,能够快速地将物质和能量从初级生产者传递到次级消费者[3-4]。该类群具有体型小、繁殖周期短、种类多的特点,对水体环境变化十分敏感,其物种多样性及组成与水体环境密切相关,轮虫的物种与群落组成是水体环境与生态监测的重要内容[5-8]。轮虫群落的物种多样性与历史因素有关,它具有明显的地理分布模式,如臂尾轮科在印度次大陆和非洲上分布多为世界性种,而在澳大利亚和南美洲分布多为特有种,这样的分布模式与大陆漂移和第四纪冰川气候变化有关[1]。影响轮虫多样性与演替的因素主要分为生物因素与非生物因素。非生物因素主要为温度、营养盐、pH值等,生物因素则包括物种库、种群初始密度、竞争和捕食等[3, 9-13]。
洱海是一座典型的构造断焰湖泊,位于我国西南亚热带高原地区,是大理州最重要的淡水生态系统,具有重要的生态服务功能。随着湖区经济的快速发展、人口数量的大幅度增加以及湖区与周边的旅游开发,洱海的水质不断下降,近年来甚至发生蓝藻水华[14-15]。为改善洱海的水质,大理州政府近年来实施环湖截污、生态农业等多项措施,并从2017年起洱海实施全年封湖禁渔与生态调控。实施的部分措施已开始发挥生态作用,洱海生态系统,特别是浮游动物群落结构发生了很大的变化[16]。研究表明,温度和捕食是影响热带-亚热带浮游动物群落长期动态与季节变化的最直接因素[17]。随着季节变化,鱼类群落的数量构成发生显著的季节变化,特别是在鱼类的生长季节,捕食压力增加,选择性捕食浮游动物的鱼类影响大型浮游动物的数量,从而影响轮虫的主要竞争者,直接与间接地驱动浮游动物群落的动态变化,影响轮虫群落结构的季节演替[18-20]。温度直接影响浮游动物的生长、繁殖、呼吸以及成体的大小[21-24];温度还通过间接影响浮游动物的食物质量和选择性捕食者来影响浮游动物[21]。大理地区不存在严格意义的冬季,洱海全年水温变化相对较小,但仍具有较为明显的季节性。在春季,由于水温较低,鱼类对大型枝角类的捕食压力较低,浮游动物中的盔形溞占优势;春末夏初,随着鱼类进入生长季节,特别是幼鱼的大量生长,盔形溞等大型枝角类的丰度快速下降,降低了枝角类对轮虫的食物竞争压力,但鱼类捕食者增加[25-26]。洱海北部湖区是水质退化较为严重的水域,时有藻类水华发生,西太公鱼等小型鱼类在北部湖区的数量也显著高于其他区域。因此,对该湖区轮虫的种类多样性与群落结构进行监测,总结轮虫群落的季节演替特征有助于合理的生态监测,可以了解该湖区对当前实施的水质改善措施的响应,并为开展生态评估提供基础信息。本文较系统地调查了洱海北部湖区轮虫群落的物种及群落组成,分析了轮虫的物种多样性与群落结构,基于多元统计分析了该湖区轮虫群落的季节演替规律及其对环境的响应特征。
1 材料与方法 1.1 研究区概况和采样洱海位于云南省大理白族自治州境内,是云南省第二大淡水湖泊。它是一个典型的构造断陷湖泊,该湖泊流域面积为2565 km2,当洱海水位为最高运行水位(1966 m)时,湖泊面积为252.1 km2,容积为29.59亿m3,平均水深为10.8 m。洱海的主要入湖河流有北部的弥苴河、罗时江和永安江,西部的苍山十八溪,南部的波罗江和白塔河。当前洱海的优势浮游植物种类主要为蓝藻和硅藻,而鱼类则以西太公鱼、太湖新银鱼、为主,西太公鱼、麦穗鱼等小型鱼类在北部湖区的数量显著高于其他区域[27-28]。
于2020年3、6、9和12月对洱海北部湖区的5个样点(喜洲、桃源、双廊、湖心0和湖心1,图 1)进行采样。使用25#浮游生物网在水面下0.5 m处进行水平缓慢拖网采集浮游动物定性样品,从表层下0.5 m、中上层、中下层以及底层上0.5 m处各采集2.5 L水样,经38 μm浮游生物网进行过滤,获得浮游动物定量样品。使用福尔马林溶液固定浮游动物的定性和定量样品并至终浓度为5%。按照Koste分类系统进行鉴定,并在显微镜下进行计数[29]。计数的同时测量轮虫的体长和体宽,采用近似几何体积计算轮虫体积,用近似密度1 g/cm3计算生物量[30-31]。将优势度大于0.02的物种定为轮虫优势种。现场使用水质仪记录水温(temp)、pH、溶解氧(DO)等环境参数,用塞氏黑白盘测定透明度(SD),按照国家水质检测标准方法(GB 3838—2002)测定总磷(TP)、总氮(TN)、氨氮(NH3-N)、叶绿素a(Chl.a)、化学需氧量(COD)和高锰酸盐指数(CODMn)。
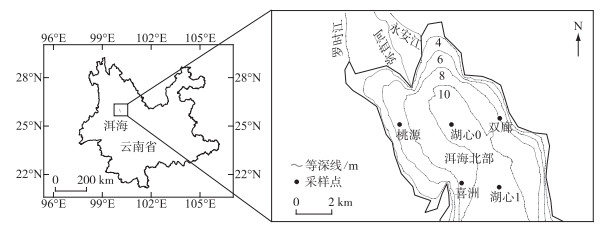
|
图 1 洱海北部湖区5个采样点的分布 Fig.1 Localities of five sampling sites in the northern zone of Lake Erhai |
本研究使用Excel进行常规绘图。轮虫群落的统计分析使用R语言平台中的stats、MASS、vegan和packfor函数包。Shapiro-Wilk检验表明各处理组总氮浓度、叶绿素a浓度、轮虫物种丰度、生物量数据呈正态分布且方差齐性,对其进行单因素方差分析,以季节作为因子变量,P < 0.05表示具有显著差异。对不符合正态分布的变量(总磷浓度(P=0.01)、透明度(P=0.00)、温度(P=0.00)、真Simpson指数(P=0.02))进行Kruskal-Wallis检验。进行轮虫群落数据分析时,对轮虫丰度数据进行Hellinger转化,基于Bray-Curtis距离进行轮虫丰度的非度量多维尺度分析(NMDS)[32]。基于Bray-Curtis距离,采用ANOSIM分析检验4个季节两两之间轮虫群落的差异显著性。在冗余分析(RDA)中,将水温、pH、COD、DO、CODMn、五日生化需氧量、TP、TN、NH3-N、SD、电导率、Chl.a、轮虫竞争者(枝角类丰度)、轮虫捕食者(剑水蚤丰度和前节晶囊轮虫丰度)、浮游植物丰度作为解释变量,对解释变量进行标准化处理,使用前向选择剔除不显著变量[33]。
真Simpson多样性指数(D′)计算公式为:
| D′=1/∑P2i | (1) |
式中,ni为第i种物种的个数,N为群落中物种的总丰度,Pi为群落中第i种的相对丰度,即Pi=ni/N[34]。
优势度(Yi)计算公式为:
| Yi=Pi⋅fi | (2) |
式中,fi表示轮虫i在所有采样点出现频率。将Y>0.02的物种粗略地划为优势种[35]。生物量优势度使用相对生物量进行优势度的计算。
2 结果 2.1 理化指标单因素方差分析表明,TP(F=7.03,P=0.003)、TN(F=4.86,P=0.014)、Chl.a(F=4.62,P=0.016)、SD(F=61.08,P < 0.001)、温度(F=520.15, P < 0.001)存在显著的季节差异。洱海北部湖区TP浓度最高值出现在秋季,为0.03 mg/L;最低值出现在冬季,为0.016 mg/L(图 2a)。洱海北部TN浓度最高值出现在夏季,为0.67 mg/L;最低值出现在春季,为0.48 mg/L(图 2b)。洱海北部的Chl.a浓度最高值出现在冬季,为11.6 μg/L,最低值出现在秋季,为7 μg/L(图 2c)。春季的SD最高,为3 m,从夏季、秋季到冬季依次逐渐减小。洱海北部湖区水温最高值出现在秋季,为25.8℃,最低值出现在春季,为13.7℃(图 2d)。
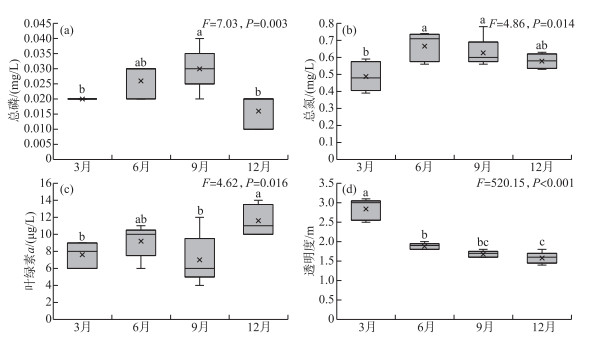
|
图 2 洱海北部湖区总磷(a)、总氮(b)、叶绿素a(c)和透明度(d)的季节变化(图中不同小写字母表示不同季节之间具有显著性差异(P < 0.05)) Fig.2 Seasonal variation of TP (a), TN (b), Chl.a (c)and SD (d)in the northern zone of Lake Erhai (Different lowercase letters represent significant difference between seasons (P < 0.05)) |
4个季节的调查共检出轮虫26属48种,其中无柄轮属(Ascomorpha)、晶囊轮属(Asplanchna)、胶鞘轮属(Collotheca)、须足轮属(Euchlanis)、龟甲轮属(Keratella)、多肢轮属(Polyarthra)在4个季节均出现。异尾轮属(Trichocerca)的种类数最多,共计9种。洱海北部湖区轮虫群落秋季的物种丰富度最高(17种),春季的物种数最低(11种),不同季节的轮虫物种丰富度存在显著性差异(F=4.56,P=0.017)(图 3a)。洱海北部湖区轮虫群落的真Simpson多样性指数最高值出现在冬季,为2.17,显著高于其它3个季节(F=41.38,P < 0.001)(图 3b)。
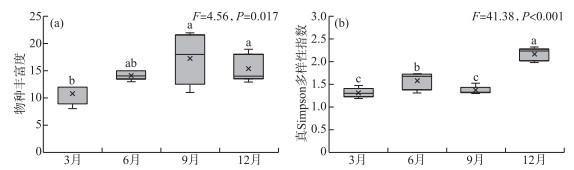
|
图 3 洱海北部湖区轮虫群落物种丰富度(a)和真Simpson多样性指数(b)(图中不同小写字母表示不同季节之间具有显著性差异(P < 0.05)) Fig.3 Species richness (a) and true Simpson diversity (b) of rotifer communities in the northern zone of Lake Erhai (Different lowercase letters represent significant difference between seasons (P < 0.05)) |
洱海北部湖区4个季节的轮虫总丰度平均值为606 ind./L,不同季节的轮虫丰度有显著性差异(F=6.31,P=0.005),轮虫总丰度最高值出现在秋季,最低值出现在冬季(图 4a)。从轮虫属的相对丰度来看,在同一季节,5个采样点轮虫属的相对丰度差异不大。在春季,疣毛轮虫占主要优势,到夏季,演变为多肢轮虫占主要优势;在秋季和冬季,则是龟甲轮虫占据主要优势,说明洱海北部的轮虫群落存在明显的季节演替(图 4b)。洱海北部湖区4个季节的轮虫生物量平均值为539.5 μg/L,不同季节的轮虫丰度有显著性差异(F=12.04,P < 0.001),轮虫生物量最高值出现在春季,最低值出现在冬季(图 4c)。从轮虫属的相对生物量来看,在春季,晶囊轮虫占优势,在夏季,晶囊轮虫、多肢轮虫和皱甲轮虫均占优势;在秋季,除采样点湖心1由巨冠轮虫占据主要优势外,其它点均为晶囊轮虫占优势;到冬季,除采样点桃源为巨冠轮虫占优势外,其它点均为晶囊轮虫占优势(图 4d)。
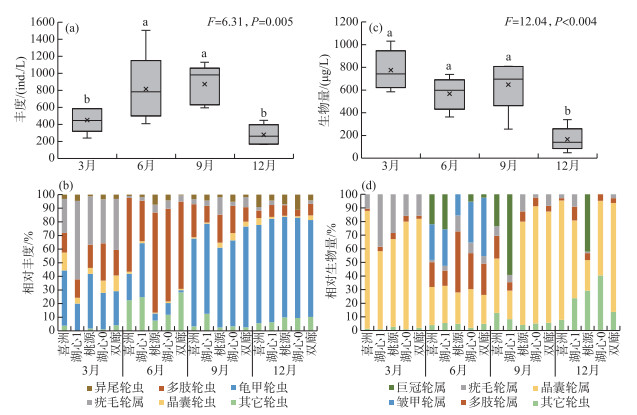
|
图 4 洱海北部湖区轮虫总丰度(a)、生物量(c)及主要轮虫属的相对丰度(b)和相对生物量(d)的季节变化(图中不同小写字母表示不同季节之间具有显著性差异(P < 0.05)) Fig.4 The seasonal variation of the total abundance (a) and the total biomass (c) of rotifers and the relative abundance (b) and the relative biomass (d) of major genera of rotifers in the northern zone of Lake Erhai (Different lowercase letters represent significant difference between seasons (P < 0.05)) |
从丰度优势种来看,在春季,螺形龟甲轮虫为第1优势种;到夏季,演变为长肢多肢轮虫为主要优势种;在秋季,无棘龟甲轮虫为第1优势种;在冬季,螺形龟甲轮虫又成为第1优势种(图 5a)。从生物量优势种来看,在春季,前节晶囊轮虫为第1优势种;在夏季,前节晶囊轮虫和长肢多肢轮虫为主要优势种;到秋季和冬季,前节晶囊轮虫又成为第1优势种(图 5b)。
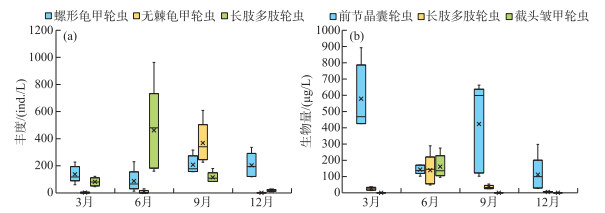
|
图 5 洱海北部湖区轮虫主要优势种种群丰度(a)和生物量(b)的季节动态 Fig.5 Seasonal dynamics of dominant species abundance (a) and biomass (b) of rotifers in the northern zone of Lake Erhai |
非度量多维尺度分析中的杠杆值(Stress)较小(0.132),表明洱海北部湖区轮虫群落结构存在显著的季节差异。冬季和夏季的采样点分别位于排序轴1的左侧和右侧,秋季和冬季的采样点分别位于排序轴2的上侧和下侧,反映了轮虫群落的结构变化具有较强的季节性(图 6a)。ANOSIM检验表明,4个季节两两之间的轮虫群落距离均存在显著性差异(P < 0.05)。
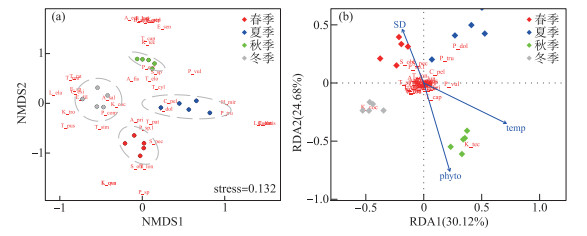
|
图 6 洱海北部湖区轮虫群落非度量多维尺度分析(NMDS)(a)和冗余度分析(RDA)(b)(图中为轮虫拉丁名缩写,如“K_coc”代表“Keratella cochlearis”,具体见附表Ⅰ) Fig.6 Nonmetric multidimensional scale analysis (NMDS) (a) and redundancy analysis (RDA) (b) of rotifer communities in the northern zone of Lake Erhai (Here, the Latin abbreviation of rotifer, for example, "K_coc" stands for "Keratella cochlearis", see Attached Tab.Ⅰ for details) |
在轮虫群落冗余度分析中,前两轴的累积解释量为54.8%(附表Ⅱ)。通过前向选择从15个影响因子中,筛选出透明度、温度和浮游植物丰度(phyto)为影响轮虫群落的显著因子,表明洱海北部轮虫群落结构变异受到水体透明度、温度和浮游植物丰度的影响(Radj2=21.9%)(图 6b, 附表Ⅲ)。春季、夏季、秋季和冬季的采样点分别分布于排序轴1和轴2组成的坐标系中的第2、1、4、3象限,进一步说明轮虫群落结构存在季节差异。
3 讨论洱海是一座大型的亚热带高原湖泊,地处我国西南高地,全年温差相对较小。由于周边人类活动增强与气候变暖,该湖泊水质严重退化并出现富营养化[36]。洱海北部湖区的TP和TN浓度在季节上变化趋势基本一致,均具有较强季节性(图 2)。该湖区的Chl.a浓度在4个季节变化波动性大,其变化趋势与SD相反,体现了富营养化水体的特点。
本次季节调查发现,洱海轮虫物种多样性最高的3个属为异尾轮属、腔轮属和龟甲轮属。其中异尾轮虫和腔轮虫被认为是热带和亚热带地区轮虫的主要属[37],而龟甲轮属、巨头轮属、疣毛轮属在热带与亚热带地区均有分布,但大部分种类分布在温带地区[38]。说明洱海的轮虫群落符合热带和亚热带地区轮虫群落的组成特点。洱海北部湖区主要的优势种为龟甲轮虫、多肢轮虫、晶囊轮虫和疣毛轮虫。螺形龟甲轮虫在4个季节均为优势种,该种作为全球性的广布种,对温度、盐度等具有较强的耐受性,并且螺形龟甲轮虫的后棘刺有助于它躲避捕食[39-40]。长肢多肢轮虫也是全球性的广布种[41],对溶解氧浓度、电导率和营养条件具有很强的耐受性[42],通过加快游泳速度来躲避捕食,能够在高捕食压力下占优势[43]。前节晶囊轮虫是全球性的轮虫,是最大的浮游捕食者之一(200~500 μm)[44]。作为杂食性轮虫,既能以其它轮虫(如螺形龟甲轮虫)或小型枝角类(如象鼻溞)为食,又能以浮游植物(如蓝藻、硅藻)为食,并且当水体中食物组成发生变化时,它能通过改变食性而在食物竞争中取得优势[45-51]。
相较于吴秋婷等和高登成等对轮虫群落的调查结果,洱海北部湖区的轮虫丰度和生物量有上升的趋势。近3年来,洱海中占据优势的银鱼已逐渐被西太公鱼所取代,西太公鱼作为一种食物范围较广的入侵种,优先捕食枝角类,其次为轮虫和桡足类[16, 52-53]。在北部湖区,目前西太公鱼、麦穗鱼等小型鱼类已占绝对优势,在数量上也远高于其它湖区。从丰度优势种来看,螺形龟甲轮虫在4个季节均为优势种,无棘龟甲轮虫仅在秋季为优势种,而在2019年的调查中,螺形龟甲轮虫和无棘龟甲轮虫在4个季节均为优势种,湖中带后棘刺的螺形龟甲轮虫的比例增加和无后棘刺的无棘龟甲轮虫的比例减少,也反映轮虫受到的捕食压力呈增大的趋势[16, 39]。从生物量优势种来看,前节晶囊轮虫在生物量上占优势,且除夏季外,其它季节前节晶囊轮虫的生物量占总生物量比例的50%以上,与吴秋婷等[26]报道的结果相比基本没有变化。在春季,水体中温度相对较低,盔形溞等大型枝角类在水体中占据优势,与轮虫竞争食物,湖中轮虫丰度较低,由于水体中前节晶囊轮虫丰度较高,轮虫的生物量在春季最高。到了夏季,水温升高后,鱼类的密度增大,鱼类会优先捕食水体中大型浮游动物,如盔形溞和前节晶囊轮虫等,导致浮游植物浓度大幅度增加,轮虫受到的捕食压力和竞争压力均减小,轮虫的丰度上升,但由于前节晶囊轮虫这类大型种类的丰度减少,轮虫的总生物量相较于春季是减少的。洱海北部湖区的轮虫优势种由前节晶囊轮虫占优势演变为由前节晶囊轮虫、长肢多肢轮虫和截头皱甲轮虫占优势,这与吴秋婷等[26]的结果有所不同。这可能是由于北部湖区中的西太公鱼、麦穗鱼、黄魚幼、鰕虎鱼等小型肉食性鱼类密度较高,它们能利用轮虫,而多肢轮虫的游泳速度快,能够躲避捕食而在湖中占优势[43]。在秋季,由于实施生态调控,鱼类密度下降,水体中枝角类丰度有所增加,形成对轮虫的竞争压力。到了冬季,水温有所下降,浮游植物细胞丰度趋于下降,并且鱼类捕食压力也大幅度下降,水体中的大型浮游动物丰度增加,受竞争压力和食物限制,轮虫的丰度呈下降趋势,此时水体中能躲避捕食且能适应温度变化的螺形龟甲轮虫占据优势。从优势种的季节演替和NMDS分析均表明轮虫群落存在明显的季节演替。
RDA分析筛选出透明度、温度和浮游植物细胞丰度为解释洱海北部湖区轮虫群落变化的主要变量或因素。当水体透明度高时,浮游植物以非蓝藻为主,具有较好的可食性,水体中的个体较大的枝角类在与轮虫的竞争中能取得优势;而当水体中浮游植物和悬浮无机颗粒物增加时,水体中的透明度下降,由于无机悬浮颗粒物直径大小在0.5~2 μm之间,与枝角类的摄食粒径大小重叠,且大多数枝角类进食方式是滤食,对食物没有选择性,导致枝角类在摄食时所取食的营养价值较低。另一方面,轮虫主要的食物颗粒范围为4~18 μm,避免对悬浮无机颗粒物的取食,由于悬浮颗粒物对枝角类和轮虫的摄食影响程度不同,从而影响轮虫群落和枝角类之间的竞争[54-55]。温度直接影响个体的生长和发育,被认为是引起轮虫发生季节性演替的关键因素[11]。温度能够直接影响轮虫的生长繁殖来影响轮虫群落,一般来说,在生长适宜温度范围内,轮虫的丰度随着水温的升高而增加,轮虫卵的发育时间也缩短,轮虫丰度能在短时间内到达高峰[5]。洱海北部湖区的夏季和秋季轮虫丰度高于春季和冬季,且与温度的变化一致,说明温度是影响该水体轮虫群落的重要因子。大部分轮虫以浮游植物为食,轮虫的总丰度一般随浮游植物的丰度升高而升高[56-57],洱海北部从春季、夏季再到秋季浮游植物细胞丰度呈增加趋势,轮虫丰度在这3个季节同样呈现上升的趋势,冬季水温下降,浮游植物细胞丰度趋于下降,轮虫因同时受到水温和竞争压力影响总丰度也下降。本文主要基于轮虫物种组成和α多样性分析了洱海北部湖区的季节特征,今后可以将南、北湖区进行比较,特别是可以从β多样性的角度进一步揭示北部湖区的群落特征[58]。
4 结论洱海北部湖区的轮虫具有典型的热带及亚热带地区亚深水湖泊物种分布特征,以异尾轮属、腔轮属和龟甲轮属的种类为主,其群落的丰度和物种组成存在明显的季节演替,这种季节性变化反映了水温和水质季节变化的直接与间接效应。在水温变化的间接效应上,鱼类和枝角类群落结构的季节动态引起轮虫群落的捕食压力和竞争压力的季节变化。透明度、温度和浮游植物细胞丰度是解释洱海北部湖区轮虫群落结构变化的重要因子。轮虫群落的物种组成和明显的季节性反映了轮虫群落对水质和水温变化的敏感性。
5 附录附表Ⅰ~Ⅲ见电子版(DOI: 10.18307/2023.0130)。
| 附表Ⅰ 洱海北部湖区轮虫物种季节组成 Appendix Ⅰ Seasonal composition of rotifers in the northern area of Lake Erhai |
| 附表Ⅱ 洱海北湖区的轮虫群落结构与环境因子的冗余度分析结果 Appendix Ⅱ The results for the first four axis of the RDA of species-environment |
| 附表Ⅲ 冗余分析前2轴与环境因子之间的相关系数 Appendix Ⅲ Correlation coefficients between environmental factors and the first two ordination axes of RDA |
| [1] |
Dumont HJ. Biogeography of rotifers. Hydrobiologia, 1983, 104(1): 19-30. DOI:10.1007/BF00045948 |
| [2] |
Segers H. Global diversity of rotifers (Rotifera) in freshwater. Hydrobiologia, 2008, 595(1): 49-59. DOI:10.1007/s10750-007-9003-7 |
| [3] |
Dumont HJ. Biotic factors in the population dynamics of Rotifers. Archiv für Hydrobiologie, 1977, 8: 98-122. |
| [4] |
Rublee PA. Rotifers in Arctic North America with particular reference to their role in microplankton community structure and response to ecosystem perturbations in Alaskan Arctic LTER lakes. Hydrobiologia, 1998, 387: 153-160. DOI:10.1023/A:1017010313812 |
| [5] |
Huang XF, Hu CY, Wu ZT. Rotifers in Lake Donghu, Wuhan. Acta Hydrobiologica Sinica, 1985, 9(2): 129-143. [黄祥飞, 胡春英, 伍焯田. 武汉东湖的轮虫. 水生生物学报, 1985, 9(2): 129-143.] |
| [6] |
Ramakrishna RT, Sarma SSS. Demographic parameters of Brachionus patulus Muller (Rotifera) exposed to sublethal DDT concentrations at low and high food levels. Hydrobiologia, 1986, 139(3): 193-200. DOI:10.1007/BF00028292 |
| [7] |
Wallace RL, Snell TW, Ricci C et al. Rotifera vol. 1: biology, ecology and systematics: 2nd edition. In: Segers H, Dumont HJ eds. Guides to the identification of the microinvertebrates of the continental waters of the world. Leiden: Backhuys Publishers, 2006.
|
| [8] |
Duggan IC, Green JD, Shiel RJ. Distribution of rotifers in North Island, New Zealand, and their potential use as bioindicators of lake trophic state. Hydrobiologia, 2001, 446/447: 155-164. DOI:10.1023/A:1017503407240 |
| [9] |
Williamson CE. Invertebrate predation on planktonic rotifers. Hydrobiologia, 1983, 104(1): 385-396. DOI:10.1007/BF00045996 |
| [10] |
Gilbert JJ. Competition between rotifers and Daphnia. Ecology, 1985, 66(6): 1943-1950. DOI:10.2307/2937390 |
| [11] |
Bērzinš B, Pejler B. Rotifer occurrence in relation to temperature. Hydrobiologia, 1989, 175(3): 223-231. DOI:10.1007/BF00006092 |
| [12] |
Bērziņš B, Pejler B. Rotifer occurrence and trophic degree. Hydrobiologia, 1989, 182(2): 171-180. DOI:10.1007/BF00006043 |
| [13] |
Sarma SSS, Iyer N, Dumont HJ. Competitive interactions between herbivorous rotifers: Importance of food concentration and initial population density. Hydrobiologia, 1996, 331(1/2/3): 1-7. DOI:10.1007/BF00025402 |
| [14] |
Wang JY, Chen GJ, Huang LP et al. Spatio-temporal patterns and drivers of cyanobacteria blooms in Erhai Lake, Southwest China. Acta Ecologica Sinica, 2017, 37(14): 4831-4842. [王教元, 陈光杰, 黄林培等. 洱海蓝藻爆发的时空特征及影响因子. 生态学报, 2017, 37(14): 4831-4842. DOI:10.5846/stxb201604200740] |
| [15] |
Lin SS, Shen SL, Zhou AN et al. Assessment and management of lake eutrophication: A case study in Lake Erhai, China. Science of the Total Environment, 2021, 751: 141618. DOI:10.1016/j.scitotenv.2020.141618 |
| [16] |
Gao DC, Lv XJ, Yang SK et al. Study on the seasonal variation and current status of zooplankton in Erhai Lake. Environmental Science Survey, 2021, 40(2): 1-6. [高登成, 吕兴菊, 杨四坤等. 洱海浮游动物季节变化及现状研究. 环境科学导刊, 2021, 40(2): 1-6.] |
| [17] |
Iglesias C, Mazzeo N, Meerhoff M et al. High predation is of key importance for dominance of small-bodied zooplankton in warm shallow lakes: Evidence from lakes, fish exclosures and surface sediments. Hydrobiologia, 2011, 667(1): 133-147. DOI:10.1007/s10750-011-0645-0 |
| [18] |
Stenson JAE. Fish impact on rotifer community structure. Hydrobiologia, 1982, 87(1): 57-64. DOI:10.1007/BF00016662 |
| [19] |
Lazzaro X. Do the trophic cascade hypothesis and classical biomanipulation approaches apply to tropical lakes and reservoirs?. Internationale Vereinigung für theoretische und angewandte Limnologie: Verhandlungen, 1997, 26(2): 719-730. DOI:10.1080/03680770.1995.11900811 |
| [20] |
Kruk C, Rodríguez-Gallego L, Meerhoff M et al. Determinants of biodiversity in subtropical shallow lakes (Atlantic coast, Uruguay). Freshwater Biology, 2009, 54(12): 2628-2641. DOI:10.1111/j.1365-2427.2009.02274.x |
| [21] |
Moore MV, Folt CF, Stemberger RS. Consequences of elevated temperatures for zooplankton assemblages in temperate lakes. Archiv für Hydrobiologie, 1996, 135(3): 289-319. DOI:10.1127/archiv-hydrobiol/135/1996/289 |
| [22] |
Weetman D, Atkinson D. Evaluation of alternative hypotheses to explain temperature-induced life history shifts in Daphnia. Journal of Plankton Research, 2004, 26(2): 107-116. DOI:10.1093/plankt/fbh013 |
| [23] |
Hardy ER, Duncan A. Food concentration and temperature effects on life cycle characteristics of tropical Cladocera (Daphnia gessneri Herbst, Diaphanosoma sarsi Richard, Moina reticulata (daday)): I. development time. Acta Amazonica, 1994, 24(1/2): 119-134. DOI:10.1590/1809-43921994242134 |
| [24] |
Yin LP, Ji Y, Zhang YJ et al. Rotifer community structure and its response to environmental factors in the Backshore Wetland of Expo Garden, Shanghai. Aquaculture and Fisheries, 2018, 3(2): 90-97. DOI:10.1016/j.aaf.2017.11.001 |
| [25] |
Lin QQ, Zhao PP, Wu QT et al. Predation pressure induced by seasonal fishing moratorium changes the dynamics of subtropical Cladocera populations. Hydrobiologia, 2013, 710(1): 73-81. DOI:10.1007/s10750-012-1260-4 |
| [26] |
Wu QT, Wei ZH, Zhu J et al. Seasonal dynamics of rotifer in a seasonal fishing moratorium lake—Lake Erhai, Yunnan Province, China. J Lake Sci, 2012, 24(4): 86-92. [吴秋婷, 卫志宏, 朱江等. 一座季节性休渔湖泊——洱海轮虫的季节动态特征. 湖泊科学, 2012, 24(4): 86-92. DOI:10.18307/2012.0412] |
| [27] |
张涛. 云南高原湖泊浮游植物空间分布特征及脆杆藻对砷胁迫的响应模式[学位论文]. 云南: 云南师范大学, 2018.
|
| [28] |
Zhou XG, Qiao YM, Wang S et al. Characteristics of fish assemblages associated with environmental factors in the Lake Erhai. Chinese Journal of Ecology, 2016, 35(6): 1569-1577. [周兴安, 乔永民, 王赛等. 洱海鱼类群落结构特征及其与环境因子关系. 生态学杂志, 2016, 35(6): 1569-1577. DOI:10.13292/j.1000-4890.201606.016] |
| [29] |
Koste W ed. Rotatoria: Die R derriere Mitteleuropas. Berlin: Gebrder Bomtraeger, 1978.
|
| [30] |
Dumont HJ, van de Velde I, Dumont S. The dry weightestimate of biomass in a selection of Cladocera, Copepoda and Rotifera from the plankton, periphyton and benthos of continental waters. Oecologia, 1975, 19(1): 75-97. DOI:10.1007/BF00377592 |
| [31] |
章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.
|
| [32] |
Legendre P, Legendre L. Numerical ecology. Amsterdam: Elsevier, 2012.
|
| [33] |
Borcard D, Gillet F, Legendre P. Numerical ecology with R. New York: Springer, 2011.
|
| [34] |
Jost L. Entropy and diversity. Oikos, 2006, 113(2): 363-375. DOI:10.1111/j.2006.0030-1299.14714.x |
| [35] |
Xu ZL, Chen YQ. Aggregated intensity of dominant species of zooplankton in autumn in the East China Sea and Yellow Sea. Chinese Journal of Ecology, 1989, 8(4): 13-15, 19. [徐兆礼, 陈亚瞿. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系. 生态学杂志, 1989, 8(4): 13-15, 19. DOI:10.13292/j.1000-4890.1989.0055] |
| [36] |
Yan CL, Zhao M, Li ZK et al. Water characteristics of inflow rivers in northern Erhai Lake and their impact on the northern lake area. Environmental Engineering, 2020, 38(12): 59-63, 5. [严春丽, 赵明, 李泽坤等. 洱海北部入湖河流水质特征及其对北部湖区的影响. 环境工程, 2020, 38(12): 59-63, 5. DOI:10.13205/j.hjgc.202012011] |
| [37] |
Fernando CH. The freshwater zooplankton of Sri Lanka, with a discussion of tropical freshwater zooplankton composition. Internationale Revue Der Gesamten Hydrobiologie Und Hydrographie, 1980, 65(1): 85-125. DOI:10.1002/iroh.19800650105 |
| [38] |
Green J. The temperate-tropical gradient of planktonic Protozoa and Rotifera. Hydrobiologia, 1994, 272(1/2/3): 13-26. DOI:10.1007/BF00006509 |
| [39] |
Stemberger RS, Gilbert JJ. Spine development in the rotifer Keratella cochlearis: Induction by cyclopoid copepods and Asplanchna. Freshwater Biology, 1984, 14(6): 639-647. DOI:10.1111/j.1365-2427.1984.tb00183.x |
| [40] |
Segers H, Smet WH. Diversity and endemism in Rotifera: A review, and Keratella bory de st vincent. Biodiversity and Conservation, 2008, 17(2): 303-316. DOI:10.1007/s10531-007-9262-7 |
| [41] |
Ridder M, Segers H eds. Monogonont Rotifera recorded in the world literature (except Africa) from 1960 to 1992. Brussels: Studiedocumenten van het KBIN, 1997.
|
| [42] |
Bērziŋš B, Pejler B. Rotifer occurrence in relation to oxygen content. Hydrobiologia, 1989, 183(2): 165-172. DOI:10.1007/BF00018721 |
| [43] |
Gilbert JJ. Escape response of the rotifer Polyarthra: A high-speed cinematographic analysis. Oecologia, 1985, 66(3): 322-331. DOI:10.1007/BF00378293 |
| [44] |
Pociecha A, Wilk-Woz'niak E. Comments on the diet of Asplanchna priodonta (Gosse, 1850) in the Dobczycki Dam Reservoir on the basis of field sample observations. Oceanological and Hydrobiological Studies, 2008, 37(3): 63-69. DOI:10.2478/v10009-008-0004-2 |
| [45] |
Ejsmont-Karabin J. Studies on the feeding of planktonic polyphage Asplanchna priodonta Gosse (Rotatoria). Ekologia polska, 1974, 22(31): 1-317. |
| [46] |
Oganjan K, Virro T, Lauringson V. Food spectrum of the omnivorous rotifer Asplanchna priodonta in two large northeastern European lakes of different trophy. Oceanological and Hydrobiological Studies, 2013, 42(3): 314-323. DOI:10.2478/s13545-013-0088-5 |
| [47] |
Salt GW. Comparisons of the diets and reproductive performances of two sympatric rotifers, Asplanchna girodi and Asplanchna priodonta. Freshwater Biology, 1989, 22(3): 417-430. DOI:10.1111/j.1365-2427.1989.tb01115.x |
| [48] |
Hofmann W. Interactions between Asplanchna and Keratella cochlearis in the Plußsee (North Germany). Hydrobiologia, 1983, 104(1): 363-365. DOI:10.1007/BF00045992 |
| [49] |
Hofmann W. Population dynamics of hypolimnetic rotifers in the Pluss-see (North Germany). Hydrobiologia, 1987, 147(1): 197-201. DOI:10.1007/BF00025742 |
| [50] |
Iyer N, Rao T. Responses of the predatory rotifer Asplanchna intermedia to prey species differing in vulnerability: Laboratory and field studies. Freshwater Biology, 1996, 36(3): 521-533. DOI:10.1046/j.1365-2427.1996.d01-510.x |
| [51] |
Kappes H, Mechenich C, Sinsch U. Long-term dynamics of Asplanchna priodonta in Lake Windsborn with comments on the diet. Hydrobiologia, 2000, 432: 91-100. DOI:10.1023/A:1004022020346 |
| [52] |
周小玉, 杨丽丽, 刘其根等. 新疆乌伦古湖西太公鱼的食物组成及其季节变化. 西安: 中国水产学会学术年会, 2010.
|
| [53] |
Yin CJ, Gong L, Chen YS et al. Modeling ecosystem impacts of the invasive Japanese smelt Hypomesus nipponensis in Lake Erhai, southwestern China. Ecological Informatics, 2022, 67: 101488. DOI:10.1016/j.ecoinf.2021.101488 |
| [54] |
Kirk KL, Gilbert JJ. Suspended clay and the population dynamics of planktonic rotifers andcladocerans. Ecology, 1990, 71(5): 1741-1755. DOI:10.2307/1937582 |
| [55] |
Kirk KL. Inorganic particles alter competition in grazing plankton: The role of selective feeding. Ecology, 1991, 72(3): 915-923. DOI:10.2307/1940593 |
| [56] |
Jeppesen E, Peder Jensen J, Søndergaard M et al. Trophic structure, species richness and biodiversity in Danish lakes: Changes along a phosphorus gradient. Freshwater Biology, 2000, 45(2): 201-218. DOI:10.1046/j.1365-2427.2000.00675.x |
| [57] |
Qian FP, Xi YL, Wen XL et al. Eutrophication impact on community structure and species diversity of rotifers in five lakes of Anhui. Biodiversity Science, 2007, 15(4): 344-355. [钱方平, 席贻龙, 温新利等. 湖泊富营养化对轮虫群落结构及物种多样性的影响. 生物多样性, 2007, 15(4): 344-355. DOI:10.3321/j.issn:1005-0094.2007.04.003] |
| [58] |
Han BP, Li QH, Xu YP et al. Origin and development of gradient analysis for biological communities and the generalized dissimilarity modelling with its application. Journal of Guizhou Normal University: Natural Sciences, 2022, 40(2): 1-10, 132. [韩博平, 李秋华, 徐玉萍等. 生物群落梯度分析方法的由来、发展及广义非相似性模拟方法与应用. 贵州师范大学学报: 自然科学版, 2022, 40(2): 1-10, 132. DOI:10.16614/j.gznuj.zrb.2022.02.001] |
 2023, Vol. 35
2023, Vol. 35 


