(2: 华中农业大学园艺林学学院, 武汉 430070)
(2: College of Horticulture and Forestry Science of Huazhong Agricultural University, Wuhan 430070, P. R. China)
消落区又称为水位涨落带、涨落区、消涨带、消落带等,由于人为控制或自然降雨在时间尺度上的不均匀性,导致江河湖泊水位会发生季节性波动,介于最高水位线与最低水位线之间的土地区域,具有交替淹没和出露特点[1-2]。为了满足防洪、发电、供水和航运等需要,国内已在众多河流上修建了70000多座大坝。大坝对生物多样性和生境异质性的累积影响逐渐凸显,水库消落区的生态环境问题引起了广泛关注[3-4]。与其它水库相比,三峡水库水位涨落幅度大(达30 m),逆自然枯洪变化(冬涨夏落),面积大(300 km2),消落区受淹没时间长(低高程区平均淹没9个多月)。三峡工程于2003年6月蓄水至135 m,2006年10月蓄水至156 m,2008年9月开始实施正常蓄水位175 m试验性蓄水[5],2020年11月完成三峡工程整体竣工验收全部程序。随着三峡水库消落区的逐步形成,国家有关部门及地方政府高度重视消落区的生态环境问题,在水库库容和消落区土地资源管理、生态保护与修复技术等方面开展了一系列工作,主要涉及消落区现状调查、耐水淹植物筛选、生态保护等方面,应用比较广泛的治理模式主要有基塘工程、林泽工程和污染削减等[6-7]。很多研究表明,水库周期性蓄水淹没-出露显著改变了消落区植物群落特征,以草本植物为主[5, 8],为消落区物种多样性的提高及生态修复提供了重要支撑,但多数研究为1—3年的数据,持续性监测时间短。随着周期性淹没次数的增加和人为活动的干扰,消落区实际的出露-淹没规律又具有一定的不确定性(受水库调度运行、来水及调水等多种因素的影响),导致消落区植物群落特征具有较大的不稳定性和可塑性[9],群落多样性是否发生了显著变化,优势植物及其重要值的变化趋势如何等问题尚需深入研究。
为了适应冬季极端水淹环境(长时间持续深水淹没)和夏季高温干旱环境,消落区植物表现出了较多的适应策略,可能表现为单一适应机制,也可能表现为综合适应策略。生态策略(ecology strategy)一直是植物生态学领域研究的热点之一,最成熟的植物生态策略研究方法是Grime提出的Competitor(C)-Stress tolerator(S)-Ruderal (R)策略理论[10]。该方法以植物比叶面积(SLA)、叶干物质量(LDMC)和叶面积(LA)3个叶片核心功能性状之间的数量关系,判定该植物的生态适应策略,反映了植物对竞争、胁迫和干扰梯度的适应性。比叶面积可以表征植物在不同生境下的资源获取能力,广泛应用于草地和林地等生态系统研究[11-12]。经过10余年的周期性淹没和出露,消落区优势植物的功能性状是否发生了显著变化,其生态适应策略如何,这些研究还较为缺乏。因此,本研究于2009年6月至2021年6月开展了消落区植物群落的长期定位监测、优势植物叶片功能性状分析和生态适应策略分析,旨在分析消落区3个高程区域植物群落组成特征和多样性变化过程,揭示水库运行特征和气象因子对消落区优势植物影响,为科学认知大型水库消落区的演变趋势和科学管理提供数据支撑。
1 材料与方法 1.1 植物群落特征监测设置大渡口区鱼洞长江大桥段(S1)、渝北区珞碛镇段(S2)、涪陵区南沱镇段(S4)、忠县石宝寨段(S5)、万州新田镇段(S6)、云阳双江镇段(S7)、巫山巫峡镇段(S11)、秭归水田坝乡段(S13)共计8个干流监测点;设置乌江白涛镇段(S3)、小江黄石镇段(S8)、高阳镇段(S9)和养鹿乡段(S10)、大宁河双龙乡段(S12)、香溪河峡口镇段(S14)共计6个支流监测点(图 1)。根据高程将消落区分为145~155、156~165和166~175 m共3个区域,每个区域内设置4个1 m×1 m样方,样方间距10 m,其中S1~S4只有高程156~165和166~175 m区域,共144个固定监测样方。现场测量样方坡度,记录每个样方内每种植物的盖度和高度。在消落区完全出露期开展监测,于2009—2021年的6月15—30日完成。为揭示水库调度运行对植物特征的影响,根据长江水文网三峡水库水位数据,统计了每年6月至次年6月调查期间水位在150、160和170 m以上的天数,分别代表次年调查期间高程145~155、156~165和166~175 m区域的淹没时间(天数)。高程150 m于2006年首次淹没,因此至2009年第1次采样时,已经历3次周期性淹没。高程160和170 m均于2008年首次淹没,因此2009年采样时,高程160和170 m已经历1次周期性淹没。
|
图 1 监测点位置示意 Fig.1 Schematic diagram of monitoring sites in the WLFZ |
重要值由Crutis&McIntosh(1951)研究森林群落时首先提出,研究草本植物重要值时其公式为[13-14]:
| 重要值 =( 相对盖度 + 相对高度 )/2 | (1) |
| 相对盖度 =( 某一植物种的盖度 / 样方内所有植物种的盖度之和 )×100% | (2) |
| 相对高度 =( 某一植物种的高度 / 样方内所有植物种的高度之和 )×100% | (3) |
优势度表征一个物种在群落中的地位与作用,其公式为:
| Yi=Pi⋅fi | (4) |
式中,Pi=Ni/N,Ni为物种i的重要值,N为样方内所有物种重要值之和;fi为物种i在各个采样点出现的频率。
Shannon-Wiener指数(H′)表征假设在无限大的群落中对个体随机取样,而且样本包含了群落中所有物种和个体出现的机会,计算公式为:
| H′=−s∑i=1PilnPi | (5) |
式中,S为样方内的物种数。
Pielou均匀度指数(E)表征生物组成的均匀程度,该指数假设对无限大的群落随机取样,样本中2个不同种相遇的概率,其公式为:
| E=H′/lnS | (6) |
2018年6月固定样方监测期间,选择消落区(高程145~175 m)和未淹没区(对照区,高程175~200 m)均有存在的植物种类,测定植物的叶面积、鲜重和干物质量。经调查,选择了狗牙根(Cynodon dactylon)(S2、S3、S4、S5、S9、S11、S12、S13、S14)、牛鞭草(S1)、喜旱莲子草(Alternanthera philoxeroides)(S2、S4、S5、S6)和地果(S1、S11)等多年生草本植物4种,鬼针草(S2、S3、S4、S5、S13、S14)、苍耳(Xanthium sibiricum)(S3、S4、S5、S9、S12、S13、S14)、水蓼(Polygonum hydropiper)(S3、S6)、小白酒草(S1、S8、S9、S11)和艾蒿(S7)等一年生草本植物5种。自茎端(或枝端)第3枚叶开始,每茎(枝)摘取4枚完全成熟且无病虫害的叶片,每种植物摘取20~30枚叶片。利用Li-3000C便携式叶面积仪测定叶片的长度、宽度、面积等。然后将叶片放入保温箱里的自封袋中,用冰袋保持低温,带回室内,万分之一天平称量叶片鲜重。将称量后的叶片放入信封中,置于烘箱105℃杀青1 h,65℃干燥48 h,称量叶干重。
| 叶片干物质量 (%)= 干质量 / 鲜质量 ×100 | (7) |
| 比叶面积 (mm2/mg)= 叶面积 / 烘干重 | (8) |
| 叶片含水量 (%)= (叶片鲜重一叶片烘干重) /叶片鲜重 ×100 | (9) |
采用StrateFy计算植物的C、S和R值[15]。
1.3 数据处理利用SPSS 18.0计算植物群落特征的平均值和标准差。通过方差齐次检验为显著后,采用单因素方差分析Tukey法两两比较,分析高程之间植物多样性是否差异显著,采用Pearson相关,双侧检验分析物种多样性指数之间的相关性。采用独立T检验分析消落区和未淹没区共有植物的叶片功能性状是否存在差异。采用Canoco5.0分析水库运行特征(周期性淹没次数、水淹持续时间、高程)和气象等因子(降雨量、气温和日照时数,数据来源于2010—2022年重庆市统计年鉴)对植物重要值的影响。分析前对环境变量进行lg(X+1)转换,分析过程对植物重要值进行lg(A*Y+1)转换(由于物种重要值的数值较小,多在0~1之间,因此A值选10)以降低优势种类对排序的影响,进行DCA分析,最大轴特征值的最大长度为0.53,小于3,因此选择冗余分析方法(RDA),并采用Bonferroni法校正显著水平P值[16]。选用OriginPro 9.0绘制植物群落特征随年际变化图和植物适应策略的三元相图。
2 结果与分析 2.1 消落区植物群落优势植物组成高程影响着植物的分布,3个高程区域优势植物有差异。2009—2021年期间,高程145~155 m优势植物有11种,其中一年生草本植物8种,为水蓼、苍耳和鳢肠(Eclipta prostrata)等。多年生草本植物3种,为喜旱莲子草、香附子(Cyperus rotundus)和狗牙根等。
高程155~165 m优势植物有17种,其中一年生草本植物11种,为水蓼、苘麻(Abutilon theophrasti)和小白酒草(Comnyza canadensis)等。多年生草本植物6种,为香附子、狗牙根和苎麻(Boehmeria nivea)等。
高程165~175 m优势植物有20种,其中一年生草本植物12种,为水蓼、铁苋菜(Acalypha australis)、和黄花蒿(Artemisia annua)等。多年生草本植物8种,为野胡萝卜(Daucus carota)、艾蒿(Artemisia argyi)和白茅(Imperata cylindrica等。
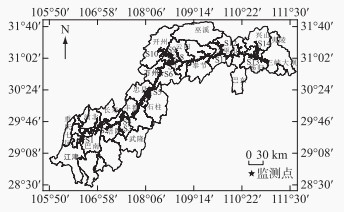
2.2 消落区植物群落多样性变化趋势随着高程的增加,植物群落Shannon-Wiener多样性指数和Pielou均匀度指数增加。高程145~155 m区域植物群落Shannon-Wiener多样性指数最低(1.47±0.47)(F=6.232,P=0.007),显著低于高程165~175 m区域(2.22±0.21)。高程145~155 m区域植物群落Pielou均匀度指数最低(0.67±0.07)(F=16.608,P=0),显著低于高程155~165 m区域(0.78±0.81)和高程165~175 m区域(0.81±0.04)(图 2)。
|
图 2 植物群落Shannon-Wiener指数和Pielou指数变化 Fig.2 Variation trend in Shannon-Wiener index and Pielou index of plant community |
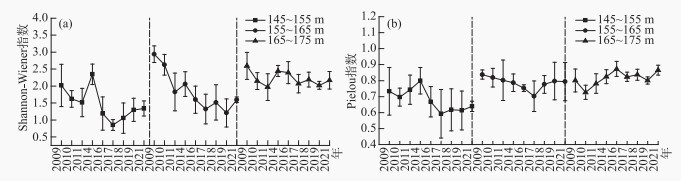
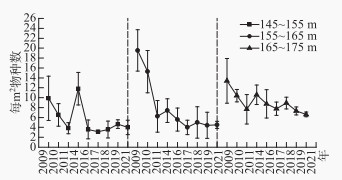
2009至2021年期间,高程145~155 m和155~165 m区域植物群落Shannon-Wiener多样性指数(图 2a)和Pielou均匀度指数(图 2b)总体上呈波动下降趋势。高程165~175 m区域植物Shannon-Wiener多样性指数稍微下降,但Pielou均匀度指数大体上呈增加趋势。3个高程区域每平方米植物的物种数呈下降趋势(图 3)。相关性分析表明,高程145~155 m(P < 0.01)和155~165 m(P < 0.05)区域的Shannon-Wiener多样性指数和Pielou均匀度指数呈显著正相关,而高程165~175 m区域的Shannon-Wiener多样性指数和Pielou均匀度指数虽然呈正相关性,但不显著。
|
图 3 植物群落每m2物种数变化 Fig.3 Variation trend in number of species per m2 |
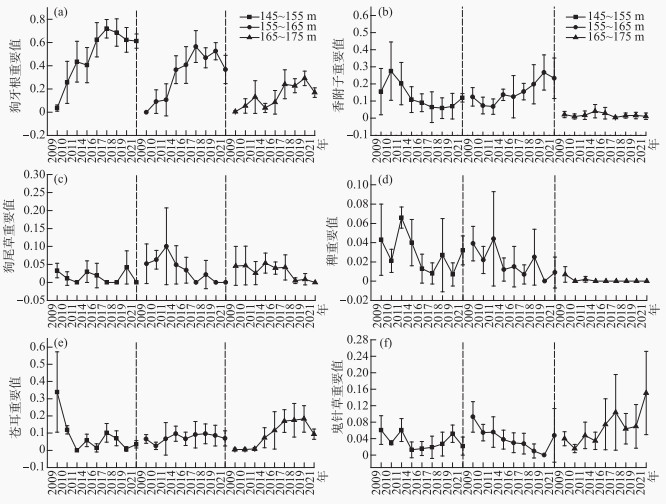
从2009—2021年,植物群落的优势种的重要值发生了变化。其中多年生草本植物狗牙根的重要值在消落区的3个高程梯度区域内均呈增加趋势(图 4a)。香附子的重要值在高程145~155和155~165 m区域呈增加趋势,在高程165~175 m区域的重要值变化不大(图 4b)。
|
图 4 主要优势种重要值变化 Fig.4 Variation trend in importance value of main dominant species |
不同年之间,一年生草本植物的重要值变动幅度较大。在3个高程梯度区域内狗尾草(图 4c)和无芒稗(图 4d)的重要值呈下降趋势。苍耳的重要值在高程145~155 m区域呈下降趋势,155~165 m区域变化不大,而在165~175 m区域呈增加趋势(图 4e)。鬼针草的重要值在高程145~155 m区域和155~165 m区域呈下降趋势,而在高程165~175 m区域呈增加趋势(图 4f)。
2.4 水库运行特征和气象因子对消落区优势植物重要值的影响RDA四轴共解释物种重要值63.03 % 的变异,校正后解释度为51.93 %。第一和第二排序轴可以分别解释44.69 % 和10.76 % 物种重要值变异。
单个变量淹没时间、高程和周期性淹没次数对植物重要值变异的影响程度,即可解释变异的比例分别为32.8 % (F=12.2,Padj=0.012)、30.7 % (F=11.1,Padj=0.012)和29.8 % (F=10.1,Padj=0.012)。气温、日照时数和降雨量对植物重要值的影响不显著。
通过Monte carlo检验,并根据条件影响特征值判定淹没时间(解释度为32.8 %,F=12.2,Padj=0.012)、周期性淹没次数(解释度为15.1 %,F=6.9,Padj=0.012)和高程(解释度为7.7 %,F=4.0,Padj=0.048)的影响显著,说明影响消落区植物重要值的主要环境因子为淹没时间、周期性淹没次数和高程。
如果RDA排序图中物种箭头与数量型环境因子箭头同向表示正相关,如果反向,表示负相关,夹角越小相关性越高[17]。狗牙根和香附子的重要值与淹没时间呈正相关,鬼针草和黄花蒿的重要值与淹没时间呈负相关。狗牙根、喜旱莲子草和苍耳等物种重要值与周期性淹没次数呈正相关,狗尾草和水蓼的重要值与淹没次数呈负相关。野胡萝卜、鬼针草和黄花蒿等物种重要值与高程正相关,狗牙根、香附子、水蓼和醴肠等物种重要值与高程负相关(图 5)。
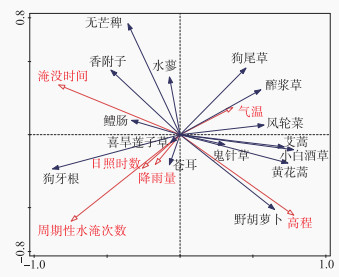
|
图 5 优势植物与环境因子的RDA分析 Fig.5 Relationships among dominant species and environmental variables by using RDA analysis |
消落区优势植物的叶功能性状在种间普遍存在较大的差异。叶面积、鲜重、烘干重和比叶面积范围分别为160.5~7167.5 mm2、14.5~1788.8 mg、5.2~243.2 mg和17.1~32.8 mm2/mg。一年生植物苍耳的叶面积最大,多年生植物地果和艾蒿的叶面积次之,狗牙根的叶面积最小。消落区优势植物中狗牙根的比叶面积最大,鬼针草、牛鞭草和苍耳的比叶面积次之,地果的比叶面积最小(表 1)。
| 表 1 优势植物叶片功能性状 Tab. 1 Leaf functional traits of dominant species |
与未淹没植物相比,消落区植物狗牙根叶面积略微增加。牛鞭草(F=2.695,P双侧=0)和水蓼(F=44.307,P双侧=0)的叶面积显著下降,艾蒿(F=4.515,P双侧=0.06)的叶面积显著增加。地果、苍耳、小白酒草和鬼针草的叶面积下降,喜旱莲子草的叶面积增加,但差异不显著。
与未淹没植物相比,消落区植物狗牙根的叶鲜重和烘干重增加,差异不显著,而喜旱莲子草的叶鲜重(F=4.587,P双侧=0)和叶烘干重(F=5.929,P双侧=0),艾蒿的叶鲜重(F=7.405,P双侧=0.001)和叶烘干重(F=10.371,P双侧=0.002)显著增加。地果、苍耳、小白酒草和鬼针草的叶鲜重和烘干重下降,差异不显著,而水蓼的叶鲜重(F=23.049,P双侧=0)和叶烘干重(F=22.867,P双侧=0),牛鞭草的叶鲜重(F=3.378,P双侧=0)和烘干重(F=7.341,P双侧=0)显著下降。
与未淹没植物相比,消落区植物牛鞭草(F=5.437,P双侧=0)的比叶面积显著增加。地果的比叶面积增加,狗牙根、喜旱莲子草、小白酒草、水蓼、艾蒿和鬼针草的比叶面积下降,差异不显著。消落区植物苍耳的比叶面积与未淹没区相近。
2.6 消落区优势植物生态适应策略分析消落区优势植物表现出较高的R型策略(26.9 % ~71.3 %),其次为C型策略(5.9 % ~61.3 %),S型策略得分最低,尤其是苍耳S型策略得分为0。不同的优势植物,其适应策略有所差异,其中多年生植物狗牙根的策略为SR型,以S策略上投资为主(C ∶S ∶R=5.9 % ∶53.4 % ∶40.7 %)。苍耳的策略为CR型,以C投资策略为主(C ∶S ∶R=61.3 % ∶0 % ∶38.7 %)。地果为C/CSR型,水蓼为CSR型,牛鞭草为SR/CSR型。小白酒草和喜旱莲子草为R/CR型,鬼针草为R/CSR型(图 6)。
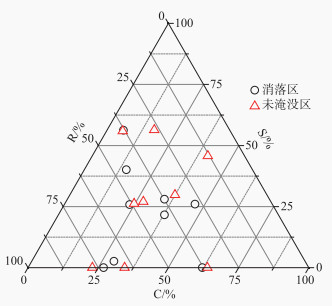
|
图 6 消落区优势植物的CSR策略图 (C,竞争型;S,忍受型;R,杂草型) Fig.6 CSR strategy of dominant species in WLFZ |
水库运行特征、气象因子和土壤理化特征是影响消落区植物生存生长的主要外部环境。水库水位的消涨幅度和波动节律等决定着消落区高程范围、经历的持续水淹时间和出露时间长短。而长时间持续水淹严重制约着消落区植物群落组成及多样性。3个高程区域受水淹时长差异明显,低高程区域受水淹时间较长。据统计,2009—2021年期间,高程150、160和170 m区域平均水淹时间分别长达284、201和101 d。本研究表明,高程145~155 m区域优势植物有11种,低矮的耐水淹草本植物如狗牙根和香附子等占绝对优势。高程165~175 m区域,优势植物种类数较多(20种),重要值差异不大,Pielou均匀度指数最高,这也说明了有更多的物种较为均匀地利用了光资源和营养资源等。程莅登等[8]和陈功等[14]均认为水淹时长是影响消落区植物群落组成和多样性的主要因子。由永飞等[17]也认为不同高程区域优势种的差异是植物对水库水位调节模式适应性策略的体现。
消落区出露时间长短显著影响着植物重要值的季节性变化。随着出露时间的延长,群落优势种的重要值变化规律因植物的生活型不同呈现出相反的变化规律。每年的1—5月,三峡水库水位逐渐下降,消落区逐渐出露,多年生草本植物(狗牙根和牛鞭草等)因具有高度耐水淹能力和克隆繁殖特性,在植物群落中占有绝对优势[18]。6—8月为水库低水位运行期,消落区完全出露,多年生草本植物生长空间相对固定,而一年生草本植物占有的空间比较随机,为了与多年生草本植物竞争生存空间和阳光,种子一旦萌发,高度和生物量快速增长,从而导致消落区出露后期狗牙根、牛鞭草和喜旱莲子草等多年生草本植物优势度下降,鬼针草、水蓼和野胡萝卜等一年生草本植物优势度增加[2]。
3.2 土壤理化特征和气象因子对消落区植物生存生长的影响消落区土壤养分影响着植物的生物量、高度和盖度,地形坡度和土层厚度影响着植被的生存生长。消落区土壤的有无,直接决定着植物是否存在,而土壤氮磷等营养盐含量决定着植被覆盖度和生物量的大小。在三峡库区巴东-巫山段,裸露的陡坡岩质很常见,既无土壤,也无植被覆盖,在岩石缝隙中零星分布有少量的草本植物。消落区坡度越大,土层厚度越小,植被盖度和生物量越低[19]。陡坡土质消落区植被常呈斑块化分布,土壤长期受涌浪侵蚀,土层越来越薄,植被将失去赖以生存生长的基质。三峡水库消落区土壤侵蚀模数大,是库区平均土壤侵蚀模数3185 t/(km2 ·a)的30倍[7]。
与水库运行特征和土壤养分对消落区植物群落特征的影响相比,气象因子的影响较小。本研究表明2009—2021年期间气象因子可以解释消落区植物重要值变化的比例较小,单独变量影响效应从大到小依次为气温、日照时数和降雨量,但影响均不显著(图 5)。消落区出露初期,气温升高和降雨可能会促进消落区种子的萌发和生长。已有研究表明温度能显著影响香蒲种子的萌发,低温10℃下不萌发,20~30℃萌发率较高(82 % ~85 %)[20],疏花水柏枝种子在23℃时萌发率(91 %)显著大于12℃时的萌发率(38 %)[21]。气象因子是否显著影响消落区植物的功能性状,尚需深入研究。
3.3 消落区植物的形态、生理代谢和繁殖适应机制为了适应冬季极端水淹环境(长时间持续深水淹没)和夏季高温干旱环境,消落区植物表现出了较多的适应策略,主要包括植物本身的冬季耐水淹能力、夏季抗旱能力、抗病虫害能力、植物的繁殖对策和种源扩散对策等,可能表现为单一适应机制,也可能表现为综合适应策略。
消落区植物适应水淹胁迫的形态机制,主要是通过多种有利于气体运输的机制避免缺氧,如不定根的发育,根和叶通气组织形成,以及叶表气膜形成等途径提高植物氧气和二氧化碳交换,以及根系通气状态[22-24]。之所以狗牙根在三峡水库消落区高程145~155 m区域占有绝对的优势地位,一方面在水淹期间狗牙根的根部通气组织发生[25],根系生物量增加[26],根系仍能维持活力,消落区出露后能很快萌发。通气组织被认为是氧气运入根内的通道,为耐水淹植物的一个重要适应特征[27-28],这有助于气体从茎干到根系快速扩散,为根呼吸提供氧气,促进根系的生长,使植物组织孔隙度和渗漏氧增加,提高主根和不定根的多孔性和植物的耐水淹能力。另一方面,狗牙根也是高度耐旱的多年生草本植物,狗牙根的茎节之间一旦遇到土壤,能够萌发根系,使其拥有众多的细根。
消落区植物适应水淹胁迫的生理代谢机制,即低氧静止策略。通过诱导发酵过程(主要是乳酸和乙醇发酵)和降低能耗过程(如翻译和生长),以适应低氧环境[29]。乙醇脱氢酶(ADH)、丙酮酸脱羧酶(PDC)被认为是植物在水淹期间主要表达的酶,调节植物碳水化合物代谢,其活性与厌氧代谢呈正相关,限制水稻根部有氧呼吸,诱导厌氧发酵[30-31]。已有研究证实了这一观点,水稻胚芽鞘在厌氧调节下的糖酵解速率是通气条件下的2.7倍[32]。水田中香附子的生物量仅为旱地中的1/3~1/2,块根的非结构性碳水化合物(可溶性糖和淀粉)浓度是旱地的2倍[33]。水淹前,三峡水库消落带植物狗牙根茎和地下部分的碳水化合物储备分别高于牛鞭草,也从侧面证明了狗牙根的耐淹能力比牛鞭草更强[34]。
消落区植物适应水淹环境的繁殖策略,主要表现为耐淹植物的克隆繁殖策略和不耐淹植物的有性生殖策略。狗牙根和牛鞭草的克隆繁殖策略也有助于抵御水淹胁迫,退水后能够迅速占领生态位,在种间竞争中具有优势[17]。本研究结果显示,虽然一年生草本植物苍耳、鬼针草、无芒稗、醴肠、水蓼和狗尾草不耐水淹,但它们也是消落区高程155~175 m区域常见的优势物种。其主要原因是,9月水库蓄水前种子能够完全成熟,种子数量多,且水淹期间大多数种子没有失去活力,水位消退后能够萌芽和生长迅速,在种间竞争中具有优势。另外,这些植物的种子体积小,三峡水库冬季高水位运行时,有些种子滞留原地或植株周围,有些种子随水流流到下游,沉降到某个位置,消落区出露时,这些种子可以萌发成新的植株,逐渐生长发育,并在9月前结实,完成生活史。吴阳等[35]在香溪河的研究也证实了水蓼、狗尾草和酸模(Rumex acetosa)均能借助于风力和水力传播,是消落区土壤种子库重要来源。
3.4 消落区植物的叶片功能性状及生态适应策略比叶面积可以作为衡量消落区植物适应环境能力的综合指标,在草地和林地等生态系统研究中已被认为是研究特定环境条件下植物生态学策略的首选指标[11-12],是植物在生长过程中资源获取策略的关键叶性状指标,能够反映植物在不同生境下的资源获取能力。本文研究表明消落区优势植物中狗牙根的比叶面积最大,为(32.8±7.2)mm2/mg,鬼针草、牛鞭草和苍耳的比叶面积次之,地果的比叶面积最小(表 1),这也就说明了不同物种间比较,狗牙根适应消落区的极端胁迫环境的能力最强。地果的适应能力相对较差,仅在较高高程(170~175 m)区域分布。不同生活环境或演替阶段植物的比叶面积大小有差异。生活在相对贫瘠的环境中和处于演替初期的植物具有更小的比叶面积,因为它们需要将更多的干物质投入以抵御不良环境[36]。本文的研究结果也证明了这点,消落区植物狗牙根、喜旱莲子草、小白酒草、水蓼、艾蒿、鬼针草和苍耳的比叶面积小于未淹没区。
在CSR理论中,C表征植物在高资源和低干扰的环境中迅速抢占资源的能力,S表征逆境中存活的物种特性,R具有杂草特性,表征植物将获得的资源投入繁殖行为中的能力[10, 37]。本研究表明消落区植物狗牙根以S型策略上投资为主(53.4 %),苍耳以C型(61.3 %)投资策略主,小白酒草(64.6 %)、喜旱莲子草(71.3 %)和鬼针草(50.9 %)以R型策略投资为主,这也从侧面说明不同植物的适应策略差异,其中狗牙根的适应机制是较强的耐水淹能力,苍耳的叶面积最大,比叶面积也较大,在消落区出露初期可较快地占用光热资源,消落区出露末期小白酒草和鬼针草可将占用的资源转化为个体小而数量极为庞大的种子。
4 结论本研究揭示了三峡水库消落区植物群落组成特征,3个高程区域优势植物差异明显,高程145~155 m区域以耐水淹的狗牙根、香附子和喜旱莲子草等为主,高程165~175 m区域以种子数量取胜的草本植物小白酒草、水蓼、鬼针草和苍耳等为主。随着高程的增加,植物群落Shannon-Wiener多样性指数和Pielou均匀度指数增加。从2009—2021年期间,高程145~155和165~175 m区域Shannon-Wiener多样性指数和Pielou均匀度指数呈波动下降趋势,优势植物狗牙根和香附子的重要值呈增加趋势。水库运行特征对消落区植物重要值变化的影响较大,RDA分析表明淹没时间、周期性淹没次数和高程均对植物重要值变化影响显著。不同的植物的生态适应策略差异较大,其中狗牙根以S策略上投资为主,苍耳以C投资策略主,小白酒草、喜旱莲子草和鬼针草以R型投资为主。因此,在实施消落区生态修复工程时,可优先选择具有较强耐水淹能力、抗干旱能力、低枯落物多年生植物狗牙根和香附子等,并适当配置能够产生个体小而数量极为庞大种子的植物水蓼和小白酒草等。
| [1] |
Lv MQ, Wu SJ, Chen CD et al. A review of studies on water level fluctuating zone(WLFZ) of the Three Gorges Reservoir(TGR) based on bibliometric perspective. Acta Ecologica Sinica, 2015, 35(11): 3504-3518. [吕明权, 吴胜军, 陈春娣等. 三峡消落带生态系统研究文献计量分析. 生态学报, 2015, 35(11): 3504-3518.] |
| [2] |
Zhang ZY, Hu XH, Xiang L et al. Plant community structure and seasonal variation in the water level fluctuation zone of Three Gorges Reservoir. Journal of Hydroecology, 2020, 41(6): 37-45. [张志永, 胡晓红, 向林等. 三峡水库消落区植物群落结构及其季节性变化规律. 水生态学杂志, 2020, 41(6): 37-45. DOI:10.15928/j.1674-3075.2020.06.005] |
| [3] |
Nilsson C, Berggren K. Alterations of riparian ecosystems caused by river regulation. BioScience, 2000, 50(9): 783. DOI:10.1641/0006-3568(2000)050[0783:aorecb]2.0.co;2 |
| [4] |
New T, Xie ZQ. Impacts of large dams on riparian vegetation: Applying global experience to the case of China's Three Gorges Dam. Biodiversity and Conservation, 2008, 17(13): 3149-3163. DOI:10.1007/s10531-008-9416-2 |
| [5] |
中国工程院三峡工程试验性蓄水阶段评估项目组. 三峡工程试验性蓄水阶段评估报告. 北京: 中国水利水电出版社, 2014.
|
| [6] |
Lei B, Wang YC, You YF et al. Diversity and structure of herbaceous plant community in typical water-level-fluctuation zone with different spacing elevations in Three Gorges Reservior. J Lake Sci, 2014, 26(4): 600-606. [雷波, 王业春, 由永飞等. 三峡水库不同间距高程消落带草本植物群落物种多样性与结构特征. 湖泊科学, 2014, 26(4): 600-606. DOI:10.18307/2014.0415] |
| [7] |
Yuan XZ. Practice exploration on ecosystem restoration of water level fluctuating zone in Pengxi River of Three Gorges Reservoir. Journal of Yangtze River Scientific Research Institute, 2022, 39(1): 1-9. [袁兴中. 三峡库区澎溪河消落带生态系统修复实践探索. 长江科学院院报, 2022, 39(1): 1-9.] |
| [8] |
Cheng LD, Deng HP, He S et al. Distribution patterns and diversity of plant communities in fluctuating areas of Chongqing section of Yangtze River. Chinese Journal of Ecology, 2019, 38(12): 3626-3634. [程莅登, 邓洪平, 何松等. 长江重庆段消落区植物群落分布格局与多样性. 生态学杂志, 2019, 38(12): 3626-3634. DOI:10.13292/j.1000-4890.201912.033] |
| [9] |
Guo Y, Yang S, Shen YF et al. Study on the natural distribution characteristics and community species diversity of existing plants in the Three Gorges Reservoir. Acta Ecologica Sinica, 2019, 39(12): 4255-4265. [郭燕, 杨邵, 沈雅飞等. 三峡水库消落带现存植物自然分布特征与群落物种多样性研究. 生态学报, 2019, 39(12): 4255-4265.] |
| [10] |
Grime JP. Evidence for the existence of three primary strategies in plants and its relevance to ecological and evolutionary theory. The American Naturalist, 1977, 111(982): 1169-1194. DOI:10.1086/283244 |
| [11] |
Adler PB, Salguero-Gómez R, Compagnoni A et al. Functional traits explain variation in plant life history strategies. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(2): 740-745. DOI:10.1073/pnas.1315179111 |
| [12] |
Liu ZG, Dong N, Zhang HX et al. Divergent long- and short-term responses to environmental gradients in specific leaf area of grassland species. Ecological Indicators, 2021, 130: 108058. DOI:10.1016/j.ecolind.2021.108058 |
| [13] |
Zhang JT, Xiang CL, Li M. Effects of tourism and topography on vegetation diversity in the subalpine meadows of the Dongling Mountains of Beijing, China. Environmental Management, 2012, 49(2): 403-411. DOI:10.1007/s00267-011-9786-1 |
| [14] |
Chen G, Li XL, Huang J et al. Characteristics of plant communities and their relationships with environmental factors in the water level fluctuation zone of the Zigui region of the Three Gorges Reservoir. Acta Ecologica Sinica, 2022, 42(2): 688-699. [陈功, 李晓玲, 黄杰等. 三峡水库秭归段消落带植物群落特征及其与环境因子的关系. 生态学报, 2022, 42(2): 688-699.] |
| [15] |
Pierce S, Negreiros D, Cerabolini BEL et al. A global method for calculating plant CSR ecological strategies applied across biomes world-wide. Functional Ecology, 2017, 31(2): 444-457. DOI:10.1111/1365-2435.12722 |
| [16] |
Lepš J, Šmilauer P. Multivariate analysis of ecological data using CANOCO: Visualizing multivariate data. New York: Cambridge University Press(US), 2013: 13-15, 50-51, 70-217.
|
| [17] |
You YF, Yang CH, Lei B et al. Effect of water level regulation on vegetation characteristics in the water-level-fluctuation zone of the Three Gorges Reservoir. Chinese Journal of Applied and Environmental Biology, 2017, 23(6): 1103-1109. [由永飞, 杨春华, 雷波等. 水位调节对三峡水库消落带植被群落特征的影响. 应用与环境生物学报, 2017, 23(6): 1103-1109.] |
| [18] |
Zhang LM, Lan B, Zhang DS et al. Niche and interspecific association of dominant herbaceous plants in the water-level-fluctuating zone of Fuling-Fengjie section of the Three Gorges Reservoir. Acta Ecologica Sinica, 2022, 42(8): 3228-3240. [张乐满, 兰波, 张东升等. 三峡水库涪陵——奉节段消落带优势草本植物生态位与种间联结性研究. 生态学报, 2022, 42(8): 3228-3240.] |
| [19] |
Zhang ZY, Wan CY, Zheng ZW et al. Plant community characteristics and their responses to environmental factors in the water level fluctuation zone of the Three Gorges Reservoir in China. Environmental Science and Pollution Research International, 2013, 20(10): 7080-7091. DOI:10.1007/s11356-013-1702-1 |
| [20] |
Hu K, Yan GR, Tang AJ. Effects of multiple abiotic factors on sexual recruitment of Typha orientalis population in the riparian zone of Three Gorges Reservoir. Chinese Journal of Ecology, 2022, 41(6): 1121-1127. [胡可, 严光荣, 唐安军. 非生物因子对东方香蒲种群有性更新的影响. 生态学杂志, 2022, 41(6): 1121-1127. DOI:10.13292/j.1000-4890.202205.003] |
| [21] |
Yuan WQ, Zhan HY, Chen FQ et al. Ecological characteristics of seed germination of an endangered species Myricaria laxiflora. Ecology and Environment, 2008, 17(6): 2341-2345. [袁万群, 詹海燕, 陈芳清等. 濒危植物疏花水柏枝种子萌发的生态学特性. 生态环境, 2008, 17(6): 2341-2345.] |
| [22] |
Mustroph A, Steffens B, Sasidharan R. Signalling interactions in flooding tolerance. Annual Plant Reviews, 2018(1): 1-42. DOI:10.1002/9781119312994.apr0623 |
| [23] |
Yamauchi T, Colmer TD, Pedersen O et al. Regulation of root traits for internal aeration and tolerance to soil waterlogging-flooding stress. Plant Physiology, 2017, 176(2): 1118-1130. DOI:10.1104/pp.17.01157 |
| [24] |
Kurokawa Y, Nagai K, Huan PD et al. Rice leaf hydrophobicity and gas films are conferred by a wax synthesis gene (LGF1) and contribute to flood tolerance. The New Phytologist, 2018, 218(4): 1558-1569. DOI:10.1111/nph.15070 |
| [25] |
Abiko T, Kotula L, Shiono K et al. Enhanced formation of aerenchyma and induction of a barrier to radial oxygen loss in adventitious roots of Zea nicaraguensis contribute to its waterlogging tolerance as compared with maize (Zea mays ssp. mays). Plant, Cell & Environment, 2012, 35(9): 1618-1630. DOI:10.1111/j.1365-3040.2012.02513.x |
| [26] |
Hong M, Guo QS, Nie BH et al. Responses of Cynodon dactylon population in hydro-fluctuation belt of Three Gorges Reservoir area to flooding-drying habitat change. Chinese Journal of Applied Ecology, 2011, 22(11): 2829-2835. [洪明, 郭泉水, 聂必红等. 三峡库区消落带狗牙根种群对水陆生境变化的响应. 应用生态学报, 2011, 22(11): 2829-2835. DOI:10.13287/j.1001-9332.2011.0431] |
| [27] |
Manzur ME, Grimoldi AA, Insausti P et al. Radial oxygen loss and physical barriers in relation to root tissue age in species with different types of aerenchyma. Functional Plant Biology, 2014, 42(1): 9-17. DOI:10.1071/FP14078 |
| [28] |
Du XM, Ni XL, Ren XL et al. De novo transcriptomic analysis to identify differentially expressed genes during the process of aerenchyma formation in Typha angustifolia leaves. Gene, 2018, 662: 66-75. DOI:10.1016/j.gene.2018.03.099 |
| [29] |
Locke AM, Barding GA Jr, Sathnur S et al. Rice SUB1A constrains remodelling of the transcriptome and metabolome during submergence to facilitate post-submergence recovery. Plant, Cell & Environment, 2018, 41(4): 721-736. DOI:10.1111/pce.13094 |
| [30] |
Sarkar RK, Reddy J, Sharma S et al. Physiological basis of submergence tolerance in rice and implications for crop improvement. Current Science, 2006, 91: 899-906. |
| [31] |
Ismail AM, Ella ES, Vergara GV et al. Mechanisms associated with tolerance to flooding during germination and early seedling growth in rice (Oryza sativa). Annals of Botany, 2008, 103(2): 197-209. DOI:10.1093/aob/mcn211 |
| [32] |
Gibbs J, Greenway H. Review: Mechanisms of Anoxia tolerance in plants. Ⅰ. Growth, survival and anaerobic catabolism. Functional Plant Biology, 2003, 30(1): 1-47. DOI:10.1071/PP98095 |
| [33] |
Peña-Fronteras JT, Villalobos MC, Baltazar AM et al. Adaptation to flooding in upland and lowland ecotypes of Cyperus rotundus, a troublesome sedge weed of rice: Tuber morphology and carbohydrate metabolism. Annals of Botany, 2008, 103(2): 295-302. DOI:10.1093/aob/mcn085 |
| [34] |
Li SQ, Shi SH, Pan XJ et al. Growth and carbohydrates consumption of plants during dark complete submergence: A case study of Cynodon dactylon and Hemarthria altissima hydro-fluctuation belt of Three Gorges Reservoir area. Journal of Chongqing Normal University: Natural Science, 2017, 34(6): 49-56. [李斯琪, 史邵华, 潘晓娇等. 黑暗完全水淹环境下植物的生长与碳水化合物消耗——以三峡库区消落带植物狗牙根和牛鞭草为例. 重庆师范大学学报: 自然科学版, 2017, 34(6): 49-56.] |
| [35] |
Wu Y, Chen FQ, Lv K et al. Characteristics of secondary dispersal of seeds and its effects on the soil seed bank of a drawdown zone in the Xiangxi River. Chinese Journal of Applied and Environmental Biology, 2017, 23(6): 1096-1102. [吴阳, 陈芳清, 吕坤等. 香溪河消落带种子二次传播特征及其对土壤种子库的作用. 应用与环境生物学报, 2017, 23(6): 1096-1102.] |
| [36] |
Westoby M, Falster DS, Moles AT et al. Plant ecological strategies: Some leading dimensions of variation between species. Annual Review of Ecology and Systematics, 2002, 33: 125-159. DOI:10.1146/annurev.ecolsys.33.010802.150452 |
| [37] |
Lin MZ, Huang Y, Li Y et al. Geographical distribution characteristics and influencing factors of plant survival strategies in an alpine grassland. Chinese Journal of Plant Ecology, 2022, 46(9): 1-10. [林马震, 黄勇, 李洋等. 高寒草地植物生存策略地理分布特征及其影响因素. 植物生态学报, 2022, 46(9): 1-10.] |
 2023, Vol. 35
2023, Vol. 35 


