(2: 湖南省微生物研究院,长沙 410009)
(2: Hunan Institute of Microbiology, Changsha 410009, P.R.China)
蓝藻水华发生频率在全球范围内迅速增加,对水体生态系统功能和人类健康构成严重威胁[1]。氮磷营养盐过量输入是水体富营养化和蓝藻水华暴发的主要原因[1]。减少水体营养盐外源输入,如河流的氮磷输入,短时间内并不总能使水体摆脱富营养化和蓝藻水华[2]。越来越多的证据表明,沉积物的氮磷内源释放是导致减排后水质滞后达标的主要原因[3]。基于2007-2016年在太湖21个采样点湖水中氮(总氮、铵态氮(NH4+-N)、硝态氮(NO3--N)、有机氮)的月度检测数据进行模型估算,结果显示约128 Gg的有机氮从沉积物释放到太湖水体中,其中大部分进一步矿化为NH4+-N,促进了蓝藻水华的持续暴发[3]。基于2005-2018年在太湖32个采样点的湖水总磷月度检测数据进行质量平衡模型估算,结果显示沉积物内源磷释放可以满足太湖蓝藻23%~90%磷的需求[2]。
细菌是沉积物中氮循环的主要驱动者,有氧条件下,NH4+-N可以通过硝化作用转化为NO3--N;无氧条件下,NO3--N可以通过反硝化、厌氧氨氧化和硝酸盐异化还原成铵,转化成其他氮化合物[4]。活性铁被认为是控制沉积物中磷迁移转化的关键因素[5]。有氧条件下,Fe(Ⅲ)矿物结合固定磷;无氧条件下,Fe(Ⅲ)矿物还原并释放沉积物中与之结合的磷[6]。研究认为,Fe(Ⅲ)矿物主要通过细菌还原(铁还原菌)和化学还原(还原态硫ΣH2S)两种方式被还原[7]。硫酸盐还原菌能够将硫酸盐转化为ΣH2S,ΣH2S继而还原Fe(Ⅲ)并形成FeS或FeS2,占据磷的吸附点位,促使磷释放[7]。沉积物自上而下由不同的氧化还原带组成,沉积物的氧化还原带由每个深度发生的主要氧化还原过程来定义,首先是溶解氧(DO)渗透深度内的有氧呼吸过程,接着依次是反硝化、锰还原、铁(Fe)还原、硫酸盐还原等厌氧呼吸过程[8]。由于沉积物-水界面具有明显的环境梯度,沉积物中氮磷浓度通常会出现显著的垂向变化[5, 9],但细菌驱动氮磷在垂向上迁移转化的机制尚不明晰。
当检测沉积物中氮和铁等氧化还原敏感性元素时,被动采样技术是测定其浓度的最准确的采集方法。高分辨透析技术(high-resolution dialysis,HR-Peeper)是常用的获取沉积物孔隙水的被动采样技术,薄膜扩散梯度技术(diffusive gradients in thin films,DGT)是能检测沉积物中DGT可获取态铁磷、NH4+-N、NO3--N的技术[5, 10-11],这些技术垂向上可达到毫米级的分辨率。应用这些高分辨被动采样技术对沉积物中氮磷迁移转化进行研究可以加深人们对沉积物中氮磷垂向分布特征的认识[5, 10-11]。可能是受限于沉积物毫米级垂向切割技术,目前对于沉积物中细菌的毫米级高分辨垂向分布特征的了解甚少。
基于以上问题,本研究将采样点设在蓝藻水华频发的太湖梅梁湾。采用一种自制的毫米级柱状沉积物自动垂向分层切割装置(ZL 2021 2 1765579.2)对沉积物进行垂向切割[12],结合高通量测序技术分析沉积物中细菌群落的毫米级垂向分布,采用HR-Peeper和DGT技术分析溶解态和DGT可获取态铁磷、铵态氮(NH4+-N)、硝态氮(NO3--N)的毫米级垂向分布。通过耦合分析如上细菌和氮磷铁理化数据,以期深入认识沉积物中细菌影响氮磷在垂向上迁移转化的机制。
1 材料与方法 1.1 采样点位与样品采集梅梁湾属于太湖藻型湖区,水体严重富营养化,经常遭受蓝藻水华的侵扰。本研究于2017年5月10日,使用沉积物柱状采样器(11 cm×50 cm,日本Rigo公司)在梅梁湾的1个采样点(31°31′33.5″N,120°12′34.0″E)采集9个平行沉积物柱样(内径×高=11 cm×40 cm)。同时使用YSI 6600(美国Yellow Stone公司)多参数水质测定仪测定上覆水温度、DO和pH等理化指标。
沉积物柱样在4 h内被运回实验室。将第1组3个沉积物柱样放入一个水箱(47 cm×47 cm×40 cm),水箱中的水来自采样点原位湖水,根据湖水温度,使水箱水温保持在20℃,用于HR-Peeper和DGT样品的采集。第2组3个沉积物柱样,首先用微电极(OX-100和RD-100,丹麦Unisense公司)测定当天DO (分辨率为0.2 mm)、氧化还原电位(Eh)和pH(分辨率为0.5 mm)的垂向分布,然后使用自制的毫米级柱状沉积物自动垂向分层切割装置(ZL 2021 2 1765579.2)对沉积物进行垂向切割(0~50 mm,间隔2 mm),用于分析细菌群落[12]。最后,将第3组的3个沉积物柱样切片(0~50 mm,间隔10 mm),用于含水率和烧失量的分析。用于DNA提取和理化性质分析的样品分别储存在-50℃和-20℃的冰箱。
1.2 样品理化指标分析HR-Peeper用于获取溶解态铁磷、铵态氮(NH4+-N)、硝态氮(NO3--N);氧化锆-螯合树脂DGT用于获取DGT可获取态铁磷; PrCH DGT用于获取DGT可获取态NH4+-N;A520E DGT用于获取DGT可获取态NO3--N。这些装置的制作和使用依据相关参考文献进行[5, 10, 11],HR-Peeper和DGT的垂向分辨率分别为4和2 mm。样品采集后,分别用1 mol/L HNO3和NaOH作为提取液将DGT可获取态铁和磷洗提取出来,用2 mol/L NaCl作为提取液将DGT可获取态NH4+-N和NO3--N洗提取出来。采用邻菲罗啉比色法测定铁浓度,钼锑抗比色法测定磷浓度,纳氏试剂比色法测定NH4+-N浓度,二磺酸酚比色法测定NO3--N浓度[13]。使用酶标仪(美国BioTek公司)对铁、磷、NH4+-N、NO3--N的浓度进行测定。
将沉积物样品在105℃的烘箱内烘6~8 h至恒重后测定沉积物含水率;称取105℃烘干后的样品放入坩埚中,在550℃灼烧4 h测定沉积物的烧失量[14]。
1.3 样品细菌群落的测定与分析使用DNA提取试剂盒(美国MP Biomedical LLC)提取沉积物样品中DNA。先采用细菌引物515f(5′-GTGCCAGCCGG-3′)/907r(5′-CCGTCAATTCMCTTRAGTT-3′)对沉积物样品16S rRNA基因进行特异性PCR扩增[7],然后制备克隆文库,最后在Illumina-MiSeq平台上进行测序(2×300 bp,美国Illumina公司)。测序由上海凌恩生物技术有限公司完成。原始序列数据在QIIME平台完成初步分析处理[15],选择30047个干净序列对细菌OTU进行标准化处理。使用Mothur软件分析了不同分层沉积物细菌群落的α多样性,计算了香农指数和Chao1等指数[16]。为了直观地呈现细菌群落在OTU水平上样本之间的差异,进行了非度量多维尺度分析(NMDS),采用相似性分析(Analysis of similarities,ANOSIM)判断不同分组样品中细菌群落组成在OTU水平上差异是否显著。根据不同分层沉积物样品的16S rRNA基因分类信息,利用原核生物分类功能注释(Functional annotation of prokaryotic taxa: FAPROTAX)软件1.1预测了细菌群落的潜在功能[17]。在补充材料中可查看FAPROTAX注释的氮铁硫细菌转化过程对应的细菌分类。用STAMP软件对样品的细菌转化过程做了组间差异显著分析[18]。用冗余分析(redundancy analysis,RDA)对样品中FAPROTAX预测的细菌转化过程与环境理化因子进行了相关分析,由于DGT可获取态理化参数和溶解态理化参数的垂向分辨率不一致,分别是2和4 mm,所以分别对其进行了RDA分析。其中NMDS、ANOSIM和RDA分析在R软件分析统计平台上完成[19]。
本文中的原始序列数据保存在中国科学院北京基因组研究所(中国国家生物信息中心)国家基因组数据中心的基因组序列档案中,登录号为CRA005971。
2 结果 2.1 上覆水及沉积物的基本理化特征采样时梅梁湾正在暴发蓝藻水华。上覆水的理化结果显示,湖水水温为19.96℃,叶绿素a (Chl.a)浓度为311.00 μg/L,浊度高达1559 NTU,电导率为507.33 μS/cm。此外,水下2.33 m处的pH值为8.43,偏碱性;DO浓度为8.46 mg/L。沉积物含水率在50.40%~64.83%之间波动,随着沉积物深度增加而降低(图 1a)。沉积物的烧失量值在5.11%~6.32%之间波动,先在-10~0 mm增加,然后随沉积物深度增加而降低(图 1a)。微电极分析结果显示,沉积物-水界面的DO浓度较低(约0.07 mg/L),0 mm以下沉积物的DO浓度均低于检测限(图 1b)。沉积物-水界面的Eh值从界面-30~0 mm随沉积物深度增加而快速下降(427.21~282.15 mV),从-39~-30 mm Eh值随沉积物深度增加而缓慢上升(282.15~284.44 mV),-50~-39 mm又随沉积物深度的增加缓慢下降(284.44~254.81 mV)(图 1c)。沉积物-水界面的pH值从界面0 mm随沉积物深度增加而下降,从-16~-5 mm pH随沉积物深度的增加而升高,随后随沉积物深度的增加而下降(图 1d)。
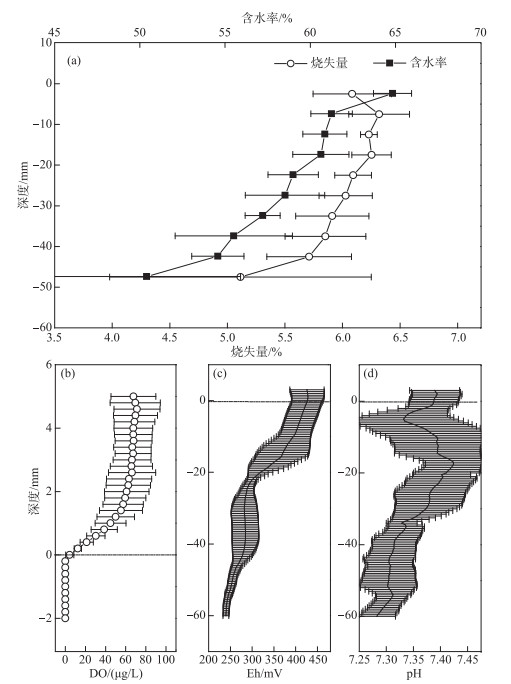
|
图 1 沉积物基本理化参数(含水率、烧失量、DO、Eh和pH)的垂向分布特征 Fig.1 Vertical distribution of parameters (Moisture content, loss on ignition, DO, Eh and pH) in the sediment |
溶解态和DGT可获取态NH4+-N浓度随深度增加而增加,而溶解态和DGT可获取态NO3--N浓度分别在-20~0 mm和-10~0 mm随沉积物深度增加而减少,之后趋于稳定的浓度值范围(图 2a,b)。溶解态和DGT可获取态铁磷浓度随沉积物深度增加而增加,且铁磷浓度呈现同步变化(图 2c,d)。溶解态铁磷浓度从-20~0 mm随沉积物深度增加有明显增加,-20 mm以下随深度增加缓慢,从-32 mm以下随深度又有明显的增加。DGT可获取态磷的浓度在沉积物-32 mm以下随深度增加而显著增加,并在-55 mm左右出现浓度峰值;DGT可获取态铁的浓度从-32~-6 mm处有些许的增加,在-32 mm以下随沉积物深度增加显著增加,并与DGT可获取态磷一样,在-55 mm左右出现浓度峰值。

|
图 2 溶解态和DGT可获取态NH4+-N、NO3--N、Fe和P在沉积物-水界面的垂向分布特征 Fig.2 Vertical distribution in dissolved and DGT-labile NH4+-N, NO3--N, Fe and P across the overlying water-sediment profiles |
不同沉积物分层样品中细菌群落在OTU水平上的香农指数和Chao1等α多样性指数从-32~0 mm呈现较小的波动,-32 mm以下迅速下降(图 3a,b)。沉积物各层样品中细菌群落在OTU水平上的NMDS分析结果也显示了-32~0 mm各层样品(浅层)与-50~-34 mm各层样品(深层)的细菌群落组成存在差异性,Stress值为0.103(图 3c),ANOSIM统计结果进一步表明,两组的细菌群落组成差异显著(statistic R: 0.7099,Significance: 0.001)。

|
图 3 细菌α多样性指数在沉积物中的垂向分布特征及沉积物不同分层样品细菌群落在OTU水平上的NMDS分布特征 Fig.3 Vertical distribution of bacterial α-diversity in the sediment and NMDS distribution of bacterial community in different layer sediments at OTU level |
两个分组中参与氮铁硫等元素转化的细菌相对丰度差异显著分析结果显示,浅层沉积物中参与氮转化(硝酸盐还原、好氧亚硝酸盐氧化)、铁还原、中间价态硫化合物还原(单质硫呼吸、硫代硫酸盐呼吸)过程的细菌相对丰度显著高于深层沉积物的,而深层沉积物中参与硫酸盐还原过程的细菌相对丰度显著高于浅层沉积物的(图 4a)。对浅层中的-16~0 mm组(浅层s)和-32~-18 mm组(浅层d)中参与氮铁硫等元素转化的细菌相对丰度做进一步差异显著分析,结果显示: 浅层s参与硝酸盐还原的细菌相对丰度显著高于浅层d的,而浅层d中参与锰还原的细菌相对丰度显著高于浅层s的(图 4b)。对-32~0 mm各层沉积物中关键细菌转化过程做进一步的分析,发现一些细菌转化过程具有相似的垂向分布特征(图 5)。参与中间态硫还原(单质硫、硫代硫酸盐和亚硫酸盐)的细菌和参与铁还原的细菌在-32~-18 mm深度有较高的相对丰度(图 5a),而参与尿素水解和厌氧氨氧化的细菌在该深度范围内也有相对丰度升高的趋势(图 5b)。

|
图 4 浅层和深层沉积物中参与氮铁硫等元素转化过程的细菌相对丰度的差异显著性分析结果 Fig.4 Significant difference analysis of the relative abundances of bacterial groups involved into the transformation of N, Fe and S in the surface and deep sediment layers |
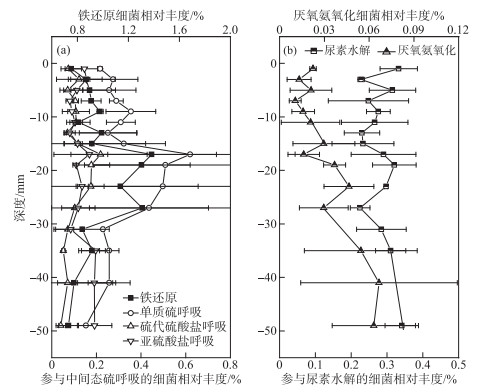
|
图 5 沉积物中通过FAPROTAX预测的细菌转化过程的垂向分布特征 Fig.5 Vertical distribution of microbial transforming process by FAPROTAX in the sediment |
DGT可获取态氮铁磷浓度与氮铁硫转化细菌相对丰度的RDA分析结果显示:DGT可获取态铁磷、NH4+-N和NO3--N、Eh等理化指标与氮铁硫细菌转化过程显著相关,其中参与硫酸盐还原的细菌相对丰度与DGT可获取态铁磷浓度呈显著正相关,参与亚硝酸盐氧化的细菌相对丰度与DGT可获取态NO3--N浓度呈显著正相关(图 6a)。溶解态氮铁磷浓度与氮铁硫转化细菌相对丰度的RDA分析结果显示:溶解态磷和Eh等理化指标与氮铁硫细菌转化过程显著相关,其中硫酸盐还原与溶解态磷浓度呈显著正相关(图 6b)。
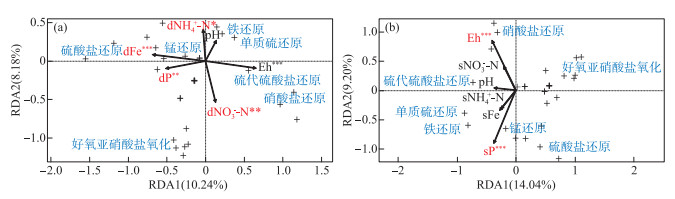
|
图 6 沉积物理化指标与细菌转化过程的冗余分析结果 (“+”代表细菌转化过程,差异显著的转化过程蓝色加粗;d:DGT可获取态,s:溶解态;***代表P < 0.001,**代表P < 0.01,*代表P < 0.05) Fig.6 Redundancy analysis results of physicochemical indexes and bacterial transforming process in the sediment (The transforming process with significant difference is marked in blue bold; d: DGT-labile, s: dissolved; ***: P < 0.001, **: P < 0.01, *: P < 0.05) |
采样时梅梁湾正在暴发蓝藻水华,0 mm以下沉积物的DO浓度均低于检测限(图 1b)。溶解态和DGT可获取态NO3--N浓度分别在-20~0 mm和-10~0 mm随沉积物深度增加而减少,随后维持稳定的浓度波动(图 2a,b),细菌硝酸盐还原过程主要发生在-16~0 mm沉积物(图 4b),溶解态和DGT可获取态NO3--N浓度的明显减少可能是由细菌硝酸盐还原导致的。沉积物pH值在-16~-5 mm沉积物深度呈增加趋势,这也表明该深度具有反硝化活性(图 1d)。有文献报道一个深水湖泊沉积物中硝酸盐还原主要发生在-13~-6 mm深度,对应的Eh变化范围为440~470 mV[8]。本研究中浅水湖泊沉积物Eh从-16~0 mm的变化范围为364.01~427.21 mV(图 1c)。由此可见,虽然Eh是表征环境中各厌氧呼吸过程的重要指标,但不同湖泊沉积物中细菌反硝化过程发生的Eh范围不同。此外,随深度增加Eh持续降低(图 1c),厌氧环境会抑制细菌硝化过程[8],从而可能导致了溶解态和DGT可获取态NH4+-N浓度随深度增加而增加(图 2a,b)。
沉积物溶解态和DGT可获取态铁磷浓度从-32 mm随沉积物的深度增加而显著增加,尤其是DGT可获取态铁磷浓度(图 2c,d)。用来指示细菌群落α多样性的香农指数和Chao1指数在-32 mm也出现明显减少(图 3 a,b)。沉积物各分层样品中细菌群落在OTU水平上的组成显著分成两个类群(图 3c),即-32~0 mm各分层样品中细菌群落(浅层)和-50~-34 mm各分层样品中细菌群落(深层),两组细菌群落差异显著(P=0.001)。本研究的这些结果显示,沉积物-32 mm深度是溶解态和DGT可获取态铁磷的关键分界点,细菌群落可能对铁磷浓度变化有重要影响。铁的氧化还原是控制沉积物中磷迁移转化的关键因素[5]。有氧条件下,铁氧化结合固定磷;无氧条件下,铁还原释放与之结合的磷[6]。铁还原主要通过细菌还原(铁还原菌)和化学还原(还原态硫ΣH2S)两种方式被还原[7]。硫酸盐还原菌能够将硫酸盐转化为ΣH2S,ΣH2S继而还原Fe(Ⅲ)并形成FeS或FeS2,占据磷的吸附点位,促使磷释放[7]。
3.2 浅层沉积物中细菌铁还原对铁磷迁移转化的影响可能因为采样时太湖梅梁湾正在暴发蓝藻水华,沉积物界面0 mm处的DO浓度已低于检测限(图 1b)。沉积物从浅到深,随着Eh的降低,依次是反硝化、锰(IV)还原、铁还原、硫酸盐还原[8]。氮转化(硝酸盐还原、好氧亚硝酸盐氧化)、铁还原、中间价态硫化合物还原(单质硫呼吸、硫代硫酸盐呼吸)等过程主要发生在浅层沉积物中(图 4a)。进一步分析显示细菌硝酸盐还原过程主要发生沉积物-16~0 mm沉积物深度,锰还原过程主要发生在-32~-18 mm沉积物深度(图 4b)。因此,本研究沉积物中细菌铁还原过程主要发生在-32~-18 mm沉积物深度,对应的Eh变化范围为282.79~341.95 mV(图 1c)。
尽管铁还原菌主要分布在-32~-18 mm沉积物深度(图 4,5),溶解态铁磷从-32~-20 mm随深度增加缓慢,DGT可获取态铁的浓度从-32~-6 mm处有少许的增加,而DGT可获取态磷浓度在该深度几乎无增加(图 2c,d),RDA分析结果也显示,细菌铁还原与溶解态和DGT可获取态铁磷的相关关系不显著(图 6)。这说明细菌铁还原过程对沉积物内源磷释放的影响有限,该结果与之前在梅梁湾的一个研究报道一致[7]。此外,在-18~-32mm沉积物深度,铁还原菌、硫/硫代硫酸盐/亚硫酸盐还原菌和参与尿素水解和厌氧氨氧化过程细菌的相对丰度出现同步峰值区间(图 5),某些细菌具有代谢多样性,能够利用多种电子受体,该沉积物深度可能发生了氮铁硫元素的耦合氧化还原过程[20]。
3.3 深层沉积物中细菌硫酸盐还原对铁磷迁移转化的影响硫酸盐还原过程主要发生在-50~-34 mm深层沉积物中(图 4a),对应的Eh变化范围为254.81~284.00 mV(图 1c)。溶解态和DGT可获取态铁磷浓度自-32 mm以下均随深度增加显著增加,尤其是DGT可获取态铁磷浓度(图 2c,d)。RDA分析结果也显示,硫酸盐还原过程与溶解态磷和DGT可获取态铁磷的相关关系显著(图 6)。硫酸盐还原被认为是沉积物磷大量释放的关键影响因子之一,硫酸盐还原的产物硫化物不仅能还原Fe(Ⅲ),还能以FeS/FeS2的形式沉淀铁,因此,硫化物能降低铁结合磷的有效性[6]。之前也有报道认为,夏季梅梁湾沉积物中磷铁的大量释放主要是由细菌的硫酸盐还原导致的[7]。因此,深层沉积物中的硫酸盐还原是导致沉积物溶解态和DGT可获取态铁磷浓度从-32 mm随沉积物的深度增加而显著增加的主要原因。
4 结论1) 梅梁湾沉积物中细菌群落与溶解态和DGT可获取态氮铁磷浓度在垂向上呈现显著的异质性。
2) 细菌硝酸盐还原主要发生在-16~0 mm沉积物深度,这可能导致了溶解态和DGT可获取态NO3--N浓度在该沉积物深度的明显减少。
3) 细菌铁还原主要分布在-32~-18 mm沉积物深度,细菌硫酸盐还原菌主要分布在-50~-34 mm的沉积物深度;细菌硫酸盐还原是导致沉积物溶解态和DGT可获取态铁磷浓度从-32 mm随沉积物的深度增加而显著增加的主要原因。
| [1] |
Huisman J, Codd GA, Paerl HW et al. Cyanobacterial blooms. Nature Reviews Microbiology, 2018, 16(8): 471-483. DOI:10.1038/s41579-018-0040-1 |
| [2] |
Xu H, McCarthy MJ, Paerl HW et al. Contributions of external nutrient loading and internal cycling to cyanobacterial bloom dynamics in Lake Taihu, China: Implications for nutrient management. Limnology and Oceanography, 2021, 66(4): 1492-1509. DOI:10.1002/lno.11700 |
| [3] |
Wang MZ, Xu XW, Wu Z et al. Seasonal pattern of nutrient limitation in a eutrophic lake and quantitative analysis of the impacts from internal nutrient cycling. Environmental Science & Technology, 2019, 53(23): 13675-13686. DOI:10.1021/acs.est.9b04266 |
| [4] |
Kuypers MMM, Marchant HK, Kartal B. The microbial nitrogen-cycling network. Nature Reviews Microbiology, 2018, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9 |
| [5] |
Ding S, Chen M, Gong M. Internal phosphorus loading from sediments causes seasonal nitrogen limitation for harmful algal blooms. Science of the Total Environment, 2018, 625: 872-884. DOI:10.1016/j.scitotenv.2017.12.348 |
| [6] |
Roden EE, Edmonds JW. Phosphate mobilization in iron-rich anaerobic sediments: Microbial Fe (Ⅲ) oxide reduction versus iron-sulfide formation. Archiv für Hydrobiologie, 1997, 139(3): 347-378. DOI:10.1127/archiv-hydrobiol/139/1997/347 |
| [7] |
Fan XF, Ding SM, Gong MD et al. Different influences of bacterial communities on Fe (Ⅲ) reduction and phosphorus availability in sediments of the cyanobacteria- and macrophyte-dominated zones. Frontiers in Microbiology, 2018, 9: 2636. DOI:10.3389/fmicb.2018.02636 |
| [8] |
Melton ED, Stief P, Behrens S et al. High spatial resolution of distribution and interconnections between Fe- and N-redox processes in profundal lake sediments. Environmental Microbiology, 2014, 16(10): 3287-3303. DOI:10.1111/1462-2920.12566 |
| [9] |
Wang LQ, Liang T, Zhong BQ et al. Study on nitrogen dynamics at the sediment-water interface of Dongting Lake, China. Aquatic Geochemistry, 2014, 20(5): 501-517. DOI:10.1007/s10498-014-9232-0 |
| [10] |
Huang JY, Bennett WW, Teasdale PR et al. Development and evaluation of the diffusive gradients in thin films technique for measuring nitrate in freshwaters. Analytica Chimica Acta, 2016, 923: 74-81. DOI:10.1016/j.aca.2016.04.006 |
| [11] |
Huang JY, Bennett WW, Welsh DT et al. Development and evaluation of a diffusive gradients in a thin film technique for measuring ammonium in freshwaters. Analytica Chimica Acta, 2016, 904: 83-91. DOI:10.1016/j.aca.2015.11.022 |
| [12] |
范献方. 一种毫米级柱状沉积物自动垂向分层切割装置. 中国专利ZL 2021 2 1765579.2., 2021.
|
| [13] |
国家环境保护总局. 水和废水监测分析方法. 北京: 中国环境科学出版社, 2002.
|
| [14] |
鲍士旦. 土壤农化分析: 3版. 北京: 中国农业出版社, 2000.
|
| [15] |
Caporaso JG, Kuczynski J, Stombaugh J et al. QⅡME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [16] |
Schloss PD, Westcott SL, Ryabin T et al. Introducing mothur: Open-source, platform-independent, community-supported software for describing and comparing microbial communities. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09 |
| [17] |
Louca S, Parfrey LW, Doebeli M. Decoupling function and taxonomy in the global ocean microbiome. Science, 2016, 353(6305): 1272-1277. DOI:10.1126/science.aaf4507 |
| [18] |
Parks DH, Beiko RG. Identifying biologically relevant differences between metagenomic communities. Bioinformatics: Oxford, England, 2010, 26(6): 715-721. DOI:10.1093/bioinformatics/btq041 |
| [19] |
Ihaka R, Gentleman R. R: A language for data analysis and graphics. Journal of Computational and Graphical Statistics, 1996, 5(3): 299-314. DOI:10.1080/10618600.1996.10474713 |
| [20] |
Bao P, Li GX. Sulfur-driven iron reduction coupled to anaerobic ammonium oxidation. Environmental Science & Technology, 2017, 51(12): 6691-6698. DOI:10.1021/acs.est.6b05971 |
 2023, Vol. 35
2023, Vol. 35 


