大气二氧化碳浓度在过去200年中增加了25 %,并预期于21世纪末达到700 ppm,全球气温也会同步上升3~5℃[1]。微藻是地球上的主要初级生产者,而大气二氧化碳浓度升高和升温将明显改变藻类的生理状态(包括生长速度[2]、光合作用[3]、细胞成分[4]等),并进一步影响藻类的生态功能:在海洋中,浮游植物通过光合作用所固定的二氧化碳约占了整个海洋固定二氧化碳量的1/2[5],而且随着大气二氧化碳浓度的升高和升温,这一比例还将进一步提高[6],浮游藻类甚至还可能通过大量消耗二氧化碳而遏止全球变暖[7];在淡水中,全球气候变化(包括大气二氧化碳浓度升高和升温)与富营养化的联合作用则可能导致蓝藻水华的频率和规模增加[8-11]。上述研究说明深入探索大气二氧化碳浓度升高和升温对微藻的影响将具有重要的生态学意义。
除环境因素会影响微藻的生态功能外,藻类病毒也能够通过感染和裂解微藻而改变其生态功能,如改变微藻的生物量与群落结构[12], 调控营养物循环[13], 加速宿主进化[14]等。但是藻类病毒的增殖会受到宿主状态的显著影响[15],如:大气二氧化碳浓度升高会干扰赫氏颗石藻的生长,并使感染该藻的病毒的释放量增加[16];大气二氧化碳浓度升高还会促进鞘丝藻的生长,并使噬藻体(蓝藻病毒)的吸附率、释放量增加[17];温度从25℃升高至29℃对鲍氏织线藻的生长没有显著影响,但却使噬藻体的释放量显著增加,潜伏期和裂解周期明显缩短[18]。特别是,大气二氧化碳浓度升高和升温对噬藻体的感染力还存在复杂的联合作用,如这两种因素能够协同提高噬藻体的成斑效率(即在宿主藻固体平板上的裂解率),但对噬藻体释放量的影响则会互相抵消[18],考虑到大气二氧化碳浓度升高和同步的升温已被历史观测和气候变化预测模型所证实[1],说明研究二者同步升高的联合影响将更接近全球气候变化的现实。
自然条件下,噬藻体种群的维持不但受其增殖性能的影响,而且也受其在水体中失活性能的影响,通常认为,日光中的紫外线是水体中噬藻体失活的最主要原因(如日光照射3 h即可使表层水中噬藻体的失活率达到92 % [19]),但宿主藻的光修复则可以高效修复失活的噬藻体(如席藻对紫外损伤噬藻体的光修复率高达58 %)[20]。显然,如此高的光修复率是维持“病毒-宿主系统”生态平衡的关键之一。而且,有充分的证据表明,微生物的光修复能力会随着大气二氧化碳浓度[17, 21]或温度[22]的升高而增高,进而增强对紫外损伤噬藻体的修复[17]。
代表性排放路径(representative concentration pathway, RCP)是联合国评估全球气候变化的基本依据(全球气候变化的效应预测和政策建议均基于不同的RCP场景),而大气二氧化碳浓度和温度的同步升高(synchronous elevation of pCO2 and temperature,SECT)则是RCP场景的核心效应[1]。尽管已有充分的证据表明藻类病毒(包括噬藻体)对于微藻的生态功能有不可忽视的巨大影响[23],但已有的有关SECT对微藻生态功能(及其全球效应)影响的研究和模型却几乎完全忽视了藻类病毒的存在[16],不同RCP场景下SECT对噬藻体感染力的影响更是尚未见诸报道。
PP类噬藻体指能够感染织线藻(Plectonema)和席藻(Phormidium)的噬藻体,其在我国淡水富营养水体中分布广泛[24],且其GP 10基因的相似度高达94 % ~98 % [25]。其中,噬藻体PP是我国首株淡水噬藻体分离株,具有裂解周期短、释放量大、感染性状稳定的特点[26]。作为PP类噬藻体的宿主,席藻广泛分布于贫营养至富营养水体中,尽管其在淡水中的优势度总体并不高[27-28],但其细胞密度及分布频率在近年来均在持续增加[29]。在自然水体中,大量生长的席藻的常见存在形式为底栖藻垫[21],但也有形成漂浮性水华的报道[30-31],并且这两种形式的席藻均能够产生毒素进而影响人类健康和生态系统的稳定性[29, 32-34]。本研究以噬藻体PP及其宿主(席藻)为材料,在不同的RCP等级下,既研究了SECT对噬藻体增殖性能的影响(涉及吸附率、裂解周期、裂解率、释放量等),也研究了SECT对噬藻体失活性能的影响(涉及光修复率),有助于深入认识噬藻体在全球气候变化进程中的生态功能。
1 材料和方法 1.1 材料与装置宿主藻:席藻(Phormidium sp.)为本课题组2009年在武汉分离得到[20]。噬藻体:噬藻体PP为本课题组2001年在武汉分离得到[26]。
自制SECT培养箱:培养箱的温控系统由温度控制器、风扇、加热器等组成,实测箱内温度波动范围为±0.2℃。CO2浓度控制系统由CO2钢瓶、缓冲箱、CO2控制器、电磁阀、气泵、减压阀等构成,其中CO2钢瓶中的高浓度CO2先经减压阀和电磁阀输入至缓冲箱(一级CO2控制器通过控制电磁阀启闭使缓冲箱内的pCO2浓度为(2000±200)ppm),缓冲箱内的气体再经微型气泵输入至SECT培养箱(二级CO2控制器通过控制微型气泵的启闭使SECT培养箱内的pCO2浓度的波动幅度达到±50 ppm)。
1.2 宿主藻的培养用AA液体培养基[35]培养席藻,光暗比为14 h ∶10 h,光强为2000 lx。为更好地模拟全球气候变化过程中大气二氧化碳浓度升高的实际过程,采用顶空法控制pCO2浓度(而非直接将CO2通入培养液中)。SECT分组为:CK组,25℃+400 ppm;RCP4.5,27.4℃+538 ppm;RCP6.0,28.0℃+670 ppm;RCP8.5,29.8℃+936 ppm。其中,RCP4.5和RCP6.0代表中等强度的温室效应气体排放,而RCP8.5代表高强度的温室效应气体排放[1]。
为使席藻充分适应上述温度和二氧化碳条件,先使该藻在上述条件下传代培养10个月后,再将其藻细胞密度稀释至2.0×106 cells/mL,继续在相应SECT条件下培养,每天采用显微镜直接计数法测定藻细胞密度,并取对数期藻用于后续试验。
1.3 噬藻体PP对宿主藻的吸附率的测定由于随着RCP等级的逐步提高(主要是由于二氧化碳浓度的逐步升高),对数期藻液的pH比对照组分别下降了0.05,0.10和0.25,为了使稀释后的藻液仍保留此pH差异,取对数期藻液用0.02 μm滤膜过滤收集滤液,再用滤液稀释相应的对数期藻液,使其初始藻细胞密度达到1.0×107 cells/mL。将效价(即具有增殖能力的病毒的浓度[36])为1.0×108 PFU/mL的噬藻体PP,按照MOI(multiplication of infectivity,即噬藻体效价与宿主细胞浓度的比例[36])为1 ∶104的比例加入稀释后的藻液中,充分混匀后置于相应SECT条件下培养,分别在0、15、30、45和60 min时取1 mL于12000×g离心5 min,采用96孔板法(8平行4梯度)测上清中的效价[36]。将0 min的效价记为P0,其它时间点的效价记为Pi,吸附率=(P0-Pi)/P0×100 % [36]。
1.4 裂解曲线和一步生长曲线的测定用1.3中的方法将对数期藻液的细胞密度稀释至1.0×107 cells/mL。加入初始效价为1.0×108 PFU/mL的噬藻体PP,使MOI为1 ∶1,混匀后放在对应SECT条件下静置吸附30 min。再将混合液于18000×g离心10 min,用相应的滤过液对沉淀洗涤3次(以彻底去除未吸附的噬藻体PP)。再将样品分为a、b两组,a组用于显微镜检计藻细胞数,b组则用上述滤过液梯度稀释100倍和10000倍。将a、b样品放在对应SECT条件的摇床上100转/min振荡培养(用于防止已释放的子代噬藻体PP吸附到临近的藻丝上),并分别在0、60、90、120、150、180、210、240、270和300 min时从a组中取样镜检测量藻细胞数并据此绘制藻细胞的裂解曲线,同时从b组中取样用96孔板法测量噬藻体PP的效价,各时间点的噬藻体释放量=Pi/Ai(其中Ai为被裂解的藻细胞数=初始藻细胞数-该时刻的剩余藻细胞数,Pi为噬藻体效价的增加量=该时刻的噬藻体效价-初始噬藻体效价[36]),并据此绘制噬藻体PP的一步生长曲线。
1.5 紫外损伤噬藻体的光修复率的测定将噬藻体PP裂解液(其效价计为“原始效价”)置于12 μW/cm2的UV-B灯下照射30 min进行紫外损伤处理后,取0.1 mL紫外损伤的噬藻体PP分别在白光和红光条件下采用空斑法测定其效价。由于紫外损伤的噬藻体能够在白光(主要是波长为300~500 nm的光)条件下被宿主光修复,而在波长大于620 nm的红光条件下则不会发生光修复,故紫外损伤噬藻体的光修复率可通过以下公式计算得到[19]:
| 光修复率 %= 白光条件下的效价一红光条件下的效价 原始效价-红光条件下的效价 | (1) |
先将随机测量的20条藻丝总长度除以这20条藻丝的总细胞数,即得到每个藻细胞的平均长度,再将20~50个血球计数板计数室(每个计数室的体积为0.1 mm3)内的藻丝总长度除以每个藻细胞的平均长度即得到这20~50个计数室内的藻细胞数,并据此计算藻细胞密度。
1.7 统计分析上述试验均设3个平行,作图采用Graphpad Prism 5完成(图表中的误差量均用±SD表示);数据分析采用SPSS 10.0完成,其中吸附率曲线采用单变量一般线性模型分析,宿主藻生物量、噬藻体平均释放量和紫外损伤修复率采用单因素方差分析,多重比较采用最小显著性差异法(least significant difference,LSD)法。
2 结果与分析 2.1 宿主藻的生长尽管各RCP等级下的席藻的对数期(图 1)长度并无明显差异(均从第2天持续至第12天),但高RCP等级下的藻细胞密度明显更高:至对数期末期,RCP8.5和RCP6.0条件下的藻细胞密度均显著高于RCP4.5条件和对照组(P<0.05),说明显著性的生长加速发生在高于RCP4.5的条件下。
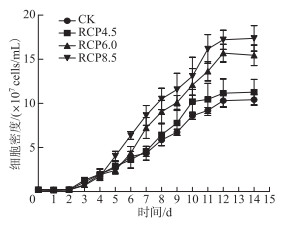
|
图 1 席藻的生长曲线 Fig.1 The growth curves of Phormidium sp. |
各RCP等级下噬藻体PP的吸附率(图 2)均在0~15 min快速增加,在15~60 min下吸附率的增速则明显变缓,但是各组的吸附率无显著差异(P>0.05)。
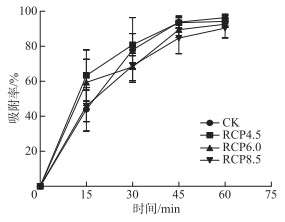
|
图 2 噬藻体PP的吸附率曲线 Fig.2 The adsorption curves of cyanophage PP |
噬藻体PP对席藻的裂解周期会随着RCP等级的升高而逐步缩短(图 3):RCP4.5条件和CK条件下的裂解则主要发生在120~180 min,而RCP6.0和RCP8.5条件下则提前至60~120 min发生裂解,且RCP8.5条件下90 min时的细胞密度显著低于RCP6.0条件,说明噬藻体PP对席藻的裂解在RCP8.5条件下更快。
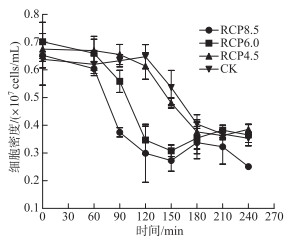
|
图 3 席藻的裂解曲线 Fig.3 The lytic curves of Phormidium sp. |
当达到裂解周期时,不同RCP等级下的裂解率差异显著(P<0.05),其中RCP6.0和RCP8.5条件下的裂解率显著高于对照组(P<0.05),增幅分别高达57 % 和64 % (图 4)。

|
图 4 达到裂解周期时的裂解率 Fig.4 The lytic ratio at the end of lytic cycle |
不同RCP等级下噬藻体PP的一步生长曲线(图 5)差异明显,根据图 3、图 5,将噬藻体的潜伏期、裂解周期和释放量归纳见表 1。
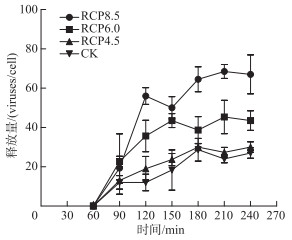
|
图 5 噬藻体PP的一步生长曲线 Fig.5 The one-step growth curves of cyanophage PP |
| 表 1 噬藻体PP的潜伏期、裂解周期和释放量 Tab. 1 The latent period, lytic cycle and burst size of cyanophage PP |
随着RCP等级的提高,噬藻体PP的潜伏期和裂解周期均明显缩短,释放量则显著增加(表 1):潜伏期从120 min逐步缩短至60 min(缩短了60 min),相应的裂解周期也从180 min缩短至120 min(也缩短了60 min),说明裂解周期的缩短主要是由于潜伏期的缩短所造成的;同时,RCP8.5的释放量比其它3组增加了27 % ~93 % (P<0.01),RCP6.0的释放量也比RCP4.5和CK组分别增加了47 % 和52 % (P<0.05),但RCP4.5和CK组之间无显著差异(P>0.05)。此外,表 1中采用两种方法测得的裂解周期的总体变化趋势一致(即裂解周期随PCPs等级提高而缩短),但裂解曲线法测得的裂解周期和一步生长曲线法测得的裂解周期存在0~30 min的差异,考虑到本研究的取样间隔为30 min,故将来有必要通过更精细的测量(如将取样间隔设为5~10 min)来确认此差异是否具有统计学意义。
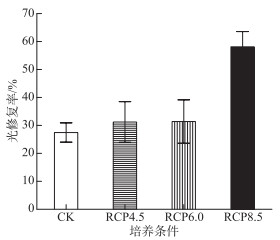
2.5 席藻对紫外损伤噬藻体PP的光修复率尽管RCP4.5和RCP6.0条件下的光修复率与对照组差异不显著(图 6,P>0.05),但RCP8.5条件下的光修复率却显著高于其它3个条件(P<0.05),其增幅高达86 % ~112 %。
|
图 6 席藻对紫外损伤噬藻体PP的光修复率 Fig.6 The photoreactivation ratio of UV-decayed cyanophage PP by Phormidium sp. |
对比上述各项指标在不同RCP等级下的变化趋势(表 2),发现:尽管潜伏期和裂解率的变化与宿主藻生长(通过藻细胞密度的变化情况反映)的变化是同步的,但是,噬藻体的吸附率却没有显著变化,而且,当从RCP6.0升级至RCP8.5时,噬藻体PP的释放量和光修复率显著增加、裂解周期明显缩短,但席藻的生长却没有显著加速。此结果说明,伴随RCP等级的提高,噬藻体的某些感染力指标的变化与席藻生长的变化是不同步的,且噬藻体的不同感染力指标的变化趋势也是有差异的。
| 表 2 席藻生长和噬藻体感染力指标在不同RCP等级下的变化 Tab. 2 The change of physiological parameters of Phormidium-cyanophage system at different RCP conditions |
Levitan等发现束毛藻的生长速度会随大气pCO2升高而提高[37-38],而Mi s ' kiewicz等也观察到鲍氏织线藻会在15~29℃区间随着升温而加速生长[39],类似的,本研究也发现席藻的生长随SECT强度的增加而加速(其中,显著性的生长加速发生在高于RCP4.5的条件下)。究其原因,可能是由于蓝藻光合作用的RubisCO 1D与二氧化碳的亲和力较低[40],因此提高大气pCO2浓度将通过促进光合作用而刺激蓝藻生长;此外,由于很多蓝藻都具有喜高温的特性[41],说明其可能在较高温度时具有更快的生长速度。
3.2 SECT对噬藻体增殖性能的影响本研究中,SECT对噬藻体PP的吸附率没有显著影响。而此前牛晓莹等的研究则表明,同样以噬藻体PP为研究对象,SECT会使其感染鲍氏织线藻的吸附率明显增加[42],此结果既可能是由于所使用的宿主藻不同造成的,也可能是由于吸附率的计算(测量)方法不同造成的:牛晓莹等是用沉淀中的噬藻体效价除以初始效价计算吸附率[42],而本文则是用初始效价与上清液中的噬藻体效价的差除以初始效价来计算吸附率。根据本文的结果,在吸附率无差异(图 2)的前提下,高RCP等级下噬藻体的裂解率更高(图 4),说明高RCP等级下的宿主藻更容易被裂解,所测得的噬藻体效价也将更高,故牛晓莹等的方法有可能高估了吸附率。从机理上看,二氧化碳浓度升高与温度升高对吸附的作用是可以互相抵消的:二氧化碳浓度升高至少能通过两个途径抑制噬藻体的吸附,其一是较高浓度的二氧化碳会刺激胞外多糖的合成[43],而胞外多糖会干扰病毒的吸附[44],其二是二氧化碳浓度升高会导致pH下降(本研究中也观察到了此现象,详见1.3),进而干扰脂多糖的合成[45],而脂多糖是噬藻体吸附宿主的关键受体[46-47];与二氧化碳浓度升高的效应相反,温度升高则可能通过促进脂多糖的合成[45]而为噬藻体的吸附提供更多受体[46-47]。
有报道指出,大气二氧化碳浓度升高会使赫氏颗石藻病毒[16]和噬藻体PP[17]的释放量增加,而高温也可以导致拟柱孢藻噬藻体的释放量增加、潜伏期缩短[48]。本研究也观察到SECT使噬藻体PP的潜伏期(及裂解周期)明显变短,释放量显著增加。通常,宿主新陈代谢越旺盛,病毒的感染力就越强[49-50]。而本研究中,SECT能够明显促进宿主藻的生长,而宿主藻活跃的生理状态则可以为病毒复制提供更为充足的物质和能量,加速病毒大分子的合成,从而使潜伏期缩短并使释放量增加[51]。
在与病毒的长期协同进化过程中,宿主形成了一套对抗病毒感染的机制,即病毒的吸附和感染并不是总能导致宿主被裂解和子代病毒的释放。本研究发现SECT会使宿主藻的裂解率显著提高,类似的,Cheng等也观测到SECT会使噬藻体PP感染鲍氏织线藻的成斑效率显著提高[18]。本研究中,由于SECT对吸附率并无显著影响,因此推测主要是由于吸附后的某种机制导致宿主对噬藻体的抗性减弱。如有证据表明环境因素会明显影响包括噬菌体/噬藻体DNA入侵受阻[50]、DNA修饰[52]及流产感染[53]在内的抗性机制:Kumar等发现DNA的入侵受pH(大气二氧化碳浓度升高会导致pH下降)和温度的影响[54],特别是,较高的温度能够使病毒尾部穿孔蛋白的构象发生改变,从而提高DNA入侵的速度[55];DNA修饰系统广泛存在于蓝藻中[56-58],其活性主要取决于多种DNA限制性内切酶的活性[52],而这些酶的活性会受到温度和pH的影响[59-61];流产感染是指病毒复制的中、晚期阶段受到干扰,进而使病毒不能裂解宿主或病毒释放量减少的现象[62-63],已有证据表明流产感染相关基因的表达至少会受温度的显著影响[53, 63],但仍然缺乏二氧化碳浓度变化(或pH变化)影响流产感染的报道。
3.3 SECT对光修复率的影响本研究发现RCP8.5条件下,宿主藻的光修复率显著增加,这与Zhou等观察到的大气二氧化碳浓度升高能够促进鞘丝藻对噬藻体PP的光修复的结果是吻合的[17]。其原因既可能是源于SECT所引起的高裂解率(导致RCP8.5条件下测定的效价偏高,图 4),也有可能是因为大气二氧化碳浓度升高会刺激藻类光解酶(光修复的关键酶)基因的转录[21],而光解酶基因转录后的调控机制也可能受温度等环境因素的影响[22]。
3.4 生态学意义本研究中,当SECT变化超过RCP4.5后,不但宿主藻的生长明显加速,而且噬藻体PP的感染力也明显加强(潜伏期缩短,裂解率、释放量和光修复率增加)。通常认为,随着全球气候变化的加剧,水华蓝藻的生长会更加旺盛[64-65],而本研究则表明,噬藻体(作为蓝藻种群的重要控制因子之一)对宿主蓝藻的感染力也会随之增加。也就是说,当SECT变化超过某阈值后,其对蓝藻水华的影响将(至少)取决于宿主蓝藻生长加速和噬藻体感染力增加的共同作用。
根据2.6节的分析,噬藻体感染力指标的变化与宿主藻生长的变化是“不同步”的,不但说明宿主蓝藻生长的变化仅能解释部分噬藻体感染力指标的变化,而且也将驱动宿主蓝藻和噬藻体之间的生态平衡关系在全球气候变化的不同阶段发生改变,如根据本文结果,在较高的RCP等级下,噬藻体感染力的加强将比宿主蓝藻生长的加速更为显著,从而有利于此生态平衡向噬藻体倾斜。此外,由于噬藻体感染涉及诸多独立的生理/生化过程,且这些生理/生化过程并非总是伴随藻类的生长状态而变化,故噬藻体感染力的不同指标对不同RCP等级的响应也是有差异的(详见2.6节)。因此,在构建相应的全球气候变化的生态效应模型时,有必要细致评估不同感染力指标在各RCP等级下的变化情况,而这些评估目前尚缺乏研究[16]。
此外,本文研究的席藻(一种丝状蓝藻)虽在富营养化淡水水体中广泛分布且能够产毒,但其优势度和危害性远不及此类水体中最常见的微囊藻(一种群聚态的单细胞蓝藻)[64-65],而全球气候变化因素对微囊藻噬藻体的影响尚未见诸报道。因此,参考本文发现的线索,后续值得深入研究全球气候变化背景下微囊藻噬藻体生态功能的变迁。
4 结论当大气二氧化碳浓度和温度同步升高的幅度超过RCP4.5后,总体上会加速宿主藻的生长并逐步提高噬藻体PP的感染力,但宿主藻的生长及噬藻体的不同感染力指标随RCP等级提高而显著变化的趋势不完全同步:1)宿主藻生长的加速及噬藻体潜伏期的缩短和裂解率的增加主要发生在RCP4.5和RCP6.0之间;2)噬藻体裂解周期的缩短和释放量的增加不但发生在RCP4.5和RCP6.0之间,也发生在RCP6.0和RCP8.5之间;3)光修复率的增加仅发生在RCP6.0和RCP8.5之间。
| [1] |
Stocker T, Qin DH, Plattner GK et al. Climate change 2013: the physical science basis: summary for policymakers. Switzerland: IPCC, 2013, 37-47. |
| [2] |
Riebesell U, Wolf-Gladrow DA, Smetacek V. Carbon dioxide limitation of marine phytoplankton growth rates. Nature, 1993, 361(6409): 249-251. DOI:10.1038/361249a0 |
| [3] |
Fu FX, Mulholland MR, Garcia NS et al. Interactions between changing pCO2, N2 fixation, and Fe limitation in the marine unicellular cyanobacterium Crocosphaera. Limnology and Oceanography, 2008, 53(6): 2472-2484. DOI:10.4319/lo.2008.53.6.2472 |
| [4] |
Fu FX, Warner ME, Zhang YH et al. Effects of increased temperature and CO2 on photosynthesis, growth, and elemental ratios in marine Synechococcus and Prochlorococcus (cyanobacteria). Journal of Phycology, 2007, 43(3): 485-496. DOI:10.1111/j.1529-8817.2007.00355.x |
| [5] |
Field CB, Behrenfeld MJ, Randerson JT et al. Primary production of the biosphere: Integrating terrestrial and oceanic components. Science, 1998, 281(5374): 237-240. DOI:10.1126/science.281.5374.237 |
| [6] |
Behrenfeld MJ, O'Malley RT, Siegel DA et al. Climate-driven trends in contemporary ocean productivity. Nature, 2006, 444(7120): 752-755. DOI:10.1038/nature05317 |
| [7] |
Schmitz B. Plankton cooled a greenhouse. Nature, 2000, 407(6801): 143-144. DOI:10.1038/35025173 |
| [8] |
Kosten S, Huszar VLM, Bécares E et al. Warmer climates boost cyanobacterial dominance in shallow lakes. Global Change Biology, 2012, 18(1): 118-126. DOI:10.1111/j.1365-2486.2011.02488.x |
| [9] |
Carey CC, Ibelings BW, Hoffmann EP et al. Eco-physiological adaptations that favour freshwater cyanobacteria in a changing climate. Water Research, 2012, 46(5): 1394-1407. DOI:10.1016/j.watres.2011.12.016 |
| [10] |
Paerl HW, Huisman J. Climate change: A catalyst for global expansion of harmful cyanobacterial blooms. Environmental Microbiology Reports, 2009, 1(1): 27-37. DOI:10.1111/j.1758-2229.2008.00004.x |
| [11] |
Paerl HW, Huisman J. Blooms like it hot. Science, 2008, 320(5872): 57-58. DOI:10.1126/science.1155398 |
| [12] |
Coloma SE, Dienstbier A, Bamford DH et al. Newly isolated Nodularia phage influences cyanobacterial community dynamics. Environmental Microbiology, 2017, 19(1): 273-286. DOI:10.1111/1462-2920.13601 |
| [13] |
Zhang YY, Huang LL, Wang XY et al. Regulation of cyanobacteria population density by cyanophage and its effect on material circulation in water. J Lake Sci, 2022, 34(2): 376-390. [张奕妍, 黄兰兰, 王夕予等. 噬藻体对蓝藻种群密度的调控及其对水体中物质循环的影响. 湖泊科学, 2022, 34(2): 376-390. DOI:10.18307/2022.0202] |
| [14] |
Thompson LR, Zeng QL, Kelly L et al. Phage auxiliary metabolic genes and the redirection of cyanobacterial host carbon metabolism. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(39): E757-E764. DOI:10.1073/pnas.1102164108 |
| [15] |
Mojica KD, Brussaard CP. Factors affecting virus dynamics and microbial host-virus interactions in marine environments. FEMS Microbiology Ecology, 2014, 89(3): 495-515. DOI:10.1111/1574-6941.12343 |
| [16] |
Carreira C, Heldal M, Bratbak G. Effect of increased pCO2 on phytoplankton-virus interactions. Biogeochemistry, 2013, 114(1): 391-397. DOI:10.1007/s10533-011-9692-x |
| [17] |
Zhou Q, Gao Y, Zhao Y et al. The effect of elevated carbon dioxide concentration on cyanophage PP multiplication and photoreactivation induced by a wild host cyanobacterium. Acta Ecologica Sinica, 2015, 35(1): 11-15. DOI:10.1016/j.chnaes.2014.11.001 |
| [18] |
Cheng K, Van de Waal DB, Niu XY et al. Combined effects of elevated pCO2 and warming facilitate cyanophage infections. Frontiers in Microbiology, 2017, 8: 1096. DOI:10.3389/fmicb.2017.01096 |
| [19] |
Suttle CA, Chan AM, Cottrell MT. Infection of phytoplankton by viruses and reduction of primary productivity. Nature, 1990, 347(6292): 467-469. DOI:10.1038/347467a0 |
| [20] |
Cheng K, Zhao YJ, Du XL et al. Solar radiation-driven decay of cyanophage infectivity, and photoreactivation of the cyanophage by host cyanobacteria. Aquatic Microbial Ecology, 2007, 48(1): 13-18. |
| [21] |
Zhou QC, Zhou F, Liao MJ et al. The photoreactivation ratio of cyanophage PP in wild host under different light or temperature conditions. Acta Ecologica Sinica, 2010, 30(7): 1868-1874. [周起超, 周飞, 廖明军等. 不同光、温条件下野生宿主对噬藻体PP的光修复率. 生态学报, 2010, 30(7): 1868-1874. DOI:10.3321/j.issn:1000-0933.2007.07.030] |
| [22] |
García-Gómez C, Gordillo FJL, Palma A et al. Elevated CO2 alleviates high PAR and UV stress in the unicellular chlorophyte Dunaliella tertiolecta. Photochemical & Photobiological Sciences, 2014, 13(9): 1347-1358. DOI:10.1039/c4pp00044g |
| [23] |
Xu L, Tian C Q, Lu X H et al. Photoreactivation of Escherichia coli is impaired at high growth temperatures. Journal of Photochemistry and Photobiology B: Biology, 2015, 147: 37-46. DOI:10.1016/j.jphotobiol.2015.03.012 |
| [24] |
Guo YX, Cheng K, Zhao YJ et al. The distribution and infectivity of cyanophage and other algae-lysin factors in fresh water. China Environmental Science, 2003, 23(2): 167-170. [郭亚新, 程凯, 赵以军等. 淡水噬藻体及其他溶藻因子的分布与感染力. 中国环境科学, 2003, 23(2): 167-170. DOI:10.3321/j.issn:1000-6923.2003.02.013] |
| [25] |
Ye X, Cheng K, Xu M et al. PP Cyanophage of the ecological distribution and phylogenetic preliminary study. Journal of Central China Normal University: Natural Sciences, 2010, 44(1): 109-114. [叶新, 程凯, 许敏等. PP类噬藻体的生态分布及系统进化研究. 华中师范大学学报: 自然科学版, 2010, 44(1): 109-114. DOI:10.3321/j.issn:1000-1190.2008.01.021] |
| [26] |
Zhao YJ, Cheng K, Shi ZL et al. The first isolation and identification of cyanophage in China. Progress in Natural Science, 2002, 12(9): 923-927. [赵以军, 程凯, 石正丽等. 我国首株噬藻体(蓝藻病毒)的分离与鉴定. 自然科学进展, 2002, 12(9): 923-927.] |
| [27] |
Fujimoto N, Sudo R, Sugiura N et al. Nutrient-limited growth of Microcystis aeruginosa and Phormidium tenue and competition under various N: P supply ratios and temperatures. Limnology and Oceanography, 1997, 42(2): 250-256. DOI:10.4319/lo.1997.42.2.0250 |
| [28] |
Singh Y, Khattar JS, Singh DP et al. Limnology and cyanobacterial diversity of high altitude lakes of Lahaul-Spiti in Himachal Pradesh, India. Journal of Biosciences, 2014, 39(4): 643-657. DOI:10.1007/s12038-014-9458-4 |
| [29] |
McAllister T G, Wood S A, Hawes I. The rise of toxic benthic Phormidium proliferations: A review of their taxonomy, distribution, toxin content and factors regulating prevalence and increased severity. Harmful Algae, 2016, 55: 282-294. DOI:10.1016/j.hal.2016.04.002 |
| [30] |
Srivastava A, Ahn CY, Asthana RK et al. Status, alert system, and prediction of cyanobacterial bloom in South Korea. BioMed Research International, 2015, 2015: 584696. DOI:10.1155/2015/584696 |
| [31] |
Iwayama A, Ogura H, Hirama Y et al. Phytoplankton species abundance in Lake Inba (Japan) from 1986 to 2016. Ecological Research, 2017, 32(6): 783. DOI:10.1007/s11284-017-1482-z |
| [32] |
Chaturvedi P, Kumar A M, Nath B S. Microcystin-producing and non-producing cyanobacterial blooms collected from the Central India Harbor potentially pathogenic Vibrio cholerae. Ecotoxicology and Environmental Safety, 2015, 115: 67-74. DOI:10.1016/j.ecoenv.2015.02.001 |
| [33] |
Sinang SC, Poh KB, Shamsudin S et al. Preliminary assessment of cyanobacteria diversity and toxic potential in ten freshwater lakes in Selangor, Malaysia. Bulletin of Environmental Contamination and Toxicology, 2015, 95(4): 542-547. DOI:10.1007/s00128-015-1620-7 |
| [34] |
Wood SA, Puddick J, Fleming R et al. Detection of anatoxin-producing Phormidium in a New Zealand farm pond and an associated dog death. New Zealand Journal of Botany, 2017, 55(1): 36-46. DOI:10.1080/0028825X.2016.1231122 |
| [35] |
Allen MB, Arnon DI. Studies on nitrogen-fixing blue-green algae. I. growth and nitrogen fixation by Anabaena cylindrica lemm. Plant Physiology, 1955, 30(4): 366-372. DOI:10.1104/pp.30.4.366 |
| [36] |
Wilhelm S, Weinbauer M, Suttle C A. Manual of aquatic viral ecology. Manual of Aquatic Viral Ecology. ASLO, 2010, 118-133. |
| [37] |
Levitan O, Rosenberg G, Setlik I et al. Elevated CO2 enhances nitrogen fixation and growth in the marine cyanobacterium Trichodesmium. Global Change Biology, 2007, 13(2): 531-538. DOI:10.1111/j.1365-2486.2006.01314.x |
| [38] |
Hutchins DA, Fu FX, Zhang Y et al. CO2 control of Trichodesmium N2 fixation, photosynthesis, growth rates, and elemental ratios: Implications for past, present, and future ocean biogeochemistry. Limnology and Oceanography, 2007, 52(4): 1293-1304. DOI:10.4319/lo.2007.52.4.1293 |
| [39] |
Miśkiewicz E, Ivanov AG, Williams JP et al. Photosynthetic acclimation of the filamentous Cyanobacterium, Plectonema boryanum UTEX 485, to temperature and light. Plant and Cell Physiology, 2000, 41(6): 767-775. DOI:10.1093/pcp/41.6.767 |
| [40] |
Badger MR, Price GD, Long BM et al. The environmental plasticity and ecological genomics of the cyanobacterial CO2 concentrating mechanism. Journal of Experimental Botany, 2006, 57(2): 249-265. DOI:10.1093/jxb/eri286 |
| [41] |
Lürling M, Eshetu F, Faassen EJ et al. Comparison of cyanobacterial and green algal growth rates at different temperatures. Freshwater Biology, 2013, 58(3): 552-559. DOI:10.1111/j.1365-2427.2012.02866.x |
| [42] |
Niu XY, Cheng K, Rong QQ et al. The combined effects of elevated CO2 and elevated temperature on proliferation of cyanophage PP. Acta Ecologica Sinica, 2012, 32(22): 6917-6924. [牛晓莹, 程凯, 荣茜茜等. CO2浓度和温度升高对噬藻体PP增殖的联合作用. 生态学报, 2012, 32(22): 6917-6924. DOI:10.5846/stxb201110181547] |
| [43] |
Boonchai R, Kaewsuk J, Seo G. Effect of nutrient starvation on nutrient uptake and extracellular polymeric substance for microalgae cultivation and separation. Desalination and Water Treatment, 2015, 55(2): 360-367. DOI:10.1080/19443994.2014.939501 |
| [44] |
Knecht L E, Veljkovic M, Fieseler L. Diversity and function of phage encoded depolymerases. Frontiers in Microbiology, 2020, 10: 2949. DOI:10.3389/fmicb.2019.02949 |
| [45] |
Benedí VJ, Regué M, Albertí S et al. Influence of environmental conditions on infection of Klebsiella pneumoniae by two different types of bacteriophages. Canadian Journal of Microbiology, 1991, 37(4): 270-275. DOI:10.1139/m91-042 |
| [46] |
Samimi B, Drews G. Adsorption of cyanophage AS-1 to unicellular cyanobacteria and isolation of receptor material from Anacystis nidulans. Journal of Virology, 1978, 25(1): 164-174. DOI:10.1128/JVI.25.1.164-174.1978 |
| [47] |
Xiong ZZ, Wang YL, Dong YL et al. Cyanophage A-1(L) adsorbs to lipopolysaccharides of Anabaena sp. strain PCC 7120 via the tail protein lipopolysaccharide-interacting protein (ORF36). Journal of Bacteriology, 2019, 201(2): e00516-e00518. DOI:10.1128/JB.00516-18 |
| [48] |
Steenhauer LM, Wierenga J, Carreira C et al. Isolation of cyanophage CrV infecting Cylindrospermopsis raciborskii and the influence of temperature and irradiance on CrV proliferation. Aquatic Microbial Ecology, 2016, 78(1): 11-23. DOI:10.3354/ame01800 |
| [49] |
Parada V, Herndl GJ, Weinbauer MG. Viral burst size of heterotrophic prokaryotes in aquatic systems. Journal of the Marine Biological Association of the United Kingdom, 2006, 86(3): 613-621. |
| [50] |
Gnezda-Meijer K, Mahne I, Poljšak-Prijatelj M et al. Host physiological status determines phage-like particle distribution in the lysate. FEMS Microbiology Ecology, 2006, 55(1): 136-145. DOI:10.1111/j.1574-6941.2005.00008.x |
| [51] |
Weinbauer MG. Ecology of prokaryotic viruses. FEMS Microbiology Reviews, 2004, 28(2): 127-181. DOI:10.1016/j.femsre.2003.08.001 |
| [52] |
Zhang QY. Genes associated with cyanophage infection: A review. Microbiology China, 2020, 47(10): 3277-3286. [张奇亚. 噬藻体感染相关基因的研究进展. 微生物学通报, 2020, 47(10): 3277-3286. DOI:10.13344/j.microbiol.china.200527] |
| [53] |
Bidnenko E, Chopin A, Ehrlich S et al. Activation of mRNA translation by phage protein and low temperature: The case of Lactococcus lactis abortive infection system AbiD1. BMC Molecular Biology, 2009, 10: 4. DOI:10.1186/1471-2199-10-4 |
| [54] |
Kumar SS, Takeda Y, Kanamaru S et al. Association and dissociation of the cell puncturing complex of bacteriophage T4 is controlled by both pH and temperature. Biochimica et Biophysica Acta, 2006, 1764(9): 1487-1492. DOI:10.1016/j.bbapap.2006.07.007 |
| [55] |
Löf D, Schillén K, Jönsson B et al. Forces controlling the rate of DNA ejection from phage lambda. Journal of Molecular Biology, 2007, 368(1): 55-65. DOI:10.1016/j.jmb.2007.01.076 |
| [56] |
Szekeres M, Szmidt AE, Török I. Evidence for a restriction/modification-like system in Anacystis nidulans infected by cyanophage AS-1. European Journal of Biochemistry, 1983, 131(1): 137-141. DOI:10.1111/j.1432-1033.1983.tb07240.x |
| [57] |
Zhao FQ, Zhang XW, Liang CW et al. Genome-wide analysis of restriction-modification system in unicellular and filamentous cyanobacteria. Physiological Genomics, 2006, 24(3): 181-190. DOI:10.1152/physiolgenomics.00255.2005 |
| [58] |
Stucken K, Koch R, Dagan T. Cyanobacterial defense mechanisms against foreign DNA transfer and their impact on genetic engineering. Biological Research, 2013, 46(4): 373-382. DOI:10.4067/S0716-97602013000400009 |
| [59] |
Sanders ME, Klaenhammer TR. Phage resistance in a phage-insensitive strain of Streptococcus lactis: Temperature-dependent phage development and host-controlled phage replication. Applied and Environmental Microbiology, 1984, 47(5): 979-985. DOI:10.1128/aem.47.5.979-985.1984 |
| [60] |
Guimont C, Henry P, Linden G. Restriction/modification in Streptococcus thermophilus: Isolation and characterization of a type Ⅱ restriction endonuclease Sth455I. Applied Microbiology and Biotechnology, 1993, 39(2): 216-220. DOI:10.1007/BF00228609 |
| [61] |
Dempsey RM, Carroll D, Kong HM et al. Sau42I, a BcgI-like restriction-modification system encoded by the Staphylococcus aureus quadruple-converting phage π42. Microbiology, 2005, 151(4): 1301-1311. DOI:10.1099/mic.0.27646-0 |
| [62] |
Emond E, Holler BJ, Boucher I et al. Phenotypic and genetic characterization of the bacteriophage abortive infection mechanism AbiK from Lactococcus lactis. Applied and Environmental Microbiology, 1997, 63(4): 1274-1283. DOI:10.1128/aem.63.4.1274-1283.1997 |
| [63] |
Tangney M, Fitzgerald GF. AbiA, a lactococcal abortive infection mechanism functioning in Streptococcus thermophilus. Applied and Environmental Microbiology, 2002, 68(12): 6388-6391. DOI:10.1128/AEM.68.12.6388-6391.2002 |
| [64] |
Verschoor AM, Van dijk MA, Huisman J et al. Elevated CO2 concentrations affect the elemental stoichiometry and species composition of an experimental phytoplankton community. Freshwater Biology, 2013, 58(3): 597-611. DOI:10.1111/j.1365-2427.2012.02833.x |
| [65] |
Verspagen JMH, Van de Waal DB, Finke JF et al. Contrasting effects of rising CO2 on primary production and ecological stoichiometry at different nutrient levels. Ecology Letters, 2014, 17(8): 951-960. DOI:10.1111/ele.12298 |
 2023, Vol. 35
2023, Vol. 35 


