(2: 南昌大学鄱阳湖环境与资源利用教育部重点实验室, 南昌 330031)
(3: 南昌大学生命科学学院, 南昌 330031)
(4: 江西省生态环境科学研究与规划院, 南昌 330039)
(5: 中国科学院水生生物研究所, 武汉 430072)
(2: Key Laboratory of Poyang Lake Environment and Resource Utilization of Ministry of Education, Nanchang University, Nanchang 330031, P. R. China)
(3: School of Life Science, Nanchang University, Nanchang 330031, P. R. China)
(4: Jiangxi Academy of Eco-Environmental Sciences & Planning, Nanchang 330039, P. R. China)
(5: Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P. R. China)
伴随人口数量的增加、社会经济的持续发展,工业有机废水和城市污水造成的点源污染以及农业和渔业生产造成的面源污染进入湖泊中,导致很多湖泊富营养化进程加剧,湖泊生态系统结构和功能退化,生态系统服务价值下降[1-2]。因此,富营养化湖泊治理是生态环境保护领域的一个重要研究热点。沉水植物在所有水生植物类群中与水体环境关系最为密切,它占据水体和底质的主要界面,可通过减少风浪引起的底泥再悬浮、大量吸收营养、分泌克藻有机物、为浮游动物提供避难所等途径来维持湖泊清水稳态[3]。通过恢复水生植被,特别是沉水植被,培植草型湖泊生态系统来控制富营养化和净化水质是富营养化湖泊治理的一个有效途径[4-5]。然而,在富营养湖泊中恢复沉水植被成效欠佳,其主要原因是富营养湖泊的部分环境条件已经不适宜沉水植物生长或锚定,需要对环境条件进行人工干预和调控,而目前对沉水植物生长的环境条件认识仍不足[4]。
影响富营养湖泊中沉水植物生长和锚定的主要因素为光照条件和沉积物特征[6-7]。一方面在湖泊水体富营养化过程中,水体氮磷含量增加,促进浮游植物和附着藻类的快速生长,导致到达植物叶片表面的有效光合辐射显著减少[8],抑制沉水植物生长。另一方面,在湖泊富营养化过程中,沉积物的理化性质发生了显著变化[9-12],主要体现为沉积物中有机质含量升高,大量有机质分解形成厌氧环境,积累有毒有害物质,沉水植物的根系生长受到抑制甚至出现烂根情况,引起植物生长受限甚至死亡[13-15]。同时随着有机质含量增加,沉积物密度和稳定性降低,呈流体、半流体状态,不利于沉水植物的锚定,易受到风浪、鱼类活动等外界因素的干扰,引起沉水植物倒根漂浮[16-17]。此外,为了削减内源营养负荷,部分富营养化湖泊需要开展沉积物疏浚工程,疏浚深度过小导致沉积物的有机质含量仍然较高,疏浚深度过大导致沉积物过于贫瘠,都不利于沉水植物的生长[18-19]。
沉积物是沉水植物生长和锚定的介质,沉积物质量是决定沉水植被能否成功恢复的关键因素之一。沉水植物虽然可以从水中获取生长所需的营养物质,但沉积物仍是沉水植物最重要的营养来源[20-23]。此外,沉积物的其它理化性质(如含水量、密度、机械组成、硫化物等)也与沉水植物的生长和锚定密切相关[20]。因此明确生态修复常用沉水植物生长和锚定的沉积物条件,对评估拟修复湖泊沉积物是否适宜沉水植物生长、特定修复区域的物种选择和指导改善沉积物质量(疏浚、添加改良剂等)有重要意义。
目前已有较多学者对沉积物与沉水植物的关系开展了研究,但是仍缺乏对生态修复常用沉水植物生长和锚定条件的系统总结。因此,本研究以沉水植物黑藻(Hydrilla verticillata)为例,首先通过挖掘文献数据初步确定黑藻生长和锚定的沉积物理化参数范围,然后通过控制实验对上述结果进行验证和扩充,最后和野外调查数据进行对比和验证,从而为黑藻恢复工程设计提供初步的沉积物边界条件数据,也为其它生态修复常用沉水植物的类似研究提供方法上的借鉴。
1 材料和方法 1.1 植物的选择黑藻为单子叶植物水鳖科(Hydrocharitaceae)多年生沉水草本植物,广泛分布于我国东北、华北、华中、华东、华南和西南地区,分布生境多种多样,河流、湖泊、水塘、沟渠、甚至是稻田都有分布[24]。黑藻的繁殖方式包括有性繁殖与无性繁殖,通常以休眠芽进行无性繁殖[25]。黑藻可通过地上休眠芽撒播和顶枝扦插的方式引入恢复区域,操作简单,条件适宜时存活率高[26],存活后具有很强的分枝能力和营养繁殖能力[27-28]。同时黑藻生物量高,净化水质能力强,能够降低沉积物营养负荷,耐污性好,常在富营养化水体沉水植被恢复工程中作为先锋物种[29-30]。
1.2 文献数据收集与分析通过登陆中国知网、Web of Science两个数据库,以黑藻、Hydrilla verticillata为关键词进行文献检索,中国知网的检索时间为1980年1月1日-2022年8月30日,Web of Science的检索时间为1983年1月1日-2022年8月30日,筛选出研究沉积物条件与黑藻生长、锚定关系的相关文献,并对收集的文献中引用的相关参考文献进行查阅,对符合条件的也纳入后续分析。文献筛选完成后,根据数据的来源场所,分野外调查和室外实验分别进行定性和定量分析,由于控温控光的室内实验条件下植物的生长可能与自然条件下差别较大,不纳入分析,只作为论文结果解析时参考。
定性分析的目的是明确黑藻能够正常生长和锚定的沉积物理化参数范围。黑藻在野外调查中特定沉积物条件下(对应1个或多个沉积物参数值)能正常生长的判断标准为:该沉积物条件下有黑藻存在的定性记录;黑藻在控制实验中特定沉积物条件下能正常生长的判断标准为:该沉积物条件下实验结束时的植物生物量大于初始生物量;黑藻在特定沉积物条件下能够正常锚定的判断标准为:该沉积物条件下黑藻的锚定力大于受到的水的拖曳力。基于文献数据得到的黑藻能正常生长和锚定的沉积物理化参数范围为各文献给出的相应参数范围的并集。
定量分析的目的是分析黑藻的相对生长率随沉积物参数变化的趋势,因此需要收集文献中给出的黑藻的相对生长率数据及对应的沉积物参数值。对于只用图表示的数据,通过Engague Digitize软件对文献中给出的沉积物参数、黑藻生长和锚定参数进行提取转换为数字形式。对于未给出植物相对生长率,但是给出初始和结束时植物生物量的文献,通过实验初始和结束时的生物量计算植物的相对生长率[31-32]。最后将通过文献收集的数据和本研究中控制实验的数据整合在一起,进行统计分析。
部分实验涉及多因子的交互作用,在进行定量数据分析时,没有考虑因子交互作用,分析某一特定环境因子对植物生长参数的影响时是假定其它环境因子是相对适宜的(即当有其它因子影响目标因子效应时,只选择其它因子水平中相对适宜植物生长的数据)。对于部分文献中明显异常的数据,不纳入定性定量分析。
1.3 控制实验 1.3.1 实验设计为了验证和扩充由文献分析确定的黑藻生长和锚定的沉积物条件,从未来拟进行生态修复的城市湖泊取柱状沉积物,测定沉积物的理化参数,然后在户外水池中培养黑藻,最后测定黑藻的生长和锚定参数,用来评估选取的湖泊沉积物是否适宜黑藻的生长和锚定,并将结果与文献数据确定的沉积物条件进行对比。黑藻的培养周期为2021年7月17日-9月7日,共计51天,期间连续观测植物生长情况,如繁殖体不能萌发生长或植物中途死亡,则表明该沉积物不能支持黑藻的正常生长,如果植物最终生物量大于种植时的起始生物量则表明植物能够生长;对于能够生长的植物,在收获时测定其锚定力;计算黑藻在拟修复湖泊中可能受到的拖曳力,与测定的锚定力对比,判断黑藻是否能在待恢复水域稳定定植。
1.3.2 湖泊选择选择南昌市2个湖泊——前湖和青山湖。作为重要的城市景观水体,两个湖泊都没有沉水植物分布,水体生态环境质量较差,是未来需要重点治理和修复的湖泊。在采集沉积物的同时,对两个湖泊的水质情况进行测定,2个湖泊(平均值±标准差)的pH分别为6.90±0.13、6.61±0.01,电导率分别为(301.8±10.5)、(183.7±2.7) μS/cm,总氮分别为(3.72±1.217)、(1.80±0.034) mg/L,总磷分别为(0.12±0.080)、(0.10±0.004) mg/L,氨氮分别为(2.64±0.04)、(1.04±0.17) mg/L,叶绿素a分别为(78.4±54.6)、(141.4±39.9) μg/L,透明度/水深分别为0.31±0.07、0.15±0.01。
1.3.3 沉积物采集在2021年7月5日-7月6日,用内径5 cm的柱状采泥器分别采集南昌市青山湖(3个点位)、前湖(5个点位)的原位柱状沉积物,每个点位各5份,其中3份用于重复实验,2份用于检测初始指标,沉积物采样管高30 cm,当湖泊底部为硬质底,采集的沉积物不足30 cm时,用适宜大小的顶托装置将沉积物从采样管下端顶至上端距上口2~3 cm的位置,然后将采样管放入不锈钢采样管架中固定。
1.3.4 植物种植选择24株生物量相近(鲜重约1 g),长势一致,长度为10 cm的黑藻顶枝分别种植于沉积物中,种植深度为2~3 cm;将不锈钢采样管架放入南昌大学生物园内的室外水池(长6 m;宽4 m;深1.6 m)中水深1 m处的不锈钢阶梯架上,水池中装满了经过充分曝气的自来水,沉积物表面距水面约60 cm。
1.3.5 实验过程水质监测水池内水的总氮、总磷和氨氮含量每两周测定一次,电导率、pH、溶氧、水温、叶绿素a、消光系数每周测定一次[33]。
1.3.6 沉积物物理化学指标测定通过查阅文献,本研究选择的沉积物参数包括粒径组成、有机质、总氮、总磷、含水率、密度、碱解氮、速效磷、硫化物。种植植物前将8个点位中用于初始指标检测的一份沉积物样品拿出,各取采样管上层10 cm沉积物装入自封袋,带回实验室混匀后利用铝盒(直径4 cm,高2.5 cm)盛满鲜土,放置于105℃烘箱内烘干6~8 h至恒重,称量土样前后质量,计算沉积物的密度和含水率;剩余的土样置于敞口容器中进行风干处理,风干后取20 g沉积物利用湿式筛分法测定沉积物粒径组成(砾石:>2 mm、砂:>0.063 mm、粉砂和黏土:xy 0.063 mm),剩余沉积物磨碎过100目筛(孔径147 μm),用灼烧法测定沉积物有机质含量、凯氏定氮法测定总氮、钼锑抗比色法测定总磷、碳酸氢钠浸提-比色法测定速效磷、碱解扩散法测定碱解氮[34]。另一份沉积物样品在水池中采用薄膜扩散梯度(DGT)技术[35]测定硫化物。
1.3.7 植物生长指标、锚定能力测定待植物培养周期结束后,将采样管架提至水面利用数显式拉力计测定植株的锚定力;锚定力测定完成后收获植物地上部分,随后将采样管内的沉积物装入自封袋带回实验室,利用清水清洗植物,对植株地上部分、根进行区分,沥干水分装入信封,放置于60℃烘箱48 h以上至恒重,记录地上部分生物量、根生物量并计算植株的相对生长率[31]。
锚定力测定的具体方法为:(a)用软绳缠绕在植株基部;(b)然后利用量程为0~5 N的数显式拉力计挂钩钩住软绳;(c)缓慢拔出,记录植株拔出沉积物过程中的最大瞬时值,即为植株的锚定力大小;在拔出的过程中,如力超过拉力计量程则更换为更大量程的数显式拉力计。
参照Schutten[36],计算植物受水流的拖拽力,公式为:
| F=Amv1.5 | (1) |
式中,F为植株受到的拖拽力(N),A为植株的粗糙系数,m为植株的地上部分干重(kg),v为水流速度(m/s),流速可根据待修复水域可能遇到的最大流速设定,由于缺乏两个湖泊的流速数据,本研究参照Schutten[17],用0.6 m/s计算,与正常情况下的湖泊相比,这个流速值相对较高,该流速是在风暴等极端条件下湖泊可能会有的流速[17, 37]。其中植物的粗糙系数参照Schutten[36]中与黑藻形态近似的伊乐藻(Elodea canadensis)的系数(A=1362)。当植物锚定力大于拖拽力的时候,表明该沉积物条件下沉水植物可以稳定定植,反之则表明该沉积物条件下沉水植物不能稳定定植。
1.4 野外调查 1.4.1 湖泊选择洱海是云南省第二大淡水湖泊,沉水植物分布面积大(约24 km2),植物生长的沉积物理化参数范围跨度较大,是研究沉积物理化参数与植物生长关系的理想场所。
1.4.2 采样方法及指标测定于2022年6月28日-7月4日对沿洱海湖岸的98个样带[38]进行沉水植物调查,每条样带由湖岸向湖心设置采样点,为了避免光照条件不同对黑藻生长的影响干扰调查结果,选择在0.5~3 m水深区域进行植物采集,该范围内光照相对充足(洱海沉水植物可分布至5.5~6 m)。当样带内目视发现黑藻时设置为一个采样点,每个采样点用自制的水下镰刀(采集面积约为0.2 m2)采集沉水植物,每个样方内植物按种类分开,洗去泥沙和附着物,沥干浮水,称量植物的鲜重。此次调查共在其中39条样带上采集到包含黑藻的样方61个,水深分布范围为0.5~3.1 m。在采集沉水植物的同时,在植物样方正下方用柱状采泥器采集一份沉积物带回实验室,取上层10 cm的沉积物测定有机质含量、密度、含水率(检测方法同1.3.6)。
1.5 数据分析本研究涉及文献分析、控制实验和野外调查3组数据,3组数据间可相互验证和补充。当3组数据间有明显矛盾时,将对数据进行核查和矛盾原因分析;当3组数据间没有明显矛盾,3组数据互为补充,在确定黑藻正常生长和锚定的参数范围和适宜区间时,取3组数据的并集。
统计分析均采用R软件[39]进行。对于控制实验,首先利用“psych”包对沉积物中的理化指标进行“pearson”分析,评估各参数之间的相关性,然后利用广义加性模型分析沉积物理化参数与黑藻相对生长率和锚定力的关系。广义加性模型属于非参数模型的一种,不需要事先假定自变量和因变量之间符合某种特定关系,能应用非参数的方法检测数据结构,并找出其中的规律,因而适用于探索性寻找数据规律的分析。广义加性混合模型采用R软件“mgcv”包的“gam”函数进行构建,平滑函数选择默认的薄板样条平滑函数(thin plate regression spline),数据分布选择高斯分布[39]。在分析沉积物理化参数与黑藻锚定力时,只选择有机质含量、密度、含水率和粉砂+黏土的百分比(<0.063 mm)4个与锚定力关系最为密切的指标[16]。最后将控制实验数据整合到文献挖掘的数据中,利用广义加性模型重新分析沉积物理化参数与黑藻相对生长率的关系,作为确定适宜黑藻生长的沉积物理化参数范围的依据。
由于适宜沉水植物生长的沉积物条件没有明确的规定,本研究以广义加性模型拟合曲线顶点(即拟合的植物的最大相对生长率)为参照点,以能维持50 % 及以上最大相对生长率的沉积物理化参数范围为适宜黑藻生长的适宜区间。当曲线两边的端点仍大于50 % 最大相对生长率时,暂取端点为边界点,超过边界点的范围待未来的研究进行补充。对于野外调查数据,以沉积物参数为横坐标,以样方生物量为纵坐标,先将生物量最高的10 % 的样方生物量数值求平均,然后以此平均值的50 % 代表的值为参照,将大于等于该参照的所有样方中对应的最大和最小的沉积物理化参数值间的范围确定为适宜黑藻生长的区间。
2 结果与分析 2.1 基于文献数据的黑藻生长和锚定的沉积物条件需求根据上文所述方法,筛选到符合条件的黑藻文献22篇,其中5篇用于定量分析。文献中涉及影响黑藻生长和锚定的沉积物参数主要包括有机质、总氮、总磷、含水率、密度、速效磷、硫化物等,其中涉及沉积物有机质含量、密度、含水率、总氮、总磷的研究较多。
定性分析发现,室外实验中黑藻在沉积物有机质含量为0.16 % ~38.36 %、密度为1.12~1.64 g/cm3、含水率为26.21 % ~67.33 %、总氮为0.19~7.23 g/kg、总磷为0.10~2.15 g/kg、硫化物<1.27 mmol/L(实验期间的均值)的范围内均能够存活生长,在沉积物有机质含量为0.13 %、总氮为0.05 g/kg、总磷为0.09 g/kg时出现死亡(表 1)。
| 表 1 基于文献数据的黑藻正负生长的沉积物理化参数范围 Tab. 1 Ranges of sediment physical and chemical parameters with positive and negative growth of Hydrilla verticillata based on literature data |
仅王瑞[33]研究了黑藻锚定与沉积物性质的关系,根据该文献报道,在沉积物有机质含量为0.29 % ~18.3 %、密度为1.16~1.64 g/cm3、含水率为24.59 % ~61.87 % 时黑藻的锚定力均大于水体产生的拖曳力(假定水体流速为0.6 m/s)。
2.2 控制实验 2.2.1 沉积物特征8个点位的沉积物物理化学指标的检测结果见表 2,结果表明前湖5个采样点的沉积物性质差别较大,有机质含量、密度、含水率分别在1.44 % ~7.76 %、1.61~2.06 g/cm3、19.80 % ~57.84 % 之间,青山湖3个采样点的沉积物性质差别较小,有机质含量、密度、含水率分别在8.14 % ~10.84 %、1.47~1.76 g/cm3、62.87 % ~72.17 % 之间。相比于前湖5个点位的沉积物性质而言,青山湖的沉积物较为肥沃,有机质含量以及总氮、总磷含量都普遍高于前湖的沉积物。除前湖两个点位的机械组成有较多砾石和砂(>0.063 mm)之外,其余点位均以粉砂和黏土(<0.063 mm)为主。
| 表 2 实验开始时沉积物的理化特征 Tab. 2 Physical and chemical characterastics of the sediment at the beginning of the experiment |
实验期间水池水体总氮、总磷、氨氮浓度(平均值±标准差)分别为(0.26±0.11)、(0.05±0.02)、(0.09±0.04) mg/L,水质pH为10.26±0.65,水温在31℃左右。沉积物表面光照达到水面光强的55 %,表明水下光照条件良好,可以排除弱光限制。
2.2.3 沉积物指标间的关系沉积物主要参数的相关性分析结果如表 3所示,沉积物有机质、密度、含水率与多个沉积物指标呈显著相关。总氮和碱解氮相关系数达到0.88,总磷和速效磷相关系数达到0.93。
| 表 3 沉积物主要参数的相关系数矩阵 Tab. 3 Correlation coefficients and significance levels for relationships between physical and chemical parameters of the sediment |
基于广义加性模型的沉积物参数与黑藻相对生长率的分析结果如图 1所示,沉积物的有机质含量、密度、含水率、总氮、总磷、速效磷和硫化物含量均对黑藻的相对生长率有显著性影响(P< 0.05)。黑藻的相对生长率随着沉积物有机质含量、密度、含水率、总氮含量的增加呈现先增大后减小的趋势(图 1a、1b、1c、1d),随着沉积物总磷、速效磷、硫化物的增大而增大(图 1e、1g、1h)。
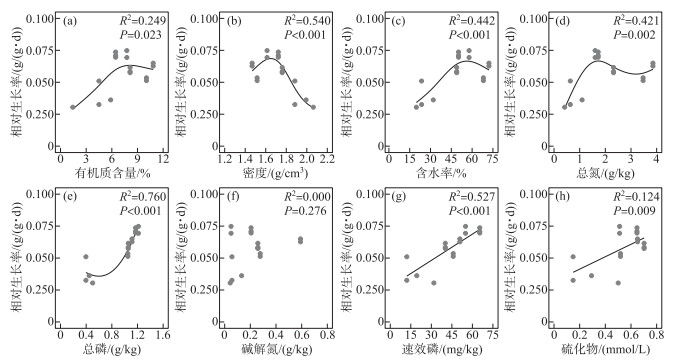
|
图 1 沉积物理化参数与黑藻相对生长率的关系 Fig.1 Relationships between sediment parameters and relative growth rate of Hydrilla verticillata |
基于广义加性模型的沉积物有机质含量对黑藻锚定力的分析结果如图 2所示,沉积物有机质、密度、含水率对锚定力均有显著性影响(P<0.05)。在有机质含量1.44 % ~10.84 %、密度1.47~2.06 g/cm3、含水率19.80 % ~72.17 % 的梯度范围内,黑藻植株的锚定力都呈现先增加后减小的变化趋势,在有机质含量为7.76 %、密度为1.61 g/cm3、含水率为57.84 % 时达到最大值(图 2a、2b、2c),随着粉砂和黏土所占的比例增大而增大(图 2d),且锚定力和拖曳力的差值均大于0(图 2e、2f、2g、2h),即黑藻的锚定力均大于所受到的拖曳力。

|
图 2 沉积物有机质含量、密度、含水率、粉砂和黏土的百分比与植物锚定力、锚定力-拖曳力的关系 Fig.2 Relationships between sediment organic matter content, density, water content, silt and clay percentage and plant anchorage force, anchoring force minus drag force |
文献数据与控制实验数据整合后,基于广义加性模型的沉积物参数与黑藻相对生长率的关系如图 3所示,黑藻的相对生长率整体上随着沉积物有机质含量、密度、含水率、总氮、总磷的增加呈先增大后减小的变化趋势。适宜黑藻生长的沉积物各参数范围分别为有机质0.64 % ~21.84 %、密度1.12~2.06 g/cm3、含水率25.32 % ~72.06 %、总氮0.47~3.84 g/kg、总磷0.18~1.11 g/kg。
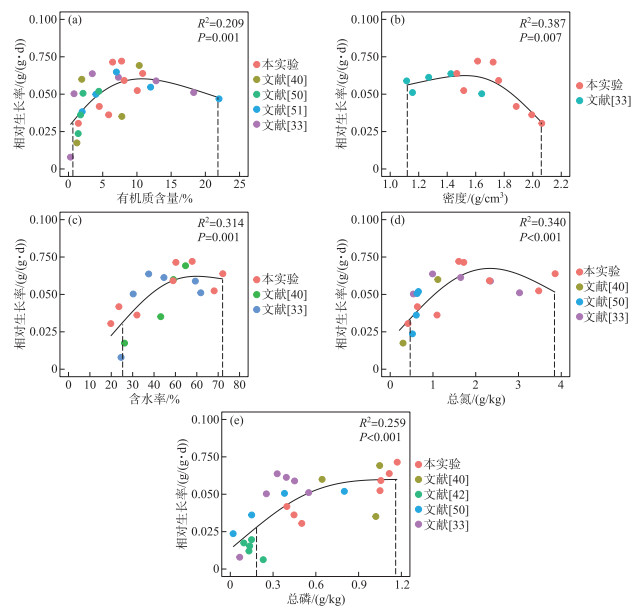
|
图 3 沉积物有机质含量、密度、含水率、总氮、总磷与黑藻相对生长率的关系 (虚线:适宜黑藻生长的沉积物参数区间) Fig.3 Relationships between organic matter content, water content, density, total nitrogen, total phosphorus of sediment and relative growth rate of Hydrilla verticillata (Imaginary line: Range of sediment parameters suitable for Hydrilla verticillata) |
野外调查的样方中黑藻生物量最高可达到5500 g/m2。适宜黑藻生长的沉积物各参数范围分别为有机质含量1.67 % ~10.93 %、密度1.09~1.71 g/cm3、含水率28.07 % ~68.59 % (图 4)。
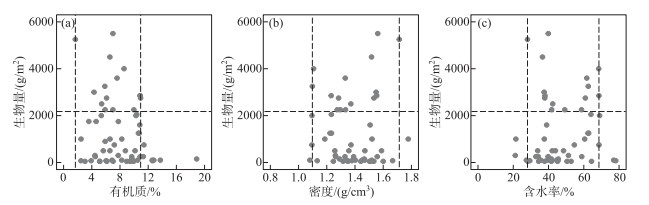
|
图 4 沉积物有机质含量、密度、含水率与黑藻生物量的关系(横虚线:生物量最高的10 % 样方生物量平均值; 竖虚线:适宜黑藻生长的沉积物参数区间) Fig.4 Relationships between organic matter content, water content and density of sediment and biomass of Hydrilla verticillata (Horizontal imaginary line: average quadrat biomass of the top 10 % biomass; Longitudinal imaginary line: range of sediment parameters suitable for Hydrilla verticillata) |
通过控制实验对文献数据进行验证和扩充,以及与野外调查数据进行对比和验证,最终得到更新后的黑藻正负生长沉积物理化参数范围(表 4),其中室外实验中密度和含水率在更新后得到了更宽的范围,同时新增了野外调查的有机质含量、密度、含水率数据。黑藻在沉积物有机质含量为0.64 % ~21.84 %、密度为1.09~2.06 g/cm3、含水率为25.32 % ~72.06 %、总氮为0.47~3.84 g/kg、总磷为0.18~1.11 g/kg范围内适宜生长;在沉积物有机质含量、密度、含水率分别为0.29 % ~18.30 %、1.16~2.06 g/cm3、19.80 % ~72.17 % 的范围内,黑藻植株能够稳定定植。
| 表 4 黑藻正负生长的沉积物理化参数范围(更新后) Tab. 4 Ranges of sediment physical and chemical parameters with positive and negative growth of Hydrilla verticillata (updated) |
为了更好地治理富营养化湖泊、恢复沉水植被,需要明确沉水植物生长和锚定的沉积物条件。已有较多学者对沉积物与沉水植物生长和锚定的关系开展了研究[17, 20, 58],但是仍缺乏对生态修复常用沉水植物生长和锚定的沉积物条件的系统总结。本研究结合文献分析、控制实验和野外调查对黑藻生长和锚定的沉积物条件需求进行了研究,通过3种方法相互验证和补充,初步确定了黑藻在沉积物有机质含量为0.16 % ~38.36 %、密度为1.08~2.06 g/cm3、含水率为19.80 % ~78.14 %、总氮为0.19~7.23 g/kg、总磷为0.10~2.15 g/kg、硫化物<1.27 mmol/L的范围内能正常生长,在沉积物有机质含量为0.64 % ~21.84 %、密度为1.09~2.06 g/cm3、含水率为25.32 % ~72.06 %、总氮为0.47~3.84 g/kg、总磷为0.18~1.11 g/kg范围内适宜生长;在沉积物有机质含量、密度、含水率分别为0.29 % ~18.30 %、1.16~2.06 g/cm3、19.80 % ~72.17 % 范围内,黑藻植株能够稳定定植。
沉积物的多个理化参数都对沉水植物生长具有重要影响,其中沉积物的有机质和营养元素(氮、磷)含量对沉水植物生长的影响是被研究的最多的,也是最为重要的[20]。虽然沉水植物能从水中吸收营养物质,但是沉积物仍是供应沉水植物营养元素的主体[59],而沉积物有机质含量与氮磷含量有密切的关联,通常有机质含量高的沉积物,氮磷含量也高[60]。本研究的控制实验数据也表明沉积物有机质含量与总氮、总磷含量呈较强的正相关关系,而沉积物中总氮、总磷含量又可以很好地反映沉积物中植物可利用态的氮磷(碱解氮、速效磷)的含量。现有的数据表明,黑藻能在较宽的有机质、总氮、总磷含量范围(0.16 % ~38.36 %、0.19~7.23 g/kg、0.10~2.15 g/kg)内生长。但是过于贫瘠的沉积物无法支撑黑藻的生长,陈开宁等[52]发现在贫瘠的砂石沉积物(有机质含量0.13 %、总氮含量0.05 g/kg、总磷含量0.09 g/kg)中黑藻出现了死亡,王瑞[39]也发现在水深较深时(1.6 m),黑藻在红壤中(有机质含量0.29 %、总氮含量0.21 g/kg、总磷含量0.07 g/kg)不能维持正生长。沈亚强[61]对长江中下游35个湖泊的调查发现,这些湖泊沉积物有机质范围为0.45 % ~26.80 %,这表明该区域内大多数的湖泊沉积物都能支持黑藻的生长。综合文献和控制实验数据,黑藻的相对生长率随沉积物有机质呈先增加后下降的趋势,并且拟合曲线呈左偏分布,在低有机质范围内,黑藻相对生长率随沉积物有机质含量增加快速增加,而后保持相对稳定,当有机质含量升高到一定值以后,黑藻的相对生长率又开始下降,但下降缓慢,在沉积物有机质达到21.84 %,黑藻仍然维持较高的相对生长率。沉水植物穗状狐尾藻(Myriophyllum spicatum)也呈现出类似的规律[60]。这可能是因为在低有机质范围内,随着有机质含量增加,沉积物营养元素含量(特别是氮磷)也增加,植物相对生长率也相应的增加,在中等含量有机质范围内,营养不再是植物生长的限制因子,植物相对生长率保持相对稳定,当沉积物有机质含量进一步增加时,高含量有机质的分解造成的缺氧、有毒物质的积累则会抑制黑藻的生长[14, 20, 60],但是在光照充足时,植物对高有机质胁迫有较强的耐受能力[58],如杨娇[43]发现当有机质含量达到38.36 %,黑藻仍能存活。洱海调查数据显示黑藻在有机质范围为1.67 % ~10.93 % 有较高的单位面积生物量(>2175 g/m2),这一区间落在基于文献和控制实验数据确定的适宜黑藻生长的范围内,主要原因是在自然湖泊中,黑藻的分布还受多种因素的影响,特别是其它植物的竞争,会出现一些区域沉积物条件虽然适宜黑藻生长,但是被其它竞争更强的物种占据的情况。
沉积物密度和含水率可以作为反映沉积物有机质、氮磷含量的间接指标,当沉积物密度高,含水率低时,沉积物一般为砂质或硬泥,氮磷含量低;沉积物密度低,含水率高时,沉积物一般为软黑泥,有机质含量高,氮磷含量也高[40, 62]。本研究控制实验中沉积物指标的相关性分析也表明,沉积物各参数间关系紧密,因而用少量的指标就可以表征沉积物的整体情况。现有的数据表明,沉积物氮磷含量较低时会限制黑藻的生长,而沉积物中相对高含量的氮磷对可能不会对黑藻生长产生直接毒害。另外,待修复的富营养湖泊的水体也会为沉水植物提供一定的营养供给[63-64],因此,在自然湖泊中,如果沉积物不是贫瘠的砂质和硬泥,沉积物氮磷通常不会成为沉水植物生长的限制因子,此时测定沉积物有机质、密度和含水率3个容易测定的指标之一可能就足以判断沉水植物的生长情况。而目前较多的文献在研究沉积物与植物生长的关系时没有测定或报道沉积物含水率和密度的数据,建议在以后的类似研究中同时提供这两个指标的数据,为进一步明确沉水植物生长的沉积物条件提供数据支持。高浓度的硫化物对沉水植物有严重的毒害作用[13],而在本研究控制实验中,黑藻的相对生长率随硫化物增加而增加,这主要是因为实验中硫化物浓度仍较低,对植物的作用很小,植物主要受到与硫化物含量相关的其它因素的影响。虽然沉积物中硫化物对植物生长有比较重要的影响,但是该指标在实际湖泊沉积物调查中测定过程繁琐、在时间上变异较大[33],可能难以实际应用于大范围的沉积物适宜性评估。而沉积物中硫化物浓度的升高通常是有机质含量增加导致的[13, 65],因此仍可以用有机质含量间接的反映。综上,根据沉积物各参数对黑藻生长影响的重要性及指标测定的便宜性,可优先选择沉积物有机质含量(烧失重)、含水率、密度3个指标,辅以总磷、总氮、硫化物等指标来确定黑藻生长的沉积物条件需求。
湖泊沉积物是否适宜锚定对沉水植物能否生存和长期生长起着至关重要的作用[17]。Sand-Jensen等[16]研究表明,锚定能力的大小由扎根于湖泊沉积物中植物根系本身的大小以及沉积物的物理特性(密度、含水率等)共同决定。本研究发现,黑藻锚定力随着沉积物中有机质含量、密度和含水率变化呈单峰分布。这是因为,在低有机质范围内,沉水植物根生物量以及根系长度均随有机质含量(营养)的增加而增加,虽然沉积物密度下降,含水率增加,锚定力仍增大,随着有机质含量的继续增加,植物的根系重量和长度不再继续增加,而沉积物的含水率仍在增大、密度在继续减小,从而使得沉积物的稳定性降低,根系与周围沉积物之间的粘性结合力下降,锚定力减小[60]。但是目前文献和本研究涉及的有机质、密度、含水率范围内,黑藻植株被连根拔起的可能性也很小,因为黑藻植株的锚定力均远大于水体中的拖曳力。本研究控制实验中黑藻锚定力随沉积物中粉砂和黏土的比例增加而增加,主要是因为在粉砂和黏土的比例低时,植物生长较差,根系不发达,即使沉积物物理特征是有利于植物锚定的,但其锚定力仍较小,在粉砂和黏土的比例高,植物生长较好,根系发达,虽然此时沉积物物理特征不利于锚定,但植株锚定力仍较大。
尽管本研究初步给出了黑藻生长和锚定的沉积物条件需求,可以为黑藻的恢复提供一定的参考,但是如果拟修复湖泊的沉积物条件超出了本研究的范围,或者希望评估湖泊沉积物条件是否满足其它沉水植物生长和锚定的要求,可以借鉴本研究采用的实验方法:即通过柱状采泥器采集湖泊原位底泥,在光照条件适宜的情况下培养沉水植物,测定沉水植物的相对生长率和锚定力,进而判断拟修复湖泊沉积物是否适宜沉水植物生长和锚定。需要注意的是,利用上述方法评估沉积物是否适宜沉水植物生长和锚定最好选择在夏季,因为沉积物中高含量有机质对植物的毒害作用受温度影响,在温度较高时,有机质分解快,沉积物更容易缺氧、分解,产生的有毒物质积累更为快速,对沉水植物的胁迫更强烈[58]。利用这种方法在夏季获得的数据可以进一步对文献数据进行验证和扩充,最终获得更为准确的沉水植物生长和锚定的沉积物条件。
4 结论通过文献分析、控制实验和野外调查3种方法相互验证和补充,能够较全面地获得沉水植物正常生长和锚定的沉积物参数范围,较好地揭示沉水植物生长和锚定随沉积物理化参数变化的趋势,从而确定适宜沉水植物生长沉积物参数区间。本研究初步明确了适宜黑藻生长和锚定的沉积物条件,可以为黑藻的恢复提供一定的参考。然而,我国湖泊地域分布广泛,沉积物条件变异大,为了得到更全面和准确的黑藻的生长和锚定的沉积物条件需求数据,仍需要更多湖泊的野外调查数据和控制实验数据进行验证和扩充。另外,本研究没有考虑沉积物条件与其它环境因子因子的交互作用对沉水植物的影响,因此无法判断在其它环境因子不利时,适宜的沉积物参数区间内黑藻生长和锚定的情况,未来需加强黑藻及其它沉水植物生长和锚定在多个环境因子互作情形下的定量研究。
致谢: 感谢中国科学院水生生物研究所洱海工作站对本研究野外调查工作的帮助,感谢南昌大学的王广豪、吴鑫、宁紫旋、郭诗园等同学参与本研究的部分控制实验工作。
| [1] |
Xu QJ, Jin XC, Yan CZ. Macrophyte degradation status and countermeasures in China. Ecology and Environment, 2006(5): 1126-1130. [许秋瑾, 金相灿, 颜昌宙. 中国湖泊水生植被退化现状与对策. 生态环境, 2006(5): 1126-1130. DOI:10.3969/j.issn.1674-5906.2006.05.047] |
| [2] |
Yu D, Chong YX, Tu MH et al. Study on the threatened aquatic higher plant species of China. Chinese Biodiversity, 1998, 6(1): 13-21. [于丹, 种云霄, 涂芒辉等. 中国水生高等植物受危种的研究. 生物多样性, 1998, 6(1): 13-21.] |
| [3] |
Jeppeson E, Sondergaard M, Sondergaard M et al. The structuring role of submerged macrophytes in lakes. Springer, 1998, 131. |
| [4] |
Qin BQ. Principles and approach for lake ecological restoration. Acta Ecologica Sinica, 2007, 27(11): 4848-4858. [秦伯强. 湖泊生态恢复的基本原理与实现. 生态学报, 2007, 27(11): 4848-4858. DOI:10.3321/j.issn:1000-0933.2007.11.055] |
| [5] |
Liu ZW, Zhang XF, Chen FZ et al. The responses of the benthic-pelagic coupling to eutrophication and regime shifts in shallow lakes: Implication for lake restoration. J Lake Sci, 2020, 32(1): 1-10. [刘正文, 张修峰, 陈非洲等. 浅水湖泊底栖-敞水生境耦合对富营养化的响应与稳态转换机理: 对湖泊修复的启示. 湖泊科学, 2020, 32(1): 1-10. DOI:10.18307/2020.0101] |
| [6] |
Liu Y, He L, Hilt S et al. Shallow Lakes at risk: Nutrient enrichment enhances top-down control of macrophytes by invasive herbivorous snails. Freshwater Biology, 2021, 66(3): 436-446. DOI:10.1111/fwb.13649 |
| [7] |
Zhang YL, Jeppesen E, Liu XH et al. Global loss of aquatic vegetation in lakes. Earth-Science Reviews, 2017, 173: 259-265. DOI:10.1016/j.earscirev.2017.08.013 |
| [8] |
Phillips G, Willby N, Moss B. Submerged macrophyte decline in shallow lakes: What have we learnt in the last forty years?. Aquatic Botany, 2016, 135: 37-45. DOI:10.1016/j.aquabot.2016.04.004 |
| [9] |
Van Der Molen DT, Portielje R, Boers PCM et al. Changes in sediment phosphorus as a result of eutrophication and oligotrophication in Lake Veluwe, The Netherlands. Water Research, 1998, 32(11): 3281-3288. DOI:10.1016/S0043-1354(98)00117-1 |
| [10] |
Hobæk A, Løvik JE, Rohrlack T et al. Eutrophication, recovery and temperature in Lake Mjøsa: Detecting trends with monitoring data and sediment records. Freshwater Biology, 2012, 57(10): 1998-2014. DOI:10.1111/j.1365-2427.2012.02832.x |
| [11] |
Sand-jensen K, Borum J, Binzer T. Oxygen stress and reduced growth of Lobelia dortmanna in sandy lake sediments subject to organic enrichment. Freshwater Biology, 2005, 50(6): 1034-1048. DOI:10.1111/j.1365-2427.2005.01382.x |
| [12] |
Zhang YD, Yu JL, Su YL et al. Long-term changes of water quality in aquaculture-dominated lakes as revealed by sediment geochemical records in Lake Taibai (Eastern China). Chemosphere, 2019, 235: 297-307. DOI:10.1016/j.chemosphere.2019.06.179 |
| [13] |
Wu J, Cheng SP, Liang W et al. Effects of organic-rich sediment and below-ground sulfide exposure on submerged macrophyte, Hydrilla verticillata. Bulletin of Environmental Contamination and Toxicology, 2009, 83(4): 497-501. DOI:10.1007/s00128-009-9800-y |
| [14] |
Terrados J, Duarte CM, Kamp-Nielsen L et al. Are seagrass growth and survival constrained by the reducing conditions of the sediment?. Aquatic Botany, 1999, 65(1-4): 175-197. DOI:10.1016/S0304-3770(99)00039-X |
| [15] |
van Wijck C, de Groot CJ, Grillas P. The effect of anaerobic sediment on the growth of Potamogeton pectinatus L.: The role of organic matter, sulphide and ferrous iron. Aquatic Botany, 1992, 44(1): 31-49. DOI:10.1016/0304-3770(92)90079-x |
| [16] |
Sand-Jensen K, Møller CL. Reduced root anchorage of freshwater plants in sandy sediments enriched with fine organic matter. Freshwater Biology, 2014, 59(3): 427-437. DOI:10.1111/fwb.12275 |
| [17] |
Schutten J, Dainty J, Davy AJ. Root anchorage and its significance for submerged plants in shallow lakes. Journal of Ecology, 2005, 93(3): 556-571. DOI:10.1111/j.1365-2745.2005.00980.x |
| [18] |
Fan CX, Zhong JC, Zhang L et al. Research progress and prospect of environmental dredging decision-making of lake sediment. J Lake Sci, 2020, 32(5): 1254-1277. [范成新, 钟继承, 张路等. 湖泊底泥环保疏浚决策研究进展与展望. 湖泊科学, 2020, 32(5): 1254-1277.] |
| [19] |
Yu H, Ye C, Song X et al. Comparative analysis of growth and physio-biochemical responses of Hydrilla verticillata to different sediments in freshwater microcosms. Ecological Engineering, 2010, 36(10): 1285-1289. DOI:10.1016/j.ecoleng.2010.06.004 |
| [20] |
Barko JW, Smart RM. Sediment-related mechanisms of growth limitation in submersed macrophytes. Ecology, 1986, 67(5): 1328-1340. DOI:10.2307/1938689 |
| [21] |
Carignan R, Kalff J. Phosphorus sources for aquatic weeds: Water or sediments?. Science, 1980, 207(4434): 987-989. DOI:10.1126/science.207.4434.987 |
| [22] |
Chambers PA, Kaiff J. Depth distribution and biomass of submersed aquatic macrophyte communities in relation to secchi depth. Canadian Journal of Fisheries and Aquatic Sciences, 1985, 42(4): 701-709. DOI:10.1139/f85-090 |
| [23] |
Bolpagni R, Pino F. Sediment nutrient drivers of the growth dynamics of the rare fern Marsilea quadrifolia. Hydrobiologia, 2017, 792(1): 303-314. DOI:10.1007/s10750-016-3064-4 |
| [24] |
朱锦宁. 黑藻属的分子谱系及其生物地理研究[学位论文]. 武汉: 武汉大学, 2015.
|
| [25] |
Liu M, Wang C, Liu MY. The ontogeny of Hydrilla verticillata (l.f.) royle. Bulletin of Botanical Research, 2007, 27(5): 529-533. [刘玫, 王臣, 刘鸣远. 黑藻早期个体发育的研究. 植物研究, 2007, 27(5): 529-533.] |
| [26] |
Zhang M, Liu ZG, Li XQ et al. Screening and application of aquatic vegetation ecological restoration species in shallow lakes in the middle and lower reaches of the Yangtze River. Ecological Science, 2014, 33(2): 344-352. [张萌, 刘足根, 李雄清等. 长江中下游浅水湖泊水生植被生态修复种的筛选与应用研究. 生态科学, 2014, 33(2): 344-352.] |
| [27] |
韦三立. 水生花卉. 北京: 中国农业出版社, 2004.
|
| [28] |
Lian GH, Zhang S. Artificial vegetative reproduction and plantation technique for Elodea nuttallii and six other species of submerged plants. J Lake Sci, 1996, 8(S1): 11-16. [连光华, 张圣照. 伊乐藻等水生高等植物的快速营养繁殖技术和栽培方法. 湖泊科学, 1996, 8(S1): 11-16. DOI:10.18307/1996.sup02] |
| [29] |
Li W, Liu GH, Xiong BH et al. The restoration of aquatic vegetation in lakes of Poyang Lake nature reserve after catastrophic flooding in 1998. Journal of Wuhan Botanical Research, 2004(4): 301-306. [李伟, 刘贵华, 熊秉红等. 1998年特大洪水后鄱阳湖自然保护区主要湖泊水生植被的恢复. 武汉植物学研究, 2004(4): 301-306.] |
| [30] |
Yan Q. Study on application of submerged plant Hydrilla verticillata in aquatic ecosystem restoration. Environment and Development, 2013, 25(8): 94-96. [闫芊. 沉水植物黑藻在水生生态系统修复中的应用研究. 环境与发展, 2013, 25(8): 94-96.] |
| [31] |
Li QS, Huang Q, Li YJ et al. Effects of water depth on growth of submerged macrophytes Vallisneria natans and Myriophyllum spicatum. J Lake Sci, 2019, 31(4): 1045-1054. [李启升, 黄强, 李永吉等. 水深对沉水植物苦草(Vallisneria natans)和穗花狐尾藻(Myriophyllum spicatum)生长的影响. 湖泊科学, 2019, 31(4): 1045-1054. DOI:10.18307/2019.0404] |
| [32] |
Wang R, He L, Zhang M et al. Factors on seed germination, tuber sprout and plant growth of Vallisneria species in China. J Lake Sci, 2021, 33(5): 1315-1333. [王瑞, 何亮, 张萌等. 中国苦草属(Vallisneria)植物萌发与生长的影响因素. 湖泊科学, 2021, 33(5): 1315-1333. DOI:10.18307/2021.0503] |
| [33] |
王瑞. 三种常见沉水植物适生条件研究[学位论文]. 南昌: 南昌大学, 2020.
|
| [34] |
范成新. 湖泊沉积物调查规范. 北京: 科学出版社, 2018.
|
| [35] |
Ding SM, Sun Q, Xu D et al. High-resolution simultaneous measurements of dissolved reactive phosphorus and dissolved sulfide: The first observation of their simultaneous release in sediments. Environmental Science & Technology, 2012, 46(15): 8297-8304. DOI:10.1021/es301134h |
| [36] |
Schutten J, Davy AJ. Predicting the hydraulic forces on submerged macrophytes from current velocity, biomass and morphology. Oecologia, 2000, 123(4): 445-452. DOI:10.1007/s004420000348 |
| [37] |
Qin BQ, Xu PZ, Wu QL et al. Environmental issues of Lake Taihu, China. Hydrobiologia, 2007, 581(1): 3-14. DOI:10.1007/s10750-006-0521-5 |
| [38] |
Li W, He L, Zhu TS et al. Distribution and leaf C, N, P stoichiometry of Vallisneria natans in response to various water depths in a large mesotrophic lake, Lake Erhai, China. J Lake Sci, 2014, 26(4): 585-592. [李威, 何亮, 朱天顺等. 洱海苦草(Vallisneria natans)水深分布和叶片C、N、P化学计量学对不同水深的响应. 湖泊科学, 2014, 26(4): 585-592. DOI:10.18307/2012.0510] |
| [39] |
Team RC. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL. 2020
|
| [40] |
Lin QW, Jin TX, Ma JM et al. Effects of sediment type and positive/negative cutting on growth and physiology of Hydrilla verticillata. Journal of Hydroecology, 2021, 42(1): 91-100. [蔺庆伟, 靳同霞, 马剑敏等. 底质类型与正反扦插对轮叶黑藻生长生理的影响. 水生态学杂志, 2021, 42(1): 91-100. DOI:10.15928/j.1674—3075.201901280031] |
| [41] |
Liu XD, Hou ZY, Xie YH et al. Influence of water level on four typical submerged plants in wetlands of Lake Dongting. J Lake Sci, 2021, 33(1): 181-191. [刘向东, 侯志勇, 谢永宏等. 水位对洞庭湖湿地4种典型沉水植物的影响. 湖泊科学, 2021, 33(1): 181-191.] |
| [42] |
He WK, Cao T, Ni LY et al. Growth of seven submersed macrophytes cultured on five sediment mixtures from the Lake Erhai. Acta Hydrobiologica Sinica, 2017, 41(2): 428-436. [何文凯, 曹特, 倪乐意等. 洱海底泥特性对七种沉水植物生长的影响. 水生生物学报, 2017, 41(2): 428-436. DOI:10.7541/2017.53] |
| [43] |
Yang J, Wang Z, Li EH et al. Characteristics of growth and physiology of Hydrilla verticillata and Ceratophyllum demersum in different sediments in Dianchi Lake. Wetland Science, 2015, 13(4): 430-436. [杨娇, 王智, 厉恩华等. 滇池不同底泥条件下黑藻和金鱼藻的生长生理特征. 湿地科学, 2015, 13(4): 430-436.] |
| [44] |
Zuo JC, Sun SM, Wang YN et al. Effects of GA and IAA on winter buds sprouting and seedling growth of Hydrilla verticillata. Guangdong Agricultural Sciences, 2014, 41(19): 170-173. [左进城, 孙守梅, 王雅宁等. 赤霉素和吲哚乙酸对轮叶黑藻冬芽萌发和幼苗生长的作用. 广东农业科学, 2014, 41(19): 170-173. DOI:10.16768/j.issn.1004-874x.2014.19.014] |
| [45] |
Zhang J, Zhu W, Cao JS et al. Effects of heterogeneity of sediments on growth of submerged macrophytes. Water Resources Protection, 2006, 22(4): 44-46. [张俊, 朱伟, 操家顺等. 水体底质异质性对沉水植物生长的影响. 水资源保护, 2006, 22(4): 44-46.] |
| [46] |
Li W, Cao T, Ni LY et al. Effects of water depth on carbon, nitrogen and phosphorus stoichiometry of five submersed macrophytes in an in situ experiment. Ecological Engineering, 2013, 61: 358-365. DOI:10.1016/j.ecoleng.2013.09.028 |
| [47] |
Zhang XK, Liu XQ, Ding QZ. Morphological responses to water-level fluctuations of two submerged macrophytes, Myriophyllum spicatum and Hydrilla verticillata. Journal of Plant Ecology, 2013, 6(1): 64-70. DOI:10.1093/jpe/rts009 |
| [48] |
Zhu GR, Li W, Zhang M et al. Adaptation of submerged macrophytes to both water depth and flood intensity as revealed by their mechanical resistance. Hydrobiologia, 2012, 696(1): 77-93. DOI:10.1007/s10750-012-1185-y |
| [49] |
Wu ZB, Zuo JC, Ma JM et al. Establishing submersed macrophytes via sinking and colonization of shoot fragments clipped off manually. Wuhan University Journal of Natural Sciences, 2007, 12(3): 553-557. DOI:10.1007/s11859-006-0057-6 |
| [50] |
Yan HM, Qi ZF, Lin C et al. Effects of sediments on submerged macrophytes growth. Journal of Anhui Agri, 2015, 43(29): 283-285. [闫晖敏, 漆志飞, 林超等. 不同基底对沉水植物的生长影响研究. 安徽农业科学, 2015, 43(29): 283-285.] |
| [51] |
Silveira MJ, Thomaz SM. Growth of a native versus an invasive submerged aquatic macrophyte differs in relation to mud and organic matter concentrations in sediment. Aquatic Botany, 2015, 124: 85-91. DOI:10.1016/j.aquabot.2015.03.004 |
| [52] |
Chen KN, Chen XF, Chen WM et al. Effects of different sediments on the growth of four submerged macrophytes. Chinese Journal of Applied Ecolog, 2006, 17(8): 1511-1516. [陈开宁, 陈小峰, 陈伟民等. 不同基质对四种沉水植物生长的影响. 应用生态学报, 2006, 17(8): 1511-1516. DOI:10.18307/2006.0207] |
| [53] |
Gao F, Zhang YM, Yang F et al. Growth and photosynthetic fluorescence characteristics responses of four submersed macrophytes to rising water leve. Journal of Ecology and Rural Environment, 2017, 33(4): 341-348. [高汾, 张毅敏, 杨飞等. 水位抬升对4种沉水植物生长及光合特性的影响. 生态与农村环境学报, 2017, 33(4): 341-348. DOI:10.11934/j.issn.1673-4831.2017.04.007] |
| [54] |
Wu XD, Wang GX, Wei HN et al. Growth responses of Hydrilla verticillata to increasing water levels. J Lake Sci, 2012, 24(3): 384-390. [吴晓东, 王国祥, 魏宏农等. 模拟水位上升对黑藻生长的影响. 湖泊科学, 2012, 24(3): 384-390. DOI:10.18307/2012.0309] |
| [55] |
Zuo JC, Liang W, Xu D et al. The vegetative recovery of Hydrilla verticillata under several harvesting strategies. Journal of Agro-Environment Science, 2011, 30(7): 1391-1397. [左进城, 梁威, 徐栋等. 几种收割策略下轮叶黑藻(Hydrilla verticillata)的生长恢复研究. 农业环境科学学报, 2011, 30(7): 1391-1397. DOI:10.3724/SP.J.0000.2009.20222] |
| [56] |
Li Q, Wang GX. Influence of silts on growth and development of Hydrilla verticillata's seedling in silt waters. Acta Ecologica Sinica, 2010, 30(4): 995-1002. [李强, 王国祥. 水体泥沙对黑藻幼苗生长发育的影响. 生态学报, 2010, 30(4): 995-1002. DOI:10.18307/2007.0214] |
| [57] |
Su HJ, Wu Y, Xia WL et al. Stoichiometric mechanisms of regime shifts in freshwater ecosystem. Water Research, 2019, 149: 302-310. DOI:10.1016/j.watres.2018.11.024 |
| [58] |
Li WC. On the adaptiveness of aquatic macrophyte to the sediment in Wuli Lake. J Lake Sci, 1996, 8(Z1): 30-36. [李文朝. 五里湖底质条件与水生高等植物的适应性研究. 湖泊科学, 1996, 8(Z1): 30-36. DOI:10.18307/1996.sup05] |
| [59] |
Barko JW, Gunnison D, Carpenter SR. Sediment interactions with submersed macrophyte growth and community dynamics. Aquatic Botany, 1991, 41(1/2/3): 41-65. DOI:10.1016/0304-3770(91)90038-7 |
| [60] |
He L, Wang R, Zhang H et al. Growth and anchorage of Myriophyllum spicatum L. in relation to water depth and the content of organic matter in sediment. Frontiers in Environmental Science, 2021, 9: 766413. DOI:10.3389/fenvs.2021.766413 |
| [61] |
沈亚强. 沉水植物的沉积物条件需求研究及云贵高原湖泊、黄河干流植被调查. 北京: 中国科学院大学, 2010.
|
| [62] |
Hoffmann M, Sacher M, Lehner S et al. Influence of sediment on the growth of the invasive macrophyte Najas marina ssp. intermedia in lakes. Limnologica, 2013, 43(4): 265-271. DOI:10.1016/j.limno.2012.11.002 |
| [63] |
Li W, Zhong JY, Yuan GX et al. Stoichiometric characteristics of four submersed macrophytes in three plateau lakes with contrasting trophic statuses. Ecological Engineering, 2017, 99: 265-270. |
| [64] |
Zhu DT, Qiao NN, Li MH et al. Effect of light intensity, temperature, tottal nitrogen concentration and their interaction on Hydrilla verticillata. Acta Hydrobiologica Sinica, 2011, 35(1): 88-97. [朱丹婷, 乔宁宁, 李铭红等. 光强、温度、总氮浓度对黑藻生长的影响. 水生生物学报, 2011, 35(1): 88-97. DOI:10.3724/SP.J.1035.2011.00088] |
| [65] |
Thamdrup B, Fossing H, Jørgensen BB. Manganese, iron and sulfur cycling in a coastal marine sediment, Aarhus Bay, Denmark. Geochimica et Cosmochimica Acta, 1994, 58(23): 5115-5129. DOI:10.1016/0016-7037(94)90298-4 |
 2023, Vol. 35
2023, Vol. 35 


