(2: 大连理工大学,海岸和近海工程国家重点实验室,大连 116024)
(2: State Key Laboratory of Coastal and Offshore Engineering, Dalian University of Technology, Dalian 116024, P.R.China)
湖泊是地表水资源的重要承载者,是流域生态系统中的重要组成部分。我国湖泊众多、分布广泛,张闻松等[1]通过遥感数据测得全国共有1 km2以上湖泊3741个,总面积约93723.00 km2。湖泊富营养化仍然是现阶段我国面临的环境问题之一,根据《2020年中国生态环境状况公报》(摘录)[2],轻度富营养状态占监测湖泊总数的23.6 %,中度富营养状态占比4.5 %,重度富营养状态占比0.9 %。控制氮磷输入总量是一直以来坚持的富营养化防治措施,科学家们也密切关注氮磷在湖泊水体和沉积物中的环境行为[3-4]。近几年有研究者提出气候变化造成的湖泊升温,很可能抵消人类一直以来为改善富营养化所做的努力[5-6],这对湖泊富营养化的缓解提出了新的挑战。
冰封生态环境对湖泊升温响应敏感。一方面,湖泊升温造成冰封时间缩短和冰盖减弱[7],伴随光照增强和水温升高,冰下生物活动增强[8]。以往研究者们认为冬季水生生物处于低温休眠状态,但是越来越多的研究表明,冬季冰下具有较高的初级生产力[9-11]。另一方面,湖泊四季的生态过程相互联系,冬季湖泊生态环境状态影响春季冰盖消失后的营养组成、生物群落结构和生物量[12-13]。因此,了解冬季湖泊冰下的初级生产力水平,对研究全球变暖背景下的水体生态环境变化过程是非常重要的。水质较好的湖泊中,初级生产者包括水生植物、浮游植物等,但是随着湖泊富营养化程度的加深,沉水植物逐渐减少,浮游植物在初级生产力中的贡献逐渐增大[14],从以沉水植物占优势的“清水态”转换为以浮游植物占优势的“浊水态”。那么,当浮游植物成为主要的初级生产者时,冰封期初级生产力是什么水平;冰雪覆盖会直接影响真光层的深度,这是否显著影响浮游植物的初级生产力;有观点认为变暖增加浮游植物的初级生产力,加快冷水湖泊中藻型湖泊的形成[15],那么温度对冰下初级生产力的变化起何种作用。为了讨论这些问题,本文聚焦冰盖生消过程中光照、水温对以浮游植物初级生产力的驱动作用,旨在揭示冰物理过程与冰下生态环境演变的联系。
初级生产力计算方法主要有4种:黑白瓶法、同位素法、叶绿素法和模型估算法。其中,模型估算法利用遥感技术测定水面浮游植物叶绿素浓度,在此基础上建立初级生产力深度垂向归纳模型(vertically generalized production model,VGPM),用于估算水体初级生产力。后来也有学者通过实测数据输入模型进行计算,例如张运林[16]利用实测叶绿素a(Chl.a)和悬浮物浓度等数据构建了VGPM模型,计算了梅梁湾1995-2003年逐月的初级生产力,并通过对比发现与传统模型计算结果较好吻合。Lomas[17]比较研究了同位素14C法和VGPM模型,证明基于实测Chl.a的VGPM模型可以准确估计初级生产力。但是VGPM模型应用于冰封期水体初级生产力的估算,是目前还有待于拓展的领域。VGPM模型中,真光层深度是输入量之一。通常将水体表面光合有效辐射强度(photosynthetically active radiation, PAR)的1 % 的深度作为真光层深度的界定标准[18],冰盖对太阳光的吸收和散射作用,影响冰下水体的真光层深度,因此,计算冰封期的真光层深度需要考虑到冰层的消光系数。田伟东建立了应用于冰封期水体的改进VGPM模型,计算真光层深度时,考虑了冰厚对真光层深度的影响,并采用了实测冰水界面PAR计算冰下的初级生产力[19]。
上述研究为冰封期湖泊冰下初级生产力的研究奠定了基础,但相比开阔水体,冰封期湖泊初级生产力的研究仍然是目前较薄弱的一环。其一,对完整冰封期的调查观测数据仍然较少,而完整的冰下初级生产力变化过程对于理解冰下生态系统对环境因子的响应至关重要。其二,冰物理过程与冰下生态的联系仍然有待明确,Kirillin等讨论了温度影响水体垂直交换[20],进而影响冰下物质交换和浮游植物活动,Hintz等认为融冰期缩短造成冰下光可利用性的增加,是冰下生物活动增强的重要因素[21],而杨文焕等研究发现在不同的冻融期与浮游植物关联度高的环境因子不同[22],说明冰物理过程引起环境因子的改变对冰下生态的驱动机制仍然是有待于深入研究的领域。因此,本研究旨在应用改进的VGPM模型,通过2021-2022冬季完整冰封期的水体透明度、冰厚、冰面PAR强度、冰水界面PAR强度、水温和叶绿素a浓度数据计算初级生产力,并分析冰封期初级生产力变化趋势与驱动因素。本研究结果将揭示驱动冰下初级生产力的关键物理因子,为冰封期湖泊生态环境的相关研究提供一定参考。
1 区域概况与研究方法 1.1 区域概况与监测方法含章湖位于辽宁省大辽河入海口(40°40′~40°43′N,122°2′~122°8′E)(图 1a),湖区总面积约10 km2,平均水深6.0 m[23]。该湖地处北温带,受温带大陆性半湿润季风气候影响,全年降水较少且集中于夏季,全年多大风,主导风向为西南风和西北风。流域多年的平均气温为10.5℃,夏季最高气温可达33℃,冬季最低气温可达-22℃,冬季平均气温为-6.6℃。在大约每年的12月初开始结冰,直至翌年3月开始消融,并在3月中旬完全融化。含章湖受人类活动干扰强,常接纳周围生活污水。根据2019-2021年的调查数据,湖区年内平均总氮(TN)浓度为1.15 mg/L,总磷(TP)浓度为0.16 mg/L,超出地表Ⅳ类水质标准(GB 3838-2002)、水体富营养化的单因子临界值(TN≥0.2 mg/L, TP≥0.02 mg/L)[24]和湖泊浊水稳态临界值(TP≥0.12 mg/L)[25],湖内初级生产者以浮游微藻为主,平均藻密度为8.54×107 cells/L,是典型的富营养化湖泊。
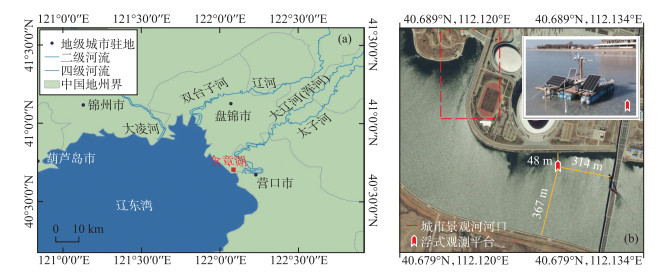
|
图 1 研究区域及浮式观测平台(a: 含章湖位置;b: 浮式观测平台) Fig.1 Research area and floating observation platform (a: The location of Lake Hanzhang; b: floating observation platform) |
本研究监测分为人工调查和在线监测。人工调查中,考虑到采样安全,采样时间从结冰期冰厚15 cm开始,到春季水温快速升高前结束,平均每5天测定一次,2021年12月31日至2月25日共计11次。期间,使用赛氏盘现场测定水体透明度(SD);分别采集水深为0.7、2.0、4.0 m的水样,装入样品瓶后4℃冷藏保存,于24 h内完成测定,测定项目包括TN、TP和高锰酸盐指数(CODMn),TN采用过硫酸钾氧化-重氮偶氮分光光度法测定(GB/T 12763.4-2007),TP采用过硫酸钾氧化-磷钼蓝分光光度法测定(GB/T 12763.4-2007),CODMn采用高锰酸钾酸性法测定(GB 11894-1989)。在线监测项目包括冰厚、PAR、水温、浊度和Chl.a浓度,分别使用浮式观测平台(图 1b)搭载的超声波测距仪(精度为±0.01 m,监测频率为每1 min一次)、太阳辐射传感器(冰面2台,分别测定冰面入射光辐照度,冰面反射光辐照度,冰下0.8 m处一台,监测频率为每30 min一次)、YLS-ZDW型叶绿素与浊度原位监测传感器(水温测定量程为-5~50℃,分辨率为0.01℃,精度为±0.15℃;浊度测定量程为0~1000 FTU,分辨率为0.01 FTU,精度为±2 %;Chl.a测定量程为0~400 μg/L,分辨率为0.01 μg/L,精度为±5 %;监测频率均为每1 min一次;水深0.7、1.5、2.0、4.0 m处分别设置1个监测点)进行在线监测。浮式观测平台于2021年12月20日布置完毕,超声波测距仪和太阳辐射传感器随之开始测定,叶绿素与浊度原位监测传感器于2022年1月12日开始工作,3月14日全部监测结束并撤回平台。
1.2 冰封期真光层深度计算方法真光层深度(Zeu)是VGPM模型的输入量之一,本研究对Zeu的计算参考田伟东改进的真光层深度计算方法[19]。对于非冰封期水体,近似将其视为性质均一的介质,则透过水中的光线遵循朗伯-比尔定律,即随着深度的增加,PAR呈指数衰减,结合真光层深度定义,可以推导出:
| Zeu=2ln10Kd(PAR)=4.605Kd(PAR) | (1) |
式中,Kd(PAR)为光合有效辐射漫衰减系数(m-1)。
Holmes[26]的研究指出,Kd(PAR)与透明度之间关系为:
| Kd(PAR)=fSD | (2) |
式中,SD为水体透明度(m);f为常数,不同水体的f值有所不同。马建行[27]对我国北方20个湖泊的Kd(PAR)与SD的研究表明,选取f值为1.4时较合适,故本研究中f值选取1.4。
对于冰封期水体,水体表面有冰盖覆盖,而冰盖会对太阳辐射产生吸收和散射作用,从而影响水体中的光环境。因此在计算冰封期水体真光层深度时首先要计算冰层消光系数。PAR在冰体内的衰减为指数衰减,考虑到冰面的镜面反射作用,冰层消光系数可以表示为:
| Ki(PAR)=1hiln[(1−Rs)Ed(0,PAR)Ed(hi,PAR)] | (3) |
式中,Ki(PAR)为冰层消光系数(m-1);hi为冰厚(m);Rs为冰面镜面反射率;Ed(0, PAR)为冰表面的PAR(μmol/(m2 ·s));Ed(hi, PAR)为冰水混合界面处PAR(μmol/(m2 ·s))。
真光层深度还可以定义为水下光合有效辐射强度为14 μmol/(m2 ·s)处的深度[28],结合冰层消光系数与光合有效漫衰减系数,可以推导出冰封期水体真光层深度计算模型:
| Zeui=SDfln(1−Rs)Ed(0,PAR)14eKi(PAR)hi | (4) |
式中,Zeui为冰封期水体真光层深度(m);f取1.4;SD为冰封期水体透明度(m);hi为冰厚;Ki(PAR)为冰层消光系数(m-1);Rs为冰面镜面反射率,一般取值为5 %,本研究中通过冰面反射PAR和冰面入射PAR的比值计算;Ed(0, PAR)为冰表面PAR(μmol/(m2 ·s))。
1.3 冰封期初级生产力计算方法VGPM模型是由Behrenfeld和Falkowski[29]基于大尺度、长时间的监测数据建立的计算模型,并在研究大量资料后进一步简化VGPM模型,得到初级生产力的核心计算公式:
| PPeui=0.66125PBopt×Dir×EiEi+4.1×Zeui×Copt | (5) |
式中,PPeui为冰封期水体初级生产力(mg C/(m2 ·d));PoptB为冰封期水柱最大固碳速率(mg C/(mgChl ·h));Dirr为冰封期光照周期(h), 可通过含章湖的经纬度查询日出与日落时间,进而计算获得。Ei为冰水混合界面处PAR(mol/(m2 ·d)),本研究使用水深0.8 m处PAR近似代替;Copt为真光层深度的Chl.a浓度(μg/L),本研究使用最接近真光层深度的Chl.a浓度监测值近似替代。
水柱最大固碳速率是计算水体初级生产力的重要参数,贾艳红等[30]的研究表明,在一定水温范围内,固碳速率随温度升高而增大。Behrenfeld和Falkowski[29]提出水柱中最大固碳速率计算方法如下:
| PBopt=1.2956+0.2749T+0.0617T2−0.0205T3+2.462×10−3T4−1.348×10−4T3+3.4132×10−6T6−3.27×10−8T7 | (6) |
式中,T为水体表面水温(℃)。对于非冰封期水体,水表层温度最高,水柱最大固碳速率通常出现在表层;但对于冰封期水体,最高水温并不在冰水界面处,因此选取平均温度最高的2.0 m处水温作为近似替代。
2 结果 2.1 冰厚变化情况本研究使用超声波测距仪测定每日冰厚情况,冰封期共85天。从图 2可以看出,监测期间冰厚变化可以大致分为3个阶段:结冰期、缓慢融冰期和快速融冰期。监测起始的2021年12月20日未结冰,在12月21日出现冰层,并在随后的几天内,冰厚迅速增大,冰盖生长期从2021年12月21日持续到2022年2月1日,并在当天达到最大冰厚0.43 m,冰厚出现短时大幅增加的原因是2月1日发生了降雪,冰层表面超声探头测定时计入积雪的厚度;随后在2月2日至2月27日期间冰层处于缓慢融冰期,冰厚变化缓慢,存在小幅波动,总体上呈现缓慢减小的趋势;在2月28日以后,湖冰发生显著融化,冰厚迅速减小,至3月14日时冰层完全融化。在含章湖冬季整个冰封期,湖冰的平均冰厚为0.29 m。
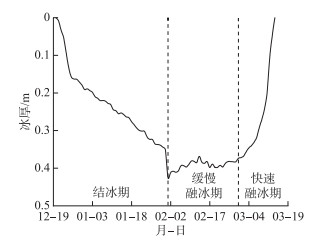
|
图 2 冰封期水体冰厚变化情况 Fig.2 The dynamics of ice thickness in the ice-covered period |
在线监测得到Chl.a、水温、PAR的变化情况如图 3所示。经计算,监测期间水深0.7、1.5、2.0、4.0 m处平均Chl.a浓度分别为18.70、15.98、22.38、22.83 μg/L。从Chl.a随时间的变化情况来看(图 3a),4个深度的Chl.a均在冰封期呈现出先升高后降低再升高的趋势。在1月12日至2月1日为结冰期,4个深度Chl.a均呈增加趋势;在2月2日至2月28日为缓慢融冰期,在此期间各个深度Chl.a达到峰值并开始下降,其中,水深越浅的点位下降开始得越早;在3月1日之后的快速融冰期,各个深度Chl.a均开始回升。监测期间的水温(图 3b)在垂直方向的分布存在显著反转,融冰期表层水温迅速增加。
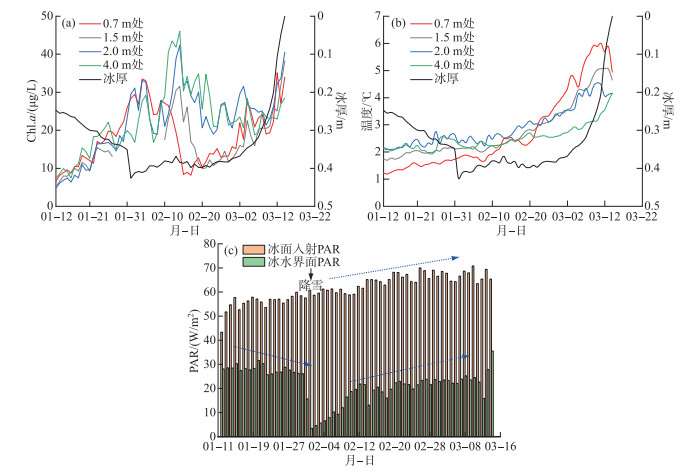
|
图 3 Chl.a浓度(a)、水温(b)和PAR(c)的变化情况 Fig.3 Dynamics of Chl.a concentration(a) and water temperature(b) and PAR(c) |
每日光合有效辐射(PAR)的结果(图 3c)表明,监测期间的冰面入射PAR呈现明显的上升趋势,这是由于监测日期均在冬至日之后,太阳直射点从南回归线逐渐向北移动,北半球日照时间因此相应变长,使太阳总辐射变强,PAR也逐渐增大。而冰水界面PAR显著小于冰面入射PAR,且呈现先降低后上升的趋势,在2月1日之前处于冰层生长期,冰层加厚,消光作用增强,使得冰水界面PAR逐渐下降,在2月1日有降雪,覆盖在冰面上的雪层同样会吸收大量PAR[28],因此冰水界面PAR达到最低值,之后冰层融化和太阳辐射的加强,冰水界面PAR再次回升。经计算,冰面入射PAR总平均值为61.73 W/m2,冰水界面PAR在没有雪层覆盖时平均值为23.83 W/m2,冰水界面PAR与冰面入射PAR的比值在6 % ~65 % 之间,平均比值为36 %。
2.3 真光层深度及初级生产力变化情况由公式(4)可以计算出冰封期水体真光层深度,而3月14日由于冰层完全融化需要使用非冰封期水体真光层深度计算模型(公式(7)),结果如图 4a所示。监测期间含章湖水体真光层深度最大值为3月14日的1.61 m,最小值为2月1日的0.80 m,监测期间总平均值为1.11 m。含章湖冰封期水体真光层深度表现为先降低后回升,再迅速增加。真光层深度在早期下降可能是由于冰层处于结冰期,冰层加厚使得进入水体的光辐射减少,而在2月1日的降雪大幅减少了光辐射,真光层深度因此达到最低值;在融化期,冰层的消光作用减弱,同时随着太阳直射点北移,每日冰面入射PAR也不断增强,真光层深度开始回升;在监测的最后几天,冰层迅速减小直至完全融化,导致真光层深度显著增大。冰厚与真光层深度呈显著的负相关关系(R2=0.699,P<0.05),能验证上述分析。
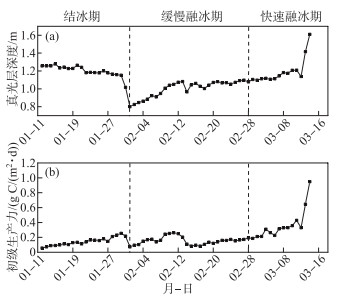
|
图 4 真光层深度(a)及初级生产力(b)变化情况 Fig.4 Dynamics of the euphotic depth (a) and the primary production (b) |
利用水温计算出冰封期水柱最大固碳速率后,结合冰封期光照周期、冰水界面PAR、冰封期真光层深度、最接近真光层深度的Chl.a浓度监测值,即可使用计算出冰封期水体初级生产力,结果如图 4b所示。监测期间水体初级生产力最小值为0.06 g C/(m2 ·d),出现在1月12日;初级生产力最大值为0.95 g C/(m2 ·d),出现在3月14日,最大值约为最小值的16倍;整个冰封期期间的平均值为0.20 g C/(m2 ·d)(图 4b)。含章湖冰封期初级生产力呈现波动中爬升的变化趋势,在1月30日、2月11日、3月4日和3月11日分别出现一个小高峰,在监测的最后几天,初级生产力迅速上升,达到监测期间的最大值。在2月1日之前的冰生长期和2月28日之后的冰融化期,初级生产力均呈现出明显的上升趋势,而在二者之间的时期,初级生产力发生了波动变化。
2.4 冰封期驱动初级生产力的关键物理因子驱动湖泊水体初级生产力变化的原因有很多,如透明度、水温、营养盐、Chl.a和PAR等因子。其中,冰封期冰下的水温、光照等物理因子是与开阔水体相比有明显变化的因素,影响冰下生态环境发生变化,因此本研究集中讨论物理因子对初级生产力的驱动作用。在本文采用的VGPM模型中,计算初级生产力的输入参数有水温、冰水界面PAR强度、真光层深度和Chl.a浓度。此外,冰厚为反映结冰过程的基本因子之一,本文从这5个因子中分析其中的关键因素。水温通过影响浮游植物进行光合作用所需的酶的活性,影响光合作用强度与初级生产力;真光层深度和PAR会影响进入水体的光照强度,从而影响浮游植物进行光合作用的能力,进而影响初级生产力;Chl.a浓度近似反映了水中浮游植物的含量,浮游植物生物量越大,越有可能进行更多的初级生产。主成分分析结果(图 5,Bartlett检验P<0.05,说明数据可用于主成分分析)表明,整个冰封期水温与初级生产力的相关性最高,说明水温是影响初级生产力的关键因素。图中可以看出不同日期的初级生产力被区分开,与依据冰厚的分期(2月1日以前为结冰期、2月1日-2月28日为缓慢融冰期和2月28日以后为快速融冰期)相符合,说明按照不同时期来分析初级生产力的变化情况是合理的。
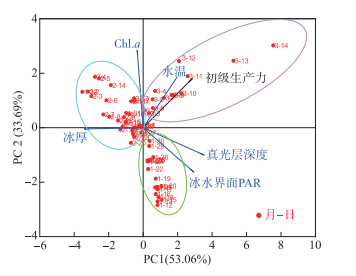
|
图 5 冰封期初级生产力与相关因子的主成分分析 Fig.5 Principal component analysis of factors affecting primary productivity in the ice-covered period |
为了探究不同时期的关键物理因子,对结冰期、缓慢融冰期和快速融冰期中不同因子与初级生产力进行一元线性回归分析。按照VGPM模型,理论上水温、冰水界面PAR强度、真光层深度和Chl.a浓度与初级生产力均为正相关关系,但是回归分析表明,实际上不同时期呈显著正相关的因子不同。水温(图 6a)、Chl.a浓度(图 6d)在结冰期和快速融化期与初级生产力为显著正相关,冰水界面PAR(图 6b)、真光层深度(图 6c)在缓慢融冰期、快速融冰期为显著正相关。其中,水温影响Chl.a浓度,冰水界面PAR影响真光层深度,并且进一步分析发现,Chl.a浓度和水温在结冰期为显著正相关(R2=0.599,P < 0.05)、在快速融化期为显著正相关(R2=0.291,P < 0.05),冰水界面PAR和真光层深度在缓慢融冰期为显著正相关(R2=0.992,P < 0.05)、快速融冰期(R2=0.708,P < 0.05)为显著正相关。这说明在结冰期,水温是控制初级生产力的关键因子;在缓慢融冰期,冰水界面PAR是控制初级生产力的关键因子;在快速融冰期,水温和冰水界面PAR同时控制初级生产力。在融冰期的末期,初级生产力随着升温和光照增强而迅速增加,加剧了水中微藻活动进一步增强的风险。
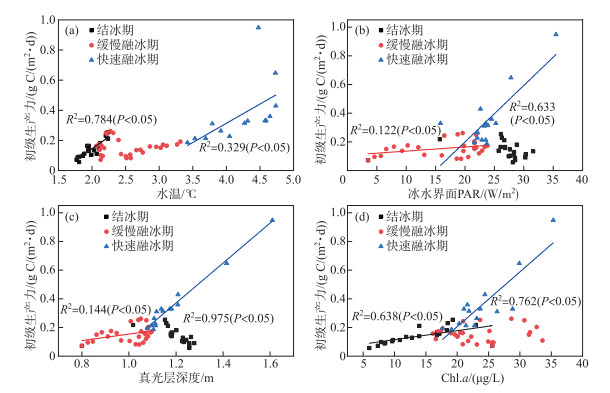
|
图 6 不同因素与初级生产力的关系(a:水温;b:冰水界面PAR;c:真光层深度;d:Chl.a浓度) Fig.6 Relationships between different factors and primary productivity (a: water temperature; b: PAR of the ice-water interface; c: euphotic depth; d: Chl.a concentration) |
通过综合营养状态指数法TLI(Σ)评估含章湖富营养化状况(总站生字[2002]090号),本研究选取的指标参数有Chl.a、TN、TP、SD和CODMn,采用以Chl.a为基准参数的归一化权重方法[31]计算,TLI(Σ)值越高,表示营养程度越重,TLI(Σ) >70时为重度富营养。含章湖冰封期综合营养指数TLI(Σ)均大于70,表明冰封期含章湖处于重度富养化状态(图 7)。在结冰期,富营养化程度随着冰厚的增加逐渐加深,这可能与结冰时污染物由冰体向水体迁移有关[32-34]。在缓慢融冰期富营养化指数整体较高,富营养化程度呈波动状态。Chl.a、TN、TP、SD和CODMn5种指标中,Chl.a对TLI(Σ)贡献率最大,为42.9 %,其次为TP(18.0 %)和TN(16.0 %),表明冰封期含章湖微藻的生物活动对水质的影响最大。在快速融冰期含章湖叶绿素浓度随着时间变化增加(图 3a),根据Chl.a单因子评价法[35],快速融冰期富营养化程度增加。总体上随着冰封期的发展和结束,水体富营养化程度不断提高,因此需要对冰下水质情况及生物活动加以重视。
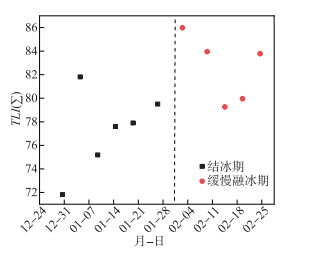
|
图 7 冰封期综合营养状态指数变化情况 Fig.7 Dynamics of comprehensive eutrophication index in the ice-covered period |
本研究湖区在冰封期处于重度富营养状态。水体的富营养化促进初级生产,但同时也显著改变浮游-底栖食物网的比例结构,水体能流路径由底层向上层浮游路径转变[36-37],这种状态下初级生产力由浮游植物贡献。通常认为冰下光照是生物活动的主要限制因子[21, 38],但是有研究者发现浮游植物最大光合效率所需的光辐照度只有底栖沉水植物的30 % [39],因此,本文重点讨论的是,在富营养化水体以浮游植物为主要初级生产者时,冰下初级生产力的演变过程如何受光照、水温等物理因子的调控。
通过对完整冰封期的调查观测结果发现,在结冰期冰厚增加和降雪覆盖都会使真光层深度下降,但是初级生产力并没有完全随着真光层深度的下降而减小。一方面,与沉水植物相比,浮游植物分布在水体上层,本研究中最低真光层深度为0.8 m,仍然有浮游植物光合作用的空间,与草型湖区不同,藻型湖区的初级生产力受叶绿素a的影响比真光层深度影响更大[8],这说明藻型湖泊和草型湖泊在冰封期初级生产力的响应机制很可能是不同的。初级生产力所需的量子辐照度约25 μmol/(m2 ·s),辐照度水平约为5 W/m2[40],本研究中日均冰水界面PAR为(21.7±6.9) W/m2,大部分时间中满足初级生产力的光照需要,只有在降雪当日和第二日,日均冰水界面PAR显著降低,分别为3.5和4.6 W/m2,初级生产力随之下降,但当雪融化时,随着PAR的回升初级生产力也开始恢复,这说明整体来看冰下光辐照度虽然因为冰雪衰减,但是还没有低到限制初级生产的水平,这与含章湖所处的纬度有关。另一方面,在本研究中,水温是与冰封期初级生产力相关性最高的因素,水温与叶绿素也表现了显著的正相关,这也表明升温对冰封期浮游植物的生长繁殖有较大影响。
除了光照和水温以外,冰下的对流混合也可能影响浮游植物的生物活动。在冰完全覆盖的淡水湖泊中,通常水体分层,并且对流较弱[19]。而咸水趋于结冰温度时密度增大,表层水下沉,增加水体垂直对流。含章湖为咸水湖,盐度为6~6.5之间,经测定含章湖冰下盐度垂直分布均匀。当水柱垂直对流良好时,一方面浮游植物可以上下交换,这会减弱真光层以下的光限制[41],另一方面沉积物释放的营养盐更容易被交换到表层[42],这都有利于浮游植物的生长,这可能是含章湖冰下叶绿素含量较高的原因。本研究中浮游植物活动没有受光照的支配,叶绿素a和PAR呈负相关,从图 3中也可以看出叶绿素a的高值区不是一直在表层水体。南极Bonney湖[43]冰下叶绿素浓度与PAR呈显著负相关,归因为自遮蔽作用(self-shading),高叶绿素浓度衰减了光辐照度。以上讨论表明冰下的垂直对流减弱了冰下光对浮游植物生长的限制。
综合分析得知,冰下浮游植物受到的光限制并没有此前认为的那样严重,虽然冰厚增加和降雪覆盖都会使冰下光照减弱、真光层深度下降,但是浮游植物的初级生产力却并没有随之降低。结冰期的初级生产力主要由水温控制,融冰期随着升温和光照增强,Chl.a和初级生产力又显著增强。因此,湖泊富养化程度越严重,浮游植物占比就越大,冰下初级生产力所受限制就越小,冰下富营养化程度又因此而加重,形成恶性循环。
3.2 营养盐对初级生产力的作用含章湖冰封期平均初级生产力为0.20 g C/(m2 ·d),与纬度相近的乌梁素海(40°36′~41°03′N)冰封期初级生产力具有相同的数量级水平(0.14 g C/(m2 ·d))[19]。按VPGM计算公式,在水温、冰水界面PAR强度和Chl.a浓度三个参数中,含章湖只有Chl.a浓度高于乌梁素海,这说明除了水温和光照以外,在冰封期还有其他不可忽略的因素,如氮磷营养盐含量[9, 44],影响浮游植物的生长增殖。为了验证这一结果,进一步对含章湖冰封期Chl.a及微藻生物活动相关的环境因子进行相关性分析,结果显示(图 8),Chl.a与总氮和水温呈显著正相关(P < 0.05),说明除水温以外,总氮对叶绿素的变化影响最大。通过计算氮磷比发现,水体中TN ∶TP=8.6,湖泊研究中一般以氮磷质量比10 ∶1为标准,小于10时,认为氮是藻类生长的限制性因素[45],这说明含章湖冰封期是氮限制潜在富营养状态,这一结果也解释了总氮与叶绿素的显著正相关(图 8)。因此,营养盐的浓度和比例影响Chl.a的浓度和初级生产力。
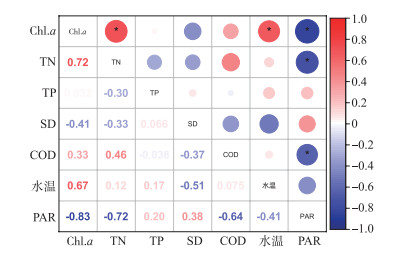
|
图 8 含章湖冰封期环境因子的相关性分析(*P≤0.05) Fig.8 Correlation analysis of environmental factors |
总之,冰下生态系统的演变机制是一个复杂的问题。与化学和生物因子相比,从非冰封期到冰封期再到非冰封期,水温、光照等物理因子是冰下水体中首先变化的要素,本研究力求探索出初级生产力变化过程中的关键物理因素,希望以此为突破口将冰物理过程与冰生态过程联系起来。本研究的创新点在于厘清了冰封期初级生产力的关键物理驱动因子,并且讨论了冰下水体中面临的富营养化现状和挑战,今后将继续开展冰封期湖泊生态环境的演变过程及驱动机制的相关研究。
4 结论1) 2021-2022年冬季含章湖冰封期共85 d。冰封期间,最大冰厚为0.43 m,平均冰厚为0.29 m。根据冰厚和初级生产力变化情况将含章湖冰封期划分为3个时期:结冰期、缓慢融冰期、快速融冰期。
2) 冰封期含章湖初级生产力呈现波动中爬升的趋势,最小值为0.06 g C/(m2 ·d),最大值为0.95 g C/(m2 ·d),平均值为0.20 g C/(m2 ·d)。在结冰期,水温是控制初级生产力的关键因子,在缓慢融冰期,冰水界面PAR是控制初级生产力的关键因子,在快速融冰期,水温和冰水界面PAR同时控制初级生产力。
3) 虽然冰厚增加和降雪覆盖使冰下光照减弱、真光层深度下降,但是冰下浮游植物没有受到光限制,冰封期初级生产力没有随光照衰减而降低。冰下水体富营养化程度在结冰期逐渐加重,因此对湖泊的冰下生物活动及冰下水质状况需要加强关注。
| [1] |
Zhang WS, Song CQ. Spatial distribution and dynamics of lakes in China: Progress in remote sensing monitoring at national scale and new inventory of the maximum lake extent and change trajectory. National Remote Sensing Bulletin, 2022, 26(1): 92-103. [张闻松, 宋春桥. 中国湖泊分布与变化: 全国尺度遥感监测研究进展与新编目. 遥感学报, 2022, 26(1): 92-103. DOI:10.11834/jrs.20221290] |
| [2] |
China ecological environment status bulletin 2020 (excerpt). Environmental Protection, 2021, 49 (11): 47-68.2020 [年中国生态环境状况公报(摘录). 环境保护, 2021, 49 (11): 47-68. ]
|
| [3] |
Schindler DW. The dilemma of controlling cultural eutrophication of lakes. Proceedings Biological Sciences, 2012, 279(1746): 4322-4333. DOI:10.1098/rspb.2012.1032 |
| [4] |
Qin BQ, Zhou J, Elser JJ et al. Water depth underpins the relative roles and fates of nitrogen and phosphorus in lakes. Environmental Science & Technology, 2020, 54(6): 3191-3198. DOI:10.1021/acs.est.9b05858 |
| [5] |
Ho JC, Michalak AM, Pahlevan N. Widespread global increase in intense lake phytoplankton blooms since the 1980s. Nature, 2019, 574(7780): 667-670. DOI:10.1038/s41586-019-1648-7 |
| [6] |
Salk KR, Venkiteswaran JJ, Couture RM et al. Warming combined with experimental eutrophication intensifies lake phytoplankton blooms. Limnology and Oceanography, 2022, 67(1): 147-158. DOI:10.1002/lno.11982 |
| [7] |
Woolway RI, Kraemer BM, Lenters JD et al. Global Lake responses to climate change. Nature Reviews Earth & Environment, 2020, 1(8): 388-403. DOI:10.1038/s43017-020-0067-5 |
| [8] |
Markensten H, Moore K, Persson I. Simulated Lake phytoplankton composition shifts toward cyanobacteria dominance in a future warmer climate. Ecological Applications, 2010, 20(3): 752-767. DOI:10.1890/08-2109.1 |
| [9] |
Hampton SE, Galloway AWE, Powers SM et al. Ecology under lake ice. Ecology Letters, 2017, 20(1): 98-111. DOI:10.1111/ele.12699 |
| [10] |
Kohlbach D, Graeve M, Lange BA et al. Dependency of Antarctic zooplankton species on ice algae-produced carbon suggests a sea ice-driven pelagic ecosystem during winter. Global Change Biology, 2018, 24(10): 4667-4681. DOI:10.1111/gcb.14392 |
| [11] |
Song S, Li CY, Shi XH et al. Under-ice metabolism in a shallow lake in a cold and arid climate. Freshwater Biology, 2019, 64(10): 1710-1720. DOI:10.1111/fwb.13363 |
| [12] |
Li CY, Yang F, Shi XH et al. Impact of seasonal ice cover on nutrient distribution in Ulansuhai Lake. Journal of Hydroelectric Engineering, 2016, 35(11): 1-8. [李畅游, 杨芳, 史小红等. 乌梁素海覆冰特征及其对营养盐分布的影响分析. 水力发电学报, 2016, 35(11): 1-8. DOI:10.11660/slfdxb.20161101] |
| [13] |
Yang F, Cen R, Feng WY et al. Dynamic simulation of nutrient distribution in lakes during ice cover growth and ablation. Chemosphere, 2021, 281: 130781. DOI:10.1016/j.chemosphere.2021.130781 |
| [14] |
Moss B. Allied attack: Climate change and eutrophication. Inland Waters, 2011, 1(2): 101-105. DOI:10.5268/iw-1.2.359 |
| [15] |
Lv XT, Lv YL, Song S et al. Eutrophication in cold-water lakes driven by combined effects of climate change and human activities. Acta Ecologica Sinica, 2017, 37(22): 7375-7386. [吕笑天, 吕永龙, 宋帅等. 气候变化与人类活动双重驱动的冷水湖泊富营养化. 生态学报, 2017, 37(22): 7375-7386. DOI:10.5846/stxb201704110632] |
| [16] |
Zhang YL, Feng S, Ma RH et al. Spatial pattern of euphotic depth and estimation of phytoplankton primary production in Lake Taihu in autumn 2004. J Lake Sci, 2008, 20(3): 380-388. [张运林, 冯胜, 马荣华等. 太湖秋季真光层深度空间分布及浮游植物初级生产力的估算. 湖泊科学, 2008, 20(3): 380-388. DOI:10.18307/2008.0319] |
| [17] |
Lomas MW, Moran SB, Casey JR et al. Spatial and seasonal variability of primary production on the Eastern Bering Sea shelf. Deep Sea Research Part Ⅱ Topical Studies in Oceanography, 2012, 65: 126-140. DOI:10.1016/j.dsr2.2012.02.010 |
| [18] |
Huang LC, Zhou YY, Zhou QC et al. Temporal-spatial variation in phytoplankton primary production and its influencing factors in Lake Chenghai on the Yunnan Plateau, China. J Lake Sci, 2019, 31(5): 1424-1436. [黄立成, 周远洋, 周起超等. 云南程海浮游植物初级生产力的时空变化及其影响因子. 湖泊科学, 2019, 31(5): 1424-1436. DOI:10.18307/2019.0508] |
| [19] |
田伟东. 乌梁素海真光层深度及浮游植物初级生产力模拟分析研究[学位论文]. 呼和浩特: 内蒙古农业大学, 2020.
|
| [20] |
Kirillin G, Leppäranta M, Terzhevik A et al. Physics of seasonally ice-covered lakes: A review. Aquatic Sciences, 2012, 74(4): 659-682. DOI:10.1007/s00027-012-0279-y |
| [21] |
Hintz NH, Schulze B, Wacker A et al. Ecological impacts of photosynthetic light harvesting in changing aquatic environments: A systematic literature map. Ecology and Evolution, 2022, 12(3): e8753. DOI:10.1002/ece3.8753 |
| [22] |
Yang WH, Shen H, Zhou ML et al. Ecological characteristics of dominant phytoplankton community in Lake Nanhai (Baotou) during freezing-thawing period. J Lake Sci, 2020, 32(2): 450-461. [杨文焕, 申涵, 周明利等. 冻融期包头南海湖浮游植物群落及优势种生态特征. 湖泊科学, 2020, 32(2): 450-461. DOI:10.18307/2020.0214] |
| [23] |
Xie F, Zhang YW, Lu P et al. Characteristics and influencing factors of lake ice growth and decay in a shallow lake from a cold region. J Lake Sci, 2021, 33(5): 1552-1563. [解飞, 张议文, 卢鹏等. 寒区浅水湖冰生消特征及其影响因素. 湖泊科学, 2021, 33(5): 1552-1563. DOI:10.18307/2021.0523] |
| [24] |
Kong FX. Controlling lake eutrophication and cyanobacteria blooms. Jiangsu Science and Technology Information, 2007(9): 7-11. [孔繁翔. 湖泊富营养化治理与蓝藻水华控制. 江苏科技信息, 2007(9): 7-11. DOI:10.3969/j.issn.1004-7530.2007.09.002] |
| [25] |
Wang HT, Wang HJ, Li Y et al. The control of lake eutrophication: Focusing on phosphorus abatement, or reducing both phosphorus and nitrogen?. Acta Hydrobiology Sinica, 2020, 44(5): 938-960. [王洪铸, 王海军, 李艳等. 湖泊富营养化治理: 集中控磷, 或氮磷皆控?. 水生生物学报, 2020, 44(5): 938-960. DOI:10.7541/2020.111] |
| [26] |
Holmes RW. The secchi disk in turbid coastal water. Limnology and Oceanography, 1970, 15(5): 688-694. DOI:10.4319/lo.1970.15.5.0688 |
| [27] |
马建行. 东北地区典型湖库Kd(PAR)与真光层深度遥感反演[学位论文]. 长春: 中国科学院东北地理与农业生态研究所, 2016.
|
| [28] |
Kirk J. Light and photosynthesis in aquatic ecosystems. 3rd ed. New York: Cambridge University Press, 2011. |
| [29] |
Behrenfeld MJ, Falkowski PG. Photosynthetic rates derived from satellite-based chlorophyll concentration. Limnology and Oceanography, 1997, 42(1): 1-20. DOI:10.4319/lo.1997.42.1.0001 |
| [30] |
Jia YH, Sun Y, Niu BY. Estimation of ocean primary productivity in the Yellow Sea based on remote sensing and GIS. Journal of Huaihai Institute of Technology: Natural Science Edition, 2010, 19(4): 87-91. [贾艳红, 孙莹, 牛博颖. 基于RS和GIS的黄海海区海洋初级生产力估算. 淮海工学院学报: 自然科学版, 2010, 19(4): 87-91. DOI:10.3969/j.issn.1672-6685.2010.04.023] |
| [31] |
金相灿, 章宗涉. 中国湖泊环境: 第一册. 北京: 海洋出版社, 1995, 33-35. |
| [32] |
Yang F, Li CY, Shi XH et al. Impact of seasonal ice structure characteristics on ice cover impurity distributions in Lake Ulansuhai. J Lake Sci, 2016, 28(2): 455-462. [杨芳, 李畅游, 史小红等. 乌梁素海冰封期湖泊冰盖组构特征对污染物分布的影响. 湖泊科学, 2016, 28(2): 455-462.] |
| [33] |
Belzile C, Gibson JAE, Vincent WF. Colored dissolved organic matter and dissolved organic carbon exclusion from lake ice: Implications for irradiance transmission and carbon cycling. Limnology and Oceanography, 2002, 47(5): 1283-1293. DOI:10.4319/lo.2002.47.5.1283 |
| [34] |
Chu KJ, She YT, Kemp J et al. Interrelationship between nutrients and chlorophyll-a in an urban stormwater lake during the ice-covered period. Journal of Contemporary Urban Affairs, 2017, 1(3): 24-30. DOI:10.25034/ijcua.2018.3675 |
| [35] |
金相灿, 屠清瑛. 湖泊富营养化调查规范(2版). 北京: 中国环境科学出版社, 1990, 289-302. |
| [36] |
Alexander TJ, Vonlanthen P, Seehausen O. Does eutrophication-driven evolution change aquatic ecosystems?. Philosophical Transactions of the Royal Society B: Biological Sciences, 2017, 372(1712): 20160041. DOI:10.1098/rstb.2016.0041 |
| [37] |
Li H, Shen HY, Li SJ et al. Effects of eutrophication on the benthic-pelagic coupling food web in Baiyangdian Lake. Acta Ecologica Sinica, 2018, 38(6): 2017-2030. [李华, 沈洪艳, 李双江等. 富营养化对白洋淀底栖-浮游耦合食物网结构和功能的影响. 生态学报, 2018, 38(6): 2017-2030. DOI:10.5846/stxb201701060057] |
| [38] |
Burch MD. Annual cycle of phytoplankton in Ace Lake, an ice covered, saline meromictic lake. Hydrobiologia, 1988, 165(1): 59-75. DOI:10.1007/BF00025574 |
| [39] |
Rautio M, Dufresne F, Laurion I et al. Shallow freshwater ecosystems of the circumpolar Arctic. Écoscience, 2011, 18(3): 204-222. DOI:10.2980/18-3-3463 |
| [40] |
Leppäranta M, Reinart A, Erm A et al. Investigation of ice and water properties and under-ice light fields in fresh and brackish water bodies. Hydrology Research, 2003, 34(3): 245-266. DOI:10.2166/nh.2003.0006 |
| [41] |
Özkundakci D, Gsell AS, Hintze T et al. Winter severity determines functional trait composition of phytoplankton in seasonally ice-covered lakes. Global Change Biology, 2016, 22(1): 284-298. DOI:10.1111/gcb.13085 |
| [42] |
Shatwell T, Thiery W, Kirillin G. Future projections of temperature and mixing regime of European temperate lakes. Hydrology and Earth System Sciences, 2019, 23(3): 1533-1551. DOI:10.5194/hess-23-1533-2019 |
| [43] |
Obryk MK, Doran PT, Priscu JC. The permanent ice cover of Lake Bonney, Antarctica: The influence of thickness and sediment distribution on photosynthetically available radiation and chlorophyll-a distribution in the underlying water column. Journal of Geophysical Research: Biogeosciences, 2014, 119(9): 1879-1891. DOI:10.1002/2014JG002672 |
| [44] |
Wen ZD, Song KS, Shang YX et al. Variability of chlorophyll and the influence factors during winter in seasonally ice-covered lakes. Journal of Environmental Management, 2020, 276: 111338. DOI:10.1016/j.jenvman.2020.111338 |
| [45] |
Horne AJ, Goldman CR. Limnology Second Edition. New York: Mc Graw-Hill, Inc, 1994.
|
 2023, Vol. 35
2023, Vol. 35 


