(2: 中国科学院大学, 北京 100049)
(2: University of Chinese Academy of Sciences, Beijing 100049, P.R. China)
病毒在海洋和淡水系统中的含量超过每毫升107个[1],作为特异性感染蓝藻的病毒,噬藻体数量丰富且种类繁多,是水生微生物群落的重要组成部分。研究发现,噬藻体主要通过裂解来调控宿主蓝藻的密度及种群结构[2-4]。据统计海洋中每天约有1.5%~6%的聚球藻被噬藻体裂解[5]。同样淡水水体中噬藻体也能大量裂解藻细胞,Yoshida等[6]在聚球藻藻华爆发期间对日本Mikata湖的研究发现,每天有0.0055%~2.1%的宿主种群被噬藻体裂解。Coulombe等[7]在1981年发现束丝藻(Aphanizomenon flos-aquae)水华消退时藻细胞中存在病毒样颗粒,因此推测噬藻体可能参与了该水华的消亡。Weinbauer等[8]在1997年3月到1998年1月监测一个超富营养化池塘发现,噬藻体浓度较高时,铜绿微囊藻密度急剧下降,且产毒微囊藻在所有微囊藻生物量中由47.1%下降到0.5%,表明噬藻体还会影响产毒和不产毒蓝藻种群结构变化。
上述发现使噬藻体控藻的应用潜力得到关注,Desjardins等[9]于1983年在发生Leptolyngbya boryanum藻华的池塘中添加噬藻体LPP-1,发现其可以影响藻细胞的丰度和分布。1988年,Martin等[10]在80 L微宇宙实验中发现,加入噬藻体SM-2使蓝藻生物量显著下降。随着越来越多的噬藻体从水体中被分离,人们逐渐发现噬藻体控制蓝藻水华的潜力。2006年,Yoshida等[11]在日本分离得到一株可以裂解铜绿微囊藻的噬藻体,实验结果表明它可以有效控制铜绿微囊藻水华。此外,2020年, Lin等[12]以华美微囊藻(Microcystis elabens)为宿主分离出一株广谱噬藻体Me-ZS1,该噬藻体将蓝藻的相对丰度从33.25%下降到20.63%,而对照组中蓝藻的相对丰度为52.77%。张珊珊[13]2022年以铜绿微囊藻FACHB-905藻株为宿主分离出了一株新型广谱烈性噬藻体Min S1,该噬藻体可以感染几种不同目的藻类,包括色球藻目、念珠藻目、颤藻目、段殖藻目和聚球藻目,表明该噬藻体宿主范围广泛,在蓝藻水华治理中具有较大的应用潜力。
噬藻体在适宜的条件下可快速裂解蓝藻细胞,其中光照、温度和MOI(感染复数,Multiplicity of Infection,噬藻体效价与藻细胞数量比值)是影响噬藻体裂解蓝藻最重要的条件。廖湘勇等[14]发现在光照周期L ∶D=14 h ∶10 h条件下,噬藻体A-4(L)在平板上感染PCC 7120藻苔出现同心圆噬藻斑,而持续光照条件下未出现,进一步推测周期光照影响了A-4(L)对藻细胞的吸附或子代A-4(L)的释放,使A-4(L)感染过程变缓或感染力变弱。温度是影响噬藻体感染的另一个重要因素,有研究发现温度升高会提高噬藻体PP的吸附率[15]。MOI也会对噬藻体侵染造成影响,程凯等[16]发现随着MOI的增大,鲍氏织线藻被噬藻体PP侵染后藻丝开始断裂的时间明显提前,当MOI为1 ∶2时,藻丝从3 h开始断裂,而当MOI为10 ∶1时,藻丝则从2 h开始断裂。
1976—1977年间,Koz'yakov等[17]在苏联列宁格勒通过筛选约2000份样品,分离出包括A-4(L)在内的共9个鱼腥藻病毒亚型。在负染电镜下观察,A-4(L)具有一个长度约为10 nm的尾部[14],因此被划分为短尾病毒。A-4(L)侵染宿主细胞潜伏期很短,在28~30℃条件下只需0.5~2 h[18]。本文以A-4(L)裂解丝状蓝藻鱼腥藻PCC 7120为例,探究光照、温度和MOI对A-4(L)裂解宿主细胞的影响,探索A-4(L)裂解藻细胞的最佳投加时间和投加剂量,并利用室内探究的条件开展室外噬藻体裂解藻细胞验证。
1 材料与方法 1.1 噬藻体与蓝藻噬藻体A-4(L)和鱼腥藻PCC 7120均由中国科学院水生生物研究所徐旭东研究员惠赠。鱼腥藻PCC 7120是一种丝状蓝藻,能够被A-4(L)裂解。使用BG11液体培养基,在30℃、50 μmol/(m2 ·s)连续光照条件下振荡培养PCC 7120。
1.2 新鲜噬藻体裂解液的制备培养至对数生长期的PCC 7120(OD750为0.5左右)经5000转/min(离心机Eppendorf Centrifuge 5810 R,转头型号F34-6-38)离心5 min后用BG11培养基洗涤一次,重悬在等体积的新鲜BG11培养基中。在200 mL藻液中加入1 mL效价约为107 PFU/mL(PFU,Plaque Forming Unit)的A-4(L),将其置于30℃,50 μmol/(m2 ·s)连续光照条件下培养2~3 d,至藻细胞裂解液澄清透明。将裂解液经5000转/min离心5 min,取其上清液。为了尽量去除藻细胞碎片,再使用10 mL一次性塑料无菌注射器安装孔径0.22 μm无菌滤膜(Millipore Express PES Membrane Filter Unit)过滤,过滤后得到的裂解液置于4℃冰箱保存。每次实验开始前制备新鲜的裂解液,并用噬藻斑法测其效价约为107 PFU/mL。
1.3 噬藻体效价的测定本实验中用噬藻斑法测定A-4(L)的效价,将A-4(L)用BG11培养基按10-1,10-2…10-10(900 μL BG11+100 μL A-4(L))梯度稀释。再从每个梯度中取100 μL混液与1 mL离心浓缩之后的藻液(OD750为0.5的藻液浓缩10倍)混合,30℃下静置30 min使噬藻体更好地吸附到藻细胞后,与等体积的1.5%琼脂BG11培养基混匀,迅速平铺在底层琼脂BG11平板上,每个梯度设置3个平行。待平板凝固后,将其放在30℃,50 μmol/(m2 ·s)连续光照条件下静置培养2 d,记录各个稀释梯度的噬藻斑个数。噬藻体效价的计算为,计数平板上清晰可数的噬藻斑个数,乘稀释倍数,再乘10即为噬藻体的效价PFU/mL。
1.4 噬藻体侵染藻株的OD750曲线将PCC 7120培养到对数生长期,再经5000转/min离心5 min收集藻细胞用BG11培养基洗涤一次,重悬在等体积的新鲜BG11培养基中。根据每次实验要求实验组加入合适体积的A-4(L),对照组加入等体积的BG11,每隔一定时间取样测OD750。以侵染时间为横坐标,OD750为纵坐标,绘制PCC 7120的OD750曲线。
1.5 PCC 7120光照适应Arhel-Goren等[19]研究发现,PCC 7120具有生物钟特征:12 h的光暗循环培养两天后置于连续的光照条件下,PCC 7120仍能保持在光暗循环下的昼夜节律。为了探究PCC 7120的昼夜节律是否影响A-4(L)对其裂解,本研究将PCC 7120置于30℃,50 μmol/(m2 ·s)周期光照(L ∶D=12 h ∶12 h)下培养。按照给光时间将PCC 7120分为两组,甲组7:00—19:00给光,乙组则19:00—7:00给光,培养14 d,使两组藻分别适应各自光暗周期的变化。14 d后早上7:00(为第0 h)甲、乙实验组开始添加A-4(L)侵染(MOI为0.01)时,甲组藻株处于光周期的状态,乙组藻株处于暗周期的状态,侵染时都给予连续光照。
1.6 不同光强下噬藻体吸附率测定为了探究光照强度对于噬藻体吸附的影响,本研究在30℃条件下,设置光强分别为200、80、0 μmol/(m2 ·s),藻细胞密度为1.5×107 cells/mL,藻细胞OD750为0.5左右,MOI为0.01,测定A-4(L)吸附率。取A-4(L)侵染藻细胞的样品1 mL,10000转/min离心5 min,采用最大可能数法(Most Probable Number,MPN)测定上清液中未被吸附的A-4(L)效价,从而间接地测定已被吸附的A-4(L),计算A-4(L)吸附率。将上清中待测A-4(L)按10倍梯度稀释,然后将处于对数生长期且经过新鲜BG11培养基重悬后的藻细胞接入无菌96孔板,每孔加150 μL。再加入不同的A-4(L)稀释液50 μL,每个稀释梯度接4个孔,空白组加入等量BG11培养基。将96孔板置于30℃,50 μmol/(m2 ·s)连续光照条件下培养2 d,记录各稀释度下的藻细胞侵染孔数。将出现侵染的稀释梯度和平行样品数作为数量指标,在最大或然数表上查出近似值,再乘数量指标第一位数的稀释倍数,即为原始样品中的噬藻体效价[20]:吸附率(%) =(1-上清中的A-4(L)效价÷A-4(L)的初始效价)×100%。
1.7 qPCR测定A-4(L)DNA pol基因拷贝数Lindell等[21]通过qPCR绝对定量的方法测定在原绿球藻MED4胞内和胞外噬藻体P-SSP7 DNA pol基因的拷贝数,且qPCR绝对定量的方法与传统的MPN法和电镜法定量噬藻体有很强的正线性相关关系,可以准确定量噬藻体。本研究以A-4(L) DNA pol为目的基因,将其导入pET28H质粒,构建载体,绘制qPCR绝对定量的标准曲线,通过实时定量PCR SYBR Green法来检测A-4(L)DNA pol拷贝数。PCC 7120胞内和胞外的A-4(L) DNA pol基因拷贝数,分别表征A-4(L)在胞内的复制以及胞外的释放。qPCR反应总体系为10 μL,各体系体积为:SYBR Green Realtime PCR Master Mix 5 μL,正向、反向引物各0.25 μL,A-4(L) DNA 2 μL,最后用无菌水补齐至10 μL。qPCR上机程序为:95℃预变性3 min,随后进行40个循环:95℃,20 s;60℃下退火30 s;72℃,30 s。该实验中,初始OD750为0.5左右的藻细胞中加入A-4(L)使MOI为0.01左右,整个侵染过程在30℃,光强为50 μmol/(m2 ·s)的全光照下进行。采集的藻样样品立即进行如下前处理:先经8000转/min离心5 min后,获得上清待用于胞外A-4(L) DNA的提取,沉淀藻细胞先加入少量BG11培养基经过8000转/min,5 min离心弃上清。前处理完的样品立即置于4℃冰箱,待样品采集完沉淀藻细胞进行以下处理:先经过95℃加热15 min,裂解藻细胞,再提取胞内A-4(L) DNA。A-4(L) DNA提取使用TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0试剂盒,具体操作详见试剂盒说明书。该实验所用引物序列如表 1所示,表中所示引物除了用于线性化pET28H和单克隆的引物来自张承才老师实验室,其余引物均为本人针对A-4(L)所设计,qPCR扩增产物预期长度为200 bp。
| 表 1 引物序列 Tab. 1 Primer sequences |
探究不同光照时长对于噬藻体A-4(L)裂解PCC 7120藻细胞的影响:在30℃,光强50 μmol/(m2 ·s)条件下,将培养箱光照设置为7:00—19:00给光(L ∶D=12 h ∶12 h),分别在一天中的早上7:00、中午12:00、下午15:00和晚上19:00 4组不同时间添加A-4(L),MOI为0.01左右,每隔一定时间测藻细胞OD750。
1.9 不同温度的侵染探究不同温度对于噬藻体A-4(L)裂解PCC 7120藻细胞的影响:分别在15、20、25及30℃下添加A-4(L) 侵染PCC 7120,MOI为0.01左右,4组温度下给予全光照,光强均为50 μmol/(m2 ·s),每隔一定时间测藻细胞OD750以及用噬藻斑法测定侵染第24 h胞外A-4(L)效价。
1.10 不同MOI的侵染为了探究不同MOI对A-4(L)裂解藻细胞的影响,在30℃且光强为50 μmol/(m2 ·s)的全光照条件下,分别在PCC 7120中添加不同浓度的A-4(L)使MOI为1.13、1.13×10-2、1.13×10-4和1.13×10-6,实验藻细胞密度为1.8×107 cells/mL左右,不同MOI下200 mL实验体系中A-4(L)浓度分别为107、105、103、10 PFU/mL左右,每隔一定时间测藻细胞OD750。对于MOI=1.13中的A-4(L)采用超滤离心法对其浓缩,选择截留分子量为100 KD、Amicon Ultra-15离心超滤管,每个超滤管中加入15 mL新鲜A-4(L)裂解液,在4℃+3000转/min+10 min的条件下进行离心。离心后收集截留在滤膜内约500 μL浓缩A-4(L)裂解液,再用噬藻斑法检验其效价,约为108~109 PFU/mL。
1.11 室外侵染室外侵染实验于2022年5月7—8日在日光光照条件下进行,室外温度为19~28℃,晴天。本研究从武汉东湖采集湖水,为了减少湖水中微生物、悬浮颗粒和浮游动物对藻细胞的影响,将湖水经过0.45 μm滤膜抽滤。BG11培养至对数期的PCC 7120经5000转/min离心5 min后重悬到抽滤的湖水中用于室外侵染实验。1 L大烧杯中加500 mL藻液,设置三组平行。早上7:00添加A-4(L)使MOI为0.01左右,空白组添加等量BG11,每隔一定时间取样测定OD750。由于正午光照过强达到1500 μmol/(m2 ·s),故12:00—14:00短暂转移至阴凉处,使正午光强约为500 μmol/(m2 ·s)。
1.12 数据分析数据绘图采用Origin 2018,数据分析采用IBM SPSS Statistics 25 One-way ANOVA(LSD)进行方差分析和多重比较,P < 0.05差异显著。
2 结果 2.1 光照对A-4(L)侵染的影响全光照条件下且MOI=0.01时,A-4(L)在8 h后裂解藻细胞(图 1A),但是黑暗条件下PCC 7120的OD750曲线与未加A-4(L)的对照曲线(图 1B)类似,说明几乎没有裂解发生。实验结果表明A-4(L)裂解藻细胞依赖光照,黑暗条件下A-4(L)无法裂解藻细胞。
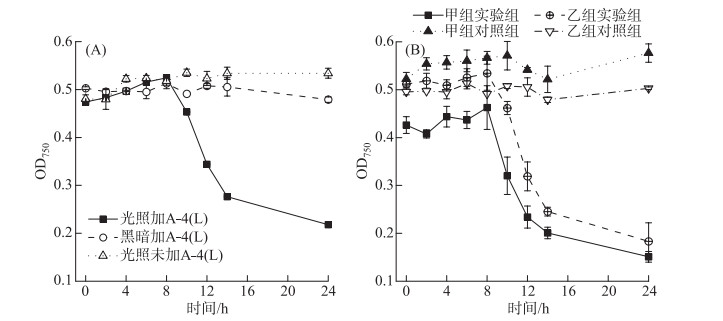
|
图 1 不同光照条件下A-4(L)侵染PCC 7120的OD750曲线 (A. 光照和黑暗下侵染藻株;B. 侵染不同昼夜节律下藻株) Fig.1 OD750 curves of PCC 7120 infected by A-4(L) under different light conditions (A. PCC 7120 infected in the light and dark; B. PCC 7120 with different circadian rhythms) |
两组颠倒光照时间培养14 d的PCC 7120在连续光照下被A-4(L)侵染(图 1B),第0 h开始添加A-4(L)侵染时,甲组藻株处于光周期的状态,乙组藻株处于暗周期的状态。若A-4(L)对PCC 7120的裂解与PCC 7120的昼夜节律有关,则甲组藻株OD750在早上7:00光照8 h后下降,而乙组藻株应该在晚上19:00光照8 h后下降,但是两组OD750均在给光8 h后开始下降,说明A-4(L)对PCC 7120的裂解不依赖PCC 7120的昼夜节律,而依赖光照。有文献也指出,噬藻体AS-1对细长聚球藻Synechococcus elongatus的侵染不受宿主昼夜节律的影响,而光照对AS-1侵染影响更大[22]。
2.1.1 光照强度对A-4(L)吸附的影响本实验结果表明,5 min之后A-4(L)在光照条件下对PCC 7120的吸附率显著高于黑暗下(P < 0.05)(图 2),80 μmol/(m2 ·s)和200 μmol/(m2 ·s)光强下吸附率无显著性差异(P>0.05)。无论光照还是黑暗条件下,噬藻体的吸附过程十分迅速。即使在黑暗条件下仍有超过50%的A-4(L)吸附到藻细胞上,表明A-4(L)对宿主细胞的吸附不依赖光照。
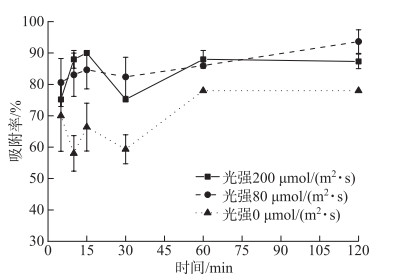
|
图 2 不同光强下A-4(L) 对PCC 7120的吸附率 Fig.2 Adsorption ratios of A-4(L) to PCC 7120 under various intensities of light |
光照条件下A-4(L)在胞内大量复制并释放到胞外,而黑暗下只有极少量的复制(图 3A)。胞内A-4(L)复制在光照8 h达到最大,DNA pol拷贝数为1.1×107 copies/mL,8 h后胞内复制随着大量的藻细胞被裂解而逐渐减少。A-4(L)侵染PCC 7120 (MOI=0.01)OD750在8 h后显著下降,可知A-4(L)在大量复制完成之后便开始裂解藻细胞。对比胞内和胞外A-4(L) DNA pol拷贝数,可以发现胞内DNA pol拷贝数高于胞外。胞外A-4(L)释放量在光照12 h最大(图 3B),DNA pol拷贝数为2.6×106 copies/mL,而第12 h黑暗下胞外A-4(L) DNA pol拷贝数为2.1×105 copies/mL,说明光照下的胞外A-4(L)释放量远远高于黑暗下。胞外A-4(L) DNA pol拷贝数在0~2 h内由于A-4(L)吸附到藻细胞上而减少,在2 h后大幅度增加,可知A-4(L)的潜伏期为2 h左右,经过潜伏期之后,A-4(L)开始释放到胞外。在2~12 h内,胞外A-4(L) DNA pol拷贝数大幅度增加,表明此时A-4(L)的裂解期为10 h左右。但是A-4(L)侵染PCC 7120的OD750在8 h后才下降(图 1A),说明在大幅度裂解藻细胞之前,A-4(L)已经进行胞外释放了。因此A-4(L) DNA pol拷贝数比藻细胞OD750能更准确地了解侵染过程,估算A-4(L) DNA复制时间,潜伏期以及释放量。
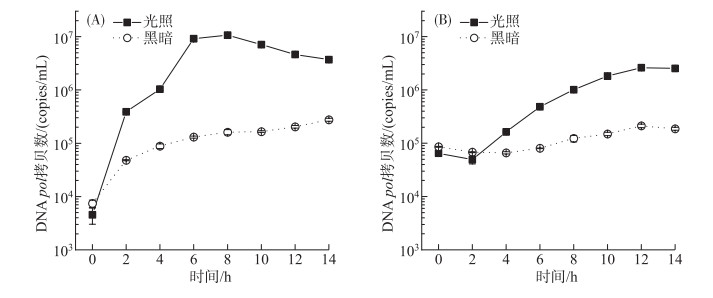
|
图 3 胞内(A)和胞外(B)A-4(L) DNA pol基因拷贝数 Fig.3 Intracellular (A) and extracellular (B) A-4(L) DNA pol gene copies |
A-4(L)在连续光照下8 h后就可裂解藻细胞(MOI为0.01),7:00(图 4A)和12:00(图 4B)添加A-4(L)的两组均在8 h后藻细胞大量裂解。15:00(图 4C)一组由于只有4 h的光照时长,8 h时OD750没有大幅度下降,而第二天白天给光后OD750才快速下降。19:00(图 4D)一组在黑暗下12 h藻细胞均未裂解,第二天白天给光后OD750才快速下降。由图 4C和4D结果对比可知,A-4(L)只经过光照4 h无法正常裂解藻细胞,只有经过6 h及以上的光照,A-4(L)才能裂解藻细胞。A-4(L)成功裂解PCC 7120所需光照时长可能与侵染中某一关键进程有关,这一关键进程是强烈依赖光照的,在光照下完成了这一过程后,则裂解宿主的剩余进程可以在黑暗下发生(图 4B)。
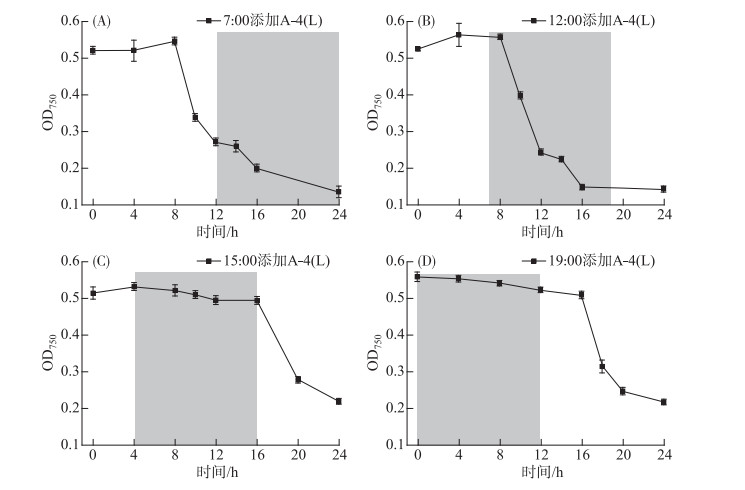
|
图 4 不同光照时长下A-4(L)侵染PCC 7120 OD750曲线 (A. 7:00添加;B. 12:00添加;C. 15:00添加;D. 19:00添加; 阴影部分表示无光照) Fig.4 OD750 curves of PCC 7120 infected by A-4(L) during different light periods (Adding A-4(L) at 7:00(A), 12:00(B); 15:00(C) and 19:00(D); Shadows indicate dark) |
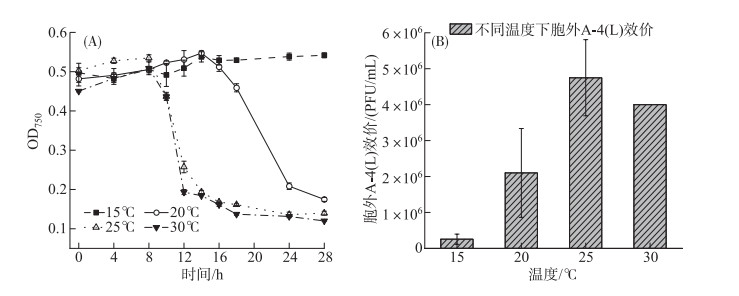
15℃时,藻细胞28 h内未见裂解;20℃时,14 h后藻细胞裂解;在25℃和30℃时,8 h后藻细胞即可被A-4(L)快速裂解(图 5A);表明温度升高,A-4(L)裂解藻细胞时间明显提前。在15~25℃温度范围内,随着温度的升高,A-4(L)裂解越快且胞外A-4(L)效价明显提高(图 5B),且15℃和20℃下的胞外A-4(L)显著低于25℃下的胞外A-4(L)(P < 0.05)。而25℃和30℃条件下的侵染,藻细胞OD750变化以及第24 h胞外A-4(L)效价没有明显区别。
|
图 5 温度对A-4(L)侵染PCC 7120的影响 (A:不同温度下A-4(L)侵染PCC 7120 OD750曲线; B:不同温度下胞外A-4(L)效价) Fig.5 Effect of temperature on infection of PCC 7120 by A-4(L) (A: OD750 curves of PCC 7120 infected by A-4(L) at different temperature; B: Extracellular A-4(L) titer at different temperature) |
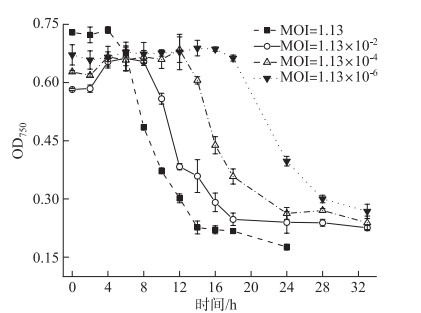
当MOI=1.13时,A-4(L)侵染4 h后藻细胞开始被裂解;当MOI=1.13×10-2时,藻细胞被大量裂解的启动时间被延后至第8 h;当MOI=1.13×10-4时,延后至第12 h后;当MOI=1.13×10-6时,持续延后至第16 h后。MOI提高两个数量级,藻细胞裂解则提前4 h。以A-4(L)侵染宿主24 h为限,当MOI为1.13、1.13×10-2、1.13×10-4和1.13×10-6时,宿主细胞的OD750分别下降了76%、59%、58%和41%(图 6)。表明MOI越大,噬藻体裂解宿主细胞越快。
|
图 6 不同MOI下A-4(L)侵染PCC 7120 OD750曲线 Fig.6 OD750 curves for PCC 7120 infected by A-4(L) at different MOI |
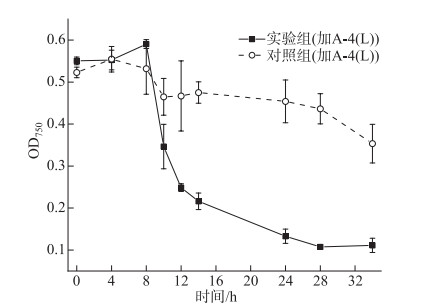
室外侵染验证结果如图 7所示,投加A-4(L)的实验组藻细胞密度在8 h后开始迅速下降,细胞裂解,侵染28 h OD750下降至0.1。对照组中藻细胞密度在8 h后略有下降,后期保持稳定(OD750约为0.45)。证明A-4(L) 在日光照射的湖水样品中仍然可以高效裂解藻细胞。
|
图 7 抽滤的湖水中A-4(L)侵染PCC 7120 OD750曲线 Fig.7 OD750 curve for PCC 7120 infected by A-4(L) in the filtered lake water |
根据全光照30℃条件下胞外A-4(L) DNA pol基因的拷贝数在0~2 h内下降,可知A-4(L)的潜伏期为2 h左右,而牛晓莹[15]发现噬藻体PP在29℃条件下的潜伏期为200 min左右,表明A-4(L)的潜伏期较短,可快速裂解藻细胞。根据图 3B以及OD750曲线结果,A-4(L)在大幅度裂解藻细胞之前已经进行胞外释放了。因为MOI为0.01左右,起始A-4(L)只能裂解约1%的极少量藻细胞并释放子代A-4(L),同时未侵染的藻细胞可分裂产生新的细胞,所以此时藻细胞未被大量裂解,而随着A-4(L)在胞内复制的进行达到顶峰后,这时藻细胞才能被大量的A-4(L)大幅度裂解。在连续光照且MOI=0.01条件下,A-4(L)在8 h后即可快速裂解PCC 7120藻细胞,而在黑暗条件下无法裂解。类似地,噬藻体Pav-LD在光照条件下感染阿氏浮丝藻2天后便开始裂解,而在黑暗条件下一周也未裂解[23]。噬藻体在黑暗下无法裂解藻细胞,是侵染的哪一过程依赖光照呢?本研究表明,A-4(L)的吸附不依赖光照,因为在黑暗下仍然有超过50%吸附率。姜红[24]在探究噬藻体PP感染野生宿主的增殖动力学中,发现光照不是噬藻体吸附到宿主上的必要条件,这与本研究结论一致。而胞内和胞外A-4(L) DNA pol基因的拷贝数结果表明,黑暗抑制了胞内A-4(L)复制,且在黑暗下胞外噬藻体释放量远低于光照条件下,说明胞内A-4(L)复制和胞外释放高度依赖光照。所以本研究表明黑暗条件下A-4(L)的复制以及子代A-4(L)的释放受到抑制,导致其无法裂解藻细胞。Borbély等[25]发现在黑暗条件下丝状蓝藻的噬藻体复制增殖会完全停止,因为噬藻体复制需要宿主细胞的ATP[26],而ATP主要由宿主光合作用产生。通过比较胞内和胞外A-4(L) DNA pol拷贝数,可以发现光照组的胞内A-4(L) DNA pol拷贝数高于胞外A-4(L) DNA pol拷贝数,主要原因在于,当A-4(L)释放到胞外后,会被吸附到未裂解的藻细胞上,导致胞外测定的A-4(L) DNA pol拷贝数低于胞内。
3.1.2 光照强度Puxty等[27]发现聚球藻噬藻体S-PM2d在高光照条件(210 μmol /(m2 ·s))下的潜伏期比低光照条件(15 μmol/(m2 ·s))下缩短了5 h。光照强度不仅会影响噬藻体的潜伏周期,还会影响噬藻体吸附率和子代噬藻体释放量。Kao等[22]在不同光强下测定了噬藻体AS-1子代释放量,发现光照强度的增加导致子代AS-1释放量的相应增加;他还发现在光强为45 μmol/(m2 ·s)时,侵染样品上清中未被吸附的噬藻体效价比光强为3 μmol/(m2 ·s)要低4~6倍,说明光强越高,噬藻体吸附率也越高。本研究中光强200 μmol/(m2 ·s)和80 μmol/(m2 ·s)时的噬藻体吸附率均显著高于光强0 μmol/(m2 ·s),但是光强200 μmol/(m2 ·s)的吸附率并未比光强80 μmol/(m2 ·s)高,可能是80 μmol/(m2 ·s)的光强太高,该光强条件下,噬藻体的吸附率已经达到最大。此外,本研究中吸附率是利用MPN法测定上清中未吸附的A-4(L)效价,其中MPN法采用了4管平行,平行数较少,可能是导致图 2中有些误差线较大的原因之一。
3.1.3 光照时长A-4(L)在黑暗下连续24 h都无法裂解藻细胞,而在有光时连续光照7 h(MOI为0.01时)便可在黑暗下裂解藻细胞(图 4B),说明充足的光照对于噬藻体裂解藻细胞是必需的。噬藻体侵染需要充足的光照,我们推测是因为侵染的前期某一过程需要光照的参与。A-4(L)吸附不需要光照,但是DNA复制高度依赖光照。且光照条件下A-4(L) DNA复制在8 h达到顶峰,A-4(L)在给光7 h后可在黑暗下裂解藻细胞,表明依赖光照的大量复制完成后,A-4(L)可以在黑暗下裂解藻细胞。噬藻体AS-1侵染物光照培养0.5~1 h后移到黑暗下时,AS-1无法产生正常的子代噬藻体,而在光照下培养3 h后移到黑暗下时,AS-1能够释放大量的子代噬藻体[22],AS-1成功感染所需的光照时长可能与感染时的具体过程有关[28-29]。这些结果均表明噬藻体需要充足的光照来助其完成某一侵染过程,一旦完成之后,剩余的裂解进程就可以在黑暗下发生。少量A-4(L) DNA复制可在黑暗下进行,可能是因为A-4(L)可以借助藻细胞氧化磷酸化获得的能量进行复制[30]。然而相比于黑暗条件下的胞内A-4(L) DNA复制,胞外A-4(L)释放量极少,即少量复制完成的A-4(L)几乎无法进行胞外释放,可能是A-4(L)在黑暗条件下无法完成衣壳蛋白合成或衣壳蛋白与基因组包装的过程。
3.2 温度对侵染的影响本研究表明,在15~25℃区间内,随着温度升高,A-4(L)的裂解时间提前,而25℃和30℃时A-4(L)裂解藻细胞的时间一致。牛晓莹等[15]在探究CO2浓度和温度升高对噬藻体PP增殖的联合作用时,发现温度升高大幅度提高了PP的裂解周期和子代PP释放量。因为噬藻体依靠宿主细胞增殖,所以感染成功与否很大程度上取决于宿主细胞的生理状态[31],即有利于宿主生长的条件能促进噬藻体的感染。本研究中,PCC 7120在25~30℃这个温度区间生理状态好,导致A-4(L)对其裂解速度快。但是牛晓莹等[15]指出温度升高对宿主的生长没有影响,但是仍能促进PP的感染。可能的原因是,牛晓莹设置的温度为25℃和29℃,此时宿主已经达到最佳的生理状态,所以从25℃升到29℃,宿主的生理状态并不会改变。但是由于噬藻体的核衣壳由结构蛋白质组成[32],温度升高能够增强宿主细胞内某些酶的活性,提高病毒大分子合成与核衣壳装配的效率[33],从而提高子代噬藻体释放量。
3.3 MOI对侵染的影响Tucker等[34]发现在Baroon湖泊中的噬藻体Ma-LBP的效价与铜绿微囊藻细胞去除率呈正相关,添加的Ma-LBP效价越高,藻细胞生物量下降的越多。本研究中以A-4(L)侵染后24 h为限,当MOI为1.13、1.13×10-2、1.13×10-4和1.13×10-6时,藻细胞的OD750分别下降了76%、59%、58%和41%。即MOI越大,噬藻体裂解宿主细胞效果越好,且裂解时间提前。此外,Fuhrman等[35]估计每毫升宿主和噬藻体数量的乘积为1012时,噬藻体才裂解藻细胞。本研究中,当MOI为10-6时,每毫升藻细胞和A-4(L)数量乘积在1010左右,但是A-4(L)仍可裂解藻细胞。同样,Tucker等[34]在实验室探究噬藻体和铜绿微囊藻裂解感染时,两者数量乘积在1010~1014之间,藻细胞仍然可以裂解,推测是因为在实验室的藻细胞培养条件和噬藻体侵染条件适宜。
3.4 室外实验光照对A-4(L)侵染影响的结果表明,噬藻体裂解藻细胞依赖光照且需要6 h及以上的光照时长,基于此,建议上午7:00—12:00投加噬藻体。温度对A-4(L)侵染的影响研究中发现,20℃时噬藻体光照14 h后才能大量裂解藻细胞,而25℃和30℃时噬藻体光照8 h(MOI为0.01)后便可大量裂解藻细胞,可知在环境温度为25~30℃时,噬藻体可以利用白天光照裂解藻细胞。针对噬藻体投放剂量问题,综合考虑成本以及充分利用白天光照完成裂解,建议投放剂量MOI为0.01。从室外验证实验可以看出,A-4(L)在日光照射的湖水样品中可以高效裂解藻细胞。当然,此室外验证使用的蓝藻是室内纯培养模式株,针对野外不同种类蓝藻的控制还难以实现。姜红等[36]以武汉东湖水体中存在的丝状蓝藻作为噬藻体PP的野生宿主时,发现PP感染效率远低于其对室内纯培养鲍氏织线藻的效率。野外环境复杂,蓝藻种类繁多,分离更多的噬藻体将使其更好地应用于蓝藻水华的控制中。
4 结论本研究探究光照、温度和MOI对于A-4(L)侵染PCC 7120的影响,从而推定了应用噬藻体裂解藻细胞的最佳投加时间和投加剂量。即在环境温度为25~30℃时,上午7:00—12:00投加噬藻体使MOI约为0.01,可在24 h内将藻细胞裂解,且室外日光光照下的实验证明上述条件适用于在抽滤的湖水中高效裂解藻细胞,为噬藻体应用于蓝藻水华的控制提供一定的基础。但是噬藻体应用存在特异性较强、野生藻株与实验室驯化的藻株有很大差异、以及感染后出现抗性藻株等问题,在将来的天然水体实际应用中还需要进一步的研究。
| [1] |
DeBruyn JM, Leigh-Bell JA, McKay ML et al. Microbial distributions and the impact of phosphorus on bacterial activity in Lake Erie. Journal of Great Lakes Research, 2004, 30: 166-183. DOI:10.1016/S0380-1330(04)70338-X |
| [2] |
Sullivan MB, Waterbury JB, Chisholm SW. Cyanophages infecting the oceanic cyanobacterium Prochlorococcus. Nature, 2003, 424: 1047-1051. DOI:10.1038/nature02147 |
| [3] |
Garza DR, Suttle CA. The effect of cyanophages on the mortality of Synechoeoccus spp. and selection for UV resistant viral communities. Microbial Ecology, 1998, 36: 281-292. DOI:10.1007/s002489900115 |
| [4] |
Hewson I, O'Neil JM, Dennison WC. Virus-like particles associated with Lyngbya majuscula (Cyanophyta; Oscillatoriacea) bloom decline in 5 Moreton Bay, Australia. Aquatic Microbial Ecology, 2001, 25: 207-213. DOI:10.3354/ame025207 |
| [5] |
Suttle CA. The significance of viruses to mortality in aquatic microbial communities. Microbial Ecology, 1994, 28: 237-243. DOI:10.1007/BF00166813 |
| [6] |
Yoshida M, Yoshida T, Kashima A et al. Ecological dynamics of the toxic bloom-forming cyanobacterium Microcystis aeruginosa and its cyanophage in freshwater. Applied and Environmental Microbiology, 2008, 74(10): 3269-3273. DOI:10.1128/AEM.02240-07 |
| [7] |
Coulombe AM, Robinson GGC. Collapsing Aphanizomenon flos-aquae blooms: Possible contributions of photo-oxidation, O2 toxicity and cyanophages. Canadian Journal of Botany, 1981, 59(7): 1277-1284. DOI:10.1139/b81-171 |
| [8] |
Weinbauer MG, Fuka D, Puskaric S et al. Diel, seasonal, and depth related variability of viruses and dissolved DNA in the Northern Adriatic Sea. Microbial Ecology, 1995, 30(1): 25-41. DOI:10.1007/BF00184511 |
| [9] |
Desjardins PR, Olson GB. Viral control of nuisance cyanobacteria (blue-green algae).Ⅱ. Cyanophage strains, stability studies of phages and hosts, and effects of environmental factors on phage-host interactions. California Water Resources Center, 1983, 185. |
| [10] |
Martin EL, Benson R. Phages of cyanobacteria. In: Calendar R(ed). The Bacteriophages. Plenum Publishing Corporation, 1988, 2: 607-645.
|
| [11] |
Yoshida T, Takashima Y, Tomaru Y et al. Isolation and characterization of a cyanophage infecting the toxic cyanobacterium Microcystis aeruginosa. Applied and Environmental Microbiology, 2006, 72(2): 1239-1247. DOI:10.1128/AEM.72.2.1239-1247.2006 |
| [12] |
Lin W, Li DF, Sun ZT et al. A novel freshwater cyanophage vB_MelS-Me-ZS1 infecting bloom-forming cyanobacterium Microcystis elabens. Molecular Biology Reports, 2020, 47(10): 7979-7989. DOI:10.1007/s11033-020-05876-8 |
| [13] |
张珊珊. 噬藻体MinS1和YongM基因组分析及定量蛋白质组学分析[学位论文]. 河北: 河北师范大学, 2022.
|
| [14] |
Liao XY, Ou T, Gao H et al. Main reason for concentric rings plaque formation of virus infecting cyanobacteria A-4(L) in lawns of Anabaena variabilis. Acta Microbiologica Sinica, 2014, 54(2): 191-199. [廖湘勇, 欧铜, 高宏等. 蓝细菌病毒A-4(L)在鱼腥藻(Anabaena variabilis)藻苔中形成同心圆噬斑的成因. 微生物学报, 2014, 54(2): 191-199.] |
| [15] |
Niu XY, Cheng K, Rong QQ et al. The combined effects of elevated CO2 and elevated temperature on proliferation of cyanophage PP. Acta Ecologica Sinica, 2012, 32(22): 6917-6924. [牛晓莹, 程凯, 荣茜茜等. CO2浓度和温度升高对噬藻体PP增殖的联合作用. 生态学报, 2012, 32(22): 6917-6924.] |
| [16] |
Cheng K, Wang CY, Guo YX et al. Measurement of lysing cycle and burst size of cyanophage infecting filamentous cyanobacteria(blue-green algae). Virologica Sinica, 2002, 17(4): 374-376. [程凯, 王春艳, 郭亚新等. 感染丝状蓝藻的噬藻体的裂解周期和释放量的测定. 中国病毒学, 2002, 17(4): 374-376.] |
| [17] |
Koz'yakov S. Cyanophages of the series A(L) specific for the blue-green alga Anabaena variabilis. Exp Algol Biol Sci Res, 1977, 25: 151-175. |
| [18] |
Hu NT, Thiel T, Giddings Jr TH et al. New Anabaena and Nostoc cyanophages from sewage settling ponds. Virology, 1981, 114(1): 236-246. DOI:10.1016/0042-6822(81)90269-5 |
| [19] |
Rinat AG, Valentina B, Francesca DP et al. Robust, coherent, and synchronized circadian clock-controlled oscillations along Anabaena filaments. eLife, 2021, 10: e64348. DOI:10.7554/eLife.64348 |
| [20] |
熊珍珍. 噬藻体A-1(L)和A-4(L)侵染鱼腥藻PCC 7120的识别机理[学位论文]. 武汉: 中国科学院水生生物研究所, 2017.
|
| [21] |
Lindell D, Jaffe JD, Coleman ML et al. Genome-wide expression dynamics of a marine virus and host reveal features of co-evolution. Nature, 2007, 449(7158): 83-86. DOI:10.1038/nature06130 |
| [22] |
Kao CC, Green S, Stein B et al. Diel infection of a cyanobacterium by a contractile bacteriophage. Applied and Environmental Microbiology, 2005, 71(8): 4276-4279. DOI:10.1128/AEM.71.8.4276-4279.2005 |
| [23] |
Gao EB, Li SH, Lv B et al. Analysis of the cyanophage (PaV-LD) infection in host cyanobacteria under different culture conditions. Acta Hydrobiologica Sinica, 2012, 36(3): 420-425. [高恶斌, 李三华, 吕波等. 水华蓝藻噬藻体对不同条件培养的宿主细胞感染性分析. 水生生物学报, 2012, 36(3): 420-425.] |
| [24] |
姜红. 噬藻体PP感染野生宿主的增殖动力学研究[学位论文]. 武汉: 华中师范大学, 2007.
|
| [25] |
Borbély G, Kari C, Gulyás A et al. Bacteriophage infection interferes with guanosine 3'-diphosphate-5'-diphosphate accumulation induced by energy and nitrogen starvation in the cyanobacterium Anacystis nidulans. Journal of Bacteriology, 1980, 144(3): 859-864. DOI:10.1128/jb.144.3.859-864.1980 |
| [26] |
Padan E, Ginzburg D, Shilo M. The reproductive cycle of cyanophage LPPI-G in Plectonema boryanum and its dependence on photosynthetic and respiratory systems. Virology, 1970, 40: 514-521. DOI:10.1016/0042-6822(70)90194-7 |
| [27] |
Puxty RJ, Evans DJ, Millard AD et al. Energy limitation of cyanophage development: Implications for marine carbon cycling. The ISME Journal, 2018, 12: 1273-1286. DOI:10.1038/s41396-017-0043-3 |
| [28] |
Sherman LA, Connelly M, Sherman DM. Infection of Synechococcus cedrorum by the cyanophage AS-1M. I. Ultrastructure of infection and phage assembly. Virology, 1976, 71: 1-16. DOI:10.1016/0042-6822(76)90089-1 |
| [29] |
Sherman LA, Pauw P. Infection of Synechococcus cedrorum by the cyanophage AS-1M. Ⅱ. Protein and DNA synthesis. Virology, 1976, 71: 17-27. DOI:10.1016/0042-6822(76)90090-8 |
| [30] |
Cheng K, Frenken T, Brussaard CPD et al. Cyanophage propagation in the freshwater cyanobacterium phormidium is constrained by phosphorus limitation and enhanced by elevated pCO2. Frontiers in Microbiology, 2019, 10: 617. DOI:10.3389/fmicb.2019.00617 |
| [31] |
Mojica, Kristina DA, Brussaard et al. Factors affecting virus dynamics and microbial host-virus interactions in marine environments. FEMS Microbiology Ecology, 2014, 89: 495-515. DOI:10.1111/1574-6941.12343 |
| [32] |
邓凤霞. 噬藻体PP的时空分布研究[学位论文]. 武汉: 华中师范大学, 2006.
|
| [33] |
Zhang YY, Huang LL, Wang XY et al. Regulation of cyanobacteria population density by cyanophage and its effect on material circulation in water. J Lake Sci, 2022, 34(2): 376-390. [张奕妍, 黄兰兰, 王夕予等. 噬藻体对蓝藻种群密度的调控及其对水体中物质循环的影响. 湖泊科学, 2022, 34(2): 376-390. DOI:10.18307/2022.0202] |
| [34] |
Tucker S, Pollard P. Identification of cyanophage Ma-LBP and infection of the cyanobacterium Microcystis aeruginosa from an Australian subtropical lake by the virus. Applied and Environmental Microbiology, 2005, 71(2): 629-635. DOI:10.1128/AEM.71.2.629-635.2005 |
| [35] |
Fuhrman JA, Suttle CA. Viruses in marine planktonic systems. Oceanography, 1993, 6: 50-62. |
| [36] |
Jiang H, Cheng K, Xiao CQ et al. The relationship between cyanophage PP and its wild host(filamentous cyanobacteria): Adsorption rate, latent period and burst size. Acta Ecologica Sinica, 2007(7): 2911-2915. [姜红, 程凯, 肖慈琼等. 噬藻体PP对野生宿主——丝状蓝藻的吸附率、裂解周期及释放量的影响. 生态学报, 2007(7): 2911-2915.] |
 2023, Vol. 35
2023, Vol. 35 


