(2: 中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 210008)
(3: 兰州大学泛第三极环境中心, 兰州 730000)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P.R. China)
(3: Center for the Pan-Third Pole Environment, Lanzhou University, Lanzhou 730000, P.R. China)
水体和沉积物是湖泊生态系统中迥异但又紧密相连的两类生境[1]。由于水体和沉积物的理化特征存在差异,栖息在这两类生境中的细菌群落特征也存在显著的差异[2-3]。细菌是湖泊生态系统中物质循环和能量流动的重要参与者,在维持生态系统平衡和驱动元素循环中起着关键性作用[4-5]。同时,细菌对环境变化的敏感性较高,是环境变化的重要标志[5-6]。因此,研究湖泊水体和沉积物细菌群落结构的差异对于湖泊水生态治理与保护具有重要的科学意义[7-8]。
目前,有关湖泊水体和沉积物细菌群落结构组成和多样性的研究越来越多的受到科研人员的关注。汪欣等[9]研究发现宛山荡水体中细菌群落的演替受沉水植物的影响较为明显,同时水生植物的存在会增加水体中细菌的代谢活性;周天旭等[10]研究发现,深水湖泊中细菌群落结构组成和多样性存在明显的垂向分层现象;对于沉积物而言,Zhao等[11]研究发现沉积物中细菌的群落结构与湖泊中生长的植被类型有关,而高慧琴等[12]研究表明细菌的多样性与沉积物的理化性质有关。此外,细菌网络模式反映了细菌之间复杂的相互作用、细菌群落构建以及细菌群落之间的生态位共享程度,其在水体和沉积物生境相关研究中得到了应用[13]。Yang等[14]研究发现柴达木盆地湖泊水体细菌网络的节点数、模块化、平均路径长度显著低于沉积物。综合来看,细菌群落结构和多样性是分析细菌结构差异的最常用手段,然而,上述手段忽略了由细菌之间相互作用驱动的细菌结构差异。
太湖是我国第三大淡水湖泊,在经济发达的长江三角洲具有举足轻重的地位。同时,太湖生态类型多样,不同湖区之间生境条件存在显著差异[15],是研究细菌群落结构和功能对生境变化响应的理想场所。石文莉等[16]研究表明太湖不同湖区营养水平对沉积物细菌网络特征影响显著,与轻度富营养湖区相比,中度富营养化湖区细菌网络更为密集,其抗环境干扰的能力更强;汪贝贝等[17]研究发现冬季太湖底泥细菌群落特征受水体总磷影响最为显著,其次是硝态氮;刘新等[18]研究表明太湖优势物种马来眼子菜和芦苇在腐解过程中水体细菌群落发生了显著改变,逐渐以难降解有机类细菌为主。此外,太湖水华过程[19]、沉积物环境变化[20]均会对细菌群落产生显著的影响。然而,前人研究更多的是关注太湖水体或是沉积物细菌群落特征及其影响因素,对水体和沉积物中细菌群落结构、多样性和细菌网络特征的差异研究相对较少。因此,本文以太湖为研究对象,分别采集水体和沉积物样本后基于高通量测序技术,结合多元统计分析方法解析太湖不同区域水体和沉积物中细菌群落结构组成和多样性水平、细菌网络特征及其驱动因素,并探讨营养盐水平和重金属对细菌群落组成和结构的影响,以期为太湖水生态保护与水资源管理提供新的思路。
1 材料与方法 1.1 研究区域概况太湖(30°55′40″~31°32′58″N,119°52′32″~120°36′10″E)位于长江中下游地区,属半封闭浅水湖泊,水面面积2338 km2, 平均水深1.89 m[21],水力停留时间约为284 d[22]。太湖地处亚热带季风气候,四季分明,夏季受热带海洋气团影响,盛行东南风,温和多雨;冬季受北方高压气团控制,盛行偏北风,寒冷干燥。由于湖泊面积大,太湖生境多样,各个区域水体营养水平、沉积物性质和大型水生植物分布存在显著的空间差异[23-24]。梅梁湾位于太湖北部,是太湖富营养化程度最高的区域之一,其水华强度高于其他区域[22]。太湖湖心区营养水平较低,处于中营养水平。太湖西部湖区属于河口区,该湖区受陆地污染源沿河汇入及河流和湖泊的双重影响[25-26]。太湖南部湖区受污染影响相对较小,水质优于西部湖区[27]。
1.2 采样点布设与样品采集按照不同生境,于2010年6月在太湖的西部湖区(A)、梅梁湾(B)、湖心区(C)和南部湖区(D)进行了表层水和表层沉积物样品的采集,共布设了27个样点(图 1)。表层水样品用5 L采水器采集1 L表层50 cm水样并带回实验室进行后续DNA提取及理化指标分析。表层沉积物样品使用柱状采样器(Φ90 mm×500 mm,Rigo公司,日本)进行原位无扰动采集,每个样点采集3根柱状沉积物,将上覆水排出后,用无菌抹刀现场提取3根柱状沉积物最顶部1 cm的沉积物,混合均匀后作为表层沉积物样品。将表层沉积物样品分成两份,一份样品用pH计、Pt电极和温度计分别测定pH值(Sed_pH)、氧化还原电位(Sed_Eh)和泥温(Sed_Temp),然后冷藏(4℃)并带回实验室进行后续理化指标分析,另一份样品存放于灭菌处理过的塑料采样瓶中,带回实验室后于-20℃冷冻保存用于后续细菌群落分析。
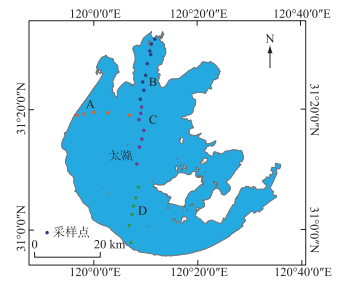
|
图 1 采样点位分布 Fig.1 The distribution of sampling sites |
现场利用6600V2型多参数水质仪(YSI)测定水温(Wat_Temp)、pH值(Wat_pH)和电导率(Wat_Cond),实验室分析指标包括硝态氮(Wat_NO3-)、亚硝态氮(Wat_NO2-)、铵态氮(Wat_NH4+)、磷酸盐(Wat_PO43-)和有色可溶性有机物(Wat_cDOM)。表层水样品经0.45 μm滤膜过滤后利用连续流动分析仪(Skalar SA 1000,Breda,荷兰)测定水体Wat_NO3-、Wat_NO2-、Wat_NH4+和Wat_PO43-浓度,Wat_cDOM浓度通过测定355 nm波长处的吸光度来确定,详细的分析步骤依据Bricaud等人[28]的方法。
1.4 沉积物理化指标分析孔隙水样品经0.45 μm滤膜过滤稀释后测定Sed_NO3-、Sed_NO2-、Sed_NH4+、Sed_TP和Sed_PO43-浓度,Sed_NO3-、Sed_NO2-、Sed_NH4+和Sed_PO43-浓度测定方法与水体指标一致,Sed_TP浓度采用钼酸铵分光光度法测定[29]。沉积物主要分析含水率(Sed_Wat_Content)、孔隙率(Sed_Porosity)、烧失量(Sed_LOI)、粒度(Sed_GrainSize)和重金属指标。Sed_Wat_Content采用烘干法进行测定[30],即表层沉积物在105℃下干燥24 h后的重量损失来确定;Sed_LOI采用点火法进行测定[31],Sed_Porosity采用Crusius和Anderson的方法进行测定[32],Sed_GrainSize采用激光衍射粒度分析仪(MastSizer 2000,英国)进行测定;Cu、Zn、Ni、Cr、Pb等金属元素使用电感耦合等离子体原子发射光谱法(ICP-AES)进行测定[33]。
1.5 细菌群落指标分析表层水样品选取500 mL水样,先用5 μm孔径滤膜过滤,再将滤后水使用0.2 μm孔径滤膜过滤后进行后续DNA提取,使用试剂盒(Fast DNA Spin Kit for Soil)分别提取表层水和沉积物样品中的DNA样本,选择引物27F(5′-AGAGTTTGGATCMTGGCTCAG-3′)和519R(5′-CGGTTACCTTGTTACGACTT-3′)以及8-bp条形码序列进行细菌16S rRNA基因的PCR扩增,将每个样品扩增3次后,混合扩增产物并进行纯化,将纯化的扩增子以等摩尔浓度合并,并使用Roche 454 FLX焦磷酸测序仪进行测序。
本文使用QIIME pipeline处理焦磷酸测序产生的序列[34]。具体方法如下:使用Denoiser算法对序列进行降噪[35],并使用基于种子的UCLUST算法以97%的成对相似度聚类成操作分类单元(OTU)[36],移除嵌合体后,使用PyNAST将每个OTU的代表性序列与Greengenes数据库的核心参考序列进行比对[37-38],最后,将细菌序列以最小序列数进行稀疏化,以确保生物多样性不受丰度或采样强度变化的影响。原始测序数据已经上传至MG-RAST数据库,序列登记编号为4508181.3~4508379.3。
1.6 数据处理与统计分析所有数据分析均在R软件(v 3.6.0)中进行。使用“vegan”和“adespatial”包分别计算水体和沉积物细菌群落的α多样性(Richness指数)和β多样性指数(local contribution to beta diversity,LCBD),比较不同区域之间细菌多样性的差异,LCBD详细的计算方法参见Pierre Legendre和Miquel De Cáceres[39]描述的方法进行;利用“stats”包里Kruskal-Wallis检验和Wilcoxon秩和检验比较环境因子在整体及两区域间的差异,分析水体和沉积物中细菌群落的组成并比较细菌门丰度在不同区域之间的差异;此外,基于细菌群落Bray-Curtis距离,使用非度量多维尺度分析(NMDS)研究水体和沉积物中细菌群落组成的差异,并使用相似性分析(ANOSIM)检验水体和沉积物细菌群落组成差异的显著性;利用“vegan”包线性拟合细菌群落的Bray-Curtis非相似性指数与地理距离之间的关系,使用Mantel test分析水体和沉积物细菌群落组成差异的显著性,探讨水体和沉积物细菌群落的距离衰减模式。使用“vegan”包进行PCA分析,并对10种重金属元素(Cu、Zn、Ni、Cr、Pb、Ba、Co、Fe、Mn、Sr)进行降维,以其第一轴PC1(解释度为51.93%)代表重金属组成进行后续分析;使用“stats”包计算Akaike信息准则(AIC值),选择合适的模型(一次模型或二次模型)来拟合多样性与环境因子的关系[40];此外,以超过一半样点出现过的细菌门丰富度和LCBD作为响应变量,使用“randomForestSRC”包对水体和沉积物中细菌群落组成的驱动因子进行分析。细菌网络构建:首先对样品进行OTU种间丰度进行相关性分析,基于随机矩阵理论(random matrix theory,RMT)方法,计算不同阈值条件下相关性矩阵对应的邻接矩阵,调整阈值条件,直至该邻接矩阵特征值分布近似于Poisson分布,相关系数大于此阈值的,认为其种间相关关系显著,从而确定分子生态网络的节点与边;在此基础上,利用“sparCC”包计算网络特征参数(节点数、连接数、平均度、平均路径长度、图密度、聚类系数),并采用Fast greedy法进行模块聚类计算,计算节点特征参数(模块性、正内聚力、负内聚力、总内聚力[41]以及负、正内聚力的比值,以进一步分析微生物群落动态与环境因子的关系,并通过Gephi软件将水体和沉积物细菌网络图进行可视化。
2 结果与分析 2.1 环境因子的空间分布特征太湖不同区域富营养化水平在空间上存在显著性差异(P < 0.05,附表Ⅰ)。对水体而言,B区除了Wat_NO3-和Wat_NH4+浓度未表现出显著性差异外(P>0.05),其他营养指标(Wat_PO43-、Wat_NO2-和Wat_cDOM)浓度均高于其他3个区域(P < 0.05);对沉积物而言,B区Sed_LOI含量也显著高于其他3个区域(P < 0.05),其他营养指标(Sed_TP、Sed_NO2-、和Sed_NH4+)含量与其他区域之间无显著差异性(P>0.05),Sed_PO43-含量低于A区,但不存在显著性差异(P>0.05)。
太湖不同区域之间沉积物重金属元素含量也存在显著的空间差异(P < 0.05),与其他3个区域相比,B区沉积物中重金属元素含量相对较高,其中Cu、Zn、Ni、Cr 4种典型重金属污染物含量均显著高于其他3个区域(P < 0.05)。此外,Pb、Co、Mn等重金属在不同区域均未表现出显著性差异(P>0.05)。
2.2 细菌群落组成太湖水体细菌群落分别检测出16个门类的3856个OTUs,而沉积物细菌群落分别检测出24个门类的15554个OTUs。太湖水体和沉积物中细菌群落组成存在明显的差异(图 2)。对水体细菌群落而言,放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和蓝细菌门(Cyanobacteria)是主要的优势细菌门,相对丰度均值分别达到了29.9%、28.2%和19.6%,相对丰度总和超过水体细菌总数的75%;对沉积物细菌群落而言,Proteobacteria的相对丰度最高,达到了37.1%,其次为酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和拟杆菌门(Bacteroidetes),但三者的相对丰度均远低于Proteobacteria。此外,Actinobacteria和Cyanobacteria虽然在水体中相对丰度较高,但在沉积物中,两者相对丰度分别仅占细菌总数的2.36%和2.05%。进一步使用NMDS和ANOSIM对水体和沉积物细菌群落组成的差异性进行解析,由图 3可知,水体和沉积物细菌群落呈现出显著差异(R2=0.48,P=0.001),且不同湖区细菌分布规律不一致,其中A区水体和沉积物细菌群落较为分散。细菌群落的Bray-Curtis非相似性指数与地理距离的线性拟合结果揭示了太湖水体和沉积物细菌均具有明显的距离衰减模式(图 4),沉积物细菌群落衰减模式与水体相比具有更大的斜率。
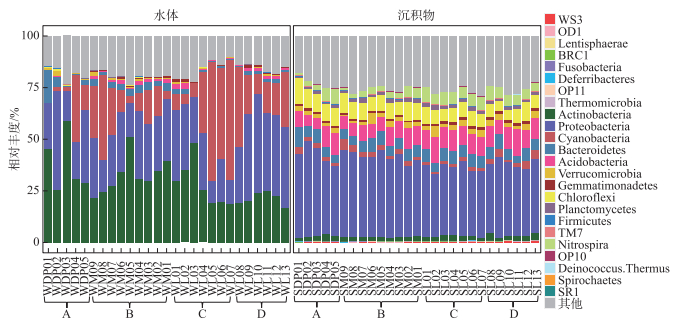
|
图 2 水体和沉积物细菌门类相对丰度 Fig.2 Phyla percentages of bacteria in the surface water and sediment of Lake Taihu |
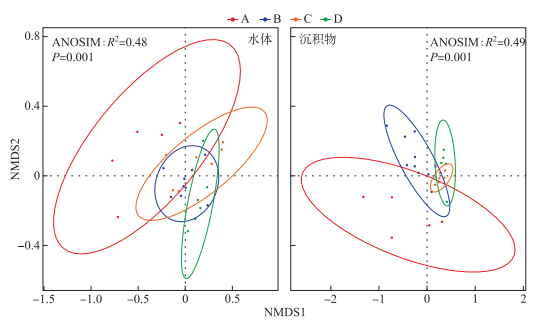
|
图 3 水体和沉积物细菌群落的NMDS图 Fig.3 Nonmetric multidimensional scaling (NMDS) based on the Bray-Curtis dissimilarity matrices of bacteria in the surface water and sediment of Lake Taihu |
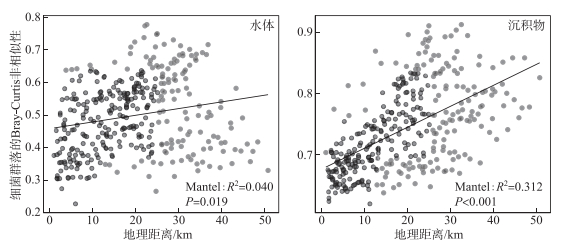
|
图 4 水体和沉积物细菌群落Bray-Curtis非相似性指数与地理距离之间的关系 Fig.4 Relationship between Bray-Curtis dissimilarity of bacterial communities and geographical distance in the surface water and sediment of Lake Taihu |
不同湖区之间细菌群落组成也存在显著差异(P < 0.05)。对水体细菌群落而言(附表Ⅱ),D区Proteobacteria的相对丰度显著高于其他3个区域(P < 0.05),而A区Acidobacteria的相对丰度显著低于其他3个区域(P < 0.05);D区Actinobacteria的相对丰度略低于C区,显著低于A和B区(P < 0.05);A区Bacteroidetes的相对丰度略低于B区,但略高于C区和D区;芽单胞菌门(Gemmatimonadetes)的相对丰度则表现为:D区略高于A区和C区,但略低于B区;其他细菌的相对丰度在不同区域之间未表现出显著性差异(P>0.05)。对沉积物细菌群落而言(附表Ⅱ,A区Proteobacteria的相对丰度稍高于B区和D区,显著高于C区(P < 0.05),而A区Chloroflexi的相对丰度最高,B区次之,C区和D区最低;Acidobacteria、Gemmatimonadetes和硝化螺菌门(Nitrospira)的丰度均表现为:A区与B区无显著性差异(P>0.05),但均显著低于C区和D区(P < 0.05);其他细菌的相对丰度在不同区域之间未表现出显著性差异(P>0.05)。
2.3 细菌群落多样性及其与环境因子的关系本文分别使用Richness和LCBD量化水体和沉积物细菌群落的α多样性和β多样性。由表 1可知,水体和沉积物细菌群落Richness均表现为A区>B区>D区>C区的分布规律,但水体细菌群落Richness显著低于沉积物细菌群落Richness(P < 0.05)。水体和沉积物细菌群落LCBD均表现为A区最高,但水体细菌群落LCBD在B区最低,而沉积物细菌群落LCBD在C区最低。
| 表 1 4个区域之间水体和沉积物细菌群落多样性的比较(平均值±标准差) Tab. 1 Comparison of bacterial community diversity in the surface water and sediment among four regions (mean ± standard deviation) |
太湖水体和沉积物中细菌群落多样性与营养盐指标(Sed_TP、Wat_cDOM、Wat_NH4+)和重金属组成(PC1)的相关性分析结果表明(图 5),在α多样性方面,沉积物细菌群落Richness与Sed_TP含量呈现显著非线性关系(P < 0.05),而水体细菌群落Richness则与该环境因子无显著相关关系(P>0.05);水体和沉积物细菌群落Richness与Wat_cDOM和Wat_NH4+浓度均无显著相关关系(P>0.05)。此外,水体细菌群落与PC1呈现显著负相关关系(P < 0.05),而沉积物细菌群落则与PC1无显著相关关系(P>0.05)。在β多样性方面,水体和沉积物细菌群落LCBD与Sed_TP含量均表现出线性正相关关系(P < 0.05),但沉积物细菌群落与Sed_TP的相关性更强;同时,水体和沉积物细菌群落与PC1均呈现出显著非线性关系(P < 0.01)。此外,沉积物细菌群落与Wat_cDOM浓度呈现显著非线性关系(P < 0.05),而水体细菌群落则与Wat_NH4+浓度呈现显著非线性关系(P < 0.05)。
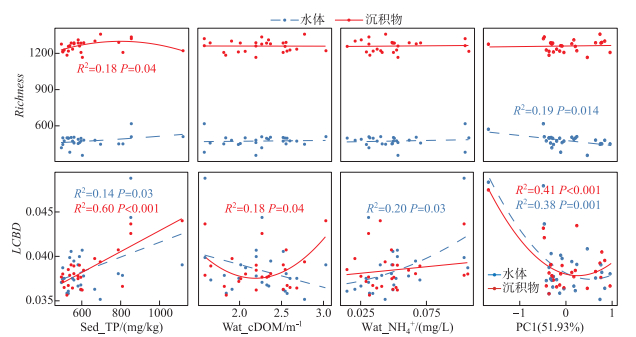
|
图 5 水体与沉积物中细菌群落多样性与营养盐指标和PC1的相关性(PC1:重金属组成) Fig.5 Relationships between Richness/LCBD and nutrient factors and PC1 for bacterial community in the surface water and sediment of Lake Taihu (PC1: the principal component of heavy metal elements) |
太湖水体和沉积物不同细菌门Richness具有不同的驱动因子。以主要细菌门(超过50%采样点中均被检测到)为例, 对水体细菌门而言,Actinobacteria受到Wat_Cond、Sed_Li、Sed_Eh和Wat_pH的驱动,而Proteobacteria则受到Sed_Porosity、PC1和Wat_Cond的驱动(图 6a);对沉积物细菌门而言,PC1、Sed_Na和Sed_Li含量是Proteobacteria的重要驱动因子,而Wat_NO2-和Wat_PO43-则是Actinobacteria的重要驱动因子(图 6c)。对整个细菌群落而言,Wat_Cond、Wat_pH、PC1和Sed_Porosity是影响水体细菌群落Richness的重要因子,而Sed_TP和Sed_Li含量是影响沉积物细菌群落Richness的重要因子。

|
图 6 以Richness和LCBD作为响应变量的随机森林分析(a~b:水体;c~d:沉积物) Fig.6 Results of random forest analysis with species Richness and LCBD as response variable (a-b: water; c-d: sediment) |
太湖水体和沉积物不同细菌门LCBD的驱动因子也存在明显的差异。以优势细菌门为例,在水体中,Actinobacteria的LCBD主要驱动因素是Sed_Na和PC1,而Proteobacteria的LCBD最重要的驱动因素是Sed_Li含量(图 6b);在沉积物中,Sed_TP和Sed_Li含量是Proteobacteria和Acidobacteria的LCBD共同的驱动因素,相比之下,Sed_Li对Proteobacteria的LCBD表现出更大的重要性(图 6d)。对于整个细菌群落而言,水体细菌群落LCBD的重要影响因子是PC1、Wat_Temp和Wat_pH,而沉积物细菌群落LCBD的重要影响因子是Sed_TP和Sed_Li含量。
2.5 细菌网络特征分析为了更加深入地研究细菌群落,本文分别构建了水体和沉积物中细菌群落的共现网络(图 7)。水体细菌群落网络图共由140个节点数和1202条连接数组成,包括705条正连接数和497条负连接数,主要细菌门为Proteobacteria(34.3%)、Actinobacteria(33.6%)和Cyanobacteria(25.7%),Actinobacteria和Cyanobacteria内部OTU之间的连接数均为正相关,而Proteobacteria内部OTU之间的连接数正负相关均存在。沉积物细菌群落网络图共由159个节点数和1310条连接数组成,包括639条正连接数和671条负连接数,主要细菌门为Proteobacteria(52.8%),Proteobacteria内部OTU之间的连接数与水体细菌网络类似,即正相关和负相关连接数均存在,且正连接数居多。
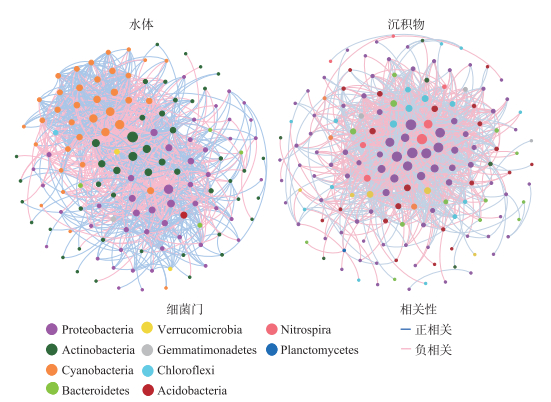
|
图 7 水体和沉积物中细菌共现网络 Fig.7 Co-occurrence networks of bacterial communities in the surface water and sediment |
细菌网络特征参数与环境因子的相关性分析结果表明(图 8),水体和沉积物中pH显著相关(R2=0.93,P < 0.01),二者均与水体细菌网络的平均度、图密度、聚集系数以及模块性呈现显著正相关关系(P < 0.05)。同时,正内聚力、负内聚力以及总内聚力与pH之间也呈现出正相关关系(P < 0.05),但负、正内聚力的比值随pH值的增加而降低。
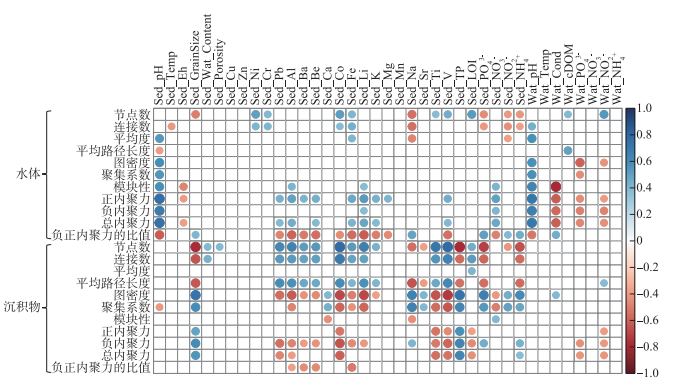
|
图 8 水体和沉积物细菌网络参数与环境因子的相关性(空白:代表相关性不显著) Fig.8 The correlations between network parameters of bacterial communities in the surface water and sediment and environmental variables (Blank: no significant correlation) |
对于沉积物细菌网络而言,沉积物中营养物质与金属元素含量与大多细菌网络参数具有显著相关性(P < 0.05)(图 8)。Sed_TP、Sed_PO43-和Sed_NH4+含量与节点数、连接数和平均路径长度呈现显著负相关关系(P < 0.05),但与图密度和聚类系数呈现显著正相关关系(P < 0.05)。同时,Sed_TP、Sed_PO43-和Sed_NH4+含量与负内聚力呈现显著正相关关系(P < 0.05)。此外,Sed_Pb、Sed_Al、Sed_Ba、Sed_Be、Sed_Co、Sed_Fe、Sed_Li、Sed_Ti和Sed_V含量均与节点数、连接数和平均路径长度呈现显著正相关关系(P < 0.05),且至少与图密度和聚类系数之一呈现显著负相关关系(P < 0.05)。同时,随着这些金属元素含量的增加,负内聚力和总内聚力大多表现出显著下降的趋势(P < 0.05),但正内聚力仅与Sed_Co、Sed_Ti、和Sed_V表现出显著负相关关系(P < 0.05)。
3 讨论 3.1 水体和沉积物细菌群落特征差异分析太湖水体和沉积物细菌群落组成和结构均表现出明显的空间异质性。不同区域沉积物中细菌均以Proteobacteria为主,但水体细菌优势种表现出差异(图 2),其原因可能是湖泊水体比沉积物更易受到周围环境的影响且水体受到外界干扰的程度不同(附表Ⅰ)。与水体细菌群落相比,沉积物部分细菌门的相对丰度在不同区域之间表现出显著性差异(附表Ⅱ),如Actinobacteria在A和B区的相对丰度高于其他两个区域,这与Wang等[42]的研究结果一致。与其他区域相比,A区水体和沉积物细菌群落较为分散(图 3),这表明A区水体和沉积物细菌群落空间异质性高。此外,沉积物细菌群落在空间上的周转率大于水体细菌群落(图 4),这可能与浅水湖泊沉积物更易受到扩散限制的影响有关。
沉积物细菌群落丰富度显著高于水体细菌群落(表 1),其原因可能是沉积物中固体颗粒物为细菌提供必要的附着体和充足的营养物质。此外,水体和沉积物细菌群落多样性均表现为A区最高(表 1),其原因可能是恶劣的环境条件促进了多种生境特化种的出现,从而增加了细菌群落的多样性水平[43]。
3.2 营养盐对细菌群落结构的影响营养盐通过改变水体pH、透明度和光照等环境因子,从而使细菌群落受到环境选择的强烈影响,最终导致细菌群落组成和结构的转变[42, 44]。在本研究中,水体细菌群落结构多样性主要受到水体pH的影响,而沉积物细菌群落多样性则是受到沉积物中TP的驱动(图 6),这表明太湖不同区域营养盐水平通过影响水体pH与沉积物中TP来间接驱动水体和沉积物中细菌群落结构的改变。当水体pH较高时,水体细菌网络的平均度、聚集系数、模块性以及总内聚力趋向于更高值,使得细菌网络结构变得更加复杂;同时,在高pH胁迫下,细菌群落的稳定性可能会下降(图 8),这表明营养盐还可以通过影响pH而间接影响细菌的网络结构。此外,本研究结果表明沉积物细菌网络结构与沉积物中营养盐含量有关(图 8),随着沉积物中营养盐含量的增加,生境的异质性可能会由于大型植物的丧失而大大降低,进而导致生态系统中可利用生态位的减少,最终引发物种对有限资源的更加激烈的竞争[45],这意味着随着太湖富营养化程度的增加,沉积物中细菌群落结构可能会变得更加紧密,种群间的竞争会更加激烈。
3.3 重金属对细菌群落结构的影响重金属的存在通常会对细菌具有毒害作用[46-47],其主要通过诱导活性氧自由基产生,进而对细菌造成不同程度的损伤[48],最终导致细菌群落组成和结构发生转变[49-50]。在本研究中,水体细菌群落多样性受PC1驱动,而沉积物细菌群落多样性受重金属元素Li驱动(图 6),这表明太湖水体和沉积物中细菌群落对重金属污染产生了截然不同的响应机制。同时,本研究发现水体和沉积物共有的细菌优势种受不同金属元素的驱动(图 6),产生这种变化的原因可能与细菌所处的环境有关[51]。此外,本研究结果表明随着沉积物中金属元素含量的增加,细菌群落网络规模逐渐增加,但其复杂性出现了下降(图 8),其原因可能是重金属胁迫使得细菌群落物种产生了改变,从而改变了细菌网络的结构[48]。
4 结论1) 太湖水体和沉积物中细菌群落组成表现出明显的差异性。Actinobacteria、Proteobacteria和Cyanobacteria是水体细菌群落中最主要的细菌门,而沉积物中Proteobacteria占据优势地位;同时,与水体相比,沉积物细菌群落在空间上的周转率更大。
2) 太湖不同区域水体和沉积物中细菌群落组成以及多样性具有明显的空间分布差异。Actinobacteria、Proteobacteria和Acidobacteria等优势细菌门的相对丰度在不同区域之间均表现出显著差异;水体和沉积物细菌群落丰富度均表现为A区>B区>D区>C区的分布规律,而细菌群落独特性(LCBD)则均表现为A区最高的分布规律。
3) 营养盐水平和重金属含量对太湖水体和沉积物细菌群落影响显著,且两类生境中细菌群落驱动因子存在显著差异。对水体而言,水体电导率、pH值、PC1和沉积物孔隙度是驱动细菌丰富度的重要因子,PC1、水温及pH值是影响细菌群落LCBD的重要因子,而细菌网络复杂性随pH值的增加而增加,且在高pH环境中占主导地位;对沉积物而言,其丰富度和LCBD变化的重要影响因子均是沉积物总磷和锂,细菌网络复杂性随金属元素施加的环境压力增大而降低,但随总磷、磷酸盐和铵态氮浓度的增加而增加。
5 附录附表Ⅰ、Ⅱ见电子版(DOI: 10.18307/2023.0536)。
| 附表Ⅰ 太湖4个区域环境因子比较(均值±标准差) Appendix Ⅰ Comparison of environmental variables among four regions of Lake Taihu (mean ± standard deviation) |
| 附表Ⅱ 4个区域之间水体和沉积物细菌门的相对丰度比较(平均值±标准差) Appendix Ⅱ Comparison of the relative abundance of bacterial phyla in the surface water and sediment among four regions (mean ± standard deviation) |
| [1] |
Zeng J, Jiao CC, Zhao DY et al. Patterns and assembly processes of planktonic and sedimentary bacterial community differ along a trophic gradient in freshwater lakes. Ecological Indicators, 2019, 106: 105491. DOI:10.1016/j.ecolind.2019.105491 |
| [2] |
孙旭. 富营养化湖泊底栖动物对沉积物氮转化菌群落结构和功能的影响[学位论文]. 南京: 南京大学, 2015.
|
| [3] |
Jiao CC, Zhao DY, Zeng J et al. Disentangling the seasonal co-occurrence patterns and ecological stochasticity of planktonic and benthic bacterial communities within multiple lakes. Science of the Total Environment, 2020, 740: 140010. DOI:10.1016/j.scitotenv.2020.140010 |
| [4] |
孙芳. 蓝藻水华水体底泥微生物群落结构及铜锈环棱螺生物干扰的影响[学位论文]. 宁波: 宁波大学, 2012.
|
| [5] |
Azam F, Fenchel T, Field J et al. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series, 1983, 10: 257-263. DOI:10.3354/meps010257 |
| [6] |
Cotner JB, Biddanda BA. Small players, large role: Microbial influence on biogeochemical processes in pelagic aquatic ecosystems. Ecosystems, 2002, 5(2): 105-121. DOI:10.1007/s10021-001-0059-3 |
| [7] |
Zhu L, Sun LY, Chu RH et al. On the characteristic of sediments microbial community structure of urban polluted river. Advances in Water Science, 2013, 24(1): 132-137. [朱亮, 孙凌宇, 储如花等. 城市纳污河流沉积物微生物群落结构特征. 水科学进展, 2013, 24(1): 132-137.] |
| [8] |
Wu QL, Jiang HL. Microbiological research on Chinese lakes. Bulletin of Chinese Academy of Sciences, 2017, 32(3): 273-279. [吴庆龙, 江和龙. 中国湖泊微生物研究. 中国科学院院刊, 2017, 32(3): 273-279. DOI:10.16418/j.issn.1000-3045.2017.03.008] |
| [9] |
Wang X, He SW, Pan JZ et al. Effects of aquatic plant restoration on water quality and microbial functional diversity of Wanshan Lake. Journal of Ecology and Rural Environment, 2021, 37(10): 1352-1360. [汪欣, 何尚卫, 潘继征等. 水生植物恢复对宛山荡水质及水体微生物代谢功能多样性的影响. 生态与农村环境学报, 2021, 37(10): 1352-1360.] |
| [10] |
Zhou TX, Luo WL, Da J et al. Spatial distribution of bacterioplankton community composition and their diversity in Lake Fuxian during thermal stratification period. J Lake Sci, 2022, 34(5): 1642-1655. [周天旭, 罗文磊, 笪俊等. 抚仙湖垂向分层期间水体细菌群落结构组成及多样性的空间分布. 湖泊科学, 2022, 34(5): 1642-1655. DOI:10.18307/2022.0518] |
| [11] |
Zhao DY, Liu P, Fang C et al. Submerged macrophytes modify bacterial community composition in sediments in a large, shallow, freshwater lake. Canadian Journal of Microbiology, 2013, 59(4): 237-244. DOI:10.1139/cjm-2012-0554 |
| [12] |
Gao HQ, Liu L, Fang ZJ. Physicochemical properties and microbial diversity of superficial deposits of lakes in summer. Journal of Hohai University (Natural Sciences), 2011, 39(4): 361-366. [高慧琴, 刘凌, 方泽建. 夏季湖泊表层沉积物的理化性质与微生物多样性. 河海大学学报: 自然科学版, 2011, 39(4): 361-366. DOI:10.3876/j.issn.1000-1980.2011.04.002] |
| [13] |
Ren Z, Zhang C, Li X et al. Bacterial communities present distinct co-occurrence networks in sediment and water of the thermokarst lakes in the Yellow River source area. Frontiers in Microbiology, 2021, 12: 716732. DOI:10.3389/fmicb.2021.716732 |
| [14] |
Yang J, Jiang HC, Sun XX et al. Distinct co-occurrence patterns of prokaryotic community between the waters and sediments in lakes with different salinity. FEMS Microbiology Ecology, 2020, 97(1): fiaa234. DOI:10.1093/femsec/fiaa234 |
| [15] |
Cai TY, Ye C, Li CH et al. Analysis on diversity of aquatic macrophyte and environmental factors within radiant belt toward lake of lake-terrestrial ecotone in Lake Taihu. J Environ Eng Technol, 2022. [蔡天祎, 叶春, 李春华等. 太湖湖滨带水向辐射带水生植物多样性及生境因子分析. 环境工程技术学报, 2022. DOI:10.12153/j.issn.1674-991X.20210733] |
| [16] |
Shi WL, Jiang RD, Ma TH et al. Molecular ecological network analysis of sedimental microbial community and its response to environmental factors in different trophic status areas of Taihu Lake. Journal of Nanjing University (Natural Science), 2018, 54(5): 1045-1056. [石文莉, 蒋如东, 马天海等. 太湖不同营养水平湖区沉积环境微生物分子生态网络特征及其环境响应分析. 南京大学学报(自然科学), 2018, 54(4): 1045-1056.] |
| [17] |
汪贝贝, 刘宇轩, 陆光华等. 冬季太湖底泥细菌群落结构特征及其与环境因子的相关性. 环境科技, 2021, 34(3): 1-6. |
| [18] |
Liu X, Liu H, Jiang HL et al. Analysis of the production process of chromophoric dissolved organic matter (CDOM) and the change of microbial community in the decomposition process of different aquatic plants. Resources and Environment in the Yangtze Basin, 2020, 29(5): 1140-1149. [刘新, 刘浩, 江和龙等. 不同水生植物腐解过程中有色可溶有机物(CDOM)的产生过程及微生物群落变化分析. 长江流域资源与环境, 2020, 29(5): 1140-1149. DOI:10.11870/cjlyzyyhj202005009] |
| [19] |
冯胜, 李定龙, 秦伯强. 太湖水华过程中微生物群落的动态变化. 宁波大学学报, 2010, 23(1): 7-12. |
| [20] |
Liu X, Huang QH, Jiang HL et al. The decomposition processes of aquatic plant residue and the change of microbial community structure in a shallow lake sediment. Ecology and Environmental Sciences, 2016, 25(3): 489-495. [刘新, 黄庆慧, 江和龙等. 浅水湖泊沉积物中水生植物残体降解过程及微生物群落变化. 生态环境学报, 2016, 25(3): 489-495.] |
| [21] |
王苏民, 窦鸿身. 中国湖泊志. 北京: 科学出版社, 1998.
|
| [22] |
Xu H, Paerl HW, Qin BQ et al. Nitrogen and phosphorus inputs control phytoplankton growth in eutrophic Lake Taihu, China. Limnology & Oceanography, 2010, 55(1): 420-432. DOI:10.4319/lo.2010.55.1.0420 |
| [23] |
Qin BQ. The changing environment of Lake Taihu and its ecosystem responses. Journal of Freshwater Ecology, 2015, 30(1): 1-3. DOI:10.1080/02705060.2014.992053 |
| [24] |
Zhang YL, Liu XH, Qin BQ et al. Aquatic vegetation in response to increased eutrophication and degraded light climate in eastern Lake Taihu: Implications for lake ecological restoration. Scientific Reports, 2016, 6: 23867. DOI:10.1038/srep23867 |
| [25] |
Liu FX, Jiang Y, Wang JL et al. Assessment of water quality in the estuarine area (west of Wangyu River) of Gonghu Bay, Taihu Lake, China. Acta Agriculturae Shanghai, 2019, 35(3): 50-57. [刘福兴, 蒋媛, 王俊力等. 太湖贡湖湾(望虞河以西)主要河口区域水质状况评价. 上海农业学报, 2019, 35(3): 50-57. DOI:10.15955/j.issn1000-3924.2019.03.10] |
| [26] |
Ma TT, Fan YM, Li KY et al. Ecological health assessment of main estuaries of Lake Taihu based on phytoplankton index of biotic integrity. Journal of Ecology and Rural Environment, 2021, 37(4): 501-508. [马廷婷, 范亚民, 李宽意等. 基于浮游植物完整性指数的太湖主要河口生态健康评价. 生态与农村环境学报, 2021, 37(4): 501-508.] |
| [27] |
Jin YW, Zhu GW, Xu H et al. Spatial distribution pattern and stock estimation of nutrients during bloom season in Lake Taihu. Environmental Science, 2015, 36(3): 936-945. [金颖薇, 朱广伟, 许海等. 太湖水华期营养盐空间分异特征与赋存量估算. 环境科学, 2015, 36(3): 936-945. DOI:10.13227/j.hjkx.2015.03.024] |
| [28] |
Bricaud A, Morel A, Prieur L. Absorption by dissolved organic matter of the sea (yellow substance) in the UV and visible domains. Limnology and Oceanography, 1981, 26(1): 43-53. DOI:10.2307/2835805 |
| [29] |
国家环境保护总局. 水和废水监测分析方法(第四版). 北京: 中国环境科学出版社, 2002.
|
| [30] |
Wang F, Zhou B, Xu JM et al. Remote sensing inversion mode of suspended particles concentration in Hangzhou Bay based on in situ measurement spectrum. Environmental Science, 2008, 29(11): 3022-3026. [王繁, 周斌, 徐建明等. 基于实测光谱的杭州湾悬浮物浓度遥感反演模式. 环境科学, 2008, 29(11): 3022-3026. DOI:10.13227/j.hjkx.2008.11.052] |
| [31] |
Heiri O, Lotter AF, Lemcke G. Loss on ignition as a method for estimating organic and carbonate content in sediments: Reproducibility and comparability of results. J Paleolimnology, 2001, 25(1): 101-110. DOI:10.1023/A:1008119611481 |
| [32] |
Crusius J, Anderson RF. Core compression and surficial sediment loss of lake sediments of high porosity caused by gravity coring. Limnology and Oceanography, 1991, 36(5): 1021-1031. DOI:10.2307/2837598 |
| [33] |
Dahlquist RL, Knoll JW. Inductively coupled plasma-atomic emission spectrometry: Analysis of biological materials and soils for major, trace, and ultra-trace elements. Applied Spectroscopy, 2016, 32(1): 1-30. DOI:10.1366/000370278774331828 |
| [34] |
Caporaso JG, Kuczynski J, Stombaugh J et al. QⅡME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [35] |
Reeder J, Knight R. Rapidly denoising pyrosequencing amplicon reads by exploiting rank-abundance distributions. Nature Methods, 2010, 7(9): 668-669. DOI:10.1038/nmeth0910-668b |
| [36] |
Edgar RC. Search and clustering orders of magnitude faster than BLAST. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btp461 |
| [37] |
DeSantis TZ, Hugenholtz P, Larsen N et al. Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB. Applied and Environmental Microbiology, 2006, 72(7): 5069-5072. DOI:10.1128/aem.03006-05 |
| [38] |
Caporaso JG, Bittinger K, Bushman FD et al. PyNAST: A flexible tool for aligning sequences to a template alignment. Bioinformatics, 2010, 26(2): 266-267. DOI:10.1093/bioinformatics/btp636 |
| [39] |
Legendre P, De Caceres M. Beta diversity as the variance of community data: Dissimilarity coefficients and partitioning. Ecology Letters, 2013, 16(8): 951-963. DOI:10.1111/ele.12141 |
| [40] |
Yamaoka K, Nakagawa T, Uno T. Application of Akaike's information criterion (AIC) in the evaluation of linear pharmacokinetic equations. Journal of Pharmacokinetics and Biopharmaceutics, 1978, 6(2): 165-175. DOI:10.1007/bf01117450 |
| [41] |
Herren CM, McMahon KD. Cohesion: A method for quantifying the connectivity of microbial communities. The ISME Journal, 2017, 11(11): 2426-2438. DOI:10.1038/ismej.2017.91 |
| [42] |
Wang JJ, Zhang Y, Li ZK et al. Higher seasonal variation of actinobacterial communities than spatial heterogeneity in the surface sediments of Taihu Lake, China. Canadian Journal of Microbiology, 2013, 59(5): 353-358. DOI:10.1139/cjm-2012-0663 |
| [43] |
Shen D, Jurgens K, Beier S. Experimental insights into the importance of ecologically dissimilar bacteria to community assembly along a salinity gradient. Environmental Microbiology, 2018, 20(3): 1170-1184. DOI:10.1111/1462-2920.14059 |
| [44] |
Ren L, Jeppesen E, He D et al. pH influences the importance of niche-related and neutral processes in lacustrine bacterioplankton assembly. Applied and Environmental Microbiology, 2015, 81(9): 3104-3114. DOI:10.1128/AEM.04042-14 |
| [45] |
Shade A, Jones SE, McMahon KD. The influence of habitat heterogeneity on freshwater bacterial community composition and dynamics. Environmental Microbiology, 2008, 10(4): 1057-1067. DOI:10.1111/j.1462-2920.2007.01527.x |
| [46] |
Giller KE, Witter E, McGrath SP. Toxicity of heavy metals to microorganisms and microbial processes in agricultural soils: A review. Soil Biology and Biochemistry, 1998, 30(10-11): 1389-1414. DOI:10.1016/S0038-0717(97)00270-8 |
| [47] |
Gadd GM, Griffiths AJ. Microorganisms and heavy metal toxicity. Microbiol Ecol, 1977, 4(4): 303-317. DOI:10.2307/4250539 |
| [48] |
Johnes PJ. Evaluation and management of the impact of land use change on the nitrogen and phosphorus load delivered to surface waters: The export coefficient modelling approach. J Hydro, 1996, 183(3): 323-349. DOI:10.1016/0022-1694(95)02951-6 |
| [49] |
Li XQ, Meng DL, Li J et al. Response of soil microbial communities and microbial interactions to long-term heavy metal contamination. Environ Pollution, 2017, 231(1): 908-917. DOI:10.1016/j.envpol.2017.08.057 |
| [50] |
Yin HQ, Niu JJ, Ren YH et al. An integrated insight into the response of sedimentary microbial communities to heavy metal contamination. Scientific Reports, 2015, 5(1): 14266. DOI:10.1038/srep14266 |
| [51] |
Zhang LY, Delgado-Baquerizo M, Shi Y et al. Co-existing water and sediment bacteria are driven by contrasting environmental factors across glacier-fed aquatic systems. Water Res, 2021, 198(1): 117139. DOI:10.1016/j.watres.2021.117139 |
 2023, Vol. 35
2023, Vol. 35 


