(2: 广东省水库蓝藻水华防治中心, 广州 510632)
(3: 珠海水务环境控股集团有限公司, 珠海 519000)
(2: Guangdong Center for Control and Prevention of Reservoir Cyanobacteria Blooms, Guangzhou 510632, P.R. China)
(3: Zhuhai Water Environment Holdings Group LTD., Zhuhai 519000, P.R. China)
富营养化是水生态系统最主要的环境问题之一,富营养化发生与防治是水生态学研究的热点[1]。营养盐的增加是富营养化发生的根本原因,浮游植物丰度增加是富营养化的主要表征,浮游植物与营养盐的响应关系是富营养化防治的理论依据[1]。一般认为,淡水浮游植物主要受P限制,也称为P限制范式,在这一主导范式下,人们主要关注P对浮游植物的作用[2]。事实上,自然条件下,浮游植物生长所需的多种营养盐随地表径流同时进入水体,浮游植物群落改变是多营养盐联合添加的结果,而在P限制范式下,其他营养盐的作用长期被忽视[3]。
N、P和Fe均是浮游植物生长必需营养盐,流域人类活动带来的污染和水土流失会导致流域N、P和Fe大量进入水体,同时水体季节性厌氧酸化也会导致内源P和Fe季节性释放,N、P和Fe同时增加是水体普遍发生的现象[1, 4]。随着研究结果和经验的积累,人们发现不仅是P,N和Fe增加对浮游植物生长的促进作用在湖泊中也广泛存在[4]。例如,Guildford等[5]在非洲马拉维湖进行的N、P和Fe的富集实验表明,同时添加N、P和Fe时,Chl.a浓度是只添加N和P时的4倍。Wever等[6]在非洲坦噶伊卡湖的原位实验也证实浮游植物群落受N、P和Fe的共限制作用。North等[7]在北美伊利湖东部近岸和敞水区水域进行的营养加富实验表明,与单独添加N和P相比,N、P和Fe的组合添加导致浮游植物生物量更大程度的增加。许海等[8]在我国太湖的原位实验也证实在东太湖水域,Fe和N与P协同作用于浮游植物的生长。上述研究表明湖泊中浮游植物可能受N、P和Fe共限制,N和Fe与P共同影响浮游植物生长。
华南热带地区(北回归线以南)属于我国珠三角经济区,水库蓄水是该地区重要的水源,水库富营养化的防治是保障供水安全的重要内容。在这些水库中,溶解性P长期低于10 μg/L,水体N和P原子比维持在16∶1之上,P被认为是浮游植物生长的主要限制性营养盐[9]。近年更多的研究发现,N和Fe对浮游植物群落季节演替的解释作用比P更大[10]。进一步分析发现,水体中溶解性氮的浓度常低于0.3 mg/L,溶解性的铁浓度常低于0.05 mg/L,均属于文献报道的浮游植物生长限制性浓度阈值范围内[11],N和Fe也可能是潜在的限制因子。可见,基于NP原子比和限制性浓度阈值两种方法判断浮游植物生长限制性营养盐的结果不一致,需要进一步通过原位营养添加实验验证N、P、Fe对浮游植物的限制作用。该地区的降雨具有明显的季节性,80%的降雨集中在4-9月的丰水期,其中丰水期前期(4-6月)降雨和径流带来营养盐输入是水库外源营养输入的主要时期[10]。同时,受水体分层的影响,大型水库一般自4月出现稳定底部厌氧层和内源Fe释放,外源输入和内源释放共同导致该时期频繁出现N、P和Fe同时增加的现象[10]。为进一步揭示该季节性的N、P和Fe增加对浮游植物群落的作用,本研究以一座典型华南热带水库——广东省大沙河水库为例,于2021年1-6月期间,通过野外调查分析水库N、P、Fe浓度和浮游植物生物量的变化趋势,并通过原位营养盐添加实验揭示N、P和Fe加富对浮游植物群落的作用,为水库富营养化防治提供理论依据。
1 材料与方法 1.1 水库概况大沙河水库(22°52′N,112°43′E)是位于中国热带区域的中-富营养水库,水库的集雨面积2.17×105 m2,最大蓄水量为2.58×108 m3,正常库容1.57×108 m3,是广东省37座大型水库之一。水库在灌溉、防洪、发电、供水、养殖、造林等多方面发挥着重要作用,是开平市主要的水源地。水库年平均降水量为(2226±623)mm,丰水期为4-10月,枯水期为11月到次年3月[10]。实验点位于副坝前的敞水区(22°51′N,112°43′E),是水库主要供水区域(图 1)。
|
图 1 大沙河水库形态特征及原位实验位置 Fig.1 Morphological characteristics and in-situ experimental site in Dashahe Reservoir |
于2021年1-6月开展月度调查,采集表层0.5 m的水样,分析水库总氮(TN)和溶解性氮(DN)、总磷(TP)和溶解性磷(DP)、总铁(TFe)和溶解性铁(DFe)以及浮游植物生物量(以Chl.a指示)的变化,其中DN、DP和DFe即经过0.45 μm的纤维滤膜抽滤后滤水的总N、P和Fe。TN、DN、TP和DP按照国家水质监测标准方法(GB 3838-2002)用分光光度法测定;TFe和DFe用ICP-AES法测定;Chl.a采用经过0.45 μm的纤维滤膜抽滤250 mL水样,反复冻融-浸提,运用改进的丙酮萃取方法进行测定,所有样品均在24 h内处理和完成测定[12]。
1.3 原位实验设置于2021年4月17日在大沙河水库湖泊区逐月采样点位置开展实验。实验共设置8个实验组:1个对照组,7个处理组分别添加不同组合的营养元素,每组设置3个平行,共24个实验瓶。取130 L水库原水经64 μm孔径滤网滤除浮游动物后装于200 L清洁大桶中完全混匀后测定水中溶解性N、P、Fe,并将混匀后的水样分装入5 L透明的聚乙烯瓶,每瓶装4.7 L。因有文献指出N、P、Fe限制浮游植物生长的阈值范围分别为:≤ 0.3 mg/L、≤ 0.01 mg/L和≤ 0.1 mg/L[13-14],实验原水中溶解性的N、P和Fe浓度分别为0.1、0.008和0.046 mg/L,结合文献和原水条件,实验设置添加营养盐至充足条件,即保证生长不受营养盐限制。N和P的添加参考BG-11培养基,以KNO3为N源,N添加浓度为2.0 mg N/L,以K2HPO4·3H2O为P源,P添加浓度为0.2 mg P/L;为避免其他元素的干扰,以FeCl3·6H2O为Fe源[6],为避免Fe3+过高可能导致沉淀作用,设置Fe添加浓度为0.1 mg Fe/L(表 1)。添加营养盐后,将实验瓶置于水下0.2 m,原位培育10天,维持自然光照、温度、表面湍流条件。
| 表 1 实验设置的营养添加组合以及实验组和实验瓶标记 Tab. 1 The designed combination of nutrients addition in each experimental treatment and the labels of the experimental groups and bottles |
已有文献指出验证营养盐限制作用的原位实验周期应控制在3~10天以内[5-6],因此本实验于实验初始(T0)、第5(T5)和第10天(T10)采集水样,测定Chl.a。一般而言,封闭环境下浮游植物群落趋于稳定需要一周左右时间,因此,取第10天水样100 mL加1% Lugol固定,用于浮游植物群落定量分析。
浮游植物种类鉴定和门类划分参考《中国淡水藻类:系统、分类及生态》[15]。使用倒置显微镜,以视野法对浮游植物进行计数[16]。
浮游植物丰度计算公式为:
| Ni=(Ci⋅S)/(V⋅n⋅s) | (1) |
| N=m∑i=1Ni | (2) |
式中,Ni为种(或属)i的丰度(cells/mL),V为定量计数的水样体积(mL),S为计数框面积(mm2),s为计数视野面积(mm2),n为计数视野数,Ci为视野法计数的种i细胞总数(个),N为浮游植物群落的总丰度(cells/mL),i=1, 2, …, m, m为物种数。
丰度大于10%的种(或属)为群落中的优势种(或属)。
种(或属)i的优势度计算公式为:
| 优势度 (%)=(Ni/N)×100% | (3) |
多样性指标包括Shannon多样性指数(H)和Pielou均匀度指数(e),计算公式为:
| H=−m∑i=1(Pi⋅lnPi) | (4) |
| e=H/lnS | (5) |
式中,i=1, 2, …, m, m为物种数,N为全部种的个体总数,Ni为第i个物种的丰度,Pi=Ni/N,Pi表示第i个种丰度占浮游植物丰度的比例;S表示物种丰富度。
群落相异性指数(Bray-Curtis index, BC距离)表示群落差异性,计算公式为:
| BC 距离 =p∑i=1|xij−xik|p∑i=1(xij+xik) | (6) |
式中,xij和xik分别表示第i个物种在第j个和第k个样方中的丰度,P为物种数。
水库营养盐浓度与Chl.a浓度的关系采用Pearson相关性分析。原位实验数据中,对符合正态性和方差齐性的单指标,采用方差分析(analysis of variance, ANOVA)检验组间差异显著性,所有检验的显著性水平均为P<0.05。用非度量多维尺度分析(non-metric multidimensional scaling, NMDS)呈现处理组之间群落的差异及类群的生态位差异,采用置换多元方差分析(permutational multivariate analysis of variance, PerMANOVA)检验处理组之间群落差异的显著性。所有统计分析均通过R软件4.1.2版本完成,在R语言平台上采用软件包(multcomp、vegan和ggplot2)进行浮游植物群落的多样性计算和结构比较等多元统计分析[17]。
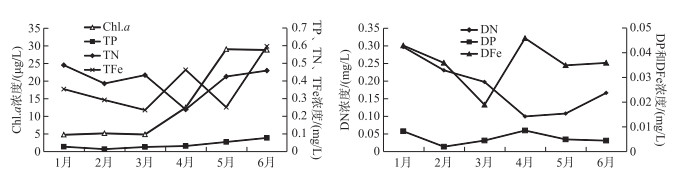
2 结果与分析 2.1 水库浮游植物与环境因子的变化调查期间N、P和Fe浓度变化趋势不同:TN浓度在1-3月期间逐月降低,在4-6月期间逐渐增加;TP浓度持续增加;TFe浓度在1-3月期间逐月降低,4-6月期间波动较大。DN浓度明显降低、DP浓度没有明显变化,而DFe浓度明显升高。4月份之后Chl.a浓度明显升高,从1-3月期间的(4.9±0.2)μg/L升高到6月的29 μg/L(图 2)。在统计上,仅有TP浓度与Chl.a浓度呈显著正相关(P<0.05, n=6, Pearson)。
|
图 2 营养盐(TN、TP、TFe、DN、DP和DFe)和叶绿素a浓度动态 Fig.2 Dynamics of nutrients (TN, TP, TFe, DN, DP and DFe) and Chl.a concentrations |
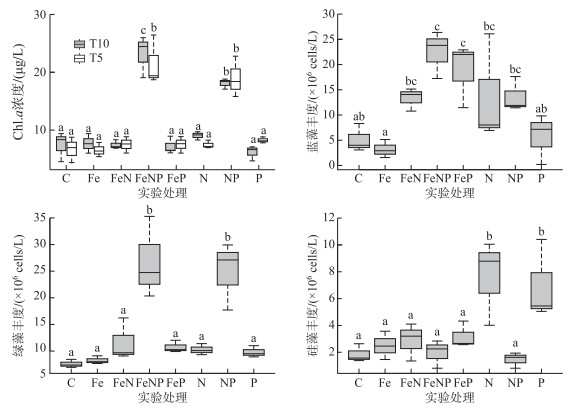
实验初始阶段(T0)Chl.a浓度为(2.9±1.0)μg/L,实验第5天(T5)和第10天(T10)NP和FeNP组Chl.a浓度显著高于其他组(P<0.05, ANOVA)分别是对照组的2和3倍,其中第10天FeNP组Chl.a显著高于NP组(P<0.05, ANOVA)。该结果表明只有NP的联合添加才能显著促进浮游植物总量的增加,而Fe添加可以显著加强这种促进作用。蓝藻、绿藻、硅藻为浮游植物的主要门类组成,所有营养盐添加组均有门类水平上丰度升高的现象,但各门类对营养盐添加的响应存在明显的差异:除单独加Fe组,处理组蓝藻丰度均明显高于对照组,其中FeP组和FeNP组显著高于对照组(P<0.05, ANOVA),丰度分别为(19±4)×106 cells/L和(22±3)×106 cells/L;所有处理组绿藻和硅藻丰度均高于对照组,绿藻仅在NP组和FeNP组显著升高(P<0.05, ANOVA),丰度分别为(20±4)×106 cells/L和(22±4)×106 cells/L,硅藻仅在N组和P组显著升高(P<0.05, ANOVA),丰度分别为(8±2)×106 cells/L和(7±4)×106 cells/L(图 3)。
|
图 3 各实验组浮游植物Chl.a浓度和蓝藻、绿藻和硅藻丰度 (箱线图中方框的底部和上部分别表示上四分位数和下四分位数;方框中的黑线表示中位数;虚线表示四分位高度的1.5倍;虚线顶部的线表示异常值截断) Fig.3 The Chl.a concentration and abundance of cyanobacteria, chlorophyte and diatom in each experimental treatment |
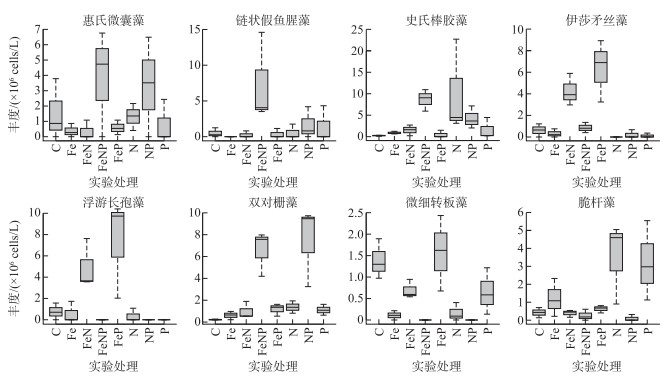
本实验中共鉴定出浮游植物6门57属94种(包括变种和变型),其中绿藻门60种,硅藻门15种和蓝藻门13种,其余种类包括隐藻、甲藻和裸藻有6种。有8个优势种,分别为:蓝藻门的浮游长孢藻(Dlichospermum planctonica)、伊莎矛丝藻(Cuspidothrix issatschenkoi)、惠氏微囊藻(Microcystis wesenbergii)、链状假鱼腥藻(Pseudoanabaena catenata)和史氏棒胶藻(Rhabdogloea smithii);绿藻门的微细转板藻(Mougeotia parvula)和双对栅藻(Scenedesmus bijugayus);硅藻门的脆杆藻(Fragilaria sp.)。所有营养盐添加组均有种水平上丰度升高的现象,但各优势种对营养盐添加的响应存在明显的差异:惠氏微囊藻、链状假鱼腥藻和史氏棒胶藻在FeNP组丰度最高,分别为(4±2)×106 cells/L、(7±4)×106 cells/L和(9±1)×106 cells/L,而浮游长孢藻和伊莎矛丝藻在FeP组丰度最高,分别为(7±3)×106 cells/L和(6±2)×106 cells/L。微细转板藻为对照组的浮游植物优势种,除FeP组,该种在其他组的丰度均显著低于对照组(P<0.05, ANOVA)。双对栅藻丰度在NP组丰度最高,为(7±2)×106 cells/L;脆杆藻在FeP组丰度最高,为(6±1)×105 cells/L。单独添加P组的脆杆藻显著高于对照组(P<0.05, ANOVA);单独添加N组双对栅藻、史氏棒胶藻和脆杆藻显著高于对照组(P<0.05, ANOVA);单独添加Fe组双对栅藻、史氏棒胶藻和脆杆藻明显高于对照组,但统计学上没有显著差异(图 4)。
|
图 4 惠氏微囊藻、链状假鱼腥藻、史氏棒胶藻、伊莎矛丝藻、浮游长孢藻、双对栅藻、微细转板藻和脆杆藻在各实验组中的丰度(箱图标识同图 3) Fig.4 The abundance of Microcystis wesenbergii, Pseudoanabaena catenata, Rhabdogloea smithii, Cuspidothrix issatschenkoi, Dlichospermum planctonica, Scenedesmus bijugayus, Mougeotia parvula and Fragilaria sp. in each experimental treatment |
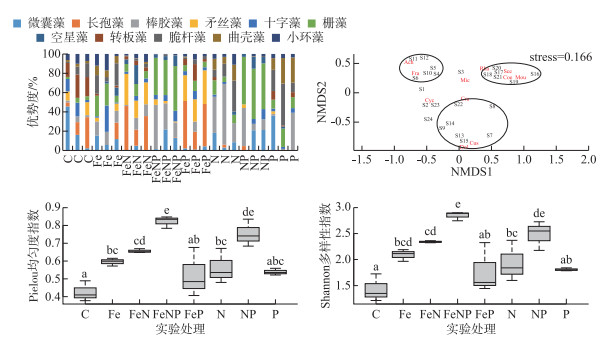
浮游植物群落中优势度大于10%的属共有11个:微囊藻(Microcystis)、长孢藻(Dolichospermum)、棒胶藻(Rhabdogloea)、矛丝藻(Cuspidothrix)、十字藻(Crucigenia)、栅藻(Scenedesmus)、空星藻(Coeastruml)、转板藻(Mougeotia)、脆杆藻(Fragilaria)、曲壳藻(Achnanthes)、小环藻(Cyclotella)。基于优势属的NMDS分析结果表明,不同的营养添加导致群落明显分化,群落组间差异显著(P<0.05, PerMANOVA)。基于群落的相似性,可将实验组分为3簇:FeN组和FeP组为一簇,群落优势属为丝状蓝藻(长孢藻和矛丝藻),与对照组群落BC距离均值为0.70±0.02;N组和P组为一簇,优势属为脆杆藻和曲壳藻,与对照组群落BC距离均值为0.75±0.03;NP组和FeNP组为一簇,群落优势属为微囊藻、棒胶藻、栅藻、空星藻和转板藻,与对照组群落BC距离均值为0.82±0.03。加Fe实验组与对照组群落距离最近,均值为0.56±0.11。所有营养盐添加组浮游植物Pielou均匀度指数和Shannon多样性指数均明显高于对照组。单独添加条件下,N组和Fe组群落Pielou均匀度指数和Shannon多样性指数均显著高于对照组,P组的Pielou均匀度指数和Shannon多样性指数也升高,但没有统计显著性;所有加N的联合添加组多样性指数均显著高于对照组。FeNP组Pielou均匀度为0.82±0.02,Shannon多样性指数为2.84±0.05,均显著(P<0.05, ANOVA)高于其他组(图 5)。
|
图 5 各组优势属组成和基于NMDS分析的群落组间差异以及Pielou均匀度指数和Shannon多样性指数(NMDS分析中Mic为微囊藻、Dol为长孢藻、Rha为棒胶藻、Cus为矛丝藻、Cru为十字藻、Sce为栅藻、Coe为空星藻、Mou为转板藻、Fra为脆杆藻、Ach为曲壳藻、Cyc为小环藻,S1~S24代表各实验瓶的群落,箱图标识同图 3) Fig.5 The composition of phytoplankton by dominant genus, community difference by NMDS analysis and Pielou evenness index and Shannon's diversity index |
本研究调查结果表明,4-6月期间水库TN、TP和TFe浓度均呈增加趋势,Chl.a浓度明显升高,TP浓度与Chl.a浓度呈显著正相关。原位实验结果表明N、P、Fe单独添加对浮游植物生物量(以Chl.a表征)的促进作用不显著,只有NP的联合添加才能显著促进Chl.a浓度的增加,而Fe添加可以显著加强这种促进作用。上述结果表明P是导致Chl.a浓度升高的主要因素,N和Fe的增加也是导致Chl.a浓度升高的重要原因。已有文献对浮游植物群落限制性营养盐的定义为:当添加某营养盐显著促进浮游植物生物量的增加时,该营养盐为浮游植物群落的限制因子;当单独添加某两种营养盐均不能促进浮游植物生物量的增加,而同时添加能显著促进浮游植物生长时,群落受到两种营养盐的共限制[18-19]。根据该定义,大沙河水库的浮游植物群落处于N和P共限制状态,因此只有N和P共同添加才能使Chl.a浓度显著升高。实验期间,溶解性氮(DN)浓度低于0.3 mg/L,溶解性磷(DP)浓度低于0.01 mg/L,均在浮游植物生长的限制性浓度阈值范围内[11, 14],基于限制性浓度阈值的评价结果也表明浮游植物处于N和P共限制或均不充足的环境。
调查期间水体中溶解性铁(DFe)浓度低于0.1 mg/L,处于部分蓝藻生长限制性浓度阈值,但大部分真核藻类Fe需求较低,Fe对真核藻类生长限制作用不明显[7-8]。Fe是浮游植物生长的必需元素,浮游植物大量增殖会消耗水体中可利用的Fe,当内外源补充速率低于消耗速率时,Fe也可能成为限制性元素。原位实验中,Fe单独添加既没有促进Chl.a浓度升高也没有促进浮游植物丰度的升高,但FeNP组的浮游植物丰度和Chl.a浓度均显著高于NP组。表明当N和P增加、浮游植物大量增殖之后,对Fe的消耗导致Fe成为浮游植物继续生长的限制因子,当Fe与NP同时补充后,浮游植物可以继续生长到达NP可以支持的最大生物量。该结果也证实了水体中的Fe不足以维持浮游植物长期的增殖,随着NP的增加,浮游植物生长消耗Fe,需要及时的补充以满足持续的生长。丰水期外源Fe的输入和内源Fe释放是很重要的补充来源,在N和P持续输入的背景下Fe的补充对Chl.a浓度的持续升高也有重要作用。
3.2 浮游植物类群间的响应差异原位实验中的浮游植物群落以蓝藻、绿藻、硅藻为主要门类组成,有8个优势种,结果表明各门类和优势种对营养盐添加的响应存在明显的门类和种间差异。N和P是细胞生长需求的大量元素,但物种对N和P的需求具有明显的种间差异[11]。蓝藻和绿藻在N和P单独添加时丰度升高不显著,在N和P共同添加条件下丰度显著升高,根据上述判断浮游植物群落限制因子的方法[19-20],表明蓝藻和绿藻受到N和P的共限制。硅藻丰度仅在N组和P组显著升高,但升高幅度明显低于绿藻和蓝藻,表明N和P对硅藻的限制作用不如绿藻和蓝藻明显,这与硅藻门种类适应低营养环境的特征一致[21-22]。
Fe元素是浮游植物生长必需元素,但不参与细胞结构(细胞壁、膜、核酸等)的组成,主要作为蛋白和酶的活性中心参与细胞代谢[23-24]。细胞内Fe主要分布于浮游植物光合系统中,浮游植物Fe需求的种间差异主要由光合系统PSI(含12个Fe原子)和PSII(含2~3个Fe原子)的比例决定[24]。一般而言,蓝藻比绿藻具有更高的PSI∶PSII比,因此属于原核生物的蓝藻门种类具有较高的Fe需求,在水体中最容易受到Fe的限制[23-24]。实验结果表明蓝藻丰度在加Fe组(FeP组和FeNP组)升高明显,蓝藻门优势种类丰度最大值均出现在加Fe组:惠氏微囊藻、假鱼腥藻和史氏棒胶藻在FeNP组丰度最高,而长孢藻和伊莎矛丝藻在FeP组丰度最高。Fe添加对绿藻和硅藻生长的促进作用不显著,这与绿藻和硅藻Fe需求低不易受Fe限制相一致。
基于优势属的NMDS分析结果表明,不同的营养添加导致群落明显分化,群落组间差异显著(P<0.05, PerMANOVA)。在N、P和Fe不足的条件下,群落中物种对营养盐需求的种间差异,会导致不同营养盐添加组合/比例下,浮游植物群落出现分化[23, 25]。本实验中不同营养盐添加组合/比例下,群落有明显的分化:FeN组和FeP组为一簇,群落优势属为丝状蓝藻的长孢藻和矛丝藻;N组和P组为一簇,优势属为脆杆藻和曲壳藻;NP组和FeNP组为一簇,群落优势属为微囊藻、棒胶藻、栅藻、空星藻和转板藻。该结果也表明浮游植物群落受到N、P和Fe的共限制,营养盐供应组合/比例的改变会导致群落结构改变。
3.3 浮游植物群落多样性对营养盐增加的响应原位实验结果表明,任意营养盐添加均导致群落均匀度和Shannon多样性指数升高,其中以FeNP组升高幅度最大。营养盐竞争是影响群落多样性的重要因素,一般而言,营养盐的竞争排斥会导致群落多样性降低,稳态条件下群落多样性取决于限制因子的数量,限制因子越多群落多样性越高[26]。本研究中,水体N、P和Fe均处于不充足状态,营养盐的添加会促进生长受限的种类生长,降低竞争排斥的效应,群落多样性增加是最直观的表现。陈纯等[27]在研究营养加富对浮游植物群落演替和多样性影响时发现,适量添加营养盐产生的上行效应可缓解浮游植物之间的竞争程度,提高浮游植物群落的多样性。该结果与本研究结果一致,证实在营养盐不足、群落生长受限的初始条件下,营养盐加富使物种之间的营养竞争减弱,群落多样性水平升高。
综上所述,浮游植物总量、组成类群的丰度和群落多样性的变化均表明,3种营养盐的添加均对浮游植物生长有促进作用,证实水体中可利用性N、P和Fe均处于不充足状态,群落生产量的增长和结构的变化是3种营养盐共同作用的结果。
4 结论研究结果表明大沙河水库可利用性N、P和Fe处于浮游植物生长限制性浓度阈值范围,单独增加一种营养盐对浮游植物生长促进作用不明显,3种营养盐共同作用导致浮游植物丰度尤其是蓝藻丰度增加。浮游植物对营养添加的响应具有明显类群间的差异,其中N和P增加对所有优势类群均有促进作用,Fe增加主要促进蓝藻的生长。N、P和Fe对群落结构和多样性均有调节作用,对水库浮游植物群落与营养盐响应关系的分析中,应突破P限制范式,在N、P和Fe共同作用的背景下,解析营养盐增加对浮游植物群落的效应以及制订富营养防治的对策。
致谢: 暨南大学生态学系水库生态学课题组全体同学在野外调查过程中提供帮助,王雨桐和戚志远在原位实验开展方面给予支持,韩博平教授审读了全文,在此一并致谢。
| [1] |
Xu H, McCarthy MJ, Paerl HW et al. Contributions of external nutrient loading and internal cycling to cyanobacterial bloom dynamics in Lake Taihu, China: Implications for nutrient management. Limnology and Oceanography, 2021, 66(4): 1492-1509. DOI:10.1002/lno.11700 |
| [2] |
Schindler DW, Hecky RE, Findlay DL et al. Eutrophication of lakes cannot be controlled by reducing nitrogen input: Results of a 37-year whole-ecosystem experiment. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(32): 11254-11258. |
| [3] |
Elser JJ, Bracken MES, Cleland EE et al. Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater, marine and terrestrial ecosystems. Ecology Letters, 2007, 10(12): 1135-1142. DOI:10.1111/j.1461-0248.2007.01113.x |
| [4] |
Molot LA, Schiff SL, Venkiteswaran JJ et al. Low sediment redox promotes cyanobacteria blooms across a trophic range: Implications for management. Lake and Reservoir Management, 2021, 16: 1-33. DOI:10.1080/10402381.2020.1854400 |
| [5] |
Guildford SJ, Hecky RE, Taylor WD et al. Nutrient enrichment experiments in tropical great lakes Malawi/Nyasa and Victoria. Journal of Great Lakes Research, 2003, 29: 89-106. DOI:10.1016/S0380-1330(03)70541-3 |
| [6] |
Wever AD, Muylaert K, Langlet D et al. Differential response of phytoplankton to additions of nitrogen, phosphorus and iron in Lake Tanganyika. Freshwater Biology, 2008, 53(2): 264-277. DOI:10.1111/j.1365-2427.2007.01890.x |
| [7] |
North RL, Guildford SJ, Smith REH et al. Evidence for phosphorus, nitrogen, and iron colimitation of phytoplankton communities in Lake Erie. Limnology and Oceanography, 2007, 52(1): 315-328. DOI:10.4319/lo.2007.52.1.0315 |
| [8] |
Xu H, Qin BQ, Zhu GW. Nutrient limitation of cyanobacterial growth in different regions of Lake Taihu in summer. China Environmental Science, 2012, 32(12): 2230-2236. [许海, 秦伯强, 朱广伟. 太湖不同湖区夏季蓝藻生长的营养盐限制研究. 中国环境科学, 2012, 32(12): 2230-2236.] |
| [9] |
肖利娟. 华南地区两座大型水库浮游植物群落与演替机制比较[学位论文]. 广州: 暨南大学, 2011.
|
| [10] |
Xiao LJ, Lei LM, Peng L et al. Iron operates as an important factor promoting year-round diazotrophic cyanobacteria blooms in eutrophic reservoirs in the tropics. Ecological Indicators, 2021, 125: 107446. DOI:10.1016/j.ecolind.2021.107446 |
| [11] |
Reynolds CS. The ecology of phytoplankton. Cambridge: Cambridge University Press, 2006.
|
| [12] |
Lin SJ, He LJ, Huang PS et al. Comparison and improvement on the extraction method for chlorophyll a in phytoplankton. Ecologic Science, 2005, 24(1): 9-11. [林少君, 贺立静, 黄沛生等. 浮游植物中叶绿素a提取方法的比较与改进. 生态科学, 2005, 24(1): 9-11.] |
| [13] |
Downs TM, Schallenberg M, Burns CW. Responses of lake phytoplankton to micronutrient enrichment: A study in two New Zealand lakes and an analysis of published data. Aquatic Sciences, 2008, 70(4): 347-360. DOI:10.1007/s00027-008-8065-6 |
| [14] |
Chorus I, Spijkerman E. What Colin Reynolds could tell us about nutrient limitation, N∶P ratios and eutrophication control. Hydrobiologia, 2021, 848(1): 95-111. DOI:10.1007/s10750-020-04377-w |
| [15] |
胡鸿钧, 魏印心. 中国淡水藻类——系统、分类及生态. 北京: 科学出版社, 2006.
|
| [16] |
Utermöhl H. Zur vervollkommnung der quantitativen phytoplankton-methodik. SIL Communications, 1953-1996, 1958, 9(1): 1-38. DOI: 10.1080/05384680.1958.11904091.
|
| [17] |
Borcard D, Gillet F, Legendre P. Numerical ecology with R. New York: Springer, 2011.
|
| [18] |
Stanley Harpole W, Ngai JT, Cleland EE et al. Nutrient co-limitation of primary producer communities. Ecology Letters, 2011, 14(9): 852-862. DOI:10.1111/j.1461-0248.2011.01651.x |
| [19] |
Saito MA, Goepfert TJ, Ritt JT. Some thoughts on the concept of colimitation: Three definitions and the importance of bioavailability. Limnology and Oceanography, 2008, 53(1): 276-290. DOI:10.4319/lo.2008.53.1.0276 |
| [20] |
Harpole WS, Ngai JT, Cleland EE et al. Nutrient co-limitation of primary producer communities. Ecology Letters, 2011, 14(9): 852-862. DOI:10.1111/j.1461-0248.2011.01651.x |
| [21] |
Reynolds CS, Huszar V, Kruk C et al. Towards a functional classification of the freshwater phytoplankton. Journal of Plankton Research, 2002, 24(5): 417-428. DOI:10.1093/plankt/24.5.417 |
| [22] |
Padisák J, Crossetti L O, Naselli-Flores L. Use and misuse in the application of the phytoplankton functional classification: A critical review with updates. Hydrobiologia, 2009, 621: 1-19. DOI:10.1007/s10750-008-9645-0 |
| [23] |
Molot LA, Li GY, Findlay DL. Findlay et al. Iron-mediated suppression of bloom-forming cyanobacteria by oxine in a eutrophic lake. Freshwater Biology, 2010, 55(5): 1102-1117. DOI:10.1111/j.1365-2427.2009.02384.x |
| [24] |
Borowitzka MA, Beardall J, Raven JA. The physiology of microalgae: Part Ⅲ nutrients and their acquisition, iron. New York: Springer, 2016.
|
| [25] |
Tilman D. Resource competition between plankton algae: An experimental and theoretical approach. Ecology, 1977, 58(2): 338-348. DOI:10.2307/1935608 |
| [26] |
Interlandi SJ, Kilham SS. Limiting resources and the regulation of diversity in phytoplankton communities. Ecology, 2001, 82(5): 1270-1282. DOI:10.1890/0012-9658(2001)082[1270:lratro]2.0.co;2 |
| [27] |
Chen C, Li SJ, Xiao LJ et al. Effects of nutrient enrichment and fish stocking on succession and diversity of phytoplankton community. Acta Ecologica Sinica, 2013, 33(18): 5777-5784. [陈纯, 李思嘉, 肖利娟等. 营养盐加富和鱼类添加对浮游植物群落演替和多样性的影响. 生态学报, 2013, 33(18): 5777-5784. DOI:10.5846/stxb201304010584] |
 2024, Vol. 36
2024, Vol. 36 


