(2: 武汉大学, 海绵城市建设水系统科学湖北省重点实验室, 武汉 430072)
(3: 长江水资源保护科学研究所, 武汉 430051)
(2: Hubei Key Laboratory of Water System Science for Sponge City Construction, Wuhan University, Wuhan 430072, P.R. China)
(3: Changjiang Water Resources Protection Institute, Wuhan 430051, P.R. China)
鄱阳湖作为我国湿地生态系统中生物资源最丰富的地区,在维护长江-鄱阳湖江湖关系、长江水生态安全和生物多样性保护等方面扮演着重要角色[1]。由于鄱阳湖独特的水文情势变化,鄱阳湖洲滩湿地呈现出季节性淹没和出露规律,驱动着湿地生态系统的季节变化。近些年来,受极端气候等因素影响,鄱阳湖的枯水程度显著加剧,干旱持续时间总体上呈现增长趋势,水文情势的异常变动给洲滩湿地植物带来了诸多影响[2-3]。在变化的水文情势背景下,探究鄱阳湖洲滩湿地优势植物的水分来源和水分利用特性对阐明其演替趋势具有重要的理论及现实意义。
稳定同位素技术作为探索生物与其生存环境相互关系的有效工具,已经成为揭示生态系统中水、碳元素循环的重要研究手段[4-5]。许多研究利用植物水与其潜在水源的同位素特性探讨植物水分来源,量化不同水源的利用比例,进而揭示植物的水分利用模式。过去这类研究多聚焦于干旱、半干旱地区,重点探究植物如何应对季节性水分胁迫,发现植物从湿季到干季采取单一水源过渡到多水源利用的适应策略[6-7]。湿润地区的研究则强调了植物利用水源的相对稳定性,认为植物最可能主要依赖土壤上层剖面的水分[8]。Zhao等[9]总结了以往关于植物茎水同位素特性的文献资料,分析了植物水分利用对降水时空变化模式的响应,发现植物的主要水分来源很大程度上受到降水模式的影响,植物优先利用稳定且连续的水源,而在干旱条件下采取更加多变的水分利用策略。基于稳定同位素的鄱阳湖洲滩湿地典型植物的水分补给来源和利用策略也被诸多学者讨论[10-11],但是这些研究多集中于对土壤水分利用深度的量化解析,缺少对土层中的重力水这一潜在水源的考虑,目前仍然缺乏对洲滩湿地植物水分来源季节性变化的充分认识。
植物水分利用效率(water use efficiency,WUE)定义为干物质量与蒸腾水量之比,是评估植物碳同化与水分利用之间调控关系的重要参数。植物的碳稳定同位素与光合作用气体交换的物理和生化过程紧密相关,并且碳稳定同位素方法克服了传统方法受取样时间和空间的限制,为指示植物WUE的变化特性提供了新视角[12]。曹夏禹等[13]利用叶片碳同位素表征植物WUE,探究鄱阳湖洲滩湿地不同植物在水分胁迫下生存状态的差异,并推测变化环境下植物的演替趋势。除光合作用能力之外,气孔导度也是影响植物WUE的重要因素,因而叶片尺度上的内在WUE(intrinsic water use efficiency,iWUE)被定义为光合速率与气孔导度之比,用于反映植物对环境变化的适应策略[14]。过去的研究利用叶片碳同位素计算植物iWUE并讨论其与不同气象因素的关系,发现iWUE的变化规律受到生长期内多环境因子与本身生理特性的共同影响[15-16]。也有研究基于碳同位素探讨了植物iWUE对水文条件变化(如土壤水、地下水等)的响应,发现植物在水分亏缺情况下会提高iWUE,最大化利用有限的水资源[17-18]。许多研究表明植物叶片组织的氧稳定同位素反映了其形成时期的蒸发情况,认为叶片有机质的氧同位素可以表征气孔导度的变化[19-20]。理论上,当植物生长在相同的蒸发条件下,气孔导度的降低将导致叶片细胞间的水汽压以及水汽通过气孔和叶边界层扩散过程动力学分馏的变化[21],从而导致叶片有机物中氧同位素的整体富集。因此,有学者同时利用叶片有机质的碳、氧同位素探究限制资源与叶片功能性状对植物iWUE变化模式的影响[22]。然而,现阶段针对鄱阳湖洲滩湿地植物iWUE变化规律的研究仍然较少,缺乏对iWUE变化机制的分析,并且结合叶片有机质氧同位素的探讨鲜有报道。
在极端水文事件频发的背景下,系统识别鄱阳湖洲滩湿地植物稳定同位素特性的动态变化及其指示意义,明确植物在生长过程中对不同水分变化的适应策略具有重要意义。本研究于2020年12月-2021年5月对以灰化苔草(C3植物)和南荻(C4植物)为主的典型洲滩湿地生态系统开展了连续的样品采集,分析了植物茎水、叶片水同位素的基本特性及时间变化规律,结合土层中的重力水、土壤水以及降水的同位素特性,辨识了植物在不同时期的主要水分来源;基于叶片碳同位素,评估了苔草和南荻iWUE的时间变化特性,结合叶片有机质的氧同位素,区分了光合作用能力和气孔导度对iWUE的影响。研究结果可为鄱阳湖洲滩湿地生态系统的科学管理、修复与保护提供理论参考。
1 材料与方法 1.1 研究区概况及样带选择鄱阳湖位于长江中游南岸,是我国目前最大的淡水湖泊,鄱阳湖国家级自然保护区(29°02′~29°18′N,115°52′~116°08′E)位于鄱阳湖的西北角,其地理位置如图 1所示。保护区西半部受修河影响,东部受赣江影响,管辖有沙湖、蚌湖、大湖池等共9个子湖泊及湖滩草洲,总面积达224 km2。保护区多年平均气温(1965—2018年)为17.4℃,7月气温最高,平均为29.2℃,1月气温最低,平均为4.9℃。保护区多年平均年降水量(1965—2018年)为1511 mm,降水的年内分布不均,雨季4—9月的降水量占全年总降水量的68%。
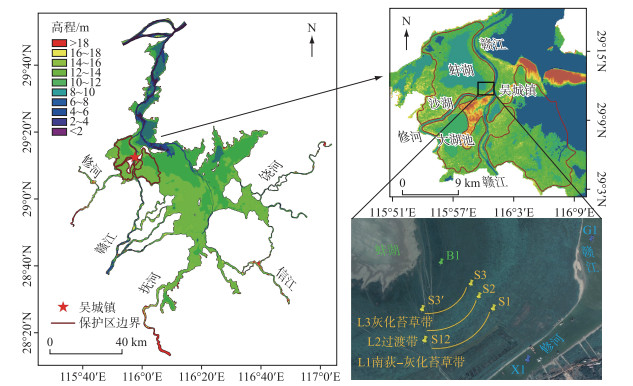
|
图 1 研究区域及采样点地理位置 Fig.1 Geographical location of the study area and sampling sites |
蚌湖是保护区内面积相对较大的碟形湖,洲滩湿地生境和植被生态类型呈现明显的环带状变化,生物群落组成以及生态系统结构在众多碟形湖中具有典型性和代表性。蚌湖的洲滩湿地土壤水分含量动态响应鄱阳湖的水文情势变化,存在明显的季节性干湿交替现象,可以很好地反映鄱阳湖洲滩湿地的生态水文特征。因此,本研究选取在蚌湖和修河之间的典型洲滩湿地设置监测断面,对以灰化苔草和南荻为主的湿地生态系统进行连续的采集和分析。鄱阳湖湿地灰化苔草的春草在2月开始萌发,3—5月为生长期,在汛期淹没前完成生活周期,湖水位下降之后,9—12月为秋草的萌发生长期;南荻3月开始出芽,直到7月为营养生长期,9—10月开花,12月开始枯叶[23]。典型洲滩湿地上,植物群落沿高程由高到低呈环带状分布,从环状带L1~L3,植物由南荻-灰化苔草群落逐渐过渡到灰化苔草群落(图 1)。本研究共设置植物采样点S1、S2、S3,并设置辅助采样点S12和S3′,其中S12位于过渡带L2的上缘地带,S3′的湿地生境和植物类型与S3接近。
1.2 样品采集本研究于2020年12月-2021年5月对典型洲滩湿地苔草、南荻进行样品采集,采样约每4周进行一次,其中在3月植物生长旺盛时期于上、下旬各开展一次采样工作。选取地势均一、植物生长态势良好的地块布设2 m×2 m的样方,样方内随机挑选长势相近、健壮的苔草和南荻植株,采集根茎结合处的植物茎样品以及完全展开无破损的叶片样品,分别装入12 mL玻璃瓶中,用于植物茎水和叶片水氢、氧稳定同位素的测定。此外,在样方内另剪取苔草和南荻健康叶片若干,各自混合后分别装于自封袋中,用于植物叶片有机质碳、氧稳定同位素的测定,并挖掘采集生长旺盛的苔草和南荻根系,各自混合后分别装于自封袋中用于碳稳定同位素的测定。
采集植物样品的同时,利用土钻对采样点位置进行钻孔,钻孔深度约为150 cm。以10 cm为间隔划分土壤层,收集植物采样点0~50 cm深度范围的土壤样品,装入12 mL玻璃瓶中用于土壤水氢、氧稳定同位素的测定。由于保护区丰沛的降水和湿地土壤特性,典型洲滩湿地土层中来源于降水补给的重力水广泛存在。在钻孔结束后,采样点位置周边土层中的重力水一定程度上流动填充钻孔,等待钻孔内水位相对稳定,抽取得到重力水样品,并利用地下水尺测定水面距地表的深度大致反映重力水的埋深情况。在采样点S3下缘地带与蚌湖的直接相连处布设蚌湖湖水采样点B1,在采样点S1附近布设修河、赣江河水采样点X1和G1,分别采用涉水采样和船只采样的方式对地表水样品进行采集(图 1)。此外,于2020年12月-2021年5月期间,在保护区中心的吴城镇对当地的日降水样品进行连续的采集和记录。上述所有水样均转移到100 mL聚乙烯瓶中冷藏保存。
1.3 样品处理与测试对于降水、地表水和重力水样品,直接采用0.22 μm滤头进行过滤,贮存在2 mL进样瓶中加盖密封。对于装入12 mL玻璃瓶中的植物茎、叶片和土壤样品,使用LI-2100全自动真空冷凝抽提系统提取水分,抽提后的植物茎水、植物叶片水和土壤水采用0.22 μm滤头进行过滤,贮存在2 mL进样瓶中加盖密封。上述所有处理后的水样放置在样品柜中4℃保存待测。
对于装入自封袋中的植物叶片和根系样品,冲洗去除泥土和灰尘后,使用1.2 mol/L盐酸充分浸泡,采用超纯水反复冲洗干净,放入45℃烘箱中烘至恒重。将烘干后的植物样品磨碎至粉末后用150 μm孔径筛网过滤,装入棕色玻璃瓶中于避光处干燥保存。采用Mettler-Toledo XPR10超微量天平称取适量过筛后的植物叶片和根系样品装入锡杯中用于碳稳定同位素的测定,称取适量植物叶片样品装入银杯中用于有机质氧稳定同位素的测定。
所有样品的稳定同位素测定工作在武汉大学水资源工程与调度全国重点实验室完成。采用MAT253稳定同位素比质谱仪连接Flash 2000HT元素分析仪测定水样的δ2H和δ18O值,植物叶片和根系的δ13C值,以及植物叶片有机质的δ18O值。水样δ2H和δ18O值的测定结果以V-SMOW为参考标准,分析不确定性分别小于1‰和0.1‰;植物叶片和根系δ13C值的测定结果以V-PDB为参考标准,分析不确定性小于0.15‰;植物叶片有机质δ18O值的测定结果以V-SMOW为参考标准,分析不确定性小于0.3‰。所有上述测定结果的δR可以表示为:
| $ {\rm{ \mathsf{ δ}}} R=\left(R_{\text {sample }} / R_{\text {standard }}-1\right) \times 1000 ‰ $ | (1) |
式中,δR代表δ2H、δ18O或δ13C,Rsample和Rstandard分别代表样品和标准物质中某种元素(H、O或C)重同位素与轻同位素的丰度之比。
1.4 植物iWUE及叶片δ18O富集因子计算植物叶片的δ13C值可用于计算时间积分的iWUE(μmol/mol),其计算公式为[22, 24]:
| $ \mathrm{iWUE}=C_{\mathrm{a}} / 1.6 \times\left(1-C_{\mathrm{i}} / C_{\mathrm{a}}\right) $ | (2) |
| $ C_{\mathrm{i}} / C_{\mathrm{a}}= \begin{cases}\left(\Delta^{13} \mathrm{C}-a\right) /(b-a) & \mathrm{C} 3 \text { 植物 } \\ \left(\Delta^{13} \mathrm{C}-a\right) /\left(b_4+\varPhi\left(b_3-s\right)-a\right) & \mathrm{C} 4 \text { 植物 }\end{cases} $ | (3) |
| $ \Delta{ }^{13} \mathrm{C}=\left({\rm{ \mathsf{ δ}}}^{13} \mathrm{C}_{\mathrm{a}}-{\rm{ \mathsf{ δ}}}^{13} \mathrm{C}_{\mathrm{L}}\right) /\left(1+{\rm{ \mathsf{ δ}}}^{13} \mathrm{C}_{\mathrm{L}} / 1000\right) $ | (4) |
式中,Ca为大气CO2浓度,Ci为叶片胞间CO2浓度;a为CO2通过气孔扩散时的分馏系数,b为由RuBP羧化酶决定的分馏系数;Φ为从C4植物维管束鞘细胞泄漏出来的由PEP羧化酶固定的碳的比例,s为泄漏时的分馏系数;b3和b4分别为由RuBP羧化酶和PEP羧化酶决定的分馏系数;Δ13C为植物碳同位素判别值;δ13Ca为大气CO2的δ13C值;δ13CL为植物叶片的δ13C值。
大气中的CO2浓度(Ca)及其δ13C值(δ13Ca)可通过如下计算公式得到[25]:
| $ C_{\mathrm{a}}=277.78+1.35 \exp [0.01572(t-1740)] $ | (5) |
| $ {\rm{ \mathsf{ δ}}}^{13} \mathrm{C}_{\mathrm{a}}=-6.429-0.006 \exp [0.0217(t-1740)] $ | (6) |
式中,t为采样年份,本研究中t值取2020和2021。
植物叶片有机质相对于植物利用水源的氧同位素富集因子Δ18O可用于表征时间积分的气孔导度,其计算公式为[22]:
| $ \Delta^{18} \mathrm{O}=\left({\rm{ \mathsf{ δ}}}^{18} \mathrm{O}_{\mathrm{L}}-{\rm{ \mathsf{ δ}}}^{18} \mathrm{O}_{\mathrm{S}}\right) /\left(1+{\rm{ \mathsf{ δ}}}^{18} \mathrm{O}_{\mathrm{S}} / 1000\right) $ | (7) |
式中,δ18OL为植物叶片有机质的δ18O值;δ18OS为植物利用水源的δ18O值,本研究中取值为植物茎水的δ18O值。
1.5 数据分析方法本研究采用显著性检验和相关性分析等方法对原始数据进行统计分析。利用Mann-Whitney非参数检验比较苔草和南荻之间同位素特性的差异;利用Kruskal-Wallis非参数检验事后多重比较法对比不同采样时期之间苔草、南荻同位素特性及iWUE的差异,以及对比不同类型水体之间同位素特性的差异;显著性水平取0.05。
2 结果与分析 2.1 植物茎、叶水同位素组成及变化特征采样期间,典型洲滩湿地苔草茎水δ2H值的变化范围为-24.7‰~-8.9‰,平均值为-15.2‰,δ18O值的变化范围为-4.6‰~-1.8‰,平均值为-3.2‰;南荻茎水δ2H值的变化范围为-22.8‰~-9.1‰,平均值为-14.0‰,δ18O值的变化范围为-4.6‰~-2.3‰,平均值为-3.1‰。植物茎水δ2H和δ18O值之间存在显著的线性关系,分别对苔草和南荻植物茎水的δ2H和δ18O值进行线性拟合,得到各自的植物水线(plant water line,PWL),如图 2所示。可以看到,苔草和南荻植物茎水的氢、氧稳定同位素组成没有显著差异,均落在过去报道的当地大气降水线(local meteoric water line,LMWL)的两侧[26]。苔草和南荻PWL的斜率和截距没有明显差别,均明显低于LMWL,表明相对于降水,植物利用水源整体上经历了一定程度的蒸发分馏作用。
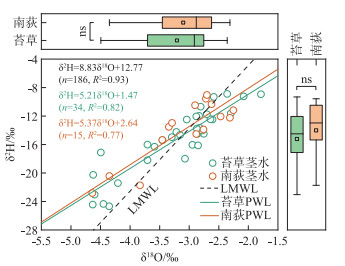
|
图 2 典型洲滩湿地苔草、南荻植物茎水的δ2H-δ18O关系(ns代表不存在显著性差异) Fig.2 Relationship between the δ2H and δ18O values of plant stem water for Carex cinerascens and Triarrhena lutarioriparia in the typical beach wetland |
典型洲滩湿地苔草叶片水δ2H值的变化范围为-12.2‰~21.7‰,平均值为1.9‰,δ18O值的变化范围为-2.7‰~7.0‰,平均值为1.3‰;南荻叶片水δ2H值的变化范围为-12.5‰~19.2‰,平均值为2.4‰,δ18O值的变化范围为-3.4‰~9.0‰,平均值为2.5‰。整体上,苔草和南荻叶片水同位素组成表现出较大的变异范围,两者之间不存在统计学差异(P>0.05)。分别对苔草和南荻叶片水的δ2H和δ18O值进行线性拟合,得到各自的叶片水线(leaf water line,LWL),如图 3所示。结果发现,两种优势植物的叶片水同位素组成均主要分布在各自的PWL下方,并且LWL具有比PWL更低的斜率,表明叶片水在蒸腾过程中明显的同位素分馏。
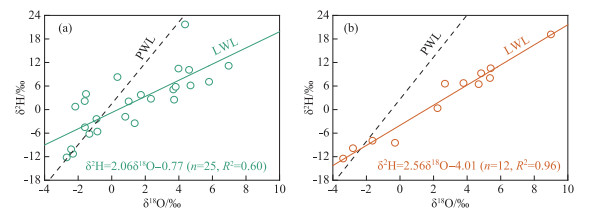
|
图 3 典型洲滩湿地苔草(a)、南荻(b)叶片水的δ2H-δ18O关系 Fig.3 Relationship between the δ2H and δ18O values of plant leaf water for Carex cinerascens (a) and Triarrhena lutarioriparia (b) in the typical beach wetland |
苔草和南荻植物茎水、植物叶片水δ18O值随时间的变化情况如图 4所示。可以看到,从冬季至春季,苔草茎水的δ18O值总体上呈现波动富集的变化趋势;1月和2月南荻枯萎,未收集到南荻样品,从3月上旬南荻萌发生长期开始,南荻茎水的δ18O值同样表现出略微富集的变化趋势。此外,相同采样时期内,苔草和南荻植物茎水的δ18O值之间均没有显著差异。相对来说,植物叶片水的δ18O值更加富集,具有与植物茎水相似的时间变化规律,并且相同采样时期内,苔草和南荻叶片水的δ18O值之间均没有显著差异。
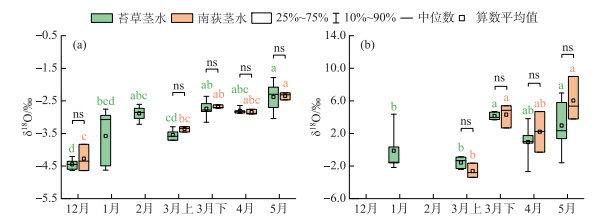
|
图 4 典型洲滩湿地苔草、南荻植物茎水(a)和叶片水(b)δ18O值的时间变化(ns代表不存在显著性差异;各组数据间有相同字母代表差异不显著,无相同字母代表差异显著) Fig.4 Temporal variation of the δ18O values of plant stem water (a) and leaf water (b) for Carex cinerascens and Triarrhena lutarioriparia in the typical beach wetland |
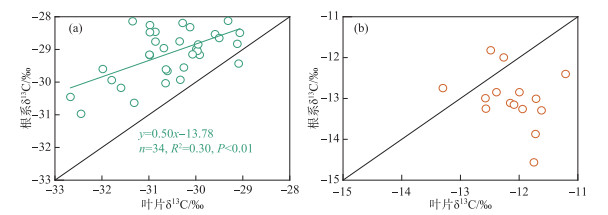
采样期间,典型洲滩湿地苔草叶片δ13C值的变化范围为-32.7‰~-29.1‰,平均值为-30.6‰,南荻叶片δ13C值的变化范围为-13.3‰~-11.2‰,平均值为-12.1‰;苔草根系δ13C值的变化范围为-31.0‰~-27.1‰,平均值为-29.1‰,南荻根系δ13C值的变化范围为-14.6‰~-11.8‰,平均值为-13.0‰。苔草、南荻叶片与根系δ13C值之间的相关关系如图 5所示。结果表明,采样时期苔草根系的δ13C值相对叶片更加富集,根系和叶片的δ13C值之间存在显著的正相关性(P<0.01);南荻根系的δ13C值相对叶片更加贫化,两者之间不存在统计学上的相关关系(P=0.30)。Cernusak等[27]综述了C3植物非光合作用组织趋向于更加富集13C的原因,认为与异养组织内生物化学组成和过程的变化、生长模式的季节性差异、暗呼吸作用中的同位素分馏等因素有关。对于C4植物来说,相对于叶片,根系趋向于表现出相近或者略微贫化的δ13C值[28],也有研究表明C4植物根系的δ13C值显著贫化于相应叶片[29]。本研究中苔草、南荻叶片和根系的δ13C值分析结果与过去的报道一致,并且C4植物南荻叶片与根系δ13C值的差值达到0.9‰。
|
图 5 典型洲滩湿地苔草(a)、南荻(b)叶片与根系δ13C值之间的相关关系 Fig.5 Correlation between the δ13C values of leaves and roots for Carex cinerascens (a) and Triarrhena lutarioriparia (b) in the typical beach wetland |
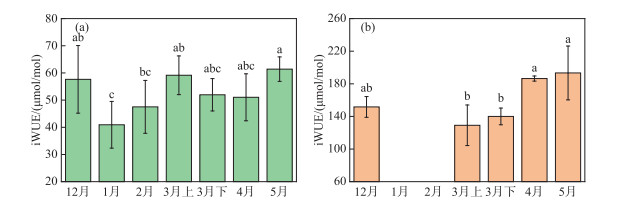
基于叶片δ13C值计算得到的典型洲滩湿地植物iWUE结果表明,苔草iWUE的变化范围为28.4~69.1 μmol/mol,平均值为52.8 μmol/mol,南荻iWUE的变化范围为101.9~234.6 μmol/mol,平均值为160.1 μmol/mol,南荻的iWUE明显高于苔草,与两种优势植物不同的光合作用路径有关。苔草和南荻iWUE随时间的变化情况如图 6所示。整体上,苔草在1月的iWUE最低,2—3月iWUE具有增长趋势,在之后的春季生长期,苔草的iWUE没有表现出明显变化(P>0.05);南荻在3月上旬萌发时期的iWUE最低,在之后的生长期其iWUE具有显著的增长趋势。
|
图 6 典型洲滩湿地苔草(a)、南荻(b)iWUE的时间变化 (各组数据间有相同字母代表差异不显著,无相同字母代表差异显著) Fig.6 Temporal variation of the iWUE for Carex cinerascens and (a) Triarrhena lutarioriparia (b) in the typical beach wetland |
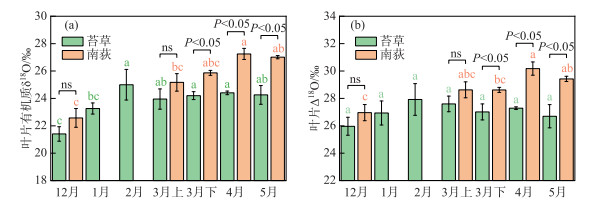
采样期间,典型洲滩湿地苔草叶片有机质δ18O值的变化范围为20.6‰~26.4‰,平均值为23.8‰,南荻叶片有机质δ18O值的变化范围为21.8‰~27.5‰,平均值为25.6‰。苔草、南荻叶片氧稳定同位素富集因子Δ18O值的计算结果表明,苔草Δ18O值的变化范围为24.9‰~29.0‰,平均值为27.0‰,南荻Δ18O值的变化范围为26.3‰~30.5‰,平均值为28.8‰。苔草、南荻叶片有机质δ18O值和叶片Δ18O值随时间的变化情况如图 7所示。可以看到,苔草叶片的δ18O值在冬季具有明显的富集趋势,而在春季生长期较为稳定,没有表现出统计学差异;对于南荻来说,在春季生长期,其叶片δ18O值呈现出不显著的富集趋势。在3月上旬,苔草和南荻的叶片有机质δ18O值之间没有表现出明显差异,之后南荻叶片的δ18O值始终显著高于苔草。整体上,苔草和南荻的叶片Δ18O值具有与叶片有机质δ18O值相似的时间变化规律,而与植物茎水、叶片水δ18O值的变化趋势并不同步(图 4),表明叶片Δ18O值与植物吸收水源的关系不大,主要还是受到叶片气孔导度变化的影响。
|
图 7 典型洲滩湿地苔草、南荻叶片有机质δ18O值(a)和叶片Δ18O值(b)的时间变化 (ns代表植物间不存在显著性差异;相同字母代表同一植物在不同采样时期差异不显著,无相同字母代表差异显著) Fig.7 Temporal variation of the δ18O (a) and Δ18O (b) values of leaf organic matter for Carex cinerascens and Triarrhena lutarioriparia in the typical beach wetland |
采样期间,典型洲滩湿地植物茎水、植物叶片水与其他潜在水源同位素组成的对比情况如图 8所示,不同采样时期土层中重力水的埋深情况如表 1所示。总体上,降水同位素组成具有较大变幅,在过去总结的鄱阳湖湿地降水同位素的变化范围之内[26]。植物叶片水和蚌湖湖水的同位素组成更加富集,与受到强烈的蒸腾和蒸发作用影响有关;修河和赣江的同位素组成表现为最为贫化,与植物茎水具有显著差异。采样期间,典型洲滩湿地土层中重力水的埋深具有逐渐变深后又接近地表的变化规律,其中2月的埋深最深,这一时期未收集到重力水样品,4—5月埋深最浅,主要存在于植物根系的分布范围之内。采样时期土壤水和重力水的δ18O值差异不显著,相比于河水略微富集,可能与两者均主要受降水补给有关,同时接近大气环境,容易受到蒸发作用的影响。整体来看,在各潜在水源当中,植物茎水的同位素组成在降水同位素的变化范围之内,与土层中重力水的同位素组成最为相近,其次则为与植物根系分布联系密切的土壤水。因此,本研究进一步分析植物茎水与降水、重力水、土壤水之间的动态变化关系,探讨植物利用水源的季节性变化。
|
图 8 采样期间植物茎水、植物叶片水与其他水体的同位素特性 (各组数据间有相同字母代表差异不显著,无相同字母代表差异显著) Fig.8 Isotopic characteristics of plant stem water, leaf water and other water bodies during the sampling period |
| 表 1 不同采样时期典型洲滩湿地土层中重力水的埋深情况* Tab. 1 Depth of the gravitational water in the typical beach wetland during different sampling months |
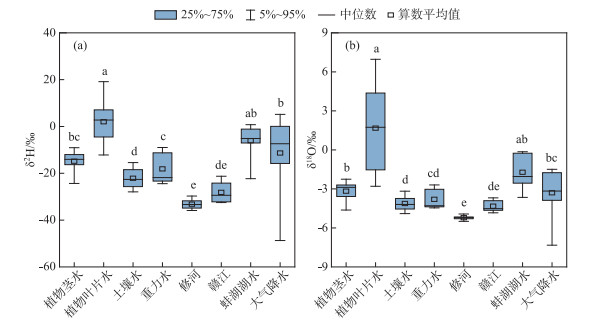
考虑到苔草和南荻植物茎水的氢、氧稳定同位素组成没有表现出显著差异,建立不同采样月份所有植物茎水、重力水、土壤水以及降水的δ2H-δ18O关系(图 9)。可以看到,研究区冬季降水较少,相对于重力水和土壤水,降水同位素组成大多更加富集。在冬季12月,植物茎水的同位素组成与重力水最为接近,相较于土壤水略微富集。在1—3月上旬期间,除2月受前期降水较少的因素影响导致未收集到重力水样品之外,1月和3月上旬的重力水和土壤水具有相近的同位素组成,这段时期植物茎水的同位素组成均表现出明显的相对富集。研究区春季降水增多,在4—5月,重力水的同位素组成总体上落在相应时期降水同位素的变化范围之内,这段时期植物茎水和重力水的同位素组成最为相近,而土壤水的同位素组成则表现出明显的相对贫化。
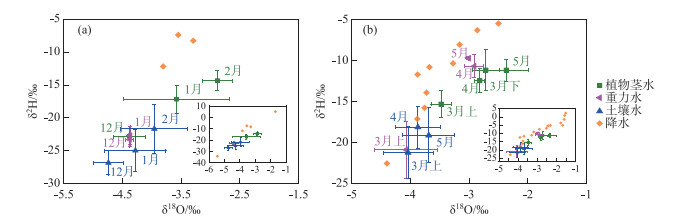
|
图 9 不同采样时期植物茎水、重力水、土壤水以及降水的δ2H-δ18O关系 (图(a)、(b)中的橙色标志分别代表冬季和春季采样时期在研究区收集测定的日降水同位素结果) Fig.9 Relationship between the δ2H and δ18O values of plant stem water, gravitational water, soil water and precipitation during different sampling months |
受植被类型、根系条件、水文气候特征、土壤水分条件等因素影响,植物的主要水分来源和水分利用形式具有复杂性和极大的不确定性。植物茎水的同位素特性可以视作是不同可利用水源混合的结果,并且过去的研究指出,除部分盐生植物之外,植物根部在吸水过程中大体上不发生同位素分馏现象[30]。因此,可以通过比较植物茎水与其潜在水源之间氢、氧稳定同位素的差异,判断植物水分的来源、混合和动态变化过程。
总体来说,植物利用水源的季节性变化主要由两方面因素决定,分别为植物根系系统的分布以及水文条件的变化。本研究在典型洲滩湿地植物样品的采集过程中,对苔草和南荻的根系进行了挖掘调查,观察了自然条件下两者的根系分布情况。结果发现,两者大部分根系分布于0~15 cm土壤范围内,主要根系分布较浅,植物的地下生物量集中在土壤表层和亚表层,具有典型的湿地植物根系特点。过去许多研究利用同位素端元混合模型评估了不同水文时期各水源对植物的贡献比例[6, 10],然而对典型洲滩湿地植物而言,从主要根系的分布情况可以初步推断,浅层土壤水可能是苔草和南荻直接利用的主要水源。虽然如此,也有研究指出在许多情况下,植物能够间接利用深层水源,如部分湿生植物的根系系统具有二态性,能同时利用深层和浅层土壤水分,深层土壤水在根系的水力提升作用下,能够在浅层土壤得以释放,从而被其他浅根植物吸收利用,使其他浅根植物具有深层土壤水甚至地下水的同位素特征[31]。但是在本研究选取的典型洲滩湿地上,植物以苔草和南荻为主,其他类型植物的占比很少,不存在上述这类情况。
采样期间,典型洲滩湿地植物茎水与各潜在水源的同位素组成分布表明了植物利用水源可能与降水、重力水和土壤水存在紧密联系。由植物茎水与上述水源之间同位素组成的时间变化特性可以推断,典型洲滩湿地植物在不同采样时期具有不同的水分来源。在冬季12月,典型洲滩湿地植物可能以土层中的重力水作为主要利用水源。1—3月上旬研究区降水较少,重力水的埋深较深(表 1),考虑到植物的根系分布特征,这段时期典型洲滩湿地植物的水分来源较为多元化,转变为同时利用降水和土壤水以满足自身生长需求。4—5月研究区降水频繁,重力水埋深较浅,且水量较为充足,同位素特性表明这一阶段植物在一定程度上优先利用重力水作为主要水源。此外,相同采样时期苔草和南荻植物茎水相似的同位素组成表明两种植物利用相同的水源,在水分限制条件下存在潜在的竞争关系。
总体上,典型洲滩湿地植物被认为采取动态的水分利用模式,不同时期植物的主要水分来源存在差异。过去的研究揭示了不同季节之间植物水分利用策略的变化,发现当处于雨季时,植物主要利用降水有效补给的浅层土壤水,而在干季时期,植物趋向于采用多种水源结合的水分利用模式[6]。本研究的结果表明,当降水频繁、水量充足时,来源于降水且埋深较浅的重力水可能是典型洲滩湿地植物利用的主要水源,而非根系分布范围的土壤水;在枯水期重力水埋深较深时,植物则采取降水和土壤水的混合利用模式应对水分胁迫。
3.2 植物iWUE变化的主要限制因素不同植物由于叶片气体交换特性的生理差异,会具有不同的WUE,即使同种植物,生活在不同的环境条件下,也会展现出光合作用气体交换特性的系统性偏差[29, 32]。过去的研究在理论上详细地阐述了C3和C4植物光合作用的碳同化机制及同位素分馏模式,表明植物WUE由光合作用能力和气孔开闭共同影响[33]。气孔在植物碳同化、呼吸、蒸腾作用等气体代谢过程中,扮演着空气和水蒸气通路的作用,由于植物的光合作用与蒸腾作用平行发生,在植物光合作用吸收CO2的同时,不可避免地要散失水分。另外,气孔也会根据环境条件的变化调节自身开度,反过来影响植物的水分利用,即同时调控着植物的水过程和碳过程。
植物叶片有机质的δ18O值很大程度上由叶-气水汽压差决定,受气孔导度变化的影响,而不受光合作用能力改变的影响。因而,通过测定计算植物叶片Δ18O值可以获取关于控制植物iWUE的生理和环境因素的重要信息,在过去的研究中得到成功应用[21-22]。大体来说,当iWUE的变化主要受气孔导度变化的影响时,iWUE和叶片Δ18O值之间应该呈现出正相关关系;而当iWUE主要受光合作用能力变化的影响时,iWUE和叶片Δ18O值之间应该不存在显著相关性,或者呈现出负相关关系[34]。
从典型洲滩湿地苔草和南荻萌发生长期iWUE和叶片Δ18O值之间的相关关系(图 10)可以看到,苔草iWUE和叶片Δ18O值之间不存在相关性,南荻iWUE和叶片Δ18O值之间存在显著的正相关关系,表明苔草和南荻iWUE的变化受到不同的机制影响。刘莹等[35]在利用碳稳定同位素探究C4植物白羊草WUE对干旱胁迫的响应机理研究中,发现了相对于轻度干旱胁迫,充分供水条件下植物叶片具有略微贫化的δ13C值;也有研究认为当水分条件充足时,植物的水分利用策略将由“保守型”转变为“挥霍型”,从而使得叶片具有贫化的δ13C值[36]。然而,典型洲滩湿地南荻叶片Δ18O值的时间变化特性表明其气孔导度在生长期具有轻微的降低趋势,其iWUE的变化规律不能通过水分利用方式不再保守进行解释。苔草在生长期水量充沛情景下较为稳定的iWUE与水分利用方式不再保守的情况也不相符。有学者认为,在植物生长早期,叶片δ13C值的富集可以解释为同位素富集的非结构性碳水化合物由根系转移至新形成的叶片[27, 37],但是对于南荻而言,相对于叶片,根系的δ13C值更加贫化。综合上述分析可以推断,苔草在萌发生长期iWUE的变化规律可能与光合作用能力相关的因素有关,生长期内苔草的光合作用能力较为稳定,具有相对稳定的iWUE,而南荻的气孔导度受到外界因素一定程度的影响,从而导致iWUE具有增长趋势。
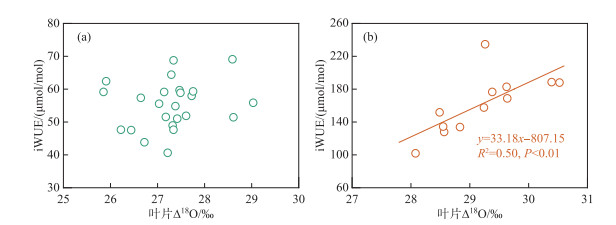
|
图 10 萌发生长期苔草(a)和南荻(b)iWUE与叶片Δ18O值之间的相关关系 Fig.10 Correlation between the iWUE and Δ18O values of leaf organic matter for Carex cinerascens (a) and Triarrhena lutarioriparia (b) during the germination and growing period |
本研究系统分析了鄱阳湖国家级自然保护区典型洲滩湿地苔草和南荻水、碳稳定同位素与iWUE的动态变化特征,阐明了植物在冬季和春季的水分利用模式,讨论了植物iWUE的变化规律。得到的主要结论如下:
1) 苔草和南荻植物茎水的同位素组成没有表现出明显差异,从冬季至春季,植物茎水的δ18O值呈现波动富集的变化趋势,叶片水同位素的时间变化规律与植物茎水相似。
2) 苔草根系的δ13C值相对叶片更加富集,根系和叶片的δ13C值之间存在显著的正相关性,南荻根系的δ13C值相对叶片更加贫化,两者之间不存在统计学上的相关关系。
3) 植物茎水的同位素组成与土层中的重力水最为相近,其次为土壤水。春季降水频繁时,来源于降水且埋深较浅的重力水可能是植物利用的主要水源,而在枯水期重力水埋深较深时,植物采取降水和土壤水的混合利用模式。
4) 苔草在萌发生长期具有相对稳定的iWUE,其变化规律主要与光合作用能力相关的因素有关,而南荻的气孔导度受到外界因素一定程度的影响,导致iWUE在萌发生长期具有增长趋势。
| [1] |
Liu XB, Han Z, Wang SY et al. A research thinking of Poyang Lake wetland from the perspective of Yangtze River protection. Journal of China Institute of Water Resources and Hydropower Research, 2021, 19(2): 201-209. [刘晓波, 韩祯, 王世岩等. 长江大保护视角下鄱阳湖湿地保护的研究思考. 中国水利水电科学研究院学报, 2021, 19(2): 201-209.] |
| [2] |
Hu ZP, Lin YR. Analysis of evolution process and driving factors for aquatic vegetations of Poyang Lake in 30 years. Resources and Environment in the Yangtze Basin, 2019, 28(8): 1947-1955. [胡振鹏, 林玉茹. 鄱阳湖水生植被30年演变及其驱动因素分析. 长江流域资源与环境, 2019, 28(8): 1947-1955. DOI:10.11870/cjlyzyyhj201908018] |
| [3] |
Tan ZQ, Xu XL, Li YL et al. Wetland landscape pattern evolution of large Yangtze-connected lakes in the middle reaches of Yangtze River. Resources and Environment in the Yangtze Basin, 2017, 26(10): 1619-1629. [谭志强, 许秀丽, 李云良等. 长江中游大型通江湖泊湿地景观格局演变特征. 长江流域资源与环境, 2017, 26(10): 1619-1629. DOI:10.11870/cjlyzyyhj201710014] |
| [4] |
Chen L, Wang ZL. Applications of carbon isotopic method in wetland carbon cycle and related research advances. Chinese Journal of Ecology, 2012, 31(7): 1862-1869. [陈玲, 王中良. 碳同位素在湿地碳循环研究中的应用及进展. 生态学杂志, 2012, 31(7): 1862-1869. DOI:10.13292/j.1000-4890.2012.0314] |
| [5] |
Li ZX, Feng Q, Li ZJ et al. Ecohydrology based on stable isotope tracing in the northern Qilian Mountains: Preliminary progress and its applications. Journal of Glaciology and Geocryology, 2019, 41(5): 1044-1052. [李宗省, 冯起, 李宗杰等. 祁连山北坡稳定同位素生态水文学研究的初步进展与成果应用. 冰川冻土, 2019, 41(5): 1044-1052.] |
| [6] |
Bargués Tobella A, Hasselquist NJ, Bazié HR et al. Strategies trees use to overcome seasonal water limitation in an agroforestry system in semiarid West Africa. Ecohydrology, 2017, 10(3): e1808. DOI:10.1002/eco.1808 |
| [7] |
Si JH, Feng Q, Cao SK et al. Water use sources of desert riparian Populus euphratica forests. Environmental Monitoring and Assessment, 2014, 186(9): 5469-5477. DOI:10.1007/s10661-014-3796-4 |
| [8] |
Geris J, Tetzlaff D, McDonnell JJ et al. Spatial and temporal patterns of soil water storage and vegetation water use in humid northern catchments. Science of the Total Environment, 2017, 595: 486-493. DOI:10.1016/j.scitotenv.2017.03.275 |
| [9] |
Zhao Y, Wang L. Plant water use strategy in response to spatial and temporal variation in precipitation patterns in China: A stable isotope analysis. Forests, 2018, 9(3): 123. DOI:10.3390/f9030123 |
| [10] |
Xu XL, Li YL, Tan ZQ et al. Variations of water sources for a typical mesophyte vegetation in the Lake Poyang wetland using stable isotopes. J Lake Sci, 2020, 32(6): 1749-1760. [许秀丽, 李云良, 谭志强等. 鄱阳湖湿地典型中生植物水分利用来源的同位素示踪. 湖泊科学, 2020, 32(6): 1749-1760. DOI:10.18307/2020.0615] |
| [11] |
Pan GY, Cao XY, Zhang X et al. Water use strategy of Carex in the dry season of Poyang Lake. Journal of Shaanxi Normal University: Natural Science Edition, 2018, 46(1): 97-103. [潘国艳, 曹夏禹, 张翔等. 鄱阳湖苔草枯水期的水分利用策略. 陕西师范大学学报: 自然科学版, 2018, 46(1): 97-103.] |
| [12] |
Acosta-Rangel A, Ávila-Lovera E, De Guzman ME et al. Evaluation of leaf carbon isotopes and functional traits in avocado reveals water-use efficient cultivars. Agriculture, Ecosystems & Environment, 2018, 263: 60-66. DOI:10.1016/j.agee.2018.04.021 |
| [13] |
Cao XY, Zhang X, Xiao Y et al. Water use efficiency of plants based on stable carbon isotope: Case of Poyang Lake wetlands. Yangtze River, 2017, 48(5): 17-25. [曹夏禹, 张翔, 肖洋等. 基于稳定碳同位素比的植物水分利用效率分析——以鄱阳湖湿地为例. 人民长江, 2017, 48(5): 17-25.] |
| [14] |
Ma WT, Tcherkez G, Wang XM et al. Accounting for mesophyll conductance substantially improves 13C-based estimates of intrinsic water-use efficiency. The New Phytologist, 2021, 229(3): 1326-1338. DOI:10.1111/nph.16958 |
| [15] |
Tian JY, Diao HY, Yuan FH et al. Characteristics of water use efficiency in a succession series of broadleaved Korean pine forests in Changbai Mountain, China. Chinese Journal of Applied Ecology, 2021, 32(4): 1221-1229. [田金园, 刁浩宇, 袁凤辉等. 长白山阔叶红松林演替序列水分利用效率特征. 应用生态学报, 2021, 32(4): 1221-1229. DOI:10.13287/j.1001-9332.202104.016] |
| [16] |
Huang FZ, Li DX, Wang B et al. Foliar stable carbon isotope composition and water use efficiency of plant in the Karst seasonal rain forest. Chinese Journal of Applied Ecology, 2019, 30(6): 1833-1839. [黄甫昭, 李冬兴, 王斌等. 喀斯特季节性雨林植物叶片碳同位素组成及水分利用效率. 应用生态学报, 2019, 30(6): 1833-1839. DOI:10.13287/j.1001-9332.201906.008] |
| [17] |
Song LN, Zhu JJ, Yan QL et al. Comparison of intrinsic water use efficiency between different aged Pinus sylvestris var. mongolica wide windbreaks in semiarid sandy land of Northern China. Agroforestry Systems, 2015, 89(3): 477-489. DOI:10.1007/s10457-014-9784-4 |
| [18] |
Sun SJ, He CX, Qiu LF et al. Stable isotope analysis reveals prolonged drought stress in poplar plantation mortality of the Three-North Shelter Forest in Northern China. Agricultural and Forest Meteorology, 2018, 252: 39-48. DOI:10.1016/j.agrformet.2017.12.264 |
| [19] |
Sternberg LSL, Deniro MJ, Savidge RA. Oxygen isotope exchange between metabolites and water during biochemical reactions leading to cellulose synthesis. Plant Physiology, 1986, 82(2): 423-427. DOI:10.1104/pp.82.2.423 |
| [20] |
Barbour MM, Fischer RA, Sayre KD et al. Oxygen isotope ratio of leaf and grain material correlates with stomatal conductance and grain yield in irrigated wheat. Functional Plant Biology, 2000, 27(7): 625. DOI:10.1071/pp99041 |
| [21] |
Cabrera-Bosquet L, Albrizio R, Nogués S et al. Dual Δ13C/δ18O response to water and nitrogen availability and its relationship with yield in field-grown durum wheat. Plant, Cell & Environment, 2011, 34(3): 418-433. DOI:10.1111/j.1365-3040.2010.02252.x |
| [22] |
Wang J, Wen XF. Limiting resource and leaf functional traits jointly determine distribution patterns of leaf intrinsic water use efficiency along aridity gradients. Frontiers in Plant Science, 2022, 13: 909603. DOI:10.3389/fpls.2022.909603 |
| [23] |
Hu ZP, Ge G, Liu CL et al. Structure of Poyang Lake wetland plants ecosystem and influence of lake water level for the structure. Resources and Environment in the Yangtze Basin, 2010, 19(6): 597-605. [胡振鹏, 葛刚, 刘成林等. 鄱阳湖湿地植物生态系统结构及湖水位对其影响研究. 长江流域资源与环境, 2010, 19(6): 597-605.] |
| [24] |
Henderson SA, Caemmerer SV, Farquhar GD. Short-term measurements of carbon isotope discrimination in several C4 species. Functional Plant Biology, 1992, 19(3): 263. DOI:10.1071/pp9920263 |
| [25] |
Feng XH. Long-term ci/ca response of trees in western North America to atmospheric CO2 concentration derived from carbon isotope chronologies. Oecologia, 1998, 117(1): 19-25. DOI:10.1007/s004420050626 |
| [26] |
Tao SY, Zhang X, Pan GY et al. Moisture source identification based on the seasonal isotope variation of precipitation in the Poyang Lake Wetland, China. Journal of Hydrology: Regional Studies, 2021, 37: 100892. DOI:10.1016/j.ejrh.2021.100892 |
| [27] |
Cernusak LA, Tcherkez G, Keitel C et al. Why are non-photosynthetic tissues generally 13C enriched compared with leaves in C3 plants? Review and synthesis of current hypotheses. Functional Plant Biology: FPB, 2009, 36(3): 199-213. DOI:10.1071/FP08216 |
| [28] |
Hobbie EA, Werner RA. Intramolecular, compound-specific, and bulk carbon isotope patterns in C3 and C4 plants: A review and synthesis. The New Phytologist, 2004, 161(2): 371-385. DOI:10.1111/j.1469-8137.2004.00970.x |
| [29] |
Cernusak LA, Aranda J, Marshall JD et al. Large variation in whole-plant water-use efficiency among tropical tree species. The New Phytologist, 2007, 173(2): 294-305. DOI:10.1111/j.1469-8137.2006.01913.x |
| [30] |
Lin GH, Sternberg LSL. Hydrogen isotopic fractionation by plant roots during water uptake in coastal wetland plants. Stable Isotopes and Plant Carbon-water Relations, 1993, 497-510. DOI:10.1016/b978-0-08-091801-3.50041-6 |
| [31] |
Sardans J, Peñuelas J. Hydraulic redistribution by plants and nutrient stoichiometry: Shifts under global change. Ecohydrology, 2014, 7(1): 1-20. DOI:10.1002/eco.1459 |
| [32] |
Wang YT, Li JY, Cheng W et al. Study on seasonal variation in carbon isotope composition correspond with soil temperature and humidity and weather factors for main greening tree species in Beijing. Acta Ecologica Sinica, 2008, 28(7): 3143-3151. [王玉涛, 李吉跃, 程炜等. 北京城市绿化树种叶片碳同位素组成的季节变化及与土壤温湿度和气象因子的关系. 生态学报, 2008, 28(7): 3143-3151.] |
| [33] |
Farquhar GD, Ehleringer JR, Hubick KT. Carbon isotope discrimination and photosynthesis. Annual Review of Plant Physiology & Plant Molecular Biology, 1989, 40: 503-537. |
| [34] |
Flanagan LB, Farquhar GD. Variation in the carbon and oxygen isotope composition of plant biomass and its relationship to water-use efficiency at the leaf- and ecosystem-scales in a northern Great Plains grassland. Plant, Cell & Environment, 2014, 37(2): 425-438. DOI:10.1111/pce.12165 |
| [35] |
Liu Y, Li P, Shen B et al. Effects of drought stress on Bothriochloa ischaemum water-use efficiency based on stable carbon isotope. Acta Ecologica Sinica, 2017, 37(9): 3055-3064. [刘莹, 李鹏, 沈冰等. 采用稳定碳同位素法分析白羊草在不同干旱胁迫下的水分利用效率. 生态学报, 2017, 37(9): 3055-3064. DOI:10.5846/stxb201601180112] |
| [36] |
Hu HY, Li HX, Ni B et al. Characteristic of typical vegetation community and water use efficiency of dominant plants in desert steppe of Ningxia. Journal of Zhejiang University: Agriculture and Life Sciences, 2019, 45(4): 460-471. [胡海英, 李惠霞, 倪彪等. 宁夏荒漠草原典型群落的植被特征及其优势植物的水分利用效率. 浙江大学学报: 农业与生命科学版, 2019, 45(4): 460-471.] |
| [37] |
Werner C, Gessler A. Diel variations in the carbon isotope composition of respired CO2 and associated carbon sources: A review of dynamics and mechanisms. Biogeosciences, 2011, 8(9): 2437-2459. DOI:10.5194/bg-8-2437-2011 |
 2024, Vol. 36
2024, Vol. 36 

