(2: 水利部中国科学院水工程生态研究所, 水利部水工程生态效应与生态修复重点实验室, 武汉 430076)
(3: 西藏自治区高原生物研究所, 拉萨 850000)
(2: Key Laboratory of Ecological Impacts of Hydraulic-projects and Restoration of Aquatic Ecosystem, Institute of Hydroecology, Ministry of Water Resources and Chinese Academy of Sciences, Wuhan 430076, P.R. China)
(3: Tibet Plateau Institute of Biology, Lhasa 850000, P.R. China)
揭示生物多样性的形成/维持机制即群落构建机制是生物多样性保护的重要途径,也是生物地理学、群落生态学和保护生物学的关键目标[1-2]。对于群落构建机制的研究首先要综合评估生物多样性现状,即对生物多样性进行测度。传统的群落生态学研究往往将生物多样性等同于物种多样性。然而,群落中物种在生态过程中的作用和贡献往往与其功能性状密切相关,功能多样性不仅可以刻画群落中物种功能性状的数值、范围、分布及相对丰度等[3],还能够量化物种在群落中的作用与功能(如生物对环境和资源的利用程度),将群落中的物种与生态学过程有效联系起来,因而成为刻画群落生物多样性的重要指标[4]。此外,群落内现有物种的聚合模式是进化过程与生态过程共同作用的结果,作为连接物种亲缘关系与群落生态学的桥梁,系统发育多样性的引入将群落的生态学过程置于进化生物学和生物地理学背景之下,为群落生物多样性研究提供了新的视角[5-6]。功能多样性与系统发育多样性各具侧重点,相较于单独使用物种多样性指标,二者的引入能够更好地揭示群落聚合、生物多样性维持及生态系统功能的内在机理[7-8]。
雅鲁藏布江是世界上海拔最高的大河,发源于喜马拉雅山脉中段北麓的杰马央宗冰川,自西向东横贯西藏南部,在喜马拉雅山东麓的南迦巴瓦峰急转南流,在墨脱县巴昔卡出境流入印度并改名为布拉马普特拉河。雅鲁藏布江全长2057 km,流域面积24.6万km2,约占西藏总面积的五分之一;里孜以上为上游段,里孜至派镇为中游段,中上游江段有众多宽谷与峡谷串联相接,形成复杂独特的河流形态;派镇以下至巴昔卡为下游段,该江段海拔落差巨大,河床狭窄,滩礁遍布,浪高水急,是世界上最长和最深的峡谷——雅鲁藏布大峡谷[9]。已有地质学研究表明,雅鲁藏布大峡谷是在青藏高原隆升地质背景下河流袭夺改道的产物:雅鲁藏布江在历史上曾经与伊洛瓦底江及察隅河相连通,经历两次溯源袭夺形成了现有的水系格局[10-11]。频繁的地质运动不仅造成了水系变迁,也对该区域地表河流环境产生了深刻影响,众多珍稀特有鱼类应运而生。根据已有调查记录,雅鲁藏布江流域共分布有土著鱼类30余种,除细尾高原鳅(Triplophysa stenura)等少数种类外均为该流域特有物种,其中包括巨须裂腹鱼(Schizothorax macropogon)、平鳍裸吻鱼(Psilorhynchus homaloptera)等国家二级保护动物[12-13]。
目前,雅鲁藏布江中游干流和部分支流已经建成或在建多座水电站或水利枢纽,下游江段的水电开发也被纳入“十四五”规划和2035年远景目标;同时,公路和铁路建设等人类活动对河流生态系统的影响也在与日俱增,在此背景下开展雅鲁藏布江流域鱼类多样性评估工作显得尤为迫切。目前,已有学者探讨了雅鲁藏布江中下游江段鱼类群落时空动态及其与环境因子的关系[13-14],这些研究大都是基于物种多样性,而整合功能和系统发育等维度的鱼类多样性研究报道却十分匮乏。本研究基于在雅鲁藏布江全流域尺度内的鱼类资源调查,整合物种多样性、功能多样性和系统发育多样性指数,利用群落构建模型检验等手段,综合评价雅鲁藏布江鱼类多样性现状,初步揭示驱动鱼类群落构建的生态学过程,以期为该区域鱼类多样性保护与管理提供科学依据,也为应用多维度指数评价鱼类多样性的研究提供参考借鉴。
1 材料与方法 1.1 研究区域与鱼类样本采集调查采样范围选定在雅鲁藏布江上游仲巴县至下游墨脱县背崩乡江段,在其间干支流共布设24个样点(附表Ⅰ),分别于2020年4—5月、2021年7—8月和2022年1月开展流动性鱼类资源调查。渔具根据河段生境特点选择定置刺网、地笼或小型电鱼机;其中定置刺网和地笼过夜放置12~24 h,小型电鱼机每次工作0.5 h,采样强度和频次以样点内不再新增物种记录为依据;每次采样记录好时间、渔具等信息。捕获的鱼类样本鉴定到种,并逐尾测定体长、体重等生物学参数;每种鱼类尽量随机选择10~15尾标本,在鱼体右侧剪取背部肌肉或胸鳍组织保存于无水乙醇中,残体则用10% 浓度福尔马林固定;样品带回实验室后分别供分子生物学实验和功能性状测定实验所用。
1.2 多样性指数测度选取物种丰度(物种数)S、Shannon-Wiener多样性指数、Simpson多样性指数和Pielou均匀度指数用以表征各样点鱼类群落的物种多样性;4种指数的计算过程在R语言“vegan”包中实现[15]。
选取12种不同类别的功能性状用于鱼类群落功能多样性指数的计算,根据现场调查、形态测量、解剖观察并结合已发表文献及FishBase数据库检索等方法进行分类或赋值,包括3项与营养相关的功能性状、3项与运动相关的功能性状、3项与栖息地利用相关的功能性状以及3项与生活史策略相关的功能性状(表 1)。选取5项功能多样性指数用以刻画鱼类群落的功能多样性,分别是功能丰富度(FRic)指数、功能均匀度(FEve)指数、功能离散度(FDiv)指数、功能分异度(FDis)指数和Rao的二次熵(Rao's Q)指数;5项指数的计算过程在R语言“FD”包中实现[16]。
| 表 1 雅鲁藏布江流域鱼类的12种功能性状 Tab. 1 Twelve functional traits of fishes in the Yarlung Tsangpo River drainage |
选取线粒体细胞色素b(Cytb)基因作为分子标记进行系统发育多样性分析。采用略加改进的高盐法[19]提取基因组DNA,PCR反应体系和扩增流程参照文献[20],扩增引物选用L14724和L15915[21],PCR产物送至武汉天一华煜基因科技有限公司进行纯化、双向测序及拼接,测序使用的引物与扩增引物保持一致。利用ClustalX软件[22]和MEGA 7.0软件[23]对序列数据进行比对和校正,并分析序列中碱基组成、变异位点、转换颠换比值及物种间遗传距离等参数。系统发育多样性分析引入群落物种最短进化枝长之和的Faith系统发育多样性(PD)指数,以及平均配对种间系统发育距离(MPD)指数和平均最近种间系统发育距离(MNTD)指数。PD指数是指连接群落中所有物种的最短进化枝长之和[24],MPD指数是指群落中两两物种间的平均系统发育距离[5],MNTD指数是指群落中物种与其亲缘关系最近的物种间的平均系统发育距离[5];3项指数的计算过程在R语言“picante”包中实现[25]。
1.3 数据分析为检验鱼类群落组成的空间差异,基于物种丰度数据并根据Bray-Curtis相异度对24个样点的鱼类群落进行分层聚类[26];分析过程在R语言“vegan”包中进行[15]。采用Kruskal-Wallis检验方法比较层次聚类的各聚类组间多样性指数的水平差异,Kruskal-Wallis检验是一种基于秩和比较的非参数检验,适用于样本量较小且不符合正态分布的数据;检验过程在SPSS 20.0软件中完成。使用Shapiro-wilk检验判别12项多样性指数的正态性:如果所有指数均服从正态分布,则使用Pearson相关性检验判断各指数间的相关关系,否则采用Spearman秩相关检验;相关性分析及作图在R语言“psych”包中实现[27]。
对物种功能性状的系统发育信号即功能性状与物种进化历史的关联程度进行检测,选用Blomberg's K值检验法。K值是比较性状的观察值与布朗运动模型预测值的统计量,其原理是系统发育树末端物种性状数据的均方差与基于系统发育树方差—协方差矩阵计算的均方误差的比值;K值接近1表明性状进化过程接近布朗运动而具有一定的系统发育信号,K值接近0表明性状进化倾向于随机,K值大于1则说明性状的系统发育信号强[28];系统发育信号检测在R语言“phytools”包中实现[29]。
群落功能性状结构和系统发育结构的模型检验分别选用平均配对性状距离(S.E.S.PW)指数和净亲缘关系(NRI)指数;二者的计算公式如下:
| S.E.S.PW=−1×(PWobs −mean(PWnull )SD(PWnull )) | (1) |
| NRI=−1×MPDobs −mean(MPDnull )SD(MPDnull ) | (2) |
式中,PWobs和MPDobs分别表示群落物种个体间配对功能性状距离和系统发育距离的平均观测值,mean(PWnull)和mean(MPDnull)分别表示功能性状聚类树上和系统发育树上物种随机分配并进行1000次迭代产生的999个随机化结果的平均值,SD(PWnull)和SD(MPDnull)分别表示这些随机值的标准差。
S.E.S.PW或NRI值大于0表示群落功能性状结构或系统发育结构趋于聚集,组成群落的物种多为功能相似种或近缘种,主导群落构建的过程为生境过滤;二者小于0表示群落功能性状结构或系统发育结构趋于发散,组成群落的物种多为功能相异种或远缘种,主导群落构建的过程为种间竞争排斥和生态位分化;二者接近0则说明群落构建倾向于随机过程[5, 30];模型检验过程分别在R语言“FD”包[16]和“picante”包[25]中实现。
2 结果与分析 2.1 鱼类物种组成与种间遗传距离在雅鲁藏布江流域24个调查样点共采集到37种鱼类,隶属于3目7科24属。其中土著鱼类27种,分属于2目4科15属;外来鱼类10种,分属于3目5科10属。从物种组成上看,流域内鱼类物种以鲤形目鲤科鱼类占比最高,包含13种土著鱼类和5种外来鱼类。鱼类物种名录及其分布情况见附表Ⅰ。基于群落间物种丰度的Bray-Curtis相异度水平对24个样点的鱼类群落进行层次聚类,结果如图 1所示。以0.6相异度作为划分界限,可将24个样点分成4个差异明显的组:组Ⅰ为帕隆藏布汇口以上流量较小的支流及大型支流中上游河段的样点(夏布曲、尼木玛曲、拉萨河墨竹工卡、脚布朗曲、里龙普曲及扎绕河样点);组Ⅱ包含的样点较多,为帕隆藏布汇口以上除组Ⅰ外的干流及大型支流的样点;组Ⅲ为帕隆藏布汇口以下的干流样点(卡布村和背崩乡样点);组Ⅳ为帕隆藏布汇口以下的支流样点(金珠藏布、西贡河及白马西路河样点)。
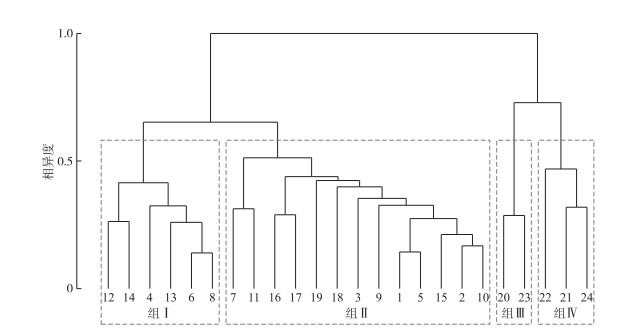
|
图 1 雅鲁藏布江流域24个样点鱼类群落的层次聚类树状图 Fig.1 Dendrogram of hierarchical clustering on fish communities of 24 sampling sites in the Yarlung Tsangpo River drainage |
对37种鱼类线粒体Cytb基因序列进行测定,经比对校正后获得长度为1140 bp的序列集,并上传至GenBank数据库中(登录号:OQ437204~OQ437240)。序列集中碱基A占比27.8%,碱基T占比29.1%,碱基C占比27.8%,碱基G占比15.3%,表现出强烈的反G偏倚。序列集中包含553个变异位点,其中单变异位点56个,简约信息位点497个,转换与颠换之比为3.36。基于Kimura双参数模型的物种间平均遗传距离为25.5%;异齿裂腹鱼和弧唇裂腹鱼之间遗传距离最小,为2.4%;扁头异鮡和小黄黝鱼之间遗传距离最大,为40.4% (附表Ⅱ)。37种鱼类基于Cytb基因序列的种间遗传距离将用于下一步群落系统发育多样性分析中。
2.2 鱼类多样性格局从物种多样性维度来看,24个样点的鱼类物种丰度S在3~14之间,最高值出现在下游干流背崩乡样点,最低值出现在中游支流脚布朗曲及扎绕河两个样点;Shannon-Wiener多样性指数在0.589~1.924之间,最高值出现在下游支流西贡河样点,最低值出现在下游支流金珠藏布样点;Simpson多样性指数在0.259~0.817之间,最高值出现在中游支流多雄藏布样点,最低值出现在下游支流金珠藏布样点;Pielou均匀度指数在0.366~0.887之间,最高值出现在中游支流多雄藏布样点,最低值出现在下游支流金珠藏布样点。
从功能多样性维度来看,各样点的FRic指数在0.0005~0.0956之间,最高值出现在中游支流尼洋河八一镇样点,最低值出现在中游支流脚布朗曲及扎绕河两个样点;FEve指数在0.4062~0.9014之间,最高值出现在中游支流里龙普曲样点,最低值出现在下游支流金珠藏布样点;FDiv指数在0.5047~0.9861之间,最高值出现在下游支流金珠藏布样点,最低值出现在中游支流多雄藏布样点;FDis指数在0.0440~0.1201之间,最高值出现在下游支流西贡河样点,最低值出现在中游支流尼洋河巴河镇样点;Rao's Q指数在0.0035~0.0193之间,最高值出现在下游干流背崩乡样点,最低值出现在中游支流尼洋河巴河镇样点。
从系统发育多样性维度来看,各样点的PD指数在0.351~1.309之间,最高值出现在下游干流背崩乡样点,最低值出现在中游支流脚布朗曲及扎绕河两个样点;MPD指数在0.070~0.206之间,最高值出现在下游支流西贡河样点,最低值出现在下游支流金珠藏布样点;MNTD指数在0.063~0.251之间,最高值出现在中游支流扎绕河样点,最低值出现在中游干流加查县样点。各样点多样性指数的具体情况见附表Ⅲ。
基于层次聚类划分的4个组的多样性指数范围以及不同维度多样性指数在组间的水平差异见图 2。具体而言,共有2项物种多样性指数(Simpson指数和Pielou指数)和2项系统发育多样性指数(MPD指数和MNTD指数)在组间均未检测出显著性差异;其他8项指数均检测出至少一对的组间显著性差异(P<0.05);其中,物种丰度、FRic指数和FDis指数共同表现为组Ⅰ水平低于另外三组,Rao's Q指数和PD指数也检测到相同的结果(仅组Ⅱ与组Ⅳ、组Ⅲ与Ⅳ之间无显著性差异,其他配对组间均具有显著性差异)。
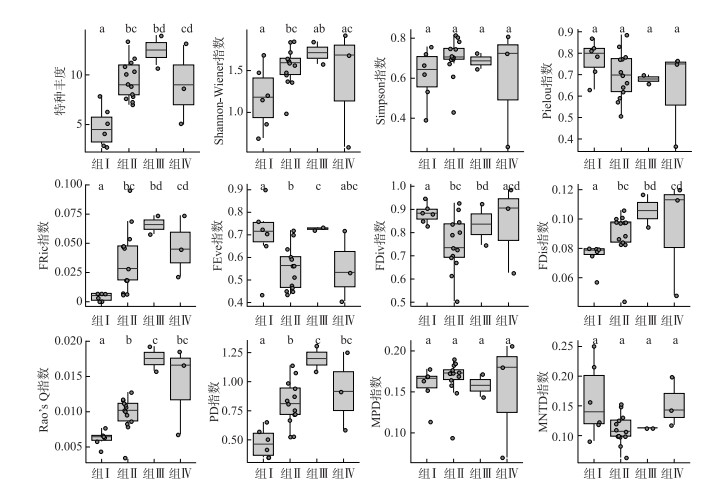
|
图 2 雅鲁藏布江流域鱼类群落4个聚类组间的多样性指数比较(不同字母指示组间存在显著性差异) Fig.2 Comparisons between four clustering groups of fish communities in the Yarlung Tsangpo River drainage (different letters indicate the significant differences among groups) |
由于12项多样性指数中有5项不符合正态分布(附表Ⅲ),故采用Spearman秩相关检验分析12项多样性指数间的相关性,具体结果见图 3。其中,物种丰度、Shannon-Wiener指数、Simpson指数、Pielou指数、FRic指数、FDis指数、Rao's Q指数、PD指数及MPD指数两两之间存在不同显著性水平的正相关关系,相关系数在0.42~0.97之间(P < 0.05/0.01/0.001)。FDiv指数和MNTD指数与其他指数之间多存在显著或极显著的负相关关系,相关系数范围分别为-0.59~-0.41和-0.53~-0.44(P < 0.05/0.01)。此外,FEve指数仅与Pielou指数存在极显著的正相关关系(P < 0.001),与其他指数之间未检测到显著的相关关系。
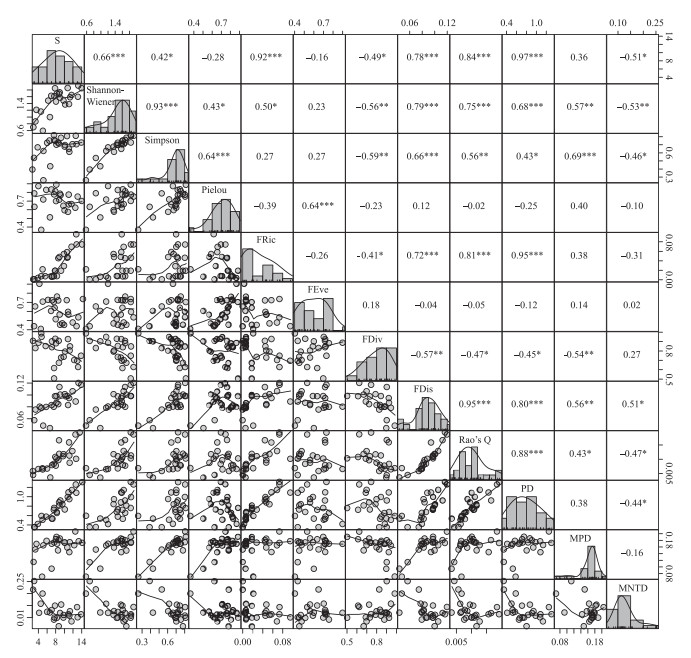
|
图 3 雅鲁藏布江流域鱼类群落12项多样性指数之间的相关关系 (*/**/***分别表示显著性水平P < 0.05/P < 0.01/P < 0.001) Fig.3 Correlation relationships among 12 diversity indices of fish communities in the Yarlung Tsangpo River drainage (*/**/*** indicate significance of P < 0.05/P < 0.01/P < 0.001) |
雅鲁藏布江鱼类12种功能性状的赋值及其系统发育信号的检验结果见附表Ⅳ。K在0.630~3.724之间,除相对肠长、繁殖力和产卵类型外,其他9项功能性状均检测出具有显著性的K(P < 0.05),表明多数功能性状与物种进化历史的联系非常紧密。其中,营养级、相对吻长、相对体高、相对尾柄长、相对背鳍长、栖息水层和最大体长7项性状的K接近于1(0.807~1.355),表明这些性状进化过程接近布朗运动,具有一定程度的系统发育信号;而流速偏好和底质偏好的K明显大于1(2.301~3.724),表明这两项功能性状更加保守。
基于群落功能性状结构和系统发育结构的模型检验对24个样点鱼类群落构建过程进行分析,结果见图 4。基于群落功能性状结构的检验结果显示各样点鱼类群落的S.E.S.PW值均小于0,范围为-2.323~-0.142,其中8个样点的检验结果具有显著性(P < 0.05),表明这些样点的群落功能性状在不同程度上均趋于发散。基于群落系统发育结构的检验结果显示各样点鱼类群落的NRI值在-2.263~0.597之间,仅尼木玛曲样点达到显著性水平(P < 0.05);其中7个样点NRI值大于0,群落系统发育结构表现为微弱的聚集;17个样点NRI值小于0,群落系统发育结构表现为不同程度的发散。
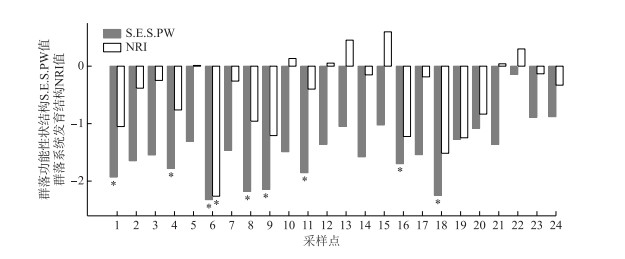
|
图 4 雅鲁藏布江流域24个样点鱼类群落功能性状结构S.E.S.PW指数和系统发育结构NRI指数 (*表示与0之间存在显著性差异,P < 0.05) Fig.4 The functional structure index S.E.S.PW and phylogenetic structure index NRI for fish communities of 24 sites in the Yarlung Tsangpo River drainage (* indicate the significance difference with 0 at the level of P < 0.05) |
本研究在雅鲁藏布江各样点中调查到27种土著鱼类和10种外来鱼类,与前人的调查结果基本一致[12-13, 31]。土著鱼类以鲤科裂腹鱼亚科、条鳅科高原鳅属和鮡科鱼类为主要类群,除少数分布范围较广的高原鳅外全部为该流域特有种;外来鱼类组成多为东亚平原山区常见种类,推测为观赏或养殖鱼类及其伴随种经人为放生等途径进入[32]。雅鲁藏布江自上游至下游的鱼类群落大致可分为4个差异明显的组群,这与剧烈的河流环境梯度以及峡谷对鱼类交流的阻隔效应等因素密切相关。作为印度洋暖湿气流进入青藏高原的通道,大峡谷所在的下游江段气候温暖湿润,是西藏地区年均降水量最大的区域,墨脱县江段河谷两岸呈现出热带雨林景观;而中上游江段由于受到暖湿气流的影响较小,整体上属于高原气候类型[33]。从鱼类区系组成上看,以帕隆藏布汇口为分界点,以上江段中分布的鱼类属于典型的高原区系类群:由裂腹鱼类、高原鳅和鮡科鱼类3大类群构成(组Ⅰ和组Ⅱ);而汇口以下江段鱼类组成更加复杂多样,出现了鲃亚科与野鲮亚科的种类以及条鳅科南鳅属鱼类,开始显现出亚热带水域的鱼类区系特征(组Ⅲ和组Ⅳ)。帕隆藏布作为曾经连通雅鲁藏布江与察隅河的河道,其鱼类群落组成与雅鲁藏布江中上游干流江段保有较高的相似性。此外,帕隆藏布汇口以上的雅鲁藏布江小型支流由于流量较小、生境容量有限,其鱼类物种组成有异于干流样点,主要分布有拉萨裸裂尻鱼和短尾高原鳅等中小型鱼类;在帕隆藏布汇口以下的墨脱县江段情况类似,西藏墨头鱼等中小型鱼类在支流丰度较高,弧唇裂腹鱼等大型鱼类在干流丰度较高;上述研究结果进一步证实鱼类在不同生境类型中的丰度差异导致了两大江段内部鱼类群落结构的产生[34-35]。
整合物种、功能和系统发育多维度指数评价群落或生态系统的生物多样性是近年来的研究热点,学者们致力于寻找各类不同评价指标尽可能全面地刻画生物多样性[36-37]。已有应用不同维度多样性指数的研究表明物种多样性、功能多样性和系统发育多样性三者间存在着紧密关联[38-39],本研究也得到了类似结论:物种、功能和系统发育3个维度12项多样性指数之间普遍存在正相关或负相关关系。例如,与物种丰度相关性较高的几个指数,包括Shannon-Wiener指数、Simpson指数、FRic指数、FDis指数、Rao's Q指数和PD指数等,在这些指数的涵义中与物种丰度相关的假设是隐含其中的,在今后的生物多样性评价中可适当筛选精简。FEve指数通常衡量群落物种在所占据性状空间的分布是否均匀以及资源利用是否充分,进而作为群落生产力和抵抗力稳定性的评价指标[40],在12项指数中仅与Pielou指数存在中等程度的正相关,暗示二者在指示群落物种均匀性和资源利用能力方面具有独特价值。FDiv指数和MNTD指数分别用以衡量群落内物种功能性状的离散程度和系统发育关系的离散程度,功能性状相似或亲缘关系近的物种越多,群落内部竞争越激烈,生态系统功能越不稳定[41];这两项指数与其他指示丰度的指数之间存在显著的负相关,表明二者能够提供有关群落内部种间生态位相似程度的信息。
在基于功能性状结构和系统发育结构的群落构建过程研究中首先需要检验一个假设:亲缘关系更近的物种在生态功能特征上总是更加相似,即物种的系统发育位置与其功能性状之间有很强的对应关系[5, 42]。本研究选取的多数功能性状检测出具有显著性的系统发育信号,说明雅鲁藏布江鱼类的功能性状与进化历史存在着紧密的耦合关联。群落功能性状结构和系统发育结构的检验结果有所差异,暗示着不同维度模型在模拟鱼类群落构建过程中具有不同的指示内涵。基于群落功能性状结构的检验结果表明所有样点中驱动鱼类群落构建的生态过程均为不同程度的种间竞争排斥;群落系统发育检验结果显示多数样点为未达显著性水平的种间竞争排斥,少数样点检测结果为近中性过程或微弱的生境过滤。因此,整体而言,种间竞争排斥应该在雅鲁藏布江鱼类群落构建过程中发挥了相对重要的作用,推测其原因可能是由于雅鲁藏布江水温偏低、水体营养贫瘠且外源营养物质补充较少,物种间营养竞争关系较为紧张。已有研究证实,包括异齿裂腹鱼、拉萨裸裂尻鱼、弧唇裂腹鱼和西藏墨头鱼在内的雅鲁藏布江主要鱼类物种均为主要以着生藻类和底栖动物为食的杂食性鱼类[35-36, 43],同域分布的鱼类由于食物来源重叠度高而产生激烈的营养竞争。因此,在制定雅鲁藏布江鱼类资源保护方案时,应格外重视为鱼类提供食物来源的卵石/砾石底质浅水河滩生境。此外,需要指出的是,本研究基于群落功能性状结构和系统发育结构的模型检验结果进行了探讨,对于鱼类群落构建机制的深入解析后续还需结合具体生态学过程(如种间互作关系和栖息地环境因子限制)及其他随机过程(如物种扩散)开展进一步研究。
4 附录附表Ⅰ~Ⅳ见电子版(DOI: 10.18307/2024.0133)。
| 附表Ⅰ 雅鲁藏布江流域鱼类物种名录及分布 Appendix Ⅰ Fish species list and their occurrence in 24 sampling sites of the Yarlung Tsangpo River drainage |
| 附表Ⅱ 雅鲁藏布江流域鱼类基于线粒体Cyt b基因序列和Kimura双参数模型的遗传距离(%) Appendix Ⅱ The genetic distances (%) among fish species in the Yarlung Tsangpo River drainage inferred from mitochondrial Cyt b gene sequences based on Kimura 2-parameter model |
| 附表Ⅲ 雅鲁藏布江流域24个样点鱼类群落的12项多样性指数及其正态性检验 Appendix Ⅲ Twelve diversity indices of fish communities in 24 sampling sites of the Yarlung Tsangpo River drainage with their normality tests |
| 附表Ⅳ 雅鲁藏布江流域鱼类12项功能性状的赋值及其系统发育信号 Appendix Ⅳ The assignments and phylogenetic signals for 12 functional traits of fish species in the Yarlung Tsangpo River drainage |
| [1] |
Heino J. A macroecological perspective of diversity patterns in the freshwater realm. Freshwater Biology, 2011, 56(9): 1703-1722. DOI:10.1111/j.1365-2427.2011.02610.x |
| [2] |
Sutherland WJ, Freckleton RP, Godfray HCJ et al. Identification of 100 fundamental ecological questions. Journal of Ecology, 2013, 101(1): 58-67. DOI:10.1111/1365-2745.12025 |
| [3] |
Schleuter D, Daufresne M, Massol F et al. A user's guide to functional diversity indices. Ecological Monographs, 2010, 80(3): 469-484. DOI:10.1890/08-2225.1 |
| [4] |
Mouillot D, Graham NAJ, Villéger S et al. A functional approach reveals community responses to disturbances. Trends in Ecology & Evolution, 2013, 28(3): 167-177. DOI:10.1016/j.tree.2012.10.004 |
| [5] |
Webb CO, Ackerly DD, McPeek MA et al. Phylogenies and community ecology. Annual Review of Ecology and Systematics, 2002, 33: 475-505. DOI:10.1146/annurev.ecolsys.33.010802.150448 |
| [6] |
Matthew WP, Luke JH. An integrative view of phylogenetic comparative methods: Connections to population genetics, community ecology, and paleobiology. Annals of the New York Academy of Sciences, 2013, 1289(1): 90-105. DOI:10.1111/nyas.12157 |
| [7] |
Dehling DM, Fritz SA, Töpfer T et al. Functional and phylogenetic diversity and assemblage structure of frugivorous birds along an elevational gradient in the tropical Andes. Ecography, 2014, 37(11): 1047-1055. DOI:10.1111/ecog.00623 |
| [8] |
Hurtado P, Prieto M, Aragón G et al. Critical predictors of functional, phylogenetic and taxonomic diversity are geographically structured in lichen epiphytic communities. Journal of Ecology, 2019, 107(5): 2303-2316. DOI:10.1111/1365-2745.13189 |
| [9] |
高登义. 世界第一大峡谷: 雅鲁藏布大峡谷历史、资源及其与自然环境和人类活动关系. 杭州: 浙江教育出版社, 2001.
|
| [10] |
Brookfield ME. The evolution of the great river systems of southern Asia during the Cenozoic India-Asia collision: Rivers draining southwards. Geomorphology, 1998, 22(3/4): 285-312. DOI:10.1016/S0169-555X(97)00082-2 |
| [11] |
Zeitler PK, Meltzer AS, Koons PO et al. Erosion, Himalayan geodynamics, and the geomorphology of metamorphism. GSA Today, 2001, 11(1): 4. DOI:10.1130/1052-5173(2001)0110004:ehgatg>2.0.co;2 |
| [12] |
张春光, 蔡斌, 许涛清. 西藏鱼类及其资源. 北京: 中国农业出版社, 1995.
|
| [13] |
Liu F, Li M, Wang J et al. Species composition and longitudinal patterns of fish assemblages in the middle and lower Yarlung Zangbo River, Tibetan Plateau, China. Ecological Indicators, 2021, 125(1): 107542. DOI:10.1016/j.ecolind.2021.107542 |
| [14] |
Li L, Ma B, Jin X et al. Structural and diversity characteristics of fish communities in the Motuo reach of the Yarlung Zangbo Grand Canyon. Journal of Fishery Sciences of China, 2022, 29(9): 1326-1336. [李雷, 马波, 金星等. 西藏雅鲁藏布江大峡谷墨脱江段鱼类群落结构及多样性的空间分布特征. 中国水产科学, 2022, 29(9): 1326-1336. DOI:10.12264/JFSC2021-0330] |
| [15] |
Oksanen J, Simpson GL, Blanchet FG et al. vegan: Community ecology package version 2.6-4, 2022.
|
| [16] |
Laliberté E, Legendre P, Shipley B. FD: Measuring functional diversity (FD) from multiple traits, and other tools for functional ecology, 2014.
|
| [17] |
Shuai FM, Li XH, Chen FC et al. Functional diversity of freshwater fishes and methods of measurement. Acta Ecologica Sinica, 2017, 37(15): 5228-5237. [帅方敏, 李新辉, 陈方灿等. 淡水鱼类功能多样性及其研究方法. 生态学报, 2017, 37(15): 5228-5237. DOI:10.5846/stxb201605030836] |
| [18] |
蒋忠冠. 洱海鱼类的生态形态学与功能多样性研究[学位论文]. 武汉: 中国科学院水生生物研究所, 2015.
|
| [19] |
Tang QY, Freyhof J, Xiong BX et al. Multiple invasions of Europe by East Asian cobitid loaches (Teleostei: Cobitidae). Hydrobiologia, 2008, 605(1): 17-28. DOI:10.1007/s10750-008-9296-1 |
| [20] |
Gong Z, Liu YC, Ma CM et al. Genetic diversity of Triplophysa brevicauda in the middle Yarlung Tsangpo River based on mitochondrial Cytb gene sequences. Freshwater Fisheries, 2022, 52(4): 31-39. [巩政, 刘艳超, 马聪敏等. 基于线粒体Cytb基因的雅鲁藏布江中游短尾高原鳅遗传多样性研究. 淡水渔业, 2022, 52(4): 31-39.] |
| [21] |
Xiao WH, Zhang YP, Liu HZ. Molecular systematics of Xenocyprinae (Teleostei: Cyprinidae): Taxonomy, biogeography, and coevolution of a special group restricted in East Asia. Molecular Phylogenetics and Evolution, 2001, 18(2): 163-173. DOI:10.1006/mpev.2000.0879 |
| [22] |
Thompson JD, Gibson TJ, Plewniak F et al. The CLUSTAL_X windows interface: Flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research, 1997, 25(24): 4876-4882. DOI:10.1093/nar/25.24.4876 |
| [23] |
Kumar S, Stecher G, Tamura K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution, 2015, 33(7): 1870-1874. DOI:10.1093/molbev/msw054 |
| [24] |
Faith DP. Conservation evaluation and phylogenetic diversity. Biological Conservation, 1992, 61(1): 1-10. DOI:10.1016/0006-3207(92)91201-3 |
| [25] |
Kembel SW, Cowan PD, Helmus MR et al. Picante: R tools for integrating phylogenies and ecology. Bioinformatics, 2010, 26(11): 1463-1464. DOI:10.1093/bioinformatics/btq166 |
| [26] |
Clifford HT, Stephenson W. An introduction to numerical classification. New York: Academic Press, 1975.
|
| [27] |
Revelle W. Psych: Procedures for psychological, psychometric, and personality research[Dissertation]. Evanston: Northwestern University, 2022.
|
| [28] |
Blomberg SP, Garland T, Ives AR. Testing for phylogenetic signal in comparative data: Behavioral traits are more labile. Evolution; International Journal of Organic Evolution, 2003, 57(4): 717-745. DOI:10.1111/j.0014-3820.2003.tb00285.x |
| [29] |
Revell LJ. Phytools: An R package for phylogenetic comparative biology (and other things). Methods in Ecology and Evolution, 2012, 3(2): 217-223. DOI:10.1111/j.2041-210x.2011.00169.x |
| [30] |
Wang SY, Lv GH, Jiang LM et al. Multi-scale analysis on functional diversity and phylogenetic diversity of typical plant community in Ebinur Lake. Ecology and Environmental Sciences, 2020, 29(5): 889-900. [王诗韵, 吕光辉, 蒋腊梅等. 不同尺度下艾比湖典型植物群落功能多样性和系统发育多样性研究. 生态环境学报, 2020, 29(5): 889-900.] |
| [31] |
Feng X, Li B, Chen YF et al. Species-level monitoring of rare and invasive fishes using eDNA metabarcoding in the middle and upper Yarlung Zangbo River, Tibet. Water Biology and Security, 2023, 2(1): 100089. DOI:10.1016/j.watbs.2022.100089 |
| [32] |
Ding HP, Zhang ZM, Xie CX et al. Effects of fish invasion on aquatic ecosystem of the Yarlung Zangbo River and the prevention and control strategies. Chinese Journal of Ecology, 2022, 41(12): 2440-2448. [丁慧萍, 张志明, 谢从新等. 鱼类入侵对雅鲁藏布江水域生态系统的影响及其防治对策. 生态学杂志, 2022, 41(12): 2440-2448. DOI:10.13292/j.1000-4890.202301.012] |
| [33] |
Deng LB, Chen DL, Deng LQ. Ecological evaluation of Yarlung Zangbo Grand Canyon National Nature Reserve in Tibet. Scientia Silvae Sinicae, 2011, 47(5): 1-6. [邓立斌, 陈端吕, 邓丽群. 西藏雅鲁藏布大峡谷国家级自然保护区生态评价. 林业科学, 2011, 47(5): 1-6.] |
| [34] |
王健. 雅鲁藏布江下游鱼类群落结构及弧唇裂腹鱼(Schizothorax curvilabiatusa)生物学特征[学位论文]. 武汉: 中国科学院水生生物研究所, 2018.
|
| [35] |
巩政. 雅鲁藏布江下游墨头鱼属鱼类的分类整理与生态适应研究[学位论文]. 武汉: 中国科学院水生生物研究所, 2019.
|
| [36] |
Arnan X, Cerdá X, Retana J. Relationships among taxonomic, functional, and phylogenetic ant diversity across the biogeographic regions of Europe. Ecography, 2017, 40(3): 448-457. DOI:10.1111/ecog.01938 |
| [37] |
Baraloto C, Hardy OJ, Timothy Paine CE et al. Using functional traits and phylogenetic trees to examine the assembly of tropical tree communities. Journal of Ecology, 2012, 100(3): 690-701. DOI:10.1111/j.1365-2745.2012.01966.x |
| [38] |
Dong SK, Tang L, Zhang XF et al. Relationship between plant species diversity and functional diversity in alpine grasslands. Acta Ecologica Sinica, 2017, 37(5): 1472-1483. [董世魁, 汤琳, 张相锋等. 高寒草地植物物种多样性与功能多样性的关系. 生态学报, 2017, 37(5): 1472-1483. DOI:10.5846/stxb201509281981] |
| [39] |
Xia ZJ, Liu F, Yu FD et al. Species, functional and taxonomic diversity of fish in the Chishui River Basin. Journal of Hydroecology, 2022, 43(5): 89-98. [夏治俊, 刘飞, 余梵冬等. 赤水河流域鱼类物种、功能和分类多样性研究. 水生态学杂志, 2022, 43(5): 89-98. DOI:10.15928/j.1674-3075.202103190080] |
| [40] |
Zhang Q, Zeng Y, Xiao J et al. Functional diversities of fish community in Peng'an section of the middle reach of Jialing River. Acta Hydrobiologica Sinica, 2022, 46(5): 630-642. [张倩, 曾燏, 肖瑾等. 嘉陵江中游蓬安段鱼类群落功能多样性研究. 水生生物学报, 2022, 46(5): 630-642. DOI:10.7541/2022.2020.258] |
| [41] |
Zhang JT, Fan LH. Development of species functional diversity and its measurement methods. Journal of Mountain Science, 2011, 29(5): 513-519. [张金屯, 范丽宏. 物种功能多样性及其研究方法. 山地学报, 2011, 29(5): 513-519.] |
| [42] |
Cheng YK, Zhang H, Wang X et al. Effects of functional diversity and phylogenetic diversity on the tropical cloud forest community assembly. Chinese Journal of Plant Ecology, 2019, 43(3): 217-226. [程毅康, 张辉, 王旭等. 功能多样性和谱系多样性对热带云雾林群落构建的影响. 植物生态学报, 2019, 43(3): 217-226.] |
| [43] |
谢从新, 霍斌, 魏开建等. 雅鲁藏布江中游裂腹鱼类生物学与资源保护. 北京: 科学出版社, 2019.
|
 2024, Vol. 36
2024, Vol. 36 


