(2: 中国地质大学(武汉), 流域关键带演化湖北省重点实验室, 武汉 430074)
(2: Hubei Key Laboratory of Critical Zone Evolution, China University of Geosciences, Wuhan 430074, P.R. China)
泥炭沼泽占全球陆地总面积的3%,但却储存了约600 Gt碳,占地球陆地土壤碳储量的近25%[1],对全球碳循环和气候变化具有极为重要的调节作用。通常认为,泥炭地碳库形成于末次冰消期以来湿润气候条件下有机质缓慢堆积过程,其中一种典型模式为湖泊沼泽化[2]。泥炭地沉积记录证实,随着有机质不断积累,冰消期后形成的开阔湖面会不断萎缩,逐渐形成矿养型沼泽,而后形成雨养型沼泽[3]。在此过程中,湖泊中的浮叶植物首先被挺水植物取代,而后陆生草本和灌木开始不断增加,在雨养型沼泽中泥炭藓成为优势植被[2]。可见,植被群落演替是泥炭地环境演变的直接表征,并控制着泥炭地碳库形成,因而一直是泥炭地环境与全球变化研究关注的重点[4]。
泥炭地是由生产者和消费者通过食物链共同组成的生态系统[2]。消费者通过捕食作用直接或间接影响初级生产者生产力、生物量和分解过程[5],进而影响水生生态系统碳累积过程。然而,与初级生产者植被相比,目前对泥炭地消费者的关注较少[6]。传统观点认为,在泥炭地酸性贫营养生境中,消费者数量和种类相对较少。然而近年来研究发现,以摇蚊和甲螨为代表的微体动物种类和数量丰富[7-8]。考虑次级生产者之间食性偏好不同,在泥炭地演化的不同阶段,随着湿地植被的演化,次级生产者群落结构必然发生改变。
摇蚊是湖泊和泥炭地中一类重要的次级生产者,主要取食沉积物有机碎屑,包括泥炭植物、浮游植物、底栖藻类等内源有机质和陆生植物碎屑以及土壤有机质等外源输入有机物质,是湖泊和泥炭地生态系统食物链的关键组成部分[9]。然而,摇蚊幼虫食性广泛,通常不会固守某种专一的摄食模式,而是随食物来源发生转换[10]。在湖泊向泥炭沼泽演化过程中,随着生境类型和植被群落演替,摇蚊群落结构会如何变迁?目前相关报道很少,回答这一问题,不仅有助于深入认识泥炭地摇蚊生物多样性形成机制和摇蚊生态属性,而且可为追溯泥炭地环境演变历史提供关键线索。
神农架林区大九湖盆地地处典型的东亚季风区,由于湿润的气候和封闭的环境,盆地内发育了中国中东部地区保存最完整的亚热带亚高山泥炭沼泽湿地,并于2013年入选国际重要湿地名录。大九湖湿地分布有湖泊、溪流、临时性蓄水洼地、泥炭藓沼泽等多种湿地类型,涵盖了湖泊向泥炭沼泽演化的不同阶段环境状态,因而为探讨泥炭地演化序列提供了极佳的研究素材。已有研究发现,大九湖泥炭藓沼泽中摇蚊群落以半陆生Psilometriocnemus为主要优势类群,而且近400年来,优势种经历了由静水种到半陆生种逐渐转变的过程[11]。可见,摇蚊是指示泥炭地环境变化的有效生物指标。
为进一步探讨摇蚊群落结构对泥炭地演化过程的响应机制,本研究以大九湖湿地作为研究区域,沿水位等梯度在湖泊、溪流、临时性水洼和泥炭藓沼泽等多种生境中采集32个表层沉积物及水样,揭示不同生境条件下摇蚊群落结构差异,并通过多元统计分析探讨摇蚊群落结构的潜在影响因子,为未来更长时间尺度(千年尺度或更长)上泥炭发育和底栖群落间作用分析奠定基础。
1 材料与方法 1.1 研究区概况大九湖湿地公园(31°24′~31°33′N,109°56′~110°11′E,图 1)地处湖北省神农架林区的西部,隶属大九湖乡,处于中国地势第二级阶梯的东部边缘,由大巴山东延余脉组成高山盆地,在地质变迁中积水成湖,其与湖北省内十堰竹山及重庆的巫山县接壤。大九湖地形特点为四周高山环绕,中央为岩溶盆地。在岩溶和流水等多种因素的共同作用下,形成了华中地区乃至全球同纬度地区唯一的亚热带亚高山泥炭藓湿地。大九湖湿地面积约16 km2,盆底海拔为1700~1760 m,属典型的亚高山沼泽型湿地气候,主要湿地类型包括泥炭藓沼泽、亚高山草甸、苔草沼泽、睡菜沼泽、香蒲沼泽、紫茅沼泽及荷塘水渠沼泽等。自1980s起,大九湖人类活动频繁,直至2006年政府开始对其进行生态保护。

|
图 1 神农架林区地形图(a)以及大九湖湿地泥炭藓藓丘(b)、水洼(c)和沟渠(d)3种生境类型 Fig.1 The topography of the Shennongjia Forestry District (a) and different habitats of Sphagnum moss hummock (b), pond (c) and ditch (d) in the Dajiuhu Wetland |
本研究于2020年9月和2021年7月沿水位梯度分别设置采样点24和21个,样点覆盖泥炭地、沟渠、水洼(多为季节性水域)、湖泊等不同类型生境。样品采集过程中,首先使用GPS记录各采集点的经纬度位置及海拔高度,使用米尺测量水位埋深(depth to water table, DWT;采样点位于水面以上记为正,水面以下记为负),利用美国HACH公司生产的哈希HQ40D水质分析仪测定泥炭浸出水氧化还原电位(ORP)、电导率(Conductivity)、pH值及溶解氧(DO)。现场采集各样点的水体样品用于实验室其他水质参数的分析。针对干旱的泥炭地样点,手动采集表层泥炭样品;而对于水位较深的水体,利用改良的1/16 m2彼得森抓泥器抓取水体底泥,并刮取最上部(0~1 cm)表层沉积物置于密封袋密封保存后带回实验室冷藏于4℃冰箱中,用于后续摇蚊亚化石等的指标分析。
2 实验室分析及数据处理 2.1 水质指标及底泥烧失量测定于实验室内测定水体中主要离子浓度(K、Ca、Mg、Na)、各形态氮及形态磷浓度。其中K、Ca、Mg、Na离子浓度采用美国Leeman Labs公司产的Prodigy Spec型电感耦合等离子体原子发射光谱仪(IPC-AES)进行测定,使用荷兰Skalar公司产的连续流动分析仪(Skalar San Plus)测定各形态氮和形态磷浓度,于中国科学院南京地理与湖泊研究所完成测定。沉积物中总有机碳(TOC)和总氮(TN)含量测试则于中国科学院武汉植物园利用德国Elementary公司的Vario EL cube型元素分析仪参考标准样完成(误差小于等于0.1%)。底泥烧失量(LOI)的测定依据参考文献[12]进行,即:称取2 g湿样于105℃下烘12 h后将样品置于550℃的马弗炉中灼烧5 h。
2.2 沉积物摇蚊头壳亚化石提取表层沉积物摇蚊亚化石的提取按照文献[13]的标准方法进行。鉴定一般至属级水平,保存较好的头壳则鉴定到种,完整的或者多于半个颏的头壳记为一个,半个颏的记为半个,不足半个的则忽略不计。每个样品至少挑拣摇蚊壳体40头[14],否则不参与后续分析。摇蚊的属种鉴定依据文献[13, 15-17]进行。
2.3 数据处理本研究中,利用Shannon-Wiener指数进行摇蚊群落多样性评估,利用软件past 2.03完成其计算过程。由于数据为非正态分布,采用克鲁斯卡尔-沃利斯检验(Kruskal-Wallis test)评估不同生境中主要环境因子、摇蚊属种和摇蚊群落结构特征(丰度及多样性)的差异显著性,采用Dunn's成对检验识别存在显著差异的生境类型[18],该检验在SPSS 27中实现。
排序分析中,选择在2个及以上样品中出现且至少在1个样品中含量不低于2%的摇蚊属种参与分析,以减少稀有属种对分析过程的影响。所有参与分析的摇蚊数据进行平方根(square-root)转换,以减少属种的自相关效应并降低稀有属种所占权重。为减小环境参数量纲的影响,对除pH以外的所有环境数据进行(X-Xmin)/(Xmax-Xmin)标准化。降维对应分析(detrended correspondence analysis, DCA)可用于判识摇蚊群落数据变化的梯度长度,以判定摇蚊群落对环境变量的响应模式。本研究中,DCA显示摇蚊数据梯度长度为3.6,介于2~4个标准单位之间,表明单峰或线性模式均可用于阐明摇蚊群落对环境变量的响应过程。本文选用典范对应分析(canonical correspondence analysis, CCA)揭示摇蚊与环境变量间的关系。分析过程中以摇蚊数据作为响应变量,环境因子(DWT、ORP、电导率、DO、pH、LOI、TOC、TN、离子浓度、形态氮和形态磷等)作为解释变量,通过非限制性蒙特卡洛置换检验每个变量的显著性,剔除共线性参数(VIF≥20)并选取最显著的有效环境参数。为了进一步检验筛选的显著环境要素对响应变量的解释能力,本文对显著环境因子进行了偏典范对应分析(partial CCA)和方差分解(variation partitioning analysis, VPA)分析。所有排序分析在软件CANOCO 5.0中完成。
3 结果根据每个表层沉积物样品至少提取40个摇蚊头壳的最低要求,本研究中采集的45个样品中共32个满足该要求,因此本文仅对32个样品进行结果分析。
3.1 采样点基本特征32个采样点按生境类型进行编码,各样点基本信息如表 1所示。样点周围多挺水植物,菖蒲、苔草、灯芯草等为主要植被类型。
| 表 1 大九湖湿地采样点基本环境信息 Tab. 1 Basic environmental information of sampling sites in the Dajiuhu Wetland |
所有样点中,1~9号为泥炭藓藓丘,DWT在0~11 cm之间;10~22号为泥炭地洼地、沟渠及蓄水洼地生境,生境存在季节性或间歇性干旱,采样点均位于水面以下(即DWT<0 cm);23~32号为湖泊,DWT在-147~-22 cm间波动。在泥炭藓藓丘生境(1~9号样点)中,pH值及水体溶解氧浓度(DO)为几类生境中最低(前者变化范围为4.9~7.5,后者变化范围为0.6~7.1 mg/L),相反,LOI、TOC含量则为几类生境中最高(前者变化范围为29.7%~88.7%,后者变化范围为146.2~390.7 g/kg),TN含量及C/N值也相对较高(前者变化范围为11.7~24.2 g/kg,后者变化范围为14.6~29.5)。泥炭地洼地生境(10~13号样点)中,pH在5.4~6.7之间变化,DO浓度较泥炭藓藓丘生境高(3.3~8.1 mg/L),LOI、TOC、TN含量及C/N值在几类生境中处于较高值(变化范围分别为8.7%~78%、63~381.4 g/kg、3.9~26.3 g/kg及13.9~19.6),其中LOI、TOC及TN样点间波动过大,位于该生境的12号样点的LOI、TOC、TN含量都极低。沟渠生境(14~18号样点)中,pH在6.3~7.6之间波动,DO变化范围为3.6~7.3 mg/L,而LOI、TOC、TN和C/N明显低于泥炭藓生境(变化范围分别为9.1%~37.4%、30.5~190.6 g/kg、3.3~14.4 g/kg及10.7~20.2)。水洼生境(19~22号样点)中,pH和DO浓度上升(前者变化范围为6.7~7.2,后者变化范围为4.6~9.4 mg/L),LOI、TOC、TN及C/N值则持续下降(变化范围分别为8.4%~21.7%、27.1~103.4 g/kg、3.1~7.8 g/kg及10.3~15.5)。湖泊生境(23~32号样点)中,pH和DO浓度为几类生境最高值(前者变化范围为6.6~9.0,后者变化范围为6.1~11.7 mg/L),而LOI、TOC、TN及C/N值达到了几类生境中的最低值,其变化范围分别为4.6%~30.6%、12.1~143.1 g/kg、1.3~8.3 g/kg及9.3~20。整体而言,相对干旱的泥炭地(藓丘/洼地)生境的pH和DO浓度较低,LOI、TOC、TN及C/N较高;而较湿润的临时性水体生境(沟渠、水洼)和淹水生境(湖泊)的pH与DO浓度较高,LOI、TOC、TN及C/N则较低。根据K-W检验结果,不同生境中的pH、DO、LOI、TOC、TN及C/N均存在显著差异(P<0.01,图 2)。
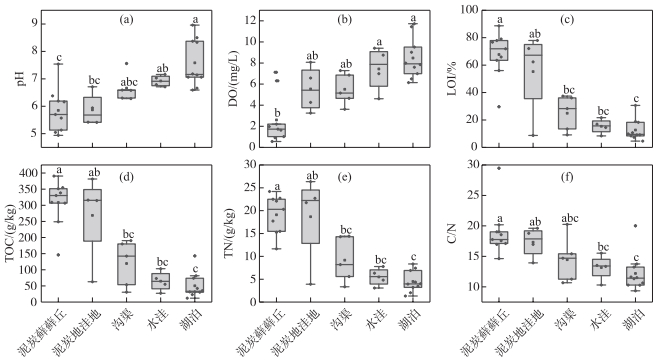
|
图 2 大九湖不同生境中主要环境因子箱型图(不同小写字母表示差异显著,P<0.05,下同) Fig.2 Boxplots of major environmental factors in different habitats of the Dajiuhu Wetland |
32个表层沉积物样品中共挑拣摇蚊头壳3142.5头,分属4亚科51属74种。所属亚科分别是长足摇蚊亚科(Tanypodinae)、寡角摇蚊亚科(Diamesinae)、直突摇蚊亚科(Orthocladiinae)和摇蚊亚科(Chironominae)。其中,摇蚊亚科在摇蚊种群中占绝对优势,共出现24属40种,其壳体总数占摇蚊头壳总数的58.4%;直突摇蚊亚科总计20属26种,占所有摇蚊的38.6%;长足摇蚊亚科6属7种,占摇蚊头壳总数的2.3%;寡角摇蚊亚科仅出现1属种,其仅占摇蚊头壳总数的0.1%。所有样品中,摇蚊种群主要优势种包括Limnophyes (平均相对丰度为13.0%)、Polypedilum nubeculosum-type(11.3%)、Psilometriocnemus(9.8%),其次为Chironomus flaviplumus-type(7.7%)、Neozavrelia(5.8%)、Pseudosmittia(4.7%)、Polypedilum sordens-type(4.5%)、Tribelos(3.6%)、Sergentia coracina-type(3.3%),共占所有摇蚊头壳的63.7%。
将摇蚊组成按样点生境类型划分(图 3):(1)浅水湖泊生境(23~32号样点),摇蚊以P. nubeculosum-type、C. flaviplumus-type、P. sordens-type、Glyptotendipes pallens-type等水生摇蚊为优势属种,平均相对丰度分别为17.9%、11.9%、9.4%、7.5%。Rheotanytarsus和S. coracina-type出现频率不高,但相对丰度可达3.6%和2.9%;(2)间歇性水洼生境(19~22号样点),摇蚊种群依旧以水生摇蚊为主,主要属种C. flaviplumus-type、P. nubeculosum-type和S. coracina-type的平均相对丰度分别为19.7%、9.3%和9.1%;该生境同时发育大量半陆生种Limnophyes,其相对丰度达26.7%;(3)沟渠生境(14~18号样点)中,半陆生摇蚊和水生摇蚊种共存,半陆生种如Limnophyes、Psilometriocnemus、Tribelos等丰富度较湖泊和水洼样点有所增加,相对丰度分别为13.2%、6.2%、3.0%;水生种如P. nubeculosum-type、C. flaviplumus-type、P. sordens-type丰度或频率有所降低,其相对丰度仅分别为6.1%、5.8%、3.2%;(4)泥炭地洼地仅4个样点(10~13号样点),摇蚊组成上差别较大,10号和13号样点中Psilometriocnemus和Tribelos丰度较高,而11号和12号样点则以P. nubeculosum-type为优势摇蚊种,其相对丰度高达12.9%;(5)最为干旱的泥炭藓藓丘样点(1~9号样点)中,水生摇蚊减少甚至消失,半陆生摇蚊丰富度及丰度明显增加,摇蚊种群以Psilometriocnemus、Limnophyes、Neozavrelia和Pseudosmittia为主要优势属种,平均相对丰度分别为24.6%、21.6%、17.7%、16.0%。Tribelos出现频率不高,但其平均丰度达到5.3%。
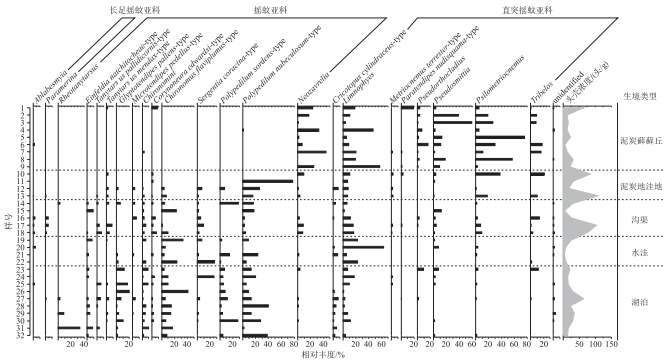
|
图 3 大九湖湿地不同生境表层沉积物主要摇蚊组成 Fig.3 Major chironomid taxa in surface sediments from different habitats in the Dajiuhu Wetland |
根据K-W检验结果,74种中共有20个种在不同生境间存在显著差异,如Chironomini sp.、C. flaviplumus-type、G. pallens-type、Neozavrelia、P. nubeculosum-type、Psilometriocnemus、Pseudosmittia等(图 4a~g)。所有样点摇蚊种群的Shannon-Wiener指数变化范围为0.8~3.3,且在不同生境间表现出显著差异性(P<0.05),泥炭藓藓丘生境中摇蚊多样性最低,而处于过渡区域的沟渠样点摇蚊种类最为丰富(图 4h)。样点间摇蚊头壳浓度差别较大,总体在4~109头/g间波动,但不同生境间差异并不显著(P=0.05,图 4i)。
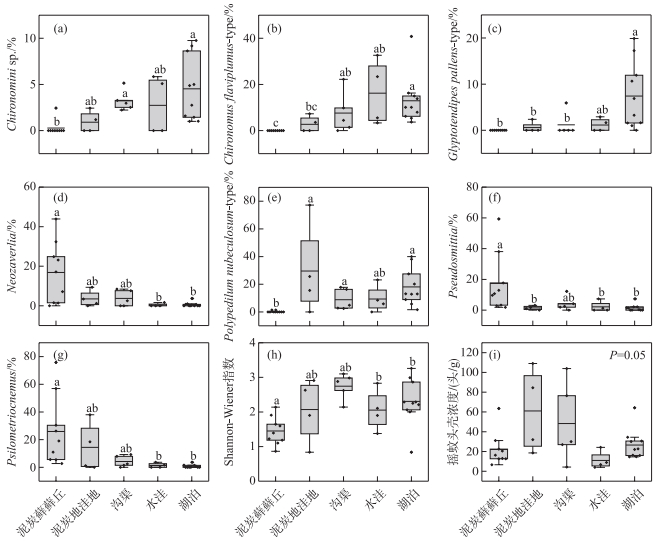
|
图 4 大九湖湿地5类生境优势摇蚊属种丰度(a~g)、Shannon-Wiener指数(h)及摇蚊头壳密度(i)箱型图 Fig.4 Boxplots of dominant chironomid species abundance (a-g), Shannon-Wiener index (h) and head capsule density (i) in five types of habitats from the Dajiuhu Wetland |
CCA结果表明,DWT、LOI及pH是影响摇蚊群落组成及分布的显著环境变量。3个环境因子共解释了26.3%的摇蚊变量,其中第1、2轴分别解释摇蚊变量的18.6%和4.7%。LOI和DWT与CCA第1轴呈高度正相关关系,而pH则与其呈负相关关系(图 5)。CCA摇蚊-环境双轴图(图 5a)中,Pseudosmittia、Pseudorthocladius、Tribelos、Neozavrelia、Psilometriocnemus等主要属种分布在LOI的正方向,与LOI存在密切的正相关关系;G. pallens-type、P. nubeculosum-type、P. nubifer-type、P. sordens-type、Tanypus等则位于排序轴左侧即pH的正方向,与pH关系密切;Limnophyes、Metriocnemus terrester-type等则与DWT表现出一定的正相关关系。样点-环境双轴图(图 5b)显示,泥炭藓藓丘及泥炭地洼地的样点主要分布在第1轴右侧,与LOI及DWT呈正相关关系,其余生境样点多位于第1轴左侧,沿pH梯度及第2轴变化明显。泥炭藓藓丘与湖泊样点分别位于CCA双轴图的左右两侧,而其他样点分布则存在较为明显的重叠。
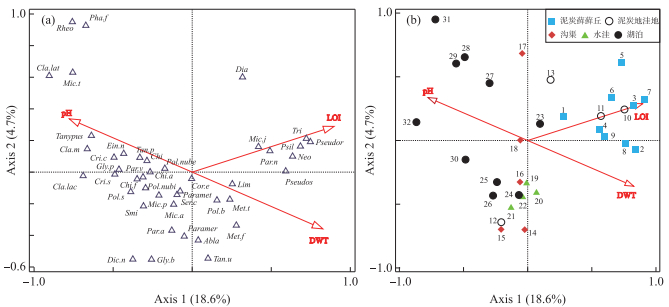
|
图 5 大九湖湿地32个表层沉积物样品典范对应分析(CCA)的摇蚊属种(a)和样点(b)与环境变量双轴图 (摇蚊属种名称缩写如下:Abla=Ablabesmyia, Tri=Tribelos, Tan.p=Tanytarsus pallidicornis-type, Tan.u=Tanytarsini unidentified-type, Psil=Psilometriocnemus,Pseudos=Pseudosmittia, Neo=Neozavrelia, Pseudor=Pseudorthocladius, Lim=Limnophyes, Ser.c=Sergentia coracina-type, Smi=Smittia, Pol.s=Polypedilum sordens-type, Pol.nubi=Polypedilum nubifer-type, Pol.nube=Polypedilum nubeculosum-type, Pol.b=Polypedilum bergi-type, Pha.f=Phaenopsectra flavipes-type, Par.v=Parachironomus varus-type, Paramet=Parametriocnemus, Paramer=Paramerina, Par.a=Paratendipes albimanus-type, Par.n=Paratendipes nudisquama-type, Dic.n=Dicrotendipes nervosus-type, Dia=Diamesa, Chi.f=Chironomus flaviplumus-type, Cla.lat=Cladopelma lateralis-type, Cla.m=Cladotanytarsus mancus-type, Cla.lac=Cladopelma laccophila-type, Cri.c=Cricotopus cylindraceus-type, Cri.s=Cricotopus sylvestris-type, Chi=Chironomini, Chi.a=Chironomus anthracinus-type, Chi.f=Chironomus flaviplumus-type, Cor.e=Corynoneura edwardsi-type, Gly.p=Glyptotendipes pallens-type, Gly.b=Glyptotendipes barbipes-type,Rheo=Rheotanytarsus,Mic.t=Microchironomus tener-type, Mic.a=Micropsectra atrofasciata-type, Mic.p=Microtendipes pedellus-type, Mic.j=Micropsectra junci-type, Met.t=Metriocnemus terrester-type, Met.f=Metriocnemus fuscipes-type) Fig.5 Biplots of canonical correspondence analysis (CCA) between chironomid taxa (a) or samples (b) and significant environmental factors in 32 surface sediment samples from the Dajiuhu Wetland |
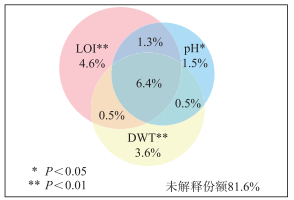
偏CCA分析结果表明,LOI的边际效应最大,pH的边际效应最小,3个变量的显著性均小于0.05(表 2)。其方差分解分析显示,3个环境因子共解释了18.4%的摇蚊变量,其中LOI的独立解释份额最高(4.6%)。然而,相比环境因子的独立作用,环境因子间的交叉作用占比更高,LOI、DWT和pH三者共同作用的解释份额为6.4%(图 6)。
| 表 2 CCA筛选的显著环境因子的变异膨胀系数和边际效应 Tab. 2 Variation inflation coefficients and marginal effects of significant environmental factors selected by canonical correspondence analysis |
|
图 6 显著环境因子的独立及交互作用 Fig.6 The unique and shared effects of significant environmental factors |
32个样点摇蚊组成分析表明,大九湖湿地不同生境条件下摇蚊群落组成差异非常明显,存在亚热带亚高山泥炭沼泽特有属种,LOI、DWT与pH是塑造摇蚊群落的关键环境因子,生境条件差异显著影响摇蚊群落组成和结构。
4.1 不同生境中的摇蚊群落组成目前在国际上对于沼泽湿地摇蚊群落的调查大多基于摇蚊成虫。在加拿大,相关研究多倾向于森林、草本泥炭沼泽等湿地中的蓄水洼地和开放水域(如湖泊等),获得的摇蚊群落组成与湖泊沿岸带等水生生境较为相似,即摇蚊亚科(Chironominae)在所有亚科中所占比例最高,如Chironomus、Endochironomus、Glyptotendipes、Polypedilum等最为常见。为数不多的关于沼泽湿地的研究中,直突摇蚊亚科(Orthocladiinae)和长足摇蚊亚科(Tanypodinae)丰度较摇蚊亚科(Chironominae)高,但年际变化较大[19-20]。芬兰地区沼泽湿地摇蚊群落以Orthocladiinae最为丰富,在含水量大于75%的泥炭生境中,半陆生种Limnophyes、Metriocnemus、Pseudorthocladius、Psedosmiitia等构成摇蚊群落的重要组成部分[21]。
在本研究中,大九湖湿地典型旱生(泥炭藓丘和/或洼地)和水生生境(湖泊)间摇蚊群落组成存在显著差异。在水生生境中,摇蚊主要由湖沼种组成,与长江中下游地区浅水湖泊摇蚊群落高度相似;在旱生生境中,摇蚊则主要由典型的陆生-半陆生种组成,其优势属种与芬兰地区泥炭地及鄂西地区七姊妹山、二仙岩泥炭地摇蚊较为相似,Limnophyes、Pseudorthocladius、Pseudosmiitia均为其常见属种[21-22];而在过渡型生境如沟渠、蓄水洼地中则水生属种与半陆生属种共存,水生属种以Polypedilum和Chironomus为主,而半陆生种以Limnophyes居多,这与其他地区泥炭沼泽淹水生境(蓄水洼地、湖泊等开放水域)研究结果较为一致[23]。
水体沼泽化过程中,生态系统由水生生境逐渐转变为半陆生生境,其中也包含水生-半陆生过渡型生境,即水-陆交替演化阶段。根据本研究,可以推测泥炭地发育过程中,摇蚊群落也经历了水生-水陆共存-半陆生优势种群的交替演化过程。这一推测在其他地区相关研究中也得到了验证。如波兰的abieniec泥炭钻孔摇蚊序列显示,由湖泊相转变为泥炭沼泽相沉积过程中摇蚊群落优势种由S. coracina-type、Cladotanytarsus mancus-type2、Stictochironomus rosenschoeldi-type等水生属种逐渐过渡为以Limnophyes、Pseudorthocladius和Pseudosmittia等半陆生属种为主[9]。尽管不同生境间摇蚊头壳浓度并未表现出显著差异,但相对湿润且有机质含量丰富的泥炭地洼地和沟渠中摇蚊生物量是最为丰富的。沟渠生境同样供给了非常丰富的摇蚊类型,这一结果很好地验证了边缘效应学说,即生态过渡带具有更高的生物量和物种丰富度。较干旱生境中的优势属种Psilometriocnemus(P<0.01)、Neozavrelia(P<0.05)、Pseudosmittia(P<0.01)与水生优势属种P. nubeculosum-type(P<0.01)均在不同生境中存在显著差异。
值得关注的是,本研究中泥炭生境优势种Psilometriocnemus和Neozavrelia在同一区域的七姊妹山和二仙岩表层泥炭中也曾被大量发现[22],但在其他地区泥炭地及长江中下游地区湖泊摇蚊群落调查中却鲜少被记录。基于Rosenberg提出的关于泥炭地特有种标准[24],本研究认为Psilometriocnemus和Neozavrelia可能是亚热带亚高山泥炭藓泥炭地特有摇蚊种,在未来泥炭地发育过程重建中可能具有良好的生物指示意义。
4.2 关键环境因子对摇蚊群落的独立及交叉作用CCA结果显示LOI是影响大九湖湿地复杂生境中摇蚊群落结构最为显著的环境变量,说明有机质含量或底质类型是控制摇蚊群落最为关键的要素之一。这一观点在全球其他地区如北美[25]、欧洲[26-27]等的研究中也曾多次被证实。有机质可以为底栖动物提供重要的食物来源和庇护场所,因此生境有机质含量对底栖动物生物量和群落组成至关重要。有研究表明,有机质去除将导致河流等淡水生态系统中摇蚊丰度显著下降,属种组成发生显著改变[10]。然而,较高的有机质含量会伴随生境pH降低、光透度下降、水体溶解氧浓度降低[27-28],对底栖动物类群的生长也有一定的抑制作用。另一方面,有机质类型也是底栖生物发育过程中的重要影响因素。有机质浓度较低的水体中,自生藻类是湖泊有机物质的重要组分;而高有机质湖泊(如DOC>4 mg/L)中,外源陆生有机质则成为系统内部最为重要的碳源[27]。陆源有机质(如高等植物碎屑)通常含有丰富的饱和脂肪酸,摇蚊等底栖生物细胞合成过程中所需的不饱和脂肪酸却相对匮乏[29]。与之相反,藻类是水体中EFAs(生物必需脂肪酸)的重要合成者。因此,对底栖动物而言,陆源有机质属于低质量碳源,而藻类等内源碳源一定程度上决定了底栖动物生物量和群落组成[29-30]。大九湖湿地中,泥炭藓样点有机质含量较其他生境样点高(沉积物TOC、TN、LOI及水体DOC均较高),但C/N值(变化范围为14.6~29.5,均值为19)表明其陆源有机碎屑在所有有机质中占比较高。营养并不充分的“低质量”食物可以短期内作为底栖动物的补充性食物,但无法成为优质食物的真正替代品[31-32],许多底栖动物最终无法适应,这可能是导致泥炭生境中摇蚊丰富度较低的一个原因。相反,较低的C/N值(湖泊样点变化范围为9.3~20.0,均值为12.2)表明内源有机质是湖泊最重要的碳源,藻类可为多种底栖动物提供其所必需的脂肪酸等营养成分,满足不同类型底栖动物的生长需求。此外,有学者曾对不同摇蚊胃内容物进行分析,指出Tribelos和Pseudosmittia幼虫所取食的藻类远少于静水属种Polypedilum,而其胃部植物碎屑含量则远超Polypedilum[33]。这说明,半陆生属种Tribelos和Pseudosmittia等幼虫可能对食物质量要求不高,泥炭生境中“低质量”食物可以满足其发育需求,竞争所导致的生态位分化已使得它们对陆生-半陆生泥炭生境表现出了良好的适应性。泥炭地洼地生境中仅4个样点,并且样点水位跨度较大,其中10号和13号样点由于高LOI和高C/N使得Tribelos和Psilometriocnemus含量增加,11号样点虽然LOI含量高,但是该样点的C/N含量低,12号样点中的LOI、TOC、TN均极低,而两样点的优势属种为P. nubeculosum-type,说明有机质的来源及含量都对摇蚊群落具有影响。
尽管显著性和解释份额都低于LOI,DWT所表征的水文条件却被视为水生态系统(尤其泥炭沼泽)生物地球化学循环和系统发育的关键环境要素之一。国内外很多学者都曾深入探讨不同类型水生系统(如溪流、河流、湖泊等)中水文条件对底栖类群所产生的直接和间接影响[34-36]。泥炭沼泽水位变化对底栖类群也具有重要的塑造作用[37],泥炭地洪水脉冲可以对某些摇蚊幼虫的羽化过程产生明显的抑制作用,水生摇蚊属种迅速占领淹水生境生态位,取代耐旱属种的优势地位,从而显著改变摇蚊群落组成和生物量。沉积物钻孔序列也曾记录了类似的变化过程,如Płóciennik等追踪了波兰abieniec泥炭地距今18 ka以来的摇蚊种群演化过程,清晰描述了开放水体萎缩过程中水生摇蚊被半陆生摇蚊取代、摇蚊丰度和丰富度下降的变化过程[9]。即使在较短的时间尺度上,摇蚊对泥炭地表湿度变化的响应也与其他代用指标保持高度一致[11]。本研究中,不同生境摇蚊占据水位梯度上不同的生态位空间,如静水摇蚊(如Polypedilum、Glyptotendipes和Chironomus)选择淹水生境,而陆生-半陆生摇蚊(如Psilometriocnemus、Pseudosmittia、Neozavrelia、Pseudorthocladius和Tribelos)则栖息于干旱的泥炭地,表明摇蚊能对不同生境间水位波动做出良好响应。
事实上,不同环境因子间也是相互关联、相互作用的。相关分析表明大九湖湿地多数环境要素间存在显著的正相关或负相关关系(图 5,表 2),其交互作用也将对栖息地生物群落产生重要影响。VPA结果也表明,显著环境因子对摇蚊变量的共同解释份额高于它们的单独解释份额。湿地水文条件决定其植被群落结构(如植被类型、组成和生物量等)动态及残体分解过程,进而影响有机质累积和泥炭形成。因此,大九湖湿地不同生境有机质含量差异归根结底是水位埋深作用的结果。由于有机质可以直接为底栖类群提供碳源和庇护场所,其对摇蚊群落的作用也比水文条件更为直接,尤其在有机质梯度较大的生境,有机质含量及来源对底栖类群的塑造作用也较水位埋深更为明显。水文条件和有机质含量还可以通过改变其他环境参数进而塑造生物群落。泥炭藓生长过程中可借助糖醛酸羧基吸收K+、Ca2+和Mg2+等阳离子,交换出H+使周围环境逐渐酸化[38],同时其残体分解过程中不断释放腐殖酸促进土壤水pH值下降[39]。pH可直接影响摇蚊幼虫新陈代谢过程,导致某些类型(如Tanytarsus)幼虫无法完成羽化过程[40]。低pH还可能导致水生生物对环境中Ca和Na等元素的同化能力下降,生长过程受到显著抑制[41]。本研究中,泥炭藓藓丘或洼地pH较其他样点低,也可能是这两类生境中摇蚊多样性偏低的原因之一。
5 结论大九湖湿地不同生境供给了优势种迥异的摇蚊群落。在湖泊生境中摇蚊群落以典型静水种P. nubeculosum-type为优势种,多静水属种共存;泥炭地洼地、沟渠及间歇性洼地属过渡性水体,静水种与半陆生种共存,摇蚊的多样性及丰富度较高,尤其沟渠生境中边缘效应最为明显;Psilometriocnemus和Neozavrelia可视为亚热带亚高山泥炭沼泽的特有摇蚊种类,与Pseudosmittia等共同组成干旱的泥炭藓藓丘生境中的优势属种。LOI、DWT及pH是塑造摇蚊群落结构的显著环境变量,其因子间相互作用较各因子对摇蚊群落的单独影响更为明显。本研究结果表明,沿水生-半陆生生境梯度,摇蚊群落经历了静水种-静水/半陆生种共存-半陆生种的过渡,摇蚊对生境类型变化具有良好的响应,未来摇蚊或可作为较长时间尺度泥炭地发育演化过程的重要代用指标。
| [1] |
Loisel J, Gallego-Sala AV, Amesbury MJ et al. Expert assessment of future vulnerability of the global peatland carbon sink. Nature Climate Change, 2021, 11(1): 70-77. DOI:10.1038/s41558-020-00944-0 |
| [2] |
Rotherham ID. Peatlands: Ecology, conservation and heritage. New York: Routledge, 2020.
|
| [3] |
Rühland K, Smol JP, Paul Jasinski JP et al. Response of diatoms and other siliceous indicators to the developmental history of a peatland in the tiksi forest, Siberia, Russia. Arctic, Antarctic, and Alpine Research, 2000, 32(2): 167-178. DOI:10.1080/15230430.2000.12003352 |
| [4] |
Rydin H, Jeglum JK. The Biology of Peatlands, 2nd ed. New York: Oxford University Press, 2013.
|
| [5] |
Mieczan T, Michał N, Adamczuk M et al. Stable isotope analyses revealed high seasonal dynamics in the food web structure of a peatbog. International Review of Hydrobiology, 2015, 100(5/6): 141-150. DOI:10.1002/iroh.201501788 |
| [6] |
Mieczan T, Niedz'wiecki M, Tarkowska-Kukuryk M. Effects of rotifers, copepods and chironomid larvae on microbial communities in peatlands. European Journal of Protistology, 2015, 51(5): 386-400. DOI:10.1016/j.ejop.2015.06.010 |
| [7] |
Płóciennik M, Skonieczka M, Antczak O et al. Phenology of non-biting midges (Diptera Chironomidae) in peatland ponds, central Poland. Entomologica Fennica, 2018, 29(2): 61-74. DOI:10.33338/ef.71014 |
| [8] |
Seniczak A, Seniczak S, Iturrondobeitia JC et al. Mites (Oribatida and Mesostigmata) and vegetation as complementary bioindicators in peatlands. Science of the Total Environment, 2022, 851(Pt 2): 158335. DOI:10.1016/j.scitotenv.2022.158335 |
| [9] |
Póciennik M, Self A, Birks HJB et al. Chironomidae (Insecta: Diptera) succession in Zabieniec bog and its palaeo-lake (central Poland) through the Late Weichselian and Holocene. Palaeogeography, Palaeoclimatology, Palaeoecology, 2011, 307(1/2/3/4): 150-167. DOI:10.1016/j.palaeo.2011.05.010 |
| [10] |
Entrekin SA, Wallace JB, Eggert SL. The response of Chironomidae (Diptera) to a long-term exclusion of terrestrial organic matter. Hydrobiologia, 2007, 575(1): 401-413. DOI:10.1007/s10750-006-0386-7 |
| [11] |
Hou GL, Cao YM, Tian WL et al. Response of chironomid assemblages to the changes of wetness in Dajiuhu Peatland of Hubei Province during the past 400 years. J Lake Sci, 2022, 34(3): 1030-1043. [侯桂林, 曹艳敏, 田文龙等. 近400年来湖北大九湖泥炭地摇蚊对湿度变化的响应. 湖泊科学, 2022, 34(3): 1030-1043. DOI:10.18307/2022.0326] |
| [12] |
Heiri O, Lotter AF, Lemcke G. Loss on ignition as a method for estimating organic and carbonate content in sediments: Reproducibility and comparability of results. Journal of Paleolimnology, 2001, 25(1): 101-110. DOI:10.1023/A:1008119611481 |
| [13] |
Brooks SJ, Langdon PG, Heiri O et al. The identification and use of Palaearctic Chironomidae larvae in palaeoecology. London: Quaternary Research Association, 2007.
|
| [14] |
Quinlan R, Smol JP. Setting minimum head capsule abundance and taxa deletion criteria in chironomid-based inference models. Journal of Paleolimnology, 2001, 26(3): 327-342. DOI:10.1023/A:1017546821591 |
| [15] |
Rieradevall M, Brooks SJ. An identification guide to subfossil Tanypodinae larvae (Insecta: Diptera: Chironomidae) based on cephalic setation. Journal of Paleolimnology, 2001, 25(1): 81-99. DOI:10.1023/A:1008185517959 |
| [16] |
Epler JH. Identification manual for the larval Chironomidae (Diptera) of North and South Carolina. America: North Carolina Department of Environment and Natural Resources Division of Water Quality, 2001.
|
| [17] |
唐红渠. 中国摇蚊科幼虫生物系统学研究(双翅目: 摇蚊科)[学位论文]. 天津: 南开大学, 2006.
|
| [18] |
Dunn OJ. Multiple comparisons using rank sums. Technometrics, 1964, 6(3): 241-252. DOI:10.1080/00401706.1964.10490181 |
| [19] |
Lammers R. Ecology of the tanypodinae in a Minnesota wetland. SIL Proceedings, 1922-2010, 1975, 19(4): 3142-3148. DOI:10.1080/03680770.1974.11896424 |
| [20] |
Lammers R. Plant and insect communities in a Minnesota wetland[Dissertation]. Minneapolis: University of Minnesota, 1976.
|
| [21] |
Dowling C, Murray AD. The distribution of the Chironomidae (Diptera) in two Irish blanket bogs. Proc R Ir Acad, 1981, 81(81B): 53-61. |
| [22] |
Cao YM, Peter G, Yan Y et al. Chironomid communities from subalpine peatlands in subtropical China as indicators of environmental change. Journal of Paleolimnology, 2019, 62(2): 165-179. DOI:10.1007/s10933-019-00081-5 |
| [23] |
Larson DJ. Aquatic Coleoptera of peatlands and marshes in Canada. Memoirs of the Entomological Society of Canada, 1987, 119(S140): 99-132. DOI:10.4039/entm119140099-1 |
| [24] |
Rosenberg DM, Wiens AP, Bilyj B. Chironomidae (Diptera) of peatlands in northwestern Ontario, Canada. Ecography, 1988, 11(1): 19-31. DOI:10.1111/j.1600-0587.1988.tb00777.x |
| [25] |
Larocque I, Pienitz R, Rolland N. Factors influencing the distribution of chironomids in lakes distributed along a latitudinal gradient in northwestern Quebec, Canada. Canadian Journal of Fisheries and Aquatic Sciences, 2006, 63(6): 1286-1297. DOI:10.1139/f06-020 |
| [26] |
Nyman M, Korhola A, Brooks SJ. The distribution and diversity of Chironomidae (Insecta: Diptera) in western Finnish Lapland, with special emphasis on shallow lakes. Global Ecology and Biogeography, 2005, 14: 137-153. DOI:10.1111/J.1466-822X.2005.00148.X |
| [27] |
Luoto TP, Rantala MV, Galkin A et al. Environmental determinants of chironomid communities in remote northern lakes across the treeline-Implications for climate change assessments. Ecological Indicators, 2016, 61: 991-999. DOI:10.1016/j.ecolind.2015.10.057 |
| [28] |
Premke K, Karlsson J, Steger K et al. Stable isotope analysis of benthic fauna and their food sources in boreal lakes. Journal of the North American Benthological Society, 2010, 29(4): 1339-1348. DOI:10.1899/10-002.1 |
| [29] |
Vesterinen J, Strandberg U, Sami JT et al. Periphyton as a key diet source of essential fatty acids for macroinvertebrates across a nutrient and dissolved organic carbon gradient in boreal lakes. Limnology and Oceanography, 2022, 67(7): 1604-1616. DOI:10.1002/lno.12156 |
| [30] |
Kesti P, Hiltunen M, Strandberg U et al. Lake browning impacts community structure and essential fatty acid content of littoral invertebrates in boreal lakes. Hydrobiologia, 2022, 849(4): 967-984. DOI:10.1007/s10750-021-04760-1 |
| [31] |
Kelly PT, Solomon CT, Weidel BC et al. Terrestrial carbon is a resource, but not a subsidy, for lake zooplankton. Ecology, 2014, 95(5): 1236-1242. DOI:10.1890/13-1586.1 |
| [32] |
Belle S, Luoto TP, Kivilä HE et al. Chironomid paleo diet as an indicator of past carbon cycle in boreal lakes: Lake Kylmänlampi (Kainuu Province; Eastern Finland) as a case study. Hydrobiologia, 2017, 785(1): 149-158. DOI:10.1007/s10750-016-2914-4 |
| [33] |
Henriques-Oliveira AL, Nessimian JL, Dorvillé LFM. Feeding habits of Chironomid larvae (Insecta: Diptera) from a stream in the Floresta da Tijuca, Rio de Janeiro, Brazil. Brazilian Journal of Biology, 2003, 63(2): 269-281. DOI:10.1590/s1519-69842003000200012 |
| [34] |
Engels S, Cwynar LC. Changes in fossil chironomid remains along a depth gradient: Evidence for common faunal thresholds within lakes. Hydrobiologia, 2011, 665(1): 15-38. DOI:10.1007/s10750-011-0601-z |
| [35] |
Wang BQ, Liu XQ, Peng ZH et al. The community structure of zoobenthos in the Three Gorges Reservior: A comparison before and after the impoundment. Acta Hydrobiologica Sinica, 2015, 39(5): 965-972. [王宝强, 刘学勤, 彭增辉等. 三峡水库底栖动物群落结构特征及其与蓄水前资料的比较. 水生生物学报, 2015, 39(5): 965-972. DOI:10.7541/2015.126] |
| [36] |
de Melo DB, Dolbeth M, Paiva FF et al. Extreme drought scenario shapes different patterns of Chironomid coexistence in reservoirs in a semi-arid region. Science of the Total Environment, 2022, 821: 153053. DOI:10.1016/j.scitotenv.2022.153053 |
| [37] |
Rosenberg DM, Wiens AP, Bilyj B et al. Peatland Chironomidae (Diptera): Effects of flooding on emergence from Lake 979, Experimental Lakes Area, Ontario. Journal of the North American Benthological Society, 2001, 20(3): 448-467. DOI:10.2307/1468041 |
| [38] |
Clymo RS. The ecology of Peatlands. Sci Prog Oxf, 1987, 71(284): 593-614. |
| [39] |
Zhu RL. Peat mosses (Sphagnum): Ecologically, economically, and scientifically important group of carbon sequestration plants. Chinese Bulletin of Botany, 2022, 57(5): 559-578. [朱瑞良. 泥炭藓: 一类具有重要生态、经济和科学价值的碳封存植物. 植物学报, 2022, 57(5): 559-578.] |
| [40] |
Henrikson L, Olofsson JB, Oscarson HG. The impact of acidification on Chironomidae (Diptera) as indicated by subfossil stratification. Hydrobiologia, 1982, 86(3): 223-229. DOI:10.1007/BF00006140 |
| [41] |
Havas M. Physiological response of aquatic animals to low pH. In: Singer R ed. Effects of acidic precipitation on benthos. Washington: U.S. Environmental Protection Agency, 1981: 49-65.
|
 2024, Vol. 36
2024, Vol. 36 


