(2: 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072)
(2: State Key Laboratory of Fresh Water Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, P.R. China)
着生藻类是指附着在水下各种基质上的藻类群落[1],广泛存在于河流、湖泊、水库等环境中[2]。着生藻类根据附着微生境的不同,其群落结构有较大差异[3-4]。在天然河流中,着生藻类的附着基质会受到季节性的洪水冲刷,造成泥沙等沉积物的悬浮运移,短时间内会使河道着生藻类发生剥离[5-6]。Jowett、Fovet、曹平等分别通过野外原位观测[7]、围隔实验[8]和室内模拟实验[9]等方式[10]来研究水动力方式对着生藻类的影响。结果表明,水流流速对着生藻类群落组成、优势类群以及藻类形态具有显著性影响[11-12]。水流流速增加能加快营养盐的输运[13],促进藻类细胞代谢以及对营养物的吸收[14],从而促进着生藻类生长;但流速过高时,着生藻类会在水流剪切力及悬浮颗粒的冲刷作用下不断被磨损剥离[15],或随附着的沉积物基质受到水流的侵蚀而直接脱落[5],进而降低着生藻类生物量,并改变其群落组成[9]。
目前研究多以天然河流、湖泊环境中的着生藻类为主[16-17],对于人工衬砌明渠调水工程中着生藻类的研究还较匮乏。有学者通过对明渠输水系统内着生藻类群落与环境因子的同步调查,确认了明渠着生藻类群落具有显著的时空异质性[18],水动力条件是影响明渠着生藻类群落时空格局的关键因素,明渠输水系统内不同水工构筑物会通过影响水流条件和水质理化因子对着生藻类群落发挥显著影响[19]。但上述研究的时空尺度较大,缺乏短时期内着生藻类对不同水动力条件响应的定量分析。而衬砌明渠混凝土基质与天然河流泥沙随水流输移的运动特性具有较大差异[8],水动力因子(例如流速、流量、水位和水体扰动)[13]对着生藻类生长、消散的影响也不尽相同[17, 20],因此探索明渠着生藻类对水动力响应特性对实现明渠着生藻类调控具有重要意义。
另一方面,输水明渠作为我国调水工程的主要输水方式,其安全和高效的运行受到广泛关注[21]。以南水北调中线工程为例,明渠大面积的混凝土衬砌以及充足的光照为着生藻类提供了良好的生长环境[19]。经过一定时间的运行后,明渠衬砌表面着生藻类会快速增殖,使明渠糙率增大[22],堵塞拦污栅等渠系建筑物,降低明渠输水能力,并造成水质恶化等问题[23-25]。为保证明渠输水安全高效运行,目前常见的除藻方法包括物理机械刮除、添加化学杀藻剂、投放食藻生物等。考虑到此类除藻措施在能耗、效率、水质二次污染以及推广难易程度等方面的局限性[26-27],现拟从水动力角度出发[28-29],通过水力调控方式增大水流对着生藻类边界层的剪应力,以实现着生藻类的冲刷剥离[30-31]。为此,本研究对附着在不同粗糙度的混凝土基质、不同生长阶段的着生藻类开展原位生长观测和水动力冲刷实验,探究基质粗糙度、生长阶段、冲刷流速、冲刷时长对着生藻类生物量变化以及群落结构的影响,为输水明渠及渠道化河流中着生藻类的生态调控提供理论依据。
1 材料与方法 1.1 实验系统实验地点为武汉大学农田水利与环境实验场,选择灌排渠系水量实时测控系统部分渠段开展实验。实验渠段流速自上游向下游逐渐增大,根据流速特点,选择P1、P2、P3、P4共4个不同流速点位开展着生藻类水动力实验。实验渠段布置如图 1所示。

|
图 1 实验场地图 Fig.1 Layout of test system |
实验时间为2022年3-9月,根据混凝土不同抹面工艺的施工规范要求,制作3种不同粗糙度的混凝土基质块,基质块长、宽均为11 cm,厚度2 cm。采用超景深三维显微操作系统(VHX-600ESO日本)对其表面粗糙度进行测量[32],表面粗糙度分别为粗糙(50 μm)、中粗(35 μm)、光滑(20 μm)。以粗糙组混凝土基质块在实验明渠低流速区(v≈0.2 m/s)进行着生藻类培养,连续9周每周对着生藻类进行采样,分析其生物量及着生藻类群落在混凝土基质上的变化。
根据明渠不冲不淤的流速要求,我国大部分灌区明渠设计流速为1 m/s左右,而在明渠正常运行状态下其流量往往低于设计流量,实际流速也远低于1 m/s[33]。故明渠流速经测验后,选定v=0.2、0.4、0.6、0.8 m/s多组流速区域,开展连续5天的水动力冲刷实验,对相同生长阶段(9周)的着生藻类进行不同流速、不同时长的冲刷实验(实验1),分析不同冲刷流速及冲刷时长下着生藻类的响应。
对不同生长阶段(分别为培养1、3、6、9周)的着生藻类在v=0.8 m/s流速区连续冲刷2天(实验2),分析高流速水力扰动对不同生长阶段着生藻类的影响。
对附着在3种不同粗糙度混凝土基质块上的着生藻类在v=0.8 m/s流速区连续冲刷2天(实验3),分析不同基质粗糙度对明渠着生藻类生长、冲刷剥离的影响。
1.3 样品采集与指标测定通过硬毛刷在混凝土基质块上刷取6块2.1 cm2的着生藻类,用纯水定容至90 mL,将其均分成3份,1份采用分光光度法测定藻类叶绿素a含量;1份通过用GF/C滤膜过滤得到着生藻类,在烘箱烘24 h测其干重,然后在马弗炉中450℃焚烧6 h,测量无灰干重(Ash-Free Dry Mass, AFDM);1份用鲁哥试剂固定,使用Olympus CX23显微镜对着生藻类进行种类鉴定[34-35]及细胞计数[36]。
现场测量水温(T)、pH、溶解氧(DO)等理化参数,总磷(TP)浓度测定方法为钼酸铵分光光度法,总氮(TN)浓度测定方法为过硫酸钾氧化分光光度法[37-38]。
1.4 数据处理及统计分析由于不同生长阶段藻类生物量差别较大,冲刷实验后的藻类生物保留量不能直观表现冲刷效果,故采用藻类生物量的冲刷变化量,即相对变化率来作为冲刷效果的评价指标[9]。
1) 相对变化率计算:
| δ=(x1−x0x0)×100% | (1) |
式中,δ是藻类生物量相对变化率,x1为冲刷实验后的藻类生物量(μg/cm2, g/cm2, ×104 cells/cm2),x0为冲刷实验前的藻类生物量(μg/cm2, g/cm2, ×104 cells/cm2)。
2) Shannon-Wiener指数(H′)、优势度指数(Y)计算公式分别为:
| H′=−S∑i=1Pilog2Pi | (2) |
| Pi=niN | (3) |
| Y=niNfi | (4) |
式中,N为同一样品中藻类个体总数;ni为第i种藻类个体数;Pi为第i种个体数占藻类总个体数的比例。其中H′值越大,群落多样性越高[39]。fi为第i种藻类在样品中的出现频率,Y>0.02定义为优势种[40]。
3) 实验数据使用SPSS 23软件进行单因素方差分析(One-way ANOVA)、单变量方差分析、显著性检验、多重比较分析,在R4.3.0环境下使用vegan包进行mantel相关分析,通过Origin 2017软件进行藻类生物量、藻类群落组成的绘制[41]。
2 结果 2.1 水体环境因子各点位的理化指标如表 1所示,实验明渠营养盐水平为中营养水平,总氮平均浓度为(1.42±0.34) mg/L,总磷平均浓度(0.11±0.05) mg/L,平均水温为(26.78±2.47)℃,水体呈弱碱性, pH平均值为8.41±0.16,水体平均DO浓度为(9.08±0.56) mg/L。不同点位之间除了流速具有显著性差异外,其他水体理化指标无显著性差异。
| 表 1 各点位水体理化指标检测结果* Tab. 1 Test results of physical and chemical indicators of water at each site |
在实验明渠内,对混凝土基质块上的着生藻类进行连续9周的采样观测,通过单变量方差分析及Mantel检验,不同生长阶段的着生藻类生物量及群落组成具有显著性差异(P < 0.05)。在观测周期内,着生藻类的生物量变化过程有3个明显时期,分别为迟滞期、指数生长期、稳定期。在培养初期(T生长≤5周),混凝土基质上着生藻类的叶绿素a含量、无灰干重和细胞密度、藻类生物量均处于较低水平,属于藻类生长迟滞期;当6周≤T生长≤8周时,藻类快速增殖,生物量快速增长,着生藻类群落发展进入指数生长期;T生长≈ 9周时,藻类生物量维持较高水平,群落组成相对稳定,通过Mantel相关分析,此阶段(T生长=8、9周时)着生藻类群落组成无显著性差异(R=0.1587, P=0.09),着生藻类群落发展至稳定期(图 2a~d)。
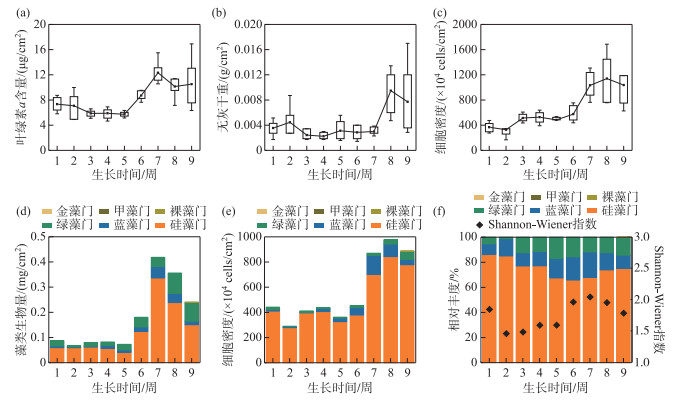
|
图 2 不同生长阶段藻类生物量、群落组成及其多样性 Fig.2 Algae biomass, community composition and diversity at different growth stages |
不同生长阶段着生藻类群落组成及细胞密度相对丰度如图 2e、2f,在T生长=1周时以硅藻为主(86.46%),群落的优势藻种为舟形藻、曲壳藻。而随着生长时间增长,硅藻占比逐渐下降,并在T生长=6周左右降至最低(65.88%),蓝藻(18.48%)、绿藻(18.48%)占比逐渐增大,到T生长=9周时,硅藻占比又有所升高(75.10%)。在建群过程中,Shannon-Wiener指数的变化趋势是先下降后上升,在建群迟滞期,不同藻类种群间相互竞争,确定优势藻种后,群落的多样性下降,进入指数生长期后,着生藻类快速增殖,群落多样性增大。
2.3 不同水动力条件下着生藻类的响应 2.3.1 着生藻类生物量对已充分生长的明渠着生藻类群落(T生长=9周)开展水动力冲刷实验,结果如图 3所示。单因素方差分析表明,不同流速之间着生藻类生物量存在差异显著(P < 0.05)。着生藻类生物量随流速增大呈现先增加后降低的趋势,从叶绿素a含量及藻类生物量结果来看(图 3a、3d),v=0.6 m/s组的着生藻类生物量最高,v=0.8 m/s组的着生藻类生物量最低。v=0.8 m/s组的无灰干重、细胞密度(图 3b、4c)显著低于其他流速组(P < 0.05)。流速v从0.2 m/s提升至0.6 m/s,可促进着生藻类生长,流速v=0.8 m/s对着生藻类有明显的冲刷剥离作用。
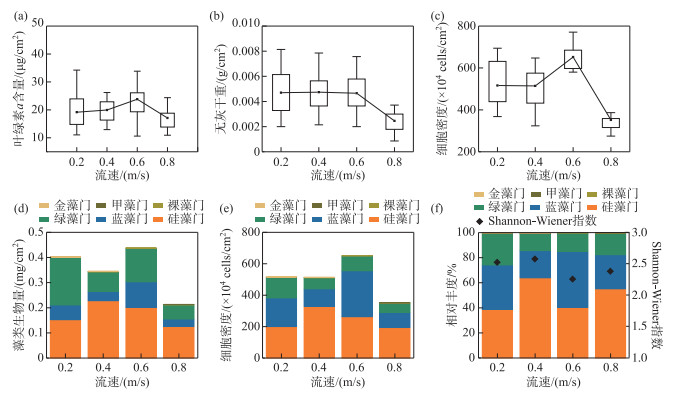
|
图 3 不同流速组藻类生物量、群落组成及其多样性 Fig.3 Algal biomass, community composition and diversity in different flow velocity groups |
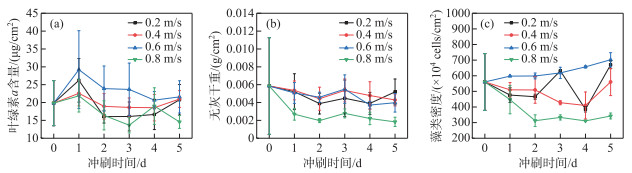
|
图 4 不同流速组藻类生物量随冲刷时长变化情况 Fig.4 Changes of algal biomass to erosion time in different flow velocity groups |
不同流速组着生藻类生物量随冲刷时长的响应情况如图 4所示,各流速组叶绿素a含量(图 4a)的变化情况为先波动上升后下降,而后随着冲刷时间的延长有逐渐上升,其中,v=0.6 m/s组的藻类叶绿素a含量始终维持较高水平。各流速组无灰干重(图 4b)变化趋势为先下降后有所回升,在冲刷2~4天内降低至最小,v=0.8 m/s组藻类无灰干重显著低于其他流速组(P < 0.05)。v=0.6 m/s组的藻类细胞密度(图 4c)最大,且随着时间不断增大,v=0.2、0.4 m/s组的藻类细胞密度变化规律为先下降后波动上升,而v=0.8 m/s组藻类细胞密度在冲刷第2天降至最低且一直维持较低水平。
2.3.2 着生藻类群落组成共检测出藻类6门37属,其中硅藻门12属,占比48.5%,蓝藻门10属,占比33.6%,绿藻门12属,占比17.5%,裸藻门、甲藻门、金藻门各1属,藻类细胞密度主要由硅藻门、蓝藻门、绿藻门贡献。各流速组中均存在的优势种包括:硅藻门的舟形藻(Navicula sp.)、曲壳藻(Achnanthes sp.)、短逢藻(Eunotia sp.)、针杆藻(Synedra sp.)、小环藻(Cyclotella sp.),蓝藻门的鞘丝藻(Lyngbya sp.)、颤藻(Oscillatoria sp.),绿藻门的小球藻(Chlorella sp.)、鞘藻(Oedogonium sp.)(表 2)。
| 表 2 不同流速下着生藻类优势种及优势度* Tab. 2 Dominant species and dominance of periphytic algae in different flow velocity groups |
不同流速组着生藻类群落组成如图 3e和图 3f所示,Mantel检验表明,不同流速组着生藻类群落组成具有显著性差异(R=0.1458, P=0.002)。v=0.2 m/s组着生藻细胞密度较低,硅藻(38.81%)和蓝藻(35.43%)占比相近。v=0.4 m/s组硅藻占比最高(63.95%);v=0.6 m/s组着生藻细胞密度最高,蓝藻占比最高(44.86%),鞘丝藻为绝对优势藻种(34.83%);v=0.8 m/s组着生藻类细胞密度最低,硅藻为优势类群。
随着流速增大,Shannon-Wiener指数呈现先上升后下降的变化趋势(图 3f),v=0.4 m/s时,Shannon-Wiener指数最高,着生藻类群落的多样性最大,当v=0.6 m/s时,Shannon-Wiener指数较低,蓝藻取得竞争优势的同时抑制了其他藻类的生长与繁殖,群落多样性最小。
各流速组着生藻类群落组成随冲刷时长的变化情况如图 5所示,除v=0.4 m/s组外,各流速组着生藻类群落组成在水力冲刷前后具有显著性差异(P < 0.05)。v=0.2 m/s及v=0.6 m/s组的藻类数量呈上升趋势,且蓝藻数量随着冲刷时间的延长而上升,占比也不断增大,绿藻占比整体波动不大。在v=0.8 m/s水力冲刷作用下,各藻类群落数量都有所下降,其中硅藻数量变化最为明显,且在冲刷进行2 d后,v=0.8 m/s组的藻类数量就相对稳定,群落组成也无显著性差异(P>0.05)。
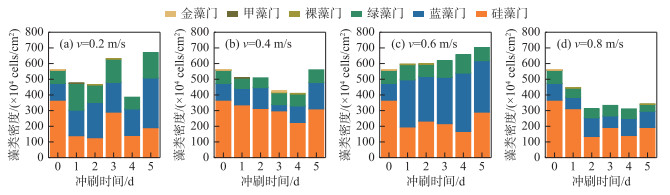
|
图 5 不同流速组着生藻类群落组成 Fig.5 Algae community composition in different flow velocity groups |
综合整个冲刷实验1结果可知,通过改变水动力条件能显著影响明渠着生藻类的生物量以及群落组成(P < 0.05)。提高流速至v=0.6 m/s能促进着生藻类生长增殖,蓝藻、绿藻占比增加,提高流速至v=0.8 m/s并连续冲刷2 d后,着生藻类因冲刷作用而发生剥离,各项藻类生物量指标都有明显下降,叶绿素a含量降低17.27%,无灰干重降低66.22%,藻类细胞密度降低44.28%,此时着生藻类生物量相对变化率最为大,群落组成变化明显。随冲刷时间延长,藻类生物量维持较低水平,群落组成也较为稳定,因此,制定以v=0.8 m/s的高流速连续冲刷2 d为后续实验的冲刷方案。
根据着生藻类建群生物量变化规律及特征,选择T生长=1周(迟滞期前期)、T生长=3周(迟滞期中期)、T生长=6周(指数生长期)、T生长=9周(稳定期)共4个不同生长阶段的着生藻类进行冲刷实验2,以此分析高流速(v=0.8 m/s)水力扰动对不同着生藻类生长阶段的影响,探究冲刷效果最为显著的着生藻类生长阶段。
实验分析结果如图 6所示。在水流冲刷作用下,各生长阶段的无灰干重、细胞密度、Shannon-Wiener指数均下降,并且群落组成的变化均表现为硅藻占比上升,蓝藻、绿藻占比下降,藻类群落的多样性都有一定减小。T生长=1周、6周组,叶绿素a含量在冲刷后有所上升,且无灰干重以及细胞密度变化率较小;T生长= 3周、9周组,经冲刷实验后,所有藻类生物量指标均下降,其中,T生长=3周组的生物量变化率最大。T生长=1周(迟滞期前期)、T生长=6周(指数生长期)以及T生长=9周(稳定期)组着生藻类群落多样性较高,群落的稳定性较强,高流速(v=0.8 m/s)对着生藻类群落的影响较小,冲刷效果不明显,T生长=3周(迟滞期中期)组,群落多样性较低,此时期提高流速对着生藻类的冲刷剥离效果最明显。
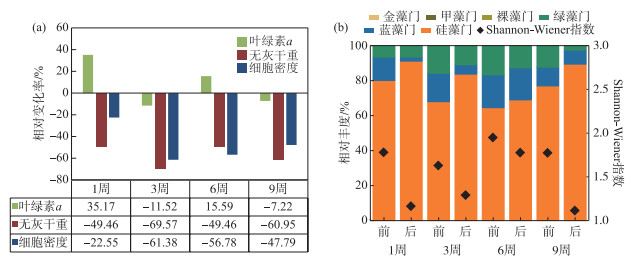
|
图 6 不同生长阶段藻类生物量变化率(a),相对丰度、Shannon-Wiener指数变化(b) Fig.6 Change rate of algae biomass at different growth stages (a), relative abundance and Shannon-Wiener index change (b) |
对不同粗糙度基质、不同生长阶段的着生藻类进行采样分析,并在相同流速点位进行同步冲刷实验3。3种粗糙度基质上着生藻类生物量如图 7,单变量方差分析表明,不同粗糙度基质的着生藻类生物量之间具有显著性差异(P < 0.05)。从叶绿素a含量、细胞密度、藻类生物量结果来看,粗糙组的着生藻类生物量最高,中粗组、光滑组着生藻类生物量比较接近。Mantel检验表明,不同粗糙度基质的着生藻类群落组成具有显著性差异(P < 0.05),且粗糙组与中粗组的Shannon-Wiener指数分别为1.30、1.34,高于光滑组(1.17)。
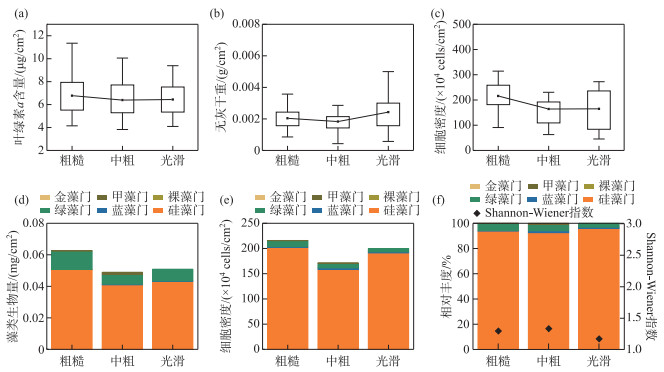
|
图 7 不同粗糙度基质上藻类生物量、群落组成及其多样性 Fig.7 Algae biomass, community composition and diversity on the surface of substrates with different roughness |
3种粗糙度基质上着生藻类不同生长阶段生物量变化过程见图 8,当T生长=1周时,粗糙组叶绿素a含量最高,中粗组次之,光滑组最小,3种粗糙度组无灰干重结果接近,细胞密度计数结果与叶绿素a含量分析结果呈相同规律;当T生长=3周时,不同粗糙度基质着生藻生物量的差距减小,粗糙度最小的光滑组生物量相较于T生长=1周有明显增加;当T生长=6周时,叶绿素a含量仍然是粗糙组最高,中粗组和光滑组接近,无灰干重和细胞密度结果则是光滑组最高,中粗组最低。总体看来,在T生长=1周时,基质粗糙度越大,着生藻类生物量越大,随着建群时间推移,在建群中后期,着生藻类生物量与基质粗糙度无明显相关关系。
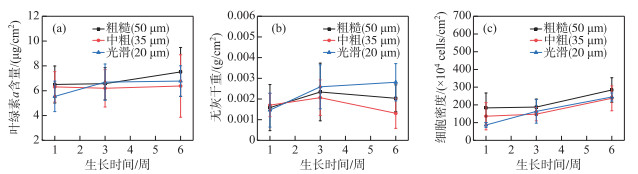
|
图 8 不同粗糙度基质上不同生长阶段藻类生物量 Fig.8 Algae biomass on the surface of substrates with different roughness and in different growth stages |
对3种不同粗糙度基质上的着生藻类进行水动力冲刷实验3,对比冲刷前后着生藻类生物量可得其变化率。由图 9a可得,粗糙组3个着生藻类生物量指标的变化率都最小,中粗组叶绿素a相对变化率最大,但无灰干重比冲刷前增大,光滑组3个着生藻类生物量指标均减小,且无灰干重及细胞密度的相对变化率最大。从着生藻类相对丰度结果来看(图 9b),不同基质粗糙度组在冲刷实验前后,硅藻占比都是最高,为绝对优势类群,光滑组的Shannon-Wiener指数在冲刷前后都最小,群落多样性最低。综合来看,着生藻类附着基质的粗糙度越小,其生物量受水动力影响的相对变化率越大。
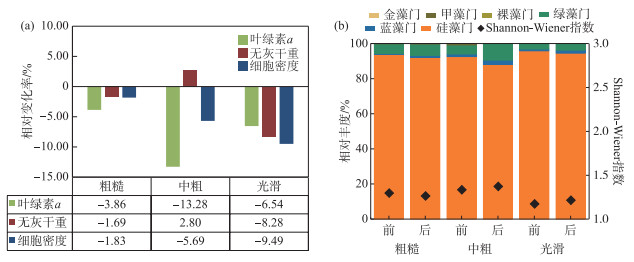
|
图 9 不同粗糙度藻类生物量变化率(a),相对丰度及其多样性变化(b) Fig.9 Change rate of algae biomass with different roughness (a), relative abundance and diversity change (b) |
着生藻类的建群过程一般可划分为3个阶段,首先是迟滞期,该阶段群落生物量较低且变化缓慢;然后是指数生长期,该阶段群落生物量在短时间内快速增加,并迅速达到峰值;最后是稳定期,该阶段群落生物量处于较高水平,并随着群落的发展有一定的波动[42]。藻类各建群时期的时间长短以及生物量峰值大小与藻类生长的水体环境密切相关[43]。裴国风[39]对武汉东湖2个不同营养状态的湖区着生藻类生长及建群过程进行了比较研究,在不同营养水平的水体中,着生藻类建群的延迟期长短、生物量峰值以及达到生物量峰值所需的时间均存在显著差异(P < 0.05),营养状态较高的水果湖区着生藻类群落生长达到生物量峰值(88.40 μg/cm2)的时间为24 d,营养状态较低的牛巢湖区着生藻类群落生长达到生物量峰值(11.18 μg/cm2)的时间长达54 d。张润洁[44]对浑河着生藻类群落结构的研究显示,着生藻类群落建群速度与水温密切相关,丰、枯水期着生藻类生长达到生物量峰值的时间也会相差2周,但平均能在20 d左右达到生物量峰值。本实验明渠水体的营养化水平为中营养状态,平均水温为(26.78±2.47)℃,综合多个着生藻类生物量指标变化趋势能看出,明渠着生藻类在培养周期9周内具有3个明显的建群阶段,T生长≤5周为迟滞期,T生长在6~8周时为指数生长期,着生藻类生物量短时间内迅速增加并达到峰值(12.35 μg/cm2),对比营养化水平相对较高的湖泊、河流等水体环境,实验中明渠着生藻类群落达到生物量峰值的时间会延长,其生物量峰值也会有所降低,T生长=9周时进入稳定期,其着生藻类群落也充分发展更加接近于运行较久的实际明渠工程。
着生藻类群落结构演替过程一般是有机物先吸附于基质上,之后诸如舟形藻、菱形藻(Nitzscha sp.)等硅藻以面着生的形式在基质表面增殖[3]。随着时间推移,柄状、黏质状着生藻类以及其他丝状藻类开始附着[43]。而后群落不断发展,伴随着面着生、点着生以及丝状藻类的交替生长,并逐渐形成包括下层藻垫层、上层丝状、链状藻类这类复杂的藻类群落结构[44]。本实验藻类建群过程基本符合以上建群特征,早期优势藻种为舟形藻、曲壳藻、针杆藻、桥弯藻(Cymbella sp.)等单细胞藻类,随着生长阶段推进,中后期鞘丝藻、颤藻等丝状藻占比逐渐提升。受水动力冲刷的影响,不同生长阶段的蓝、绿藻类群落相对丰度都有所降低,群落多样性下降。着生藻类在建群过程中群落多样性的变化规律与着生藻类生物量的变化规律并不完全一致,周彦锋等[45]、易科浪等[46]关于着生藻类群落在人工基质上建群特性展开研究,结果也同样显示,着生藻类群落多样性在建群前期呈下降趋势,而后随生物量的累积又逐渐上升。分析可能是由于不同藻种生长快慢的差异,舟形藻、曲壳藻在建群前期发展为绝对优势藻种,从而降低了群落的多样性。
3.2 明渠水动力条件对着生藻类的影响水动力条件对着生藻类的影响主要体现为当流速较低时,增大流速可以减小覆盖在着生藻上的边壁层厚度,有利于藻细胞对营养物的吸收、增强藻类新陈代谢,从而促进藻类生长[11];当流速较高时,水流的拖拽作用将剥离藻类、破坏细胞形态[17],从而降低藻类生物量。Bigges等[11, 30]对3种不同生长形态的着生藻类对流速(0~0.8 m/s)的响应规律展开研究,结果显示基质上连续均匀的黏质状硅藻、蓝藻群落的生物量随流速增加而呈上升趋势;茎状、短丝状硅藻群落的生物量呈单峰分布,在流速v≈0.4 m/s时,藻类生物量最高;长丝状藻群落,生物量随速度增加而单调下降。在本研究中,着生藻类的形态特征也是呈短丝状并以硅藻为优势类群,对流速的响应规律表现为“低促高抑”,当流速由v=0.2 m/s增大到v=0.6 m/s时,着生藻类的生物量及细胞密度均明显上升。适宜的流速条件不仅能加快营养物在藻类上下层之间输运,促进藻类细胞对营养物的吸收[47],还能影响藻类的光合活性及酶活性以促进藻类细胞代谢[17, 20, 48]。在本实验中,TN、TP浓度随流速增大而呈下降趋势,当v=0.6 m/s时,能促进鞘丝藻等蓝藻类群对营养物的吸收利用,并通过环境过滤与适者生存的选择促进蓝藻生长增殖,使得蓝藻优势增强。
有研究表明,过高的水流流速也会通过拖曳作用直接将着生藻类从基质上脱落[9],或者通过冲刷着生藻类附着的沉积物基质,进而剥离着生藻类[29]。此外,增大流速还会增加对沉积物的侵蚀,产生更多的悬移物增加对着生藻类的磨损[5]。在本研究中,流速增大至v=0.8 m/s时,着生藻类的叶绿素a含量、无灰干重、细胞密度、藻类生物量均为最低,并在冲刷2 d后下降至较低水平,各藻类生物量指标相对变化率最大,对着生藻类有明显的冲刷剥离作用。冲刷实验2、3结果也显示,流速增大至v=0.8 m/s能显著影响着生藻类群落组成,降低群落多样性。
目前,有关水动力对着生藻类生长具有促进及抑制共同影响的研究不少[6, 17, 20],其中临界流速[13]还与着生藻类形态[11]、藻类群落组成以及水体含沙量密切相关[49]。丝状、直立状藻类在剪切力作用下,相较面着生的匍匐状藻类更易发生剥离[50];以硅藻为主要优势类群的群落比以蓝藻和绿藻为优势类群的群落对高流速的适应性更强[9, 51];在输水明渠及渠道化河流中,水体含沙量越大,携带的固体颗粒物越多,相同流速对着生藻的剥离作用越强[29, 52]。本研究中流速对着生藻类的作用存在明显临界阈值(约0.6 m/s),可对具有相似群落结构的明渠着生藻类调控提供依据。各组实验均在清水条件下进行,研究未考虑水流含沙量对实验结果的干扰,关于不同形态、不同优势种群的着生藻类在输水明渠及渠道化河流等不同水体营养状态及含沙条件下对流速响应规律还需要开展更深入的系统研究。
3.3 不同附着基质对着生藻类的影响由于观测时间周期长短、水体环境营养化水平的差异,不同附着基质对着生藻类的影响研究结果也并不完全统一[2]。裴国凤等[42]比较了花岗岩、玻璃、聚乙烯塑料片、木板等不同类型的基质块上着生藻类的生物量以及群落结构,花岗岩、玻璃与天然基质上的群落组成都高度接近[46]。念宇等[53]比较了石块、菹草、钉螺上的着生藻类,发现基质对其组成几乎没有影响,但不同基质上藻类生物量差异显著。有研究也表明,基质的粗糙度能显著影响着生藻类的生物量以及群落多样性[40, 54]。在本实验中,3种不同粗糙度基质上着生藻类在建群初期生物量差距最大,粗糙度越大,着生藻类建群越快,在建群中后期,不同粗糙度之间着生藻类的生物量差距较小。一般粗糙度越大,基质的表面积越大,着生藻类有更多空间可以附着,而在建群中后期,随着着生藻类生物量不断增长累积及着生藻类群落的发展,不同粗糙度间藻类的生物量差距越来越小,群落结构也逐渐相似[55]。但不同粗糙度基质上的着生藻类对相同流速的响应规律亦有差别,粗糙度越小越容易受到干扰,群落稳定性越差,藻类的冲刷去除率越明显[53]。因此,输水明渠使用不同抹面工艺的衬砌会影响着生藻类的附着,衬砌越光滑,表面粗糙度越小,着生藻类建群越慢,通过水动力调控的除藻效果也更显著。
4 结论1) 随着明渠流速增大,着生藻类生物量整体变化趋势为先上升后下降。流速v=0.6 m/s时,着生藻生物量最高,流速v=0.8 m/s时,着生藻生物量最低。低流速(v=0.2 m/s)至中流速(v=0.6 m/s)对着生藻类的生长增殖具有促进作用,过高流速(v=0.8 m/s)则会抑制着生藻类生长,水流流速对明渠着生藻类影响存在临界阈值,约0.6 m/s。
2) 增大冲刷流速至v=0.8 m/s的2 d后,藻类生物量显著减少(P < 0.05),群落多样性下降,新的藻类群落会随冲刷时长的推移逐渐稳定。
3) 明渠着生藻类的建群过程有3个明显阶段,分别为迟滞期、指数生长期、稳定期。在迟滞期(实验中约3周),此时期高流速(v=0.8 m/s)对着生藻类的冲刷剥离效果最明显。
4) 混凝土基质粗糙度越小,着生藻类建群迟滞期越长,水力除藻效果越明显。故提高输水明渠的衬砌工艺,减小基质表面粗糙度有利于抑制着生藻类生长。
| [1] |
Wetzel RG. A comparative study of the primary production of higher aquatic plants, periphyton, and phytoplankton in a large, shallow lake. Internationale Revue der Gesamten Hydrobiologie und Hydrographie, 1964, 49(1): 1-61. DOI:10.1002/iroh.19640490102 |
| [2] |
Song YZ, Zhang YD, Zhang JW et al. Periphytic algae ecology in freshwater lake: A review. Chinese Journal of Ecology, 2016, 35(2): 534-541. [宋玉芝, 张亚冬, 郑建伟等. 淡水湖泊附着藻类生态学研究进展. 生态学杂志, 2016, 35(2): 534-541. DOI:10.13292/j.1000-4890.201602.003] |
| [3] |
Zhu YX, Mi WJ, Li B et al. The influences of two hydroulics structres on periphytic algae community in the middle channel of the South-to-North Water Diversion Project. Acta Hydrobiologica Sinica, 2021, 45(4): 817-825. [朱宇轩, 米武娟, 李波等. 南水北调中线干渠两个水工构筑物对着生藻类群落的影响. 水生生物学报, 2021, 45(4): 817-825. DOI:10.7541/2021.2020.107] |
| [4] |
Labiod C, Godillot R, Caussade B. The relationship between stream periphyton dynamics and near-bed turbulence in rough open- channel flow. Ecological Modelling, 2007, 209(2): 78-96. DOI:10.1016/j.ecolmodel.2007.06.011 |
| [5] |
Francoeur SN, Biggs BJ. Short-term effects of elevated velocity and sediment abrasion on benthic algal communities. Hydrobiologia, 2006, 561: 59-69. DOI:10.1007/s10750-005-1604-4 |
| [6] |
Smith RA, Duncan MJ. Velocity and sediment disturbance of periphyton in headwater streams: Biomass and metabolism. Journal of the North American Benthological Society, 1999, 18(2): 222-241. DOI:10.2307/1468462 |
| [7] |
Jowett IG, Biggs BJF. Flood and velocity effects on periphyton and silt accumulation in two New Zealand Rivers. New Zealand Journal of Marine and Freshwater Research, 1997, 31(3): 287-300. DOI:10.1080/00288330.1997.9516767 |
| [8] |
Fovet O, Belaud G, Litrico X et al. Modelling periphyton in irrigation canals. Ecological Modelling, 2010, 221(8): 1153-1161. DOI:10.1016/j.ecolmodel.2010.01.002 |
| [9] |
Cao P, Xu FR, Gao SL et al. Experimental study on the impact of pulsed flow velocity on the scouring of benthic algae from a mountainous river. Water, 2022, 14(19): 3150. DOI:10.3390/w14193150 |
| [10] |
王利利. 水动力条件下藻类生长相关影响因素研究[学位论文]. 重庆: 重庆大学, 2006.
|
| [11] |
Biggs BJF, Goring DG, Nikora VI. Subsidy and stress responses of stream periphyton to gradients in water velocity as a function of community growth form. Journal of Phycology, 1998, 34(4): 598-607. DOI:10.1046/j.1529-8817.1998.340598.x |
| [12] |
Biggs BJF, Hickey CW. Periphyton responses to a hydraulic gradient in a regulated river in New Zealand. Freshwater Biology, 1994, 32(1): 49-59. DOI:10.1111/j.1365-2427.1994.tb00865.x |
| [13] |
Liang PY, Wang X, Ma FB. Effect of hydrodynamic conditions on water eutrophication: A review. J Lake Sci, 2013, 25(4): 455-462. [梁培瑜, 王烜, 马芳冰. 水动力条件对水体富营养化的影响. 湖泊科学, 2013, 25(4): 455-462. DOI:10.18307/2013.0401] |
| [14] |
Calvo C, Pacheco JP, Aznarez C et al. Flow pulses shape periphyton differently according to local light and nutrient conditions in experimental lowland streams. Freshwater Biology, 2022, 67(7): 1272-1286. DOI:10.1111/fwb.13916 |
| [15] |
Katz SB, Segura C, Warren DR. The influence of channel bed disturbance on benthic Chlorophyll a: A high resolution perspective. Geomorphology, 2018, 305: 141-153. DOI:10.1016/j.geomorph.2017.11.010 |
| [16] |
Guo Y, Pan Y, Huang XF et al. Study on inhibition effect of hydrodynamic mode on cyanobacteria in Taihu Lake. Environmental Science and Technology, 2021, 34(2): 38-43. [郭赟, 潘越, 黄晓峰等. 水动力方式对太湖蓝藻的抑制效果研究. 环境科技, 2021, 34(2): 38-43.] |
| [17] |
Zhang HH, Wang N, Zong RR et al. Research progress on influence of hydrodynamic conditions on algal physiology and ecology. Research of Environmental Sciences, 2022, 35(1): 181-190. [张海涵, 王娜, 宗容容等. 水动力条件对藻类生理生态学影响的研究进展. 环境科学研究, 2022, 35(1): 181-190. DOI:10.13198/j.issn.1001-6929.2021.10.20] |
| [18] |
Chen XN, Wang XJ, Li YY et al. Succession and driving factors of periphytic community in the middle route project of south-to-north water division (Henan, China). International Journal of Environmental Research and Public Health, 2022, 19(7): 4089. DOI:10.3390/ijerph19074089 |
| [19] |
Zhu YX, Mi WJ, Tu XJ et al. Environmental factors drive periphytic algal community assembly in the largest long-distance water diversion channel. Water, 2022, 14(6): 914. DOI:10.3390/w14060914 |
| [20] |
Davie AW, Mitrovic SM. Benthic algal biomass and assemblage changes following environmental flow releases and unregulated tributary flows downstream of a major storage. Marine and Freshwater Research, 2014, 65(12): 1059. DOI:10.1071/mf13225 |
| [21] |
Wang YZ, Wang CL, Zhang CM et al. Water quality variation in the middle route of South-to-North Water Diversion Project, China. Frontiers in Environmental Science, 2023, 11: 945884. DOI:10.3389/fenvs.2023.945884 |
| [22] |
Fujii H, Ikeda N. Algal growth in an irrigation canal and its effect on flow function. Paddy and Water Environment, 2019, 17(3): 419-427. DOI:10.1007/s10333-019-00737-y |
| [23] |
Zhang C, Zhao L, Zhang Y et al. Research progress of the hazard and control technology of algae bloom. Environmental Protection Science, 2015, 41(3): 107-112. [张翀, 赵亮, 张莹等. 藻类爆发危害及其控制技术研究进展. 环境保护科学, 2015, 41(3): 107-112.] |
| [24] |
Nong XZ, Shao DG, Shang YM et al. Analysis of spatio-temporal variation in phytoplankton and its relationship with water quality parameters in the South-to-North Water Diversion Project of China. Environmental Monitoring and Assessment, 2021, 193(9): 593. DOI:10.1007/s10661-021-09391-6 |
| [25] |
Zhu JE, Lei XH, Quan J et al. Algae growth distribution and key prevention and control positions for the middle route of the south-to-north water diversion project. Water, 2019, 11(9): 1851. DOI:10.3390/w11091851 |
| [26] |
Shi XL, Yang JS, Chen KN et al. Review on the control and mitigation strategies of lake cyanobacterial blooms. J Lake Sci, 2022, 34(2): 349-375. [史小丽, 杨瑾晟, 陈开宁等. 湖泊蓝藻水华防控方法综述. 湖泊科学, 2022, 34(2): 349-375. DOI:10.18307/2022.0201] |
| [27] |
Fang YB, Wang CY, Tang WW et al. Comparison of advantages and disadvantages of algae removal technology, application status and new technology progress. Industrial Water Treatment, 2020, 40(9): 1-6. [方雨博, 王趁义, 汤唯唯等. 除藻技术的优缺点比较、应用现状与新技术进展. 工业水处理, 2020, 40(9): 1-6.] |
| [28] |
Chen RH, Li FP, Zhang HP et al. Conceptual mechanism of hydrodynamic impacts on freshwater algae for flow management. J Lake Sci, 2015, 27(1): 24-30. [陈瑞弘, 李飞鹏, 张海平等. 面向流量管理的水动力对淡水藻类影响的概念机制. 湖泊科学, 2015, 27(1): 24-30. DOI:10.18307/2015.0103] |
| [29] |
Cullis JDS, Crimaldi JP, Mcknight DM. Hydrodynamic shear removal of the nuisance stalk-forming diatom Didymosphenia geminata. Limnology and Oceanography: Fluids and Environments, 2013, 3(1): 256-268. DOI:10.1215/21573689-2414386 |
| [30] |
Biggs BJF, Thomsen HA. Disturbance of stream periphyton by perturbations in shear stress: Time to structural failure and differences in community resistance. Journal of Phycology, 1995, 31(2): 233-241. DOI:10.1111/j.0022-3646.1995.00233.x |
| [31] |
Haddadchi A, Kuczynski A, Hoyle JT et al. Periphyton removal flows determined by sediment entrainment thresholds. Ecological Modelling, 2020, 434: 109263. DOI:10.1016/j.ecolmodel.2020.109263 |
| [32] |
He ZH, Zhou JB, Wu ZQ et al. Analysis and characterization on material surface micro morphology based on large scene depth and 3D visualization. Physical Testing and Chemical Analysis: Part A: Physical Testing, 2018, 54(12): 878-881. [何智华, 周静波, 吴章勤等. 基于超景深三维可视化方案的材料表面显微形貌分析与表征. 理化检验: 物理分册, 2018, 54(12): 878-881.] |
| [33] |
赵昕, 张晓元, 赵明登等. 水力学. 北京: 中国电力出版社, 2009.
|
| [34] |
胡鸿钧, 魏印心. 中国淡水藻类: 系统、分类及生态. 北京: 科学出版社, 2006.
|
| [35] |
毕永红, 张春梅, 宋高飞. 南水北调中线干渠藻类图谱. 北京: 科学出版社, 2023.
|
| [36] |
章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社, 1991.
|
| [37] |
Long TY, Zhou PR, Wu L. The simulating experiment for the impacts of environmental factors on spring algae growth in Xiangxi River. China Environmental Science, 2011, 31(2): 327-331. [龙天渝, 周鹏瑞, 吴磊. 环境因子对香溪河春季藻类生长影响的模拟实验. 中国环境科学, 2011, 31(2): 327-331.] |
| [38] |
国家环境保护总局《水和废水监测分析方法》. 水和废水监测分析方法: 第四版. 北京: 中国环境科学出版社, 2002.
|
| [39] |
裴国凤. 淡水湖泊底栖藻类的生态学研究[学位论文]. 武汉: 中国科学院水生生物研究所, 2006.
|
| [40] |
陈筱诺. 南水北调中线干渠(河南段)着生藻群落结构变化及驱动因子研究[学位论文]. 南阳: 南阳师范学院, 2022.
|
| [41] |
Dong GC, Leng CM, Cong XR et al. Phytoplankton community and driving environmental factors in Lake Dongping after 3 years implementation of the east route of South-to-North Water Diversion Project. J Lake Sci, 2022, 34(1): 61-73. [董贯仓, 冷春梅, 丛旭日等. 南水北调东线工程运行3年后东平湖浮游植物群落特征及环境驱动因子. 湖泊科学, 2022, 34(1): 61-73. DOI:10.18307/2022.0107] |
| [42] |
Pei GF, Liu MF. Comparison of benthic algal composition developed on different substrata in Lake Donghu, Wuhan. J Lake Sci, 2009, 21(3): 357-362. [裴国凤, 刘梅芳. 武汉东湖底栖藻类在不同基质上生长的比较. 湖泊科学, 2009, 21(3): 357-362. DOI:10.18307/2009.0307] |
| [43] |
李金秋. 洞庭湖底栖藻类时空分布及其与环境因子的关系[学位论文]. 武汉: 中南民族大学, 2020.
|
| [44] |
张润洁. 浑河着生藻类群落结构及影响因子分析[学位论文]. 沈阳: 辽宁大学, 2012.
|
| [45] |
Zhou YF, Zhou Y, You Y. Community structure and factors affecting periphytic algae on an artificial substrate in Wuli Lake. Journal of Hydroecology, 2017, 38(2): 57-64. [周彦锋, 周游, 尤洋. 五里湖人工基质上着生藻类群落结构及其影响因子研究. 水生态学杂志, 2017, 38(2): 57-64. DOI:10.15928/j.1674-3075.2017.02.009] |
| [46] |
Yi KL, Dai ZG, Liu BY et al. Effects of vertical location and artificial substrate on colonization of algal periphyton. Acta Ecologica Sinica, 2016, 36(15): 4864-4872. [易科浪, 代志刚, 刘碧云等. 空间层次及人工基质对着生藻类建群特性的影响. 生态学报, 2016, 36(15): 4864-4872. DOI:10.5846/stxb201501060033] |
| [47] |
Stevens CL, Hurd CL. Boundary-layers around bladed aquatic macrophytes. Hydrobiologia, 1997, 346(1): 119-128. DOI:10.1023/A:1002914015683 |
| [48] |
Li B, Zhang YH, Deng R et al. Effects of water velocity on the growth and photosynthetic activity of Cyclotella meneghiniana(diatom). Chinese Journal of Ecology, 2022, 41(7): 1385-1390. [李波, 张羽珩, 邓睿等. 流速对梅尼小环藻生长与光合活性的影响. 生态学杂志, 2022, 41(7): 1385-1390. DOI:10.13292/j.1000-4890.202207.014] |
| [49] |
Mori T, Miyagawa Y, Onoda Y et al. Flow-velocity-dependent effects of turbid water on periphyton structure and function in flowing water. Aquat Sci, 2018, 80(1): 12. DOI:10.1007/s00027-017-0552-1 |
| [50] |
Graba M, Sauvage S, Moulin FY et al. Interaction between local hydrodynamics and algal community in epilithic biofilm. Water Research, 2013, 47(7): 2153-2163. DOI:10.1016/j.watres.2013.01.011 |
| [51] |
Zhang CM, Zhu YX, Song GF et al. Spatiotemporal pattern of phytoplankton community structure and its determining factors in the channel of the middle route of South-to-North Water Diversion Project. J Lake Sci, 2021, 33(3): 675-686. [张春梅, 朱宇轩, 宋高飞等. 南水北调中线干渠浮游植物群落时空格局及其决定因子. 湖泊科学, 2021, 33(3): 675-686. DOI:10.18307/2021.0305] |
| [52] |
Neverman AJ, Death RG, Fuller IC et al. Towards mechanistic hydrological limits: A literature synthesis to improve the study of direct linkages between sediment transport and periphyton accrual in gravel-bed rivers. Environmental Management, 2018, 62(4): 740-755. DOI:10.1007/s00267-018-1070-1 |
| [53] |
Nian Y, Han YZ, Yang ZF. Ecological characteristics of periphyton communities on different kinds of substrates and comparison. Environmental Science and Technology, 2009, 22(5): 14-17. [念宇, 韩耀宗, 杨再福. 不同基质上着生生物群落生态学特性比较研究. 环境科技, 2009, 22(5): 14-17.] |
| [54] |
兰波. 洱海周丛藻类生态学研究[学位论文]. 武汉: 华中师范大学, 2011.
|
| [55] |
Zhang L, Hao ZL, Zhang XM. Preliminary study on attaching effect of benthic algae on different reef models. South China Fisheries Seienee, 2011, 7(2): 1-7. [张磊, 郝振林, 张秀梅. 不同模型礁底栖藻类附着效果的初步研究. 南方水产科学, 2011, 7(2): 1-7.] |
 2024, Vol. 36
2024, Vol. 36 


